 ,1
,1Antibacterial Activity in Vitro and Protection of Tildipirosin Injection Against Artificially Infected Haemophilus Paracoides in Piglets
LI GuoJi1, YAN ChaoQun1, MA YuQiao1, XIE Shun1, GU Xin2, CAO Ying2, HUANG ShiXin2, HUANG XianHui ,1
,1通讯作者:
收稿日期:2018-11-12接受日期:2019-03-29网络出版日期:2019-08-16
| 基金资助: |
Received:2018-11-12Accepted:2019-03-29Online:2019-08-16
作者简介 About authors
李国基,E-mail:

摘要
关键词:
Abstract
Keywords:
PDF (2112KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
李国基, 闫超群, 麻雨桥, 谢顺, 顾欣, 曹莹, 黄士新, 黄显会. 泰地罗新注射液体外抑菌试验及对感染副猪嗜血杆菌仔猪的保护作用[J]. 中国农业科学, 2019, 52(16): 2899-2911 doi:10.3864/j.issn.0578-1752.2019.16.015
LI GuoJi, YAN ChaoQun, MA YuQiao, XIE Shun, GU Xin, CAO Ying, HUANG ShiXin, HUANG XianHui.
0 引言
【研究意义】猪呼吸道疾病一直是危害猪群生长、影响猪场收益的主要原因之一。近年来,随着规模化养猪场的建设,猪呼吸道疾病的发病率明显呈现上升趋势,据相关报道[1,2],引起猪呼吸道细菌性致病菌主要包括副猪嗜血杆菌、胸膜肺炎放线杆菌、多杀性巴氏杆菌、支气管败血性波氏杆菌、沙门氏菌以及链球菌等,其中以副猪嗜血杆菌病为主的猪呼吸道疾病呈世界性分布,而且其发病率和死亡率呈显著上升趋势,已成为全球养猪业影响最为严重的细菌性传染病之一。副猪嗜血杆菌(Haemophilus Paracoides,HPs)是革兰氏阴性菌,为条件致病菌,生长需要烟酰胺腺嘌呤二核苷酸(nicotinamide adenine dinucleotide,NAD),临床上主要引起4—12周龄的仔猪发病,给养猪业带来巨大的经济损失[3, 4]。目前用于仔猪副猪嗜血杆菌病预防和治疗的药物主要为疫苗及抗生素。迄今为止,已经报道用于治疗副猪嗜血杆菌的疫苗有灭活疫苗、亚单位疫苗、DNA疫苗和弱毒疫苗[5,6,7,8]。虽然免疫接种能够降低死亡率,但是目前报道关于副猪嗜血杆菌的血清型就有15种 [9,10,11]。由于不同的血清型之间很难形成交叉保护,导致频繁发生疫苗失败[12],这对于临床预防副猪嗜血杆菌病带来困难[13,14]。泰地罗新(tildipirosin)是一种新型十六元环动物专用的大环内酯类半合成抗生素,具有高效、广谱的抗菌活性,作用机制是与敏感菌的核糖体50S亚基结合,从而抑制肽链的合成和延长,影响细菌蛋白质的合成[15]。其对副猪嗜血杆菌、胸膜肺炎放线杆菌、多杀性巴氏杆菌、支气管败血性波氏杆菌、溶血性曼海姆菌等引起动物呼吸道疾病具有很好的疗效[16,17,18]。【前人研究进展】AMRINE等[19]对母牛进行溶血性曼氏杆菌(Mannheimia Haemolytica)攻毒试验中发现,泰地罗新比泰拉霉素临床治疗效果更佳,能够有效地治疗由细菌引起的母牛肺部损伤疾病。LEI等[20] 自2014年至2016年间从中国10个省(包括湖北、安徽、山东和河南等)采集的猪肺组织样本中分离收集了164株HPs分离菌,进行药动学-药效学同步模型研究(PK/PD),证明猪肌肉注射4.17 mg·kg-1的泰地罗新注射液对HPs有较强的杀灭作用。【本研究切入点】近年来国内部分药厂已经开始研制并生产泰地罗新注射液,并且通过药动学[21]及残留消除试验[22]证明与国外生产的泰地罗新注射液疗效相当,但是目前国内外未见有关于泰地罗新注射液对猪人工感染副猪嗜血杆菌临床试验的相关报道,本研究首次报道了泰地罗新对人工感染仔猪副嗜血杆菌的临床治疗效果。【拟解决的关键问题】进一步验证其对禽畜常见病原菌的抑菌效果以及对人工感染副猪嗜血杆菌仔猪的保护作用,以及为泰地罗新注射液在我国的科学合理应用提供临床数据。1 材料与方法
1.1 试验药品与试剂
泰地罗新注射液(规格100 mL:4 g),批号:20150401,泰地罗新原料药(99.26%),批号:20150209,由上海同仁药业股份有限公司提供;对照药品:泰拉霉素注射液含量10%,批号:B007220,辉瑞公司法国 Amboise生产厂。胰酪大豆胨琼脂培养基(TSA)、胰酪大豆胨液体培养基(TSB)、脑心浸液肉汤(BHI):均购自青岛高科园海博生物科技有限公司;新生牛血清,批号:20150909,浙江天杭生物科技股份有限公司;NAD酶、Buffer、dNTP Mix、rTaq DNA聚合酶、DL 2000Marker,购于北京全式金生物技术有限公司;副猪嗜血杆菌抗体ELISA 检测试剂盒,购于北京飞凯生物技术有限公司;副猪嗜血杆菌16sRNA引物,北京六合华大基因科技有限公司合成。1.2 菌种
胸膜肺炎放线杆菌(Actinobacillus pleuropneumonia)39株,副猪嗜血杆菌(Haemophilus paracoides)74株,多杀性巴氏杆菌(Pasteurella multiflora)25株,支气管败血波氏杆菌(Bronchial septicemic wave bacillus)10株。金黄色葡萄球菌(Ataphylococcus Aureus),ATCC25923,以上菌均由华南农业大学兽医药理教研室保存。冻干菌种开启后经培养基复壮,分离纯化,根据计数结果决定菌液稀释倍数,制备含菌量为 1×1010 CFU·mL-1的细菌悬液,4℃冻存备用。1.3 仪器设备
Lab Cycler 系列PCR仪,德国 SENSO公司;Bio-Rad 凝胶成像分析仪,美国Bio-Rad公司;Research型可调微量移液器,10—100 μL、100—1 000μL德国Eppendorf 公司;XW-80A旋涡混合仪,上海青浦沪西仪器厂生产;Avanti? J-26 XP高速冷冻离心机,美国Beckman-Coulter公司;AT-261电子分析天平,瑞士 Mettler 公司生产;THZ恒温震荡箱,广州神化生物技术有限公司;SW-CJ-1FD洁净工作台,上海博讯实业有限公司;HIRAYAMA 型灭菌器,日本Wada Stainless Kogyo公司。1.4 试验培养基
1.4.1 NAD配制 称取1 g NAD冻干粉末,用少量高压过的去离子水或纯水溶解,用0.22 μm的滤器过滤后,用高压过的去离子水或纯水定容至100 mL。配制浓度为1%,2—8 ℃保存。1.4.2 TSA培养基配制方法 TSA培养基40.0 g,加入去离子水,定容至940 mL,充分摇匀溶解,调pH至7.2—7.4,121 ℃高压蒸汽灭菌15min,待冷却至55℃左右,按无菌要求加入50 mL 新生牛血清、10 mL过滤除菌的1% NAD。
1.4.3 TSB培养基配制方法 TSB培养基30.0 g,加入去离子水940 mL,充分摇匀溶解,调pH至7.2—7.4,121℃高压蒸汽灭菌15 min。使用前,按无菌要求加入50 mL新生牛血清、10 mL过滤除菌的1% NAD。
1.5 试验动物
健康三元杂交断奶仔猪 110 头,于2016年6月17号购于广州市良种猪场,体重 10—15 kg,公母兼有。出生后未接种猪胸膜肺炎放线杆菌及副猪嗜血杆菌疫苗。试验前按常规饲养于实验动物中心猪舍,采用自然光照,室温控制在26℃,相对湿度为49%—70%,每舍5头,自由饮水采食。饲喂不含任何抗菌药物的全价配合饲料。人工发病前观察2周,重点观察猪群的呼吸及采食情况。试验开始前 3 d从鼻腔黏膜采样分离副猪嗜血杆菌,前腔静脉采血分离血清后进行酶联免疫吸附试验(ELISA)检验。副猪嗜血杆菌分离为阴性,且经ELISA检验为阴性。临床观察正常,无异常症状后,方准许进行试验。试验开始前1 d进行编号、称重,检疫期满两周,且试验猪只健康无误后,在本机构GCP实验条件下开展动物试验,试验猪只腹腔攻毒后临床以及病理症状均由兽医人员诊断。1.6 体外抑菌试验
1.6.1 最小抑菌浓度(Minimum Inhibitory Concentration/MIC)的测定 取无菌试管13支,编号1—13号,每支加入无菌肉汤2 mL,1号试管加入稀释1 000倍的药物2 mL,混匀后吸取2 mL放入2号试管,依次2倍稀释至10号试管,1—10号试管每支试管加入100 μL菌液,第11号为稀释过1 000倍的药物对照(阴性对照),第12号为菌液对照(阳性对照),第13号为空白对照,本药敏试验以“CLSI药物敏感性试验标准VET01-A4”为参考(泰地罗新对金黄色葡萄球菌ATCC25923肉汤稀释试验MIC的QC质控允许范围为2—16 μg·mL-1),设定质控菌组(金黄色葡萄球菌ATCC29213)。所有试管均在37 ℃培养16—20 h,观察记录试管的变化。1.6.2 结果判读 当阳性对照组细菌明显生长,阴性对照组无细菌生长时,以试验组试管内完全抑制细菌生长的最低药物浓度为MIC值,即试管内溶液不变浑浊所对应的最低药物浓度;并对各组菌株进行MIC50和MIC90判定,即对所有菌株进行MIC确定后,再依次对各组菌株MIC值从小到大进行排列统计,能够对50%菌株有抑制作用的浓度为MIC50,对90%菌株有抑制作用的浓度为MIC90。
1.7 疾病模型复制
1.7.1 预试验 选取第一批购买的50头健康仔猪,随机分成5组,每组10头,设0.3、0.5、0.8、1 mL·kg-1bw菌液4个剂量进行腹腔攻毒,保证各试验组发病时间一致。接种后观察记录各组的临床症状,如:体温升高情况、咳嗽、腹泻、死亡率等。另设TSB培养基进行对照,观察各组的死亡率。1.7.2 正式试验 按照预试验确定攻毒剂量。正式试验60头健康断奶仔猪,随机分为 6组,每组10头,进行腹腔攻毒,保证各试验组发病时间基本一致。接种后观察记录各组的临床症状,如:体温升高情况、咳嗽、腹泻等临床症状。分组及给药情况见表1。
Table 1
表1
表1试验动物分组与处理
Table 1
| 组别 Groups | 数量(头) Numbers (Head) | 体重 Weights (kg) | 剂量 Dosage (mg·kg-1bw) | 给药方案 Drug regimen |
|---|---|---|---|---|
| 健康对照组 Healthy control group | 10 | 12.5±0.6 | — | 不感染,不给药 No infection, No administration |
| 泰地罗新注射液高剂量组 High dose group of Tildipirosin injection | 10 | 12.9±0.9 | 8.0 | 感染,肌注注射 Infection,im |
| 泰地罗新注射液中剂量组 Middle dose group of Tildipirosin injection | 10 | 12.9±1.1 | 4.0 | 感染,肌注注射 Infection,im |
| 泰地罗新注射液低剂量组 Low dose group of Tildipirosin injection | 10 | 12.7±0.9 | 2.0 | 感染,肌注注射 Infection,im |
| 泰拉霉素注射液 Tulathromycin injection | 10 | 13.1±0.5 | 2.5 | 感染,肌注注射 Infection,im |
| 感染对照组 Infective control group | 10 | 12.5±0.6 | — | 感染,不给药 Infection, No administration |
新窗口打开|下载CSV
1.8 病原菌的分离及鉴定
1.8.1 PCR扩增 将病死猪的心、肝、脾、肺、肾、心包积液、关节积液等病料接种于含5%血清和1%NAD的TSA平板上,于37 ℃培养24 h后,挑取形状与副猪嗜血杆菌类似的单菌落再次接种于含5%血清和1% NAD的TSA平板上进行纯化,纯化两次后进行PCR扩增电泳,PCR扩增产物用1%琼脂糖凝胶电泳进行电泳后检测扩增结果。1.8.2 基因组DNA的提取 挑取病料分离的疑似副猪嗜血杆菌的单菌落,接种至含5%血清和1% NAD的TSA平板上,于37 ℃摇床8—11 h,取2 mL菌液,12 000 r/min离心2 min,弃上清液,用1 mL去离子水洗涤2次,混匀后12 000 r/min离心2 min,弃上清液,沉淀物中加入60 μL去离子水,于沸水中煮沸,10 min后立即冰冻2 min,混匀后12 000 r/min离心5 min,弃上清液做DNA模板。
1.8.3 引物设计与合成 根据16s rRNA两端的保守序列及相关文献[23,24]报道,设计引物27F/1492R序列,由北京六合华大基因科技有限公司合成,扩增的目的片段长度为821 bp左右。16s rRNA的引物序列如下:F: GTGATGAGGAAGGGTGGTGT, R: GGCTTCGTC ACCCTCTGTA。
1.8.4 PCR反应体系 把上述制备的基因组DNA作为PCR扩增模板,使用20 μL的反应体系,各组分加入量见表2。
Table 2
表2
表2PCR反应体系
Table 2
| 体系组分 System components | 用量 The dosage (μL) |
|---|---|
| 灭菌超纯水 Sterilized ultra-pure water | 12.6 |
| 10×PCR buffer | 2 |
| dNTP(2.5 mmol·L-1) | 1.6 |
| 上游引物 Forward primer | 0.8 |
| 下游引物 Reverse primer 模板DNA(Template DNA) | 0.8 2 |
| rTag DNA酶 rTag DNA enzyme, 5 U·μL-1 | 0.2 |
新窗口打开|下载CSV
1.8.5 PCR反应参数 94℃预变性5 min,94℃变性45 s,56.6℃退火45 s,72℃延伸1 min,35个循环,72℃延伸10 min,4℃保存。
1.9 试验性治疗
当试验猪接种后出现呼吸困难、精神沉郁的临床症状,体温平均升高超过 1—2 ℃时开始用药治疗。给药方案见表1。给药时采取颈部肌肉两侧分点注射法。单次用药前测量直肠体温并观察临床症状。停药后对动物的临床情况进行跟踪观察。整个观察期持续至停药后15 d,试验接种前及观察结束后对试验猪称重。1.10 疗效评价指标
1.10.1 临床症状 测定试验猪接种前及接种后体温情况。同时观察呼吸、食欲、精神 状态及是否有呕吐等。从给药后至停药后15d,每日记录 8:00 和 20:00 的体温。1.10.2 死亡率 试验期间出现副猪嗜血杆菌病典型症状并死亡,剖检有典型的特征性病变,并从病肺中分离出副猪嗜血杆菌的猪只,即判定为感染死亡。根据各组动物的死亡数计算死亡率。
1.10.3 治愈率 试验期间用药后临床症状消失,精神、食欲、体温等恢复正常,增重接近或超过健康对照组的猪只,均判定为治愈。根据每组动物中的治愈数计算其治愈率。
1.10.4 有效率 治愈的猪及用药后感染猪的咳嗽、呼吸困难、体温升高、食欲降低等临床症状与感染对照组相比明显减轻或消失的猪只,均判定为有效。根据每组动物中的有效数计算其有效率。
1.10.5 增重 攻毒前及观察期结束后将试验猪称重,计算每组试验猪的平均增重和标准误差。
1.11 数据分析处理
用SPSS16.0 统计方法进行数据的显著性检验。其中死亡率、有效率、治愈率均采用卡方检验进行统计学分析。2 结果
2.1 体外抑菌试验
采用金黄色葡萄球菌ATCC25923作为质控菌,其MIC为8 μg·mL-1,在2—16 μg·mL-1范围内,符合质控要求。泰地罗新对副猪嗜血杆菌、胸膜肺炎放线杆菌、多杀性巴氏杆菌、支气管败血波氏杆菌 的MIC结果分别见表3。Table 3
表3
表3泰地罗新对四种菌的MIC试验
Table 3
| 菌种 Bacterial strain | MIC | MIC50 | MIC90 |
|---|---|---|---|
| 胸膜肺炎放线杆菌(39株)Actinobacillus pleuropneumonia(39 strains) | 2-32 | 4 | 16 |
| 多杀性巴氏杆菌(25株)Pasteurella multiflora(25 strains) | 0.25-1 | 0.5 | 1 |
| 支气管败血波氏杆菌(10株)Bronchial septicemic wave bacillus(10 strains) | 0.06-8 | 2 | 8 |
| 副猪嗜血杆菌(74株)Haemophilus Paracoides(74 strains) | 0.06-8 | 0.5 | 2 |
新窗口打开|下载CSV
2.2 泰地罗新注射液对人工感染猪副猪嗜血杆菌仔猪治疗试验
2.2.1 确定攻毒感染剂量 在预试验过程中,0.8、1 mL·kg-1bw攻毒剂量试验猪发病迅速,产生严重的呕吐反应,猪卧地不起,呼吸困难,1d内均死亡,死亡率100%;0.3 mL·kg-1bw攻毒猪精神萎靡,但症状不明显,死亡率10%;0.5 mL·kg-1bw攻毒剂量,仔猪发病症状明显,且剖检后能观察到肺脏等器官明显病变,从病料中能分离出副猪嗜血杆菌,发病率100%,死亡率70%。预试验结果见表4。Table 4
表4
表450头健康仔猪攻毒剂量及结果
Table 4
| 菌株 Bacterial strain | 日龄接种 Inoculate days | 活菌量 Living bacterium quantity (CFU/mL) | 接种剂量 Inoculation dosage (mL·kg-1) | 数量(头) Number (Head) | 攻毒结果 Poison attack results | |
|---|---|---|---|---|---|---|
| 发病数量(头) Morbidity(Head) | 死亡数量(头) Mortality(Head) | |||||
| 13R | 7-8周龄 7-8 weeks | 1×1010 | 0.3 | 10 | 5 | 1 |
| 1×1010 | 0.5 | 10 | 10 | 7 | ||
| 1×1010 | 0.8 | 10 | 10 | 10 | ||
| 1×1010 | 1 | 10 | 10 | 10 | ||
| TSB培养基 TSB medium | 7-8周龄 7-8 weeks | 1×1010 | 1mL | 10 | 0 | 0 |
新窗口打开|下载CSV
在正式试验前进行预备试验,确定感染途径和感染量,感染量至少应为受试动物的最小致死量或80%以上感染动物出现明显的发病症状。通过预试验结果表明:0.5 mL·kg-1bw攻毒剂量,可用于本次人工致病模型的感染剂量。
2.2.2 临床症状观察 攻毒2 h后,各组猪开始出现体温升高(图1);精神委顿,食欲明显减退或废绝,呼吸轻微急促、跛行且不愿走动,卧地不起(图2-A);部分猪出现张口呼吸,呈犬坐姿势,并出现短暂性呕吐症状(图2-B);攻毒约4 h后,猪体温达到最高,体毛零乱,呼吸困难,站立困难甚至瘫痪张口伸舌,严重腹式呼吸,耳、鼻、眼及后躯部位皮肤发绀(图2-C);感染组感染6 h 后,发病猪关节肿大,精神极度沉郁,最后口鼻流泡沫状液体,出现死亡(图2-D)。给药后各试验组平均体温及标准差见表5。
图1
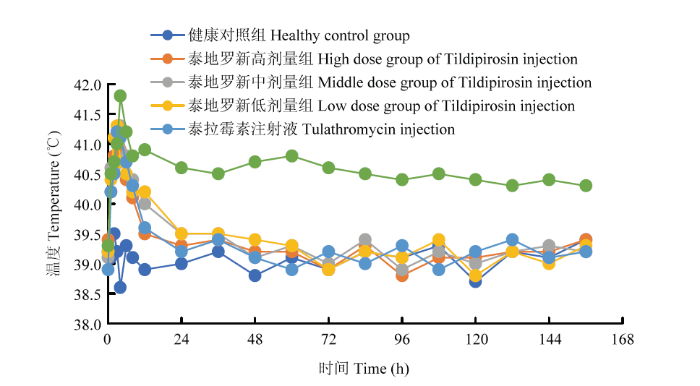 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1给药后各试验组体温检测
Fig. 1Temperature of each experimental group after administration
图2
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2临床症状观察
Fig. 2Clinical symptom observation results of piglets
Table 5
表5
表5给药后各实验组平均体温及标准差
Table 5
| 时间 Time (h) | 健康对照组 Healthy control group | 泰地罗新注射液 高剂量组 High dose group of Tildipirosin injection | 泰地罗新注射液 中剂量组 Middle dose group of Tildipirosin injection | 泰地罗新注射液 低剂量组 Low dose group of Tildipirosin injection | 泰拉霉素注射液 Tulathromycin injection | 感染对照组 Infective control group |
|---|---|---|---|---|---|---|
| 0 | 39.2±0.18 | 39.4±0.19 | 39.1±0.22 | 39.2±0.20 | 38.9±0.22 | 39.3±0.31 |
| 1 | 39.1±0.19 | 40.2±0.18 | 40.6±0.23 | 40.4±0.22 | 40.2±0.18 | 40.5±0.29 |
| 3 | 39.2±0.22 | 41.2±0.21 | 41±0.19 | 41.1±0.21 | 41.2±0.21 | 41±0.22 |
| 4 | 38.6±0.21 | 40.9±0.20 | 40.8±0.17 | 41.3±0.22 | 41.1±0.19 | 41.8±0.28 |
| 6 | 39.3±0.20 | 40.4±0.19 | 40.4±0.16 | 40.7±0.24 | 40.7±0.23 | 41.2±0.17 |
| 8 | 39.1±0.17 | 40.1±0.23 | 40±0.21 | 40.5±0.18 | 40.3±0.21 | 40.8±0.19 |
| 12 | 38.9±0.20 | 39.5±0.18 | 39.5±0.22 | 40.2±0.19 | 39.6±0.18 | 40.9±0.24 |
| 24 | 39±0.19 | 39.3±0.23 | 39.5±0.18 | 40.2±0.22 | 39.2±0.19 | 40.6±0.22 |
| 36 | 39.2±0.23 | 39.4±0.25 | 39.1±0.19 | 39.5±0.22 | 39.4±0.27 | 40.5±0.28 |
| 48 | 38.8±0.16 | 39.2±0.21 | 39.3±0.20 | 39.5±0.24 | 39.1±0.26 | 40.7±0.26 |
| 60 | 39.1±0.21 | 39.2±0.20 | 39±0.20 | 39.4±0.22 | 38.9±0.29 | 40.8±0.21 |
| 72 | 38.9±0.22 | 38.9±0.17 | 39.4±0.22 | 39.3±0.22 | 39.2±0.19 | 40.6±0.27 |
| 84 | 39.2±0.18 | 39.3±0.22 | 39.4±0.25 | 38.9±0.21 | 39±0.18 | 40.5±0.30 |
| 96 | 39.1±0.19 | 38.8±0.20 | 38.9±0.21 | 39.2±0.22 | 39.3±0.21 | 40.4±0.22 |
| 108 | 39.3±0.20 | 39.1±0.24 | 39.2±0.19 | 39.1±0.19 | 38.9±0.21 | 40.5±0.22 |
| 120 | 38.7±0.22 | 39.1±0.22 | 39±0.17 | 39.4±0.22 | 39.2±0.22 | 40.4±0.24 |
| 132 | 39.2±0.18 | 39.2±0.19 | 39.2±0.20 | 38.8±0.24 | 39.4±0.19 | 40.3±0.25 |
| 144 | 39.1±0.21 | 39.2±0.21 | 39.3±0.20 | 39.2±0.21 | 39.1±0.21 | 40.4±0.21 |
| 156 | 39.4±0.21 | 39.4±0.25 | 39.2±0.18 | 39±0.22 | 39.2±0.18 | 40.3±0.24 |
新窗口打开|下载CSV
2.2.3 体重增重情况 试验前和试验后分别对各组试验猪进行称重。经统计学分析,低剂量组,中剂量组、高剂量组与空白组给药前后体重无显著性差异(P>0.05)。详见表6。
Table 6
表6
表6试验期间各剂量组体重变化($\bar{X}$±S.D)
Table 6
| 组别 Groups | 试验前体重 Pretrial weight (kg) | 试验后体重 Posttest weigh (kg) | 增重 Weight increment (kg) |
|---|---|---|---|
| 健康对照组 Healthy control group | 12.5±0.6 | 15.5±0.7 | 3.0±0.2a |
| 泰地罗新高剂量组 High dose group of Tildipirosin injection | 12.9±0.9 | 15.8±1.2 | 2.9±0.3a |
| 泰地罗新中剂量组 Middle dose group of Tildipirosin injection | 12.9±1.1 | 15.7±1.2 | 2.9±0.2a |
| 泰地罗新低剂量组 Low dose group of Tildipirosin injection | 12.7±0.9 | 15.2±0.9 | 2.5±0.2b |
| 泰拉霉素注射液 Tulathromycin injection | 13.1±0.5 | 16.1±0.6 | 3.0±0.2a |
| 感染对照组 Infective control group | 12.5±0.6 | 14.6±0.7 | 2.1±0.1c |
新窗口打开|下载CSV
2.2.4 眼观病理变化 病死猪剖检可见关节腔有积液(图3-A);肺部表面有许多出血和淤血斑,充血肿大,有纤维渗出物附着(图3-B);腹腔有积液及丝状纤维素性渗出物(图3-C、D);肝脏有充血(图3-E);心包膜增厚,心包内积液且有纤维渗出(图3-F);胸膜表面覆盖弥漫性纤维素性渗出物;胸腔内有大量淡黄色浑浊液体,气管、支气管中充满泡沫状血性黏液及黏膜渗出物。
图3
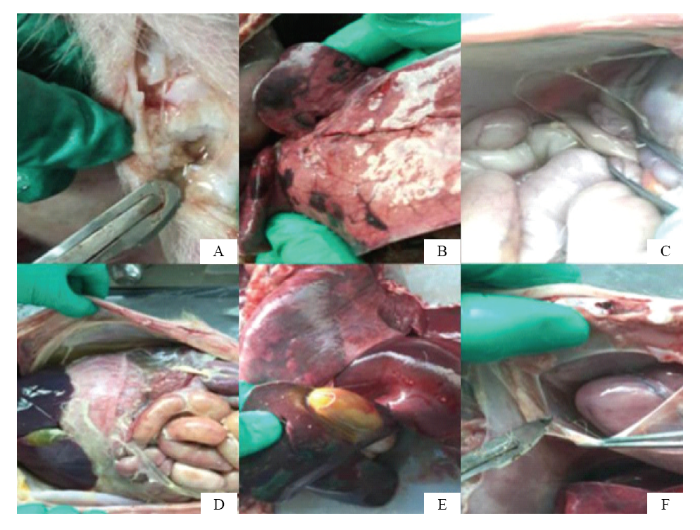 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3眼观病理变化观察
Fig. 3Observation results of ocular pathological changes
2.2.5 病原菌分离培养 将病死猪的肝(图4 -A)、肺(图4- B)等病料均匀涂在TSA平板上后,副猪嗜血杆菌在TSA培养基上生长良好,肉眼可见许多透明、光滑、边缘整齐呈露珠针尖大小的菌落。分离出的副猪嗜血杆菌在TSA培养基上的部分形态见图4。
图4
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图4病原菌分离培养观察
Fig. 4Observation of pathogen isolation and culture
2.2.6 PCR鉴定 将从肝、肺等病料中分离的菌,按“1.8”方法提取模板后,副猪嗜血杆菌16s RNA基因PCR扩增电泳图谱如图5,可见目的条带均与预测条带大小一致。
图5
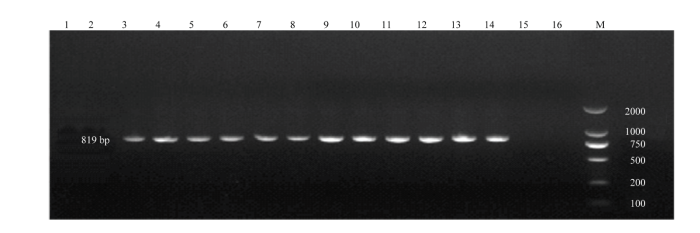 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图5副猪嗜血杆菌的16S rRNA的PCR
Fig. 5PCR results of 16S rRNA from Haemophilus parthenosus
2.2.7 疗效评价 在整个试验过程中,泰地罗新注射液高、中剂量组与对照药物组猪能迅速的减轻临床症状,具有显著的治疗效果。与感染对照组相比,给药后,大部分猪的精神沉郁,呼吸困难,体温升高等临床症状得到改善,食欲逐步恢复正常,体重增加。低剂量组共计有4头猪死亡,2头猪生长停滞,消瘦;感染不给药组共计死亡7头猪,其余3头猪生长停滞,消瘦。具体疗效评价见表7—9。
Table 7
表7
表7泰地罗新注射液对猪副嗜血杆菌病的疗效(以有效率为评价指标)
Table 7
| 编号 No. | 组别 Groups | 头数 Head | 死亡率 Mortality (%) | 有效率 Efficient (%) | 治愈率 Cure rate (%) | 与第5组 比较 (χ2检验) Compare with group 5 (χ2 test) | 与第4组 比较 (χ2检验) Compare with group 4 (χ2 test) | 与第3组 比较 (χ2检验) Compare with group 3 (χ2 test) | 与第2组 比较 (χ2检验) Compare with group 2 (χ2 test) |
|---|---|---|---|---|---|---|---|---|---|
| 1 | 泰地罗新高剂量组 High dose group of Tildipirosin injection | 10 | 0(0/10) | 100(10/10) | 100(10/10) | 20 | 1.053 | 8.571 | 1.053 |
| 2 | 泰地罗新中剂量组 Middle dose group of Tildipirosin injection | 10 | 0(0/10) | 100(9/10) | 90(9/10) | 16.36 | 0 | 5.495 | - |
| 3 | 泰地罗新低剂量组 Low dose group of Tildipirosin injection | 10 | 40(4/10) | 40(4/10) | 30(3/10) | 5 | 5.495 | - | - |
| 4 | 泰拉霉素注射液 Tulathromycin injection | 10 | 10(1/10) | 90(9/10) | 80(8/10) | 16.364 | - | - | - |
| 5 | 感染对照组 Infective control group | 10 | 70(7/10) | - | - | - | - | - | - |
| 6 | 健康对照组 Healthy control group | 10 | - | - | - | - | - | - | - |
新窗口打开|下载CSV
以有效率为评价指标(表7),经X2分析,泰地罗新注射液各给药组及对照药物组与感染不给药组相比,均存在显著性差异(P<0.05);泰地罗新各给药组与对照药物组相比,泰地罗新注射液高、中剂量组与对照药物组无显著性差异(P>0.05),泰地罗新注射液低剂量组与对照药物组相比存在显著性差异(P<0.05),表明泰地罗新低剂量组有效率远不如对照药物组;泰地罗新注射液各组之间,高、中剂量组与低剂量组存在显著性差异(P<0.05),高、中剂量组之间无显著性差异(P>0.05)。
以治愈率为评价指标(表8),经χ2分析,泰地罗新注射液高、中剂量组及对照药物组与感染不给药组相比,均存在显著性差异(P<0.05),泰地罗新低剂量组与感染不给药相比,无显著性差异(P>0.05);泰地罗新各给药组与对照药物组相比,泰地罗新注射液高、中剂量组与对照药物组无显著性差异(P>0.05),泰地罗新注射液低剂量组与对照药物组相比存在显著性(P<0.05),表明泰地罗新低剂量组的治愈率不如对照药物组;泰地罗新注射液各组之间相比,高、中剂量组与低剂量组存在显著性差异(P<0.05),高、中剂量组之间无显著性差异(P>0.05)。
Table 8
表8
表8泰地罗新注射液对猪副嗜血杆菌病的疗效(以治愈率为评价指标)
Table 8
| 编号 No. | 组别 Groups | 头数 Head | 死亡率 Mortality (%) | 有效率 Efficient (%) | 治愈率 Cure rate (%) | 与第5组 比较 (χ2检验) Compare with group 5 (χ2 test) | 与第4组 比较 (χ2检验) Compare with group 4 (χ2 test) | 与第3组 比较 (χ2检验) Compare with group 3 (χ2 test) | 与第2组 比较 (χ2检验) Compare with group 2 (χ2 test) |
|---|---|---|---|---|---|---|---|---|---|
| 1 | 泰地罗新高剂量组 High dose group of Tildipirosin injection | 10 | 0(0/10) | 100(10/10) | 100(10/10) | 20 | 2.222 | 10.769 | 1.053 |
| 2 | 泰地罗新中剂量组 Middle dose group of Tildipirosin injection | 10 | 0(0/10) | 100(9/10) | 90(9/10) | 16.364 | 0.392 | 7.5 | - |
| 3 | 泰地罗新低剂量组 Low dose group of Tildipirosin injection | 10 | 40(4/10) | 40(4/10) | 30(3/10) | 3.529 | 5.051 | - | - |
| 4 | 泰拉霉素注射液 Tulathromycin injection | 10 | 10(1/10) | 90(9/10) | 80(8/10) | 13.333 | - | - | - |
| 5 | 感染对照组 Infective control group | 10 | 70(7/10) | - | - | - | - | - | - |
| 6 | 健康对照组 Healthy control group | 10 | - | - | - | - | - | - | - |
新窗口打开|下载CSV
以死亡率为评价指标(表9),泰地罗新注射液高、中剂量组及对照药物组与感染不给药组相比,均存在显著性差异(P<0.05),泰地罗新低剂量组与感染不给药相比,无显著性差异(P>0.05);泰地罗新各给药组与对照药物组相比,均无显著性差异(P>0.05);泰地罗新注射液各组之间,高、中剂量组与低剂量组存在显著性差异(P<0.05),高、中剂量组之间无显著性差异(P>0.05)。
Table 9
表9
表9泰地罗新注射液对猪副嗜血杆菌病的疗效(以死亡率为评价指标)
Table 9
| 编号 No. | 组别 Groups | 头数 Head | 死亡率 Mortality (%) | 有效率 Efficient (%) | 治愈率 Cure rate (%) | 与第5组 比较 (χ2检验) Compare with group 5 (χ2 test) | 与第4组 比较 (χ2检验) Compare with group 4 (χ2 test) | 与第3组 比较 (χ2检验) Compare with group 3 (χ2 test) | 与第2组 比较 (χ2检验) Compare with group 2 (χ2 test) |
|---|---|---|---|---|---|---|---|---|---|
| 1 | 泰地罗新高剂量组 High dose group of Tildipirosin injection | 10 | 0(0/10) | 100(10/10) | 100(10/10) | 10.769 | 1.053 | 5 | / |
| 2 | 泰地罗新中剂量组 Middle dose group of Tildipirosin injection | 10 | 0(0/10) | 100(10/10) | 90(9/10) | 10.769 | 1.053 | 5 | - |
| 3 | 泰地罗新低剂量组 Low dose group of Tildipirosin injection | 10 | 40(4/10) | 40(4/10) | 30(3/10) | 1.818 | 2.400 | - | - |
| 4 | 泰拉霉素注射液 Tulathromycin injection | 10 | 10(1/10) | 90(9/10) | 80(8/10) | 7.500 | - | - | - |
| 5 | 感染对照组 Infective control group | 10 | 70(7/10) | - | - | - | - | - | - |
| 6 | 健康对照组 Healthy control group | 10 | - | - | - | - | - | - | - |
新窗口打开|下载CSV
通过以有效率、治愈率、死亡率3个指标,对不同组别之间的分析结果表明,泰地罗新注射液中剂量组,即推荐给药剂量,可满足临床对副猪嗜血杆菌的治疗效果。
3 讨论
3.1 体外抑菌试验
抗生素的合理使用在兽医临床中越来越重要,但抗生素的滥用也是细菌耐药性发展的最主要原因之一[25]。在我国替米考星和泰乐菌素是用的比较广泛的治疗呼吸道感染的大环类酯类抗生素,但其长时间的使用使很多地区开始出现了相关的耐药菌株,研究表明[26],泰地罗新与泰乐菌素、泰拉霉素和替米卡星等几种大环类脂类抗生素相比,具有更低的耐药性。在体外抑菌试验中,本次试验采用金黄色葡萄球菌ATCC25923作为质控菌,其MIC为8 μg·mL-1,在2—16 μg·mL-1范围内,符合质控要求,增加了结果的可靠性。研究结果表明泰地罗新对副猪嗜血杆菌的抑菌效果最强,这也与EMA[27]对数个欧洲国家在2005—2010 年分离得到的 349 株猪的呼吸道病原菌进行的泰地罗新体外最小抑菌浓度(MIC50和 MIC90)测定结果相似。表明泰地罗新注射液可用于治疗引起猪呼吸系统疾病中的副猪嗜血杆菌、胸膜肺炎放线杆菌、多杀性巴氏杆菌、支气管败血性波氏杆菌疾病。3.2 人工感染副猪嗜血杆菌仔猪的保护作用
副嗜血杆菌通常在常规猪的鼻腔和扁桃体中发现,在一定程度上也存在于健康状况良好的动物中。考虑到这一点,从上呼吸道获得的样本不应用于评估群体中的副猪嗜血杆菌感染。从胸膜、心包、腹膜、脑膜或关节等全身部位获得的组织样本是诊断副猪嗜血杆菌感染的较好选择[28]。国外研究人员通常首选剖腹产初乳缺乏猪(CD)[29,30]建立副猪嗜血杆菌致病性疾病模型,但鉴于其对实验条件要求严格以及剖腹产初乳猪缺乏猪价格昂贵,也有不少研究人员[31,32]选择自然生产初乳缺乏猪作为试验动物。本试验选择110头常规饲养的三元杂交断奶仔猪进行腹腔注射攻毒,成功复制出了副猪嗜血杆菌的典型临床症状及眼观病理变化。攻毒成功后采用泰地罗新注射液高中低3个剂量组对感染仔猪分别进行治疗,人工感染治疗结果显示,泰拉霉素对照组和泰地罗新中、高剂量组对感染猪的治愈率为100%,与本次试验体外抑菌结果一致。且试验前后与健康对照组相比,猪体重增加无显著性差异。低剂量组有4头猪治疗无效死亡,2头猪给药后临床症状有所好转,但生长受到影响,发病不给药组死亡7头猪。低剂量组与发病不给药组试验前后体重增加显著性低于健康对照组(P<0.05),且发病不给药组相对于低剂量组,体重增加也明显降低。3.3 泰地罗新注射液临床应用
我国替米考星与泰乐菌素一般为混饲或饮水给药,需要多次重复才能发挥药效[33,34,35]。当病猪食欲减退时,该给药方式将显著影响药物的治疗效果。泰地罗新给药方式为4 mg·kg-1单剂量注射给药,猪为肌肉注射,牛为皮下注射。该法操作简单,且疗效显著,因此值得推广应用[36]。闫超群等[37]以健康猪为研究对象,首次开展了泰地罗新注射液在猪体内的药动学及生物利用度研究,通过给两组猪分别按4 mg·kg-1剂量进行肌注和静脉注射给药后,发现泰地罗新注射液的绝对生物利用度为109.27%,说明泰地罗新注射液通过肌注给药能够被完全吸收,适于肌注给药。ROSE等药动试验数据表明[38],泰地罗新按4 mg·kg-1剂量对24头猪进行单次肌肉注射后,能够快速到达肺部组织并且达到治疗浓度,1 d之后达到峰浓度,在试验第17天依旧保留在治疗浓度以上。LEI等[20]结合药动学-药效学同步模型研究(PK/PD)也证明了猪肌肉注射4.17 mg·kg-1的泰地罗新注射液对HPS有较强的杀灭作用,但缺少后续的临床攻毒治疗试验研究。本试验通过开展对人工感染副猪嗜血杆菌仔猪的保护作用的研究,验证了泰地罗新注射液按4 mg·kg-1肌肉注射对仔猪感染HPS的临床治疗效果。4 结论
仔猪按4 mg·kg-1给药剂量肌肉注射泰地罗新注射液,可有效治疗由副猪嗜血杆菌感染引起的猪呼吸道疾病。参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[DB/OL][EB/OL].[0809]. Available at: .
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 2]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[D].
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[EB/OL]. [0810]. available at: .
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[EB/OL]. [0809]. Available at: .
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
