 ,1, 石延霞1, 谢学文1, 帕提古丽3, 李宝聚
,1, 石延霞1, 谢学文1, 帕提古丽3, 李宝聚 ,11
,11 2
3
Establishment and Application of a Triplex PCR Detection System for Vegetable Soil-Borne Pathogens
LIU RuiChi1,2, CHENG YouPu2, CHAI ALi ,1, SHI YanXia1, XIE XueWen1, PATIGULI3, LI BaoJu
,1, SHI YanXia1, XIE XueWen1, PATIGULI3, LI BaoJu ,1
,1通讯作者:
责任编辑: 岳梅
收稿日期:2019-02-20接受日期:2019-03-18网络出版日期:2019-06-16
| 基金资助: |
Received:2019-02-20Accepted:2019-03-18Online:2019-06-16
作者简介 About authors
刘芮池,E-mail: LIURUICHI0@163.com。

摘要
关键词:
Abstract
Keywords:
PDF (576KB)元数据多维度评价相关文章导出EndNote|Ris|Bibtex收藏本文
本文引用格式
刘芮池, 程有普, 柴阿丽, 石延霞, 谢学文, 帕提古丽, 李宝聚. 蔬菜土传病原菌三重PCR检测体系的建立与应用[J]. 中国农业科学, 2019, 52(12): 2069-2078 doi:10.3864/j.issn.0578-1752.2019.12.005
LIU RuiChi, CHENG YouPu, CHAI ALi, SHI YanXia, XIE XueWen, PATIGULI, LI BaoJu.
0 引言
【研究意义】瓜果腐霉(Pythium aphanidermatum)隶属卵菌门,是一种重要的土传病原菌,通常侵染幼苗的根和种子,造成大量死苗[1]。尖镰孢(Fusarium oxysporum)是一种世界性分布的土传病原菌,引起维管束病害,近几年来蔬菜枯萎病发生面积逐年扩大[2,3]。大丽轮枝菌(Verticillium dahliae)可侵染大豆、番茄、茄子、马铃薯等,引发黄萎病、根腐病、茎基腐病等,目前尚无有效防治手段[4]。由于这3种病原菌引起的病害症状与其他植物病害相似度高,尤其病害初期症状不明显,仅靠肉眼不能准确判断病害种类。而防治不同病原菌所用药剂不同,错误的诊断导致用药及防治失败,所以在病害潜伏期或发病初期作出准确诊断,有利于及时采取针对性防治措施,减少损失[5,6,7]。因此,对于上述3种侵染蔬菜的土传病原菌,亟需建立科学、准确、快速、高通量的检测方法。【前人研究进展】传统的病害诊断依赖于病害症状的观察和病原菌的分离与鉴定,但病害的症状观察需要典型症状出现才可准确判断,病原菌的分离培养易受环境、培养条件等影响,操作复杂,耗时长,不能满足高通量、快速的检测要求,不利于大规模样品的分析鉴定[8,9,10,11,12]。随着分子生物学的飞速发展,已有许多成熟的技术可用于植物病原菌的检测。THOMAS等[13]利用腐霉菌的18S rRNA基因保守区域,设计特异性引物Pyth712Fwd/ Pyth1758Rev对腐霉菌属进行了普通PCR检测;加拿大地区的大豆生产受腐霉菌影响严重,MARCHAND等[14]于2010—2012年采集土壤样本,对分离出的腐霉菌进行PCR扩增和测序以鉴定不同的腐霉菌物种;GEISER等[15]采用引物EF1/EF2扩增TEF基因区域以鉴定镰孢菌;RAHJOO等[16]于2004—2005年在伊朗11个地区分离出191株镰孢菌,通过TEF区域特异性引物VER1/2和PRO1/2进行PCR扩增,鉴定结果显示分别为尖镰孢、层出镰孢(F. proliferatum)和黄色镰孢(F. culmorum);LI等[17]设计了引物NMS1/NMS2用于轮枝菌属的鉴定;BRESSAN等[18]通过ITS区域建立了一种快速、特异的PCR检测方法用于土壤中大丽轮枝菌的检测,检测灵敏度为4 fg。【本研究切入点】针对多种土传病原菌的多重PCR检测技术的研究鲜有报道。针对田间多种病原菌复合侵染问题,建立3种土传病原菌的多重PCR体系,同时检测多种病原菌,提高检测效率,为病害防治赢得时间。【拟解决的关键问题】筛选适宜的检测引物,优化多重PCR检测体系,建立能够同时检测蔬菜瓜果腐霉、尖镰孢和大丽轮枝菌的多重PCR检测方法,提高病原菌检测效率,为病害的诊断提供技术支持。1 材料与方法
试验于2017年12月至2018年12月在中国农业科学院蔬菜花卉研究所完成。1.1 试验材料
供试菌株由中国农业科学院蔬菜花卉研究所蔬菜病害综合防治课题组提供,其中瓜果腐霉、尖镰孢、大丽轮枝菌为检测病菌(表1)。Table 1
表1
表1供试菌株
Table 1
| 病原菌 Pathogen | 寄主 Host | 菌株编号 Strain number | 引物 Primer | ||
|---|---|---|---|---|---|
| AsAPH2B/AsPyF | FOF1/FOR1 | VActF/VActR | |||
| 瓜果腐霉P. aphanidermatum | 番茄Tomato | FQ15092209 | + | - | - |
| 尖镰孢F. oxysporum | 黄瓜Cucumber | HG12090201 | - | + | - |
| 大丽轮枝菌V. dahliae | 茄子Eggplant | QZ12061103 | - | - | + |
| 茄镰孢F. solani | 黄瓜Cucumber | HG14060601 | - | - | - |
| 芹菜Celery | QC15061008 | - | - | - | |
| 核盘菌Sclerotinia sclerotiorum | 青花菜Broccoli | QHC18032301 | - | - | - |
| 茄子Eggplant | QZ11102201 | - | - | - | |
| 辣椒疫霉Phytophthora capsici | 辣椒Pepper | LJ12010805 | - | - | - |
| 辣椒Pepper | LJ18081001 | - | - | - | |
| 灰葡萄孢Botrytis cinerea | 番茄Tomato | FQ11051301 | - | - | - |
| 黄瓜Cucumber | HG11021509 | - | - | - | |
| 立枯丝核菌Rhizoctonia solani | 白菜Chinese cabbage | BC16052001 | - | - | - |
| 生菜Lettuce | SC16052001 | - | - | - | |
| 茄科劳尔氏菌Ralstonia solanacearum | 番茄Tomato | FQ12080802 | - | - | - |
| 番茄Tomato | FQ16060706 | - | - | - | |
| 胡萝卜果胶杆菌Pectobacterterium carotovorum | 黄瓜Cucumber | HG1501503604 | - | - | - |
| 白菜Chinese cabbage | BC18082306 | - | - | - | |
| 密执安棒形杆菌密执安亚种 Clavibacter michiganensis subsp. michiganensis | 番茄Tomato | FQ18082408 | - | - | - |
| 番茄Tomato | FQ18082410 | - | - | - | |
新窗口打开|下载CSV
1.2 基因组DNA的提取
取适量冻干菌丝样品,采用CTAB法提取病原菌基因组DNA,-20℃保存备用。1.3 多重PCR引物组合
检索国内外关于瓜果腐霉、尖镰孢、大丽轮枝菌的分子检测报道,选取可能组合的引物。瓜果腐霉采用ASANO等[19]设计的特异引物AsAPH2B/AsPyF;尖镰孢引物采用FOF1/FOR1[20];大丽轮枝菌采用引物VActF/VActR[21]。通过NCBI网站对引物组进行BLAST比对,检测这3对引物之间相似度是否符合组成多重PCR的条件,设计试验进一步验证。引物由北京博迈德生物技术有限公司合成(表2)。
Table 2
表2
表2供试引物
Table 2
| 病原菌Pathogen | 序列Sequence (5′-3′) | 产物大小Product length (bp) | 参考文献Reference |
|---|---|---|---|
| 瓜果腐霉 P. aphanidermatum | AsAPH2B: GCGCGTTGTTCACAATAAATTGC | 163 | [19] |
| AsPyF: CTGTTCTTTCCTTGAGGTG | |||
| 尖镰孢F. oxysporum | FOF1: ACATACCACTTGTTGCCTCG | 328 | [20] |
| FOR1: CGCCAATCAATTTGAGGAACG | |||
| 大丽轮枝菌V. dahliae | VActF: TAATTCACAATGGAGGGTAGG | 530 | [21] |
| VActR: GTAAGGATACCACGCTTGG |
新窗口打开|下载CSV
1.4 多重PCR体系的建立
对影响三重PCR体系的重要因素进行优化。58—65℃之间设计梯度PCR反应程序,共58、58.7、59.6、60.8、62.4、63.7、64.5、65℃ 8个梯度;引物AsAPH2B/AsPyF浓度设定0.12、0.16和0.20 μmol·L-1 3个梯度,引物FOF1/FOR1浓度设定0.16、0.20和0.24 μmol·L-1 3个梯度,引物VActF/VActR浓度设定0.24、0.28和0.32 μmol·L-1 3个梯度;3个延伸时间分别设为30 s、45 s、1 min;3个循环次数分别设为30、35、40次。PCR仪进行扩增,反应结束后取5 μL扩增产物进行琼脂糖凝胶电泳,使用Bio-rad凝胶成像系统照相。结果按照病原菌扩增的特异性和敏感性,即条带的强弱、杂带的有无等进行综合评价。
1.5 阳性样品扩增产物的测序及分析
对阳性样品的扩增产物进行双向测序,并在GenBank中进行BLAST分析,以验证PCR的特异性。1.6 三重PCR反应特异性检测
选取瓜果腐霉、尖镰孢、大丽轮枝菌基因组DNA等量混合均匀,分别以辣椒疫霉、立枯丝核菌、核盘菌等16株蔬菜土传病原菌基因组DNA为对照,利用优化好的三重PCR反应条件进行三重PCR检测,检验该体系的特异性。1.7 三重PCR反应灵敏度检测
将瓜果腐霉、尖镰孢、大丽轮枝菌基因组DNA模板浓度设置为10、1、10-1、10-2、10-3、10-4和10-5 ng·μL-1,使用优化后的三重PCR反应条件进行PCR扩增,取5 μL扩增产物进行琼脂糖凝胶电泳,凝胶成像系统照相。分别检测单一病原菌及混合病原菌的反应灵敏度。1.8 三重PCR检测体系的稳定性
为检验体系的稳定性和可重复性,分别使用北京博迈德生物技术有限公司的2×Taq Master PCR Mix和大连宝生物工程有限公司的TaKaRa Taq酶进行三重PCR反应。其中TaKaRa Taq(5 units/μL)0.125 μL,10×PCR Buffer 2.5 μL,dNTP Mixture(各2.5 mmol·L-1)2 μL,其他条件相同。两种反应体系均分别使用AerisTM型(新加坡艺思高科技有限公司)和C1000 TouchTM型(赛默飞世尔科技有限公司)的热循环仪进行扩增[22]。1.9 人工模拟接种基质中病原菌的检测
1.9.1 人工模拟带菌基质制备 将瓜果腐霉、尖镰孢、大丽轮枝菌菌株分别接种于OA和PDA平板,25℃恒温培养10 d,收集瓜果腐霉菌丝,称重,制成终浓度为10 mg·mL-1的菌丝悬液,10倍梯度稀释,将100 mL菌悬液加入到100 g无菌基质中,分别制备成浓度为10、1、10-1、10-2、10-3、10-4、10-5 mg·g-1的模拟带菌基质[23]。用灭菌刷刷下尖镰孢和大丽轮枝菌平板上的孢子,分别配成浓度为106个孢子/mL悬浮液,10倍梯度稀释。将100 mL菌悬液加入到100 g无菌基质中,分别制备成浓度为108、107、106、105、104、103、102个孢子/mL的模拟带菌基质。将分别带有3种病原菌的基质等比混合制成混合带菌基质。在每100 g模拟带菌土中随机抽取1 g土样,冷冻干燥备用[24]。1.9.2 带菌基质中DNA的提取 采用Fast DNA SPIN Kit for Soil(美国MP Biomedicals土壤基因组DNA提取试剂盒)对基质进行基因组DNA的提取,-20℃保存。
1.9.3 三重PCR检测人工模拟带菌基质 以不同浓度模拟带菌基质总DNA为模板,使用优化的三重PCR方法检测模拟的带菌基质,确定该引物对基质中病原菌分生孢子的检测灵敏度。
1.10 三重PCR体系的应用
田间采集根腐病、枯萎病及黄萎病病害根茎样本35份,土壤样本149份,其中根围土壤取自距发病植株根围2 mm,深5—10 cm的土壤,过筛去除杂物,取0.5 g根围土壤提取基因组DNA,提取病组织和根围土壤基因组DNA,并采用优化后的多重PCR反应体系进行检测,同时进行病原菌分离培养,以验证该三重PCR检测体系。2 结果
2.1 三重PCR反应体系的建立
通过对退火温度、引物浓度组合、延伸时间和循环次数的优化,最终确定三重PCR反应体系(总体积为25 μL):2×Taq Master PCR Mix 12.5 μL,10 μmol·L-1的引物AsAPH2B/AsPyF、FOF1/FOR1、VActF/VActR分别为0.3、0.4、0.6 μL,模板各1 μL,补加ddH2O至25 μL。反应程序:94℃预变性5 min;94℃变性30 s,60.8℃退火30 s,72℃延伸30 s,35个循环;72℃延伸10 min(图1)。图1
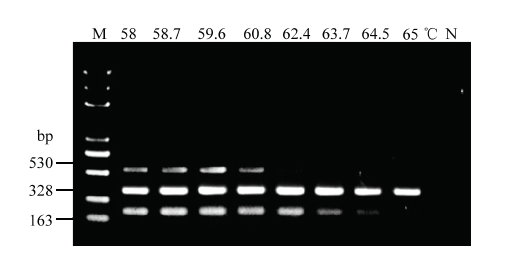 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图1三重PCR退火温度优化
Fig. 1Optimization of the annealing temperature for triplex PCR
2.2 阳性样品扩增产物的测序及分析
采用优化后的三重PCR检测体系对瓜果腐霉、尖镰孢和大丽轮枝菌进行扩增,扩增产物经克隆测序后,通过GenBank上BLAST比对,同源性均达到99%,因此确定扩增产物均为目标菌株(表3)。Table 3
表3
表3扩增产物比对结果
Table 3
| 病原菌Pathogen | GenBank登录号 GenBank accession number | 同源性Homology rate (Blastn) (%) |
|---|---|---|
| 瓜果腐霉P. aphanidermatum | KU211462.1 | 99 |
| 尖镰孢F. oxysporum | KU528856.1 | 99 |
| 大丽轮枝菌V. dahliae | KU057923.1 | 99 |
新窗口打开|下载CSV
2.3 三重PCR反应特异性检测
按照优化后的反应条件,引物AsAPH2B/AsPyF、FOF1/FOR1和VActF/VActR同时扩增出瓜果腐霉、尖镰孢和大丽轮枝菌的基因组DNA,获得163、328和530 bp的特异条带,而其他蔬菜病原菌都没有特异条带(图2)。图2
 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图2三重PCR特异性检测
M:DL 5000 Marker;1:瓜果腐霉、尖镰孢、大丽轮枝菌P. aphanidermatum, F. oxysporum and V. dahliae;2、3:茄镰孢F. solani;4、5:辣椒疫霉P. capsici;6、7:核盘菌S. sclerotiorum;8、9:立枯丝核菌R. solani;10、11:灰葡萄孢B. cinerea;12、13:茄科劳尔氏菌R. solanacearum;14、15:胡萝卜果胶杆菌P. carotovorum;16、17:密执安棒形杆菌密执安亚种C. michiganensis subsp. michiganensis;18:阴性对照Negative control
Fig. 2The specific detection of triplex PCR
2.4 三重PCR检测体系的灵敏度
三重PCR体系中,3对引物扩增单个模板能够检测到10-2 ng·μL-1的瓜果腐霉、尖镰孢和10-1 ng·μL-1大丽轮枝菌基因组DNA,同时扩增3个模板的灵敏度为10-1 ng·μL-1(图3、图4)。图3
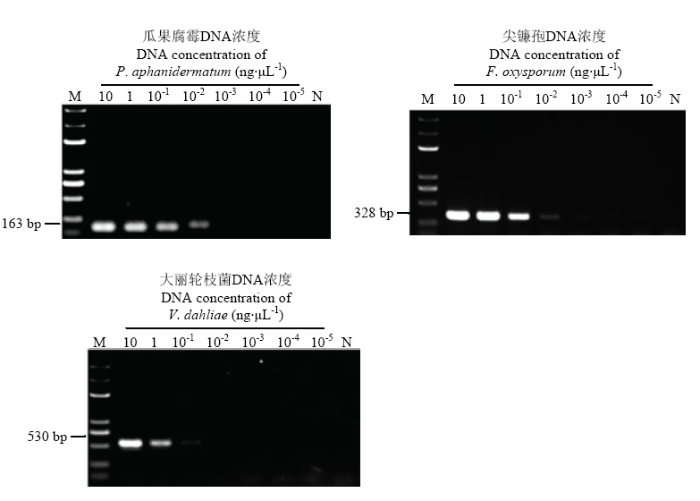 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图3三重PCR检测单一病原菌的灵敏度
M:DL 5000 Marker;N:阴性对照Negative control
Fig. 3The sensitivity of triplex PCR for detection of DNA from a single pathogen
图4
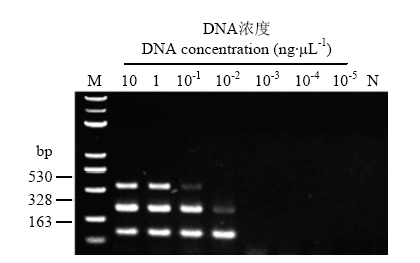 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图4三重PCR检测灵敏度
M:DL 5000 Marker;N:阴性对照Negative control
Fig. 4The sensitivity of triplex PCR detection
2.5 三重PCR检测体系的稳定性
采用大连宝生物工程有限公司和北京博迈德生物技术有限公司生产的Taq酶,PCR仪采用赛默飞世尔科技有限公司的C1000 TouchTM和新加坡艺思高科技有限公司的AerisTM热循环仪,以3种病原菌的基因组DNA为模板,进行三重PCR检测。结果显示,均可以扩增出3种病原菌的特异性目的片段(图5)。因此,所建立的三重PCR反应体系稳定,可用于瓜果腐霉、尖镰孢和大丽轮枝菌的快速诊断。图5
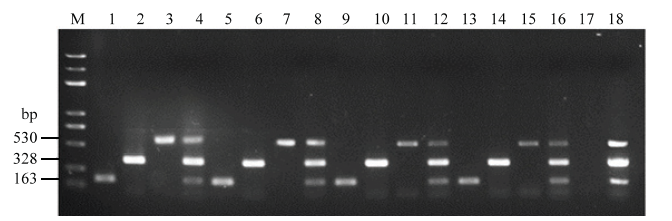 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图5三重PCR体系稳定性检测
M:DL 5000 Marker;1、5、9、13:瓜果腐霉P. aphanidermatum;2、6、10、14:尖镰孢F. oxysporum;3、7、11、15:大丽轮枝菌V. dahliae;4、8、12、16:瓜果腐霉、尖镰孢、大丽轮枝菌混合Mixture of P. aphanidermatum, F. oxysporum and V. dahliae;17:阴性对照Negative control;18:阳性对照Positive control。1—4、9—12:2×Taq Master PCR Mix;5—8、13—16:TaKaRa Taq;1—8:C1000 TouchTM;9—16:AerisTM
Fig. 5The stability detection of triplex PCR system
2.6 人工模拟接种基质检测
利用三重PCR方法对瓜果腐霉模拟带菌基质、尖镰孢模拟带菌基质、大丽轮枝菌模拟带菌基质、混合带菌基质和未加菌基质进行定量检测,结果显示对瓜果腐霉的检测灵敏度为10-2 mg菌丝/g,尖镰孢检测灵敏度为106个孢子/g,大丽轮枝菌的检测灵敏度为105个孢子/g;混合体系下对于尖镰孢和大丽轮枝菌的检测灵敏度为106个孢子/g,对瓜果腐霉的灵敏度是10-2 mg菌丝/g;而未加菌的基质DNA中未检测到(图6)。因此,所建立的三重PCR反应体系可应用于基质中瓜果腐霉、尖镰孢和大丽轮枝菌的检测。图6
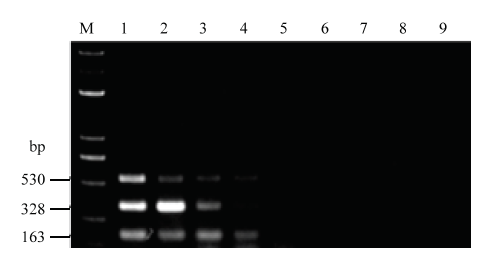 新窗口打开|下载原图ZIP|生成PPT
新窗口打开|下载原图ZIP|生成PPT图6模拟带菌基质三重PCR检测灵敏度
M:DL 5000 Marker;1—7:尖镰孢和大丽轮枝菌浓度分别为108、107、106、105、104、103、102个孢子/g,瓜果腐霉浓度分别为10、1、10-1、10-2、10-3、10-4、10-5 mg·g-1 The concentration of F. oxysporum and V. dahliae is 108, 107, 106, 105, 104, 103, 102 spores/g, respectively. The concentration of P. aphanidermatum is 10, 1, 10-1, 10-2, 10-3, 10-4, 10-5 mg·g-1, respectively;8:未加菌基质No pathogen in soil;9:阴性对照Negative control
Fig. 6Sensitivity of triplex PCR detection in artificially inoculated substrate
2.7 三重PCR体系的应用
分别从35份病组织和149份土壤中提取基因组DNA,进行三重PCR检测。结果显示4份病组织中检测到大丽轮枝菌,3份病组织中检测到瓜果腐霉,18份病组织中检测到尖镰孢,10份病组织中未检测到目标菌,病菌检出率为71.43%,检测结果与病害症状及分离培养结果吻合;在土壤检测中19份土壤检测到大丽轮枝菌,22份土壤检测到尖镰孢,30份土壤检测到瓜果腐霉,78份土壤中未检测到目标菌,检测结果与分离培养结果吻合(表4)。由此可见,通过对蔬菜病组织及其根围土壤进行三重PCR检测,可进行田间蔬菜瓜果腐霉、尖镰孢和大丽轮枝菌的快速诊断。Table 4
表4
表4不同地区病害样本三重PCR检测
Table 4
| 采样时间 Sampling time | 采样地点 Sampling site | 寄主 Host | 疑似病害 Suspected disease | 采样部位 Sampling position | 三重PCR Triple PCR | 分离培养 Isolated culture | 样本数量 Number of samples |
|---|---|---|---|---|---|---|---|
| 2017-12-09 | 浙江苍南 Cangnan, Zhejiang | 茄子Eggplant | 黄萎病Verticillium wilt | 茎基Stem | + | V. dahliae | 4 |
| 土壤Soil | + | V. dahliae | 4 | ||||
| 2018-01-16 | 山东寿光 Shouguang, Shandong | 黄瓜Cucumber | 枯萎病Fusarium wilt | 茎基Stem | + | F. oxysporum | 1 |
| 土壤Soil | + | F. oxysporum | 1 | ||||
| 2018-03-15 | 浙江苍南 Cangnan, Zhejiang | 黄瓜Cucumber | 枯萎病Fusarium wilt | 茎基Stem | + | F. oxysporum | 1 |
| 土壤Soil | + | F. oxysporum | 1 | ||||
| 2018-03-20 | 山东寿光 Shouguang, Shandong | 黄瓜Cucumber | 根腐病Root rot | 茎基Stem | + | P. aphanidermatum | 2 |
| 土壤Soil | + | P. aphanidermatum | 2 | ||||
| 2018 | 浙江苍南 Cangnan, Zhejiang | 黄瓜Cucumber | 枯萎病Fusarium wilt | 茎基Stem | + | F. oxysporum | 2 |
| 土壤Soil | + | F. oxysporum | 2 | ||||
| 2018-10-21 | 山东寿光 Shouguang, Shandong | 黄瓜Cucumber | 根腐病Root rot | 茎基Stem | + | P. aphanidermatum | 1 |
| 土壤Soil | + | P. aphanidermatum | 1 | ||||
| 2018-10-21 | 山东寿光 Shouguang, Shandong | 黄瓜Cucumber | 根腐病Root rot | 茎基Stem | - | — | 1 |
| 土壤Soil | - | — | 1 | ||||
| 2018-03-15 | 浙江苍南 Cangnan, Zhejiang | 黄瓜Cucumber | 枯萎病Fusarium wilt | 茎基Stem | - | — | 1 |
| 土壤Soil | - | — | 1 | ||||
| 2018-03-20 | 山东寿光 Shouguang, Shandong | 黄瓜Cucumber | 根腐病Root rot | 茎基Stem | - | — | 1 |
| 土壤Soil | - | — | 1 | ||||
| 2018-08-31 | 新疆喀什 Kashi, Xinjiang | 甜瓜Muskmelon | 枯萎病Fusarium wilt | 茎基Stem | F. oxysporum | 11 | |
| 茎基Stem | - | — | 4 | ||||
| 2019-01-02 | 辽宁绥中 Suizhong, Liaoning | 黄瓜Cucumber | 枯萎病Fusarium wilt | 茎基Stem | + | F. oxysporum | 3 |
| 茎基Stem | - | — | 3 | ||||
| 2017-2018 | 浙江苍南 Cangnan, Zhejiang | — | — | 土壤Soil | - | — | 48 |
| 土壤Soil | + | F. oxysporum | 12 | ||||
| 土壤Soil | + | V. dahliae | 12 | ||||
| 2018 | 山东寿光 Shouguang, Shandong | — | — | 土壤Soil | - | — | 27 |
| 土壤Soil | + | V. dahliae | 3 | ||||
| 土壤Soil | + | F. oxysporum | 6 | ||||
| 土壤Soil | + | P. aphanidermatum | 12 | ||||
| 2018-08-24 | 宁夏平罗 Pingluo, Ningxia | — | — | 土壤Soil | + | P. aphanidermatum | 9 |
| 2018-08-24 | 浙江永康 Yongkang, Zhejiang | — | — | 土壤Soil | + | P. aphanidermatum | 6 |
新窗口打开|下载CSV
3 讨论
我国蔬菜生产种苗需求量超过6 800亿株/年,育苗基质需求量大[25],由于育苗基质原料来源复杂,基质生产未能实现标准化,由基质带菌引起的蔬菜土传病害大面积发生问题时有发生,造成严重的经济损失。2015年渭南市大荔、临渭等西瓜产区种植户使用育苗基质培育西瓜苗后造成80%以上秧苗叶片发黄、根茎部腐烂(http://bbs.hsw.cn/read-htm-tid-7334210- displayMode-1.html);2017年8月,河南省崇召村菜农购买的育苗基质带菌,造成白菜、西兰花等蔬菜叶片大面积发黄、枯萎(http://www.cfvin.com/n/2017/ 08/24/164307287466.shtml)。因此,为防止基质带菌引起土传病害发生和传播,基质出厂前的带菌检测非常重要。目前国内对蔬菜土传病原菌的多重PCR体系报道较少,大多为在植株发病后根据病情对相应的病原菌进行普通PCR检测,但此种方法不能提前发现基质中的病原菌,具有滞后性,且每次只能检测一种病原菌,而病原菌复合侵染情况在田间普遍存在,因此能够同时检测多种病原菌的多重PCR技术具有较大的应用价值。多重PCR是在同一PCR体系里加入多对特异性引物,体系复杂,因素影响多,所以多重PCR反应体系建立较难。其中引物的选择直接影响PCR扩增的特异性与灵敏度,同时要防止引物相互配对,又要能够区分扩增片段大小。因此,需要选择适合长度的引物序列,从而获得最优的检测灵敏度和特异性以及各目标片段扩增均一性[26,27]。目前国际上关于瓜果腐霉、尖镰孢和大丽轮枝菌的分子检测研究较多[12,13,14,15,16,17],但同时检测这3种病原菌的多重PCR尚未见报道。根据多重PCR引物设计原则,本研究在参考大量文献引物的基础上,通过NCBI网站进行引物组BLAST比对,筛选出适用于多重PCR的引物组合,成功建立了对瓜果腐霉、尖镰孢和大丽轮枝菌进行检测的三重PCR检测体系。该体系降低了检测过程的复杂性和成本,节省时间并提高了检测的准确性,在混合DNA下检测灵敏度为10-1 ng·μL-1,与何宛芹等[28]根据EF-1α基因设计引物建立的镰孢菌四重PCR检测体系灵敏度一致。孙娟等[29]建立了能够同步检测棉花黄萎病菌、枯萎病菌和炭疽病菌的三重PCR检测体系,灵敏度为1.06 ng·μL-1,其灵敏度低于本研究所建立的三重PCR检测体系。
另外,本研究建立的三重PCR检测体系可用于基质中病原菌的检测,做到了预防病害发生,满足当前生产需要。同时,克服了土壤检测中病原菌含量少、杂质多等弊端,每克土壤中含有106个孢子即可被检测到。土壤微生物总DNA的富集和提取是该检测手段实际应用中的关键问题,仍需进一步深入研究。本研究建立的三重PCR体系可以在早期准确地检测出田间蔬菜病株根围土壤中的瓜果腐霉、尖镰孢和大丽轮枝菌,在病害潜伏期和发病初期就能对3种病害进行快速诊断,从而有效预防和控制蔬菜病害,具有较高的应用价值。
4 结论
通过引物筛选组合和条件优化,建立了可同时检测瓜果腐霉、尖镰孢和大丽轮枝菌3种蔬菜重要病原菌的三重PCR体系。该体系具有灵敏度高、稳定性和重复性好的特点,能够快速、准确地检测田间病株及其根围土壤中的瓜果腐霉、尖镰孢、大丽轮枝菌,为蔬菜土传病害的早期预防和流行监测提供了有效的技术手段。参考文献 原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
.
[本文引用: 1]
[D].
URL [本文引用: 1]
[D].
URL [本文引用: 1]
[D].
URL [本文引用: 1]
[D].
URL [本文引用: 1]
[本文引用: 1]
.
[本文引用: 1]
URLMagsci [本文引用: 1]

为获得具有高效抗菌活性的芽孢杆菌用于生物防治与果蔬保鲜,从柠檬、葡萄、红枣、酸奶、腐乳、豆瓣酱、哈尔滨红肠等26种食品样品中分离获得204株芽孢杆菌,通过对峙培养法,初筛得到62株抗瓜果腐霉(P. aphanidermatum)的菌株,选取其中抑菌效果明显的4株菌株,采用牛津杯扩散法经复筛得到1株显著抗瓜果腐霉的芽孢杆菌L-NM62,其发酵上清液对瓜果腐霉的抑菌圈直径达到(24.54±0.13)mm。菌株L-NM62经形态学、生理生化和16S rDNA序列分析,被鉴定为枯草芽孢杆菌L-NM62(Bacillus subtilis L-NM62)。进一步研究枯草芽孢杆菌L-NM62的生物学特性,发现该菌株的最适生长温度37℃,最适pH值7.5,最适接种量1.0%,并测定了该条件下枯草芽孢杆菌L-NM62的生长曲线。在此基础上,考察枯草芽孢杆菌L-NM62的抗菌谱,结果表明,枯草芽孢杆菌L-NM62具有广谱的抗菌活性,尤其对霉菌具有高效广谱的抗菌效果,显示出了很好的潜在开发应用前景。
URLMagsci [本文引用: 1]

为获得具有高效抗菌活性的芽孢杆菌用于生物防治与果蔬保鲜,从柠檬、葡萄、红枣、酸奶、腐乳、豆瓣酱、哈尔滨红肠等26种食品样品中分离获得204株芽孢杆菌,通过对峙培养法,初筛得到62株抗瓜果腐霉(P. aphanidermatum)的菌株,选取其中抑菌效果明显的4株菌株,采用牛津杯扩散法经复筛得到1株显著抗瓜果腐霉的芽孢杆菌L-NM62,其发酵上清液对瓜果腐霉的抑菌圈直径达到(24.54±0.13)mm。菌株L-NM62经形态学、生理生化和16S rDNA序列分析,被鉴定为枯草芽孢杆菌L-NM62(Bacillus subtilis L-NM62)。进一步研究枯草芽孢杆菌L-NM62的生物学特性,发现该菌株的最适生长温度37℃,最适pH值7.5,最适接种量1.0%,并测定了该条件下枯草芽孢杆菌L-NM62的生长曲线。在此基础上,考察枯草芽孢杆菌L-NM62的抗菌谱,结果表明,枯草芽孢杆菌L-NM62具有广谱的抗菌活性,尤其对霉菌具有高效广谱的抗菌效果,显示出了很好的潜在开发应用前景。
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
URLMagsci [本文引用: 1]

<P><FONT face=Verdana>【目的】探索和优化检测条件,建立同时检测草莓灰霉病菌Botrytis cinerea,炭疽病菌Colletotrichum gloeosporioides和黄萎病菌Verticillium dahliae的三重PCR检测体系,为3种病害的早期快速诊断和鉴定提供技术和方法。【方法】选择可以组合的3种病原菌特异引物,研究多重PCR的影响因素,优化PCR退火温度,采用正交试验方法,以3个引物组、Taq DNA聚合酶、dNTP和Mg2+六因素三水平优化多重PCR体系。【结果】建立并验证适合上述草莓主要病原菌的三重PCR最佳检测体系,可分别扩增出729、539和450 bp的特异条带, 最适退火温度为50℃,25 μL的反应体系中含有0.32 μmol?L-1 C729+/-、0.032 μmol?L-1 DB19/DB22、0.32 μmol?L-1 CgInt/ITS4、1.5 U Taq聚合酶、0.15 mmol?L-1 dNTP、1.6 mmol?L-1 MgCl2。【结论】利用上述引物组合和反应体系进行三重PCR检测,能够快速从田间发病植株和土壤中将草莓灰霉病菌、草莓炭疽病菌和草莓黄萎病菌检测出来,灵敏度可以达到10 pg菌丝DNA。<BR></FONT></P>
URLMagsci [本文引用: 1]

<P><FONT face=Verdana>【目的】探索和优化检测条件,建立同时检测草莓灰霉病菌Botrytis cinerea,炭疽病菌Colletotrichum gloeosporioides和黄萎病菌Verticillium dahliae的三重PCR检测体系,为3种病害的早期快速诊断和鉴定提供技术和方法。【方法】选择可以组合的3种病原菌特异引物,研究多重PCR的影响因素,优化PCR退火温度,采用正交试验方法,以3个引物组、Taq DNA聚合酶、dNTP和Mg2+六因素三水平优化多重PCR体系。【结果】建立并验证适合上述草莓主要病原菌的三重PCR最佳检测体系,可分别扩增出729、539和450 bp的特异条带, 最适退火温度为50℃,25 μL的反应体系中含有0.32 μmol?L-1 C729+/-、0.032 μmol?L-1 DB19/DB22、0.32 μmol?L-1 CgInt/ITS4、1.5 U Taq聚合酶、0.15 mmol?L-1 dNTP、1.6 mmol?L-1 MgCl2。【结论】利用上述引物组合和反应体系进行三重PCR检测,能够快速从田间发病植株和土壤中将草莓灰霉病菌、草莓炭疽病菌和草莓黄萎病菌检测出来,灵敏度可以达到10 pg菌丝DNA。<BR></FONT></P>
URL [本文引用: 1]
URL [本文引用: 1]
URL [本文引用: 1]
URL [本文引用: 1]
URL [本文引用: 2]
URL [本文引用: 2]
[本文引用: 2]
[本文引用: 2]
[本文引用: 2]
[本文引用: 2]
[本文引用: 2]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
[本文引用: 1]
URL [本文引用: 1]
URL [本文引用: 1]
URL [本文引用: 1]
URL [本文引用: 1]
DOI:10.7668/hbnxb.2014.02.013URLMagsci [本文引用: 1]

筛选到应用于多主棒孢实时荧光定量PCR检测的特异性引物CIR5/CIF5,并建立了土壤中多主棒孢的实时荧光定量PCR检测技术。引物CIR5/CIF5能够从多主棒孢基因组DNA中特异性扩增出一条259 bp的片段,常规PCR检测中灵敏度可达10 fg/μL。利用实时荧光定量PCR检测模拟带菌土壤中的带菌量,结果证明该技术对土壤中多主棒孢的检测下限为1个孢子/g土壤,可以快速、准确地定量土壤中病原菌的孢子数目,为栽培前土壤中病原菌的监测预报提供有效的技术手段。
DOI:10.7668/hbnxb.2014.02.013URLMagsci [本文引用: 1]

筛选到应用于多主棒孢实时荧光定量PCR检测的特异性引物CIR5/CIF5,并建立了土壤中多主棒孢的实时荧光定量PCR检测技术。引物CIR5/CIF5能够从多主棒孢基因组DNA中特异性扩增出一条259 bp的片段,常规PCR检测中灵敏度可达10 fg/μL。利用实时荧光定量PCR检测模拟带菌土壤中的带菌量,结果证明该技术对土壤中多主棒孢的检测下限为1个孢子/g土壤,可以快速、准确地定量土壤中病原菌的孢子数目,为栽培前土壤中病原菌的监测预报提供有效的技术手段。
URL [本文引用: 1]
URL [本文引用: 1]
DOI:10.3864/j.issn.0578-1752.2012.09.024URLMagsci [本文引用: 1]

【目的】建立快速可靠的用于食品中4种肉类(猪肉、牛肉、羊肉和鸡肉)成分快速鉴别的通用引物多重PCR(universal primers-multiplex PCR,UP-M-PCR)方法。【方法】使用DNeasy试剂盒提取法、SDS-蛋白酶K法和CTAB-蛋白酶K法分别提取肉类中总DNA,通过比较提取效率和纯度,确定提取肉类中总DNA的方法;基于动物线粒体细胞色素b基因的差异性位点,设计两组各5条长度不同的多重PCR引物,建立并优化多重PCR反应体系,通过电泳检测扩增产物分子量差异实现4种肉类的快速鉴别;应用优化的多重PCR方法对80份市售食品样本进行盲样检测,验证鉴别方法的准确性。【结果】SDS-蛋白酶K法与DNeasy试剂盒提取法的DNA效率显著优于CTAB-蛋白酶K法;在优化的反应条件下,选择特异性高、序列较长的多重PCR引物可有效地进行食品中猪、牛、羊和鸡源性成分的快速鉴定,检测灵敏度达到皮克级DNA;对市售食品样本的鉴别验证了方法的实用价值。【结论】多重PCR方法精确稳定,可用于食品中多种动物源性成分的快速鉴别。
DOI:10.3864/j.issn.0578-1752.2012.09.024URLMagsci [本文引用: 1]

【目的】建立快速可靠的用于食品中4种肉类(猪肉、牛肉、羊肉和鸡肉)成分快速鉴别的通用引物多重PCR(universal primers-multiplex PCR,UP-M-PCR)方法。【方法】使用DNeasy试剂盒提取法、SDS-蛋白酶K法和CTAB-蛋白酶K法分别提取肉类中总DNA,通过比较提取效率和纯度,确定提取肉类中总DNA的方法;基于动物线粒体细胞色素b基因的差异性位点,设计两组各5条长度不同的多重PCR引物,建立并优化多重PCR反应体系,通过电泳检测扩增产物分子量差异实现4种肉类的快速鉴别;应用优化的多重PCR方法对80份市售食品样本进行盲样检测,验证鉴别方法的准确性。【结果】SDS-蛋白酶K法与DNeasy试剂盒提取法的DNA效率显著优于CTAB-蛋白酶K法;在优化的反应条件下,选择特异性高、序列较长的多重PCR引物可有效地进行食品中猪、牛、羊和鸡源性成分的快速鉴定,检测灵敏度达到皮克级DNA;对市售食品样本的鉴别验证了方法的实用价值。【结论】多重PCR方法精确稳定,可用于食品中多种动物源性成分的快速鉴别。
DOI:10.1007/s11274-009-0106-3URL [本文引用: 1]
URL [本文引用: 1]
URL [本文引用: 1]
URL [本文引用: 1]
URL [本文引用: 1]
