 , 邢永秀
, 邢永秀 , 莫遥
, 莫遥
*通讯作者(Corresponding authors): 邢永秀, E-mail:document126@126.com; 李杨瑞, E-mail:liyr@gxaas.net 第一作者联系方式: E-mail:weichunyan025@126.com
收稿日期:2014-03-04 基金资助:
摘要
关键词:固氮菌(
Colonization of Nitrogen Fixing Bacterial Strain
WEI Chun-Yan
 , XING Yong-Xiu
, XING Yong-Xiu , MO Yao
, MO Yao
Fund:
Abstract
Keyword:Nitrogen fixing bacteria (
Show Figures
Show Figures







0 引言氮素是甘蔗最需要的营养元素, 它的有效利用对甘蔗高产量的获得具有重要意义。国内外的研究发现, 甘蔗内生固氮菌的开发利用能够为甘蔗生产减少氮肥投入做出贡献。研究不同固氮菌接种浓度在不同甘蔗品种体内的定殖规律, 可以揭示固氮菌在甘蔗体内的固氮和促生潜能, 为在甘蔗生产上应用固氮菌提供理论依据。早在20世纪60年代, Döbereiner[ 1]首次从甘蔗根部发现固氮菌后, 固氮菌的分离以及甘蔗生物固氮的研究便日新月异。研究人员已经从甘蔗中分离到许多不同属的固氮菌, 例如葡糖醋酸杆菌( Gluconacetobact er diazotrophicus)、成团泛菌( Pantoeaspp.)、草螺菌( Herbaspirillumspp.)、克雷伯氏菌( Klebsiellaspp.)、巴西固氮螺菌( Azospirllum brasilense)、假单胞菌( Pseudomonasspp.)等[ 2, 3, 4, 5, 6]。目前研究较多的是葡糖醋酸杆菌、草螺菌和巴西固氮螺菌。葡糖醋酸杆菌最初是从甘蔗[ 7]中分离到的, 后来发现除了能在甘蔗植株内定殖外, 也能在水稻[ 8]、高粱和小麦[ 9]、玉米[ 10]中定殖。草螺菌能在多种作物植株内定殖, 包括甘蔗、玉米、高粱以及其他禾本科植物[ 11, 12]。固氮菌能否侵入植物并在植株内生存和定殖是植物与固氮菌互作并发挥固氮作用的先决条件。研究表明, 固氮菌主要通过甘蔗的根尖、次生根发生处的裂隙和根表皮的伤口以及受伤的气孔侵入甘蔗[ 12, 13, 14], 并能够在甘蔗根内的细胞间隙和木质部以及叶片的叶肉细胞间隙中定殖[ 13, 14, 15, 16, 17, 18]。
绿色荧光蛋白(GFP)是从水母( Aquoria victoria)中克隆到的一种具有性能稳定、检测方便、灵敏度高的生物标记, 能够应用于观察细菌侵入植物的过程以及细菌在植物组织中的具体定殖部位[ 19]。GFP标记与其他生物标记(如GUS等)的区别在于GFP标记能在未经过任何导致组织死亡的化学染色的活细胞中直接观察到[ 20]。克雷伯氏菌DX120E是从广西本地主栽甘蔗品种新台糖22 (ROC22)的根内分离到的一株具有高固氮酶活性的固氮菌, 它还具有分泌生长素和铁载体以及溶解无机磷的特性[ 21], 在甘蔗生物固氮方面具有较好的应用潜力。本试验以DX120E不同的菌液浓度接种2个固氮能力不同的甘蔗品种(B8和GT21)的组培苗, 研究该菌的定殖能力以及同一接种浓度在不同时间和不同组培苗部位的菌群动态变化, 同时比较不同菌液浓度在两种甘蔗品种组培苗中的定殖数量, 以期为进一步研究该固氮菌株与甘蔗的互作提供参考依据。
1 材料与方法1.1 供试菌株菌株克雷伯氏菌DX120E ( Klebsiellasp.), 携有绿色荧光蛋白基因和四环素抗性基因标记, 由本实验室分离并保存。四环素使用浓度为15 μg mL-1。
1.2 甘蔗幼苗培养选用广西主栽甘蔗品种之一的桂糖21 (GT21)和巴西引进甘蔗品种B8 (由广西大学农学院甘蔗实验基地提供)组培苗。在无菌操作的条件下切取2个甘蔗品种茎尖以上约2~4 cm处的顶端分生组织接到含3.0 mg L-12,4-D的固体MS培养基上诱导愈伤组织, 在完全黑暗的条件下培养40 d后再把愈伤组织接到添加2.0 mg L-16-BA和0.2 mg L-1NAA的固体MS培养基上进行苗分化培养。在添加 3.0 mg L-1NAA和2.0 mg L-1IBA的固体MS培养基上诱导分化苗生根, 生根后转入添加有1.0 mg L-1NAA和1.0 mg L-1IBA的液体MS培养基中进行壮苗培养, 从苗分化阶段开始, 以上各阶段的传代培养周期均为30 d。培养条件为白天28℃ 16 h, 夜间25℃ 8 h, 光照强度为36 μmol m-2 s-1。对培养基进行高压灭菌(121℃, 20 min)前将其pH值调到5.8。
1.3 菌悬液的制备及接菌处理将携带绿色荧光蛋白基因的细菌菌株DX120E从-80℃超低温冰箱中取出, 用LB液体培养基(10 g L-1蛋白胨、5 g L-1酵母提取物、5 g L-1NaCl, 高压灭菌前将pH值调到7.0), 37℃、200转 min-1过夜培养至培养基浑浊, 取10 μL菌悬液到50 mL加有抗生素的LB液体培养基中, 37℃、200转 min-1过夜培养至在600 nm下的吸光度为1.0左右, 离心(4000× g, 10 min, 4℃), 收集菌体, 用无菌的pH值为7.4的磷酸缓冲液(PBS)悬浮至1×109CFU mL-1, 再用磷酸缓冲液稀释到1×108、1×106、1×104和1×102CFU mL-1等接种浓度。
选取长势基本一致的已生根的甘蔗组培单苗转到装有50 mL的1/10 MS液体培养液的500 mL培养瓶中, 培养基不含维生素也未添加任何激素。每个品种分5组处理(每个处理10瓶, 每瓶4株苗), 各组的接种剂量均为每瓶1 mL, 分别为A (接种1×108CFU mL-1菌悬液)、B (接种1×106CFU mL-1菌悬液)、C (接种104CFU mL-1菌悬液)、D (接种1×102CFU mL-1菌悬液)和CK (接同样剂量的无菌水)。
1.4 标记菌株在甘蔗组培苗内的定殖动态测定取甘蔗组培苗分为根、叶鞘和叶片等部分, 用无菌滤纸轻轻吸干水分后分别称取质量。先将各部分浸泡在75%酒精中1 min, 再用1%的次氯酸钠表面消毒2 min, 无菌水漂洗4次, 每次1 min。用无菌滤纸吸干水分后, 放到经过高压灭菌的研钵中研磨成匀浆并加9 mL灭菌的磷酸缓冲液(pH 7.4)混匀并转移到无菌的试管中, 用无菌水进行10倍系列稀释(盛有样品的悬液为原液, 其稀释度为0次方), 分离根、叶鞘和叶片内的标记菌株。分离用的培养基为含15 μg mL-1四环素的固体LB培养基。分别取每种稀释浓度的悬液100 μL加到有抗生素的LB平板中, 均匀涂布后用封口膜封好, 放到37℃的培养箱中倒置培养24 h后计数。每浓度均3个重复, 选取菌落数在30~300个范围内的平板统计每皿菌落数, 计算平均每克根、叶鞘和叶片(鲜重)内标记菌株的数量, 同时把最后一次漂洗的无菌水以及对照不接菌的根、叶鞘和叶的匀浆涂到同样的抗性平板上检查是否有菌落出现。
1.5 甘蔗植株内细菌定殖的荧光显微检测分别在接种后1、2和15 d取甘蔗组培苗的根和叶片(每1株苗为一个重复, 3次重复), 用无菌水洗去根表面上附着的标记菌株DX120E的细菌。按照上述方法表面灭菌后, 将叶片的徒手横切片或整体根放在无菌水中, 小心铺展于载玻片上, 盖上盖玻片, 置荧光显微镜下由低倍到高倍观察并照相。荧光显微镜是德国生产的莱卡DM4000B, 相机型号为DFC425C, 观察绿色荧光的滤片是I3 (激发Ex波段是450~490 nm, 分色镜DM是505 nm, 发射Em波段是LP 510 nm)。
1.6 数据分析用Microsoft Excel和SPSS15.0分析数据。
2 结果与分析2.1 不同接菌水平下液体培养基中标记菌株DX120E的群体密度从图1可以看出, 当接种浓度为1×102CFU mL-1时, 2个甘蔗品种培养基中的菌落数都表现为接种后10 d比接种后5 d高; 而在高于1×102CFU mL-1的接种浓度时(1×104、1×106和1×108CFU mL-1), 均表现出接种后10 d低于接菌5 d后的细菌量或基本维持不变。对于甘蔗品种B8, 接种不同浓度的固氮菌后, 培养基中的菌落数差异在2次测定时间内各处理间都达到显著水平, 且接菌浓度为1×106CFU mL-1时培养基中的标记菌量始终显著高于其他的接菌浓度, 而GT21在各处理接种后5 d, 1×106和1×108CFU mL-1处理间差异不显著, 说明1×104、1×106和1×108CFU mL-1这3个接菌浓度与GT21品种共培养时, 培养基中的标记菌量水平相当。固氮菌DX120E能利用培养基中的少量营养以及组培苗的根系分泌物生存和繁殖。2个甘蔗品种在接种浓度为1×104CFU mL-1以上时均表现接种后10 d的细菌数量低于接种后5 d, 而接种浓度为1×102 CFU mL-1时, 在接种10 d后培养基中的细菌量仍表现出增长的趋势。总体上看, 固氮菌DX120E在GT21组培苗培养基中的总活菌量的下降速度比在B8的培养基中慢。
图1
Fig. 1
| Figure OptionViewDownloadNew Window | |
 | 图1 不同接菌水平下液体培养基中的细菌D×120E数量动态变化A: 甘蔗品种B8; B: 甘蔗品种GT21。图中数据为对数转换数据, 误差线示标准误。同一处理时间内, 标有不同字母的处理间在0.05水平差异显著。Fig. 1 Population dynamics of strain DX120E bacteria in liquid medium under different inoculation levelsA: sugarcane variety B8; B: sugarcane variety GT21. Data present in the figures are the logarithmic transformation. Error bars in the figures indicate the standard errors. Bars superscriptedby different letters are significantly different among the treatments at 0.05 probability level at the same day. |
2.2 不同接菌水平下甘蔗组培苗不同时间不同部位标记菌株的数量由图2可知, 用不同浓度梯度的菌液(从1×102到1×108CFU mL-1菌悬液)接种2个品种的甘蔗组培苗, DX120E菌株均能进入植株根部并在根部生存和定殖, 同时能向植株地上部分迁移并积累定殖。4个接菌浓度接种B8和GT21两品种组培苗均表现出根内的细菌定殖量要比地上部分(叶鞘和叶)内部定殖的菌群数高出1~2个数量级, 表明在本试验的条件下标记菌株DX120E细菌更适合在甘蔗植株的根内生存和定殖。对于品种B8, 4个菌液浓度(1×102、1×104、1×106和1×108CFU mL-1)接种组培苗后, 根和地上部分均在接种后7 d或15 d达到最高定殖水平, 其中在根中能达到1×106 CFU g-1 FW, 地上部分能达到1×105CFU g-1 FW, 而品种GT21的根和地上部分的标记菌株最高定殖量部分接种浓度需要在接种后30 d才能达到, 说明固氮能力较强的甘蔗品种B8对标记菌株做出响应的时间比品种GT21快些。总体上, 从标记菌株在植株体内的定殖量来看, 不同接菌浓度的差异并不明显, 低浓度和高浓度接种2个甘蔗品种组培苗后, 根和地上部分最终能达到的最高定殖量均为同一数量级, 只是表现在不同的接种后天数。
2.3 标记菌株DX120E在甘蔗品种B8和GT21组培苗体内各组织的群体动态在限菌(接菌浓度为1×108CFU mL-1)条件下, 在接菌后不同时间(0~35 d)通过平板计数分离法检测组培苗不同部位培养标记菌株的群体密度。图3表明, 固氮菌DX120E在2个甘蔗品种中的群体动态图呈相似的的趋势, 即植株的根、叶鞘和叶内标记菌株DX120E的群体密度在初始(2 d)时短暂迅速上升后维持不变或缓慢下降, 叶中固氮菌数量均在接种后2 d达到一个高峰, 或者在接种后10 d达到最低点, 而后又开始逐渐上升直到试验结束。标记菌株DX120E在2个甘蔗品种植株体内各部分的菌群密度均表现为根>叶鞘>叶, 说明内生固氮菌在甘蔗中的定殖是一个动态分布的过程, 由根部入侵后从植物体内上升迁移到叶鞘和叶, 并能在各组织中定殖且维持一定的群体密度。B8根、叶鞘和叶中的固氮菌群体密度与GT21品种相似, 说明标记菌株在不同的甘蔗品种中具有相同的内生和迁移定殖能力, 对不同的甘蔗基因型不具有特异性。
图2
Fig. 2
| Figure OptionViewDownloadNew Window | |
 | 图2 不同接菌水平下甘蔗各组织中的DX120E细菌数量动态变化A: 甘蔗品种B8根; B: 甘蔗品种B8地上部分; C: 甘蔗品种GT21根; D: 甘蔗品种GT21地上部分。图中数据为对数转换数据, 误差线示标准误。同一处理时间内, 标有不同字母的处理间在0.05水平差异显著。Fig. 2 Population dynamics of strain DX120E bacteria in sugarcane tissues under ifferent inoculation levelsA: roots of sugarcane variety B8; B: aerial part of sugarcane variety B8; C: roots of sugarcane variety GT21; D: aerial part of sugarcane variety GT21. Data present in the figures are the logarithmic transformation. Error bars in the figures indicate the standard errors. Bars superscripted by different letters are significantly different among the treatments at 0.05 probability level at the same day. |
图3
Fig. 3
| Figure OptionViewDownloadNew Window | |
 | 图3 菌株DX120E细菌在甘蔗组培苗不同部位的数量动态变化A: 甘蔗品种B8最初接种浓度为1×108CFU mL-1; B: 甘蔗品种GT21最初接种浓度为1×108 CFU mL-1。图中数据为对数转换数据, 误差线示标准误。同一处理时间内, 标有不同字母的处理间在0.05水平差异显著。Fig. 3 Population dynamics of bacteria strain DX120E in difference parts of sugarcane seedlingsA: sugarcane variety B8, the inoculation level is 1×108CFU mL-1; B: sugarcane variety GT21, the inoculation level is 1×108 CFU mL-1. Data present in the figures are the logarithmic transformation. Error bars in the figures indicate the standard errors. Bars superscripted by different letters are significantly different among the treatments at 0.05 probability level at the same day. |
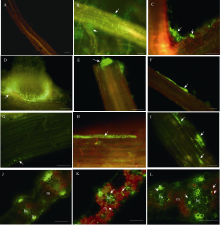
2.4 标记菌株DX120E在甘蔗组培苗根和叶中的定殖携带GFP标记的菌株DX120E, 在固体培养基上培养时, 以荧光显微镜可直接观察到绿色荧光。荧光显微镜观察表明, 在接种1×108CFU mL-1菌液后1 d, 标记菌株在根毛附近大量聚集(图4-B), 接菌后2 d在主根边缘以及主根与次生根连接处大量聚集并从细胞裂隙侵入根内(图4-C, 4-D, 4-F), 同时也可从侧根断裂处伤口聚集并侵入根内(图4-E)。接菌
后15 d, 标记菌株在根表皮细胞的细胞间隙中定殖(图4-I),同时也在根边缘细胞和根表皮细胞内定殖并充满整个细胞(图4-G, 4-H)。接菌后15 d, 观察叶片横切面发现标记菌株能在叶片的维管束鞘细胞以及叶肉细胞内定殖(图4-K, 4-L)。在对照的根和叶片横切面中, 均未观察到标记菌株(图4-A, 4-J)。本试验条件下, 固氮菌DX120E在2个甘蔗品种组培苗的根和叶内具有相似的定殖模式。
图4
Fig. 4
| Figure OptionViewDownloadNew Window | |
 | 图4 以荧光显微镜观察克雷伯氏菌DX120E在甘蔗根和叶中的定殖A: 对照未接菌根毛区; B: 标记菌株在根毛附近(箭头)大量聚集(接种后1 d); C, D: 标记菌株在主根和侧根连接处聚集(箭头)并由边缘裂隙处(箭头)侵入根内(接种后2 d); E: 标记菌株在侧根断裂处(箭头)聚集并由伤口进入根内(接种后2 d); F: 标记菌株在主根的边缘处(箭头)大量聚集(接种后2 d); G: 标记菌株在根表面边缘细胞内(箭头)定殖(接种后15 d); H: 标记菌株从根边缘细胞的裂隙侵入根细胞内(箭头)并充满整个细胞(接种15 d后); I: 标记菌株在主根的细胞间隙中(箭头)聚集和定殖(接种后15 d); J: 对照叶片横切面; K, L: 标记菌株在叶片中的维管束细胞(箭头)和叶肉细胞中(箭头)的定殖(接菌后15 d)。叶片横切面图中bs表示维管束鞘, s表示厚角组织, m表示叶肉组织。比例尺示30 μm。接种浓度为1×108CFU mL-1。Fig. 4 Fluorescent micrographs showing colonization of Klebsiellasp .DX120E in sugarcane roots and leavesA: root hair zone without inoculation; B: labeled bacteria DX120E accumulated near to the root hairs (arrows) in root hair zone (one day after inoculation); C, D: labeled bacteria DX120E accumulated in the conjunction between tap lateral roots (arrows, two days after inoculation); E: labeled bacteria DX120E accumulated in the wounded spot (arrows) and entered roots (two days after inoculation); F: labeled bacteria DX120E accumulated next to the edge of main roots (two days after inoculation); G: labeled bacteria DX120E propagated substantially inside the edge cell of root surface (arrows, 15 days after inoculation); H: labeled bacteria DX120E invaded into cell from the cracks (arrows) and filled up the cell in root (15 days after inoculation); I: labeled bacteria DX120E accumulated and propagated in cell intervals (arrows, 15 days after inoculation). J: transverse section of control leaf; K, L: labeled. bacteria DX120E propagated inside the vascular bundle sheath and mesophyll cells (arrows, 15 days after inoculation). In the transverse section of leaf, bs indicates vascular buddle sheath, m indicates mesophyll, s indicates schlerenchyma. The scale is 30 μm, and the inoculation concentration was 1×108CFU mL-1. |
3 讨论固氮菌作为理想的植物促生菌不仅要求有高的固氮活性, 而且要求生活能力强, 能在寄主植株根和叶中成功定殖。本研究表明, 克雷伯氏菌的菌株DX120E可进入
2个甘蔗品种GT21和B8的根、叶鞘和叶中, 且具有较强的持久定殖能力。DX120E能够从甘蔗根表面的裂隙、主根和侧根发生处及根的断裂处伤口进入根内并在根内细胞间隙和细胞内大量定殖, 也能够经由植株根系向叶鞘和叶部迁移, 在叶鞘中和叶片的叶肉细胞和维管束细胞中定殖。本研究结果与前人报道的其他固氮菌的定殖模式相似[ 22, 23, 24, 25]。国内外已有关于固氮菌在植物根和茎的木质部中定殖的报道[ 26, 27, 28], 并且被认为这是内生菌从根往地上部移动的可靠路径。根据Elbeltagy等[ 29]研究, 内生菌由根向茎中迁移可能是由于根表面细胞间隙形成的“侵染线”一直沿着侧根和不定根延伸造成的。Zakria等[ 30]认为内生菌的运动性在细菌入侵植物以及细菌在植物内部的迁移中起重要作用, 因此内生菌能通过生长介质直接进入植物茎基部并随后往植物的其他组织中迁移。关于固氮菌DX120E是通过什么方式从根部往其他组织中迁移还有待进一步探讨。
关于植物内生固氮菌的分离以及定殖动态变化研究, 特别是醋酸杆菌、草螺菌和固氮螺菌在水稻[ 30]、甘蔗[ 31]、高粱[ 9]、玉米[ 32]等作物中的研究较多。大多研究所使用的接菌浓度为1×102CFU mL-1与1×108CFU mL-1, 并且认为1×108CFU mL-1是比较适合的内生菌侵染浓度。目前关于系统研究不同浓度固氮菌接种宿主植物的比较研究少有报道。本实验表明不同的接菌浓度下克雷伯氏菌DX120E细菌均能从经过表面消毒的根、叶鞘和叶的匀浆中分离到, 说明DX120E能在甘蔗组培苗的各个组织器官中定殖, 但根与地上部存在一定的菌群数量差异。Luna等[ 9]报道用醋酸杆菌接种小麦和高粱的种子后能在其根、茎和叶中重新分离到一定细菌数量, 并且接菌浓度对定殖数量没有太大影响, 即少量的固氮菌便能进入植株体内并在体内定殖。Reis等[ 33]认为内生菌接种甘蔗组培苗后需要短期繁殖后才能在植物体内定殖。Zakria等[ 30]用2个浓度的草螺菌接种水稻苗后也发现在接种后30 d, 菌株在根内定殖的细菌量才达到最大值, 茎内则是接菌后45 d细菌的定殖量达到最大, 在叶中则一直检测不到菌株, 并指出高浓度的菌液有利于草螺菌在水稻中定殖。本研究发现两个甘蔗品种在接菌后2 d, 其根、叶鞘和叶内定殖的细菌量均达到高峰, 表明克雷伯氏菌DX120E的细菌能在短期内迅速进入植株根内并往根以上组织迁移和定殖, 这可能是不同菌株定殖能力不同或接种技术不同造成的。Njoloma等[ 31]用草螺菌接种2个甘蔗品种的组培苗, 发现相同的接种浓度在不同甘蔗品种的组织中定殖的细菌量有较大的区别, 且高的接种浓度比低的接种浓度有更强的定殖能力。在本实验条件下, 少量细菌接种到在含微量营养元素的1/10 MS液体培养基中培养的组培苗后, 细菌能利用培养基中的少量营养元素及植物根系分泌物繁殖, 且进入到植物组织器官后能利用组织器官中的营养物质继续积累繁殖, 因此, 在本实验条件下, 较低的接菌浓度(1×102CFU mL-1)便可有足够数量的固氮菌进入植物体内并稳定繁殖。
内生固氮菌接种甘蔗不仅能提高甘蔗的生物固氮能力, 同时也能通过分泌植物激素、溶解无机磷和提高甘蔗吸收营养元素的能力来促进甘蔗生长和提高产量[ 13, 34]。本研究中所用的固氮菌DX120E不仅具有高固氮酶活性, 且具有分泌生长素和溶解无机磷的特性, 因此研究接种甘蔗后其固氮基因在甘蔗体内的表达情况以及接种后甘蔗的生物固氮能力是开发其应用潜力所必需的。已有研究表明克雷伯氏菌能提高甘蔗[ 35]和小麦[ 36]的固氮能力。在本研究中, 从甘蔗品种ROC22根系分离得到的克雷伯氏菌DX120E能在健康的其他甘蔗品种体内定殖并未表现出任何的病症, 而且本研究的甘蔗品种是制糖用的原料蔗, 制糖过程中的高温将把所有微生物杀灭。不过, 部分克雷伯氏菌株对动物和人具有致病作用, 因此, 在我们后续的研究中将进一步鉴定固氮菌DX120E对动物和人是否具有致病作用。本研究的接种方法能在很大程度上降低菌液的使用量, 且操作方法方便可行, 尤其是将固氮菌引入甘蔗组培苗, 提供具有固氮作用的健康种苗方面具有更广阔的应用前景。关于此接种方法对甘蔗组培苗后期移栽的生长生理影响仍需要进一步研究。同时本试验是在严格控制试验条件且无菌的条件下进行的, 在田间使用固氮菌接种甘蔗的定殖模式还有待研究。本研究结果可为研究固氮菌与寄主的互作提供参考依据, 同时为应用有益固氮菌作为生物菌肥的研究提供理论依据。
The authors have declared that no competing interests exist.
作者已声明无竞争性利益关系。The authors have declared that no competing interests exist.
参考文献View Option
原文顺序
文献年度倒序
文中引用次数倒序
被引期刊影响因子
| [1] | |
| [2] | |
| [3] | |
| [4] | |
| [5] | |
| [6] | |
| [7] | |
| [8] | |
| [9] | |
| [10] | |
| [11] | |
| [12] | |
| [13] | |
| [14] | |
| [15] | |
| [16] | |
| [17] | |
| [18] | |
| [19] | |
| [20] | |
| [21] | |
| [22] | |
| [23] | |
| [24] | |
| [25] | |
| [26] | |
| [27] | |
| [28] | |
| [29] | |
| [30] | |
| [31] | |
| [32] | |
| [33] | |
| [34] | |
| [35] | |
| [36] |
