

天津大学化工学院, 天津 300072
2016年09月29日 收稿; 2016年11月28日 收修改稿
基金项目: 国家973项目(2013CB733600)、国家自然科学基金(21376171)、国家自然科学基金重点项目(21236005)资助
通信作者: 闻建平, E-mail:jpwen@tju.edu.cn
摘要: 以4-羟基环孢素转化菌Nonomuraea dietziae为出发菌,采用紫外-氯化锂复合诱变的方法,筛选得到一株产量达208 mg/L的稳定遗传菌J263,较出发菌164 mg/L的产量提高26.8%。在此基础上,采取单因素法和响应面法针对诱变菌的发酵培养基碳氮源进行系统优化,并对金属离子的添加进行考察。最终获得最佳的培养基配方(甘油26.5 g/L,糊精11.6 g/L,蛋白胨9.7 g/L,酵母浸粉3.5 g/L,大豆饼粉15.0 g/L,大豆油2.0 g/L,硫酸镁0.40 g/L,硫酸锰0.010 g/L,钼酸铵0.010 g/L)。在最优化条件下,4-羟基环孢素产量可达324 mg/L,较出发菌提高97.6%。
关键词: Nonomuraea dietziae4-羟基环孢素紫外-氯化锂诱变响应面优化
Mutagenesis, screening, and medium optimization of high[(4'-OH)MeLeu]4-CsA producing strain-Nonomuraea dietziae
JIN Lina, WEN Jianping


School of Chemical Engineering and Technology, Tianjin University, Tianjin 300072, China
Abstract: An ultraviolet-lithium chloride mutagenesis strategy was carried out on the[(4'-OH)MeLeu]4-CsA producing strain, Nonomuraea dietziae.The production of mutant strain reached 208mg/L and increased by 26.8%. Then the fermentation medium was optimized by single-factor and response surface methods. The optimal medium was determined as follows (materials/concentrations in g/L):glycerol/26.5, dextrin/11.6, peptone/9.7, yeast extract powder/3.5, soybean meal/15.0, soybean oil/2.0, MgSO4·7H2O/0.40, MnSO4·H2O/0.010, and (NH4)2MoO4/0.010. The final production reached 324mg/L and increased by 97.6% compared with the initial value.
Key words: Nonomuraea dietziae[(4'-OH)MeLeu]4-CsAultraviolet lithium chloride mutagenesisresponse surface optimization
环孢素(CsA)是一种天然的十一氨基酸多肽,具有免疫抑制剂以及抗真菌活性,是Sandimmune?和Neoral?的主要有效成分,用于治疗肝、肾以及心脏移植的抗排异反应,以及类风湿性关节炎和肾病综合征[1-2]。此外,CsA还可显著地抑制1-型艾滋病毒(HIV-1) 和丙型肝炎病毒(HCV)的复制。但是,开发基于环孢素的抗HIV/HCV药物首先必须降低或去除环孢素的免疫抑制活性,以避免环孢素在清除病毒时拮抗宿主的免疫机制[3]。而这一问题可以通过修饰环孢素[MeLeu]4残基解决。据报道,环孢素4位置羟基化产物,即4-羟基环孢素([(4'-OH)MeLeu]4-CsA),具有较高的抗HCV/HIV活性,尤其抗HIV活性是环孢素的6倍,而其免疫抑制活性则仅保留原先的1/83,显著降低了免疫抑制活性,从而实现了功能上的分离,提高了抗HIV的特异性[4]。此外,4-羟基环孢素也可以作为开发其他相似功能类似物的起点,例如,在4-羟基环孢素中的[Sar]3位置继续引入一个烷基基团,可以使抗HIV活性达到环孢素的近5倍,而其免疫抑制活性仅为原先的1/156[5]。同时,4-羟基环孢素具有促毛发生长的作用[6-7],可作为一种具有潜在价值的治疗秃头症药物,受到相关研究机构以及化妆品生产商的广泛关注[8-9]。
环孢素的4-位置羟基化过程是由生物体内的细胞色素P450羟化酶(CYPs)催化执行的,细菌细胞CYPs属于含有亚铁离子的单加氧酶,具有区域及立体专一性,催化氧分子中的一个氧原子被转移到底物分子中,另一个氧原子则被还原成水[10]。Sebekia benihana(又名Nonomuraea dietziae)是最具潜力的4-羟基环孢素生产菌,其初始转化率可达到30%左右[11],因而成为研究4-羟基环孢素转化形成的最优选择。为了提高环孢素的转化效率,Lee等[12]通过过表达CYP-21基因使CsA转化效率提高2倍(达到29%)。Park等[13]通过在最优培养基中添加钼离子使CsA转化率从10%提高到54%(CsA添加量为50 mg/L)。在国内,华北制药集团于2014年以Nonomuraea dietziae为出发菌株,采用常温常压等离子体射流和紫外照射对其进行复合物理诱变获得具有稳定遗传性能的菌株,其转化效率比出发菌株提高32%左右,产量达到260 mg/L[14],证实诱变手段可以有效提高4-羟基环孢素得率。同年,该团队又通过发酵条件优化使4-羟基环孢素产量在添加400 mg/L时提高63%左右,产量达到284.3 mg/L[15]。但由于Nonomuraea dietziae发现时间短,代谢机制研究不足。野生型菌株的转化能力较低,极大地限制了该菌的科学研究和应用开发。
本文以实验室保藏的Nonomuraea dietziae作为出发菌,通过紫外-氯化锂复合诱变筛选高效且遗传性状稳定的菌株,并优化其发酵培养基,为进一步提高[(4'-OH)MeLeu]4-CsA产量,适应工业化大规模生产奠定基础。
1 材料和方法1.1 菌株本实验室保藏Nonomuraea dietziae NRLL 11111[16]孢子冻干管。该菌株属革兰氏阳性菌,严格好氧,是从土壤中分离得到的具有耐热性的稀有放线菌[17]。其具有两种孢子形成的结构:交错嵴状的直链孢子结构和可释放出具有光滑或者粗糙表面孢子的孢囊结构,不产生黑色素,属于产红色素菌体[18]。
1.2 培养基1) 固体培养基(g/L):酵母粉4.0,麦芽粉10.0,葡萄糖4.0,琼脂20.0,pH 7.2~7.4,蒸馏水配制。诱变所用固体培养基中氯化锂浓度为2.0 g/L(参考)。2) 种子培养基(g/L):淀粉10.0,葡萄糖7.0,麦芽粉5.0,酵母浸粉5.0,蛋白胨5.0,碳酸钙1.0,pH 6.5~7.0。3) 发酵培养基(g/L):葡萄糖30.0,糊精12.0,酵母浸粉9.0,蛋白胨5.0,大豆粉饼15.0,碳酸钙1.0,初始pH 7.2。以上培养基中所用的麦芽粉、酵母浸粉、蛋白胨和大豆饼粉购自北京奥博星生物技术有限责任公司。文中所用的大豆油、花生油和玉米油购自山东鲁花集团有限公司。其余试剂均购于天津市光复精细化工有限公司。所用培养基灭菌条件为:121 ℃,25 min。
1.3 培养方法1) 固体斜面/平板培养:用接种针沾取少量保藏用斜面培养基中的孢子,划线于斜面/固体平板,接种后置于生化培养箱(SHP-250,上海精宏实验设备有限公司,上海)28 ℃条件下培养10~14 d,直到长出成熟的白色孢子。2) 液体种子培养:用5 mL灭菌的生理盐水冲洗斜面上的孢子,置于含若干玻璃珠的三角瓶中,28 ℃震荡30 min,并经8层纱布过滤,用血球计数板进行计数。之后用无菌生理盐水稀释到107个/mL,取2 mL接种到装液量为40 mL种子液的三角瓶(250 mL规格)中。在30 ℃全温振荡器(HZQ-QX,哈东联,哈尔滨)中培养72 h,摇床转速设定为240 rpm。3) 摇瓶发酵培养:取4 mL种子悬液转接到含有40 mL发酵培养基(250 mL摇瓶)中,在28 ℃的全温振荡器(HZQ-QX,哈东联,哈尔滨)220 rpm中培养120 h。在发酵24 h时加入1 mL浓度为24 g/L的环孢素乙醇溶液,将环孢素终浓度定为600 mg/L。
1.4 环孢素和4-羟基环孢素检测采用高效液相色谱(HPLC)法测定发酵液中的环孢素及4-羟基环孢素的含量。色谱型号为安捷伦1100(美国),色谱柱为Aglient Zorbox SB-C18(5 μm; 150 mm×4.6 mm; Agilent Technologies),柱温50 ℃。紫外检测波长210 nm。流动相组成为乙腈:10 mmol/L磷酸水溶液=75:25,流速为1.0 mL/min。
1.5 菌种的诱变采用紫外联合氯化锂复合诱变的方法[18-20],主要针对紫外诱变时间进行考察。实验主要过程简述如下:
单孢子悬液制备:取培养至10~14 d试管斜面(孢子成熟),加入5 mL无菌水进行冲洗,然后将孢子转移至装有玻璃珠的无菌三角瓶中,200 rpm震荡30 min,将孢子打散,8层无菌纱布过滤,滤液即为单孢子悬液,利用血球计数板计数,将单孢子悬液用无菌水稀释至108/mL。
紫外诱变:开紫外灯预热20 min左右。取2 mL单孢子悬液,稀释至106/mL,取100 μL稀释后的单孢子悬液涂布正常平板,作为对照。分别取2 mL未经稀释的单孢子悬液于带磁棒的、直径为90 mm平皿中,距15 W紫外灯20 cm处分别照射10、20、30、40、60、80、100、120 s之后放入冰浴中2 h(使细胞内参与突变体修复的各种酶类活性受到抑制,细胞修复难以进行,有利于提高突变率)。之后继续稀释至10-4倍,取100 μL在黑暗条件下(或红光条件下)涂氯化锂(12 g/L)固体平板,然后将平板置于28 ℃、黑暗条件下培养。对照平板也置于28 ℃、黑暗条件下培养7~10 d后,数单菌落,并计算致死率,制作致死曲线。一般认为对于野生型菌株而言,死亡率在90%~99.9%最好,根据致死曲线选择最佳处理时间。
致死率=诱变平板上菌落数/对照平板上菌落数×100%。
诱变菌株筛选:在优化的诱变时间下进行大批量诱变,随机挑选诱变出的单菌落。接种斜面固体培养基使其产生足量的孢子,通过摇瓶发酵,用HPLC测定4-羟基环孢素的产量。据此确定高产菌株。之后在固体斜面培养基上连续传代10次,并对每代菌株进行发酵测试,选取稳定高产的菌株用于后续培养基优化实验。
1.6 响应面法优化培养基以单因子优化的最佳培养基组分为中心点,运用Design Expert 8.0软件,针对培养基中的主要因素碳源和氮源使用中值组合重新编码,以4-羟基环孢素产量(mg/L)为响应值。考虑到实验的可操作性,设计了4因素3水平的响应面试验,其因素与水平参考Box-Behnken中心组合实验设计原理[21-22]。运用回归分析对拟合得到的方程和各因子进行方差分析,并对模型可靠性进行分析,预测得到优化结果,之后在预测的最优条件下进行4-羟基环孢素发酵产量验证。
2 结果与讨论2.1 紫外-氯化锂诱变氯化锂可以增加UV的突变效率,有效避免使用单一诱变剂出现的诱变饱和效应。高宏伟等[23]用紫外线-氯化锂复合诱变选育泰妙菌素高产菌株,使其产量提高32.4%。邱雁临等[24]用紫外-氯化锂复合诱变选育L-组氨酸产生菌,其产量提高程度(13.6%)比单独使用紫外(8.5%)、氯化锂(10.5%)都要高,证明紫外线与氯化锂复合诱变的效果优于它们的单因子诱变。基于此,本文首先以实验室保藏的Nonomuraea dietziae NRLL 11111作为出发菌,经活化传代后性状达到稳定。其在初始培养基中的[(4'-OH)MeLeu]4-CsA产量为164 mg/L(600 mg/L环孢素添加量),转化率仅为27.3%,为了进一步提高环孢素转化效率,本研究采取紫外-氯化锂联合诱变方案,对出发菌进行诱变处理。
2.1.1 紫外辐照时间对诱变致死率的影响由表 1可见,诱变10 s似乎不仅无法杀死孢子,反而可以促进孢子萌发。120 s左右基本可以杀死所有孢子,考虑到实际操作中要控制固体培养上菌落数量,因此将100 s的辐照时间作为最佳诱变时间,此时的诱变致死率为98.0%,固体培养基上的菌落数量维持在20~30个/平板之间。
Table 1
| 表 1 紫外辐照时间对诱变致死率的影响Table 1 Effect of ultraviolet ray mutagenesis time on lethality rate | |||||||||||||||||||||||||||||||||
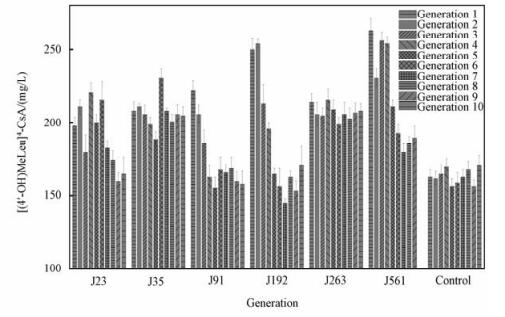
2.1.2 最佳诱变条件下的诱变结果及4-羟基环孢素发酵产量的稳定性采用100 s的辐照时间筛选得到6株初始产量较高的突变菌株,以[(4'-OH)MeLeu]4-CsA的发酵产量作为考核指标,考察遗传稳定性。由图 1可见,J35和J263的遗传稳定性更强,其最终产量稳定在(205±5) mg/L和(208±7) mg/L,两株菌4-羟基环孢素产量相差不显著。但从传代稳定性图谱来看,J263较J35而言,4-羟基环孢素产量波动更小(图 1),因而遗传稳定性更强。诱变菌较原始菌164 mg/L产量提高26.8%,表明紫外-氯化锂诱变方案具有非常高的可靠性。由于环孢素的4-位置特异性羟基化过程是由CYPs直接催化完成的,因而紫外线-氯化锂复合诱变可能直接导致催化环孢素转化的P450酶/酶系所对应的基因序列发生改变,经筛选而得到正向突变的4-羟基环孢素转化菌。
Fig. 1
 | Download: JPG larger image |
| 图 1 紫外-氯化锂诱变所得的高产菌的发酵稳定性 Fig. 1 Fermentation stability of the mutant strains by ultraviolet-lithium chloride mutagenesis 图 1 紫外-氯化锂诱变所得的高产菌的发酵稳定性 Fig. 1 Fermentation stability of the mutant strains by ultraviolet-lithium chloride mutagenesis --> | |
在此选J263作为后续培养基优化的菌株。
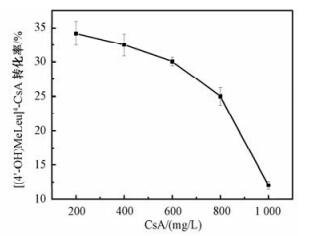
2.2 环孢素底物浓度最佳值优化鉴于4-羟基环孢素是由环孢素生物转化而来,环孢素底物的浓度会直接影响4-羟基环孢素的得率。其次,环孢素是溶解在乙醇溶液中进而进入发酵体系,而乙醇本身对菌体可能存在一定的影响,因而底物添加浓度过高可能会对菌体产生抑制作用,造成转化收益的降低。Park等[13]在4-羟基环孢素发酵体系中添加50 mg/L的环孢素底物,通过培养基优化使环孢素转化率达到54%。章丽等[25]加入500 mg/L的环孢素,其转化率仅为40%。为了考察环孢素添加量对本研究中菌株发酵效价的影响,我们在发酵体系中分别加入200、400、600、800和1 000 mg/L的环孢素底物。结果表明,前3个环孢素添加浓度对应的4-羟基环孢素得率均为30%~35%,变化幅度很小,当环孢素添加浓度高于600 mg/L,对应得率显著下降,达到1 000 mg/L时,基本完全抑制了环孢素的羟基化过程(图 2)。尽管4-羟基环孢素在环孢素添加量为200 mg/L时转化率最大(34.2%),但考虑到整个发酵过程持续时间长,效率最大化原则,故依旧选用600 mg/L的环孢素添加量进行接下来的研究。
Fig. 2
 | Download: JPG larger image |
| 图 2 环孢素的添加浓度对4-羟基环孢素转化率的影响 Fig. 2 Effect of the CsA concentration on conversion ratio of [(4'-OH)MeLeu]4-CsA 图 2 环孢素的添加浓度对4-羟基环孢素转化率的影响 Fig. 2 Effect of the CsA concentration on conversion ratio of [(4'-OH)MeLeu]4-CsA --> | |
2.3 诱变菌发酵培养基的碳源优化放线菌常用的碳源有3类,速效碳源(葡萄糖),迟效碳源(淀粉和糊精)和补充碳源(植物油,主要为大豆油、花生油和玉米油等)。这3类碳源作用都不同,且相互补充。据文献报道,Nonomuraea dietziae在以葡萄糖做碳源的条件下,主要经过Entner-Doudoroff(ED)途径进行代谢[26]。ED途径在革兰氏阴性菌中分布较广,是少数EMP途径不完整的细菌如林氏假单胞菌和运动发酵单胞菌等降解葡萄糖的主要途径[27]。在ED途径中,以葡萄糖为碳源时,1分子葡萄糖经过4步反应转化为2分子丙酮酸,但只能产生1分子ATP,1分子NADH和1分子NADPH,产能效率远小于EMP途径。而以甘油作为碳源时,1分子甘油在转化为1分子丙酮酸的过程中能产1分子ATP和3分子NAD(P)H,相较6个碳的葡萄糖产能效率更高。因此,甘油可以为菌体生长和环孢素的转化提供足量的ATP和NAD(P)H。
ED途径的总反应:
C6H12O6 (葡萄糖)+ADP + Pi + NADP+ + NAD+ → 2CH3COCOOH + ATP + NADPH + NADH + 2H+;
甘油途径:
C3H8O3 (甘油)+ ADP + Pi + 3NAD+ → CH3COCOOH + ATP + 3NADH + H+。
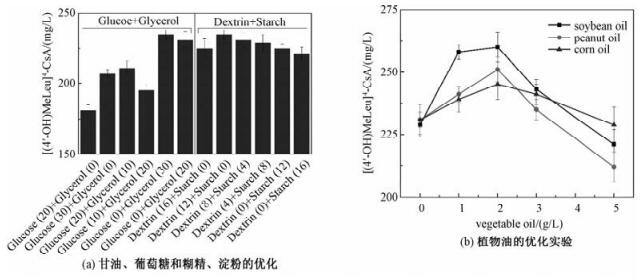
尽管Nonomuraea dietziae在以葡萄糖作为碳源条件下主要经过ED途径[26],但以甘油作为主要碳源发酵生产[(4'-OH)MeLeu]4-CsA的未有报道。葡萄糖的分解经过2-酮-3脱氧-6-磷酸葡萄糖酸(KDPG)醛缩酶催化,因而产能较糖酵解途径低。如上述分析,若以三碳(如甘油)作为碳源,不经过KDPG醛缩酶催化,则可能避免葡萄糖的低效利用,因此,本研究将甘油也列入碳源的候选序列。结果如图 3(a)所示,甘油和葡萄糖的单独和混合添加实验表明,Nonomuraea dietziae对于甘油的代谢能力强于葡萄糖,在30.0 g/L葡萄糖条件下,[(4'-OH)MeLeu]4-CsA的产量为207 mg/L,而在30.0 g/L甘油的条件下其产量可达235 mg/L,且高于甘油与葡萄糖混合的效果(图 3(a))。因此,在本研究中将30.0 g/L甘油作为唯一的速效碳源。
Fig. 3
 | Download: JPG larger image |
| 其中,(a)中的淀粉和糊精的优化实验在甘油和葡萄糖优化基础上进行,(b)中的植物油添加是在(a)的优化基础上进行。(a)中碳源后括号内的数字表示添加量,单位g/L。 图 3 发酵碳源的优化对4-羟基环孢素产量的影响 Fig. 3 Effects of carbon sources on [(4'-OH)MeLeu]4-CsA production 图 3 发酵碳源的优化对4-羟基环孢素产量的影响 Fig. 3 Effects of carbon sources on [(4'-OH)MeLeu]4-CsA production --> | |
在30.0 g/L甘油基础上,比较淀粉和糊精的添加量对[(4'-OH)MeLeu]4-CsA产量的影响。结果表明,无论是混合添加还是单独添加淀粉和糊精,[(4'-OH)MeLeu]4-CsA的产量都维持在221~235 mg/L之间,产量变化不大(图 3(a)),推测糊精和淀粉在本实验条件下可以相互替换。因而,在后续的实验中,仍然单独采用12 g/L糊精作为迟效碳源,在30.0 g/L甘油和12.0 g/L糊精作为碳源的条件下,[(4'-OH)MeLeu]4-CsA的产量达到235 mg/L。
由图 3(b)可见,植物油的添加对[(4'-OH)MeLeu]4-CsA的产量提升效果非常显著。本实验中,添加大豆油、花生油和玉米油均可以提高目标产物的量,尤其是添加2.0 g/L大豆油,[(4'-OH)MeLeu]4-CsA的产量从对照的235 mg/L升至260 mg/L,提高10.5%。植物油,尤其是大豆油,在许多抗生素发酵过程中都被作为碳源添加,如红霉素、他克莫司、子囊霉素和雷帕霉素[28-31]。大豆油中的脂肪酸降解可以直接转变为酰基辅酶A等抗生素合成所需的前体物,且不受葡萄糖代谢所产生的分解代谢抑制效应。由于[(4'-OH)MeLeu]4-CsA生产过程并不涉及前体代谢[8]。因此推测菌体将大豆油分解为酰基辅酶A后直接作为生物量合成的中间代谢物。
据此,优化所得的碳源组分为甘油30.0 g/L,糊精12.0 g/L,大豆油2.0 g/L。
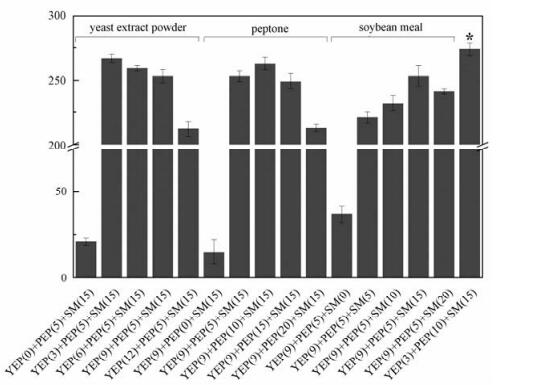
2.4 诱变菌发酵培养基的氮源优化在碳源优化的基础上,针对原始培养基中的氮源,即酵母浸粉、蛋白胨和大豆饼粉进行单因素优化,比较3个实验组YEP(0)+PEP(5)+SM(15)、YEP(9)+PEP(0)+SM(15) 和YEP(9)+PEP(5)+SM(0)(图 4),发现去掉任何一个氮源组分,[(4'-OH)MeLeu]4-CsA的产量都会受到严重影响,导致发酵失败。酵母浸粉和蛋白胨的添加量变化对[(4'-OH)MeLeu]4-CsA的产量影响较为明显,而大豆饼粉的添加量对[(4'-OH)MeLeu]4-CsA产量变化并不显著,这可能是由于大豆饼粉的成分复杂,有效氮源成分较低所致。通过氮源单因素实验,得到最优的酵母浸粉、蛋白胨和大豆饼粉条件分别为3.0,10.0和15.0 g/L。以此添加量组合,得到优化后的氮源配比,最终的发酵产量可达274 mg/L,较对照的YEP(9)+PEP(5)+SM(15) 产量(260 mg/L)提高5.4%。
Fig. 4
 | Download: JPG larger image |
| 酵母浸粉(yeast extract powder, 缩写为YEP)、蛋白胨(peptone, 缩写为PEP)以及大豆饼粉(soybean meal,缩写为SM)。每组实验均保持其余2个组分不变。标星号的实验组为优化的单因素组合后实验结果。图中括号内的数字表示添加量,单位g/L。 图 4 氮源的优化对4-羟基环孢素产量的影响 Fig. 4 Effects of nitrogen sources on [(4'-OH)MeLeu]4-CsA production 图 4 氮源的优化对4-羟基环孢素产量的影响 Fig. 4 Effects of nitrogen sources on [(4'-OH)MeLeu]4-CsA production --> | |
2.5 响应面法优化诱变菌发酵培养基响应面法(response surface method)是培养基优化中的一种常用方法。本文在单因素条件优化的基础上,针对主要的碳源(甘油和糊精)和氮源(酵母浸粉和蛋白胨)进行优化。大豆饼粉由于添加量的变化对最终产量影响并不显著,因此被排除在外。在此采用了4因素3水平的Box-Behnken中心组合实验设计方案,以单因素优化结果作为中心点。在其他因素保持不变的条件下(大豆油2.0 g/L,大豆饼粉15.0 g/L),实验设计和发酵结果如表 2所示。
Table 2
| 表 2 Box-Behnken试验设计和结果Table 2 Design and results of Box-Behnken test |
应用回归分析对各因子进行方差分析,结果列于表 3。该模型的F值为19.85,p值为0.01%,且失拟度为1.80,不显著,表明Box-Behnken模型拟合良好。在此模型中,C, D, AC, AD, BD, CD, A2, C2和D2为显著项。R-Squared为0.958 6,Pred R-Squared为0.757 1,Adj R-Squared为0.910 3。回归方程模型与实际试验拟合性较好,实验误差小,证明应用响应面法优化Nonomuraea dietziae发酵培养基可行。
Table 3
| 表 3 响应面试验中碳氮源与4-羟基环孢素产量回归方程的方差分析结果Table 3 ANOVA of regression equation in response surface test |
模型预测得到的方程为:Production=99.49+22.76×C+45.83×D+28.94×A×C-56.36×A×D+18.70×B×D-36.60 ×C×D+35.29×A2+27.05×C2+50.96×D2,其中A为甘油,B为糊精,C为蛋白胨,D为酵母浸粉。
以[(4'-OH)MeLeu]4-CsA的产量为目标函数,通过Design Expert中的Optimization程序进行最优值预测,预测得到的最佳配方为:甘油26.5 g/L,糊精11.6 g/L,蛋白胨9.7 g/L,酵母浸粉3.5 g/L。预测产量为321.65 mg/L。在此条件下进行5批发酵验证,得产量为303 mg/L,为预测产量的94.2%,表明拟合方程的有效和响应面优化法较为可靠。其中的误差可能来源于摇瓶上的溶氧和pH难以控制。
2.6 离子添加的优化在响应面优化的基础上,本研究继续考察6种金属离子的添加。由图 5可见,在6种离子中,镁离子、亚铁离子和钼酸根离子对[(4'-OH)MeLeu]4-CsA产量具有正效应。镁离子和亚铁离子可能主要参与胞内涉及ATP的合成与分解和氧化还原过程(http://www.brenda-enzymes.org/)。而钼酸根离子在之前的报道中已证实对[(4'-OH)MeLeu]4-CsA产量具有促进作用[13]。在本研究中,单独添加这些离子的效果并不明显,最高产量为312 mg/L(0.40 g/L MgSO4·7H2O)。而将这3种离子混合后进行添加,最终的[(4'-OH)MeLeu]4-CsA产量可达324 mg/L,表明这些离子之间具有一定的协同效应。
Fig. 5
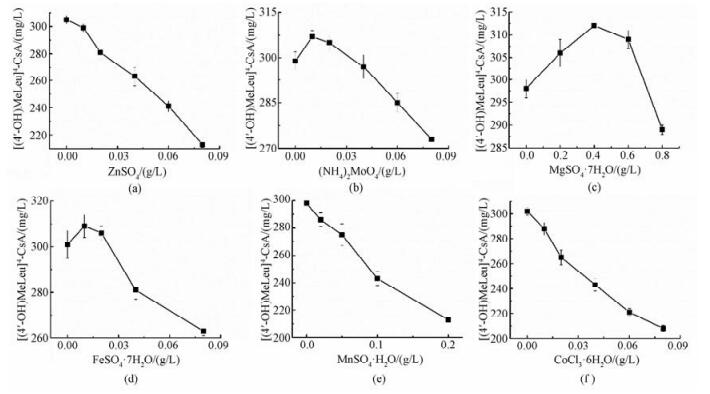 | Download: JPG larger image |
| 图 5 金属离子浓度对4-羟基环孢素产量的影响 Fig. 5 Effects of metal ion concentrations on the production of [(4'-OH)MeLeu]4-CsA 图 5 金属离子浓度对4-羟基环孢素产量的影响 Fig. 5 Effects of metal ion concentrations on the production of [(4'-OH)MeLeu]4-CsA --> | |
3 结论本文以实验室保藏的Nonomuraea dietziae作为出发菌,采用紫外-氯化锂诱变方法,筛选出一株[(4'-OH)MeLeu]4-CsA产量达208 mg/L的Nonomuraea dietziae稳定遗传的突变株J263,并对发酵培养基进行优化,优化后的培养基配方为:甘油26.5 g/L,糊精11.6 g/L,蛋白胨9.7 g/L,酵母浸粉3.5 g/L,大豆饼粉15.0 g/L,大豆油2.0 g/L,硫酸镁0.40 g/L,硫酸锰0.010 g/L,钼酸铵0.010 g/L。最优化条件下J263的4-羟基环孢素产量达到324 mg/L,较出发菌株提高97.6%。本文的研究结果可为[(4'-OH)MeLeu]4-CsA工业化大规模生产提供基础。将来,针对[(4'-OH)MeLeu]4-CsA进行发酵工艺的优化,例如通过控制溶氧提高氧气供给,采用流加工艺提高菌体对高浓度环孢素的耐受性,或者通过营养物质流加工艺提高菌体量等;以及过表达氧化还原酶系统,或者构建体外酶催化系统,将会进一步提高[(4'-OH)MeLeu]4-CsA的产量和得率。
参考文献
| [1] | Lawen A, Traber R, Geyl D, et al. Cell-free biosynthesis of new cyclosporins[J].The Journal of Antibiotics, 1989, 42(8):1 283–1 289.DOI:10.7164/antibiotics.42.1283 |
| [2] | Borel J F. Comparative study of in vitro and in vivo drug effects on cell-mediated cytotoxicity[J].Immunology, 1976, 31(4):631–641. |
| [3] | Scribner A, Houck D, Huang Z, et al. Synthesis and biological evaluation of [D-lysine]8 cyclosporin A analogs as potential anti-HCV agents[J].Bioorganic & Medicinal Chemistry Letters, 2010, 20(22):6 542–6 546. |
| [4] | Peel M, Scribner A. Cyclophilin inhibitors as antiviral agents[J].Bioorganic & Medicinal Chemistry Letters, 2013, 23(16):4 485–4 492. |
| [5] | Evers M, Barrière J C, Bashiardes G, et al. Synthesis of non-immunosuppressive cyclophilin-Binding cyclosporin A derivatives as potential anti-HIV-1 drugs[J].Bioorganic & Medicinal Chemistry Letters, 2003, 13(24):4 415–4 419. |
| [6] | Kim S-N, Ahn H-J, Lee C-W, et al. Use of nonimmunosuppressive [Y-hydroxy-n-methyl-l-leucine4] cyclosporin derivatives for treating hair loss: US, US20040161399 [P/OL]. (2004-08-19)[2016-09-05]. http://www.freepatentsonline.com/y2004/0161399.html. |
| [7] | Kim C D, Lee M H, Sohn K C, et al. Induction of synapse associated protein 102 expression in cyclosporin A-stimulated hair growth[J].Experimental Dermatology, 2008, 17(8):693–699.DOI:10.1111/exd.2008.17.issue-8 |
| [8] | Lee M J, Kim H B, Yoon Y J, et al. Identification of a cyclosporine-specific P450 hydroxylase gene through targeted cytochrome P450 complement (CYPome) disruption in Sebekia benihana[J].Applied and environmental microbiology, 2013, 79(7):2 253–2 262.DOI:10.1128/AEM.03722-12 |
| [9] | Takahashi T, Kamimura A. Cyclosporin A promotes hair epithelial cell proliferation and modulates protein kinase C expression and translocation in hair epithelial cells[J].Journal of Investigative Dermatology, 2001, 117(3):605–611.DOI:10.1046/j.0022-202x.2001.01452.x |
| [10] | Bistolas N, Wollenberger U, Jung C, et al. Cytochrome P450 biosensors: a review[J].Biosensors & Bioelectronics, 2005, 20(12):2 408–2 423. |
| [11] | Kuhnt M, Bitsch F, France J, et al. Microbial biotransformation products of cyclosporin A[J].The Journal of Antibiotics, 1996, 49(8):781–787.DOI:10.7164/antibiotics.49.781 |
| [12] | Lee M J, Han K, Kim E S. Targeted gene disruption and functional complementation of cytochrome P450 hydroyxlase involved in cyclosporin A hydroxylation in Sebekia benihana[J].J Microbiol Biotechnol, 2011, 21(1):14–19.DOI:10.4014/jmb |
| [13] | Park N S, Myeong J S, Park H J, et al. Characterization and culture optimization of regiospecific cyclosporin hydroxylation in rare actinomycetes species[J].Journal of Microbiology & Biotechnology, 2005, 15(1):188–191. |
| [14] | 章丽, 戴梦, 郑桂珍, 等. 等离子体-紫外复合诱变选育四羟基环孢菌素衍生物高产菌株[J].微生物学杂志, 2014, 34(1):68–71. |
| [15] | 刘静, 戴梦, 章丽, 等. 4-羟基环孢菌素A衍生物[γHyMeLeu4]-CyA生产菌的接合转移[J].化学与生物工程, 2013, 30(4):44–46. |
| [16] | Stackebrandt E, Wink J, Steiner U, et al. Nonomuraea dietzii sp. nov[J].International Journal of Systematic and Evolutionary Microbiology, 2001, 51(4):1 437–1 441.DOI:10.1099/00207713-51-4-1437 |
| [17] | Sebek O K, Dolak L A. Microbial hydroxylation of novobiocin and related compounds[J].The Journal of Antibiotics, 1984, 37(2):136–142.DOI:10.7164/antibiotics.37.136 |
| [18] | 黄乐平, 汤锋, 刘启阳, 等. 紫外-氯化锂复合诱变选育聚半乳糖醛酸酶高产菌株[J].安徽农业科学, 2011, 39(22):13 275–13 276. |
| [19] | 袁琳. 采用氯化锂和紫外线复合诱变方法筛选四环素高产菌株[J].宁夏医学杂志, 2000, 22(6):340–341. |
| [20] | 虞龙, 张宇, 龚文静, 等. 氯化锂-紫外-离子束复合诱变红霉素高产菌株研究[J].原子能科学技术, 2011, 45(7):780–784. |
| [21] | Wang P, Hongbing Y U, Wang L, et al. Production of levulinic acid from sucrose catalyzed by ferric chloride supported on activated carbon[J].Chemical Industry & Engineering Progress, 2009, 28(5):817–821. |
| [22] | Ahmadi M, Vahabzadeh F, Bonakdarpour B, et al. Application of the central composite design and response surface methodology to the advanced treatment of olive oil processing wastewater using Fenton's peroxidation[J].Journal of Hazardous Materials, 2005, 123(1):187–195. |
| [23] | 高宏伟, 张萍, 石彦鹏, 等. 紫外-氯化锂复合诱变选育泰妙菌素高产菌株[J].中国兽药杂志, 2011, 45(3):18–19. |
| [24] | 邱雁临, 梁亮, 汪亮. 紫外线与氯化锂复合诱变选育L-组氨酸产生菌[J].现代食品科技, 2008, 24(3):217–219. |
| [25] | 章丽, 戴梦, 郑桂珍, 等. 四羟基环孢菌素衍生物转化菌株发酵条件优化[J].中国抗生素杂志, 2014, 39(4):249–252. |
| [26] | Gunnarsson N, Mortensen U H, Sosio M, et al. Identification of the Entner-Doudoroff pathway in an antibiotic-producing actinomycete species[J].Molecular Microbiology, 2004, 52(3):895–902.DOI:10.1111/j.1365-2958.2004.04028.x |
| [27] | Conway T. The Entner-Doudoroff pathway: history, physiology and molecular biology[J].FEMS Microbiology Reviews, 1992, 9(1):1–27. |
| [28] | Hamedi J, Malekzadeh F, Niknam V. Improved production of erythromycin by Saccharopolyspora erythraea by various plant oils[J].Biotechnology Letters, 2002, 24(9):697–700.DOI:10.1023/A:1015282016388 |
| [29] | Qi H, Zhao S, Fu H, et al. Enhancement of ascomycin production in Streptomyces hygroscopicus var. ascomyceticus by combining resin HP20 addition and metabolic profiling analysis[J].Journal of Industrial Microbiology and Biotechnology, 2014, 41(9):1 365–1 374.DOI:10.1007/s10295-014-1473-9 |
| [30] | Zhao S, Huang D, Qi H, et al. Comparative metabolic profiling-based improvement of rapamycin production by Streptomyces hygroscopicus[J].Applied Microbiology and Biotechnology, 2013, 97(12):5 329–5 341.DOI:10.1007/s00253-013-4852-7 |
| [31] | Xia M, Huang D, Li S, et al. Enhanced FK506 production in Streptomyces tsukubaensis by rational feeding strategies based on comparative metabolic profiling analysis[J].Biotechnology and Bioengineering, 2013, 110(10):2 717–2 730.DOI:10.1002/bit.24941 |
