Ti合金优异的低温抗氧化性能是其得到广泛应用的重要原因。低温下,Ti氧化时生成TiO2,在基体表面为致密结构,很好地保护基体[3]。由于Ti与O之间有很强的亲和力而且O在Ti中有很高的溶解度(原子分数高达30%),通常在氧化物层下面会有一富氧层,因为O本身稳定α相,此富氧层又称为“α-case”,α-case为硬脆相,在拉伸载荷下容易产生裂纹。由于高温下物质扩散速度加剧,α-case在温度越高时,越明显。温度超过600°C后,虽然此温度下TiO2仍具有很好的物理稳定性,但由于氧的渗透过程加剧,体系被氧化速度过快,在应用上不能接受[2]。合金化改善Ti的抗氧化性已经有大量的报道,研究发现合金元素Nb[4]、Al[5, 6]和 Zr[1]等在一定的浓度范围内均为可添加的有益元素。这些元素影响氧化过程的机制是多种多样的,比如减慢氧穿过氧化层的速度等。TiO2中氧的扩散为空位机制,因此能抑制氧空位形成的元素可一定程度上减慢Ti合金氧化速度。
实验上,合金元素W已被证明可增强Ti-6Al-4V的强度[7, 8, 9]。实际的材料的应用中,任何一种性能参数都是极其重要的,因此W对Ti抗氧化性的影响的研究也十分有必要。 对于Ti合金的氧化过程,主要是环境中的氧以空位扩散机制穿过TiO2层、到达金属基体引起体系的进一步氧化[1, 2]。因此研究TiO2中合金元素W与氧空位(团簇)的相互作用对探讨W对Ti合金抗氧化性的影响有重要意义。然而实验上研究合金元素与空位的相互作用的方法十分复杂,目前为止少有相关的实验研究报道。以此为出发点,本文运用第一性原理超晶胞理论计算研究了W对TiO2中单个氧空位以及氧空位对形成能的影响,并对物理层次的机制做了进一步分析。
1 计算方法本文中的第一性原理计算内容通过奥地利维也纳大学开发的第一性原理Vienna Ab-initio Simulation Package(VASP)软件包[10, 11]完成。电子间的交换关联泛函采用广义梯度近似PW91-GGA[12]。电子与原子核的相互作用通过PAW赝势[13]描述。为了保证计算的精确性,这里对于涉及的过渡金属原子W和Ti,其内层p电子也被处理成价电子。为准确考虑点缺陷在TiO2内部引起的畸变,与前期研究一样[14],这里采用了包含240个原子的超晶胞,超胞晶格矢量分别沿[001]、[110]和[1 10]方向。 平面波截断能设置为400 eV;倒易空间k点网格为2×2×2,计算过程中取消了对称性限制,即共有4个不可约k点。这里考虑了一个W原子取代超晶胞中80个Ti原子中的一个,计算过程中发现自旋极化对结果的影响可以忽略。本文考虑的氧空位为中性,即从超晶胞中直接去除一个氧原子,而非氧离子。
氧空位的形成难易程度通过形成能衡量,形成能的定义为
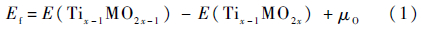
式中:x为所用超晶胞中Ti的原子个数,式(1)中x=80;晶胞中E(Tix-1MO2x-1)为含合金元素M以及氧空位的超晶胞的能量;E(Tix-1MO2x)为只含合金元素M的超晶胞的能量,M为元素W或无掺杂状态下的Ti;μO为氧的化学势,与外界环境的压力和温度有关,在忽略分子振动能和转动能的情况下,其定义为[15]
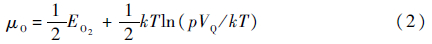
式中:VQ=(h2/2πmkT)3/2为量子体积;EO2为0 K下氧分子的能量;k、T、p、h和m分别为玻耳兹曼常数、温度、压力、普朗克常数和原子的质量。根据通常的实验条件,这里限定温度和压力的范围:200 K < T < 1 400 K,10-20 Pa<p < 105 Pa。如此可计算得到μO的范围为:-9.5 eV<μO < -5 eV。本文最终得到的形成能也是跟μO有关的物理量,第2.1节详细给出了取值范围。
2 结果与讨论 2.1 W掺杂对单个氧空位形成能的影响对于金红石结构的TiO2,金属离子周围有6个近邻的阴离子,组成八面体形状,如图 1 所示。图中,M为合金元素,这里代表Ti或掺杂元素W,在纯TiO2中,此6个氧原子完全等价,但当超晶胞中一个Ti被W原子取代后,根据原子距离,其周围出现了2类O原子,分别对应2类氧空位,在图 1中分别用VA和VB来表示。
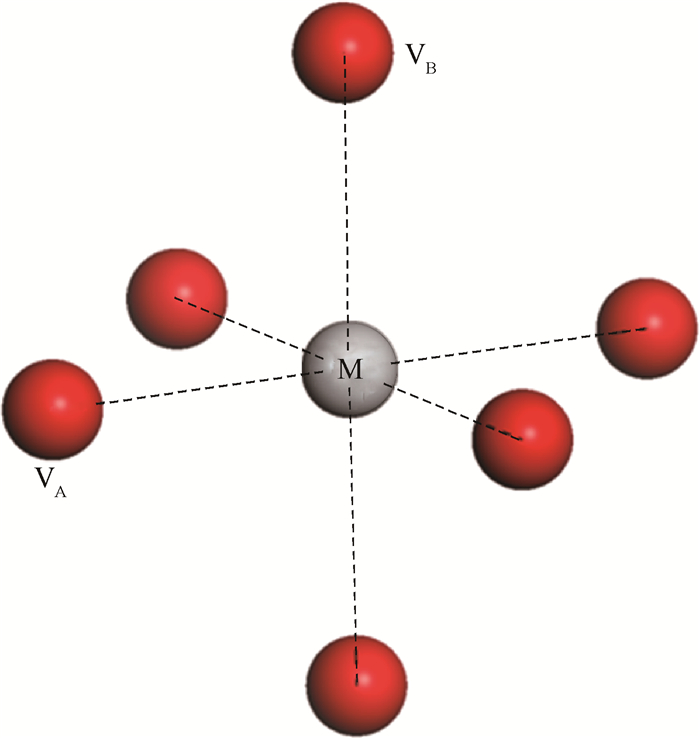 |
| 图 1 金红石TiO2结构中TiO6八面体构型 Fig. 1 TiO6 octahedral configuration in rutile TiO2 structure |
| 图选项 |
对于纯TiO2,结构优化以后,金属Ti离子与VA和VB氧空位的距离分别为0.196 nm和0.200 nm。W掺杂并进行结构优化后,其与VA和VB氧空位的距离分别为0.193 nm和0.196 nm。图 2给出了W掺杂前后单个氧空位的形成能随着氧化学势的变化,可以看出W显著增大了其近邻的氧空位的形成能,且最近邻位置VA处作用最明显。W提高了空位形成能可以从价电子数目方面加以解释:氧空位的产生本身可以导致基体中金属离子的2个价电子无法配对,W含6个价电子,比Ti多2个,这样W和氧空位近邻时,W和周围的Ti均含有未配对电子,即存在未饱和的悬挂键,显然不利于体系的稳定性。W增大了氧空位的形成能,表现出排斥氧空位。从氧空位形成能的升高方面讲,W对提高Ti的抗氧化性是十分有意义的。另一方面,W对氧化性能的提高和Nb应该是类似的[1],Nb的价电子数目同样比Ti要高。
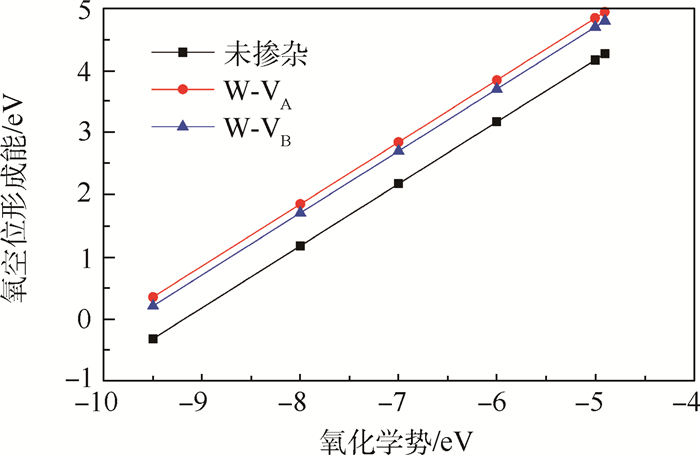 |
| 图 2 氧空位形成能随氧化学势的变化 Fig. 2 Dependence of oxygen vacancy formation energies on chemical potential of oxygen |
| 图选项 |
2.2 W掺杂对氧空位对形成能的影响相对于单个氧空位的情况,氧空位对可能的构型是多种多样的,同样这里只考虑了金属离子近邻的6个氧原子位置。这里研究了5种氧原子(空位)对,用图 3 中的符号表示为:VA1VA2,VA1VA3,VA2VA3,VA1VB1,VB1VB2。对于氧空位对的形成能的计算方法,和式(1)相同,只是这里氧空位的数量变成了2个。
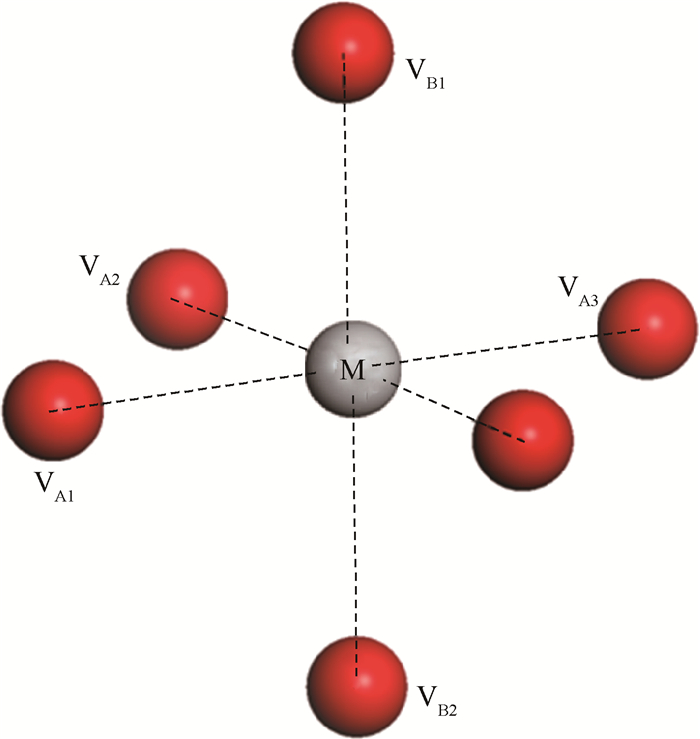 |
| 图 3 金红石结构中金属离子M近邻氧原子空位对 Fig. 3Oxygen vacancy pairs near metallic ion M in rutile structure |
| 图选项 |
氧空位对的形成能的绝对数值显然与氧的化学势相关,但由式(1)可知,掺杂前后不同构型氧空位对形成能的相对值与氧的化学势无关,如图 2中相互平行的直线,这里为了更能直接地反应不同构型之间的相对稳定性,固定
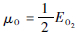 。计算得到的不同构型的氧空位对形成能如表 1所示。
。计算得到的不同构型的氧空位对形成能如表 1所示。表 1 不同构型的氧空位对的形成能 Table 1 Formation energies of various oxygen vacancy pairs
| eV | |||||
| 构型 | V A1V A2 | V A2V A3 | V A1V A3 | V A1V B1 | V B1V B2 |
| 未掺杂 | 8.9 | 9.4 | 9.4 | 8.7 | 9.7 |
| W掺杂 | 9.7 | 9.9 | 9.1 | 10.0 | 9.3 |
表选项
首先,对比纯TiO2中单个氧空位的形成能为4.3 eV,可以看出氧空位对中平均每个空位的形成能更高些,即纯TiO2中,氧空位不倾向近邻排列形成空位对。不同构型的氧空位对的形成能差别较大,显然这跟2个氧空位之间的相互作用以及整个晶格的弛豫相关,而与2个被移除体系的氧离子之间的距离没有很直接的关系。W的掺杂总体上仍然可以增大空位对的形成能,对抗氧化性的提高是有益的。但效果并没有像前面计算得到的提高单个空位形成能明显,从表 1中可以看到,对于未掺杂的TiO2,最稳定的氧空位对构型为VA1VB1,对应的形成能为8.7 eV;W掺杂后,最稳定的构型为VA1VA3,对应形成能为9.1 eV,平均每个氧空位的形成能提高了0.2 eV,而图 2中W可以将孤立氧空位的形成能提高将近0.7 eV,可以看出,在氧空位浓度增大,对应氧化速度变快时,W掺杂对抗氧化性的提高效益将会变弱。
为了从电子结构上理解不同空位对构型的相对稳定性以及W掺杂的影响,这里以形成能较高和较低的构型VA1VB1和VB1VB2为例,图 4给出了其电子态密度图。首先对于未掺杂的TiO2,2个中性的氧空位导致近邻Ti离子中产生4个富余的未配对电子,从图 4(a)中可以看到这4个电子的态均在导带的底部,为离域态,这与之前密度泛函理论(Density Functional Theory,DFT)计算得到的含单个氧空位的TiO2的态密度是符合的[14],对于氧空位对构型VB1VB2,导带底的电子态分布在较宽的能量范围,且价带向高能量水平方向有一定的偏移,这最终导致其结构相对构型VA1VB1不稳定。同时可以看出不同的电子态分布也导致了带隙大小的变化,即VA1VB1对应的带隙宽度较大。
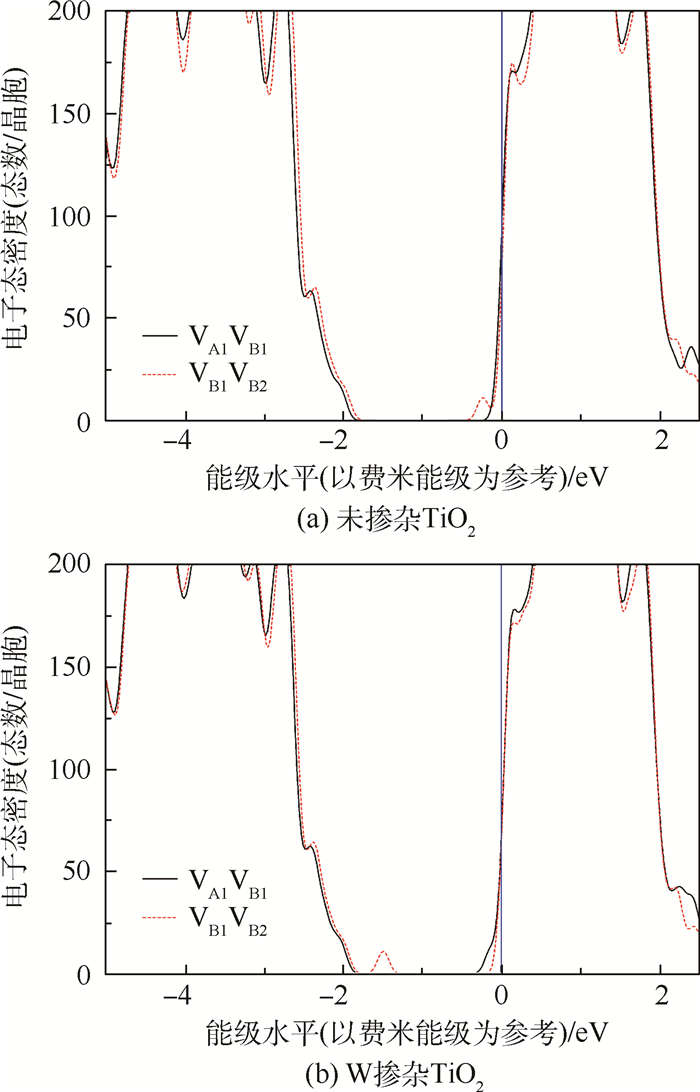 |
| 图 4 W掺杂前后不同构型的氧空位对的电子态密度 Fig. 4 Densities of electronic states of undoped and W-doped rutile containing various oxygen-vacancy pairs |
| 图选项 |
由于W比Ti多出2个价电子,W掺杂的含2个氧空位的超晶胞中将有6个未配对电子,从图 4(b)中可以看出这6个电子的能级分布随着氧空位对的构型有明显变化。对于构型VB1VB2,其中4个未配对电子在导带底部,另外2个的电子态在分布在带隙中(-1.5 eV左右),且靠近价带位置,而对于构型VA1VB1,6个电子的电子态均分布在能级较高的导带底,这种电子态分布的差别显然导致了最终体系能量的不同,反应在空位对形成能上即构型VA1VB1能量更高。
3 结 论通过第一性原理计算研究了元素W对金红石TiO2中氧空位形成的影响,得到:
1) 元素W提高了其近邻位置氧空位的形成能,对单个氧空位,空位形成能增加了0.7 eV,很大程度上抑制了空位的形成,即W对提高Ti合金的抗氧化性能是有益的。
2) 对于2个氧空位组成的不同构型的氧空位对,W同样可以抑制空位对的形成,可使平均每个氧空位形成能提高0.2 eV,显著小于孤立氧空位的情况,即在快速氧化过程中,氧空位数量增加,W对抗氧化性的提高不再十分显著。
3) 电子态密度的计算表明,氧空位对的构型不同时,体系中未配对电子的电子态能级分布也不同,对于W掺杂的体系,这些电子态除了分布在导带底部也可能分布在带隙中间,电子态的分布影响着结构的能量最终引起空位形成能的差异。
参考文献
| [1] | LVTJERING G,WILLIAMS J.Titanium[M].Berlin:Springer,2003:29-39. |
| [2] | 祝令刚.Ti和Nb合金中氧化问题的理论研究[D].沈阳:中国科学院金属研究所,2014:2-7. ZHU L G.Theoretical study on the oxidation of Ti and Nb-based alloys[D].Shenyang:Insititute of Metal Research,Chinese Academy of Sciences,2014:2-7(in Chinese). |
| Cited By in Cnki (1) | Click to display the text | |
| [3] | 张雯,易敏,沈志刚,等.氧化物涂层对航天器材料原子氧剥蚀的防护[J].北京航空航天大学学报,2013,39(8):1074-1078. ZHANG W,YI M,SHEN Z G,et al.Protection against atomic oxygen erosion of oxide coatings for spacecraft materials[J].Journal of Beijing University of Aeronautics and Astronautics,2013,39(8):1074-1078(in Chinese). |
| Cited By in Cnki | Click to display the text | |
| [4] | CHEN Y S,ROSA C J.High-temperature oxidation of Ti-4.32 wt.% Nb alloy[J].Oxidation of Metals,1980,14(2):147-165. |
| Click to display the text | |
| [5] | CHAZE A M,CODDET C.Influence of the nature of alloying elements on the adherence of oxide films formed on titanium alloys[J].Oxidation of Metals,1987,28(2):61-71. |
| Click to display the text | |
| [6] | CHAZE A M,CODDET C.Influence of aluminium on the oxidation of titanium between 550 and 750℃[J].Journal of the Less Common Metals,1990,157(1):55-70. |
| Click to display the text | |
| [7] | FRARY M,ABKOWITZ S,ABKOWITZ S M,et al.Microstructure and mechanical properties of Ti/W and Ti-6Al-4V/W composites fabricated by powder-metallurgy[J].Materials Science and Engineering:A,2003,344(2):103-112. |
| Click to display the text | |
| [8] | CHOE H,ABKOWITZ S M,ABKOWITZ S,et al.Effect of tungsten dissolution on the mechanical properties of Ti-W composites[J].Journal of Alloys and Compounds,2005,390(2):62-66. |
| Click to display the text | |
| [9] | CHOE H,ABKOWITZ S M,ABKOWITZ S,et al.Effect of tungsten additions on the mechanical properties of Ti-6Al-4V[J].Materials Science and Engineering:A,2005,396(2):99-106. |
| Click to display the text | |
| [10] | KRESSE G,FURTHMULLER J.Efficiency of ab-initio total energy calculations for metals and semiconductors using a plane-wave basis set[J].Computational Materials Science,1996,6(1):15-50. |
| Click to display the text | |
| [11] | KRESSE G,FURTHMVLLER J.Efficient iterative schemes for ab initio total-energy calculations using a plane-wave basis set[J].Physical Review B,1996,54(16):11169-11186. |
| Click to display the text | |
| [12] | PERDEW J P,WANG Y.Pair-distribution function and its coupling-constant average for the spin-polarized electron gas[J].Physical Review B,1992,46(20):12947-12954. |
| Click to display the text | |
| [13] | BLÖCHL P E.Projector augmented-wave method[J].Physical Review B,1994,50(24):17953-17979. |
| Click to display the text | |
| [14] | ZHU L G,HU Q M,YANG R.The effect of electron localization on the electronic structure and migration barrier of oxygen vacancies in rutile[J].Journal of Physics:Condensed Matter,2014,26(5):055602-055608. |
| Click to display the text | |
| [15] | IDDIR H,OGUT S,ZAPOL P,et al.Diffusion mechanisms of native point defects in rutile TiO2:Ab initio total-energy calculations[J].Physical Review B,2007,75(1):073203-073206. |
| Click to display the text |
