从转录因子WT1和去甲基化酶TET2在急性髓系白血病(AML)中存在突变互斥的遗传学现象入手,复旦大学生物医学研究院分子细胞生物学团队(简称“MCB团队”)发现WT1招募TET2到基因组特定区域,行使其去甲基化酶功能,决定WT1下游靶基因转录(Wang et al.Mol Cell. 2015)。该论文被选为Mol Cell编辑推荐文章,配发同期述评,也被Cancer discovery编辑选为亮点文章。受这项工作的启发,MCB团队构建了包含1400多个转录因子文库,筛选并发现了除WT1之外的一批与TET2蛋白相互作用的转录调节因子,包括转录因子、转录共激活子、蛋白结构域等。进一步研究发现,TET2通过转录共激活子SNIP1与转录因子c-MYC结合,三者形成三元复合物,调控c-MYC下游靶基因转录,影响DNA 损伤应激和细胞凋亡,为解析TET2参与维持基因组稳定性提供了新机制(Chen et al. Cell Reports.2018)。
近日,MCB团队研究发现,ZSCAN蛋白能够通过其SCAN结构域与TET2蛋白相结合,为理解TET2是如何被招募道染色质上并发挥生物学功能提供了新的认识。7月14日,相关成果以《Zscan4-Tet2转录轴调控代谢及蛋白质稳态促进诱导性多能干细胞重编程》(“The Zscan4-Tet2 Transcription Nexus Regulates Metabolic Rewiring and Enhances Proteostasis to Promote Reprogramming”)为题在线发表于《细胞》(Cell)子刊《细胞报告》(Cell Reports)杂志。
SCAN结构域是一个高度保守的区域,主要发现在C2H2锌指结构域的N端,并特异地存在于脊椎动物中。但是,大部分ZSCAN家族成员的生物学功能尚不明了。在人的SCAN家族蛋白中一共包含有57个成员,而在小鼠的SCAN家族蛋白中包含有43个成员。以ZSCAN家族成员之一Zscan4f为例,复旦MCB团队研究发现Tet2蛋白能被Zscan4f招募到其靶基因的启动子区域,去除DNA甲基化并激活基因表达,刺激糖酵解途径和提高蛋白酶体活性,最终促进诱导性多能干细胞的重编程,丰富了人们对TET2调控靶基因转录和发挥生物学功能的科学认知。鉴于众多ZSCAN蛋白能够与TET2蛋白相结合,该工作也为ZSCAN蛋白功能研究提供了全新研究思路。
复旦大学博士程舟礼为论文第一作者,复旦大学生物医学研究院教授叶丹、上海交通大学医学院教授张明亮为共同通讯作者。该工作还得到了中国科学院广州生物医药与健康研究院教授刘兴国、中科院生化细胞所研究员李劲松、中国科学院上海巴斯德研究所教授江陆斌、浙江大学教授刘鹏渊和教授郭行等的大力支持。
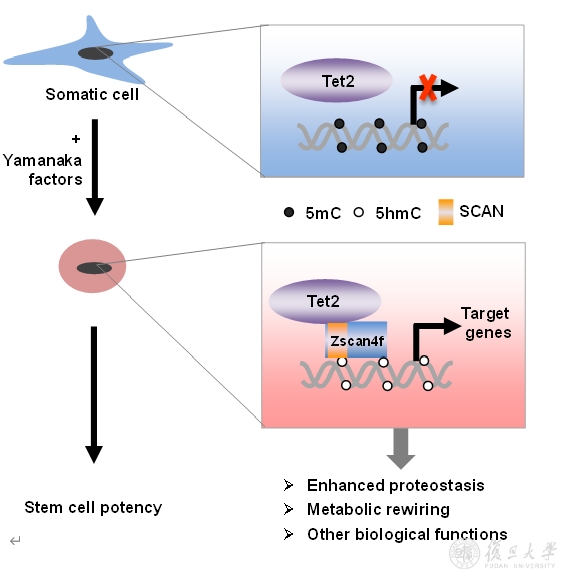
Tet2-Zscan4f复合物参与调控靶基因转录和促进体细胞重编程
论文链接:https://www.sciencedirect.com/science/article/pii/S2211124720308585?via%3Dihub
MCB团队相关成果:
Wang, Yiping, et al. WT1 recruits TET2 to regulate its target gene expression and suppress leukemia cell proliferation. Molecular Cell57.4 (2015): 662-673.
Chen, Lei-Lei, et al. SNIP1 recruits TET2 to regulate c-MYC target genes and cellular DNA damage response. Cell Reports25.6 (2018): 1485-1500.
