T细胞是脊椎动物适应性免疫的重要细胞,在病毒感染、癌症以及自体免疫疾病中起着关键作用。T细胞通过其TCR-CD3受体复合物特异性识别抗原,将胞外的抗原识别信号跨膜传递到T细胞内,激活胞内的适应性免疫信号通路,启动免疫反应。在2019年,该课题组在《自然》(Nature)上发表了题为“人T细胞受体-共受体复合物组装的结构基础”(Structural basis of assembly of the human TCR-CD3 complex)的研究文章,首次解析了人T细胞受体复合物(包含全部8个亚基)的高分辨率冷冻电镜结构,揭示了TCR-CD3亚基在膜外侧以及膜内识别、组装成功能复合物的分子机制。但一直以来,T细胞受体如何将胞外抗原信号传递到胞内激活T细胞的这一关键机制的结构基础并不清楚。
在这项研究中,该课题组解析了人源野生型、硫酸胆固醇结合型以及组成型激活的3种状态的TCR-CD3复合物的高分辨率冷冻电镜结构。首先通过解析3.2埃的野生型TCR-CD3复合物的高分辨率结构,发现两个胆固醇分子结合在TCR-CD3复合物的跨膜螺旋围成的通道内(课题组称之为“胆固醇结合通道”,通过质谱、解析硫酸胆固醇结合的TCR-CD3复合物、放射性标记胆固醇竞争性实验,证实TCR胆固醇结合通道结合的是胆固醇分子)。在该静息态的TCR复合物结构中,CD3ζ亚基跨膜螺旋的中间至C端和TCR其他亚基的互作主要由两个尾部相连的胆固醇二聚体分子介导,胆固醇二聚体分子就像闩锁将CD3ζ的跨膜α螺旋锁定在非活性的构象状态。
之后,课题组基于TCR结构产生系列突变体以阻断其与胆固醇结合,功能实验发现TCR突变体获得了不依赖抗原的CD3ζ亚基胞内区的磷酸化,说明突变体具有组成型激活的能力。为进一步研究这些突变体组成型激活的机制,该课题组解析了其中一个组成型激活的突变体(TCRβ L281A/L285A)的结构,分析发现该突变体的胆固醇结合通道中的胆固醇二聚体分子结合被打破,将该突变体和野生型TCR复合物结构进行比较,发现该突变体在CD3ζ跨膜螺旋近C端区发生显著的构象变化,势必带动与C端紧密相连的CD3ζ胞内尾巴发生构象变化,暴露出其磷酸化位点,进而激活胞内信号通路。
TCR复合物作为T细胞识别抗原、启动免疫反应的关键分子,其激活活性受到精确调控,以免在没有抗原结合或非特异性抗原结合后引发非特异性的激活,进而导致自免疫反应。因此,在未结合抗原时,TCR通过结合胆固醇分子使其维持在静息态构象,结合特异性抗原后,触发TCR构象变化,解除胆固醇对TCR的构象限制,从而激活TCR。该研究通过捕捉到TCR在静息和激活两种状态的构象,揭示胆固醇限制TCR活性的机制,对认识TCR从静息状态到激活状态的构象变化提供结构和理论依据,同时为理性设计靶向TCR调控T细胞活性的新型免疫疗法,治疗自免疫等疾病具有重要意义。
我校生命学院黄志伟教授为通讯作者。生命学院博士后陈彦、朱玉威副研究员、博士生李想和本科生高文博为论文的共同第一作者。生命学院博士生甄梓期、博士后董德、本科生黄不了、张帆研究员和电镜平台马卓、张安琪、郭长友参与该研究的部分工作。北京生命科学研究所宋小翠和马燕老师进行了质谱工作。本项目受到黑龙江省头雁团队原创探索基金和国家自然科学基金的资助。
论文链接:https://doi.org/10.1016/j.molcel.2022.02.017

胆固醇(CLR)和硫酸胆固醇(CS)结合状态下的TCR复合物结构
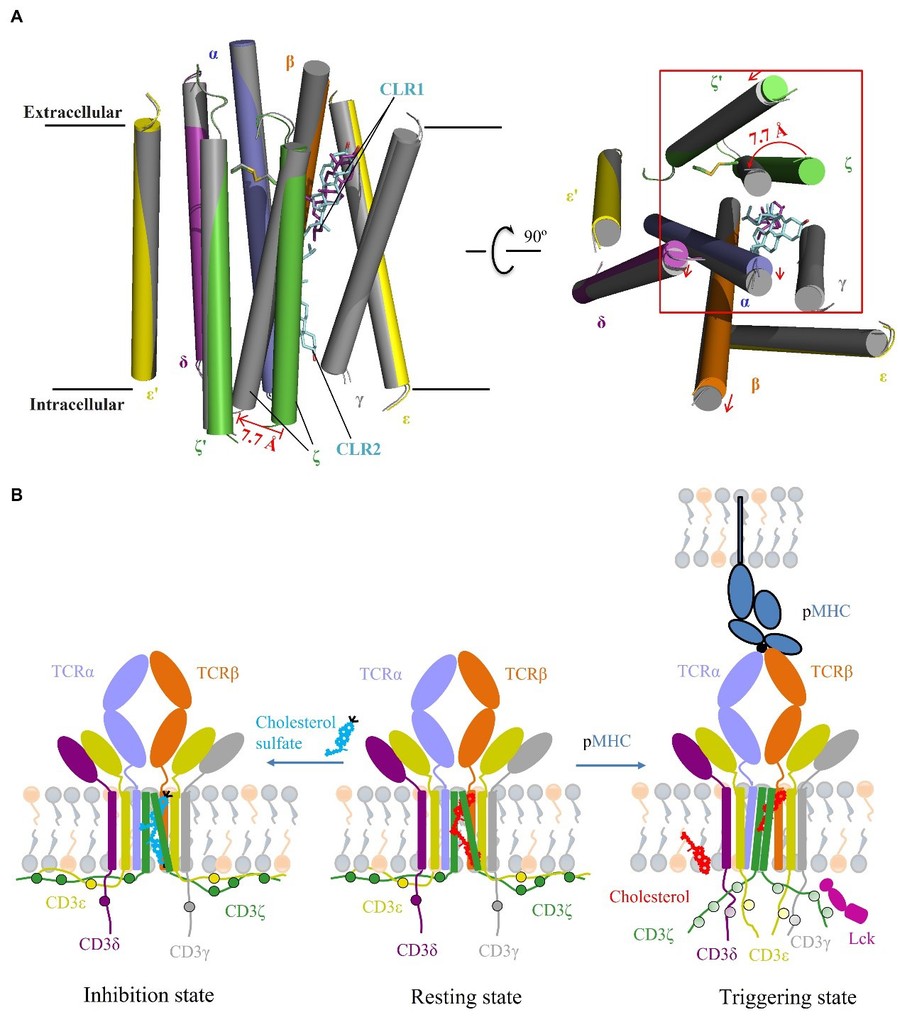
组成型激活态和野生型TCR结构比较(A)以及TCR工作模型(B)
编辑:梁英爽
