鞘氨醇1-磷酸(S1P)是细胞质膜上的鞘磷脂代谢物,可调节炎症反应、细胞迁移、血管生成、神经元和心脏发育。失调的S1P信号与自身免疫、心血管和神经退行性疾病以及癌症相关。S1P主要通过与Gi蛋白偶联受体S1PRs(S1PR1-5)结合发挥生理功能。由于S1P-S1PR1信号在诱导淋巴细胞从淋巴器官迁出中起关键作用,S1PR1是治疗多发性硬化症(MS,multiple sclerosis)的重要靶点。在机制研究上,与内源性配体S1P不同,药物调节剂芬戈莫德(FTY720)和西尼莫德(BAF312)会激活受体,并关联β-arrestin偏向性信号通路,诱导S1PR1在淋巴细胞内持续内化,导致淋巴细胞无法从淋巴结迁出,从而减缓炎症。然而药物调节剂引起S1PR1偏向性激活的构象差异仍不清楚。
何元政课题组首先通过冷冻电镜技术解析了内源性配体S1P、药物调节剂FTY720-P和BAF312分别与S1PR1-Gi结合的3种复合物结构。结构分析及功能数据表明,3种配体采用不同的机制结合受体,其中S1P和FTY720-P类似,它们的极性或带电残基位于结合口袋上方,疏水尾部位于疏水的结合口袋下方;BAF312主要通过广泛的疏水作用与受体结合。与非活性结构的S1PR1相比,3种配体结合的S1PR1结构中都出现跨膜螺旋6(TM6)向外位移的构象变化,这表明受体激活后其构象变化,从而形成Gαi结合位点。通过拮抗和激活状态的结构比较发现配体结合口袋中的W2696.48的位置和方向变化最大,在拮抗剂结合袋中,W2696.48的吲哚环垂直于膜平面,在激动剂S1P结合袋中,吲哚环向TM5翻转约70度,而在FTY720-P和BAF312结合的受体结构中,W2696.48的侧链处于S1P和拮抗剂结合结构的中间构象,这表明W2696.48吲哚环方向可以作为β-arrestin偏向性配体的传感器。结合功能分析和分子动态模拟学分析表明,β-arrestin偏向性配体通过其自身不同的结构改变了S1PR1的配体识别方式,引起受体PIF和NPxxY基序之间的广泛相互作用,激活S1PR1下游不同的信号通路,其中W2696.48的中间翻转以及F2656.44与N3077.49之间的相互作用是β-arrestin偏向性激活受体的主要特征。此外,该研究还发现S1PR1中的L2766.55和L2977.39是S1PR1特异性识别BAF312的关键位点。该研究为设计有效性和安全的新型β-arrestin偏向药物以及受体亚型选择性药物提供了理论基础。
该课题是哈工大生命科学中心与日本东北大学的合作项目。何元政课题组博士生徐珍媚、日本东北大学药理学研究生院生田达也博士为并列第一作者,何元政课题组博士生钱雨、夏瑞雪参与了该课题的研究工作。哈工大生命科学中心公共平台高级工程师郭长友、工程师张安琪合作参与了结构数据的收集工作。何元政研究员、日本东北大学药理学研究生院井上飞鸟教授为本研究论文的共同通讯作者。
全文链接:https://www.nature.com/articles/s41589-021-00930-3
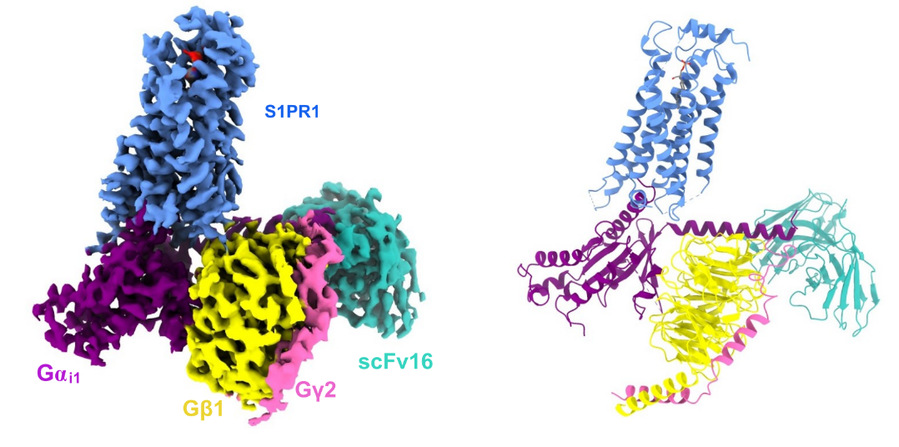
S1PR1/G蛋白复合物冷冻电镜结构
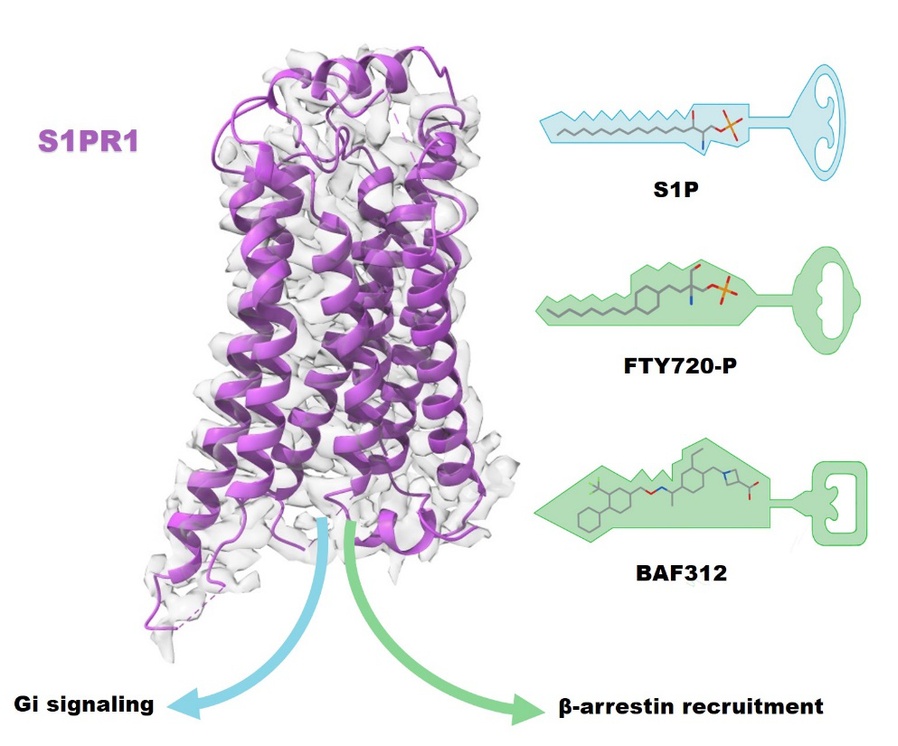
S1PR1结构揭示了当前治疗多重性硬化症药物的分子机制
编辑:梁英爽
