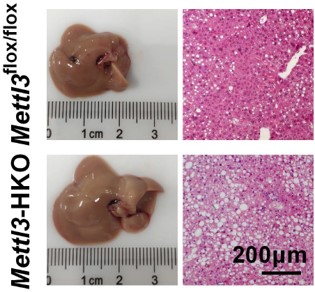
大约25%的普通非酒精性脂肪肝(NAFL)会发展为非酒精性脂肪性肝炎(NASH),NASH会进一步发展为肝硬化和肝癌。哪些基因调控了NAFL到NASH的转变还不清楚。陈政课题组发现RNA甲基转移酶METTL3在这一过程中起重要作用。肝脏特异Mettl3基因敲除小鼠在高脂喂养情况下出现NASH表型,表现为ALT升高,更显著的脂肪肝,并出现肝损伤、肝炎和肝脏纤维化,然而对照Mettl3flox/flox小鼠没有出现NASH表型。Mettl3-HKO小鼠对MCD诱导的NASH更为敏感,出现更严重的NASH。
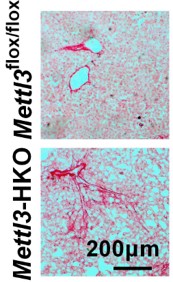
肝脏特异基因敲除Mettl3促进CD36表达,增加自由脂肪酸摄取,导致肝脏脂质积累。肝脏特异基因敲除Mettl3同时也促进CCl2表达,导致肝炎和肝损伤。CD36介导的自由脂肪酸摄取增加和CCL2诱导的炎症促进了Mettl3-HKO小鼠NASH发病进展。抗体中和CD36和CCL2可以缓解Mettl3-HKO小鼠中MCD诱导的NASH。肝脏特异过表达METTL3可以抑制CD36和CCL2的表达,缓解MCD诱导的NASH。
RNA-seq、ATAC-seq和m6ARIP-seq结果显示METTL3调节了Cd36和Ccl2启动子区染色体开放状态和转录,而且不依赖METTL3甲基转移酶活性。METTL3可以通过结合HDAC1/2(组蛋白去乙酰化酶)调节Cd36和Ccl2启动子区H3K9和H3K27的乙酰化。HDAC1/2抑制剂(TSA或Romidepsin)可以部分逆转METTL3对Cd36和Ccl2表达的抑制作用。
另外,在NASH情况下,细胞核里METTL3降低,细胞浆里METTL3增加, METTL3与HDAC1/2的相互作用变弱,METTL3的细胞核/浆穿梭与TNFα/CDK9介导的磷酸化有关。
这些结果揭示了METTL3在NASH的发病过程中的重要作用机制,提供了一个潜在治疗NASH的药物靶点。
我校生命科学中心博士后李新志和博士生袁冰川为该论文共同第一作者,陈政研究员为本论文通讯作者。生命科学与技术学院实验教学中心高级工程师鹿敏,陈政课题组研究生王玉琴、丁娜、刘春红、高铭参与本课题研究。本课题还得到了中山大学第三医院姚志成博士,中科院上海药物所研究生张世言、赵玉军研究员以及广东省微生物研究所谢黎炜研究员的大力支持。本课题得到国家自然科学基金委和哈工大“双一流”经费资助。
文章链接:https://www.nature.com/articles/s41467-021-27539-3
 |  |
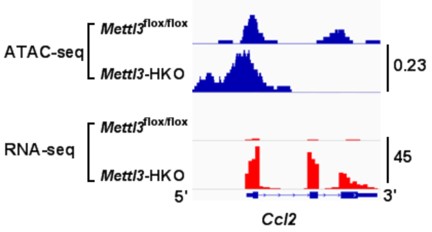

ATAC-seq和RNA-seq显示肝脏特异基因敲除Mettl3促进Cd36和Ccl2启动子区染色体开放和转录
编辑:梁英爽
