

1. 河南农业大学 烟草学院,河南 郑州 450002;
2. 江苏中烟工业有限责任公司,江苏 南京 210011
收稿日期:2020-10-20;接收日期:2021-01-14;网络出版时间:2021-01-25
基金项目:河南省科技攻关项目(No. 202102310026) 资助
摘要:P1B-ATPases是在生物中广泛存在的一类可通过水解ATP跨膜运送重金属离子的蛋白,是P型ATPase家族的一个亚类。研究发现P1B-ATPases在植物中主要负责重金属离子的主动转运,在植物重金属平衡调节系统中发挥重要作用。文中从P1B-ATPases的结构与分类出发,介绍了P1B-ATPases的作用机制,综述了目前P1B-ATPases功能的研究进展,以期为未来P1B-ATPases在改良作物品质以及生态环境治理的研究及应用提供参考。
关键词:植物重金属转运蛋白P1B-ATPases
Advances in plant heavy metal transporter P1B-ATPases
Penghu An1, Duomin Zhang1, Zifang Zhou2, Dan Han1, Zicheng Xu1, Wuxing Huang1


1. College of Tobacco, Henan Agricultural University, Zhengzhou 450002, Henan, China;
2. Jiangsu China Tobacco Industry Co., Ltd., Nanjing 210011, Jiangsu, China
Received: October 20, 2020; Accepted: January 14, 2021; Published: January 25, 2021
Supported by: Henan Province Science and Technology Research Project, China (No. 202102310026)
Corresponding author: Wuxing Huang. Tel/Fax: +86-371-63555763; E-mail: wxhuang@henau.edu.cn.
Abstract: P1B-ATPases are a group of proteins that can transport heavy metal ions across membranes by hydrolyzing ATP and they are a subclass of the P-type ATPase family. It was found that P1B-ATPases are mainly responsible for the active transport of heavy metal ions in plants and play an important role in the regulation of heavy metal homeostasis in plants. In this paper, we dissusses the mechanism of P1B-ATPases from the structure and classification of P1B-ATPases, and review the current research progress in the function of P1B-ATPases, in order to provide reference for future research and application of P1B-ATPases in improving crop quality and ecological environment management.
Keywords: plantsheavy metalstransportersP1B-ATPases
重金属广泛存在于自然和农业环境中[1]。铜(Cu)、锌(Zn) 和锰(Mn) 等是植物代谢所必需的微量营养元素,但植物体内若存在过量积累,便会产生毒性抑制植物生长发育。非必需金属如镉(Cd)、铅(Pb)、汞(Hg) 等则具有剧毒,对植物产生危害[2]。植物自身存在着维持体内金属离子浓度平衡的调节系统,重金属转运蛋白是其中重要的组成部分。重金属转运蛋白分为吸收蛋白(Metal uptake proteins) 和排出蛋白(Metal efflux proteins) 两大类。其中,吸收蛋白主要有:黄色条纹转运(Yellow stripe-like transporter,YSL) 蛋白家族、锌铁蛋白(ZRT/IRT-like protein,ZIP) 家族、天然抗性巨噬细胞蛋白家族(Natural resistance associated macrophage protein,NRAMP) 等,主要位于细胞质膜上,其功能是将重金属转运至细胞质;排出蛋白包括P1B型ATPases、阴离子扩散促进子(Cation diffusion facilitator family,CDF) 蛋白家族等,其功能是将重金属排出细胞质,或运载至液泡。P型ATP酶是一大类完整的膜蛋白家族,它们利用ATP水解的能量跨膜运输阳离子和脂质。P1B-ATPases是P-ATPase多个亚族中唯一参与重金属稳态的转运蛋白,存在于根吸收、根向叶的运输和液泡的螯合等关键过程中[3]。
P1B-ATPases广泛存在于各种生物中,在植物中利用水解ATP获得能量,主动运输重金属离子穿过脂质双层膜[4]。P1B-ATPases可以运输植物必需的金属离子,如Cu+、Cu2+、Zn2+和Co2+等,为植物生长提供稳定的离子输送。P1B-ATPases还能转运一些重金属离子,如Cd2+、Pb2+等,在植物遭遇重金属毒害时,对重金属的吸收、转运与解毒具有重要作用[5]。分析P1B-ATPases在植物中的作用机制与功能,对植物体内金属离子的转运以及抵御重金属胁迫的研究具有重要的指导意义。因此,本文概述了P1B-ATPases的结构、分类、作用机制,并就目前对P1B-ATPases功能的研究进行了综述,以期为未来P1B-ATPases在改良作物品质以及生态环境治理的研究及应用方面提供参考。
1 P1B-ATPases的结构和分类P1B-ATPases基因广泛存在于植物当中,如低等植物绿藻Chlamydomonas reinhardtii中存在3个基因即CrHMA1–3,红藻Chlamydomonas reinhardtii中存在2个基因即CmHMA1和CmHMA2[6]。在高等植物水稻Oryza sativa L.中发现9个基因为OsHMA1–9,玉米Zea mays L.和高粱Sorghum bicolor L. Moench中分别发现11个基因为ZmHMA1–11和SbHMA1–11[7]。在双子叶模式作物拟南芥Arabidopsis thaliana中发现8个基因为AtHMA1–8[8],在大豆Glycine max L. 中发现9个基因为GmHMA1–9[9]。
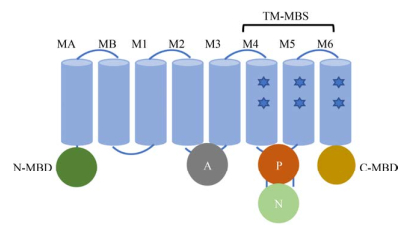
1.1 P1B-ATPases的结构P1B-ATPases的结构一般包括结构域(M)、3个功能域(A、P、N) 以及N-和C-末端可溶性金属结合域(Metal binding domain,MBD)[10] (图 1)。
 |
| 图 1 P1B-ATPases的结构示意图 Fig. 1 Schematic overview of the structural organization of P1B-ATPases. |
| 图选项 |
核心的M结构域中有6个基底跨膜区段(M1–M6),在此之前还存在2个特有的跨膜区段(MA、MB),共8个跨膜区段,与其他P-ATPases相比跨膜片段较少。其中M4、M5、M6 3个螺旋上存在保守氨基酸形成的跨膜金属结合位点(Transmembrane metal binding sites,TM-MBS),TM-MBS具有底物特异性,仅向一侧开放,且与运输方向一致[5]。M结构域组成催化亚基,在其中间含有待运输配体的结合位点。结构域的小部分暴露于膜的胞质外侧,重金属通过暴露于细胞质的半通道进入M结构域,与M4和M6中侧链的重金属离子配位。
A功能域(Actuator domain) 位于M2和M3之间,P功能域(Phosphorylation domain) 和N功能域(Nucleotide-binding domain) 位于M3和M4之间,N功能域插入P功能域,并且连接的两条链非常接近,使得N结构域可以上下移动[11]。
1.2 P1B-ATPases的分类根据M结构域中的底物特异性和M4、M5、M6这3个跨膜金属结合位点上的保守氨基酸序列的不同(图 2A),可将P1B-ATPases分为P1B-1-P1B-7共7个亚组[12]。其中,P1B-3、P1B-5、P1B-6和P1B-7仅在原核生物中存在,P1B-1是唯一在动物中发现的亚组,而P1B-1、P1B-2和P1B-4亚组存在于植物中[13]。以模式植物拟南芥为例,根据基因序列分析发现,在拟南芥中P1B-ATPases存在8个HMA[14]。其中HMA1属于P1B-4亚类,HMA2–4属于P1B-2亚类,HMA5–8属于P1B-1亚类。P1B-1- ATPases主要负责转运Cu,其特征在于M4中的CPC基序,M5中的YN (X)4P基序和M6中的MXXSS基序(其中“X”可以是任何残基)。P1B-2-ATPases负责转运Zn和Cd,在M4中具有CPC基序,在M5中具有保守的K,在M6中具有DXG基序,且含有独有的C-MBD。P1B-4-ATPases则具有广泛的转运特异性,可以转运Zn、Cu以及其他重金属,其特征在于M4中的SPC基序和M6中的HEGT基序[15]。M4、M6参与金属配位如图 2B所示。P1B-1-ATPases中的Cu由3个S原子配位,存在于M4的CPC基序和M6的MXXS基序中,与Cu的配位结合位点形如三角结构。在P1B-2-ATPases和P1B-4-ATPases中,Zn除与M4中的2个S原子配位之外,还涉及M6中的O和N原子,使Zn存在于四面体结构的配位中[10]。
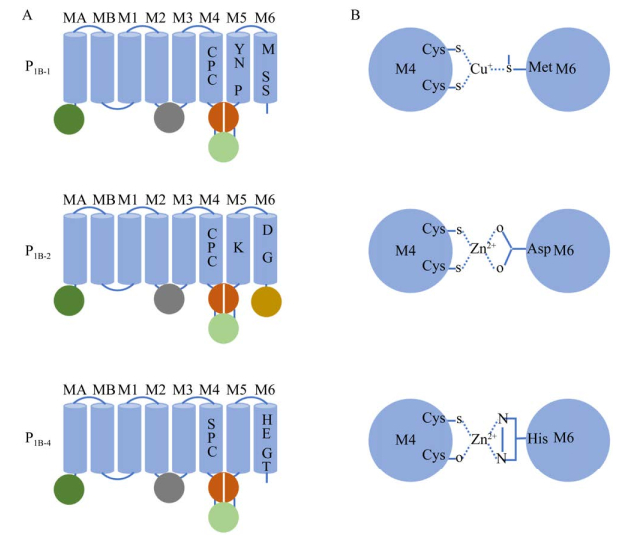 |
| 图 2 P1B-1、P1B-2和P1B-4 ATP酶中金属配位的结构组织和特征序列[16] Fig. 2 Structural organization and signature sequences for metal coordination in P1B-1, P1B-2 and P1B-4 ATPases[16]. (A) P1B-1, P1B-2 and P1B-4-ATPases transmembrane domains structure are shown in blue, N-terminal metal binding domain (MBD) is shown in dark green, A domain is shown in purple, P domain is displayed in orange, the N domain is displayed in light green, and the C-terminal MBD is displayed in brown (only present in P1B-2-ATPase). (B) Schematic diagram of residues in M4 and M6 that are supposed to participate in metal coordination. In P1B-1-ATPase, it is the two Cys residues of the CPC motif in M4 and the conserved Met of M6, which together coordinate Cu+ in the triangle coordination geometry. In P1B-2-ATPase, it is the Cys residue in the CPC motif in M4 and the conserved Asp in M6, which coordinate Zn2+ together in tetrahedral coordination. In P1B-4, the metal binding mechanism may involve the Cys residues of the SPC motif in M4, and may include the backbone carbonyl oxygen of Ser and the conserved His of M6. |
| 图选项 |
2 P1B-ATPases的作用机制P1B-ATPases通过形成和分裂共价磷酸酶中间体,并与离子跨膜易位的构象变化相结合,以ATP为供能来建立电化学梯度。Bublitz等[17]指出了P1B-ATPases与E1、E2状态有关的功能周期,表明E1/E2循环遵循膜转运蛋白的“交替进入”转运机制(图 3)。P1B-ATPases在P功能域上存在保守的天冬氨酸残基,通过瞬时磷酸酶中间体进行自动磷酸化和自动去磷酸化,其磷酸化将能量引入分子中,并导致主要的构象发生变化[4]。
 |
| 图 3 Post-Albers循环 Fig. 3 The Post-Albers cycle. The Post-Albers cycle passes through the conformational changes (arrows) of the soluble and transmembrane domains, allowing the transport compound to alternately enter the cell and the cell. The E1 state has a high affinity for the output ion (yellow) and is occluded and phosphorylated (E1P), while in the E2P state the counterion (purple) combines with dephosphorylation and reocclusion (E2P and E2), and then returns to the next transport cycle. |
| 图选项 |
在磷酸化前为E1状态,M结构域的功能位点可以自由地接受配体,对其配体具有高亲和性,并在细胞膜内部进行离子交换。排出的离子刺激ATP驱动保守天冬氨酸残基进行自动磷酸化,从而导致E1-P状态,跨膜转运路径关闭。从ATP中释放出γ-磷酸盐后,转运路径开放,从高亲和E1-P态转换为低亲和E2-P态。逆转运离子与膜位点的结合刺激了转运路径的重新关闭,产生了E2状态。同时,N结构域从磷酸化位点脱离并向P功能域移动,为A功能域提供空间以将磷酸化的P功能域去磷酸化,将低亲和的E2状态还原为高亲和的E1态,从而启动一个新的反应周期[18]。
3 P1B-ATPases的功能过去几十年以来研究者已在各种模式植物中鉴定了多种HMA基因,并验证了其功能。最近几年对P1B-ATPases的功能研究重点主要集中在利用模式植物的研究成果鉴定其他植物中存在的HMA基因,然后验证其功能。
3.1 P1B-1-ATPases的功能P1B-1-ATPases在植物中广泛存在,主要作用是维持植物体内Cu离子浓度的稳定。如拟南芥中的AtHMA5至AtHMA8、水稻中的OsHMA4– OsHMA9、甘蓝型油菜Brassica napus中的BnRAN1等均属于P1B-1-ATPases[19]。
AtHMA5至AtHMA8在M4的保守基序是CPC基序。其中AtHMA5和AtHMA7在N端有2个HMA-RD,基因序列同源性较高,而AtHMA6和AtHMA8在N端只有1个HMA-RD[15]。Kobayashi等[20]研究发现AtHMA5是唯一一个位于质膜中的P1B-ATPases (图 4),且主要表达在根部,通过从细胞质中输出Cu离子而缓解其毒害作用。Andrés-Colás等[21]研究发现,含有AtHMA5 T-DNA的突变植株表现出了对Cu的超敏性,且在根部表现尤为明显,也表明了AtHMA5在根的缓解Cu的毒害中发挥作用。Li等[22]研究表明,Cu的高耐受性与HMA5基因在拟南芥中的表达增强有关,HMA5定位于内质网中,当植物所在的外部环境具有高浓度Cu时会降解、迁移到质膜上。
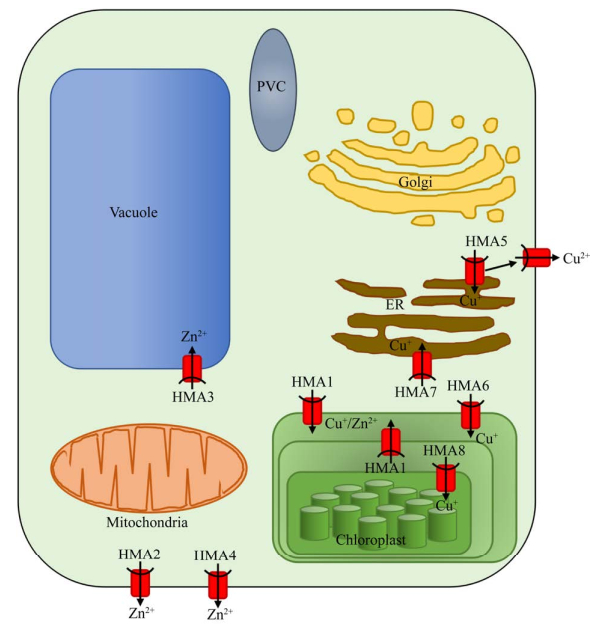 |
| 图 4 拟南芥中P1B-ATP酶亚细胞定位的示意图[16] Fig. 4 Schematic overview of subcellular localization of P1B-ATPase in Arabidopsis thaliana[16]. |
| 图选项 |
AtHMA7/RAN1是植物中第一个在功能上被表征的P1B-ATPases,因在乙烯拮抗剂中对乙烯三重反应呈阳性,因此也被命名为响应拮抗(Responsive to antagonist,RAN1),主要作用是将Cu输入至内质网中以合成乙烯受体[23]。AtHMA7/RAN1通过与反式环辛烯(一种乙烯拮抗剂) 相互作用来调节乙烯的信号传导,反式环辛烯的乙烯受体是Cu依赖性蛋白,且负责Cu在乙烯信号通路中的作用[24]。del Pozo等[25]研究发现经Cu处理后拟南芥内AtHMA7/RAN1的转录水平明显改变,表明AtHMA7/RAN1是防止植物体内Cu离子过量的重要基因。这与Baloun等[26]的研究结果表现一致,证明HMA7是铜诱导的基因,并在协调植物体内的Cu离子水平中起重要作用。Woeste等[27]对遗传通路分析发现,AtHMA7/RAN1作用于乙烯受体基因家族中突变的上游,揭示了AtHMA7/RAN1对于乙烯信号通路的重要性。
AtHMA6/PAA1和AtHMA8/PAA2是密切相关的一对P1B-ATPase,是位于叶绿体上的高亲和Cu转运蛋白(图 4),控制叶绿体对Cu的吸收并将Cu输送至叶绿体基质和类囊体中,以维持光合和抗氧化的作用[28]。但AtHMA6/PAA1和AtHMA8/ PAA2的生化特性不同,其中AtHMA8/PAA2对Cu的亲和力高于AtHMA6/PAA1[29]。AtHMA6/PAA1负责将Cu向叶绿体内转运,这为基质中的铜/锌超氧化物歧化酶(Cu/Zn SOD) 提供了辅因子[30],之后用于Cu/Zn SOD的铜分子伴侣(CCS) 负责将Cu递送至Cu/Zn SOD,后将Cu递送至HMA8再转运至内囊体内[31]。de Pozo等[25]研究发现,AtHMA6/PAA1和AtHMA8/PAA2在暴露于高浓度Cu的植物的叶中表达被下调,这可能是减少Cu离子含量、维持类囊体功能机制中的一部分。这与Tapken等[32]对拟南芥的研究中Cu过量会引起AtHMA8/PAA2降解的结果一致。相反,在缺少Cu的环境中,AtHMA8/PAA2表现上调,表明叶绿体的功能需要适量的Cu维持[25]。当AtHMA6/PAA1和AtHMA8/PAA2下调时,均会导致光合电子传递过程的损伤[19]。
在水稻中的研究表明,OsHMA5拥有与AtHMA5类似的作用。Deng等[33]研究表明,OsHMA5将Cu带入到根的木质部中,从而将Cu长距离运输到地上部。Huang等[34]研究发现,OsHMA4的功能是将Cu吸附到根的液泡中,从而减少Cu在籽粒中的积累。高浓度的Cu可显著诱导OsHMA6和OsHMA9的表达。Zou等[35]、Lee等[36]运用qRT-PCR技术分别对OsHMA6和OsHMA9的研究表明,OsHMA6和OsHMA9均定位在质膜中,具有较高的Cu离子转运活性,若敲除则会降低水稻对高浓度Cu的耐受性。其中,OsHMA6在穗、叶片和根中均有高度表达,但OsHMA9在根中表达最强,在穗中表达极弱[35]。
3.2 P1B-2-ATPases的功能HMA2–4在拟南芥中属于P1B2-ATPases的亚类,对镉、铅等有毒重金属的转运起着重要作用[37]。
3.2.1 HMA2和HMA4的功能AtHMA2和AtHMA4的一级序列拥有很高的相似度,均负责将Zn和Cd转运至木质部中,有助于锌和镉从根到叶的长距离运输。当植物被敲除HMA2、HMA4基因时,便会出现叶片发黄、发育不良等现象[38]。Wong等[39]研究发现,敲除HMA2和HMA4基因的拟南芥,根冠间Cd的转移几乎完全消失,表明HMA2和HMA4是负责植物根冠间Cd转运的主要因素。在烟草中也鉴定出两个AtHMA2、AtHMA4的直系同源物,当两个基因都敲除时植株出现了明显的Zn缺乏症状[40]。
Mills等[41]在大麦中研究HvHMA2的功能特性,发现HvHMA2的表达可以改善hma2 hma4突变体缺Zn的症状,结果表明HvHMA2具有提高缺Zn环境中植物对Zn转运能力的作用。Guo等[42]研究发现,当缺少HMA2基因时,植物表现出了对Cd的高敏感性,生长发育迟缓,木质部中Cd和Zn含量也会显著降低,从而导致Cd和Zn的根冠间易位显著降低,说明HMA2不仅负责Cd从根到茎的转运,提高植物Cd耐受性,还参与调节Zn转运系统,从而有助于维持Zn含量的稳定。
Ma等[43]研究发现,当小麦遭受锑(Sb) 胁迫时会诱导重金属进入质外体或液泡中,此时小麦中的HMA2表现上调,与叶中总Sb浓度呈显著正相关,表明HMA2基因对Sb转运的调节有重要作用。Wong等[44]通过针对HMA2的转基因突变体材料研究发现,HMA2中的N-MBD对植物的重金属转运是必不可少的,而C-MBD虽然与转运关系较不密切,但可能含有重要的对蛋白质亚细胞定位的信号。
HMA4是Zn/Cd/Co/Pb亚类中第一个被克隆和表征的基因[45],它在维持Zn离子浓度稳定的系统中处于一个关键的位置,其表达水平的微小变化都会对Zn在植物根、茎、叶中的转运与分配产生重要影响[46]。
拟南芥中AtHMA4在根中的表达要比叶中高,并且在植物受到高浓度重金属离子刺激时,受Zn和Mn的影响而上调,受Cd的影响而下调[47]。GUS定位的研究表明,HMA4可能将Zn从根部维管组织周围的细胞中运出[48]。Hanikenne等[49]通过下调HMA4的表达,证明HMA4对鼠耳芥的Zn积累以及对Cd的高耐受有着重要作用,之后再将HMA4基因导入鼠耳芥中,证明HMA4参与了Zn/Cd木质部的转运过程。
黄瓜中的CsHMA4基因在根和花中表达丰富。Migocka等[50]研究发现在Zn和Pb过量时表达增加,而在Zn缺乏时基因表达出现显著下降,表明CsHMA4在维持Zn含量稳定和缓解Pb胁迫中有着重要的作用。HMA4在甘蓝型油菜也有相关报道。Wu等[51]的研究表明,根中HMA2和HMA4是导致甘蓝型油菜中Cd从根到茎高效转运的原因,但尚未确定影响的同源基因。在此基础上,Zhang等[52]研究发现,HMA4的同源基因BnaHMA4是油菜籽中镉从根转移到叶的关键基因。
3.2.2 HMA3的功能HMA3在不同作物中的表达位置不同,在拟南芥、水稻、烟草中主要定位于根部的液泡膜中。Morel等[53]研究发现,拟南芥中的AtHMA3定位于液泡膜上(图 4),不仅在根尖有高水平的表达,在保卫细胞、排水器和维管组织中也有少量表达,且AtHMA3的过表达提高了拟南芥对Zn、Cd、Co、Pb的耐受性。Chao等[54]研究发现,当拟南芥中的AtHMA3功能缺失时,会引起植物体内Cd的高度积累,证明AtHMA3通过参与液泡螯合调节Cd的积累。
Miyadate等[55]在水稻中的研究也证实了这个结论,当水稻缺乏OsHMA3时,根部细胞的木质部中会存在更多的Cd,结果导致过量的Cd转运到了叶,表明水稻中镉的转运、积累与OsHMA3基因引起的液泡螯合关系密切。Byeon等[56]研究发现,当水稻处于Cd胁迫时,OsHMA3基因出现明显上调,猜测HMA3基因可能负责螯合Cd到根细胞的液泡中。Wang等[57]证实了这个结论,通过对Cd胁迫下的烟草进行基因表达测定,发现HMA3通过将Cd转运至根细胞的液泡膜中,将其螯合于根的液泡中,从而限制Cd从根到茎的转移,有效降低Cd胁迫对植物的损害。
大豆的GmHMA3主要在根部的内质网中实现高表达。Wang等[58]研究发现,GmHMA3的过表达不会改变整个植物中的Cd含量,而是将Cd螯合到根内质网中,从而限制了Cd从根向茎的转运[9]。遏蓝菜Thlaspi caerulescens的TcHMA3基因则是在叶片的液泡膜中高表达。Ueno等[59]研究表明,TcHMA3通过将Cd螯合到叶片的液泡中而在Cd的解毒中起重要作用,从而促进Cd的过度积累以及提高植物对Cd的耐受性。Guo等[47]从黑麦草Festulolium loliaceum中分离出FlHMA3,发现其包含与水稻OsHMA3具有77%同源性的833个氨基酸残基,Cd通过F1HMA3螯合到根细胞的液泡,抑制Cd进入细胞质,从而降低了Cd毒性。以及随着外界环境中的Cd浓度与黑麦草根、叶中的含量呈正相关,提出可以考虑使用黑麦草用于Cd污染土壤的修复。
3.3 P1B-4-ATPases的功能HMA1属于P1B-4-ATPase,在所有P1B-ATPases家族中具有最简单的结构。HMA1具有广泛的金属特异性,在Zn、Cu、Co、Ca等多种重金属的转运中都起着重要作用[60]。拟南芥中的AhHMA1在地上部的表达量高于根部,且在地上部的表达量容易受高浓度Zn的诱导而升高[61]。
大部分HMA1定位于叶绿体被膜上。在叶绿体中,铜的转运除了由HMA6和HMA8介导之外,也可以通过HMA1转运[62]。此外,HMA1与另外两种Zn转运蛋白HMA2和HMA4具有类似的氨基酸序列,含有Zn结合蛋白中普遍存在的Poly-His基序,因此,在高浓度Zn条件下,HMA1可以降低拟南芥中Zn的含量,从而缓解过量的Zn带来的毒害作用[63]。
hma1缺失突变体的叶绿体中的Cu比野生型的含量更低,Cu/Zn SOD活性也出现显著降低,Argüello等[64]推测AtHMA1主要是将Cu转运给Cu/Zn SOD。Higuchi等[65]研究表明,由于hma1缺失突变体的Cu/Zn SOD含量降低,产生了过量的活性氧,因此突变体在强光条件下出现了强光敏性。说明植物若处在高光强环境下,AtHMA1可以在此条件下将Cu转运至叶绿体蛋白或高活性酶分子,为抵御高光强胁迫作出贡献。
Mikkelsen等[66]研究发现大麦的HvHMA1定位于叶片叶绿体边缘和糊粉层细胞内,叶片中HvHMA1的表达受Zn、Cu、Cd的影响而降低。但HvHMA1在籽粒中的表达明显高于叶片,HvHMA1的下调对叶片Zn和Cu含量没有影响,但使籽粒Zn和Cu含量显著增加,因此猜测HvHMA1可能参与了籽粒萌发过程中糊粉层细胞的Zn、Cu转运。伴矿景天Sedum plumbizincicola的地上部易过度积累非必需且剧毒的重金属Cd,Zhao等[67]研究表明,SpHMA1在叶绿体中高度表达,以使叶绿体中的Cd高效排毒,抑制Cd的过量积累,维持胁迫下叶片的光合作用。
4 展望近些年来,虽然对P1B-ATPases的研究较多,但仍然有很多方面不清楚。如在其结构上P1B-ATPases的末端MBD尚不足以在晶体结构中观察到,但该问题有望随着膜蛋白的高分辨率冷冻电子显微镜的出现而解决。其次P1B-ATPases家族成员众多,虽具有相似的氨基酸序列和功能,但细微的结构差异都能使其作用机制产生不同,并且在不同作物中也存在差异[34],这说明并不容易直接将获得的序列转移到其他植物物种中。最后,随着测序基因组库的增加,对植物P1B-ATPase起源的见识正在积累,但是关于植物P1B-2和P1B-4-ATPase的起源仍然不清楚。
根系是重金属离子吸收和运输的主要器官,叶片是重金属离子的主要储存位点。并且重金属(如Cd) 可以通过取代光收集复合物Ⅱ中与叶绿素结合的Mg来抑制光合作用,从而导致光化学效率的损失。现如今,很多关于hma突变体的研究,如BraA.hma4a-3突变体可以有效增加Zn的积累,且在Zn过量产生毒性时,使植物具有更好的Zn胁迫耐受性[68]。因此,对于重金属耐受性低的作物,可研究如何利用P1B-ATPases提高其耐受性,进行生物强化。同时,可以利用植物在地上部组织中积累重金属的能力,以植物修复的方法从土壤中去除重金属,如景天[67]和杨树[69]。
参考文献
| [1] | Snow DD, Cassada DA, Bartelt–Hunt S L, et al. Detection, occurrence and fate of emerging contaminants in agricultural environments. Water Environ Res, 2012, 84(10): 764-785. DOI:10.2175/106143012X13407275694635 |
| [2] | Williams LE, Pittman JK, Hall JL. Emerging mechanisms for heavy metal transport in plants. Biochim Biophys Acta (BBA)-Biomembranes, 2000, 1465(1/2): 104-126. |
| [3] | Rascio N, Navari-Izzo F. Heavy metal hyperaccumulating plants: how and why do they do it? And what makes them so interesting?. Plant Sci, 2011, 180(2): 169-181. DOI:10.1016/j.plantsci.2010.08.016 |
| [4] | Palmgren MG, Nissen P. P-type ATPases. Ann Rev Biophys, 2011, 40: 243-266. DOI:10.1146/annurev.biophys.093008.131331 |
| [5] | Argüello JM, Eren E, González-Guerrero M. The structure and function of heavy metal transport P1B-ATPases. Biometals, 2007, 20(3/4): 233-248. |
| [6] | Blaby-Haas CE, Merchant SS. The ins and outs of algal metal transport. Biochim Biophys Acta (BBA)- Mol Cell Res, 2012, 1823(9): 1531-1552. DOI:10.1016/j.bbamcr.2012.04.010 |
| [7] | Zhiguo E, Li TT, Chen C, et al. Genome-wide survey and expression analysis of P1B-ATPases in rice, maize and sorghum. Rice Sci, 2018, 25(4): 208-217. DOI:10.1016/j.rsci.2018.06.004 |
| [8] | Zorrig W, Abdelly C, Berthomieu P. The phylogenetic tree gathering the plant Zn/Cd/Pb/Co P1B-ATPases appears to be structured according to the botanical families. Compt Rend Biol, 2012, 334(12): 863-871. |
| [9] | Wang Y, Wang C, Liu YJ, et al. GmHMA3 sequesters Cd to the root endoplasmic reticulum to limit translocation to the stems in soybean. Plant Sci, 2018, 270: 23-29. DOI:10.1016/j.plantsci.2018.02.007 |
| [10] | Omasits U, Ahrens CH, Müller S, et al. Protter: interactive protein feature visualization and integration with experimental proteomic data. Bioinformatics, 2014, 30(6): 884-886. DOI:10.1093/bioinformatics/btt607 |
| [11] | M?ller JV, Olesen C, Winther AML, et al. What can be learned about the function of a single protein from its various X-ray structures: the example of the sarcoplasmic calcium pump. Lacapère JJ, ed. Membrane Protein Structure Determination. Totowa, NJ: Humana Press, 2010: 119-140. |
| [12] | Argu'ello JM, González-Guerrero M, Raimunda D. Bacterial transition metal P1B-ATPases: transport mechanism and roles in virulence. Biochemistry, 2011, 50(46): 9940-9949. DOI:10.1021/bi201418k |
| [13] | Smith AT, Smith KP, Rosenzweig AC. Diversity of the metal-transporting P1B-type ATPases. JBIC J Biol Inorgan Chem, 2014, 19(6): 947-960. DOI:10.1007/s00775-014-1129-2 |
| [14] | Axelsen KB, Palmgren MG. Inventory of the superfamily of P-type ion pumps in Arabidopsis. Plant Physiol, 2001, 126(2): 696-706. DOI:10.1104/pp.126.2.696 |
| [15] | Williams LE, Mills RF. P1B-ATPases—an ancient family of transition metal pumps with diverse functions in plants. Trends Plant Sci, 2005, 10(10): 491-502. DOI:10.1016/j.tplants.2005.08.008 |
| [16] | ?sterberg JT, Palmgren M. Heavy metal pumps in plants: structure, function and origin. Adv Botanical Res, 2018, 87: 57-89. |
| [17] | Bublitz M, Poulsen H, Morth JP, et al. In and out of the cation pumps: P-type ATPase structure revisited. Curr Opin Struct Biol, 2010, 20(4): 431-439. DOI:10.1016/j.sbi.2010.06.007 |
| [18] | Mattle D, Sitsel O, Autzen HE, et al. On allosteric modulation of P-Type Cu+-ATPases. J Mol Biol, 2013, 425(13): 2299-2308. DOI:10.1016/j.jmb.2013.03.008 |
| [19] | Abdel-Ghany SE, Müller-Moulé P, Niyogi KK, et al. Two P-type ATPases are required for copper delivery in Arabidopsis thaliana chloroplasts. Plant Cell, 2005, 17(4): 1233-1251. DOI:10.1105/tpc.104.030452 |
| [20] | Kobayashi Y, Kuroda K, Kimura K, et al. Amino acid polymorphisms in strictly conserved domains of a P-type ATPase HMA5 are involved in the mechanism of copper tolerance variation in Arabidopsis. Plant Physiol, 2008, 148(2): 969-980. DOI:10.1104/pp.108.119933 |
| [21] | Andrés-Colás N, Sancenón V, Rodríguez-Navarro S, et al. The Arabidopsis heavy metal P-type ATPase HMA5 interacts with metallochaperones and functions in copper detoxification of roots. Plant J, 2006, 45(2): 225-236. DOI:10.1111/j.1365-313X.2005.02601.x |
| [22] | Li YB, Iqbal M, Zhang QQ, et al. Two Silene vulgaris copper transporters residing in different cellular compartments confer copper hypertolerance by distinct mechanisms when expressed in Arabidopsis thaliana. New Phytol, 2017, 215(3): 1102-1114. DOI:10.1111/nph.14647 |
| [23] | Li WB, Lacey RF, Ye YJ, et al. Triplin, a small molecule, reveals copper ion transport in ethylene signaling from ATX1 to RAN1. PLoS Genet, 2017, 13(4): e1006703. DOI:10.1371/journal.pgen.1006703 |
| [24] | Himelblau E, Amasino RM. Nutrients mobilized from leaves of Arabidopsis thaliana during leaf senescence. J Plant Physiol, 2001, 158(10): 1317-1323. DOI:10.1078/0176-1617-00608 |
| [25] | del Pozo T, Cambiazo V, González M. Gene expression profiling analysis of copper homeostasis in Arabidopsis thaliana. Biochem Biophys Res Commun, 2010, 393(2): 248-252. DOI:10.1016/j.bbrc.2010.01.111 |
| [26] | Baloun J, Nevrtalova E, Kovacova V, et al. Characterization of the HMA7 gene and transcriptomic analysis of candidate genes for copper tolerance in two Silene vulgaris ecotypes. J Plant Physiol, 2014, 171(13): 1188-1196. DOI:10.1016/j.jplph.2014.04.014 |
| [27] | Woeste KE, Kieber JJ. A strong loss-of-function mutation in RAN1 results in constitutive activation of the ethylene response pathway as well as a rosette-lethal phenotype. Plant Cell, 2000, 12(3): 443-455. DOI:10.1105/tpc.12.3.443 |
| [28] | Catty P, Boutigny S, Miras R, et al. Biochemical characterization of AtHMA6/PAA1, a chloroplast envelope Cu (Ⅰ)-ATPase. J Biol Chem, 2011, 286(42): 36188-36197. DOI:10.1074/jbc.M111.241034 |
| [29] | Sautron E, Mayerhofer H, Giustini C, et al. HMA6 and HMA8 are two chloroplast Cu+-ATPases with different enzymatic properties. Biosci Rep, 2015, 35(3): e00201. DOI:10.1042/BSR20150065 |
| [30] | Zhang YY, Chen K, Zhao FJ, et al. OsATX1 interacts with heavy metal P1B-type ATPases and affects copper transport and distribution. Plant Physiol, 2018, 178(1): 329-344. DOI:10.1104/pp.18.00425 |
| [31] | Aguirre G, Pilon M. Copper delivery to chloroplast proteins and its regulation. Front Plant Sci, 2016, 6: 1250. DOI:10.3389/fpls.2015.01250/pdf |
| [32] | Tapken W, Kim J, Nishimura K, et al. The Clp protease system is required for copper ion-dependent turnover of the PAA2/HMA8 copper transporter in chloroplasts. New Phytol, 2015, 205(2): 511-517. DOI:10.1111/nph.13093 |
| [33] | Deng FL, Yamaji N, Xia JX, et al. A member of the heavy metal P-type ATPase OsHMA5 is involved in xylem loading of copper in rice. Plant Physiol, 2013, 163(3): 1353-1362. DOI:10.1104/pp.113.226225 |
| [34] | Huang XY, Deng FL, Yamaji N, et al. A heavy metal P-type ATPase OsHMA4 prevents copper accumulation in rice grain. Nat Commun, 2016, 7: 12138. DOI:10.1038/ncomms12138 |
| [35] | Zou WL, Li C, Zhu YJ, et al. Rice heavy metal P-type ATPase OsHMA6 is likely a copper efflux protein. Rice Sci, 2020, 27(2): 143-151. DOI:10.1016/j.rsci.2020.01.005 |
| [36] | Lee S, Kim YY, Lee Y, et al. Rice P1B-type heavy-metal ATPase, OsHMA9, is a metal efflux protein. Plant Physiol, 2007, 145(3): 831-842. DOI:10.1104/pp.107.102236 |
| [37] | Takahashi R, Bashir K, Ishimaru Y, et al. The role of heavy-metal ATPases, HMAs, in zinc and cadmium transport in rice. Plant Signal Behavior, 2012, 7(12): 1605-1607. DOI:10.4161/psb.22454 |
| [38] | Hussain D, Haydon MJ, Wang YW, et al. P-Type ATPase heavy metal transporters with roles in essential zinc homeostasis in Arabidopsis. Plant Cell, 2004, 16(5): 1327-1339. DOI:10.1105/tpc.020487 |
| [39] | Wong CKE, Cobbett CS. HMA P-type ATPases are the major mechanism for root-to-shoot Cd translocation in Arabidopsis thaliana. New Phytol, 2010, 181(1): 71-78. |
| [40] | Hermand V, Julio E, De Borne FD, et al. Inactivation of two newly identified tobacco heavy metal ATPases leads to reduced Zn and Cd accumulation in shoots and reduced pollen germination. Metallomics, 2014, 6(8): 1427-1440. DOI:10.1039/C4MT00071D |
| [41] | Mills RF, Peaston KA, Runions J, et al. HvHMA2, a P1B-ATPase from barley, is highly conserved among cereals and functions in Zn and Cd transport. PLoS ONE, 2012, 7(8): e42640. DOI:10.1371/journal.pone.0042640 |
| [42] | Guo Q, Tian XX, Mao PC, et al. Functional characterization of IlHMA2, a P1B2-ATPase in Iris lactea response to Cd. Environ Exp Bot, 2019, 157: 131-139. DOI:10.1016/j.envexpbot.2018.10.008 |
| [43] | Ma CL, He MC, Zhong QY, et al. Uptake, translocation and phytotoxicity of antimonite in wheat (Triticum aestivum). Sci Total Environ, 2019, 669: 421-430. DOI:10.1016/j.scitotenv.2019.03.145 |
| [44] | Wong CKE, Jarvis RS, Sherson SM, et al. Functional analysis of the heavy metal binding domains of the Zn/Cd-transporting ATPase, HMA2, in Arabidopsis thaliana. New Phytol, 2009, 181(1): 79-88. DOI:10.1111/j.1469-8137.2008.02637.x |
| [45] | Mills RF, Krijger GC, Baccarini PJ, et al. Functional expression of AtHMA4, a P1B-type ATPase of the Zn/Co/Cd/Pb subclass. Plant J, 2010, 35(2): 164-176. |
| [46] | Nouet C, Charlier JB, Carnol M, et al. Functional analysis of the three HMA4 copies of the metal hyperaccumulator Arabidopsis halleri. J Exp Bot, 2015, 66(19): 5783-5795. DOI:10.1093/jxb/erv280 |
| [47] | Courbot M, Willems G, Motte P, et al. A major quantitative trait locus for cadmium tolerance in Arabidopsis halleri colocalizes with HMA4, a gene encoding a heavy metal ATPase. Plant Physiol, 2006, 144(2): 1052-1065. |
| [48] | Verret F, Gravot A, Auroy P, et al. Overexpression of AtHMA4 enhances root-to-shoot translocation of zinc and cadmium and plant metal tolerance. FEBS Lett, 2004, 576(3): 306-312. DOI:10.1016/j.febslet.2004.09.023 |
| [49] | Hanikenne M, Talke IN, Haydon MJ, et al. Evolution of metal hyperaccumulation required cis-regulatory changes and triplication of HMA4. Nature, 2008, 453(7193): 391-395. DOI:10.1038/nature06877 |
| [50] | Migocka M, Papierniak A, Maciaszczyk-Dziubinska E, et al. Molecular and biochemical properties of two P1B2-ATPases, CsHMA3 and CsHMA4, from cucumber. Plant Cell Environ, 2015, 38(6): 1127-1141. DOI:10.1111/pce.12447 |
| [51] | Wu ZC, Zhao XL, Sun XC, et al. Xylem transport and gene expression play decisive roles in cadmium accumulation in shoots of two oilseed rape cultivars (Brassica napus). Chemosphere, 2015, 119: 1217-1223. DOI:10.1016/j.chemosphere.2014.09.099 |
| [52] | Zhang FG, Xiao X, Wu XM. Physiological and molecular mechanism of cadmium (Cd) tolerance at initial growth stage in rapeseed (Brassica napus L. Ecotoxicol Environ Saf, 2020, 197: 110613. DOI:10.1016/j.ecoenv.2020.110613 |
| [53] | Morel M, Crouzet J, Gravot A, et al. AtHMA3, a P1B-ATPase allowing Cd/Zn/Co/Pb vacuolar storage in Arabidopsis. Plant Physiol, 2009, 149(2): 894-904. DOI:10.1104/pp.108.130294 |
| [54] | Chao DY, Silva A, Baxter I, et al. Genome-wide association studies identify heavy metal ATPase3 as the primary determinant of natural variation in leaf cadmium in Arabidopsis thaliana. PLoS Genet, 2012, 8(9): e1002923. DOI:10.1371/journal.pgen.1002923 |
| [55] | Miyadate H, Adachi S, Hiraizumi A, et al. OsHMA3, a P1B-type of ATPase affects root-to-shoot cadmium translocation in rice by mediating efflux into vacuoles. New Phytol, 2011, 189(1): 190-199. DOI:10.1111/j.1469-8137.2010.03459.x |
| [56] | Byeon Y, Lee HY, Hwang OJ, et al. Coordinated regulation of melatonin synthesis and degradation genes in rice leaves in response to cadmium treatment. J Pineal Res, 2015, 58(4): 470-478. DOI:10.1111/jpi.12232 |
| [57] | Wang M, Duan SH, Zhou ZC, et al. Foliar spraying of melatonin confers cadmium tolerance in Nicotiana tabacum L. Ecotoxicol Environ Saf, 2019, 170: 68-76. DOI:10.1016/j.ecoenv.2018.11.127 |
| [58] | Wang Y, Yu KF, Poysa V, et al. A single point mutation in GmHMA3 affects cadimum (Cd) translocation and accumulation in soybean seeds. Mol Plant, 2012, 5(5): 1154-1156. DOI:10.1093/mp/sss069 |
| [59] | Ueno D, Milner MJ, Yamaji N, et al. Elevated expression of TcHMA3 plays a key role in the extreme Cd tolerance in a Cd-hyperaccumulating ecotype of Thlaspi caerulescens. Plant J, 2011, 66(5): 852-862. DOI:10.1111/j.1365-313X.2011.04548.x |
| [60] | Zielazinski EL, Cutsail Ⅲ GE, Hoffman BM, et al. Characterization of a cobalt-specific P1B-ATPase. Biochemistry, 2012, 51(40): 7891-7900. DOI:10.1021/bi3006708 |
| [61] | Purohit R, Ross MO, Batelu S, et al. Cu+-specific CopB transporter: revising P1B-type ATPase classification. Proc Natl Acad Sci USA, 2018, 115(9): 2108-2113. DOI:10.1073/pnas.1721783115 |
| [62] | Boutigny S, Sautron E, Finazzi G, et al. HMA1 and PAA1, two chloroplast-envelope PIB-ATPases, play distinct roles in chloroplast copper homeostasis. J Exp Bot, 2014, 65(6): 1529-1540. DOI:10.1093/jxb/eru020 |
| [63] | Kim YY, Choi H, Segami S, et al. AtHMA1 contributes to the detoxification of excess Zn(Ⅱ) in Arabidopsis. Plant J Cell Mol Biol, 2010, 58(5): 737-753. |
| [64] | Argüello JM, González-Guerrero M. Cu+-ATPases brake system. Structure, 2008, 16(6): 833-834. DOI:10.1016/j.str.2008.05.002 |
| [65] | Higuchi M, Ozaki H, Matsui M, et al. A T-DNA insertion mutant of AtHMA1 gene encoding a Cu transporting ATPase in Arabidopsis thaliana has a defect in the water-water cycle of photosynthesis. J Photochem Photobiol B Biol, 2009, 94(3): 205-213. DOI:10.1016/j.jphotobiol.2008.12.002 |
| [66] | Mikkelsen MD, Pedas P, Schiller M, et al. Barley HvHMA1 is a heavy metal pump involved in mobilizing organellar Zn and Cu and plays a role in metal loading into grains. PLoS ONE, 2012, 7(11): e49027. |
| [67] | Zhao HX, Wang LS, Zhao FJ, et al. SpHMA1 is a chloroplast cadmium exporter protecting photochemical reactions in the Cd hyperaccumulator Sedum plumbizincicola. Plant Cell Environ, 2019, 42(4): 1112-1124. DOI:10.1111/pce.13456 |
| [68] | Blasco B, Navarro-León E, Ruiz JM. Study of Zn accumulation and tolerance of HMA4 TILLING mutants of Brassica rapa grown under Zn deficiency and Zn toxicity. Plant Sci, 2019, 287: 110201. DOI:10.1016/j.plantsci.2019.110201 |
| [69] | Romè C, Huang XY, Danku J, et al. Expression of specific genes involved in Cd uptake, translocation, vacuolar compartmentalisation and recycling in Populus alba villafranca clone. J Plant Physiol, 2016, 202: 83-91. DOI:10.1016/j.jplph.2016.07.009 |
