
 , 崔红娟1,2,5,6
, 崔红娟1,2,5,6

1. 西南大学 家蚕基因组生物学国家重点实验室 蚕桑纺织与生物质科学学院,重庆 400716;
2. 西南大学 医学研究院,重庆 400715;
3. 重庆市第九人民医院 (西南大学附属医院),重庆 400700;
4. 中国科学院大学 重庆医院,重庆 400014;
5. 重庆市蚕丝生物材料与再生医学工程研究中心,重庆 400716;
6. 西南大学肿瘤生物医学与转化工程研究中心,重庆 400715
收稿日期:2020-10-02;接收日期:2021-01-05;网络出版时间:2021-02-07
基金项目:国家自然科学基金(No. 81972357), 重庆市自然科学基金(No. cstc2018jcyjAX0330), 重庆市研究生科研创新项目(No. CYS20139), 西南大学研究生导师团队建设项目(No. XYDS201912) 资助
摘要:替加环素(Tigecycline) 作为一种新型甘氨环素类抗菌药物,其不仅具有抗生素的功能,还具有潜在的抗肿瘤活性。文中对替加环素单独用药、联合用药及其作用机理进行了系统的综述,并进一步阐释了其作为一种线粒体DNA翻译抑制剂,主要通过抑制线粒体蛋白合成和诱发线粒体的功能障碍,进而影响肿瘤细胞的增殖、迁移和侵袭等进程。虽然替加环素单药治疗肿瘤还存在许多争议,但其联合用药的优势还是十分明显的。因此,还需要更多的研究来深度地挖掘替加环素潜在的抗肿瘤活性,争取使其尽早用于肿瘤的临床治疗,有望成为一种廉价高效的抗肿瘤新药物。
关键词:替加环素抗肿瘤活性线粒体障碍联合用药临床试验
Anti-tumor activity of tigecycline: a review
Erhu Zhao1,2,5,6, Xue Wang4, Juanli Ji1,5,6, Zhongze Wang1,5,6, Yi Wang3

 , Hongjuan Cui1,2,5,6
, Hongjuan Cui1,2,5,6

1. College of Sericulture, Textile and Biomass Sciences, State Key Laboratory of Silkworm Genome Biology, Southwest University, Chongqing 400716, China;
2. Cancer Center, Medical Research Institute, Southwest University, Chongqing 400715, China;
3. The No. 9 Hospital of Chongqing (The Affiliated Hospital of Southwest University), Chongqing 400700, China;
4. Chongqing General Hospital, University of Chinese Academy of Sciences, Chongqing 400014, China;
5. Engineering and Technology Research Center for Silk Biomaterials and Regenerative Medicine, Chongqing 400716, China;
6. Engineering Research Center for Cancer Biomedical and Translational Medicine, Southwest University, Chongqing 400715, China
Received: October 2, 2020; Accepted: January 5, 2021; Published: February 7, 2021
Supported by: National Natural Science Foundation of China (No. 81972357), Natural Science Foundation of Chongqing, China (No. cstc2018jcyjAX0330), Chongqing Graduate Science and Technology Innovation Project, China (No. CYS20139), Fundamental Research Funds for the Central Universities, China (No. XYDS201912)
Corresponding author: Hongjuan Cui. Tel: +86-23-68251712; Fax: +86-23-68251128; E-mail: hcui@swu.edu.cn;
Yi Wang. Tel/Fax: +86-23-68865906; E-mail: 3048978619@qq.com.
Abstract: Tigecycline is a novel glycylcycline antibacterial drug, which shows both antibiotic function and anti-tumor activity. This review summarizes the single and combined use of tigecycline for tumor treatment and the underpinning mechanisms. As an inhibitor for mitochondrial DNA translation, tigecycline affects the proliferation, migration, and invasion of tumor cells mainly through inhibiting mitochondrial protein synthesis and inducing mitochondrial dysfunction. Although the effect of tigecycline monotherapy is controversial, the efficacy of combined use of tigecycline is satisfactory. Therefore, it is important to explore the molecular mechanisms underpinning the anti-tumor activity of tigecycline, with the aim to use it as a cheap and effective new anti-tumor drug.
Keywords: tigecyclineanti-tumor activitymitochondrial disorderdrug combinationclinical trial
替加环素(Tigecycline),又称丁甘米诺环素、老虎霉素,由美国惠氏公司(Wyeth-Aytrst) 于1992年开发,在2005年被美国食品和药品管理局(Food and Drug Administration,FDA) 批准上市,2011年末进入中国市场[1-4]。替加环素是一种抗菌活性更强的新型甘氨环素类抗菌药物,与四环素相比,其在中央骨架侧链的第9位以D环甘氨酸环代替了N2烷基2甘氨酰胺基(图 1)。替加环素的抗菌机制为与细菌核糖体30S亚基结合,阻止氨酰-tRNA进入核糖体A位进而抑制细菌蛋白质的合成起到杀菌作用,因此可克服细菌由外排机制及核糖体保护介导的耐药性[5-6]。替加环素当时作为新一代抗菌药物给医生带来很多希望,同时也为我国治疗多重耐药菌感染领域药物提供了基础。
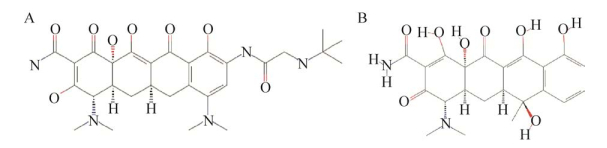 |
| 图 1 替加环素和四环素的结构式(来源于PubChem Compound数据库) Fig. 1 The structures of tigecycline (A) and tetracycline (B) (from PubChem Compound database). |
| 图选项 |
替加环素不仅具有抗生素的功能,还具有潜在的抗肿瘤活性。替加环素最早被报道在急性髓性白血病(Acute myeloid leukemia,AML) 中可通过抑制线粒体蛋白合成的功能,进而选择性地杀死肿瘤细胞;替加环素与两种AML标准化疗药物柔红霉素(Daunorubicin) 或阿糖胞苷(Cytarabine) 联合使用,会具有更好的治疗效果[7-9]。笔者实验室先后发现替加环素在多种癌症中具有抗肿瘤活性,比如胃癌、宫颈癌、口腔鳞状细胞癌、黑素瘤、神经母细胞瘤、神经胶质瘤和胰腺导管腺癌等[10-16]。另外,替加环素还被证实在宫颈癌、肺癌、乳腺癌、肝癌和甲状腺癌等中具有一定的抗肿瘤活性[11, 17-21]。因此,文中综述了替加环素在抗肿瘤方面的新角色,并探讨其可能的作用机制,为其在临床治疗肿瘤的应用中提供参考。
1 替加环素单药治疗肿瘤的临床进展替加环素作为一种2005年上市的抗生素药物,其安全性和低毒副作用的特点已经得到了临床实践的验证。有临床研究表明,每日高剂量静脉注射替加环素(先200–400 mg静脉注射一次,然后再每24 h静脉注射100–200 mg) 治疗尿路感染,5 d可有效清除患者尿液中的多药耐药性的肺炎克雷伯氏菌,12 d可完全清除产气肠杆菌,同时无胃肠道副反应或其他副作用[22]。
2016年的报道称研究者对AML患者进行了每周5次静脉注射并持续2周的替加环素临床Ⅰ期的剂量递增研究,该研究包括27例复发的和难治的AML患者分别使用了7个剂量等级(50–350 mg/d) 进行治疗,其剂量限制性毒性试验显示,替加环素每日一次给药的最大耐受剂量为300 mg;但整个治疗过程未观察到显著的药效学变化或临床反应[23]。尽管如此,药物代谢动力学实验表明,替加环素在AML患者的半衰期(约9.5 h) 明显短于非癌症患者(28–43 h),这可能是其没有观察到药效学变化或临床反应的主要原因之一[23]。幸运的是,有研究证实添加抗坏血酸和维生素E可以维持替加环素至少7 d的稳定性,这为替加环素用于临床治疗肿瘤提供新的可能[24]。因此,这还需要更多的临床研究来深度地研究替加环素单药治疗肿瘤,进而开发其潜在的抗肿瘤活性,为肿瘤的临床治疗提供新的方法和途径。
2 替加环素联合用药进展克服肿瘤细胞的耐药性,提高抗癌药物疗效已成为肿瘤治疗领域中亟待解决的关键问题。当前联合用药是克服减轻肿瘤耐药性、提高药物疗效的一种重要方式,这可通过多种不同机制来达到抗肿瘤的作用,而且还能减轻药物的不良反应。早在2011年替加环素就被报道其可和AML的标准化疗药物柔红霉素(Daunorubicin) 或阿糖胞苷(Cytarabine) 联合使用,可显著提高柔红霉素(Daunorubicin) 或阿糖胞苷(Cytarabine) 抗白血病的疗效[7, 9]。临床试验也证实在发热、高危、嗜中性粒细胞减少的白血病患者的治疗中,利用替加环素和piperacillin/tazobactam联合用药的效果显著高于单独使用piperacillin/tazobactam,且无明显的副作用[25]。另外,替加环素与伊马替尼(Imatinib) 联合用药还可在体内外选择性地清除具有BCR-ABL-TKIs耐药性的慢性粒细胞白血病(Chronic myeloid leukemia,CML) 干细胞;因为CML干细胞的氧化代谢水平较为活跃,更为依赖线粒体的氧化磷酸化作用,而替加环素可抑制线粒体的蛋白合成阻止线粒体的呼吸作用,同时伊马替尼(Imatinib) 又可抑制BCR-ABL酪氨酸激酶的活性,两者联合用药选择性地杀死CML干细胞,杜绝由于白血病微小残留病(Minimal residual disease,MRD) 导致的CML复发[26-27]。同样地,在急性淋巴细胞白血病(Acute lymphoblastic leukemia,ALL) 中,替加环素与THP-阿霉素(Doxorubicin) 或incristine的联合用药,可提高化疗药物的药效;并进一步证实化疗药物辅助靶向线粒体代谢的替加环素,可显著降低肿瘤细胞对化疗药物的耐药性[28]。
最近一项临床前研究显示,在恶性程度较高的B细胞淋巴瘤(Double-hit lymphomas,DHL) 的治疗中,替加环素与BCl-2抑制剂维奈托克(Venetoclax) 的联合使用,在体内外都表现出极强的抗肿瘤药效,其主要是通过抑制线粒体编码的电子传递链复合物细胞色素C氧化酶亚基COX1和COX2的活性,增强了维奈托克(Venetoclax) 诱导细胞凋亡的作用[29];同时还证实替加环素可与目前淋巴瘤一线治疗药物抗CD20的利妥昔单抗(Rituximab) 具有较好的潜在的联合用药的前景[29]。另外,在肝细胞癌中,替加环素可抑制线粒体蛋白COX1和COX2的合成,诱导线粒体功能障碍和氧化损伤,通过联合用药能显著提高细胞凋亡诱导剂顺铂(Cisplatin) 的化疗药效[30];最新的研究也证实辅助替加环素不仅抑制了肿瘤细胞线粒体的高电子传输系统(High electron transport system,ETS) 蛋白亚基的合成,同时限制了谷氨酰胺氧化所需的电子受体周转率,因此其可作为sorafenib耐药肝细胞癌的有效的二线治疗方法[21]。同样地,替加环素与顺铂(Cisplatin)的联合用药显著优于单独使用顺铂(Cisplatin) 对宫颈癌细胞的药效[31]。在结直肠癌中,替加环素与氧化磷酸化抑制剂VLX-600联合用药,通过抑制线粒体的氧化磷酸化,进而增强对K-ras驱动的肿瘤增殖的抑制效应[32]。在甲状腺癌中,替加环素可通过降低线粒体膜电位和抑制线粒体蛋白翻译,进而减少ATP的产生,最终导致肿瘤细胞氧化应激和损伤;其通过联合用药的方式可显著地提高紫杉醇对甲状腺癌的治疗效果[20]。在弥漫性大B细胞淋巴瘤(Diffuse large B-cell lymphomas,DLBCLs)中,替加环素和adriamycin联合使用可通过抑制SIRT1对线粒体的活化作用,改善肿瘤的耐药性[33]。在肺腺癌细胞中,替加环素与EGFR酪氨酸激酶抑制剂吉非替尼(Gefitinib)联合使用可显著地抑制肺癌干细胞的能量代谢和ATP的合成,进而增强吉非替尼(Gefitinib) 的药效且无用药顺序[34]。在胰腺导管腺癌中,替加环素可通过抑制细胞周期蛋白CCNE2的表达,通过与DNA合成抑制剂gemcitabine的联合使用,可显著地增加后者的化疗药效[15]。
总之,替加环素与当前临床治疗肿瘤的主流化疗药物联合使用,都显著增强了后者的药效(表 1)。虽然替加环素联合用药的机理不尽相同,但主要是靶向线粒体,造成线粒体功能障碍,抑制肿瘤细胞的能量代谢,进而增强化疗药物的药效。因此,替加环素至少是一种潜在的具有显著优势的临床治疗肿瘤的辅助药物。
表 1 替加环素抗肿瘤的联合用药研究Table 1 The anti-tumor effect of tigecycline combined with different drugs
| Cancers | Type of study | Combined drug | Combined drug types | Efficacy | References |
| Hematologic cancer | Clinical study | Piperacillin/ tazobactam | The broad-spectrum β-lactam antibiotic | 67.9% for combination 44.3% for monotherapy | [25] |
| Chronic myeloid leukemia, CML | In vitro/in vivo | Imatinib | Tyrosine kinase inhibitor | They selectively eradicates leukemia stem cells of CML both in vitro and in vivo | [26] |
| Double-hit lymphomas, DHL | In vitro/in vivo preclinical study | Venetoclax | The highly active brutons tyrosine kinase inhibitors and the BCL2 inhibitor | They can kill human MYC/BCL2 DHL cells They have strong antitumoral effects with the DHL-derived PDX, including long-term tumor eradication | [29] |
| Double-hit lymphomas, DHL | In vitro/in vivo preclinical study | Anti-CD20 rituximab | The chimeric monoclonal antibody | They have the potential to reinforce rituximab-containing therapies in the clinic | [29] |
| Hepatocellular carcinoma | In vitro | Cisplatin | DNA alkylator/crosslinker | They can enhances cisplatin activity against hepatocellular carcinoma through inducing mitochondrial dysfunction and oxidative damage | [30] |
| Ovarian cancer | In vitro/in vivo | Cisplatin | DNA alkylator/crosslinker | The combination of tigecycline and cisplatin at sublethal concentration results in much greater efficacy than cisplatin alone in vitro and in vivo | [31] |
| Colon carcinoma | In vitro/in vivo | VLX600 | The iron-chelating inhibitor of oxidative phosphorylation | Inhibit cell growth and tumor growth | [32] |
| Thyroid carcinoma | In vitro/in vivo | Paclitaxel | The tubulin polymerization promoter and microtubule polymer stabilizer | The combination of tigecycline with paclitaxel achieved greater efficacy than paclitaxel alone in vitro and in vivo | [20] |
| Lung adenocarcinoma | In vitro | Gefitinib | The potent, selective and orally active EGFR tyrosine kinase inhibitor | They are additive or synergistic, regardless of drug sequence | [34] |
| Pancreatic ductal adenocarcinoma | In vitro/in vivo | Gemcitabine | The pyrimidine nucleoside analog antimetabolite and an antineoplastic agent | They can enhance chemosensitivity to gemcitabine of PDAC cells | [15] |
| Diffuse large B-cell lymphoma, DLBCL | In vitro/in vivo | Adriamycin | The cytotoxic anthracycline antibiotic | They can enhance the effect of adriamycin | [33] |
表选项
3 替加环素治疗肿瘤的分子机制替加环素的抗肿瘤活性已经得到了临床证实,其发挥药效的分子机制也是多方面的;但总体上看,替加环素主要是靶向线粒体,使肿瘤细胞线粒体功能异常,进而影响肿瘤的发生发展,最终发挥其抗肿瘤效应。
3.1 靶向肿瘤细胞的线粒体线粒体作为细胞的“能量工厂”,肿瘤细胞的线粒体功能明显不同于正常细胞,比如某些肿瘤细胞的氧化磷酸化作用(Oxidative phosphorylation,OXPHOS) 和线粒体生物合成(Mitochondrial biogenesis) 更活跃和产生更多的ATP以满足肿瘤细胞赖以生存的能量代谢[35-36]。替加环素恰好又是一类线粒体蛋白翻译抑制剂,其可通过抑制线粒体的蛋白合成进而影响线粒体氧化磷酸化和线粒体生物合成[34]。因此,替加环素对OXPHOS依赖性的肿瘤细胞具有更好的治疗效果。
3.1.1 抑制线粒体的氧化磷酸化作用肿瘤是一种复杂的、多基因的、异质性的代谢性疾病,每种肿瘤的代谢方式都不尽相同。最初人们普遍认为肿瘤细胞具有以氧糖酵解为核心的“Warburg effect”,但随着深入的研究,发现OXPHOS对肿瘤细胞总ATP的贡献也必不可少,对于OXPHOS依赖性的肿瘤细胞,OXPHOS的重要程度甚至超过糖酵解[37-40]。
在AML中,替加环素可通过减弱线粒体呼吸链复合体Ⅰ和Ⅳ的活性,降低氧化磷酸化的速度进而抑制呼吸作用;同时抑制线粒体的蛋白合成,降低线粒体质量,进而增加肿瘤细胞或肿瘤干细胞的药物敏感性以及诱导其凋亡[7, 41]。而在急性淋巴细胞白血病(Acute lymphoblastic leukemia,ALL) 中,替加环素在体内外可通过抑制肿瘤细胞的呼吸作用,降低ATP的产量,进而抑制肿瘤的增殖,诱导肿瘤细胞的凋亡和降低肿瘤细胞的耐药性[28]。同样,在慢性粒细胞白血病(Chronic myeloid leukemia,CML) 中,替加环素可抑制线粒体的蛋白合成进而减弱氧化磷酸化作用,在体内外抑制肿瘤的增殖和降低肿瘤细胞的耐药性[26, 42]。
另外,在OXPHOS依赖性的弥漫性大B细胞淋巴瘤(Diffuse large B-cell lymphomas,DLBCLs)中,替加环素可通过减弱线粒体呼吸链复合体Ⅰ的活性进而抑制其呼吸作用,以及诱导线粒体活性氧(Reactive oxygen species,ROS) 产生,最终阻滞肿瘤的增殖[43]。而在结直肠癌中替加环素通过抑制线粒体蛋白合成,可有效地抑制氧化磷酸化作用更活跃的K-RAS突变型肿瘤细胞的增殖[32]。在非小细胞肺癌、卵巢癌和骨肉瘤中,替加环素可通过抑制线粒体蛋白合成作用来减弱其呼吸作用,进而诱导肿瘤细胞的凋亡或降低肿瘤细胞的耐药性[17, 31, 44]。而在肺腺癌干细胞中,替加环素可削弱肿瘤干细胞对线粒体OXPHOS的依赖,并使其对化疗药物更敏感[34]。在肾细胞癌和视网膜母细胞瘤中,替加环素可通过抑制线粒体蛋白合成及减弱线粒体呼吸链复合体Ⅰ、Ⅳ或Ⅴ的活性,进而诱导肿瘤细胞的凋亡或降低肿瘤细胞的耐药性[45-46]。在肝细胞癌中,替加环素通过抑制呼吸电子传递链上的电子受体的生成,进而抑制肿瘤细胞的增殖[21]。
3.1.2 抑制线粒体的生物合成线粒体生物合成是指在细胞中新线粒体的形成并伴随着线粒体酶活性及数量增加的复杂过程,其包括线粒体内膜、外膜和编码蛋白的合成、核基因编码蛋白的合成和转入以及线粒体DNA的复制[47]。替加环素可抑制线粒体编码蛋白COX1和COX2的蛋白合成,降低AML细胞的耗氧率,增加ROS的浓度进而诱导肿瘤细胞的凋亡;而对正常骨髓单核细胞(Bone marrow mononuclear cells) 则没有抑制效应[48]。替加环素还可通过抑制线粒体DNA编码的电子传递系统(Electron transport system,ETS) 亚基的生物合成降低肝细胞癌的复发[21];同时还可以抑制肝细胞癌COX1和COX2的蛋白合成,诱导线粒体活性氧产生,进而抑制肿瘤增殖[30]。在DLBCLs中,替加环素通过抑制由SIRT1过表达导致的COX1、ND1和ND6基因的mtDNA生物合成可降低能量代谢,进而抑制肿瘤增殖[33]。另外,替加环素可抑制骨肉瘤细胞增殖和促进其凋亡,但对正常成骨细胞无显著的抑制作用,这可能是因为骨肉瘤细胞线粒体的功能活性比正常成骨细胞的更活跃,依赖性更强[44]。
3.2 靶向PI3K/Akt和mTOR信号通路磷脂酰肌醇3-激酶(Phosphoinositide 3-kinase,PI3K)/蛋白激酶B (Protein kinase B,PKB/Akt) 和哺乳动物雷帕霉素靶蛋白(Mammalian target of rapamycin,mTOR) 信号通路是肿瘤中最常见的被异常激活的信号通路之一[49]。越来越多的研究表明PI3K/Akt和mTOR信号通路在肿瘤组织中发生了基因突变或基因扩增,其异常的改变与肿瘤细胞的存活、增殖、分化、凋亡、自噬和耐药性等息息相关,在调节肿瘤发生发展中有着十分关键的作用[49-50]。
PI3K属于原癌基因,其活化后的产物可使Akt转位于细胞膜并获得催化活性[51]。Akt是PI3K/Akt通路的关键交点,其位于上游各种信号转导的核心交叉位置;其不仅可通过作用于抑癌基因TSC1/TSC2复合体以及mTOR信号转导调节细胞生长增殖,还可通过磷酸化细胞周期抑制因子p21和p27影响细胞增殖,同时能增强核内转录因子的转录活性进而影响细胞迁移和侵袭等[50, 52-53]。替加环素可通过抑制肿瘤PI3K/Akt通路的活跃程度而发挥其抗肿瘤活性。笔者实验室的研究发现替加环素可通过抑制Akt的磷酸化或其下游基因的表达来调控肿瘤增殖和转移[12-14, 54]。在神经母细胞瘤中,Akt的激动剂IGF-1可显著地减弱替加环素对肿瘤的抑制效应[13]。相似地,在胶质瘤中替加环素则可通过miRNA-199b-5p/HES1轴抑制Akt的Ser473位点的磷酸化,并促进其下游细胞周期抑制因子p21的表达,进而抑制肿瘤增殖[14]。然而笔者实验室的另一项研究却发现替加环素在黑色瘤中是通过抑制p21蛋白表达来发挥抗肿瘤功能[12];Ma等也在多发性骨髓瘤的研究中进一步地证实了同样的研究结果[55]。细胞周期抑制因子p21的矛盾结果,可能与其亚细胞定位相关;在其传统功能上,核内p21的主要功能是细胞周期抑制因子,发挥抑癌作用;而细胞质中p21参与细胞增殖、凋亡和转移等进程,发挥促癌作用[16, 56]。
另外,mTOR信号通路位于Akt下游,其可通过增强原癌基因的转录等驱动肿瘤形成;同时其可直接靶向下游底物S6激酶(S6 kinase 1,S6K1) 进而增强糖酵解及蛋白质、脂质、核酸的生物合成来实现代谢重编程,另一个下游底物4E-BP1则通过调节转录起始复合体EIF4f影响肿瘤细胞的增殖和生存,与CDK4/6抑制剂起到协同作用[50, 57]。笔者实验室率先发现替加环素可通过激活mTOR上游的AMP依赖的蛋白激酶(AMP-dependent protein kinase,AMPK),抑制mTOR和S6K的磷酸化进而诱导自噬和抑制肿瘤增殖。同样地,在多发性骨髓瘤和卵巢癌中,替加环素可激活AMPK抑制mTOR磷酸化,以及分别阻滞其下游4E-BP1和核糖体蛋白S6的磷酸化,进而诱导自噬或改善化疗药物耐药性[31, 55]。另外,替加环素可通过抑制PI3K/Akt/mTOR信号通路,并阻滞其下游P70S6K和4E-BP1的磷酸化,诱导CML细胞自噬并改善其药物敏感性[48]。
3.3 靶向Wnt/β-catenin信号通路Wnt/β-catenin信号通路是在生物进化中相对保守的信号转导通路之一;从果蝇到人类,其成员都具有高度的同源性。在正常情况下,Wnt/β-catenin信号通路主要参与细胞命运、组织器官形成和胚胎发育等;但当发生原癌基因或抑癌基因突变时,Wnt/β-catenin信号通路会异常激活并导致机体发育异常或形成肿瘤[58-59]。在人类很多种肿瘤中,Wnt/β-catenin信号通路都是处于遗传激活状态,其在肿瘤的发生、转移和多药耐药性的产生中都发挥着重要作用[60-62]。在宫颈鳞状细胞癌中,替加环素可显著抑制Wnt/β-catenin信号通路介导的转录活性,添加Wnt/β-catenin通路激动剂或过表达β-catenin可挽救替加环素的抑制效应[11]。尽管如此,笔者实验室最近的研究发现过表达β-catenin不能挽救替加环素对胰腺导管腺癌的抑制效应,而过表达CCNE2才可以减弱替加环素对肿瘤细胞增殖、迁移和侵袭的抑制作用[15]。这样的矛盾结果可能与替加环素的药物浓度有关,因为较高的药物浓度(> 1 μmol/L) 处理后,替加环素会影响肿瘤细胞线粒体的耗氧率(Oxygen consumption rate,OCR),进而抑制其基础呼吸能力(Basal respiratory capacity,BRC)和呼吸潜力(Spare respiratory capacity,SRC),而低药物浓度则不能;同样地,过表达β-catenin也不能减弱高浓度替加环素对肿瘤细胞的抑制效应[11]。以上研究结果说明,替加环素在低浓度时可能只会影响肿瘤细胞Wnt/β-catenin通路的活性;而高浓度时会引起线粒体功能障碍,可直接或间接地影响肿瘤细胞整体的正常功能。
总之,替加环素在体内外都可显著地抑制肿瘤的发生与发展,其作用机制也是多方面的(图 2)。作为一种具有抗肿瘤活性的抗生素,替加环素若能真正地应用到临床治疗肿瘤中,其不仅可抑制肿瘤,还同时可抑制由于肿瘤患者手术导致的感染或并发症,降低肿瘤患者的术后死亡率。因此,亟需对替加环素的抗肿瘤活性进行深度研究,为临床治疗肿瘤提供新的候选药物。
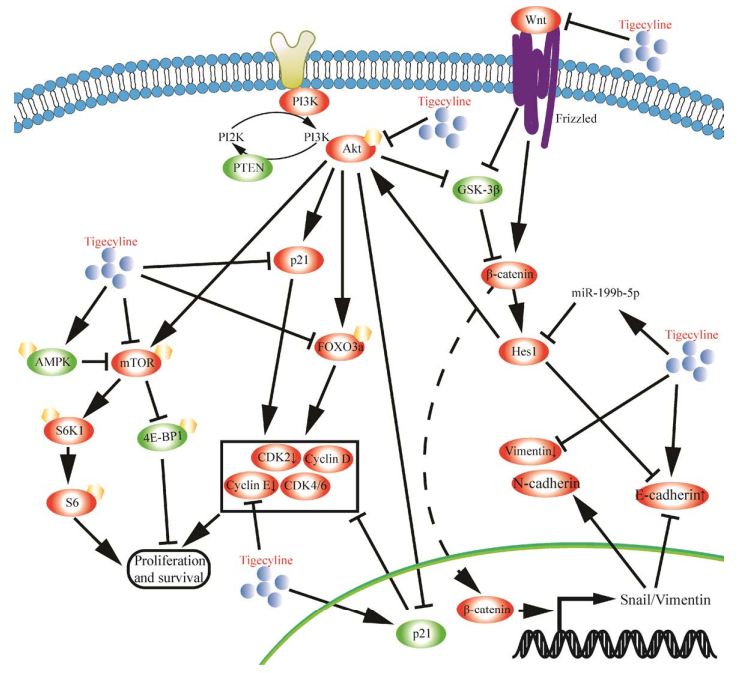 |
| 图 2 替加环素的抗肿瘤活性的作用机制图 Fig. 2 Schematic overview showing the possible mechanisms underpinning the anti-tumor activity of tigecycline. |
| 图选项 |
4 展望替加环素作为一种治疗感染的抗生素,已在国内外上市多年;但作为一种潜在的肿瘤治疗新药物,还没有引起重视。尽管替加环素在治疗感染时存在一些副作用,例如低纤维蛋白原血症、线粒体功能障碍、慢性中耳炎以及恶心、呕吐、腹泻等胃肠道症状,但初步评估的治疗肿瘤的最大治疗剂量要远小于临床治疗感染的剂量[16];这说明替加环素的安全性相对较高,可以直接用于临床肿瘤的治疗。尽管如此,关于替加环素直接杀死肿瘤细胞的争议还是比较大,但与化疗药物联合用药,提高药效和低肿瘤组织的耐药性方面得到了广泛的认可。
替加环素具有明显的抗肿瘤活性,其作用机制也是多方面的,但是大量的研究证实替加环素可靶向肿瘤细胞的线粒体,影响其蛋白合成和呼吸作用,造成线粒体功能障碍[7, 16-17, 26, 30, 33-34, 43, 46, 56]。替加环素处理后,肿瘤细胞会发生细胞周期阻滞、生长增殖抑制、迁移侵袭抑制、自噬和凋亡等表型,还会影响到PI3K/Akt通路、mTOR通路和Wnt/β-catenin通路的信号转导;产生这些影响的根本原因可能主要是线粒体功能障碍,包括线粒体蛋白合成减少、氧化磷酸化减弱、呼吸作用抑制、ATP产量降低和ROS水平升高等。因此,需要更多的研究来探索替加环素抗肿瘤活性的作用机制。由于现在仅有的一项临床Ⅰ期的研究未观察到显著的药效变化或临床反应,导致目前替加环素单药治疗肿瘤研究也主要暂停在临床Ⅰ期阶段;这项临床研究失败的原因可能是因为替加环素在AML患者的半衰期明显短于非癌症患者;但后续研究发现添加抗坏血酸和维生素E可以维持替加环素至少7 d的稳定性,这为替加环素用于临床治疗肿瘤提供新的可能。因此,还需要更多的临床研究来深度地研究替加环素的抗肿瘤活性,争取使替加环素尽早用于肿瘤的临床治疗,成为一种廉价高效的抗肿瘤新药物,也为肿瘤的临床治疗提供新的方法和途径。
参考文献
| [1] | Wenzel R, Bate G, Kirkpatrick P. Fresh from the pipeline: tigecycline. Nat Rev Drug Discov, 2005, 4(10): 809-810. DOI:10.1038/nrd1857 |
| [2] | Noskin GA. Tigecycline: a new glycylcycline for treatment of serious infections. Clin Infect Dis, 2005, 41(Suppl 5): S303-S314. |
| [3] | 汤国桢, 施晓霞. 第三代四环素品种介绍. 上海医药, 2005, 26(3): 137-138. Tang GZ, Shi XX. Introduction of the third generation tetracycline. Shanghai Med Pharmaceut J, 2005, 26(3): 137-138 (in Chinese). DOI:10.3969/j.issn.1006-1533.2005.03.014 |
| [4] | Zou GL. A new tetracycline antibiotic: tigecycline. World Notes on Antibiotics, 2004, 25(6): 278-281. 邹 国利. 新型四环素类抗生素——丁甘米诺环素. 国外医药抗生素分册, 2004, 25(6): 278-281 (in Chinese). DOI:10.3969/j.issn.1001-8751.2004.06.009 |
| [5] | 吴永杰, 白艳, 王睿, 等. 替加环素联合用药的研究进展. 中国新药与临床杂志, 2014, 33(4): 237-241. Wu YJ, Bai Y, Wang R, et al. Research progress of tigecycline in combination with other drugs. Chin J New Drugs Clin Rem, 2014, 33(4): 237-241 (in Chinese). |
| [6] | 罗丹, 郝刚, 林思思, 等. 替加环素临床耐药性的研究进展. 中国临床药理学与治疗学, 2015, 20(4): 466-468, 475. Luo D, Hao G, Lin SS, et al. Research progress on the clinical resistance to tigecycline. Chin J Clin Pharmacol Ther, 2015, 20(4): 466-468, 475 (in Chinese). |
| [7] | ?krtic M, Sriskanthadevan S, Jhas B, et al. Inhibition of mitochondrial translation as a therapeutic strategy for human acute myeloid leukemia. Cancer Cell, 2011, 20(5): 674-688. DOI:10.1016/j.ccr.2011.10.015 |
| [8] | J?r?s M, Ebert BL. Power cut: inhibiting mitochondrial translation to target leukemia. Cancer Cell, 2011, 20(5): 555-556. DOI:10.1016/j.ccr.2011.10.028 |
| [9] | Schimmer AD, Skrti? M. Therapeutic potential of mitochondrial translation inhibition for treatment of acute myeloid leukemia. Expert Rev Hematol, 2012, 5(2): 117-119. DOI:10.1586/ehm.12.8 |
| [10] | Tang CL, Yang LQ, Jiang XL, et al. Antibiotic drug tigecycline inhibited cell proliferation and induced autophagy in gastric cancer cells. Biochem Biophys Res Commun, 2014, 446(1): 105-112. DOI:10.1016/j.bbrc.2014.02.043 |
| [11] | Li H, Jiao S, Li X, et al. Therapeutic effects of antibiotic drug tigecycline against cervical squamous cell carcinoma by inhibiting Wnt/β-catenin signaling. Biochem Biophys Res Commun, 2015, 467(1): 14-20. |
| [12] | Hu HR, Dong Z, Tan P, et al. Antibiotic drug tigecycline inhibits melanoma progression and metastasis in a p21CIP1/Waf1-dependent manner. Oncotarget, 2016, 7(3): 3171-3185. DOI:10.18632/oncotarget.6419 |
| [13] | Zhong XX, Zhao EH, Tang CL, et al. Antibiotic drug tigecycline reduces neuroblastoma cells proliferation by inhibiting Akt activation in vitro and in vivo. Tumor Biol, 2016, 37(6): 7615-7623. DOI:10.1007/s13277-015-4613-6 |
| [14] | Yang R, Yi L, Dong Z, et al. Tigecycline inhibits glioma growth by regulating miRNA-199b-5p-HES1-AKT pathway. Mol Cancer Ther, 2016, 15(3): 421-429. DOI:10.1158/1535-7163.MCT-15-0709 |
| [15] | Yang J, Dong Z, Ren AS, et al. Antibiotic tigecycline inhibits cell proliferation, migration and invasion via down-regulating CCNE2 in pancreatic ductal adenocarcinoma. J Cell Mol Med, 2020, 24(7): 4245-4260. DOI:10.1111/jcmm.15086 |
| [16] | Dong Z, Abbas MN, Kausar S, et al. Biological functions and molecular mechanisms of antibiotic tigecycline in the treatment of cancers. Int J Mol Sci, 2019, 20(14): 3577. DOI:10.3390/ijms20143577 |
| [17] | Jia XF, Gu ZF, Chen WM, et al. Tigecycline targets nonsmall cell lung cancer through inhibition of mitochondrial function. Fund Clin Pharmacol, 2016, 30(4): 297-306. DOI:10.1111/fcp.12199 |
| [18] | Jones RA, Robinson TJ, Liu JC, et al. RB1 deficiency in triple-negative breast cancer induces mitochondrial protein translation. J Clin Invest, 2016, 126(10): 3739-3757. DOI:10.1172/JCI81568 |
| [19] | Tan J, Song MJ, Zhou M, et al. Antibiotic tigecycline enhances cisplatin activity against human hepatocellular carcinoma through inducing mitochondrial dysfunction and oxidative damage. Biochem Biophys Res Commun, 2017, 483(1): 17-23. DOI:10.1016/j.bbrc.2017.01.021 |
| [20] | Wang YH, Xie F, Chen DJ, et al. Inhibition of mitochondrial respiration by tigecycline selectively targets thyroid carcinoma and increases chemosensitivity. Clin Exp Pharmacol Physiol, 2019, 46(10): 890-897. DOI:10.1111/1440-1681.13126 |
| [21] | Messner M, Schmitt S, Ardelt MA, et al. Metabolic implication of tigecycline as an efficacious second-line treatment for sorafenib-resistant hepatocellular carcinoma. FASEB J, 2020, 34(9): 11860-11882. DOI:10.1096/fj.202001128R |
| [22] | Cunha BA, McDermot B, Nausheen S. Single daily high-dose tigecycline therapy of a multidrug-resistant (MDR) Klebsiella pneumoniae and Enterobacter aerogenes nosocomial urinary tract infection. J Chemother, 2007, 19(6): 753-754. DOI:10.1179/joc.2007.19.6.753 |
| [23] | Reed GA, Schiller GJ, Kambhampati S, et al. A Phase 1 study of intravenous infusions of tigecycline in patients with acute myeloid leukemia. Cancer Med, 2016, 5(11): 3031-3040. DOI:10.1002/cam4.845 |
| [24] | Jitkova Y, Gronda M, Hurren R, et al. A novel formulation of tigecycline has enhanced stability and sustained antibacterial and antileukemic activity. PLoS ONE, 2014, 9(5): e95281. DOI:10.1371/journal.pone.0095281 |
| [25] | Bucaneve G, Micozzi A, Picardi M, et al. Results of a multileft, controlled, randomized clinical trial evaluating the combination of piperacillin/tazobactam and tigecycline in high-risk hematologic patients with cancer with febrile neutropenia. J Clin Oncol, 2014, 32(14): 1463-1471. DOI:10.1200/JCO.2013.51.6963 |
| [26] | Kuntz EM, Baquero P, Michie AM, et al. Targeting mitochondrial oxidative phosphorylation eradicates therapy-resistant chronic myeloid leukemia stem cells. Nat Med, 2017, 23(10): 1234-1240. DOI:10.1038/nm.4399 |
| [27] | De Beauchamp L, Baquero P, Kuntz EM, et al. Auto-commentary on: "targeting mitochondrial oxidative phosphorylation eradicates therapy-resistant chronic myeloid leukemia stem cells". Mol Cell Oncol, 2017, 5(1): e1403532. |
| [28] | Fu XD, Liu W, Huang Q, et al. Targeting mitochondrial respiration selectively sensitizes pediatric acute lymphoblastic leukemia cell lines and patient samples to standard chemotherapy. Am J Cancer Res, 2017, 7(12): 2395-2405. |
| [29] | Ravà M, D'Andrea A, Nicoli P, et al. Therapeutic synergy between tigecycline and venetoclax in a preclinical model of MYC/BCL2 double-hit B cell lymphoma. Sci Transl Med, 2018, 10(426): eaan8723. DOI:10.1126/scitranslmed.aan8723 |
| [30] | Tan J, Song MJ, Zhou M, et al. Antibiotic tigecycline enhances cisplatin activity against human hepatocellular carcinoma through inducing mitochondrial dysfunction and oxidative damage. Biochem Biophys Res Commun, 2017, 483(1): 17-23. DOI:10.1016/j.bbrc.2017.01.021 |
| [31] | Hu B, Guo Y. Inhibition of mitochondrial translation as a therapeutic strategy for human ovarian cancer to overcome chemoresistance. Biochem Biophys Res Commun, 2019, 509(2): 373-378. |
| [32] | Martin TD, Cook DR, Choi MY, et al. A role for mitochondrial translation in promotion of viability in K-Ras mutant cells. Cell Reports, 2017, 20(2): 427-438. |
| [33] | Zhou Z, Ma D, Li PF, et al. Sirt1 gene confers adriamycin resistance in DLBCL via activating the PCG-1α mitochondrial metabolic pathway. Aging (Albany NY), 2020, 12(12): 11364-11385. |
| [34] | Sun JT, Li GF, Liu YW, et al. Targeting histone deacetylase SIRT1 selectively eradicates EGFR TKI-resistant cancer stem cells via regulation of mitochondrial oxidative phosphorylation in lung adenocarcinoma. Neoplasia, 2020, 22(1): 33-46. |
| [35] | Mayevsky A. Mitochondrial function and energy metabolism in cancer cells: past overview and future perspectives. Mitochondrion, 2009, 9(3): 165-179. |
| [36] | Aminzadeh-Gohari S, Weber DD, Vidali S, et al. From old to new — repurposing drugs to target mitochondrial energy metabolism in cancer. Semin Cell Dev Biol, 2020, 98: 211-223. |
| [37] | Suganuma K, Miwa H, Imai N, et al. Energy metabolism of leukemia cells: glycolysis versus oxidative phosphorylation. Leukem Lymphom, 2010, 51(11): 2112-2119. |
| [38] | Rodríguez-Enríquez S, Carre?o-Fuentes L, Gallardo-Pérez JC, et al. Oxidative phosphorylation is impaired by prolonged hypoxia in breast and possibly in cervix carcinoma. Int J Biochem Cell Biol, 2010, 42(10): 1744-1751. |
| [39] | Zheng J. Energy metabolism of cancer: glycolysis versus oxidative phosphorylation (Review). Oncol Lett, 2012, 4(6): 1151-1157. |
| [40] | Min HY, Pei H, Hyun SY, et al. Potent anticancer effect of the natural steroidal saponin gracillin is produced by inhibiting glycolysis and oxidative phosphorylation-mediated bioenergetics. Cancers, 2020, 12(4): 913. |
| [41] | Farge T, Saland E, De Toni F, et al. Chemotherapy-resistant human acute myeloid leukemia cells are not enriched for leukemic stem cells but require oxidative metabolism. Cancer Discov, 2017, 7(7): 716-735. |
| [42] | Wang ZX, Guan D, Wang S, et al. Glycolysis and oxidative phosphorylation play critical roles in natural killer cell receptor-mediated natural killer cell functions. Front Immunol, 2020, 11: 202. |
| [43] | Norberg E, Lako A, Chen PH, et al. Differential contribution of the mitochondrial translation pathway to the survival of diffuse large B-cell lymphoma subsets. Cell Death Differentiat, 2017, 24(2): 251-262. |
| [44] | Chen JG, Xu XM, Fan MY. Inhibition of mitochondrial translation selectively targets osteosarcoma. Biochem Biophys Res Commun, 2019, 515(1): 9-15. |
| [45] | Wang B, Ao JS, Yu D, et al. Inhibition of mitochondrial translation effectively sensitizes renal cell carcinoma to chemotherapy. Biochem Biophys Res Commun, 2017, 490(3): 767-773. |
| [46] | Xiong Y, Liu W, Huang Q, et al. Tigecycline as a dual inhibitor of retinoblastoma and angiogenesis via inducing mitochondrial dysfunctions and oxidative damage. Sci Rep, 2018, 8: 11747. |
| [47] | Li PA, Hou XL, Hao SC. Mitochondrial biogenesis in neurodegeneration. J Neurosci Res, 2017, 95(10): 2025-2029. |
| [48] | Lu ZY, Xu N, He BL, et al. Inhibition of autophagy enhances the selective anti-cancer activity of tigecycline to overcome drug resistance in the treatment of chronic myeloid leukemia. J Exp Clin Cancer Res, 2017, 36(1): 43. |
| [49] | Alzahrani AS. PI3K/Akt/mTOR inhibitors in cancer: at the bench and bedside. Semin Cancer Biol, 2019, 59: 125-132. |
| [50] | 卢训西, 国琳玮, 李小光, 等. PI3K/AKT/mTOR通路及其抑制剂在乳腺癌中的应用现状. 中国癌症杂志, 2020, 30(2): 154-160. Lu XX, Guo LW, Li XG, et al. Current status of PI3K/AKT/mTOR pathway and its inhibitors in breast cancer. Chin Oncol, 2020, 30(2): 154-160 (in Chinese). |
| [51] | Osaki M, Oshimura M, Ito H. PI3K-Akt pathway: its functions and alterations in human cancer. Apoptosis, 2004, 9(6): 667-676. |
| [52] | Manning BD, Cantley LC. AKT/PKB signaling: navigating downstream. Cell, 2007, 129(7): 1261-1274. |
| [53] | 吴群丹. PI3K-Akt-mTOR信号传导通路与乳腺癌关系的研究进展. 海峡药学, 2020, 32(1): 172-174. Wu QD. Research progress on the relationship between PI3K-Akt-mTOR signaling pathway and breast cancer. Strait Pharm J, 2020, 32(1): 172-174 (in Chinese). |
| [54] | Ren A, Qiu Y, Cui H, et al. Tigecycline exerts an antitumoral effect in oral squamous cell carcinoma. Oral Dis, 2015, 21(5): 558-564. |
| [55] | Ma RY, Zhang Y, Wang W, et al. Inhibition of autophagy enhances the antitumour activity of tigecycline in multiple myeloma. J Cell Mol Med, 2018, 22(12): 5955-5963. |
| [56] | Xu ZJ, Yan YL, Li Z, et al. The antibiotic drug tigecycline: a focus on its promising anticancer properties. Front Pharmacol, 2016, 7: 473. |
| [57] | Zoncu R, Efeyan A, Sabatini DM. mTOR: from growth signal integration to cancer, diabetes and ageing. Nat Rev Mol Cell Biol, 2011, 12(1): 21-35. |
| [58] | 黄冠又, 巫玉娟. Wnt/β-catenin信号传导通路与脑膜瘤研究进展. 中国医学创新, 2013, 10(33): 162-164. Huang GY, Wu YJ. Research progress of Wnt/β-catenin signaling pathway in meningioma. Med Innovat China, 2013, 10(33): 162-164 (in Chinese). |
| [59] | 田慧芹, 张倩云, 韩秀珍. 基于Wnt/β-catenin信号通路的结直肠癌研究进展. 生命的化学, 2016, 36(1): 71-80. Tian HQ, Zhang QY, Han XZ. Research progress of Wnt/β-catenin signaling pathway and colorectal cancer. Chem Life, 2016, 36(1): 71-80 (in Chinese). |
| [60] | Hu J, Lu XX, Zhang XY, et al. Exogenous spermine attenuates myocardial fibrosis in diabetic cardiomyopathy by inhibiting endoplasmic reticulum stress and the canonical Wnt signaling pathway. Cell Biol Int, 2020, 44(8): 1660-1670. |
| [61] | Yao H, Ashihara E, Maekawa T. Targeting the Wnt/β-catenin signaling pathway in human cancers. Expert Opin Ther Tar, 2011, 15(7): 873-887. |
| [62] | Rosenbluh J, Wang XX, Hahn WC. Genomic insights into Wnt/β-catenin signaling. Trends Pharmacol Sci, 2014, 35(2): 103-109. |
