
 , 王志, 林文萱, 徐美娟, 杨套伟, 邵明龙, 饶志明
, 王志, 林文萱, 徐美娟, 杨套伟, 邵明龙, 饶志明

江南大学 生物工程学院 工业生物技术教育部重点实验室,江苏 无锡 214122
收稿日期:2020-11-27;接收日期:2021-03-04
基金项目:国家重点研发计划(No. 2020YFA0908300),国家自然科学基金(No. 32071470),宁夏回族自治区重点研发计划(No. 2020BFH01001),山东省重点研发项目(No. 2019JZZY020605),福建省水产功能性饲料及养殖环境调控重点实验室开放课题(No. FACE20200003),生物基材料与绿色造纸国家重点实验室开放基金(No. KF201907) 资助
摘要:L-天冬酰胺酶能够水解L-天冬酰胺生成L-天冬氨酸和氨,广泛存在于微生物、植物和部分啮齿类动物的血清中,在医药和食品行业中都具有重要应用。然而无论是在医药还是在食品行业中,L-天冬酰胺酶依然存在一些问题,如催化效率低、热稳定性差、产量低等。文中通过理性设计及5′非翻译区(5′ untranslated region, 5′ UTR)改造提高米黑根毛霉Rhizomucor miehei来源的L-天冬酰胺酶(RmAsnase)的酶活及蛋白表达量。结果显示,通过同源建模结合序列比对分析构建的6个突变菌株中,突变酶A344E比酶活较野生酶提高了1.5倍。继而构建食品安全菌株枯草芽孢杆菌Bacillus subtilis 168/pMA5-A344E,对其进行UTR改造,获得重组菌株B. subtilis 168/pMA5 UTR-A344E,其酶活较原始菌提高了7.2倍,对重组菌B. subtilis 168/pMA5 UTR-A344E进行5 L罐研究,最终产量为489.1 U/mL。该酶活提高的重组菌株对L-天冬酰胺酶的工业化应用具有重要价值。
关键词:L-天冬酰胺酶定点突变比酶活UTR改造
Molecular modification and highly efficient expression of L-asparaginase from Rhizomucor miehei
Manchi Zhu, Xian Zhang

 , Zhi Wang, Wenxuan Lin, Meijuan Xu, Taowei Yang, Minglong Shao, Zhiming Rao
, Zhi Wang, Wenxuan Lin, Meijuan Xu, Taowei Yang, Minglong Shao, Zhiming Rao

Key Laboratory of Industrial Biotechnology of Ministry of Education, School of Biotechnology, Jiangnan University, Wuxi 214122, Jiangsu, China
Received: November 27, 2020; Accepted: March 4, 2021
Supported by: National Key Research and Development Program of China (No. 2020YFA0908300), National Natural Science Foundation of China (No. 32071470), Key Research and Development Program of Ningxia Hui Autonomous Region, China (No. 2020BFH01001), Key Research and Development Project of Shandong Province, China (No. 2019JZZY020605), Foundation of Fujian Key Laboratory of Functional Aquafeed and Culture Environment Control, China (No. FACE20200003), State Key Laboratory of Biobased Material and Green Papermaking, China (No. KF201907)
Corresponding author: Xian Zhang. E-mail: zx@jiangnan.edu.cn;
Zhiming Rao. Tel: +86-510-85916881; E-mail: raozhm@jiangnan.edu.cn.
Abstract: L-asparaginase hydrolyzes L-asparagine to produce L-aspartic acid and ammonia. It is widely distributed in microorganisms, plants and serum of some rodents, and has important applications in the pharmaceutical and food industries. However, the poor thermal stability, low catalytic efficiency and low yield hampered the further application of L-asparaginase. In this paper, rational design and 5′ untranslated region (5′ UTR) design strategies were used to increase the specific enzyme activity and protein expression of L-asparaginase derived from Rhizomucor miehei (RmAsnase). The results showed that among the six mutants constructed through homology modeling combined with sequence alignment, the specific enzyme activity of the mutant A344E was 1.5 times higher than the wild type. Subsequently, a food-safe strain Bacillus subtilis 168/pMA5-A344E was constructed, and the UTR strategy was used for the construction of recombinant strain B. subtilis 168/pMA5 UTR-A344E. The enzyme activity of B. subtilis 168/pMA5 UTR-A344E was 7.2 times higher than that of B. subtilis 168/pMA5-A344E. The recombinant strain B. subtilis 168/pMA5 UTR-A344E was scaled up in 5 L fermenter, and the final yield of L-asparaginase was 489.1 U/mL, showing great potential for industrial application.
Keywords: L-asparaginasesite-directed mutationspecific enzyme activityUTR strategy
L-天冬酰胺酶(EC.3.5.1.1) 能够催化L-天冬酰胺水解生成L-天冬氨酸和氨[1],广泛存在于植物、动物和微生物中[2-4]。细菌、酵母以及丝状真菌在内的许多微生物都是L-天冬酰胺酶的理想来源,微生物来源的L-天冬酰胺酶具有酶学性质优异、易于大规模生产、经济效益好等特点使其成为众多研究者的研究热点。在医药行业中,L-天冬酰胺酶可用于治疗急性淋巴细胞白血病、霍奇金淋巴瘤和淋巴系统恶性肿瘤等多种疾病[5-6]。细菌来源的L-天冬酰胺酶根据其表达的位置可以分为L-天冬酰胺酶Ⅰ和L-天冬酰胺酶Ⅱ,研究表明,只有Ⅱ型酶具有抗肿瘤活性[7-8]。在食品工业中,L-天冬酰胺酶可以减少油炸或烘焙食品中致癌物质丙烯酰胺的生成[6, 9-10]。降低食品中丙烯酰胺含量的有效措施是通过添加L-天冬酰胺酶[11-12]降低原料中的L-天冬酰胺。目前,商品化的米曲霉Aspergillus oryzae和黑曲霉Aspergillus niger来源的L-天冬酰胺酶已广泛地用于食品行业[13]。然而,已在应用的L-天冬酰胺酶的缺陷也越来越受到人们的关注。无论是在医药行业还是食品行业中,由于作用环境的复杂性,需要酶在较广的pH和温度范围内保持高的底物转化率和酶活力。
目前有多种蛋白质工程方法可以克服天然酶的缺陷并提高其工业性能[14]。在L-天冬酰胺酶的分子修饰中,理性设计是提高酶性能的主要策略。Long等[15]通过定点突变的方式构建突变菌株G107D,突变酶的催化活力较野生型提高了85%。Sudhir等[16]对活性中心外的残基进行突变,构建突变体D103V,突变酶的半衰期及底物亲和力均有所增加。Verma等[17]通过替换亚基结合表面氨基酸残基得到几株酶活提高的突变体。
本文首先将来源于米黑根毛霉Rhizomucor miehei的L-天冬酰胺酶基因RmAsnase在大肠杆菌Escherichia coli中进行克隆表达,结合同源建模得到的L-天冬酰胺酶三维结构以及多序列比对结果,选择了活性中心、保守区域以外的部分位点进行定点突变,筛选得到酶活提高的突变体。进一步对野生酶以及突变酶的酶学性质进行研究。在此基础上,将酶活提高的突变酶基因导入食品安全菌株枯草芽孢杆菌Bacillus subtilis中,同时进行UTR改造,得到酶活提高的重组菌株B. subtilis 168/pMA5 UTR-A344E,这为后续的工业化应用奠定了实验基础。
1 材料与方法1.1 材料1.1.1 菌株与质粒大肠杆菌E. coli BL21(DE3)、E. coli JM109、枯草芽孢杆菌B. subtilis 168以及质粒pET28a、pMA5均由本实验室保存,含经密码子优化的R. miehei来源的L-天冬酰胺酶RmAsnase编码基因的重组质粒pET28a-RmAsnase由生工生物工程(上海) 股份有限公司合成。
1.1.2 酶和试剂限制性内切酶BamH Ⅰ和Mlu Ⅰ、Ex Taq DNA聚合酶、T4 DNA连接酶和Dpn Ⅰ等购自TaKaRa公司。胶回收试剂盒、小量质粒提取试剂盒等购自上海捷瑞生物工程有限公司;氨苄青霉素、卡那霉素、异丙基-β-d-硫代半乳糖(IPTG) 购自生工生物工程(上海) 股份有限公司;甘油、咪唑、氯化钠、L-天冬酰胺等均为国产分析纯。
1.1.3 培养基LB培养基(g/L):酵母提取物5,胰蛋白胨10,氯化钠10 (固体培养基添加1.5%的琼脂粉)。
发酵培养基(g/L):甘油47;酵母粉35;氯化铵1.5;氯化钠5;玉米浆15;磷酸二氢钾2.04;磷酸氢二钾2.61;七水合硫酸镁1.85;L-天冬酰胺1。
补料培养基(g/L):酵母粉75;甘油500。
1.2 方法1.2.1 引物设计根据文献报道的UTR序列,选择合适的酶切位点,设计合成两对同源臂引物,序列见表 1。
表 1 文中所用引物Table 1 Primers used in this study
| Primer name | Sequence (5′–3′) |
| R135GF | AACGTATTGGCTACTCTATCTTAGAATACGATCCACTACTAGATAGCTGC |
| R135GR | GATAGAGTAGCCAATACGTTTGCCGTACAAAGAAACAGGTG |
| A171GF | TACTTCGACGGTTTCATCGTTCTTCACGGTACTGACACAATGGCATACAC |
| A171GR | CGATGAAACCGTCGAAGTACTCATAGTTAGCTTCGATGTCACGAGCGTT |
| I173VF | GACGCTTTCGTTGTTCTTCACGGTACTGACACAATGGCATAC |
| I173VR | TGAAGAACAACGAAAGCGTCGAAGTACTCATAGTTAGCTTCGATGTC |
| V206LF | GATCTCAATTACCTTTAACTGAAGTACGCAACGACGCTG |
| V206LR | AGTTAAAGGTAATTGAGATCCAGTGATGATTACCGTTTTACCTAGTT |
| V281PF | GGCCTTTACCATTACGCCCAACACATATCGCTAAATTTCGTTCTCAC |
| V281PR | TGGGCGTAATGGTAAAGGCCATTTAACGTCGATATCAATACCTAAGTTAACT |
| A344EF | CTTTTAGCTGAATTAAAAGAAGCTTGTGATCGTGGAGTTGTA |
| A344ER | TCTTTTAATTCAGCTAAAAGACCTTGACGAGCAGGTGC |
| pMA5-RMA-F | TGCAAAAAGTGAAATCAGGGGGATCCATGGATTCTCGTACTACAGCTCACGTACC |
| pMA5-RMA-R | GTGAATTTCGACCTCTAGAACGCGTTTATTCTTTACCAAGAAGTTGAGCGATTTC |
| pMA5 UTR-RMA-F | AGAGCGAAAATGCCTCACATTTGTGTATATTAGAAAGGAGGAATATATAATGGATTCTCGTACTACAGCTCACGTA |
| pMA5 UTR-RMA-R | CGAGGTGAATTTCGACCTCTAGAACGCGTTTATTCTTTACCAAGAAGTTGAGCGATTTCTT |
| The underlined sequences are the mutated sites. | |
表选项
1.2.2 重组表达菌株的构建以合成的重组质粒pET28a-RmAsnase为模板,通过重叠延伸PCR引进突变点[18]。将重叠延伸PCR产物转入E. coli BL21(DE3) 感受态细胞中,涂布于卡那霉素抗性的LB固体平板上进行培养,挑取菌落形态正确的转化子进行培养并提取质粒送至天霖生物科技无锡有限公司进行测序分析,测序正确的突变体则用于表达。以重组质粒pET28a-A344E为模板,pMA5-RMA-F和pMA5-RMA-R为引物,PCR扩增,并用BamH Ⅰ和Mlu Ⅰ酶切质粒pMA5。将酶切产物与PCR扩增产物通过同源重组进行连接,将连接产物转入E. coli JM109感受态细胞中涂布于氨苄青霉素抗性的LB固体平板上过夜培养,挑取菌落形态正确的转化子进行PCR鉴定,验证正确的进行培养并提取质粒送天霖生物科技无锡有限公司进行测序分析。挑选测序正确的菌株进行培养并抽提质粒pMA5-A344E。将质粒pMA5-A344E转化到B. subtilis 168感受态细胞中,涂布在卡那霉素抗性的LB固体平板上过夜培养。挑菌落形态正确的转化子进行PCR鉴定,验证正确的进行培养送天霖生物科技无锡有限公司进行测序分析,若测序正确,即重组菌株B. subtilis 168/pMA5-A344E构建成功。以相同的方法构建重组菌株B. subtilis 168/pMA5 UTR-A344E。
1.2.3 L-天冬酰胺酶在大肠杆菌中的表达和纯化将重组菌接种于10 mL含卡那霉素抗性的LB液体培养基中,37 ℃、200 r/min条件下培养12 h后,按1%接种量转接至50 mL含相同抗性的LB液体培养基中,37 ℃、200 r/min条件下,培养至OD600达0.8–1.0时,加入IPTG置于25 ℃摇床中培养12 h之后,在4 ℃、10 000 r/min下离心10 min收集细胞,用PBS (pH 7.4,浓度为0.05 mol/L) 缓冲液洗涤并悬浮,并在冰水浴的条件下用超声破碎仪破碎细胞,破碎液在低温条件下离心25 min,去除细胞破碎杂质后获得的上清液用于后续的蛋白纯化。蛋白纯化的方法采用Ni-NTA柱亲和层析,具体过程根据公司提供的仪器操作步骤进行。
1.2.4 L-天冬酰胺酶在枯草芽孢杆菌中的表达将重组菌接种于10 mL含有终浓度为50 μg/mL卡那霉素抗性的LB液体培养基中,37 ℃、200 r/min条件下培养12 h后,按1%接种量转接到50 mL的LB液体培养基(含终浓度为50 μg/mL的卡那霉素)中,37 ℃培养24 h,培养结束后,离心收集菌体,超声破碎后收集上清即为粗酶液,用于酶活测定。
1.2.5 L-天冬酰胺酶活的测定L-天冬酰胺酶酶活测定通过计量酶促反应生成的氨气的量来计算。参考Nessler试剂法[19]测定酶活。酶促反应体系1 mL:800 μL含终浓度0.025 mol/L底物L-Asn的Tris-HCl缓冲液,pH调到酶的最适pH,100 μL稀释酶液,置于酶的最适温度的水浴锅中反应10 min,加入100 μL质量体积百分浓度为15%的三氯乙酸溶液终止反应。在10 000 r/min转速下,离心10 min。显色的反应体系含有200 μL奈斯勒试剂、200 μL离心的上清液、4.8 mL的ddH2O,室温静置反应10 min,测A450。空白对照为先加入三氯乙酸终止反应,再进行后续的水浴处理。酶活单位:在一定的反应条件下,1个酶活单位为每分钟产生1 μmol产物(氨气) 所需要的酶量。
1.2.6 酶的最适温度及温度稳定性最适温度:在pH 7.0的条件下,将反应体系分别置于30、35、40、45、50、55、60 ℃条件下反应10 min,测定酶活。
温度稳定性:将纯酶先置于30、45 ℃水浴锅中热处理35 h,定点取样,测定酶活,以放置0 h酶活为100%。
1.2.7 酶的最适pH及pH稳定性最适pH:将纯酶分别置于含有0.025 mol/L终浓度L-天冬酰胺的不同pH缓冲液中(0.05 mol/L醋酸盐缓冲液,pH 4.0–6.0;0.05 mol/L Tris-HCl缓冲液,pH 7.0–8.0;0.05 mol/L甘氨酸-NaOH缓冲液,pH 9.0–10.0),于45 ℃条件下反应10 min,测定酶活。
pH稳定性:将纯酶置于pH 5.0–10.0的缓冲液中,在4 ℃下放置15 h,最终在45 ℃、pH 7.0的条件下测定残余酶活,以放置0 h酶活为100%。
1.2.8 5 L罐发酵培养发酵罐发酵条件:以10%的接种量将种子培养基装入5 L发酵罐中,装液量2.0 L,培养温度37 ℃,通气量4.0 vvm,转速为600 r/min,pH 7.0 (通过50%氨水和补料培养基偶联实现pH的自动控制)。
2 结果与分析2.1 米黑根毛霉L-天冬酰胺酶基因RmAsnase的克隆与表达从NCBI数据库中检索R. miehei来源L-天冬酰胺酶的基因序列,长度为2 043 bp,合成重组质粒pET28a-RmAsnase,利用该质粒进行PCR扩增,电泳结果如图 1A所示,特异性条带位置与目标一致。将重组质粒pET28a-RmAsnase转入E. coli BL21(DE3) 感受态细胞中,构建重组菌株E. coli BL21/pET28a-RmAsnase,按照方法1.2.3对重组菌株进行诱导表达及纯化,SDS-PAGE分析结果见图 1B,菌株E. coli BL21/pET28a-RmAsnase在分子量75 kDa处有明显的蛋白表达条带,纯化酶液条带单一,RmAsnase在E. coli BL21(DE3) 中成功表达,比酶活为509.1 U/mg。
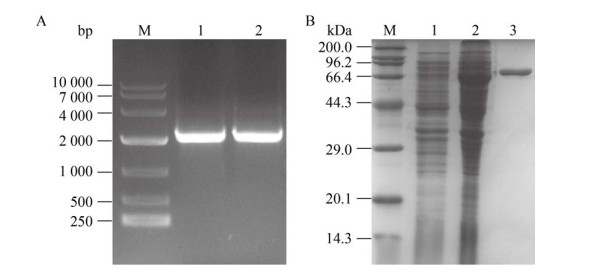 |
| 图 1 RmAsnase的基因克隆(A)、表达及纯化分析(B) Fig. 1 The cloning (A), expression and purification (B) of RmAsnase gene. (A) M: 10 000 marker; 1–2: gene RmAsnase. (B) M: protein marker; 1: E. coli BL21/pET28a crude enzyme; 2: E. coli BL21/pET28a-RmAsnase crude enzyme; 3: purified RmAsnase. |
| 图选项 |
2.2 突变位点的选择为提高RmAsnase的比酶活,根据RmAsnase的氨基酸序列,利用在线服务器SWISS-MODEL (http://swissmodel.expasy.org/),以PDB数据4R8L[20]晶体结构为模板,同源模拟RmAsnase的三维结构,同时将RmAsnase的氨基酸序列与其他3种不同来源的酶活较高的L-天冬酰胺酶进行对比分析,GenBank登录号如下所示:Thermococcus gammatolerans EJ3 (WP_015859055.1);Thermococcus kodakarensis (WP_011250607.1);Escherichia coli (WP_047644811.1)。通过序列比对显示RmAsnase的活性位点氨基酸为:T44、Y55、S147、T178、D179、K250。据文献报道,改变距离活力中心较近的点,能较大地影响酶活力[21]。通过RmAsnase的三维结构分析结合序列比对的结果,确定突变原则为避开活性位点,在其附近寻找保守区内的非保守位点。
2.3 突变体酶的构建、表达及纯化根据突变原则,按照1.2.2所述方法构建了R135G、A171G、I173V、V206L、V281P和A344E共6个突变株。将突变菌株进行诱导表达及纯化后,进行SDS-PAGE分析,结果显示蛋白条带大小均在75 kDa左右,与理论值相符(图 2)。对收集到的纯酶进行活性测定(图 3),酶活测定条件为以L-天冬酰胺为底物,在pH 7.0、45 ℃条件下,检测突变酶和野生酶的酶活。结果表明,突变酶A344E的比酶活与野生型相比显著提高,其比酶活为786.8 U/mg,为野生型比酶活的1.5倍。因此,下一步将对A344E进行酶学性质分析及三维结构模拟分析。
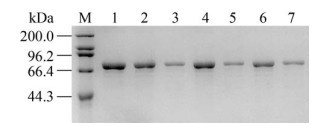 |
| 图 2 野生型RmAsnase和突变型RmAsnase的SDS-PAGE Fig. 2 SDS-PAGE analysis of wild type and mutant enzymes. M: protein marker; 1: wild type enzyme; 2: mutant enzyme R135G; 3: mutant enzyme A171G; 4: mutant enzyme I173V; 5: mutant enzyme V206L; 6: mutant enzyme V281P; 7: mutant enzyme A344E. |
| 图选项 |
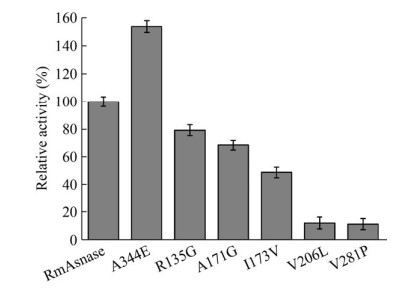 |
| 图 3 野生型RmAsnase和突变型RmAsnase的比酶活对比 Fig. 3 Comparison of specific enzyme activity between wild type and mutant enzymes. |
| 图选项 |
2.4 野生酶与突变酶的酶学性质比较2.4.1 温度对野生酶与突变酶A344E酶活及稳定性影响野生酶及突变酶在不同温度下的酶活结果见图 4A,从结果来看,野生酶最适温度为45 ℃,而突变酶A344E的最适温度发生了偏移为40 ℃,温度为40–50 ℃时,突变酶A344E仍能保持较高酶活,保留了80%以上的活性。将野生酶以及突变酶在30 ℃条件下热处理35 h后,测残余酶活,从结果来看,野生酶与突变酶A344E相对稳定,酶活基本没有损失。45 ℃条件下热处理20 h后野生型酶残余活性为58% (图 4B),而突变体酶的酶活性仅剩33% (图 4B)。这表明A344位点对L-天冬酰胺酶的热稳定性有一定的影响。
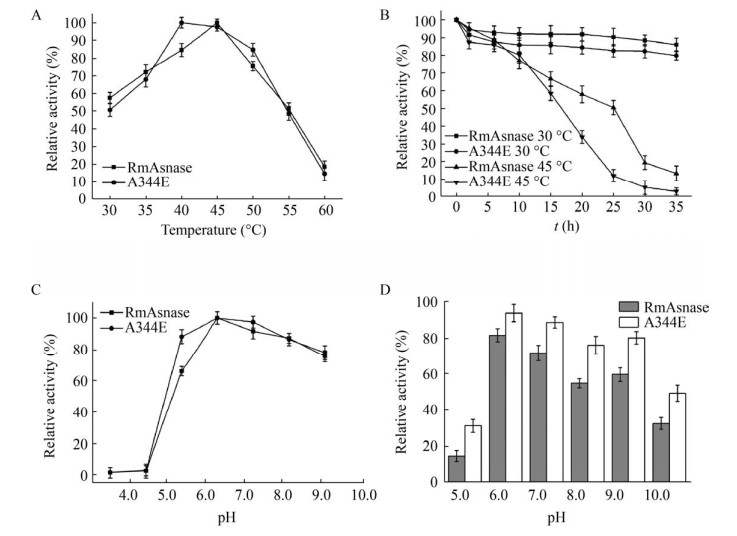 |
| 图 4 温度及pH对L-天冬酰胺酶活性和稳定性的影响 Fig. 4 Optimal temperature (A), thermal stability (B), optimal pH (C) and pH stability (D) of wild type and mutant enzymes. |
| 图选项 |
2.4.2 pH对野生酶与突变酶A344E酶活及稳定性的影响由图 4C可知,突变酶A344E与野生型酶的最适pH均为7.0,当pH在4.0–5.0之间时,酶活几乎为0,在pH 6.0–9.0之间时,突变酶A344E的相对酶活与野生酶对比相对较高,仍保持80%以上的酶活性。在pH稳定性实验中,由图 4D可以得出,野生型酶和突变酶则呈现类似的规律,但突变酶A344E较野生酶更为耐酸和耐碱。
2.5 三维结构模拟分析利用在线服务器SWISS-MODEL (http://swissmodel.expasy.org/),以PDB数据4R8L[20]晶体结构为模板,同源模拟RmAsnase以及A344E的三维结构,根据建立的三维结构模型,从氨基酸残基空间结构变化来分析突变酶A344E酶活提高的原因。图 5A显示A344位于α-螺旋处,突变后E344仍可形成α-螺旋,表明单点突变并没有引起蛋白结构较大的变化。为进一步探究A344E比酶活提高的原因,利用软件GROMACS 5.0.2版,对蛋白分子动力学进行模拟,检测其均方根涨落值(Root-mean-square fluctuation,RMSF),RMSF的高低能很好地表征蛋白质稳定性的好坏。如图 6所示,突变酶A344E的整体RMSF值高于野生酶,说明突变后的残基使酶蛋白残基整体变得松散进而导致酶的稳定性降低。344位氨基酸位于酶活性中心附近(图 5),由图 6可知,将344位氨基酸从丙氨酸突变成谷氨酸后,344位附近区域柔韧性增加,有利于底物进入,提高酶与底物结合区域结构的灵活性,从而导致比酶活增加
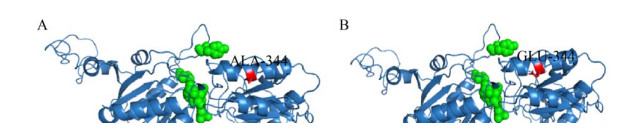 |
| 图 5 氨基酸残基突变前后RmAsnase三维结构的对比 Fig. 5 Comparison of protein 3-D structure between the wild type (A) and mutant enzyme (B). The green ball is the active site amino acid. |
| 图选项 |
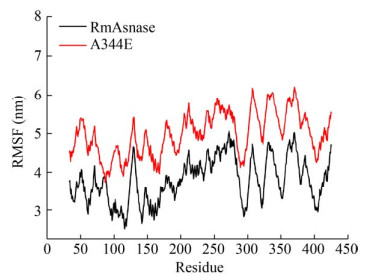 |
| 图 6 氨基酸残基突变前后RmAsnase RMSF值 Fig. 6 RMSF values between wild type and mutant enzymes. |
| 图选项 |
2.6 RmAsnase在枯草芽孢杆菌中的高效表达枯草芽孢杆菌是一种传统的模式菌株,它的发酵基础和生产技术相对成熟,且在发酵过程中不会产生毒副产物,通常被认为是食品安全菌株,因此,我们选择枯草芽孢杆菌作为宿主,用来生产L-天冬酰胺酶。Xiao等[22]设计了一个5′ UTR序列,以提高工业菌株地衣芽孢杆菌DW2的蛋白质产量。这个序列只包含约30 nt,并在打开的阅读框之前形成一个发夹结构。该元件能够提高纳豆激酶和角蛋白酶等靶蛋白的表达量。这种5′ UTR可以促进SD序列和起始密码子的可及性,从而提高翻译起始的效率。按照1.2.2的方法,以B. subtilis 168为宿主,以质粒pET28a-A344E为模板扩增基因片段,构建重组菌株B. subtilis168/ pMA5-A344E。根据文献报道的UTR序列(GTATATTAGAAAGGAGGAATATATA),设计包含UTR序列的引物pMA5 UTR-RMA-F、pMA5 UTR-RMA-R (表 1),以B. subtilis 168为宿主,以质粒pMA5-A344E为模板扩增基因片段,构建菌株B. subtilis 168/pMA5 UTR-A344E,对原始菌株B. subtilis 168/pMA5-A344E以及B. subtilis 168/pMA5 UTR-A344E于37 ℃发酵24 h,收集菌体破碎细胞,获得粗酶液进行酶活测定。由图 7可知,B. subtilis 168/pMA5 UTR-A344E酶活显著提高,经测定,酶活由原始的1.7 U/mL提高到12.2 U/mL,破碎细胞上清液中粗酶液比活力由0.5 U/mg提高到3.1 U/mg。
 |
| 图 7 重组枯草芽孢杆菌的酶活测定图 Fig. 7 Enzyme activity of recombinant Bacillus subtilis. 1: blank control; 2: B. subtilis 168/pMA5-A344E crude enzyme. 3: B. subtilis 168/pMA5 UTR-A344E crude enzyme. |
| 图选项 |
2.7 重组菌B. subtilis 168/pMA5 UTR-A344E的5 L罐发酵利用发酵罐进行发酵可以更好地对溶氧、pH、消除泡沫及补料等进行实时控制,从而有利于L-天冬酰胺酶的生产。根据方法1.2.8,对B. subtilis 168/pMA5 UTR-A344E在5 L发酵罐中的发酵酶活情况进行研究。从图 8可以看出,22–26 h重组菌B. subtilis 168/pMA5 UTR-A344E处于稳定期,30 h后重组菌进入衰亡期。从各个阶段的发酵情况可以看出,L-天冬酰胺酶的产量随着菌体生物量的升高而升高,发酵26 h时菌体生物量达到最大值,此时L-天冬酰胺酶酶活高达489.1 U/mL。
 |
| 图 8 重组菌5 L罐发酵结果 Fig. 8 The fermentation profile of B. subtilis 168/pMA5 UTR-A344E in 5 L fermenter. |
| 图选项 |
3 讨论现已报道的L-天冬酰胺酶中,其最适反应条件在温度和pH偏好性方面与商业化应用条件不匹配。本研究作为前人研究的补充,重点关注温度在40–50 ℃以及pH在6.0–9.0范围的酶。将R. miehei来源的L-天冬酰胺酶编码基因RmAsnase在大肠杆菌E. coli BL21(DE3) 中进行异源表达,将RmAsnase的氨基酸序列与其他3种不同来源的酶活较高的L-天冬酰胺酶进行对比分析,根据序列比对结果以及三维结构模拟结果,选取了活性中心附近保守区内的非保守位点进行突变。突变酶A344E的比酶活为786.8 U/mg,是野生酶的1.5倍,根据分子动力学模拟结果,突变酶A344E的整体RMSF值高于野生酶,推测突变体A344E底物结合区域结构的柔韧性增加,有利于底物进入,从而导致比酶活增加。对此还需对该点进行饱和突变及晶体结构解析。对A344E酶学性质进行研究,如表 2所示,该酶在温度40–50 ℃、pH 6.0–9.0范围内仍能保持较高的催化活力。根据来源可将L-天冬酰胺酶人为地分为嗜热菌L-天冬酰胺酶和非嗜热菌L-天冬酰胺酶。嗜热菌L-天冬酰胺酶的比酶活及发酵罐水平酶活产量较高,但其作用温度要求较高,在60 ℃以下基本没有酶活,难以满足工业化应用。目前已报道的非嗜热菌来源的L-天冬酰胺酶pH作用范围往往为中性或偏碱性,本研究构建的重组L-天冬酰胺酶最适pH范围为6.0–9.0,在弱酸性条件下也能保持80%以上的酶活,进一步拓宽了L-天冬酰胺酶在食品、医药行业中的应用,且其比酶活与大部分非嗜菌热来源的L-天冬酰胺酶相比处于较高水平(表 2),其对环境变化高度适应,这与大部分报道的L-天冬酰胺酶相比具有明显的优势,初步具备了工业化应用特征。
表 2 不同来源L-天冬酰胺酶酶学性质及微生物发酵情况比较Table 2 Comparison of enzymatic properties and microbial fermentation of L-asparaginase from different sources
| Classification | Source | Optimal pH | Optimal temperature (℃) | Specific activity (U/mg) | Expression host | Enzyme production (U/mL) | References |
| Thermophilic L-asparaginase | Pyrococcus yayanosii | 8.0 | 95 | 1 483.00 | B. subtilis | 6 324.00 | [23] |
| Thermococcus gammatolerans | 8.5 | 85 | 5 381.00 | nr | nr | [23] | |
| Non-thermophilic L-asparaginase | B. subtilis | 7.5 | 40 | 92.00 | B. subtilis | 407.60 | [24] |
| Erwinia carotovora | 8.0–8.5 | 37 | 430.00 | E. coli | 96.78 | [25-27] | |
| Vibrio succinogenes | 7.3 | 45 | 200.00 | nr | nr | [28] | |
| Nocardiopsis alba | 8.0 | 37 | 93.28 | E. coli | 158.10 | [29-30] | |
| Saccharomyces cerevisiae | 8.8 | 37 | 196.20 | P. pastoris | 86.50 | [31] | |
| Rhizomucor miehei | 6.0–9.0 | 40–50 | 786.80 | B. subtilis | 489.10 | This study | |
| nr means not reported. | |||||||
表选项
目前商业化的L-天冬酰胺酶主要由非食品级菌株大肠杆菌及生长周期较长的曲霉生产,大肠杆菌发酵生产L-天冬酰胺酶产量低且容易产生内毒素等有害物质,不利于其在食品及医药行业中的应用。为契合实际应用,进一步将突变体基因导入食品安全菌株枯草芽孢杆菌中,在此基础上利用UTR改造策略,提高突变体酶蛋白在枯草芽孢杆菌中的表达量,其酶活相比于原始菌株提高了7.2倍,对重组菌B. subtilis168/pMA5 UTR-A344E进行5 L罐研究,最终产量为489.1 U/mL。本研究构建的重组L-天冬酰胺酶生产菌的比酶活及发酵罐产酶水平还有一定的提升空间,接下来可以尝试分子改造、发酵过程优化等策略来进一步提高其比酶活及发酵罐产酶水平。
参考文献
| [1] | Friedman M. Chemistry, biochemistry, and safety of acrylamide: a review. J Agric Food Chem, 2003, 51(16): 4504-4526. |
| [2] | Eisele N, Linke D, Bitzer K, et al. The first characterized asparaginase from a basidiomycete, Flammulina velutipes. Bioresour Technol, 2011, 102(3): 3316-3321. DOI:10.1016/j.biortech.2010.10.098 |
| [3] | Oza VP, Parmar PP, Patel DH, et al. Cloning, expression and characterization of L-asparaginase from Withania somnifera L. for large scale production. Biotech, 2011, 1(1): 21-26. |
| [4] | Sahu MK, Sivakumar K, Poorani E, et al. Studies on L-asparaginase enzyme of actinomycetes isolated from estuarine fishes. J Environ Biol, 2007, 28(2 Suppl): 465-474. |
| [5] | Vidya J, Sajitha S, Ushasree MV, et al. Genetic and metabolic engineering approaches for the production and delivery of L-asparaginases: an overview. Bioresour Technol, 2017, 245: 1775-1781. DOI:10.1016/j.biortech.2017.05.057 |
| [6] | Paul T, Mondal A, Bandyopadhyay TK. Isolation, purification, characterisation and application of L-ASNase: a review. Recent Pat Biotechnol, 2019, 13(1): 33-44. |
| [7] | Yano S, Minato R, Thongsanit J, et al. Overexpression of typeⅠ L-asparaginase of Bacillus subtilis in Escherichia coli, rapid purification and characterisation of recombinant type Ⅰ L-asparaginase. Ann Microbiol, 2008, 58(4): 711-716. |
| [8] | Onishi Y, Yano S, Thongsanit J, et al. Expression in Escherichia coli of a gene encoding type Ⅱ L-asparaginase from Bacillus subtilis, and characterization of its unique properties. Ann Microbiol, 2010, 61(3): 517-524. |
| [9] | Vinci RM, Mestdagh F, De Meulenaer B. Acrylamide formation in fried potato products-present and future, a critical review on mitigation strategies. Food Chem, 2012, 133(4): 1138-1154. |
| [10] | Virk-Baker MK, Nagy TR, Barnes S, et al. Dietary acrylamide and human cancer: a systematic review of literature. Nutr Cancer, 2014, 66(5): 774-790. |
| [11] | Capuano E, Ferrigno A, Acampa I, et al. Effect of flour type on Maillard reaction and acrylamide formation during toasting of bread crisp model systems and mitigation strategies. Food Res Int, 2009, 42(9): 1295-1302. |
| [12] | Hedegaard RV, Frandsen H, Skibsted LH. Kinetics of formation of acrylamide and Schiff base intermediates from asparagine and glucose. Food Chem, 2008, 108(3): 917-925. |
| [13] | 左少华. 耐热L-天冬酰胺酶的性质鉴定及酶法控制食品中丙烯酰胺含量的研究[D]. 无锡: 江南大学, 2015. Zuo SH. Characterization of thermostable L-asparaginases and enzymatic control of acrylamide level in food[D]. Wuxi: Jiangnan University, 2015 (in Chinese). |
| [14] | Lehmann M, Wyss M. Engineering proteins for thermostability: the use of sequence alignments versus rational design and directed evolution. Curr Opin Biotechnol, 2001, 12(4): 371-375. |
| [15] | Long SQ, Zhang X, Rao ZM, et al. Amino acid residues adjacent to the catalytic cavity of tetramer L-asparaginase Ⅱ contribute significantly to its catalytic efficiency and thermostability. Enzyme Microb Technol, 2016, 82: 15-22. |
| [16] | Sudhir AP, Agarwaal VV, Dave BR, et al. Enhanced catalysis of L-asparaginase from Bacillus licheniformis by a rational redesign. Enzyme Microb Technol, 2016, 86: 1-6. |
| [17] | Verma S, Mehta RK, Maiti P, et al. Improvement of stability and enzymatic activity by site-directed mutagenesis of E. coli asparaginase Ⅱ. Biochim Biophys Acta, 2014, 1844(7): 1219-1230. |
| [18] | 张显, 龙水清, 饶志明, 等. 定点突变提高枯草芽孢杆菌L-天冬酰胺酶的活力及稳定. 食品与生物技术学报, 2015, 34(11): 1128-1134. Zhang X, Long SQ, Rao ZM, et al. Improving the activity and stability of L-asparaginase from Bacillus subtilis by site-directed mutagenesis. J Food Sci Biotechnol, 2015, 34(11): 1128-1134 (in Chinese). |
| [19] | Singh Y, Gundampati RK, Jagannadham MV, et al. Extracellular L-asparaginase from a protease- deficient Bacillus aryabhattai ITBHU02: purification, biochemical characterization, and evaluation of antineoplastic activity in vitro. Appl Biochem Biotechnol, 2013, 171(7): 1759-1774. |
| [20] | Schalk AM, Antansijevic A, Caffrey M, et al. Experimental data in support of a direct displacement mechanism for type Ⅰ/Ⅱ L-asparaginases. J Biol Chem, 2016, 291(10): 5088-5100. |
| [21] | Xie Y, An J, Yang GY, et al. Enhanced enzyme kinetic stability by increasing rigidity within the active site. J Biol Chem, 2014, 289(11): 7994-8006. |
| [22] | Xiao J, Peng B, Su ZW, et al. Facilitating protein expression with portable 5'-UTR secondary structures in Bacillus licheniformis. ACS Synth Biol, 2020, 9(5): 1051-1058. |
| [23] | 李谞. Pyrococcus yayanosii CH1 L-天冬酰胺酶的分子改造及表达优化[D]. 无锡: 江南大学, 2019. Li X. Molecular modification and expression optimization of Pyrococcus yayanosii CH1 L-asparaginase[D]. Wuxi: Jiangnan University, 2019 (in Chinese). |
| [24] | Feng Y, Liu S, Jiao Y, et al. Enhanced extracellular production of L-asparaginase from Bacillus subtilis 168 by B. subtilis WB600 through a combined strategy. Appl Microbiol Biotechnol, 2017, 101(4): 1509-1520. |
| [25] | Warangkar SC, Khobragade CN. Purification, characterization, and effect of thiol compounds on activity of the Erwinia carotovora L-asparaginase. Enzyme Res, 2010, 2010: 165878. |
| [26] | Kotzia GA, Lappa K, Labrou NE. Tailoring structure-function properties of L-asparaginase: engineering resistance to trypsin cleavage. Biochem J, 2007, 404(2): 337-343. |
| [27] | Goswami R, Hegde K, Dasu VV. Production and characterization of novel glutaminase free recombinant L-asparaginase Ⅱ of Erwinia carotovora subsp. atroseptica SCRI 1043 in E. coli BL21(DE3). Brit Microbiol Res J, 2015, 6(2): 95-112. |
| [28] | Distasio JA, Niederman RA, Kafkewitz D, et al. Purification and characterization of L-asparaginase with anti-lymphoma activity from Vibrio succinogenes. J Biol Chem, 1976, 251(22): 6929-6933. |
| [29] | Meena B, Anburajan L, Vinithkumar NV, et al. Molecular expression of L-asparaginase gene from Nocardiopsis alba NIOT-VKMA08 in Escherichia coli: a prospective recombinant enzyme for leukaemia chemotherapy. Gene, 2016, 590(2): 220-226. |
| [30] | Meena B, Anburajan L, Dheenan PS, et al. Novel glutaminase free L-asparaginase from Nocardiopsis alba NIOT-VKMA08: production, optimization, functional and molecular characterization. Biopr Biosyst Eng, 2015, 38(2): 373-388. |
| [31] | Ferrara MA, Severino NMB, Mansure JJ, et al. Asparaginase production by a recombinant Pichia pastoris strain harbouring Saccharomyces cerevisiae ASP3 gene. Enzyme Microb Technol, 2006, 39(7): 1457-1463. |
