

浙江大学 化学工程与生物工程学院,浙江 杭州 310027
收稿日期:2020-11-25;接收日期:2021-03-24;网络出版时间:2021-04-12
基金项目:国家重点研发计划(No. 2018YFA0901800),国家自然科学基金(No. 21776244),浙江省自然科学基金(Nos. LZ20B060002,18B060001) 资助
作者简介:于洪巍??浙江大学化学工程与生物工程学院教授。长期从事生物催化与转化研究,利用蛋白质工程和代谢工程手段,提高了多种化学品的生物合成效率。在包括Nature Communications、Metabolic Engineering、Biotechnology and Bioengineering、Chemical Communications、ACS Catalysis、ACS Synthetic Biology等高影响力期刊上以通讯作者身份发表SCI文章80余篇。以第一完成人获得中国发明专利授权21项。工业化成果连续荣获浙江省药学会科技进步一等奖和中国石油和化学工业联合会技术发明二等奖.
摘要:萜类化合物是一类种类繁多、功能多样的化合物,部分具有抗癌、增强免疫力等作用,具有良好的生物活性,在食品、保健品以及医疗等领域应用广泛。近年来,随着对萜类化合物生物合成途径研究的深入,研究人员采用代谢工程手段构建了多种萜类产物的高产酿酒酵母工程菌株,部分已经达到或者接近工业化生产水平。因此,采用合成生物学相关技术手段合成萜类化合物,有望取代化学合成或者传统的提取模式,成为天然萜类产物的新型生产方法。文中以常见的几种萜类产物为例,介绍并探讨萜类产物的生物合成策略以及合成生物学方面的研究进展。
关键词:萜类化合物酿酒酵母代谢改造调控策略生物合成
Advances in metabolic engineering of Saccharomyces cerevisiae for terpenoids biosynthesis
Mingkai Chen, Lidan Ye, Hongwei Yu


College of Chemical Engineering and Biological Engineering, Zhejiang University, Hangzhou 310027, Zhejiang, China
Received: November 25, 2020; Accepted: March 24, 2021; Published: April 12, 2021
Supported by: National Key Research and Development Program of China (No. 2018YFA0901800), National Natural Science Foundation of China (No. 21776244), Zhejiang Provincial Natural Science Foundation of China (Nos. LZ20B060002, 18B060001)
Corresponding author: Hongwei Yu. Tel/Fax: +86-571-88273997; E-mail: yuhongwei@zju.edu.cn.
Abstract: Terpenoids are a group of structurally diverse compounds with good biological activities and versatile functions such as anti-cancer and immunity-enhancing effects, and are widely used in food, healthcare and medical industries. Facilitated by the increasing understandings on the natural biosynthetic pathways of terpenoids in recent years, Saccharomyces cerevisiae has been engineered into high-yield strains for production of a variety of terpenoids, some of which have reached or become close to the level required by industrial production. In this connection, synthetic biology driven biotechnological production of terpenoids has become a promising alternative to chemical synthesis and traditional extraction approaches. This article summarizes the recent process in engineering S. cerevisiae for terpenoids biosynthesis, highlighting the effect of synthetic biology strategies by taking a couple of typical terpenoids as examples.
Keywords: TerpenoidsSaccharomyces cerevisiaemetabolic engineeringregulation strategiesbiosynthesis
萜类化合物在自然界中广泛存在且种类繁多,其中许多化合物被证明具有特殊的理化性质和生物活性,可用作保健品、药物、香料等,因此具有巨大的经济价值和广阔的市场前景[1]。除此之外,某些萜类化合物的分子结构和理化性质与燃料相近,因此被认为是良好的生物燃料分子[2]。
然而,萜类化合物作为一种次级代谢产物,在生物体中含量极低。且天然来源的萜类化合物主要存在于植物中,以植物为主要载体进行生产不仅需要大量的土地资源,还易受到气候条件影响,难以进行可持续的工业化生产。此外,由于萜类化合物独特的分子结构,化学合成法合成步骤多,终产率低[3],且环境友好性差,同样难以满足日渐增长的市场需求。
相比于萜类化合物的天然生产者,模式微生物酿酒酵母具有遗传背景清晰、公认安全(Generally recognized as safe,GRAS)、生长周期短、便于遗传操作且培养成本低廉等优点[4]。近年来,随着合成生物学和代谢工程的快速发展,越来越多的萜类化合物合成途径得以解析并重新构建于工程菌株中[5-6],极大地提高了萜类化合物的生物合成能力,也为利用微生物以廉价碳源和氮源为原料进行高附加值萜类化合物的工业合成奠定了良好的基础。微生物合成萜类化合物的产量主要取决于生物合成途径的畅通性以及外源途径与底盘细胞的适配程度。前者主要受到关键步骤催化酶的性能以及前体物质供应情况的制约,后者则取决于代谢通路的调控和细胞资源的合理分配。本文中,笔者将对酿酒酵母合成的典型萜类化合物进行综述,总结近几年来代谢改造酿酒酵母生产萜类化合物的主要策略和进一步提升合成效率的可能方向,为酿酒酵母高效细胞工厂的构建提供可借鉴的经验,进而推动萜类化合物的高产乃至工业化。
1 酿酒酵母合成萜类化合物途径解析1.1 共同前体合成途径存在于植物细胞胞质中的甲羟戊酸(Mevalonic acid,MVA) 途径为萜类化合物的合成提供前体。酿酒酵母具有高度相似的MVA途径,并具有内质网、高尔基体、过氧化物酶体等亚细胞结构以及翻译后修饰机制,能够很好地表达动植物来源的蛋白质。相比于大肠杆菌、藻类、霉菌等,酿酒酵母被认为更适合用作萜类产物合成的底盘细胞。在酿酒酵母中,萜类化合物主要由两种C5前体——异戊烯基焦磷酸(Isopentenyl diphosphate,IPP)和二甲基烯丙基焦磷酸(Dimethylallyl diphosphate,DMAPP)为基础单元合成,其中IPP源于乙酰辅酶A通过甲羟戊酸途径的多步转化(图 1):乙酰辅酶A转移酶Erg10催化两分子乙酰辅酶A形成乙酰乙酰辅酶A (Acetoacetyl-CoA),随后与另一个乙酰辅酶A分子在3-甲基-3-羟基戊二酰辅酶A合酶(3-hydroxy-3-methylglutaryl coenzyme A synthase,HmgS) 的作用下缩合形成3-甲基-3-羟基戊二酰辅酶A (3-hydroxy-3-methylglutaryl coenzyme A,HMG-CoA)[7]。随后,HMG-CoA被还原为甲羟戊酸,催化这一步骤的HMG-CoA还原酶是MVA途径的限速步骤[8]。甲羟戊酸经过两次磷酸化和脱羧形成IPP。IPP通过异戊二烯二磷酸异构酶(Idi1) 的作用与DMAPP相互转化。在异戊二烯基转移酶的催化作用下,基于IPP和DMAPP进一步产生了C10化合物香叶基焦磷酸(Geranyl pyrophosphate,GPP)、C15化合物法尼基焦磷酸(Farnesyl pyrophosphate,FPP) 和C20化合物香叶基香叶基焦磷酸(Geranylgeranyl pyrophosphate,GGPP) 等。这些焦磷酸物质是酿酒酵母合成萜类化合物的重要前体物质,也是萜类合成酶的直接底物[9-10]。
 |
| 图 1 酿酒酵母合成天然萜类产物途径 Fig. 1 Synthetic pathway of terpenoids in S. cerevisiae. |
| 图选项 |
1.2 萜类化合物合成途径根据所含C5基本结构单元的数量,萜类化合物可分为半萜(C5)、单萜(C10)、倍半萜(C15)、二萜(C20) 等,以此类推。绝大多数萜类化合物的烯烃骨架由萜类合成酶催化IPP、DMAPP、FPP、GGPP等产生,这类反应常伴随着一系列立体选择性的催化步骤,将底物所带的磷酸基团去除,反应过程涉及磷酸基团的电离以及质子消除等复杂的化学过程。这类酶的结构高度保守且多数不天然存在于酵母中[11-12],因此,需要在酿酒酵母中异源表达植物或者其他生物来源的萜类合成酶。为了实现蛋白质的异源表达,往往需要根据密码子偏好性对编码序列进行密码子优化,并对定位信号序列进行查找和切除[13]。以这些烯烃骨架为基本结构合成萜类化合物,再通过羟基化、糖基化、环氧化等修饰,可得到生物活性更加多样化的各种衍生物[14]。在此类修饰过程中,细胞色素P450酶起到非常重要的作用。P450酶可以催化多种氧化还原反应,包括羟基化、环氧化、氮氧化、脱胺等[15]。相比于大肠杆菌,酿酒酵母能更有效地表达此类相对复杂的酶,目前已应用于实验室合成紫穗槐二烯和青蒿酸等萜类化合物中[16]。
2 酿酒酵母合成萜类化合物的途径构建和代谢优化直接在酿酒酵母中引入外源的萜类化合物合成途径,往往产量不高,主要存在关键酶活性或者表达水平低、前体供应不足、产物合成与细胞生长顾此失彼等问题。针对这些问题,近年来已经报道了一系列改造与调控策略(图 2),成功地提高了酿酒酵母合成萜类物质的能力。
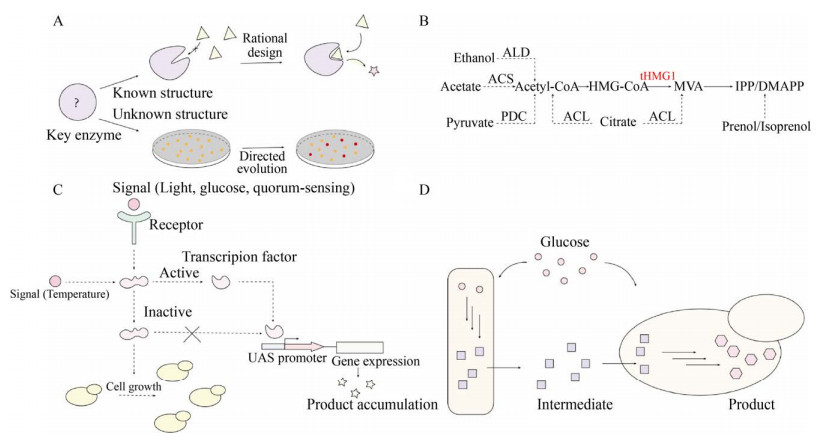 |
| 图 2 酿酒酵母合成萜类化合物的典型改造策略 Fig. 2 Typical strategies for engineering Saccharomyces cerevisiae for terpenoids synthesis. (A) Engineering key enzymes. (B) Strengthening precursor supply. (C) Dynamic regulation of genes involved in synthetic pathways. (D) Modular pathway engineering. |
| 图选项 |
2.1 异源萜类合成酶的表达与改造异源基因的功能表达是萜类产物合成途径构建的关键和主要挑战。虽然酿酒酵母具有与植物一致的MVA途径,为萜类产物提供前体物,且拥有内质网、高尔基体和过氧化物酶体等合成萜类产物所需的关键细胞器和翻译后修饰系统,能够有效表达结构较复杂的酶,但由于胞内微环境如温度、pH等不同以及翻译后修饰机制的差异,异源萜类产物合成酶在酿酒酵母中往往存在表达量低、酶活性不足等问题,限制了合成效率的提高[17]。因此可以通过数据库挖掘甚至宏基因组学手段获取挖掘不同物种来源的萜类合成酶进行关键步骤或多个步骤的催化,从中选择催化活性最高的酶进行目标产物的合成。Chen等[18]通过挖掘不同来源的CrtE、CrtI和CrtB,发现三孢布拉氏霉来源的CrtI催化性能最好,并基于此对3种酶的表达水平进行了进一步的组合优化,辅以转录因子INO2的上调和YJL064W、ROX1、DOS2位点的敲除,将番茄红素的产量提高了22倍。
植物来源的某些萜类合成酶N端含有一段短肽,用于将酶定位到特定的胞内部位如质体,该序列在酶蛋白到达目标部位后被切除[19]。而酿酒酵母没有切除质体定位信号肽的机制,因此信号肽的存在可能影响蛋白质的正确折叠,造成萜类合成酶异源表达活性不高。信号肽切除作为通用性策略,能在一定程度上解决蛋白质异源表达困难的问题,从而促进目标产物合成。Jiang等[20]通过对长春花来源的香叶醇合酶N端截短位置的设计和验证,得到了4种截短版本的香叶醇合酶,验证结果表明其活性均有所上升,其中最优的突变体使香叶醇的合成效率提高了4.45倍。笔者课题组在合成维生素E生育三烯酚的工作中,为了优化2-甲基-6-香叶基香叶基苯并喹啉甲基转移酶、生育酚酸环化酶以及γ-生育酚甲基转移酶的表达,也利用计算机软件预测了信号肽切除位点,但结果显示软件预测的最优方案与实际实验中活性提高最显著的切除位点存在一定偏差[13],因此在实际操作中建议选取多个位点进行测试。此外,这种策略并不是对所有酶都有显著效果。为了在酿酒酵母中实现萜类天然产物的高效合成,往往还需要对这些限速酶进行分子改造和/或表达调控以实现有效的催化。
对于构效关系已知的限速酶,理性设计或者半理性设计能够有效地改善其催化性能(图 2A)。Ding等[21]利用计算机辅助计算模拟酶与底物对接,并预测了6种GGPP合酶的活性及其参与合成紫杉二烯的催化效率,且实验结果与预测结果相吻合,表明计算机辅助计算可以对如何突破关键酶活性的瓶颈提供指导。Sun等[22]通过对来源于植物的P450单加氧酶CYP72A63进行理性设计,实现了4种稀有甘草三萜化合物的特异性合成。但是,对于生物合成途径中的多数酶,其晶体结构和构效关系尚未解析,难以进行有效的理性改造,现阶段更多的是通过定向进化的手段来提高限速酶的催化性能。定向进化不依赖于蛋白结构、催化机理等背景信息,但是为了从海量的定向进化突变体库中准确获取具有目标性状的阳性突变体,需要建立快速、简便、可靠的高通量筛选方法(图 2A)。因此,定向进化的应用主要限于能够与生长或者色素合成相偶联的反应催化酶的改造。对于类胡萝卜素合成途径中的部分关键酶,可以直接基于菌落颜色的变化建立高通量筛选方法,定向获得活性或者特异性提高的阳性突变体。Xie等[23]基于番茄红素和β-胡萝卜素的颜色差异建立了高通量筛选方法,对双功能酶八氢番茄红素合酶/番茄红素环化酶进行了定向进化,获得了仅具八氢番茄红素合酶活性的突变体,大幅提高了番茄红素的纯度。Zhou等[24]基于β-胡萝卜素与其酮基化产物的颜色差异对β-胡萝卜素酮化酶进行定向进化,获得了活性提高的阳性突变体。但在生物合成途径中,多数酶催化反应步骤缺少可直接检测的指标变化;即便是在色素类物质的合成途径中,也仅有少数步骤伴随着颜色变化,如β-胡萝卜素羟化酶催化的反应就没有显著的颜色变化。考虑到由β-胡萝卜素(黄色) 到虾青素(红色) 的生物转化是β-胡萝卜素羟化酶与酮化酶共同催化的结果,笔者利用虾青素与β-胡萝卜素之间的颜色差异建立了高通量筛选方法,对β-胡萝卜素酮化酶和β-胡萝卜素羟化酶的表达盒进行共定向进化,同步提高了酮基化和羟基化效率,从而进一步提高了虾青素的产量。这种以反应终产物作为指示剂,基于酶的联合催化设计的高通量筛选策略不仅适用于代谢途径自身的改造,对于其旁路途径的改造也同样有效。笔者通过引入番茄红素合成途径作为指示,利用前体合成途径代谢流与番茄红素产量之间的正相关性建立了颜色指示的高通量筛选方法,对前体合成途径的3个限速酶Dxs、Dxr和Idi进行了共定向进化,随后将阳性突变体用于异戊二烯合成,有效提高了大肠杆菌的异戊二烯产量[25]。与此类似,Furubayashi等[26]以类胡萝卜素途径作为指示,对蒎烯合酶的催化区域进行定向进化,通过颜色的变化表征酶的活性,获得了活性提高的突变体。这种利用旁路途径产物的颜色变化对共同前体途径进行改造的新型高通量筛选思路,为非色素萜类天然产物关键酶的定向进化提供了思路。由于萜类产物普遍以IPP、DMAPP、FPP、GGPP等为代谢前体,而这类焦磷酸物质在过度积累的情况下具有细胞毒性[27],还可以基于中间产物的细胞毒性及其在加速转化后的毒性缓解现象,在萜类合酶的活性和细胞生长之间建立联系,建立基于生长指示的高通量筛选方法。笔者在改造酿酒酵母合成异戊二烯的过程中,构建了过度积累DMAPP的出发菌株,并根据菌落大小变化对异戊二烯合酶突变体进行了筛选,获得了产量提高3.8倍的阳性突变体,从而显著促进了异戊二烯的合成[28]。
除了蛋白质的改造、基因拷贝数的调整,启动子、终止子等元件的设计、筛选和匹配[29-30],上下游关键酶的融合表达或者依托蛋白支架的多酶表达体系构建等手段的应用,也能够通过调控限速酶的表达量和催化性能而有效地提高目标产物的产量[31-32]。
2.2 前体物合成的强化在MVA途径中,HMG-CoA还原酶作为公认的限速酶受到重点关注。研究表明将HMG1基因截短可以有效提高MVA途径的通量,目前过表达截短的Hmg1 (tHmg1) 已经成为萜类化合物工程菌株增强前体物供应量的通用手段[33-34] (图 2B)。此外,对于较长的途径,过表达MVA途径中的其他相关酶(Erg10、Erg13、Erg12、Erg8、Erg19、Idi1等) 也可有效提高前体供应[16],从而提高目标产物的最终产量。在酿酒酵母中,乙酰辅酶A不仅作为MVA途径的前体,也是细胞生长过程中不可缺少的重要化合物。细胞中乙酰辅酶A的主要来源为糖酵解过程和三羧酸循环过程,因此加强酿酒酵母的基础代谢强度,提高糖酵解过程中的糖消耗能力,也能提高工程菌株的生产潜力。有研究表明过表达乙醛脱氢酶(ALD6)、丙酮酸脱羧酶(PDC) 和乙酰辅酶A合成酶(ACS) 可以有效提高细胞中乙酰辅酶A的供应,从而提高萜类化合物的产量[35]。在细胞质中引入异源乙酰辅酶A合成途径(图 2B) 也逐渐成为新的关注点,Kozak等[36]在酿酒酵母中成功表达了5种不同来源的乙酰乙醛脱氢酶,该途径几乎可以替代酵母自身的ACS依赖的乙酰辅酶A合成途径;Rodriguez等[37]在酿酒酵母中异源表达了来源于构巢曲霉、小鼠、圆红冬孢酵母的柠檬酸裂解酶,结合异柠檬酸脱氢酶的敲除,加强外源柠檬酸裂解途径,提高了乙酰辅酶A以及甲羟戊酸的产量。将生物合成途径定位到乙酰辅酶A充足的线粒体等细胞器中,是强化萜类化合物前体供应的另一种有效手段[38]。Farhi等[39]将负责瓦伦烯和紫穗槐二烯合成的异源倍半萜合酶定位到线粒体,使这两种萜类产物的产量分别提高3倍和7倍;笔者将整条MVA途径定位到线粒体中并通过细胞质和线粒体对乙酰辅酶A利用的双重调控,显著提高了酿酒酵母产异戊二烯[40]和芳樟醇[41]的能力。
为了绕开MVA途径和乙酰辅酶A等中心代谢途径产物,最近Chatzivasileiou等[42]提出了一种以异戊烯醇及戊烯醇为底物通过两步反应合成DMAPP和IPP的思路,可以通过外源添加异戊烯醇增强萜类化合物前体的供应(图 2B)。然而考虑到外源添加异戊烯醇造成的额外成本,该方法可能对高附加值的萜类产物合成具有更大的参考意义。
酿酒酵母在发酵生产的过程中会产生乙醇,而乙醇作为一种副产物不仅会竞争碳源,还会影响酿酒酵母的生长。因此,Yamada等[43]敲除了乙醇脱氢酶(Alcohol dehydrogenase,ADH1) 和丙酮酸脱羧酶1 (Pyruvate decarboxylase,PDC1) 以减少乙醇的生产,且通过调整糖酵解相关酶(Pgi1、Pfk1、Pfk2等) 编码基因的拷贝数,得到全局代谢工程菌株YPH499/dPdA3-34,使葡萄糖消耗和细胞数量均达到原来的1.3倍左右,且乙醇含量下降1.3倍,为萜类产物的底盘菌株优化提供了参考。
除乙醇外,酵母内源途径也会与目标萜类化合物的合成途径产生竞争。在利用FPP/GGPP为底物合成萜类化合物时,角鲨烯合成对前体物质的竞争会影响目标产物的得率。然而,由于角鲨烯下游产物麦角固醇是膜结构的重要组成部分,直接敲除角鲨烯合成基因ERG9影响细胞生长,因此普遍通过更换启动子等手段下调ERG9基因的表达。Xie等[23]和Ma等[44]利用葡萄糖诱导型启动子HXT1下调了ERG9的表达水平,分别提高了广藿香醇和β-胡萝卜素的产量,而Lenihan等、Paddon等[45-46]则分别利用甲硫氨酸和铜离子响应的启动子实现了ERG9的下调,提高了青蒿酸的产量。
2.3 合成途径的平衡调控酿酒酵母细胞生长和产物合成过程中,对胞内资源如前体物、能量、还原力等存在竞争,因此生物量与萜类化合物的产率往往难以兼顾。利用动态代谢调控实现合成途径基因的“适时转录”进而实现两阶段发酵,能够有效缓解细胞代谢压力,提高生物合成效率(图 2C)。培养条件如光照、温度、溶氧、培养基中碳源浓度、细胞密度等都可用作动态调控的输入信号对生物合成过程进行调控。Xie等[47]通过敲除Gal4抑制蛋白Gal80编码基因,使得GAL基因的表达免受成本较高的半乳糖控制,而响应培养基中的葡萄糖浓度。GAL80敲除菌株中GAL启动子的活性仅受Gal4调控。当酿酒酵母处于高葡萄糖浓度环境时,蛋白激酶Snf1和转录因子Mig1抑制GAL启动子,而在低葡萄糖浓度下,这种抑制被解除。该系统实现了高葡萄糖浓度抑制-低葡萄糖浓度诱导的动态调控,使酵母细胞生长阶段与产物积累阶段分离,显著提高了β-胡萝卜素产量。但该葡萄糖响应系统存在泄漏表达和严谨性不足等问题,对于细胞毒性较大的产物,仍然难以实现高密度发酵。在此基础上,笔者以温度为调控信号改进了此系统,以温度为输入信号设计调控模块,利用定向进化方法获得了Gal4的温敏突变体Gal4M9。该突变体响应于培养温度的改变,对目标途径的开启时间进行精确控制,从而实现产物合成阶段和生长阶段的分离。该系统用于番茄红素和虾青素的产物合成调控,成功实现了两者的高密度发酵[48]。由于Gal4在定向进化过程中发生了温度响应性和调控活性的trade-off,获得的Gal4M9的调控活性大幅降低,并且此调控系统要求长时间维持较低温度(24 ℃) 发酵,能耗较高,因此我们进一步设计了升级版本的冷击启动温度调控系统。以Gal4M9控制野生型Gal4的转录进而控制GAL启动子下的生物合成途径,可以实现调控信号的级联放大,从而补偿Gal4M9的活性损失,并且短时间的24 ℃培养即可激活野生型Gal4的持续表达,极大地节约了冷却水的使用量。利用此调控系统,成功实现了萜类衍生物生育三烯酚的高密度发酵[13]。研究者还在酿酒酵母中引入EL222光遗传转录系统,通过融合EL222与VP16的转录激活域以及细胞核定位序列构建了蓝光诱导基因表达的OptoEXP光遗传调控系统,利用OptoEXP和GAL系统共同调控,构建了黑暗条件诱导表达的OptoINVRT调控系统,实现了对酿酒酵母异源合成异丁醇和2-甲基-1-丁醇的光调控[49]。Williams等[50]则利用酿酒酵母细胞与细胞间的信息素感应系统,构建了细胞密度响应的调控系统,用于调控羟基苯甲酸(PHBA) 的生物合成。这些调控系统也都可以应用到萜类化合物生物合成的平衡调控中。
构建高产的异源合成途径,还需要有效地调整中心代谢途径,以确保代谢流尽可能多地通向目标产物。为此,David等[51]构建了丙二酰辅酶A的分层动态控制系统,动态调节途径通量和酶表达水平。一方面通过下调控制系统中内源丙二酰辅酶A合成脂肪酸的通路,促进中间体积累。另一方面,利用一种基于枯草芽孢杆菌FapR转录因子开发的新型丙二酰-CoA生物传感器来控制外源途径的表达水平,启动3-羟基丙酸(3-HP)的合成。分层控制的引入使3-HP的产量提高了10倍,并可应用于其他丙二酰辅酶A衍生产品的生产。该思路也可以应用到萜类天然产物的合成调控中。
途径的模块化调控也是生物合成途径平衡调控的重要手段之一。对于较长的萜类产物合成途径,以某一个或某几个关键代谢产物(如IPP/DMAPP、FPP、GGPP等) 为节点将整个途径拆分为几个模块,对各个模块分别进行途径调控和优化。Zhou等[6]利用模块化途径工程实现了产次丹参酮二烯酿酒酵母的构建和优化,通过发酵得到了365 mg/L次丹参酮二烯。最近,Srinivasan等[52]为了实现托烷类生物碱(TAs) 的从头合成,在酿酒酵母中敲除了8个内源基因,表达和整合了26个来源于植物、细菌、酵母或动物的基因,并对合成途径进行了人为划分。该系统结合酶蛋白的区室化功能表达以及异源转运蛋白促进模块内外物质转运通畅等策略,将托烷生物碱的合成分为5个功能模块:模块Ⅰ/Ⅱ和Ⅲ分别用于从头合成酰基受体和供体部分,然后通过模块Ⅴ将酰基受体和供体合成TA骨架,最后模块Ⅳ修饰TA骨架形成莨菪碱和东莨菪碱,实现了以单糖和氨基酸为原料合成天然产物。将途径的各个模块拆分到不同的菌株中,再通过共培养进行组装,本质上也是模块化调控的一种类型(图 2D)。Zhou等[53]将紫杉醇前体的合成途径分为两个模块,利用大肠杆菌快速生长合成紫杉二烯并利用酿酒酵母表达细胞色素P450酶将紫杉二烯氧化,获得了33 mg/L的氧化紫杉烷。
3 利用酿酒酵母合成典型萜类物质随着萜类物质合成的不断发展,以酿酒酵母为底盘细胞合成萜类产物的例子逐渐增多,表 1列举了利用酿酒酵母合成部分萜类产物的具体实例。下文将对代谢改造酿酒酵母合成几种典型萜类产物的现状展开分析。
表 1 酿酒酵母合成萜类化合物举例Table 1 Some examples of terpenoids synthesized by engineered Saccharomyces cerevisiae
| Type of terpenoids | Product | Engineering strategy | Production titer or yield | References |
| Semiterpenes | Isoprene | Push-Pull-Restrain strategy combining up-regulation of precursor supply in acetyl-CoA synthesis and the MVA pathway, increase of the isoprene forming flux, and down-regulation of the competing pathways; | 37 mg/L | [54] |
| mitochondrial and cytoplasmic dual regulation of acetyl-CoA utilization; | 2.527 g/L | [40] | ||
| combining Gal4-mediated expression enhancement and directed evolution of isoprene synthase; | 3.7 g/L | [28] | ||
| saturation mutagenesis of ISPS followed by reconstruction of metabolic balance between strengthened precursor supply and improved isoprene synthesis via adjusting copy numbers of MVD1 and IDI1 in mitochondria/cytoplasm dual regulation strain | 11.7 g/L | [55] | ||
| Monoterpenes | Geraniol | Deleting OYE2 and Atf1 to block the further conversion of geraniol, and dynamic control of ERG20 using the HXT1 promoter to redistribute the precursor GPP flux; | 1.69 g/L | [58] |
| comparing geraniol synthases (GES) from different sources and endogenous Erg20 variants, construction of Erg20-GES fusion protein, and strengthening the MVA pathway by overexpressing IDI1, tHMG1 and UPC2-1; | 293 mg/L | [57] | ||
| enhancing MVA pathway, screening, N-terminus truncation and site-directed mutation of GES, and fusion expression of GES and Erg20WW variant | 1.68 g/L | [20] | ||
| Limonene | Overexpression of Erg20 and Erg20WW, and fusion expression of limonene synthase with a neryl diphosphate synthase; | 23.7 mg/L | [59] | |
| dynamic regulation of ERG20 using PHXT1, and introduction of orthogonal synthesis pathway composed of neryl diphosphate synthase and limonene synthase | 917.7 mg/L | [60] | ||
| Sesquiterpenes | Patchoulol alcohol | Fusion expression of Erg20 and patchoulol synthase (PTS), enhancing the MVA pathway, down-regulation of ERG9 by PHXT1, and knock-out of DPP1 and LPP1; | 466.8 mg/L | [44] |
| global metabolic engineering using the cocktail delta-integration method to modulate the expression of the nine genes involved in patchoulol synthesis | 42.1 mg/L | [61] | ||
| Artemisinic acid | Down-regulation of ERG9 under Pmet upon methionine addition, and establishing a dissolved oxygen calculation model to optimize fermentation conditions; | 2.5 g/L | [45] | |
| GAL80 deletion using CRISPR-Cas9, and optimization of fermentation conditions; | 740 mg/L | [90] | ||
| down-regulation of ERG9 under PCTR3 in response to copper, and additional introduction of CYB5, ADH1 and ALDH1 | 25 g/L | [46] | ||
| Diterpenes | Sclareol | Identification of deletion mutants for higher sclareol production by iterative carotenogenic screens, resulting in a strain with six deletions (rox1, dos2, yer134c, vba5, ynr063w and ygr259c) showing a 12-fold increase in sclareol titers | 750 mg/L | [65] |
| Miltiradiene | Modular pathway engineering, fusion expression of labdadienyl/copalyl diphosphate synthase (SmCPS) and kaurene synthase-like protein (SmKSL) as well as the fusion of GGPP synthase and Erg20; | 365 mg/L | [6] | |
| construction of a geranylgeraniol high producing strain, screening different sources of miltiradiene synthase, construction of chimeric miltiradine synthase and protein modification | 3.5 g/L | [91] | ||
| Taxadiene | Overexpression of tHmg1 and Upc2-1, changing the source of GGPP synthase, and codon optimization of taxadiene synthase; | 8.7 mg/L | [67] | |
| using a CRISPR-Cas9 based cloning-free toolkit to optimize the expression of taxadiene synthase via screening promoters and introducing different protein localization, stabilizing or solubility tags; | 20 mg/L | [68] | ||
| multiple copies of taxadiene synthase fused with solubility tags, and its fusion expression with Erg20 | 129 mg/L | [69] | ||
| Vitamin A | Introduction of β-carotene synthesis pathway and β-carotene oxygenase into xylose-fermenting S. cerevisiae, and two-phase in situ extraction with dodecane as extractant | 3.335 g/L | [92] | |
| Triterpenes | Ginsenoside | Semi-rational design of glycosyltransferase for improved activity, preventing Rh2 degradation by steryl-beta-glucosidase (EGH1) deletion and increasing the supply of UDP-glucose precursor by overexpressing the synthesizing genes; | ~300 mg/L | [70] |
| modular engineering of the MVA pathway and optimization of P450 expression levels to improve protopanaxadiol (PPD) supply, increasing the copy number, engineering the promoter and directed evolution of glucosyltransferase | 2.25 g/L | [71] | ||
| Squalene | Over-expression of the MVA pathway and squalene synthase, introduction of HMG-CoA reductase from Silicibacter pomeroyi and overexpression of ADH2 and ADA from Dickeya zeae; | 9.47 g/L | [73] | |
| using peroxisomes as the subcellular compartment for squalene synthesis, and dual modulation of cytoplasmic and peroxisomal engineering | 11 g/L | [74] | ||
| β-amyrin | Down-regulating ADH1, ADH4, ADH5, ADH6, CIT2, MLS1 and ERG7 using CRISPRi to reduce the competitive consumption of acetyl-CoA and oxidosqualene, and increasing extracellular transportation by adding methyl β-cyclodextrin; | 156.7 mg/L | [76] | |
| strengthening acetyl-CoA supply by coupling endogenous and several heterologous acetyl-CoA synthesis pathways to β-amyrin production and disruption of acetyl-CoA competing pathway | 279 mg/L | [77] | ||
| α-amyrin | Engineering of α-amyrin synthase by semi-rational design and site-directed mutation, and overexpression of DGA1 to enhance the storage capacity of α-amyrin | 1.107 g/L | [78] | |
| Tetraterpenes | Lycopene | Directed evolution of CrtYB and CrtE, and adjustment of Crt gene copy numbers; | 1.61 g/L | [23] |
| screening of the Crt genes and adjusting the copy numbers, increasing the supply of acetyl-CoA, and balancing the supply of NADPH; | 3.28 g/L | [97] | ||
| overexpression of fatty acid synthesis genes to regulate triacylglycerol synthesis; | 2.37 g/L | [79] | ||
| down-regulating ERG9, knocking out DPP1, LPP1, ROX1, MOT3, directed evolution of CrtE and CrtB, overexpressing OLE1 and STB5 | 41.8 mg/g DCW | [93] | ||
| β-carotene | Overexpression of tHMG1, adding ketoconazole to inhibit the ergosterol pathway; | 6.29 mg/g DCW | [84] | |
| knocking out YPL062W, YJL064W, ROX1; | ~2.1 mg/g DCW | [94] | ||
| strengthening the endogenous synthesis (ERG19, ERG12 and ERG20 overexpression) and exogenous supplementation (oleic acid and palmitoleic acid) of unsaturated fatty acids; | 2.83 mg/g DCW | [86] | ||
| reducing the culture temperature (from 30 ℃ to 4 ℃) and supplementation of triclosan as an inhibitor of fatty acid synthesis to enhance the precursor supply for the MVA pathway; | 4.94 mg/g DCW | [85] | ||
| construction of glucose-responsive sequential control system for separation of cell growth and β-carotene synthesis | 20.79 mg/g DCW | [47] | ||
| Astaxanthin | Co-directed evolution of CrtZ and CrtW, and two-stage fermentation under control of the Gal4M9-based temperature-responsive dynamic regulation system; | 235 mg/L | [48] | |
| strengthening the MVA pathway and β-carotene synthesis pathway, directed evolution of CrtW, and adjusting gene copy numbers; | 47.18 mg/L | [95] | ||
| screening CrtZ of different sources, and ARTP-induced mutagenesis, uncovering CSS1, YBR012W-R and DAN4 sites as associated with biosynthesis astaxanthin; | 219 mg/L | [96] | ||
| ARTP-induced mutagenesis and H2O2-driven adaptive evolution | 404.78 mg/L | [89] |
表选项
3.1 半萜异戊二烯:异戊二烯作为合成橡胶的主要原料,拥有庞大的市场和巨大的商业价值。目前异戊二烯的生产方式主要还是依赖石油馏分作为原料,因此寻求更加绿色可持续的异戊二烯生产方式日益受到关注。在酿酒酵母中只需要引入异戊二烯合酶即可将内源MVA途径的代谢产物DMAPP转化为异戊二烯。由于其途径较短,因此MVA途径的前体供应以及异戊二烯合酶(ISPS) 的活性成为酿酒酵母生产异戊二烯的主要突破口。但是单纯通过游离质粒表达提高异戊二烯合酶的拷贝数,产量能达到5×10–4 g/L。Lv等[54]采用推-拉-阻的调控策略,上调乙酰辅酶A和MVA途径的代谢流,同时增加异戊二烯支流、抑制竞争途径,可以将产量提升到37 mg/L。在此基础上,一方面通过增强转录激活因子Gal4的表达,大幅提高了ISPS的表达水平,另一方面通过定向进化提高了ISPS的催化效率,从而将异戊二烯产量提高到了3.7 g/L。而在细胞质途径推-拉-阻调控的基础上,在线粒体中引入异戊二烯合成途径,对细胞内的乙酰辅酶A进行充分利用,也能大幅提升异戊二烯的产量,达到2.5 g/L[28, 42]。在这些工作的基础上,Yao等[55]进一步通过定点饱和突变获得了活性提升4倍的ISPS突变体,结合线粒体/细胞质双重代谢调控和精细调控关键前体物IPP和DMAPP的合成转化,最终将异戊二烯发酵产量提高到11.9 g/L。
3.2 单萜(1) 香叶醇:香叶醇是一种无环单萜醇,在香水、制药工业中都有着较为广泛的应用,还可以用作杀虫剂的成分。除此之外,香叶醇因其热值高、低吸湿性、低挥发性等特点,被认为是一种良好的生物燃料[56]。香叶醇在酿酒酵母中的合成途径较短,引入香叶醇合成酶(Geraniol synthase,GES)转化内源代谢物GPP即可获得。但是由于GES在酿酒酵母中表达活性较低、GPP的供应不足以及单萜类化合物细胞毒性等原因,香叶醇在酿酒酵母中一直难以实现高产[57]。为减轻单萜化合物造成的细胞毒性,常采用两相发酵体系,通过添加十二烷等无毒萃取剂进行产物的原位抽提,降低细胞内含量从而减轻毒性。此外,香叶醇等单萜还会在酿酒酵母中进一步被利用,转化为其他萜类物质,这也使香叶醇的高产变得更加困难。为此,Zhao等[58]通过敲除OYE2和ATF1减少了香叶醇向香茅醇和乙酸萜的转化,并利用HXT1启动子,根据葡萄糖/乙醇在培养基中的比例,动态调节ERG20的表达强度,以适时调整GPP的供应量,最终通过补料发酵获得了1.69 g/L的产量。Jiang等[20]通过tHMGR和IDI1的过表达增强了MVA途径,并且通过密码子优化、定点突变和N端截短等方法,提高了GES的活性,最终分批补料发酵产量为1.68 g/L。
(2) 柠檬烯:柠檬烯是一种环状单萜,广泛应用于医药、香精香料、燃料、农药等领域。与香叶醇相似,柠檬烯的合成也是以GPP为原料,通过柠檬烯合成酶(Limonene synthase,LS) 催化获得[59]。同样地,柠檬烯的合成也存在细胞毒性和关键酶限速等问题,直接在酿酒酵母中引入LS生成柠檬烯的效率很低。Cheng等[60]在酿酒酵母中重新构建了以IPP和DMAPP为前体的正交途径,除引入柠檬烯合成酶、理性设计Erg20等传统优化途径外,还引入了另一条合成途径,即NPP合酶和CltS2,利用顺式的GPP (NPP) 合成柠檬烯。该通路相比传统的GPP合成途径具有更高的通量,在ERG20的启动子被更换为较弱的PHXT1后,柠檬烯产量可以达到917.7 mg/L。
3.3 倍半萜(1) 广藿香醇:广藿香醇是一种倍半萜醇,广泛地应用于香水和化妆品中,同时也是一种重要的药物前体,具有抗炎、神经保护等特性,是目前研究较多的一种倍半萜化合物。在酿酒酵母中,引入外源的广藿香醇合酶(Patchoulol synthase,PTS) 即可催化FPP合成广藿香醇。Ma等[44]分别采用融合表达FPP合酶Erg20与PTS以通过底物通道效应提高FPP的利用率,同时下调ERG9以及敲除DPP1和LPP1,减少FPP向角鲨烯、法尼烯醇的消耗,进一步结合发酵优化,最终发酵产量可达466.8 mg/L。Mitsui等[61]在酿酒酵母中引入全局代谢工程策略来优化MVA途径,这是一种全面随机地改变酵母中目标代谢途径基因转录水平的策略,通过随机组合具有不同表达效率的启动子和酶基因来构建DNA文库。然后,用该DNA文库转化酵母,获得相关基因的转录水平被全面随机进化的重组体。通过气相色谱质谱联用仪(Gas Chromatography Mass Spectrometry,GC-MS) 筛选,从重组酵母中获得具有最佳代谢水平的菌株,广藿香醇产量达到42.1 mg/L。该优化方案旨在使MVA途径的FPP供给量与PTS所需的FPP量达到一个最佳的平衡,为酿酒酵母异源合成次级代谢产物优化提供了新的思路。
(2) 青蒿酸:青蒿素是能够有效治疗疟疾的药物成分,在20世纪80年代,我国科学家就成功地从植物中提取了青蒿素。但是植物中天然存在的青蒿素含量极低,难以满足市场需求[62]。Keasling课题组通过构建重组酿酒酵母菌株合成青蒿素的重要前体青蒿酸,然后通过化学法获得青蒿素,大幅度降低了生产成本[63]。与其他倍半萜一样,青蒿酸的合成也是以FPP作为底物,先通过紫穗槐二烯合酶将FPP转化为紫穗槐二烯,再引入来自黄花蒿的P450酶CYP71AV1和P450还原酶CPR1,将紫穗槐二烯氧化为青蒿酸。因此,增强FPP的供应是一种行之有效的代谢改造。Erg20、HMG还原酶等MVA途径关键酶的过表达能够有效提高FPP的积累,下调ERG9等竞争途径基因也是代谢优化的有效手段之一。Lenihan等[45]通过将ERG9的启动子更换为PMET3,利用甲硫氨酸下调ERG9,同时建立溶解氧计算模型,优化发酵条件,将青蒿酸的发酵产量提高到2.5 g/L。青蒿酸生物合成的另一个难题是CYP71AV1和CPR1高水平表达时产生的活性氧会减短细胞寿命。Paddon等[46]利用铜调节的启动子PCTR3替换了PMET3,降低了下调ERG9的成本,同时引入了黄花蒿来源的细胞色素酶(Cytochrome b5,Cyb5)、青蒿素醇脱氢酶(Alcohol dehydrogenase,Adh1) 和青蒿素醛脱氢酶(Aldehyde dehydrogenase,Aldh1),使青蒿酸合成途径代谢流更加通畅,增强了细胞活力和各步骤的生产能力,高密度发酵产量提高到了25 g/L。
3.4 二萜(1) 香紫苏醇:香紫苏醇是一种二萜衍生物,可用于合成重要的龙涎香替代品降龙涎醚。现阶段商业生产香紫苏醇主要从人工培育的鼠尾草中萃取获得。在酿酒酵母中,香紫苏醇的合成以GGPP为出发底物,在岩蔷薇8-羟基共丙基焦磷酸合酶(Cistus creticus 8-hydroxy copalyl diphosphate synthase,CcCLS) 的催化下生成中间产物8-羟基-柯巴基焦磷酸,再由鼠尾草香紫苏醇合酶(Salvia sclarea sclareol synthase,SsSCLS) 催化生成终产物香紫苏醇[64]。Trikka等[65]利用类胡萝卜素与香紫苏醇共用部分前体物质的特点,将能够生产类胡萝卜素的酿酒酵母与途径代谢相关基因缺失的酿酒酵母进行杂交,筛选出能够提高类胡萝卜素产量的敲除靶点,并在香紫苏醇合成中进行验证,在此基础上进行复合缺失、多次筛选,最终得到多基因缺失工程菌株,使得香紫苏醇的产量提高了12倍,在摇瓶中产量达到750 mg/L。
(2) 紫杉二烯:紫杉二烯是合成紫杉醇的重要前体之一,紫杉醇是一种有效的抗肿瘤药物,对多种肿瘤都有极佳的抗增殖活性,常被用于早期临床干预,与化疗药物联合治疗使用。目前紫杉醇主要由半合成法获得,即从红豆杉叶片中提取前体物,然后通过化学转化合成紫杉醇,这种方法虽然优于从树皮中直接提取紫杉醇,但仍依赖于红豆杉的大量种植[66]。紫杉醇的生物合成途径较为复杂,以GGPP为底物,通过紫杉二烯合酶催化得到紫杉二烯后,还需要P450单加氧酶的多步催化,才能得到含有8个氧的紫杉醇。有研究表明,大肠杆菌可以异源合成紫杉二烯,经过发酵优化后的产量可以达到1 020 mg/L[21],但是大肠杆菌存在内毒素、噬菌体侵染风险以及难以表达P450酶等修饰酶,难以进一步构建合成步骤以及实现工业生产。因此,酿酒酵母是更合适的底盘细胞。由于目前紫杉醇生物合成途径尚未获得完全解析,现阶段更多的研究关注在酿酒酵母中高产前体紫杉二烯上。Engels等[67]通过截短HMG-CoA还原酶以及引入硫化叶菌来源的GGPP合酶,增强了GGPP的供应,并且将红豆杉来源的紫杉二烯合酶进行密码子优化,紫杉二烯的摇瓶产量达到8.7 mg/L。Apel等[68]利用CRISPR-Cas9技术,构建并筛选了一系列启动子、蛋白质定位和可溶性表达标签来优化紫杉二烯合酶的表达,将紫杉二烯的产量提高到20 mg/L。Nowrouzi等[69]通过将多个拷贝的紫杉二烯合酶在染色体上整合表达,并且与Erg20进行融合表达,有效地提高了紫杉二烯合酶的表达水平,显著提高了紫杉二烯的产量,达到129 mg/L。
3.5 三萜(1) 人参皂苷:人参皂苷是一种从人参属植物中分离出的糖基化三萜,广泛存在于人参、党参、三七、西洋参等传统中草药中。人参皂苷具有良好的抗氧化、抗炎、抗肿瘤等生物活性,以及保护血管、调节免疫等功能。然而由于人参等中草药的生产周期较长,生产限制因素较多,难以进行可持续的大规模生产。同时,其复杂的化学结构也使得化学合成方法极其困难。现阶段虽然通过构建转基因植物、组织和细胞培养等方法提高了人参皂苷的产量,但是仍然存在不稳定性,难以满足日益增长的需求。利用酿酒酵母生产人参皂苷不仅能够节约土地等资源,缩短生长周期,其基因可操作性也远优于植物底盘。人参皂苷是类固醇皂苷,以通式Rx表示,其中R表示根,x表示基于字母序列的色谱极性。现阶段人参皂苷Rh2被认为具有预防和治疗肿瘤的功效。人参皂苷Rh2在酿酒酵母体内主要通过重要前体原人参二醇(Protopanaxadiol,PPD) 型人参皂苷的去糖基化获得,PPD也是几乎所有达玛烷型人参皂苷的共同前体[70]。在酿酒酵母中,PPD的合成途径主要分为两个模块,首先IPP与DMAPP在Erg20、Erg9和Erg1的共同催化作用下形成中间产物2, 3-氧化喹啉,然后2, 3-氧化喹啉在人参属植物来源的合酶PgDDS、CYP716A47和PgCPR1的共同作用下合成PPD。Wang等[71]通过过表达MVA途径相关基因和优化P450酶,构建了PPD摇瓶产量为529 mg/L的底盘细胞,并以此为基础,通过葡萄糖基转移酶(UDP-glycosyltransferase,UGT) 的定向进化、过表达和启动子改造等方法,获得了人参皂苷Rh2的高产菌株,产量达到2.25 g/L。
(2) 角鲨烯:角鲨烯是一种线性多不饱和三萜化合物,由于其结构中带有6个碳碳双键,具有可持续的还原能力,因此表现出对多种癌细胞的抗肿瘤活性[72],被广泛应用于食品和保健品行业中。角鲨烯现阶段的主要来源是从鲨鱼肝脏中非法获取或者从植物中低效提取,因此构建微生物细胞工厂非常有必要。酿酒酵母具有天然合成角鲨烯的能力,由角鲨烯合酶(Erg9) 催化FPP合成,主要通过上调MVA途径、增强前体供应等手段来促进酿酒酵母合成角鲨烯。Li等[73]通过过表达MVA途径以及角鲨烯合酶等相关基因,并引入来源于海洋玫瑰杆菌的HMG-CoA还原酶以降低角鲨烯合成过程对NADPH的高度依赖性,将角鲨烯的摇瓶产量提高到1.09 g/L;在此基础上进一步过表达来自水稻基腐病菌的乙醇脱氢酶ADH2和乙醛脱氢酶ADA,增强了工程菌株利用乙醇合成角鲨烯的能力,最终分批补料发酵的角鲨烯产量可达到9.47 g/L。Liu等[74]对角鲨烯在细胞内的合成和储存位置进行了分析,发现过氧化物酶体是酵母细胞内储存角鲨烯的动态仓库,并利用过氧化物酶体作为角鲨烯合成的亚细胞区室,将角鲨烯的产量提高了138倍;在此基础上通过细胞质和过氧化物酶体途径的双重调控,通过两阶段分批补料发酵可获得11 g/L的产量。
(3) 香树脂醇:香树脂醇是一种植物来源的五环三萜类化合物,主要分为α-香树脂醇和β-香树脂醇两种构型,两者都具有抗炎、抗肿瘤、抗氧化等生物活性[75]。香树脂醇可由酿酒酵母自身代谢产物(3S)-2, 3-氧化喹烯作为前体由香树脂醇合酶催化得到,氧化喹烯则由FPP通过Erg9、Erg1两步反应催化获得。香树脂醇微生物合成面临的主要问题是前体供应不足以及香树脂醇对细胞的毒害作用。Ni等[76]利用CRISPR技术,在酿酒酵母中下调了ADH1、ADH4、ADH5、ADH6、CIT2、MLS1和ERG7等7个基因,减少了重要前体乙酰辅酶A和氧化喹烯的竞争性消耗,进一步优化发酵条件以及外加甲基β-环糊精促进β-香树脂醇的胞外转运,成功获得了156.7 mg/L的β-香树脂醇。Liu等[77]通过强化内源和引入外源乙酰辅酶A合成途径,在增强了乙酰辅酶A供应的同时也提高了工程菌株对葡萄糖的利用效率,将β-香树脂醇的产量提高到了279 mg/L。Yu等[78]通过半理性设计的方法,以分子模拟为基础,结合定点突变得到了α-香树脂醇合酶的三点突变体,使α-香树脂醇产量提高了11倍。在此基础上过表达DGA1以增强细胞内α-香树脂醇的存储能力,减轻α-香树脂醇对细胞的毒害作用,最终发酵获得了1.107 g/L的α-香树脂醇。
3.6 四萜(1) 番茄红素:番茄红素是一种重要的类胡萝卜素,具有抗氧化、抗衰老、消炎等重要的生理活性。当前番茄红素的生产主要依赖于植物提取和化学合成,而这两种方法带来的高成本和环境污染等都是番茄红素生产中亟待解决的问题[18]。番茄红素在酿酒酵母中的生产主要以FPP为底物,通过导入香叶基香叶基焦磷酸合酶(CrtE)、八氢番茄红素合酶(CrtB) 和八氢番茄红素脱氢酶(CrtI) 3个基因构建番茄红素代谢途径。其中,CrtE是最主要的限速酶。Xie等[23]结合关键酶定向进化和代谢调控在酿酒酵母中构建了畅通的番茄红素合成途径,实现了番茄红素的合成。该研究不仅比较了不同来源八氢番茄红素合酶的催化合成能力,并且对其中活性最高的八氢番茄红素合酶/番茄红素β-环化酶(CrtYB) 这个双功能酶进行了定向进化,获得了仅具有八氢番茄红素合酶功能的突变体。在此基础上,进一步通过定向进化提高CrtE的催化性能,并结合CrtE、CrtI、tHMG1基因的过表达,使番茄红素产量达到1.61 g/L。Shi等[79]通过筛选crt系列基因并调整拷贝数、强化乙酰辅酶A和NADPH的供应等综合调控手段,将番茄红素的产量提高到了3.28 g/L。
(2) β-胡萝卜素:β-胡萝卜素是研究最广泛的类胡萝卜素之一,因其具有预防癌症、调节免疫反应等对健康有益的作用而受到广泛关注[80-81],常在食品、饲料和化妆品行业中作为添加剂使用。化学合成的β-胡萝卜素占其市场总量的90%。考虑到化学合成过程中可能存在有害物质残留,天然β-胡萝卜素的市场需求非常大。天然β-胡萝卜素的价格是化学合成的β-胡萝卜素的3倍。目前,β-胡萝卜素的天然合成方法主要包括从植物或藻类中提取以及红法夫酵母和三孢布拉氏霉等真菌的发酵[82-83]。在酿酒酵母中,β-胡萝卜素的合成以番茄红素为底物,在番茄红素环化酶(CrtY) 的作用下两端发生β-环化形成。Yan等[84]通过过表达MVA途径限速酶HMG-CoA还原酶,并且加入酮康唑来抑制麦角固醇途径,得到6.29 mg/g细胞干重的β-胡萝卜素。Sun等[85]通过改变培养温度,增强了MVA途径的前体供应,合成了4.94 mg/g细胞干重的β-胡萝卜素。Xie等[47]通过改造GAL调控系统,使β-胡萝卜素合成途径受到葡萄糖浓度调控,并将竞争途径基因ERG9的启动子替换为葡萄糖诱导启动子PHXT1,实现了对细胞生长和β-胡萝卜素合成的顺序调控,将β-胡萝卜素的产量提高到20.79 mg/g。除了通过代谢改造促进β-胡萝卜素合成,Sun等[86]还发现,在酵母培养过程中外源加入不饱和脂肪酸也可以提高β-胡萝卜素的产量。不饱和脂肪酸在酵母中不仅可以提供碳源,也可以作为还原力的重要来源,因此这可能成为提高酿酒酵母类胡萝卜素萜类产物合成能力的一种普适性策略。
(3) 虾青素:虾青素是抗氧化能力最强的天然类胡萝卜素,可以有效地清除自由基、延缓细胞衰老,也可以预防心脑血管疾病以及免疫系统疾病等,在医药和食品行业具有巨大的应用价值[87]。虾青素在酿酒酵母中的合成途径可以分为两个部分,第一部分是以FPP为原料,在类胡萝卜素合成途径催化下合成β-胡萝卜素,第二部分是由β-胡萝卜素发生羟化和酮基化反应获得虾青素。该过程需要在β-紫罗兰酮环上增加2个羟基(3和3′碳位) 和2个酮基(4和4′碳位),在大部分产虾青素的生物体中,该过程由β-胡萝卜素羟化酶(CrtZ) 和β-胡萝卜素酮化酶(CrtW或者BKT) 催化,而在红法夫酵母中该过程由虾青素合酶CrtS和细胞色素P450还原酶CRTR催化得到[88]。因此,对于虾青素的合成途径优化也往往分为两个部分,对于上游途径可主要通过上调MVA途径、下调竞争途径等传统萜类化合物合成优化方法进行优化,而对于下游β-胡萝卜素的羟化和酮基化的调控一直是虾青素合成的关键和挑战。在此过程中,需要平衡β-胡萝卜素羟化酶和酮化酶的活性和偏好性,不同来源酶的挖掘和改造、启动子的更换和拷贝数调整等方法是调整代谢通量的主要手段。除此之外,虾青素积累导致的代谢压力也是虾青素难以实现大规模生产的限制因素之一。Zhou等[24, 48, 63]通过BKT的定向进化以及CrtZ和BKT的共定向进化策略,基于颜色的变化筛选出阳性突变体,并且利用基于温敏型转录激活蛋白Gal4M9的温度响应型动态代谢调控系统进行两阶段发酵,不仅促进了β-胡萝卜素向虾青素的转化,还有效地将细胞生长和产物积累阶段分开,实现了高密度发酵,虾青素产量达到235 mg/L。Jiang等[89]通过多轮常压室温等离子体(Atmospheric and room temperature plasma,ARTP) 诱变和过氧化氢驱动适应性进化相结合的方法,得到了能够高产虾青素的工程菌株,5 L发酵罐产量达到404.78 mg/L。作者发现高产虾青素的菌株内活性氧水平较低并且生命周期延长,根据FCY22和YOR389W基因缺失的现象,提出这两个基因可能是潜在的代谢改造靶点,为改造酿酒酵母实现虾青素以及其他萜类天然产物的高产提供了参考。
4 总结与展望酿酒酵母作为底盘细胞在萜类化合物的合成中具有较大的优势,除自身拥有良好的鲁棒性外,酿酒酵母的胞内环境、细胞器等亚细胞结构以及翻译后修饰机制等方面相比于大肠杆菌等原核生物都更加接近于萜类化合物的主要天然来源——植物。近年来,随着合成生物学、代谢工程、DNA测序以及组学分析等技术的快速发展,利用酿酒酵母构建细胞工厂合成萜类天然产物已经取得很大进展。但仍有很多挑战需要攻克,许多高价值的、结构和合成途径相对复杂的萜类天然产物及其衍生物尚未实现异源合成,例如潜在的抗癌化疗药物长春新碱。对于多数已经实现异源合成的萜类产物而言,现阶段微生物细胞工厂的生产能力与工业生产的要求之间也还存在较大的距离。究其原因,对天然合成途径及其中元件功能(包括关键酶构效关系) 的认识不足,细胞内微环境的差异造成异源途径与底盘细胞的不适配,异源产物与代谢中间物对底盘细胞的毒性等都是阻碍萜类产物高效微生物合成的难题和挑战。为了进一步提高酿酒酵母生产萜类化合物的能力,可以采取的手段包括但不限于:1) 开发更加高效的多片段以及长片段DNA组装技术和基因组编辑手段,实现更多复杂萜类产物在酿酒酵母中的异源合成;2) 通过转录组学、蛋白质组学、代谢物组学等的深入研究,全面了解天然生产者和酿酒酵母工程菌株的代谢网络和调控机制,同时开发高通量的检测手段,实现对胞内产物及中间代谢物的实时检测,揭示更多的代谢改造靶点,进而提升萜类产物的异源合成效率;3) 解析异源途径与酵母细胞之间的适配机制,并基于此通过代谢调控提高元件、模块、途径与底盘之间的适配性,从而在细胞自身代谢和异源产物合成之间达成平衡;4) 剖析萜类产物在酿酒酵母中合成后的储存和转运机制,并利用亚细胞定位和区室化调控技术,最大化利用胞内资源,同时尝试拓展酵母细胞的膜结构以寻求更多的空间储存脂溶性萜类化合物或探索特异性转运蛋白实现产物的外排,以此减少细胞的代谢压力,提高生产的可持续性;5) 搭建自动化、智能化的合成生物学平台,加速萜类产物复杂的合成途径在酵母细胞中的装配和优化过程,缩短细胞工厂的设计-建造-测试-学习周期,构建高效、稳定、可控的产萜类产物酿酒酵母细胞工厂。
参考文献
| [1] | Li MJ, Hou FF, Wu T, et al. Recent advances of metabolic engineering strategies in natural isoprenoid production using cell factories. Nat Prod Rep, 2020, 37(1): 80-99. DOI:10.1039/C9NP00016J |
| [2] | Tippmann S, Scalcinati G, Siewers V, et al. Production of farnesene and santalene by Saccharomyces cerevisiae using fed-batch cultivations with RQ-controlled feed. Biotechnol Bioeng, 2016, 113(1): 72-81. DOI:10.1002/bit.25683 |
| [3] | Ajikumar K, Xiao WH, Tyo KEJ, et al. Isoprenoid pathway optimization for Taxol precursor overproduction in Escherichia coli. Science, 2010, 330(6000): 70-74. DOI:10.1126/science.1191652 |
| [4] | Chen BB, Lee HL, Heng YC, et al. Synthetic biology toolkits and applications in Saccharomyces cerevisiae. Biotechnol Adv, 2018, 36(7): 1870-1881. DOI:10.1016/j.biotechadv.2018.07.005 |
| [5] | Jackson BE, Hart-Wells EA, Matsuda SPT. Metabolic engineering to produce sesquiterpenes in yeast. Org Lett, 2003, 5(10): 1629-1632. DOI:10.1021/ol034231x |
| [6] | Zhou YJ, Gao W, Rong QX, et al. Modular pathway engineering of diterpenoid synthases and the mevalonic acid pathway for miltiradiene production. J Am Chem Soc, 2012, 134(6): 3234-3241. DOI:10.1021/ja2114486 |
| [7] | Goldstein JL, Brown MS. Regulation of the mevalonate pathway. Nature, 1990, 343(6257): 425-430. DOI:10.1038/343425a0 |
| [8] | Nagy G, Vaz AG, Szebenyi C, et al. CRISPR-Cas9- mediated disruption of the HMG-CoA reductase genes of Mucor circinelloides and subcellular localization of the encoded enzymes. Fungal Genet Biol, 2019, 129: 30-39. DOI:10.1016/j.fgb.2019.04.008 |
| [9] | Kampranis SC, Makris AM. Developing a yeast cell factory for the production of terpenoids. Comput Struct Biotechnol J, 2012, 3(4): e201210006. DOI:10.5936/csbj.201210006 |
| [10] | Matsuyama T. Recent developments in terminator technology in Saccharomyces cerevisiae. J Biosci Bioeng, 2019, 128(6): 655-661. DOI:10.1016/j.jbiosc.2019.06.006 |
| [11] | Degenhardt J, K?llner TG, Gershenzon J. Monoterpene and sesquiterpene synthases and the origin of terpene skeletal diversity in plants. Phytochemistry, 2009, 70(15/16): 1621-1637. |
| [12] | Christianson DW. Unearthing the roots of the terpenome. Curr Opin Chem Biol, 2008, 12(2): 141-150. DOI:10.1016/j.cbpa.2007.12.008 |
| [13] | Shen B, Zhou PP, Jiao X, et al. Fermentative production of Vitamin E tocotrienols in Saccharomyces cerevisiae under cold-shock-triggered temperature control. Nat Commun, 2020, 11(1): 5155. DOI:10.1038/s41467-020-18958-9 |
| [14] | Lian JZ, HamediRad M, Hu SM, et al. Combinatorial metabolic engineering using an orthogonal tri-functional CRISPR system. Nat Commun, 2017, 8(1): 1688. DOI:10.1038/s41467-017-01695-x |
| [15] | Urlacher VB, Girhard M. Cytochrome P450 monooxygenases: an update on perspectives for synthetic application. Trends Biotechnol, 2012, 30(1): 26-36. DOI:10.1016/j.tibtech.2011.06.012 |
| [16] | Westfall PJ, Pitera DJ, Lenihan JR, et al. Production of amorphadiene in yeast, and its conversion to dihydroartemisinic acid, precursor to the antimalarial agent artemisinin. Proc Natl Acad Sci USA, 2012, 109(3): E111-E118. DOI:10.1073/pnas.1110740109 |
| [17] | Wang PP, Wei YJ, Fan Y, et al. Production of bioactive ginsenosides Rh2 and Rg3 by metabolically engineered yeasts. Metab Eng, 2015, 29: 97-105. DOI:10.1016/j.ymben.2015.03.003 |
| [18] | Chen Y, Xiao WH, Wang Y, et al. Lycopene overproduction in Saccharomyces cerevisiae through combining pathway engineering with host engineering. Microb Cell Fact, 2016, 15(1): 113. DOI:10.1186/s12934-016-0509-4 |
| [19] | Bohlmann J, Meyer-Gauen G, Croteau R. Plant terpenoid synthases: molecular biology and phylogenetic analysis. Proc Natl Acad Sci USA, 1998, 95(8): 4126-4133. DOI:10.1073/pnas.95.8.4126 |
| [20] | Jiang GZ, Yao MD, Wang Y, et al. Manipulation of GES and ERG20 for geraniol overproduction in Saccharomyces cerevisiae. Metab Eng, 2017, 41: 57-66. DOI:10.1016/j.ymben.2017.03.005 |
| [21] | Ding MZ, Yan HF, Li LF, et al. Biosynthesis of taxadiene in Saccharomyces cerevisiae: selection of geranylgeranyl diphosphate synthase directed by a computer-aided docking strategy. PLoS ONE, 2014, 9(10): e109348. DOI:10.1371/journal.pone.0109348 |
| [22] | Sun WT, Xue HJ, Liu H, et al. Controlling chemo- and regio-selectivity of a plant P450 in yeast cell towards rare licorice triterpenoids biosynthesis. ACS Catal, 2020, 10(7): 4253-4260. DOI:10.1021/acscatal.0c00128 |
| [23] | Xie WP, Lv XM, Ye LD, et al. Construction of lycopene-overproducing Saccharomyces cerevisiae by combining directed evolution and metabolic engineering. Metab Eng, 2015, 30: 69-78. DOI:10.1016/j.ymben.2015.04.009 |
| [24] | Zhou PP, Li M, Shen B, et al. Directed coevolution of β-carotene ketolase and hydroxylase and its application in temperature-regulated biosynthesis of astaxanthin. J Agric Food Chem, 2019, 67(4): 1072-1080. DOI:10.1021/acs.jafc.8b05003 |
| [25] | Lv XM, Xu HM, Yu HW. Significantly enhanced production of isoprene by ordered coexpression of genes dxs, dxr, and idi in Escherichia coli. Appl Microbiol Biotechnol, 2013, 97(6): 2357-2365. DOI:10.1007/s00253-012-4485-2 |
| [26] | Furubayashi M, Ikezumi M, Kajiwara J, et al. A high-throughput colorimetric screening assay for terpene synthase activity based on substrate consumption. PLoS ONE, 2014, 9(3): e93317. DOI:10.1371/journal.pone.0093317 |
| [27] | Withers ST, Gottlieb SS, Lieu B, et al. Identification of isopentenol biosynthetic genes from Bacillus subtilis by a screening method based on isoprenoid precursor toxicity. Appl Environ Microbiol, 2007, 73(19): 6277-6283. DOI:10.1128/AEM.00861-07 |
| [28] | Wang F, Lv XM, Xie WP, et al. Combining Gal4p-mediated expression enhancement and directed evolution of isoprene synthase to improve isoprene production in Saccharomyces cerevisiae. Metab Eng, 2017, 39: 257-266. DOI:10.1016/j.ymben.2016.12.011 |
| [29] | Blazeck J, Alper HS. Promoter engineering: recent advances in controlling transcription at the most fundamental level. Biotechnol J, 2013, 8(1): 46-58. DOI:10.1002/biot.201200120 |
| [30] | Wei LN, Wang ZX, Zhang GL, et al. Characterization of terminators in Saccharomyces cerevisiae and an exploration of factors affecting their strength. ChemBioChem, 2017, 18(24): 2422-2427. DOI:10.1002/cbic.201700516 |
| [31] | Zhang YS, Li SZ, Li J, et al. Using unnatural protein fusions to engineer resveratrol biosynthesis in yeast and mammalian cells. J Am Chem Soc, 2006, 128(40): 13030-13031. DOI:10.1021/ja0622094 |
| [32] | Kang W, Ma T, Liu M, et al. Modular enzyme assembly for enhanced cascade biocatalysis and metabolic flux. Nat Commun, 2019, 10(1): 4248. DOI:10.1038/s41467-019-12247-w |
| [33] | Ohto C, Muramatsu M, Obata S, et al. Overexpression of the gene encoding HMG-CoA reductase in Saccharomyces cerevisiae for production of prenyl alcohols. Appl Microbiol Biotechnol, 2009, 82(5): 837-845. DOI:10.1007/s00253-008-1807-5 |
| [34] | Keasling JD. Synthetic biology and the development of tools for metabolic engineering. Metab Eng, 2012, 14(3): 189-195. DOI:10.1016/j.ymben.2012.01.004 |
| [35] | Lian JZ, Zhao HM. Functional reconstitution of a pyruvate dehydrogenase in the cytosol of Saccharomyces cerevisiae through lipoylation machinery engineering. ACS Synth Biol, 2016, 5(7): 689-697. DOI:10.1021/acssynbio.6b00019 |
| [36] | Kozak BU, Van Rossum HM, Benjamin KR, et al. Replacement of the Saccharomyces cerevisiae acetyl-CoA synthetases by alternative pathways for cytosolic acetyl-CoA synthesis. Metab Eng, 2014, 21: 46-59. DOI:10.1016/j.ymben.2013.11.005 |
| [37] | Rodriguez S, Denby CM, Van Vu T, et al. ATP citrate lyase mediated cytosolic acetyl-CoA biosynthesis increases mevalonate production in Saccharomyces cerevisiae. Microb Cell Fact, 2016, 15(1): 48. DOI:10.1186/s12934-016-0447-1 |
| [38] | Hammer SK, Avalos JL. Harnessing yeast organelles for metabolic engineering. Nat Chem Biol, 2017, 13(8): 823-832. DOI:10.1038/nchembio.2429 |
| [39] | Farhi M, Marhevka E, Masci T, et al. Harnessing yeast subcellular compartments for the production of plant terpenoids. Metab Eng, 2011, 13(5): 474-481. DOI:10.1016/j.ymben.2011.05.001 |
| [40] | Lv XM, Wang F, Zhou PP, et al. Dual regulation of cytoplasmic and mitochondrial acetyl-CoA utilization for improved isoprene production in Saccharomyces cerevisiae. Nat Commun, 2016, 7(1): 12851. DOI:10.1038/ncomms12851 |
| [41] | Zhang YY, Wang J, Cao XS, et al. High-level production of linalool by engineered Saccharomyces cerevisiae harboring dual mevalonate pathways in mitochondria and cytoplasm. Enzyme Microb Technol, 2020, 134: 109462. DOI:10.1016/j.enzmictec.2019.109462 |
| [42] | Chatzivasileiou AO, Ward V, Edgar SM, et al. Two-step pathway for isoprenoid synthesis. Proc Natl Acad Sci USA, 2019, 116(2): 506-511. DOI:10.1073/pnas.1812935116 |
| [43] | Yamada R, Wakita K, Ogino H. Global metabolic engineering of glycolytic pathway via multicopy integration in Saccharomyces cerevisiae. ACS Synth Biol, 2017, 6(4): 659-666. DOI:10.1021/acssynbio.6b00281 |
| [44] | Ma B, Liu M, Li ZH, et al. Significantly enhanced production of patchoulol in metabolically engineered Saccharomyces cerevisiae. J Agric Food Chem, 2019, 67(31): 8590-8598. DOI:10.1021/acs.jafc.9b03456 |
| [45] | Lenihan JR, Tsuruta H, Diola D, et al. Developing an industrial artemisinic acid fermentation process to support the cost-effective production of antimalarial artemisinin-based combination therapies. Biotechnol Prog, 2008, 24(5): 1026-1032. DOI:10.1002/btpr.27 |
| [46] | Paddon CJ, Westfall J, Pitera DJ, et al. High-level semi-synthetic production of the potent antimalarial artemisinin. Nature, 2013, 496(7446): 528-532. DOI:10.1038/nature12051 |
| [47] | Xie WP, Liu M, Lv XM, et al. Construction of a controllable β-carotene biosynthetic pathway by decentralized assembly strategy in Saccharomyces cerevisiae. Biotechnol Bioeng, 2014, 111(1): 125-133. DOI:10.1002/bit.25002 |
| [48] | Zhou PP, Xie WP, Yao Z, et al. Development of a temperature-responsive yeast cell factory using engineered Gal4 as a protein switch. Biotechnol Bioeng, 2018, 115(5): 1321-1330. DOI:10.1002/bit.26544 |
| [49] | Zhao EM, Zhang YF, Mehl J, et al. Optogenetic regulation of engineered cellular metabolism for microbial chemical production. Nature, 2018, 555(7698): 683-687. DOI:10.1038/nature26141 |
| [50] | Williams TC, Averesch NJH, Winter G, et al. Quorum-sensing linked RNA interference for dynamic metabolic pathway control in Saccharomyces cerevisiae. Metab Eng, 2015, 29: 124-134. DOI:10.1016/j.ymben.2015.03.008 |
| [51] | David F, Nielsen J, Siewers V, et al. Flux control at the Malonyl-CoA node through hierarchical dynamic pathway regulation in Saccharomyces cerevisiae. ACS Synth Biol, 2016, 5(3): 224-233. DOI:10.1021/acssynbio.5b00161 |
| [52] | Srinivasan P, Smolke CD. Biosynthesis of medicinal tropane alkaloids in yeast. Nature, 2020, 585(7826): 614-619. |
| [53] | Zhou K, Qiao KJ, Edgar S, et al. Distributing a metabolic pathway among a microbial consortium enhances production of natural products. Nat Biotechnol, 2015, 33(4): 377-383. DOI:10.1038/nbt.3095 |
| [54] | Lv XM, Xie WP, Lu WQ, et al. Enhanced isoprene biosynthesis in Saccharomyces cerevisiae by engineering of the native acetyl-CoA and mevalonic acid pathways with a push-pull-restrain strategy. J Biotechnol, 2014, 186: 128-136. DOI:10.1016/j.jbiotec.2014.06.024 |
| [55] | Yao Z, Zhou PP, Su BM, et al. Enhanced isoprene production by reconstruction of metabolic balance between strengthened precursor supply and improved isoprene synthase in Saccharomyces cerevisiae. ACS Synth Biol, 2018, 7(9): 2308-2316. DOI:10.1021/acssynbio.8b00289 |
| [56] | Lin JL, Ekas H, Markham K, et al. An enzyme-coupled assay enables rapid protein engineering for geraniol production in yeast. Biochem Eng J, 2018, 139: 95-100. DOI:10.1016/j.bej.2018.08.011 |
| [57] | Zhao JZ, Bao XM, Li C, et al. Improving monoterpene geraniol production through geranyl diphosphate synthesis regulation in Saccharomyces cerevisiae. Appl Microbiol Biotechnol, 2016, 100(10): 4561-4571. DOI:10.1007/s00253-016-7375-1 |
| [58] | Zhao JZ, Li C, Zhang Y, et al. Dynamic control of ERG20 expression combined with minimized endogenous downstream metabolism contributes to the improvement of geraniol production in Saccharomyces cerevisiae. Microb Cell Fact, 2017, 16: 17. DOI:10.1186/s12934-017-0641-9 |
| [59] | Hu ZH, Lin LC, Li HX, et al. Engineering Saccharomyces cerevisiae for production of the valuable monoterpene d-limonene during Chinese Baijiu fermentation. J Ind Microbiol Biotechnol, 2020, 47(6): 511-523. DOI:10.1007/s10295-020-02284-6 |
| [60] | Cheng S, Liu X, Jiang GZ, et al. Orthogonal engineering of biosynthetic pathway for efficient production of limonene in Saccharomyces cerevisiae. ACS Synth Biol, 2019, 8(5): 968-975. DOI:10.1021/acssynbio.9b00135 |
| [61] | Mitsui R, Nishikawa R, Yamada R, et al. Construction of yeast producing patchoulol by global metabolic engineering strategy. Biotechnol Bioeng, 2020, 117(5): 1348-1356. DOI:10.1002/bit.27284 |
| [62] | Li C, Li J, Wang G, et al. Heterologous biosynthesis of artemisinic acid in Saccharomyces cerevisiae. J Appl Microbiol, 2016, 120(6): 1466-1478. DOI:10.1111/jam.13044 |
| [63] | Paddon CJ, Keasling JD. Semi-synthetic artemisinin: a model for the use of synthetic biology in pharmaceutical development. Nat Rev Microbiol, 2014, 12(5): 355-367. DOI:10.1038/nrmicro3240 |
| [64] | Ignea C, Trikka FA, Nikolaidis AK, et al. Efficient diterpene production in yeast by engineering Erg20p into a geranylgeranyl diphosphate synthase. Metab Eng, 2015, 27: 65-75. DOI:10.1016/j.ymben.2014.10.008 |
| [65] | Trikka FA, Nikolaidis A, Athanasakoglou A, et al. Iterative carotenogenic screens identify combinations of yeast gene deletions that enhance sclareol production. Microb Cell Fact, 2015, 14: 60. DOI:10.1186/s12934-015-0246-0 |
| [66] | Ojima I, Habus I, Zhao MZ, et al. New and efficient approaches to the semisynthesis of taxol and its C-13 side chain analogs by means of β-lactam synthon method. Tetrahedron, 1992, 48(34): 6985-7012. DOI:10.1016/S0040-4020(01)91210-4 |
| [67] | Engels B, Dahm P, Jennewein S. Metabolic engineering of taxadiene biosynthesis in yeast as a first step towards taxol (Paclitaxel) production. Metab Eng, 2008, 10(3/4): 201-206. |
| [68] | Apel AR, D'Espaux L, Wehrs M, et al. A Cas9-based toolkit to program gene expression in Saccharomyces cerevisiae. Nucleic Acids Res, 2017, 45(1): 496-508. DOI:10.1093/nar/gkw1023 |
| [69] | Nowrouzi B, Li RA, Walls LE, et al. Enhanced production of taxadiene in Saccharomyces cerevisiae. Microb Cell Fact, 2020, 19(1): 200. DOI:10.1186/s12934-020-01458-2 |
| [70] | Zhuang Y, Yang GY, Chen XH, et al. Biosynthesis of plant-derived ginsenoside Rh2 in yeast via repurposing a key promiscuous microbial enzyme. Metab Eng, 2017, 42: 25-32. DOI:10.1016/j.ymben.2017.04.009 |
| [71] | Wang PP, Wei W, Ye W, et al. Synthesizing ginsenoside Rh2 in Saccharomyces cerevisiae cell factory at high-efficiency. Cell Discov, 2019, 5: 5. DOI:10.1038/s41421-018-0075-5 |
| [72] | Fang YB, Luo MY, Song X, et al. Improving the production of squalene-type triterpenoid 2, 3;22, 23-squalene dioxide by optimizing the expression of CYP505D13 in Saccharomyces cerevisiae. J Biosci Bioeng, 2020, 130(3): 265-271. DOI:10.1016/j.jbiosc.2020.04.005 |
| [73] | Li T, Liu GS, Zhou W, et al. Metabolic engineering of Saccharomyces cerevisiae to overproduce squalene. J Agric Food Chem, 2020, 68(7): 2132-2138. DOI:10.1021/acs.jafc.9b07419 |
| [74] | Liu GS, Li T, Zhou W, et al. The yeast peroxisome: a dynamic storage depot and subcellular factory for squalene overproduction. Metab Eng, 2020, 57: 151-161. DOI:10.1016/j.ymben.2019.11.001 |
| [75] | Liu YQ, Zhang GL, Sun H, et al. Enhanced pathway efficiency of Saccharomyces cerevisiae by introducing thermo-tolerant devices. Bioresour Technol, 2014, 170: 38-44. DOI:10.1016/j.biortech.2014.07.063 |
| [76] | Ni JP, Zhang GL, Qin L, et al. Simultaneously down-regulation of multiplex branch pathways using CRISPRi and fermentation optimization for enhancing β-amyrin production in Saccharomyces cerevisiae. Synth Syst Biotechnol, 2019, 4(2): 79-85. DOI:10.1016/j.synbio.2019.02.002 |
| [77] | Liu H, Fan JJ, Wang C, et al. Enhanced β-amyrin synthesis in Saccharomyces cerevisiae by coupling an optimal acetyl-CoA supply pathway. J Agric Food Chem, 2019, 67(13): 3723-3732. DOI:10.1021/acs.jafc.9b00653 |
| [78] | Yu Y, Rasool A, Liu HR, et al. Engineering Saccharomyces cerevisiae for high yield production of α-amyrin via synergistic remodeling of α-amyrin synthase and expanding the storage pool. Metab Eng, 2020, 62: 72-83. DOI:10.1016/j.ymben.2020.08.010 |
| [79] | Ma T, Shi B, Ye ZL, et al. Lipid engineering combined with systematic metabolic engineering of Saccharomyces cerevisiae for high-yield production of lycopene. Metab Eng, 2019, 52: 134-142. DOI:10.1016/j.ymben.2018.11.009 |
| [80] | Gul K, Tak A, Singh AK, et al. Chemistry, encapsulation, and health benefits of β-carotene - A review. Cogent Food Agric, 2015, 1(1): 1018696. DOI:10.1080/23311932.2015.1018696 |
| [81] | álvarez R, Vaz B, Gronemeyer H, et al. Functions, therapeutic applications, and synthesis of retinoids and carotenoids. Chem Rev, 2014, 114(1): 1-125. DOI:10.1021/cr400126u |
| [82] | Chen X, Wei ZQ, Zhu L, et al. Efficient approach for the extraction and identification of red pigment from Zanthoxylum bungeanum maxim and its antioxidant activity. Molecules, 2018, 23(5): 1109. DOI:10.3390/molecules23051109 |
| [83] | Wang JF, Liu XJ, Liu RS, et al. Optimization of the mated fermentation process for the production of lycopene by Blakeslea trispora NRRL 2895 (+) and NRRL 2896 (?). Bioprocess Biosyst Eng, 2012, 35(4): 553-564. DOI:10.1007/s00449-011-0628-6 |
| [84] | Yan GL, Wen KR, Duan CQ. Enhancement of β-carotene production by over-expression of HMG-CoA reductase coupled with addition of ergosterol biosynthesis inhibitors in recombinant Saccharomyces cerevisiae. Curr Microbiol, 2012, 64(2): 159-163. DOI:10.1007/s00284-011-0044-9 |
| [85] | Sun L, Shang F, Duan CQ, et al. Reduction of fatty acid flux at low temperature led to enhancement of β-carotene biosynthesis in recombinant Saccharomyces cerevisiae. Korean J Chem Eng, 2015, 32(7): 1354-1360. DOI:10.1007/s11814-014-0318-6 |
| [86] | Sun YX, Sun L, Shang F, et al. Enhanced production of β-carotene in recombinant Saccharomyces cerevisiae by inverse metabolic engineering with supplementation of unsaturated fatty acids. Process Biochem, 2016, 51(5): 568-577. DOI:10.1016/j.procbio.2016.02.004 |
| [87] | Pereira CPM, Souza ACR, Vasconcelos AR, et al. Antioxidant and anti-inflammatory mechanisms of action of astaxanthin in cardiovascular diseases. Int J Mol Med, 2020, 4: 37-48. |
| [88] | Ye LD, Xie WP, Zhou PP, et al. Biotechnological production of astaxanthin through metabolic engineering of yeasts. Chem Bio Eng Rev, 2015, 2(2): 107-117. |
| [89] | Jiang GZ, Yang ZM, Wang Y, et al. Enhanced astaxanthin production in yeast via combined mutagenesis and evolution. Biochem Eng J, 2020, 156: 107519. DOI:10.1016/j.bej.2020.107519 |
| [90] | Ai LM, Guo WW, Chen W, et al. The gal80 deletion by CRISPR-Cas9 in engineered Saccharomyces cerevisiae produces artemisinic acid without galactose induction. Curr Microbiol, 2019, 76(11): 1313-1319. DOI:10.1007/s00284-019-01752-2 |
| [91] | Hu TY, Zhou JW, Tong YR, et al. Engineering chimeric diterpene synthases and isoprenoid biosynthetic pathways enables high-level production of miltiradiene in yeast. Metab Eng, 2020, 60: 87-96. DOI:10.1016/j.ymben.2020.03.011 |
| [92] | Sun L, Kwak S, Jin YS. Vitamin A production by engineered Saccharomyces cerevisiae from xylose via two-phase in situ extraction. ACS Synth Biol, 2019, 8(9): 2131-2140. DOI:10.1021/acssynbio.9b00217 |
| [93] | Hong JY, Park SH, Kim S, et al. Efficient production of lycopene in Saccharomyces cerevisiae by enzyme engineering and increasing membrane flexibility and NAPDH production. Appl Microbiol Biotechnol, 2019, 103(1): 211-223. DOI:10.1007/s00253-018-9449-8 |
| [94] | ?zayd?n B, Burd H, Lee TS, et al. Carotenoid-based phenotypic screen of the yeast deletion collection reveals new genes with roles in isoprenoid production. Metab Eng, 2013, 15: 174-183. DOI:10.1016/j.ymben.2012.07.010 |
| [95] | Zhou PP, Xie WP, Li AP, et al. Alleviation of metabolic bottleneck by combinatorial engineering enhanced astaxanthin synthesis in Saccharomyces cerevisiae. Enzyme Microb Technol, 2017, 100: 28-36. DOI:10.1016/j.enzmictec.2017.02.006 |
| [96] | Jin J, Wang Y, Yao MD, et al. Astaxanthin overproduction in yeast by strain engineering and new gene target uncovering. Biotechnol Biofuels, 2018, 11: 230. DOI:10.1186/s13068-018-1227-4 |
| [97] | Shi B, Ma T, Ye ZL, et al. Systematic metabolic engineering of Saccharomyces cerevisiae for lycopene overproduction. J Agric Food Chem, 2019, 67(40): 11148-11157. DOI:10.1021/acs.jafc.9b04519 |
