
 , 张雪雅1,2, 张敏青4, 江国华1
, 张雪雅1,2, 张敏青4, 江国华1

1. 浙江理工大学 材料科学与工程学院,浙江 杭州 310018;
2. 浙江理工大学 智能生物材料研究所,浙江 杭州 310018;
3. 浙江-毛里求斯生物医用材料与组织工程联合中心,浙江 杭州 310018;
4. 浙江理工大学 体育教研部,浙江 杭州 310018
收稿日期:2020-06-20;接收日期:2020-09-27;网络出版时间:2020-10-30
基金项目:国家自然科学基金(Nos. 51873194, 51373155),浙江省自然科学基金(No. LY18E030006) 资助
摘要:微针在过去几十年中发展迅速,在透皮给药等领域已得到了广泛的研究。近些年随着微电子技术的蓬勃兴起,微针在生物诊疗中的应用越来越多的受到人们关注。通过微针提取血液和组织液进行检测分析以及微针作为电极在体液内直接对血糖、黑色素瘤、pH值等进行实时检测方面,都展现出了良好的实时检测应用前景。文中综述了微针的材料与结构设计及其在生物诊疗中的最新研究进展。
关键词:微针可穿戴设备实时检测微创无痛
Microneedles in diagnosis and treatment: a review
Tianqi Liu1,2, Gao Song1,2, Zhiyong Zeng1,2

 , Xueya Zhang1,2, Minqing Zhang4, and Guohua Jiang1
, Xueya Zhang1,2, Minqing Zhang4, and Guohua Jiang1

1. College of Materials Science and Engineering, Zhejiang Sci-Tech University, Hangzhou 310018, Zhejiang, China;
2. Institute of Smart Biomaterials, Zhejiang Sci-Tech University, Hangzhou 310018, Zhejiang, China;
3. Zhejiang Mauritius Joint Research Center for Biomaterials and Tissue Engineering, Zhejiang Sci-Tech University, Hangzhou 310018, Zhejiang, China;
4. Department of PE, Zhejiang Sci-Tech University, Hangzhou 310018, Zhejiang, China
Received: June 20, 2020; Accepted: September 27, 2020; Published: October 30, 2020
Supported by: National Natural Science Foundation of China (Nos. 51873194, 51373155), Natural Science Foundation of Zhejiang Province, China (No. LY18E030006)
Corresponding author: Minqing Zhang. Tel: +86-571-86843535; E-mail: zhangminqing@zstu.edu.cn;
Guohua Jiang. Tel: +86-571-86845580; E-mail: ghjiang_cn@zstu.edu.cn.
Abstract: Microneedles have been developed rapidly in the field of transdermal administration in the past few decades. In recent years, the development of microelectronics technology has expanded the applications of microneedles by combining with microelectronic systems, especially in biological diagnosis and treatment. Different types of microneedles have been designed to extract blood and tissue fluids for detection, or as electrodes to directly detect blood sugar, melanoma and pH in real-time in vivo, both show good prospects for real-time detection applications. In this paper, we review the design of materials and structure of microelectronic-based microneedles, and discuss their advances in biological diagnosis.
Keywords: microneedlewearable devicereal-time detectionminimally invasivepainless
凭借着效率高、成本低、准确性良好的优点,针头抽血进行化验的方法得到了广泛的使用。但是同时也暴露出一系列问题:1) 不规范的操作以及使用未经消毒的针头,可能会给病人带来严重的血源性病原感染[1-2]。2) 全世界大多数的儿童以及青少年都患有针头恐惧症,有20%–30%的成年人对针头感到恐惧[3]。3) 对于一些需要频繁地进行检测或给药的病人来说,日常的提取血样或注射药物过程令其苦不堪言。例如,糖尿病患者,即便使用简单易操作的血糖仪,频繁的手指穿刺也会导致穿刺疼痛和不适,也存在着因细菌进入人体而造成感染的风险[4]。
为了避免传统注射带来的一系列问题,在20世纪70年代人们提出了微针(Microneedles,MNs) 的概念,由于制备技术条件的限制,直至1995年Hashmi等[5]才首次采用刻蚀技术制备出了微针贴片。随后Henry等[6]首次将微针应用于透皮给药领域,提高了钙黄绿素的经皮透过率。微针不仅可以有效地将药物递送至皮肤的角质层(Stratumcorneum,SC) 下,还可以减少与真皮层内神经末梢的接触,极大程度地降低了疼痛感。
微针贴片是由成百上千根的高度为几百微米的针组成的,作为皮下注射给药的微型复制品[7],提高了药物利用率,微针迅速发展成为一种新型的给药方式,近些年来受到广泛的研究与关注。目前微针在化妆品领域应用最为广泛[8],并已商业化多年。而应用于透皮给药的微针产品还在临床试验阶段,大多数微针主要用于疫苗接种[9-10]、糖尿病的治疗[11-14]、毛发再生[15-16]、皮肤癌的治疗[17-19]等方面。近年来,微针的应用范围逐渐扩大,通过微针对分析物(例如,葡萄糖、血液、生物标志物等) 进行提取或原位检测,为生物传感器等实验产品专业到生活应用提供了良好的载体。
微针平台被用于设计诊断通过评估外部分泌物(例如,尿液、唾液、汗水和眼泪等) 或体液(组织液和血液) 来输出与医学相关的信号[20]。由于诊断时仅需要较低浓度的生物标志物且具有较高的准确性,微针被认为是理想的生物传感平台,能够以微创的方式提取或进入皮下体液,以检测各种分析物。此外,作为生物标志物重要来源的组织液得到了人们越来越多的关注。组织液不仅具有与血液相似的蛋白质、小分子和RNA,还包含比血液更富集的特定生物标志物,特别是在发生皮肤疾病(例如,黑色素瘤等) 的情况下。目前主要有两个基于微针的诊断的操作模式:(1) 通过微针采集含有生物分析物的组织液或血液以进行后续测试;(2) 将微针集成到传感器上进行原位检测。基于微针的两种诊断操作模式都具有重要意义,在此对微针的材料结构设计及在生物诊疗中的应用研究进展进行总结。
1 微针的材料与结构设计1.1 微针的材料及分类微针从材料和功能上可分为生物微针、仿生人造微针和人造微针。生物微针综合性能优异,例如,蚊子的口针是天然的无痛微针,几乎“无肤不摧”。研究发现,蚊子的口针弹性模量与聚合物材料相当,表面硬度则可媲美金属材料,并且越接近尖端表面硬度越高[21]。正是这个内柔外刚的力学性质使得蚊子口针不但能轻易刺入皮肤,还可以在皮下自由弯曲以寻找毛细血管。受天然的生物微针功能启发,仿生人造微针已逐渐引起人们的关注。例如,Bae等[22]受毒蛇后牙能够快速注入毒液的启发,设计了蛇牙状的微针,利用微针上纹路与皮肤形成的毛细管作用力能够快速注入液体药物(图 1A)。Zhang等[23]受螳螂前肢的锯齿状微观结构的启发,设计了不同尺寸和朝向的锯齿状微针,该微针阵列能够在外力作用下牢固地黏附在皮肤上,是理想的药物释放装置(图 1B)。Chen等[24]模仿蜜蜂毒刺设计了一种毒刺状微针,与普通微针相比,倒刺使微针更容易插入皮肤,同时增加了微针在皮肤上的黏附力,进一步为微针的组织黏附、透皮给药等研究提供思路(图 1C)。
 |
| 图 1 部分仿生人造微针(A:蛇毒启发的微针阵列的照片[22]. B:(i) 螳螂爬在一片叶子上的数字图像. (ii, iii) 倾斜的锯齿状螳螂前肢微观结构的光学和SEM图像. (iv) 垂直微针阵列:灰色箭头表示倒置放置时容易从皮肤上掉落,受生物启发的锯齿状钳位微针阵列具有紧密固定的能力[23]. C:蜜蜂启发的微针示意图[24]) Fig. 1 Some bionic artificial MNs. (A) Photograph of the snake fang-inspired MN array[22]. (B) (i) Digital image of a mantis climbing on a leaf. (ii, iii) Optical and SEM images of the forelegs of mantises showing slant serrated microstructure. (iv) Perpendicular MN array: the gray arrow shows it is prone to fall off from the skin when placed upside down. Bio-inspired serrated clamping MN array has the ability to hold on firmly[23]. (C) The schematic diagram of honeybee-inspired MNs[24]. |
| 图选项 |
人造微针主要采用以下3种材料:硅、聚合物和金属材料。硅加工工艺成熟,但属于脆性材料,使用过程中容易断裂;聚合物韧性好,但使用过程中针尖容易屈曲破坏;金属微针制造成本较高,并且容易氧化污染。人造微针根据结构的不同,大致可分为实体微针(Solid MNs)、中空微针(Hollow MNs)、涂层微针(Coated MNs) 和可溶微针(Dissolving MNs),其结构如图 2所示[25]。
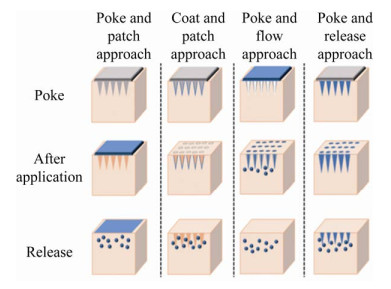 |
| 图 2 Classification of microneedles: solid MNs, hollow MNs, dissolving MNs and coated MNs[25]. Fig. 2 Classification of microneedles: solid MNs, hollow MNs, dissolving MNs and coated MNs[25]. |
| 图选项 |
实体微针[26]通过激光刻蚀的方式对硅、金属等材料进行加工制备而成,是最早被制备出来并应用到透皮给药领域的微针。当微针刺入皮肤并移除以后,皮肤上留下暂时性的微孔通道,药物涂敷在皮肤以后,通过微孔通道到达真皮层,进入血液循环发挥药效。实体微针机械性能好,能够轻易地刺入皮肤,但是由于其材料的生物相容性差和不可降解性,当微针在皮肤内断裂时,容易造成感染并且难于去除。给药效率也随着皮肤微孔的弹性收缩而下降。目前在给药领域已经应用不多,但在美容领域应用广泛。
中空微针[27-28]与实体微针尺寸相近,通过激光、刻蚀等方式使其内部形成贯穿微针的中空结构,相当于传统注射针头的缩小版。中空微针主要运载液体药物,具有传统皮下注射给药量大的优势,同时又具有无痛微创的特点,药物利用度高,但是当微针刺入皮肤后,微针容易被堵塞,阻碍药物后续递送。目前研究人员对中空微针进行了改进,通过压力、毛细管力以及电泵驱动等方式可以控制给药效率从而实现持续给药、间断给药。
在实体微针的基础上,通过蘸取或喷涂的方式制备涂层微针[29-30]。当微针刺入皮肤后,药物涂层溶解于皮肤组织液,进而达到给药的目的。相较于实体微针,涂层微针给药更加方便,操作更加简单,药效也更快。但是由于涂层厚度薄,微针表面积小,导致涂层微针的载药量不足。且在微针插入过程中,微针表面与皮肤之间的摩擦力容易使得涂层药物滞留在皮肤外部,影响给药效率。目前有研究利用涂层用于微针的保护以及药物的可控释放(图 3A)[31-32]。
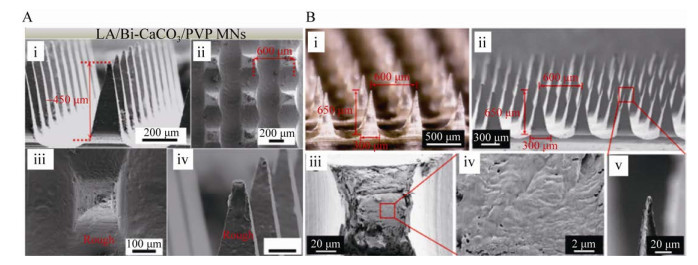 |
| 图 3 涂层微针和可溶微针(A:具有相变涂层微针的SEM图像[32]. B:(i) Alg-APBA/HA可溶微针的数字图像;(ii) 微针阵列的SEM图像. 断裂面(iii和iv) 和针尖(v)[14]) Fig. 3 Coated MNs and dissolving MNs. (A) SEM image of microneedles with phase change coating[32]. (B) (i) Digital image of Alg-APBA/HA soluble microneedles; (ii) SEM image of microneedle array. Fracture surface (iii and iv) and needle tip (v). |
| 图选项 |
可溶微针[33-37]选用生物相容性好、可生物降解的聚合物,通过离心法、抽真空法以及3D打印等方法制备而成。常用的材料有聚乙烯醇(Polyvinyl alcohol,PVA)、聚乙烯吡咯烷酮(Polyvinyl pyrrolidone,PVP)、透明质酸(Hyaluronan,HA) (图 3B) 等。药物直接包载在微针基体内,当微针刺入皮肤,在组织液或热的作用下,微针基体溶解从而释放其中的药物,同时可以实现药物缓释的效果。相较于其他类型微针,可溶微针制备方法简单、生物相容性好,得到了大量的关注与研究,被认为是最有临床应用前景的微针。但可溶微针容易吸潮,易受制备环境、运送环境以及使用环境的影响,湿度过大使得可溶微针吸潮导致强度下降,可能影响使用过程中微针的穿透率。
1.2 微针的结构设计微针的形式多种多样,按照结构特点主要分为不可分离式微针和可分离式微针。
1.2.1 不可分离式微针不可分离式微针是最先提出并制备的微针,但是由于人体皮肤的高弹性以及使用过程中微针针头的弯曲,微针的插入高度随时发生变化,从而导致给药量不准确。可分离式微针通过针与基底的分离从而提高药物的利用率。由于不需要长时间贴在皮肤上,也避免了不必要的皮肤刺激[38]。
不可分离式微针最初都是简单的形状,例如金字塔形[39-40]、圆锥形[41]、棱柱棱锥组合形[42]等。微针刺入皮肤以后,针尖部分接触皮下组织液溶解从而释放微针基体中的药物。Zhang等[43]制备了钙离子交联的藻酸盐/麦芽糖(Ca2+/Alg-Mal) 不可分离式微针(图 3A),通过包封负载胰岛素用于糖尿病的治疗。不可分离式微针溶解缓慢,一般需要数分钟或数十分钟才能去除贴片基底。微针长时间作用在皮肤上会给患者带来不适,并且由于皮肤弹性以及外力作用,部分微针会脱离皮肤进而导致给药量不准确和药物浪费。
1.2.2 可分离式微针为了避免在使用过程中由于皮肤弹性以及形变发生微针脱落而影响药物利用率,可分离式微针在不可分离式微针的基础上进行了改进。将微针部分分为两段,第一段针尖部分用于载药,第二部分在组织液或力的条件下实现与针尖的分离。降低微针在皮肤上的贴附时间,从而提高药物利用率并进一步提高给药的精准性。Yu等[44]设计了近红外光触发给药的可分离微针系统用于糖尿病的治疗(图 4A),该系统由包裹光热因子普鲁士蓝(Prussian blue,PB) 及二甲双胍的疏水性相变材料聚己内酯(Polycaprolactone,PCL) 针尖和PVA/PVP可溶性基底组成。当微针刺入皮肤后,基底溶于组织液,从而使微针针尖与基底实现分离,在近红外光照射后,PB进行光热转换将PCL融化实现可控的药物释放。为了进一步地提高分离速度,Li等[45]制备了气泡可分离式微针,该微针结构如图 4B所示,其利用不同浓度的针尖材料(聚乳酸和聚乳酸-乙醇酸共聚物) 在干燥过程中产生不同的收缩体积,制备含有不同大小气泡的微针。适宜的气泡能够提供微针足够插入皮肤的机械强度并仅需要较小的剪切力便可实现微针的快速分离。与此同时,Li等[46]还设计了快速可分离的泡腾微针贴片(图 4C)。该微针有可缓慢生物降解的聚乳酸-羟基乙酸共聚物作为针尖材料,将泡腾片配方引入至微针基体,柠檬酸作为酸源,PVP作为支架,碳酸氢钠作为碱源。当微针插入皮肤,柠檬酸与碳酸氢钠在组织液的作用下快速产生气泡促使PVP结构崩塌,实现微针的快速分离。
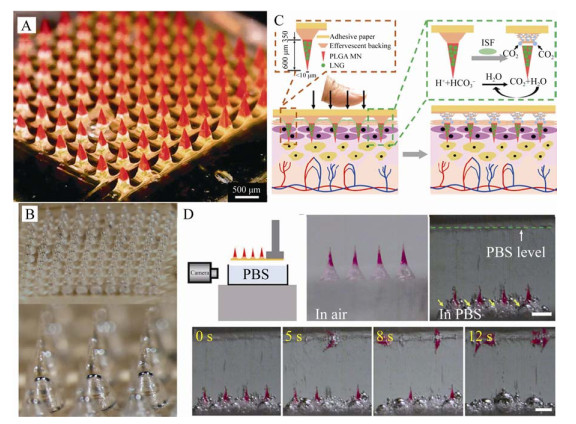 |
| 图 4 几种可分离式微针(A:装在针尖中的若丹明6G可分离式微针的显微镜照片[44]. B:包含气泡的微针阵列的代表明场显微图像. 黑色箭头表示微针和膜片衬背界面处的气泡结构[45]. C:泡腾微针贴片的设计[46]. D:微针在PBS溶液中放置前(左) 和紧随其后(右) 的明场显微图像. 黄色箭头表示在泡腾背衬中产生的气泡[46]) Fig. 4 Some separable MNs. (A) Microscope camera photos of separable MNs with Rhodamine 6G loaded in the needle tips[44]. (B) Representative bright-field microscopy images of an array of microneedles containing bubbles. The black arrows identify bubble structures at the interface of the microneedles and patch backing[45]. (C) Design of effervescent MN patches[46]. (D) Representative bright-field microscopy images of MN patches before (left) and immediately after (right) placement in PBS solution. The yellow arrows indicate gasbubbles generated in the effervescent backing[46]. |
| 图选项 |
为了实现微针更便捷的使用和更准确的给药效率,研究人员分别在不可分离式微针及可分离式微针进行了探索。但可分离式微针在皮肤上的贴附时间明显小于不可分离式微针,这意味着造成刺激皮肤的几率更小,可分离式微针更具有优势与发展前景。
2 微针提取检测物进行体外检测2.1 血液人体血液内含大量标记物(葡萄糖、胆固醇等),能够反映出人体的健康状况,实现对血液状况的连续性监测对监控人类健康有着重大意义。Tsuchiya等[47]针对患者频繁且痛苦的采血问题开发了一种自动采血装置(图 5A),来实现人体血糖的自我监测。采用薄膜沉积工艺生产出与蚊子口器尺寸相近的钛微针,搭配压痕装置使得微针能够刺入皮肤。随后微量抽血系统以微升每分钟的速度吸取血液,提取到的血液体积足够应用于检测葡萄糖水平。
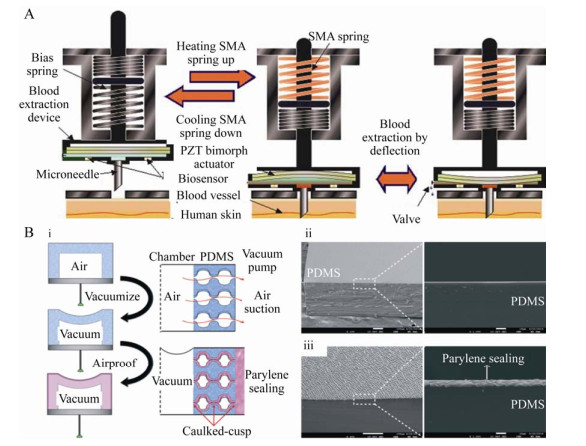 |
| 图 5 微针提取血液示意图(A:基于微针的自动采血装置[47]. B:(i) 一键式采血系统的真空预活化和聚对二甲苯涂层工艺示意图. PDMS腔室表面聚对二甲苯薄膜沉积之前(ii) 和之后(iii) 的扫描电子显微镜图像[48]) Fig. 5 Schematic diagram of blood extraction using MNs. (A) Automatic blood collection device based on MNs[47]. (B) (i) Schematic diagram of the pre-vacuum activation and parylene coating process for the one-touch blood extraction system. Scanning electron microscopy images of the PDMS chamber surface (ii) before and (iii) afterparylene film deposition[48]. |
| 图选项 |
Li等[50]将中空微针与基于纸张的生物传感器集成在一起,提出了一种一触式激活的血液多诊断系统(图 6B),仅需通过手指操作便可自动执行采血、血清分离和检测等功能。采用手指按压的方式将微针插入血管并使得PDMS变形腔产生负压,从而通过微针的中空结构的毛细作用将血液提取到储液腔内。采集的血液被样品垫吸收,并引入到不对称亚砜膜上,在此处基于大小排阻效应从血液中分离出血细胞,通过硝化纤维素膜转运至反应膜,通过比色法检测生物标志物。
 |
| 图 6 通过按压产生负压提取血液的微针示意图(A:一键激活的血液多诊断系统(OBMS) 的示意图[49]. B:使用MEMS微型采样器进行体内血液提取[50]) Fig. 6 Schematic diagram of MNs for extracting blood under negative pressure by pressing. (A) Schematic representation of the one-touch-activated blood multidiagnostic system (OBMS)[49]. (B) In vivo blood extraction using MEMS micro sampler[50]. |
| 图选项 |
Blicharz等[51]设计的自动采集血液装置,将微针阵列、注射装置、储存仓以及抗凝素集成在一个微小的设备中,仅需要按下按钮,即可采集100? μL的血液,且采集的血样与静脉注射采集的血样相比血红蛋白含量相当。目前该设备已经获得美国食品和药物管理局(Food and Drug Administrction,FDA) 的上市前批准。
2.2 组织液(ISF)目前组织液被认为是用于疾病诊断和持续检测的生物标志物的来源。多种微针适用于提取组织液:中空微针、多孔微针以及水凝胶微针。
Strambini等[52]提出了一种基于微针的无泵透皮生物传感器用于检测葡萄糖,通过利用中空二氧化硅微针的毛细作用,可以以高达1 μL/s的速度吸收组织液,组织液随后与集成在微针背面的葡萄糖酶促生物传感器耦合,能够在30 s内完成高精度的葡萄糖测量。葡萄糖的检出范围为0–35 nmol/L (图 7A)。
 |
| 图 7 微针用于组织液的提取(A:在1型微针的两个不同放大倍数下的鸟瞰扫描电子显微镜图像,传统的胰岛素针位于其顶部以进行比较[52]. B:集成了多孔微针阵列的微创血糖监测系统的示意图[53]. C:通过交联的MeHA微针贴片快速提取组织液的示意图[54]) Fig. 7 Extraction of ISF using MNs. (A) Bird-eye-view scanning electron microscope (SEM) images at two different magnifications of type 1 MNs with a typical insulin needle sitting ontheir top for comparison[52]. (B) Schematic of the proposed minimally invasive blood glucosemonitoring system integrating an array of porous MNs[53]. (C) Schematic representation of the rapid extraction of ISF by crosslinked MeHA-MN patches[54]. |
| 图选项 |
Takeuchi等[53]制备了一种海绵状的多孔微针,使用HA填充多孔PDMS微针来提高微针的机械强度,当微针刺入皮肤后,多孔微针随着HA的溶解也显现出来,通过手动压缩和毛细管作用将液体样品吸收到储液仓中(图 7B)。
Chang等[54]制备了一种可快速提取组织液的可膨胀水凝胶微针贴片,微针由甲基丙烯酸透明质酸(MeHA) 通过紫外交联制备而成,能够实现在1 min内吸取1.4 μL的组织液(图 7C)。He等[55]研究制备了PVA/CS水凝胶微针贴片用于提取组织液,水凝胶高度多孔的微结构为组织液的提取提供了良好的溶胀能力,PVA的热降解特性便于快速高效地从微针贴片中回收目标生物标志物。成功从兔子皮下提取组织液,对葡萄糖水平进行的分析结果与商业血糖检测结果相近。
综上,微针在生物体内液体采样展现了良好的潜力,在血液提取方面,中空微针可以在几秒内提取几十微升的血液。在组织液提取方面,中空微针的采集体积要明显高于多孔微针及水凝胶微针。微针在的采样能力使得其与传统注射器针头采集更具有竞争力。水凝胶微针及多孔微针虽然制备简单,但是从中释放吸取的组织液还需要其他过程。性能更好的中空微针由于可以直接将样品吸出到微针底部,目前已将各种结构的生物传感器用作样品提取。
3 微针体内实时检测3.1 葡萄糖糖尿病患者需要每天需要进行多次的血糖测量及给药,微针在糖尿病给药方面已经得到了很大的发展,但是糖尿病患者依旧要面对测量血糖时频繁刺破手指带来的痛苦。基于微针的传感器通过减小疼痛感从而提高病人的依从性,并严格监控血糖,降低血糖以及糖尿病并发症的风险。
Barrett等[56]基于葡萄糖氧化酶的循环伏安法用于检测人体组织液内的血糖(图 8A)。采用的三电极系统中,镀金的聚合物微针电极作为工作电极,铂(Pt) 丝作为对电极,银作为参比电极。通过使用二茂铁一元羧酸作为氧化还原介质来克服耗氧量的相关问题并消除干扰效应,该传感器设备展示了快速检测葡萄糖的能力。在2.0–13.5 mmol/L的葡萄糖线性浓度范围内,该葡萄糖传感器具有较高的选择性。但是并没有对传感器的稳定作用时间做出一定的检测,为了避免频繁的更换传感器,传感器系统应该具有较长的使用时间以及储存时间。
 |
| 图 8 葡萄糖的实时监测(A:基于丝素蛋白/D-山梨糖醇微针电极的微创葡萄糖电化学生物传感器的示意图以及涉及使用GOD检测葡萄糖的生物催化反应循环[56]. B:通过在微针阵列电极上通过溶解的葡萄糖氧化酶的氧化进行的FcCOOH介导的葡萄糖的电化学检测的反应机理的示意图[57]) Fig. 8 Real-time glucose monitoring. (A) Schematic diagram of the minimally-invasive glucose electrochemical biosensor based on a silk fibroin/D-sorbitol microneedle electrodeand the biocatalyzed reaction cycle involved in the detection of glucose using GOD[56]. (B) A schematic representation of the reaction mechanism forFcCOOH mediated electrochemical detection of glucose via oxidation by dissolved glucose oxidase at a microneedle array electrode[57]. |
| 图选项 |
为了克服生物传感器的不稳定性,Zhao等[57]制备了丝素蛋白/D-山梨糖醇微针阵列作为葡萄糖传感器电极用于连续监测葡萄糖含量(图 8B)。基于微针的葡萄糖生物传感器系统是使用中空的微针阵列模板构建的。将铂丝和银线固定在丝素蛋白/D-山梨糖醇的复合物中,分别制成工作电极,对电极和参比电极。工作电极被固定在微针Pt丝中的葡萄糖氧化酶功能化。丝素蛋白/D-山梨糖醇为酶分子提供了稳定且生物相容的环境。当微针刺入皮肤到达组织液时,葡萄糖氧化酶催化工作电极中的葡萄糖氧化产生过氧化氢,被传送到工作电极,并在电极表面检测过氧化氢的浓度,从而提供与初始葡萄糖浓度成比例的电流。该微针生物传感器的最佳工作pH和温度分别为7.0和35 ℃,都接近人体生理环境。检出范围为1.7–10.4 mmol/L,能够满足大部分人体生理变化范围。并且能够可高度再现葡萄糖信号,展现了良好的稳定性。
Bollella等[58]报告了基于微针的生物传感器阵列,用于连续并同时监测组织液中的乳酸和葡萄糖(图 9A)。微针的表面电沉积金-多壁碳纳米管,并通过氧化还原介体亚甲基蓝进行了修饰。两个工作电极分别使用乳酸氧化酶和葡萄糖脱氢酶进行功能化。其中葡萄糖生物传感器的灵敏度为(405.2±24.1) μA·L/(mmol·cm2),线性范围为0.05–5.00 mmol/L,检测极限为7 μmol/L。虽然该生物传感器具有同时检测两种物质的功能,但是对于葡萄糖的检测来说,线性范围较小,并不能满足日常生活中人体的葡萄糖测试。
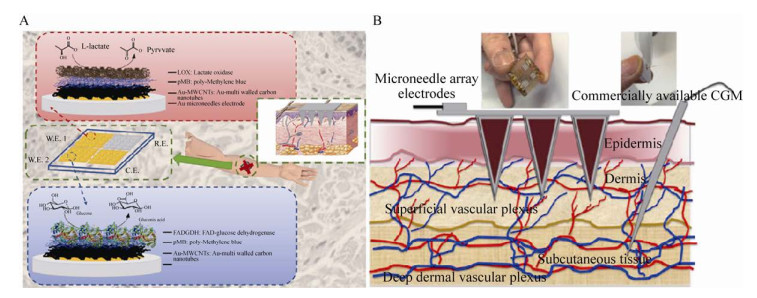 |
| 图 9 葡萄糖的实时监测(A:人工组织液中同时监测乳酸和葡萄糖的基于微针的生物传感器阵列的示意图[58]. B:两种不同获取组织液的方法(微针阵列电极与商用CGM) 和皮肤隔室的两个区域[60]) Fig. 9 Real-time glucose monitoring. (A) Schematic representation of microneedle-based biosensor array for simultaneous lactate and glucose monitoring in artificial interstitial fluid[58]. (B) Showing the two different approaches (microneedle arrayelectrodes versus commercial CGM) and the two regions of the skin compartment used to access the interstitial fluid[60]. |
| 图选项 |
同时Bollella等[59]又制备了基于微针的多空金生物传感器,用于监测组织液中的葡萄糖。在相对饱和甘汞电极施加-2V的电势使得金在电极上沉积。通过固定6-(二茂铁基)己烷硫醇作为氧化还原介质,最后用滴铸法固定黄素腺嘌呤二核苷酸葡萄糖脱氢酶来修饰多孔金工作电极。该传感器的检出线性范围增长为0.1–10.0 mmol/L,灵敏度提高至50.86 μA·L/(mmol·cm2),反应时间为3 s。在储存30 d后,传感器信号仅下降10%,具有良好的稳定性。
Sharma等[60]通过光刻技术制备了基于微针电极的微创葡萄糖生物传感器,用于微创无痛的连续葡萄糖检测(图 9B)。微针电极被含有葡萄糖氧化酶的电聚合多酚膜包裹。当葡萄糖浓度降至0.5 mmol/L时,该葡萄糖传感器响应时间为15 s。Yoon等[61]制备了一种基于硅微针的三电极集成化学传感器用于葡萄糖检测,在硅微针表面沉积铁催化剂制成工作电极和对电极,表面沉积银并进行氯化后形成Ag/AgCl参比电极。通过对体外3–20 mmol/L范围内不同葡萄糖浓度进行测试,葡萄糖浓度与电流呈线性关系,灵敏度为(17.73±3.0) μA·L/mmol。
Ju等[62]制备了一种新型SERS (表面增强拉曼光谱) 的聚甲基丙烯酸甲酯(PMMA) 微针生物传感器用于皮下葡萄糖的原位检测。镀银微针阵列表面掺入将1-癸硫醇(1-DT) 后,可在0–20 mmol/L范围内快速测量组织液内的葡萄糖。
随着研究的不断深入,检测血液、组织液内葡萄糖的微针生物传感器的线性检出范围、灵敏度、反应时间以及存放时间都得到了极大的改善。但是基于酶的生物传感器的使用时间不够持久,另外由于皮肤弹性及弯曲对传感器准确性的影响还没有进行充分的研究。
3.2 黑色素瘤黑色素瘤是一种侵袭性皮肤癌,对黑色素瘤的早期筛查诊断可降低死亡率。但是,目前黑色素瘤的诊断需要进行复杂的操作来检测其生物标志物。为了更快、便捷地检测黑色素瘤,人们将参与黑色素合成的酪氨酸酶(TYR) 作为生物标记物进行检测。Ciui等[63]设计了一种基于微针的可穿戴式电化学传感器,将还有邻苯二酚的中空微针加载到便携式电子板上,微针刺入皮肤后,体内累积的酪氨酸酶能将邻苯二酚氧化成苯醌,酶促反应生成的产物在–0.25 V (vs Ag/AgCl) 的电势下,在印刷的碳工作电极上进行安培测量,传感器系统将无线数据传输到移动设备上,可实现高度选择性的检测,并形成一个完全集成、低成本、无痛微创的黑色素瘤筛查系统。
3.3 钾离子人体电解质的失衡与某些疾病息息相关,对皮肤内部离子的检测对控制疾病有着重要作用。Parrilla等[64]提出了一种可穿戴的微针贴片,通过电位来检测组织液中的钾离子(图 10A)。在不锈钢中空微针上涂覆不同种类的涂层,作为微针传感器的电极。其中涂覆Ag/AgCl的不锈钢微针作为参比电极,涂覆碳/功能化的多壁碳纳米管(f-MWCNTs) 的微针作为钾离子选择电极,并固定在柔性的PDMS衬底上实现可穿戴的效果。对鸡和猪皮内钾离子浓度的测量,活度检出极限为10–4.9 mol/L,线性范围为10–4.2–10–1.1 mol/L,证明了微针在体内有良好的应用潜力,同时体外细胞毒性实验表明,该贴片能够使用至少24 h,对皮肤没有任何副作用。Miller等[65]也进行了钾离子检测的相关工作(图 10B),对比了多孔碳和多孔石墨烯电极作为离子选择电极的效果,其中多孔碳电极展示了更好的电化学性能,检测范围为10–5–10–2 mol/L,检测速度约为20 s。为检测人体电解质提供了一个有吸引力的平台。
 |
| 图 10 体内钾离子的检测(A:(i) 微针贴片示意图. (ii) 不同涂层对微针的改性. (iii) 插入皮肤的微针贴片示意图[64]. B:(i) 钾离子ISE微流控芯片横截面的CorelDraw图. (ii) 钾离子ISE微流控芯片的Solidworks图[65]) Fig. 10 Detection of K+ in vivo. (A) (i) Illustration of the microneedle patch. (ii) Modification of the bare microneedles with different coatings. (iii) Image of the microneedle patch inserted into the skin[65]. (B) (i) CorelDraw rendering of a cross-section of the K+ ISE microfluidic chip. (ii) Solidworks drawing of K+ ISE microfluidic chip[64]. |
| 图选项 |
3.4 神经制剂由于军事活动和农药残留,有机磷 (OP) 神经毒素对士兵和农民构成了严重威胁,会严重影响神经系统进而导致死亡。及时快速地检测毒素在皮肤上的渗透对于确保迅速就医至关重要。Mishra等[66]设计了一种用于微创检测有机磷酸酯化学试剂的微针电化学生物传感器。利用有机磷水解酶(OPH) 的催化作用与碳糊修饰中空微针电极,在OP底物存在下对OPH酶促反应产物对硝基苯酚进行快速方波伏安测量。对20–180 μmol/L范围内的甲基对氧磷(MPOx) 具有高度线性响应,同时具有良好的选择性,并且在接触组织液(ISF) 后具有高稳定性传感器。通过对小鼠的活体实验,证明了传感器对有机磷微创检测的能力。在后面的工作中[67],以类似的方式设计了可穿戴微针传感器能够分别对阿片类药物(OPi) 和有机磷神经毒素,展现了良好的灵敏度、选择性及稳定性。
3.5 pH值在诸多疾病诊断,血液检测中体内pH值的准确定量非常重要。低成本、易制造、可靠安全以及微型化是pH体内检测的关键要求。Mani等[68]设计了实时检测pH值的微针生物传感器,涂覆Ag/AgCl膜的钨基微针作为参比电极,涂覆Zn膜的钨基微针作为工作电极。该传感器的灵敏度约46.35 mV/pH。Zuliani等[69]通过电沉积氧化铱的pH微针阵列,研究了不同条件下对微针传感器斜率等特性的影响,并应用于心脏等软质组织或器官,能够持续记录心脏的pH值分布,微针传感器的稳定时间能够达到5 d。
3.6 过氧化氢人体内的过氧化氢的产生(> 1×10–3 mol/L) 可能与多种疾病相关,因此监测过氧化氢可以直接反映健康状况或疾病进展,除此之外,过氧化氢也作为特定酶的催化反应产生的副产物,可以间接地监测其他生物分子(例如,葡萄糖、尿酸等)。Jin等[70]开发了一种基于微针的透皮过氧化氢电化学生物传感器,微针工作电极通过组装及化学还原法集成了还原氧化石墨烯(rGO) 和铂纳米颗粒(Pt/rGO),并喷涂水溶性的聚乙烯吡咯烷酮作为保护层,避免电极在插入皮肤过程中被破坏。当微针点击刺入皮肤后,微针表面水溶性保护层溶解,电极暴露出来进行检测。
4 总结在过去的十年中,随着微针生物诊疗研究的不断深入,其性能在不断地被提升,微针诊疗体系具有以下优点:1) 能够实时检测各项生命指标(例如血糖等)。2) 能够以无痛、微创的方式获取血液、组织液来检测分析各种生物分析物。
但微针生物传感器仍然处于起步阶段,目前市场上仅有极少数的产品上市(表 1)。但同时也暴露出了不足:1) 已上市的产品价格大多在5–50美元之间,价格要高于传统提取血液、检测血糖的价格。2) 用于连续实时检测的产品可用时间仅能维持几天,微针生物传感器的稳定性需要进一步提升。3) 微针生物传感器仅进行了很少的体内临床试验,尤其选用金属材料作为微针材料的传感器,其安全性有待进一步的检验。4) 由于使用者年龄不同、皮肤状况不同以及手动按压刺入微针传感器导致刺入的深度不同会影响结果的准确性。5) 如何大规模批量生产微针仍是微针生物传感器商业化的重大难题。
表 1 部分已上市的微针检测产品Table 1 Some MN testing products on the market
| Device | Company | Application | Real-time monitoring | References |
| Guardian real-time | Medtronic minimed | Monitoring blood glucose | Yes | [71] |
| Paradigm real-time | Medtronic minimed | Monitoring blood glucose | Yes | [71] |
| STS | Dexcom Inc. | Monitoring blood glucose | Yes | [71] |
| Freestyle navigator | Abbot Inc. | Monitoring blood glucose | Yes | [71] |
| TAP | Seventh Sense Biosystems Inc. | Extraction of blood | No | [51] |
| HemoLink | Tasso Inc. | Extraction of blood | No | [72] |
| ISF absorber | Renephra Ltd | Extraction of ISF | No | [72] |
表选项
随着研究的进一步深入,基于微针的生物传感器会成为未来医疗服务的重要组成部分。结合微针透皮给药的功能,诊断-治疗一体化微针的开发将会对糖尿病等需要进行频繁检测及给药的患者带来便捷。当集成数据传输模块后,可以上传病人的检测情况,医生可根据数据对病人进行线上的治疗及诊断,大大缓解医疗人员不足的情况。病人也可根据微针生物传感器的结果进行自我调节。
参考文献
| [1] | Sagoe-Moses C, Pearson RD, Perry J, et al. Risks to health care workers in developing countries. N Engl J Med, 2001, 345(7): 538-541. DOI:10.1056/NEJM200108163450711 |
| [2] | Ho DD, Neumann AU, Perelson AS, et al. Rapid turnover of plasma virions and CD4 lymphocytes in HIV-1 infection. Nature, 1995, 373(6510): 123-126. DOI:10.1038/373123a0 |
| [3] | Mclenon J, Rogers MAM. The fear of needles: a systematic review and meta-analysis. J Adv Nurs, 2019, 75(1): 30-42. DOI:10.1111/jan.13818 |
| [4] | Ma GJ, Wu CW. Microneedle, bio-microneedle and bio-inspired microneedle: a review. J Control Release, 2017, 251: 11-23. DOI:10.1016/j.jconrel.2017.02.011 |
| [5] | Hashmi S, Ling PP, Hashmi G, et al. Genetic transformation of nematodes using arrays of micromechanical piercing structures. Biotechniques, 1995, 19(5): 766-770. |
| [6] | Henry S, McAllister DV, Allen MG, et al. Microfabricated microneedles: a novel approach to transdermal drug delivery. J Pharm Sci, 1998, 87(8): 922-925. DOI:10.1021/js980042+ |
| [7] | Bhatnagar S, Dave K, Venuganti VVK, et al. Microneedles in the clinic. J Control Release, 2017, 260: 164-182. DOI:10.1016/j.jconrel.2017.05.029 |
| [8] | Singh A, Yadav S. Microneedling: advances and widening horizons. Indian Dermatol Online J, 2016, 7(4): 244-254. DOI:10.4103/2229-5178.185468 |
| [9] | Suh H, Shin J, Kim Y. Microneedle patches for vaccine delivery. Clin Exp Vaccine Res, 2014, 3(1): 42-49. DOI:10.7774/cevr.2014.3.1.42 |
| [10] | Kim YC, Park JH, Prausnitz MR. Microneedles for drug and vaccine delivery. Adv Drug Deliv Rev, 2012, 64(14): 1547-1568. DOI:10.1016/j.addr.2012.04.005 |
| [11] | Zhang Y, Wang DF, Gao MY, et al. Separable microneedles for near-infrared light-triggered transdermal delivery of metformin in diabetic rats. ACS Biomater Sci Eng, 2018, 4(8): 2879-2888. DOI:10.1021/acsbiomaterials.8b00642 |
| [12] | Xu B, Cao QY, Zhang Y, et al. Microneedles integrated with ZnO quantum-dot-capped mesoporous bioactive glasses for glucose-mediated insulin delivery. ACS Biomater Sci Eng, 2018, 4(7): 2473-2483. DOI:10.1021/acsbiomaterials.8b00626 |
| [13] | Yu WJ, Jiang GH, Liu DP, et al. Transdermal delivery of insulin with bioceramic composite microneedles fabricated by gelatin and hydroxyapatite. Mater Sci Eng C, 2017, 73: 425-428. DOI:10.1016/j.msec.2016.12.111 |
| [14] | Yu WJ, Jiang GH, Zhang Y, et al. Polymer microneedles fabricated from alginate and hyaluronate for transdermal delivery of insulin. Mater Sci Eng C, 2017, 80: 187-196. DOI:10.1016/j.msec.2017.05.143 |
| [15] | Yang G, Chen Q, Wen D, et al. A therapeutic microneedle patch made from hair-derived keratin for promoting hair regrowth. ACS Nano, 2019, 13(4): 4354-4360. DOI:10.1021/acsnano.8b09573 |
| [16] | Lahiji SF, Seo SH, Kim S, et al. Transcutaneous implantation of valproic acid-encapsulated dissolving microneedles induces hair regrowth. Biomaterials, 2018, 167: 69-79. DOI:10.1016/j.biomaterials.2018.03.019 |
| [17] | Chen M, Lin ZW, Ling MH. Near-infrared light-activatable microneedle system for treating superficial tumors by combination of chemotherapy and photothermal therapy. ACS Nano, 2016, 10(1): 93-101. DOI:10.1021/acsnano.5b05043 |
| [18] | Pei P, Yang F, Liu JX, et al. Composite-dissolving microneedle patches for chemotherapy and photothermal therapy in superficial tumor treatment. Biomater Sci, 2018, 6(6): 1414-1423. DOI:10.1039/C8BM00005K |
| [19] | Dong LY, Li YC, Li Z, et al. Au nanocage-strengthened dissolving microneedles for chemo-photothermal combined therapy of superficial skin tumors. ACS Appl Mater Interfaces, 2018, 10(11): 9247-9256. DOI:10.1021/acsami.7b18293 |
| [20] | Lee H, Hong YJ, Baik S, et al. Enzyme-based glucose sensor: from invasive to wearable device. Adv Healthc Mater, 2018, 7(8): e1701150. DOI:10.1002/adhm.201701150 |
| [21] | 孔祥情, 曲艳东, 章文姣, 等. 蚊子口针刺入皮肤的刺入力分析. 科学导报, 2013, 31(22): 60-63. Kong XQ, Qu YD, Zhang WJ, et al. Insertion force of mosquito fascicle penetrating into human skin. Sci Technol Rev, 2013, 31(22): 60-63 (in Chinese). |
| [22] | Bae WG, Ko H, So JY, et al. Snake fang-inspired stamping patch for transdermal delivery of liquid formulations. Sci Transl Med, 2019, 11(503): eaaw3329. DOI:10.1126/scitranslmed.aaw3329 |
| [23] | Zhang XX, Wang FY, Yu YR, et al. Bio-inspired clamping microneedle arrays from flexible ferrofluid-configured moldings. Sci Bull, 2019, 64(15): 1110-1117. DOI:10.1016/j.scib.2019.06.016 |
| [24] | Chen ZP, Lin YY, Lee W, et al. Additive manufacturing of honeybee-inspired microneedle for easy skin insertion and difficult removal. ACS Appl Mater Interfaces, 2018, 10(35): 29338-29346. DOI:10.1021/acsami.8b09563 |
| [25] | Hao Y, Li W, Zhou XL, et al. Microneedles-based transdermal drug delivery systems: a review. J Biomed Nanotechnol, 2017, 13(12): 1581-1597. DOI:10.1166/jbn.2017.2474 |
| [26] | Narayanan SP, Raghavan S. Solid silicon microneedles for drug delivery applications. Int J Adv Manuf Technol, 2017, 93(1/4): 407-422. |
| [27] | de Groot AM, Du GS, M?nk?re J, et al. Hollow microneedle-mediated intradermal delivery of model vaccine antigen-loaded PLGA nanoparticles elicits protective T cell-mediated immunity to an intracellular bacterium. J Control Release, 2017, 266: 27-35. DOI:10.1016/j.jconrel.2017.09.017 |
| [28] | Bolton CJW, Howells O, Blayney GJ, et al. Hollow silicon microneedle fabrication using advanced plasma etch technologies for applications in transdermal drug delivery. Lab Chip, 2020, 20(15): 2788-2795. DOI:10.1039/D0LC00567C |
| [29] | Gill HS, Prausnitz MR. Coated microneedles for transdermal delivery. J Control Release, 2007, 117(2): 227-237. DOI:10.1016/j.jconrel.2006.10.017 |
| [30] | Chen XF, Fernando GJP, Crichton ML, et al. Improving the reach of vaccines to low-resource regions, with a needle-free vaccine delivery device and long-term thermostabilization. J Control Release, 2011, 152(3): 349-355. DOI:10.1016/j.jconrel.2011.02.026 |
| [31] | Liu TQ, Jiang GH, Song G, et al. Fabrication of separable microneedles with phase change coating for NIR-triggered transdermal delivery of metformin on diabetic rats. Biomed Microdevices, 2020, 22: 12. DOI:10.1007/s10544-019-0468-8 |
| [32] | Liu DP, Zhang Y, Jiang GH, et al. Fabrication of dissolving microneedles with thermal-responsive coating for NIR-triggered transdermal delivery of metformin on diabetic rats. ACS Biomater Sci Eng, 2018, 4(5): 1687-1695. |
| [33] | Miyano T, Tobinaga Y, Kanno T, et al. Sugar micro needles as transdermic drug delivery system. Biomed Microdevices, 2005, 7(3): 185-188. DOI:10.1007/s10544-005-3024-7 |
| [34] | Littauer EQ, Mills LK, Brock N, et al. Stable incorporation of GM-CSF into dissolvable microneedle patch improves skin vaccination against influenza. J Control Release, 2018, 276: 1-16. DOI:10.1016/j.jconrel.2018.02.033 |
| [35] | Yu WJ, Jiang GH, Liu DP, et al. Fabrication of biodegradable composite microneedles based on calcium sulfate and gelatin for transdermal delivery of insulin. Mater Sci Eng C, 2017, 71: 725-734. DOI:10.1016/j.msec.2016.10.063 |
| [36] | Xu B, Jiang GH, Yu WJ, et al. H2O2-responsive mesoporous silica nanoparticles integrated with microneedle patches for the glucose-monitored transdermal delivery of insulin. J Mater Chem B, 2017, 5(41): 8200-8208. DOI:10.1039/C7TB02082A |
| [37] | Tong ZZ, Zhou JY, Zhong JX, et al. Glucose- and H2O2-responsive polymeric vesicles integrated with microneedle patches for glucose-sensitive transcutaneous delivery of insulin in diabetic rats. ACS Appl. Mater. Mater. Interfaces, 2018, 10(23): 20014-20024. DOI:10.1021/acsami.8b04484 |
| [38] | An SM, Seong KY, Yim SG, et al. Intracutaneous delivery of gelatins induces lipolysis and suppresses lipogenesis of adipocytes. Acta Biomater, 2018, 67: 238-247. DOI:10.1016/j.actbio.2017.11.050 |
| [39] | Zhang Y, Jiang GH, Hong WJ, et al. Polymeric microneedles integrated with metformin-loaded and PDA/LA-coated hollow mesoporous SiO2 for NIR-triggered transdermal delivery on diabetic rats. ACS Appl Bio Mater, 2018, 1(6): 1906-1917. DOI:10.1021/acsabm.8b00470 |
| [40] | Jiang GH, Xu B, Zhu JY, et al. Polymer microneedles integrated with glucose-responsive mesoporous bioactive glass nanoparticles for transdermal delivery of insulin. Biomed Phys Eng Express, 2019, 5(4): 045038. DOI:10.1088/2057-1976/ab3202 |
| [41] | Asghar W, Li FL, Zhou YL, et al. Piezocapacitive flexible E-skin pressure sensors having magnetically grown microstructures. Adv Mater Technol, 2020, 5(2): 1900934. DOI:10.1002/admt.201900934 |
| [42] | Li YY, Hu X, Dong ZY, et al. Dissolving microneedle arrays with optimized needle geometry for transcutaneous immunization. Eur J Pharm Sci, 2020, 151: 105361. DOI:10.1016/j.ejps.2020.105361 |
| [43] | Zhang Y, Jiang GH, Yu WJ, et al. Microneedles fabricated from alginate and maltose for transdermal delivery of insulin on diabetic rats. Mater Sci Eng C, 2018, 85: 18-26. DOI:10.1016/j.msec.2017.12.006 |
| [44] | Yu WJ, Jiang GH, Zhang Y, et al. Near-infrared light triggered and separable microneedles for transdermal delivery of metformin in diabetic rats. J Mater Chem B, 2017, 5(48): 9507-9513. DOI:10.1039/C7TB02236K |
| [45] | Li W, Terry RN, Tang J, et al. Rapidly separable microneedle patch for the sustained release of a contraceptive. Nat Biomed Eng, 2019, 3(3): 220-229. DOI:10.1038/s41551-018-0337-4 |
| [46] | Li W, Tang J, Terry RN, et al. Long-acting reversible contraception by effervescent microneedle patch. Sci Adv, 2019, 5(11): eaaw8145. DOI:10.1126/sciadv.aaw8145 |
| [47] | Tsuchiya K, Nakanishi N, Uetsuji Y, et al. Development of blood extraction System for health monitoring system. Biomed Microdevices, 2005, 7(4): 347-353. DOI:10.1007/s10544-005-6077-8 |
| [48] | Li CG, Dangol M, Lee CY, et al. A self-powered one-touch blood extraction system: a novel polymer-capped hollow microneedle integrated with a pre-vacuum actuator. Lab Chip, 2015, 15(2): 382-390. DOI:10.1039/C4LC00937A |
| [49] | Liu L, Wang Y, Yao JY, et al. A minimally invasive micro sampler for quantitative sampling with an ultrahigh-aspect-ratio microneedle and a PDMS actuator. Biomed Microdevices, 2016, 18(4): 59. DOI:10.1007/s10544-016-0086-7 |
| [50] | Li CG, Joung HA, Noh H, et al. One-touch-activated blood multidiagnostic system using a minimally invasive hollow microneedle integrated with a paper-based sensor. Lab Chip, 2015, 15(16): 3286-3292. DOI:10.1039/C5LC00669D |
| [51] | Blicharz TM, Gong P, Bunner BM, et al. Microneedle-based device for the one-step painless collection of capillary blood samples. Nat Biomed Eng, 2018, 2(3): 151-157. DOI:10.1038/s41551-018-0194-1 |
| [52] | Strambini LM, Longo A, Scarano S, et al. Self-powered microneedle-based biosensors for pain-free high-accuracy measurement of glycaemia in interstitial fluid. Biosens Bioelectron, 2015, 66: 162-168. DOI:10.1016/j.bios.2014.11.010 |
| [53] | Takeuchi K, Takama N, Kim B, et al. Microfluidic chip to interface porous microneedles for ISF collection. Biomed Microdevices, 2019, 21: 28. DOI:10.1007/s10544-019-0370-4 |
| [54] | Chang H, Zheng MJ, Yu XJ, et al. A swellable microneedle patch to rapidly extract skin interstitial fluid for timely metabolic analysis. Adv Mater, 2017, 29(37): 1702243. DOI:10.1002/adma.201702243 |
| [55] | He RY, Niu Y, Li ZD, et al. A hydrogel microneedle patch for point-of-care testing based on skin interstitial fluid. Adv Healthc Mater, 2020, 9(4): 1901201. DOI:10.1002/adhm.201901201 |
| [56] | Barrett C, Dawson K, O'Mahony C, et al. Development of low cost rapid fabrication of sharp polymer microneedles for in vivo glucose biosensing applications. ECS J Solid State Sci Technol, 2015, 4(10): S3053-S3058. DOI:10.1149/2.0141510jss |
| [57] | Zhao L, Wen ZZ, Jiang FJ, et al. Silk/polyols/GOD microneedle based electrochemical biosensor for continuous glucose monitoring. RSC Adv, 2020, 10(11): 6163-6171. DOI:10.1039/C9RA10374K |
| [58] | Bollella P, Sharma S, Cass AEG, et al. Minimally-invasive microneedle-based biosensor array for simultaneous lactate and glucose monitoring in artificial interstitial fluid. Electroanalysis, 2019, 31(2): 374-382. DOI:10.1002/elan.201800630 |
| [59] | Bollella P, Sharma S, Cass AEG, et al. Minimally invasive glucose monitoring using a highly porous gold microneedles-based biosensor: characterization and application in artificial interstitial fluid. Catalysts, 2019, 9(7): 580-594. DOI:10.3390/catal9070580 |
| [60] | Sharma S, Huang ZY, Rogers ML, et al. Evaluation of a minimally invasive glucose biosensor for continuous tissue monitoring. Anal Bioanal Chem, 2016, 408(29): 8427-8435. DOI:10.1007/s00216-016-9961-6 |
| [61] | Yoon Y, Lee GS, Yoo K, et al. Fabrication of a microneedle/CNT hierarchical micro/nano surface electrochemical sensor and its in-vitro glucose sensing characterization. Sensors, 2013, 13(12): 16672-16681. DOI:10.3390/s131216672 |
| [62] | Ju J, Hsieh CM, Tian Y, et al. Surface enhanced raman spectroscopy based biosensor with a microneedle array for minimally invasive in vivo glucose measurements. ACS Sens, 2020, 5(6): 1777-1785. DOI:10.1021/acssensors.0c00444 |
| [63] | Ciui B, Martin A, Mishra RK, et al. Wearable wireless tyrosinase bandage and microneedle sensors: toward melanoma screening. Adv Healthc Mater, 2018, 7(7): 1701264. DOI:10.1002/adhm.201701264 |
| [64] | Parrilla M, Cuartero M, Sánchez SP, et al. Wearable all-solid-state potentiometric microneedle patch for intradermal potassium detection. Anal Chem, 2019, 91(2): 1578-1586. DOI:10.1021/acs.analchem.8b04877 |
| [65] | Miller PR, Xiao XY, Brener I, et al. Microneedle-based transdermal sensor for on-chip potentiometric determination of K+. Adv Healthc Mater, 2014, 3(6): 876-881. DOI:10.1002/adhm.201300541 |
| [66] | Mishra RK, Mohan AMV, Soto F, et al. A microneedle biosensor for minimally-invasive transdermal detection of nerve agents. Analyst, 2017, 142(6): 918-924. DOI:10.1039/C6AN02625G |
| [67] | Mishra RK, Goud KY, Li ZH, et al. Continuous opioid monitoring along with nerve agents on a wearable microneedle sensor array. J Am Chem Soc, 2020, 142(13): 5991-5995. DOI:10.1021/jacs.0c01883 |
| [68] | Mani GK, Miyakoda K, Saito A, et al. Microneedle pH sensor: direct, label-free, real-time detection of cerebrospinal fluid and bladder pH. ACS Appl Mater Interfaces, 2017, 9(26): 21651-21659. DOI:10.1021/acsami.7b04225 |
| [69] | Zuliani C, Ng FS, Alenda A, et al. An array of individually addressable micro-needles for mapping pH distributions. Analyst, 2016, 141(15): 4659-4666. DOI:10.1039/C6AN00639F |
| [70] | Jin QC, Chen HJ, Li XL, et al. Reduced graphene oxide nanohybrid-assembled microneedles as mini-invasive electrodes for real-time transdermal biosensing. Small, 2019, 15(6): 1804298. DOI:10.1002/smll.201804298 |
| [71] | Girardin CM, Huot C, Gonthier M, et al. Continuous glucose monitoring: a review of biochemical perspectives and clinical use in type 1 diabetes. Clin Biochem, 2009, 42(3): 136-142. DOI:10.1016/j.clinbiochem.2008.09.112 |
| [72] | Liu GS, Kong YF, Wang YS, et al. Microneedles for transdermal diagnostics: recent advances and new horizons. Biomaterials, 2020, 232: 119740. DOI:10.1016/j.biomaterials.2019.119740 |
