

1. 生物反应器工程国家重点实验室,上海 200237;
2. 华东理工大学 生物工程学院,上海 200237;
3. 国家生化工程技术研究中心 (上海),上海 200237
收稿日期:2020-10-05;接收日期:2020-12-29
基金项目:国家自然科学基金(Nos.31900073, 21978085), 上海市自然科学基金(No.19ZR1413600)资助
作者简介:庄英萍 ??博士,华东理工大学研究员、博导、生物工程学院院长,国家生化工程技术研究中心(上海) 主任,“国家高技术研究发展计划(863)”生物和医药领域工业生物技术主题专家,中国微生物学会第10届理事会常务理事,生化过程模型化与控制专业委员会主任委员,中国化工学会生物化工专业委员会副主任委员。长期从事发酵过程的优化与放大研究,与团队共同建立了完整的理论、方法与装备,并在数十个品种的工业发酵产品中成功应用。近年来获“国家科技进步二等奖” 3项,发表SCI论文100余篇,获授权发明专利近30项.
摘要:当前,生物制造技术和产业是世界关注的热点。然而,生物过程优化与放大过程中普遍面临以下几个难题,包括:过程检测手段缺乏,难以满足关键指标参数的监控;细胞代谢认知匮乏,无法理性实现过程最优化调控;反应器环境差异大,导致逐级放大效率低下。文中针对以上亟待解决的关键问题,通过案例分析介绍发酵过程实时检测-动态调控-理性放大全链条关键技术创新。在未来,生物过程设计将以集成细胞生理学(时空多尺度细胞代谢模型) 和流体动力学(CFD模型) 的全生命周期模型为指导,推进计算机辅助设计与开发,加速生物过程实现大规模智能化生产,开启绿色生物制造新时代。
关键词:新型传感器动态调控智能生物制造理性放大代谢模型
New opportunities and challenges for hybrid data and model driven bioprocess optimization and scale-up
Guan Wang1,2,3, Xiwei Tian1,2,3, Jianye Xia1,2,3, Ju Chu1,2,3, Siliang Zhang1,2,3, Yingping Zhuang1,2,3


1. State Key Laboratory of Bioreactor Engineering, Shanghai 200237, China;
2. School of Bioengineering, East China University of Science and Technology, Shanghai 200237, China;
3. National Center of Bio-Engineering & Technology (Shanghai), Shanghai 200237, China
Received: October 5, 2020; Accepted: December 29, 2020
Supported by: National Natural Science Foundation of China (Nos.31900073, 21978085), Natural Science Foundation of Shanghai, China (No.19ZR1413600)
Corresponding author: Yingping Zhuang. Tel: +86-21-64251257; Fax: +86-21-64253702; E-mail: ypzhuang@ecust.edu.cn.
Abstract: Currently, biomanufacturing technology and industry are receiving worldwide attention. However, there are still great challenges on bioprocess optimization and scale-up, including: lacing the process detection methods, which makes it difficult to meet the requirement of monitoring of key indicators and parameters; poor understanding of cell metabolism, which arouses problems to rationally achieve process optimization and regulation; the reactor environment is very different across the scales, resulting in low efficiency of stepwise scale-up. Considering the above key issues that need to be resolved, here we summarize the key technological innovations of the whole chain of fermentation process, i.e., real-time detection-dynamic regulation-rational scale-up, through case analysis. In the future, bioprocess design will be guided by a full lifecycle in-silico model integrating cellular physiology (spatiotemporal multiscale metabolic models) and fluid dynamics (CFD models). This will promote computer-aided design and development, accelerate the realization of large-scale intelligent production and serve to open a new era of green biomanufacturing.
Keywords: novel sensordynamic regulationintelligent biomanufacturingrational scale-upmetabolic model
发酵工业是关系国计民生的重要产业之一,其产品应用涉及在食品、生物化工、医药、能源轻工等诸多行业。近年来,中国生物发酵产业稳步增长,主要生物发酵产品产量从2016年的2 642万t增长到2017年的2 846万t,年总产值接近2 390亿元,生物发酵产品产量居世界第一。2018年上半年生物发酵产业延续2017年的发展态势,主要行业产品约1 420.8万t,较2017年同期增长约1.3%。到2020年,生物发酵行业预计将实现总产量3 800万t,年平均增长率8%左右,总产值达4 500亿元以上[1]。同时,生物发酵产业的技术水平逐年提高,如在味精、柠檬酸等产品产量上不仅达到世界第一,而且发酵质量方面也达到世界领先水平[2];然而,我国生物发酵产品仍以中低端的产品为主,附加值较低,品质远远不及其他同类国际产品。同时,在工业生物过程研究方面与国外有较大差距,工业效率相对低下、污染和能耗大。能耗成本约占总生产成本的20%左右,节能减排任务较重[3]。究其原因,主要由于核心技术、关键工艺优化控制上存在技术瓶颈以及精密仪器设备、配套生产装置依赖进口等限制[4]。在这种状况下,必须加快自主研发,提升自主创新能力。
生物制造产业是支撑国民经济可持续发展的重要支柱,生物过程工程则是生物制造的关键核心内容,直接影响我国创新、协调、绿色发展战略的实施,发展具有国际竞争力的生物发酵工业是我国的当务之急[5]。目前我国在高性能菌种构建与筛选方面已处于世界领先水平,但在高性能菌种产业化应用中所需的过程关键技术经济指标与国际先进水平相比仍存在差距,尤其针对市场多变、产品特性差异大以及发酵过程运行特性时变等诸多难点,如何从发酵过程中微生物细胞代谢复杂机理出发,形成高效的发酵过程优化调控、理性的发酵过程放大,提高发酵产品生产效率降低能耗是目前生物发酵行业发展的重点与关键,也是国家对绿色、可持续性好的发酵产业重点领域实现“转型升级、提升核心竞争力”的内涵所在[6]。
本文中,笔者从制约生物制造水平提升的关键因素入手,结合典型研究案例,就发酵过程实时检测-动态调控-理性放大全链条关键技术创新体系进行介绍,同时就现状和未来发展前景进行探讨,希望更多的人关注并投身该领域,共同开启绿色制造新时代。
1 新型传感分析下过程代谢参数全方位实时在线检测体系发酵过程的主体——微生物细胞具有复杂的代谢调控机制,代谢产物的累积量与菌体量和代谢底物间不是简单的线性关系,很难通过简单的增加菌体量或底物量达到高产的目标,需要通过调节发酵过程中细胞的代谢状态,使其达到最优代谢途径从而将底物更多、更快地转化为产物[7]。当前,在大规模工业生产中,宏观发酵环境参数如pH、温度、溶解氧浓度等的监测方法已成熟,但仍然缺乏对发酵过程中关键代谢性能指标参数表征、过程实时在线参数分析、细胞代谢调控过程机理及其相互关联关系的深入研究,不能有效刻画发酵过程在线检测参数与细胞代谢性能的相关联系、代谢调控机制对细胞外部流场环境的响应的关联等,无法保证发酵过程高效运行是长期以来发酵工业生产界面临的挑战和难题[8]。因此,针对发酵过程实时代谢信息缺失,亟需整合硬件先进传感器和软测量技术,创建代谢全方位在线检测大数据体系(图 1),为开发大数据驱动的过程优化策略提供坚实基础。
 |
| 图 1 代谢全方位在线检测大数据体系 Fig. 1 Big data system based on multi-faceted online detection of cellular metabolism. |
| 图选项 |
1.1 底物、产物、产率(RP) 和转化率(YP)实时在线监测系统发酵过程的精准调控很大程度上依赖于生物反应器内细胞生理代谢状态的实时、准确监控。开发适用于生物发酵过程的先进在线传感技术,实现生物制造过程营养物、胞内、胞外表征代谢特性参数(如关键节点代谢物测定) 的实时准确检测一直是在线检测技术开发与应用的重要方向[9]。传统的在线传感器如温度、pH、溶氧(Dissolved oxygen,DO) 等参数已经满足不了现代发酵过程中生理代谢参数检测的需求,因此亟待开发新型快速、无污染、无破坏、无需样品预处理的绿色分析技术。如在黑曲霉产葡萄糖酸钠的发酵过程,研究人员已经开发了在线中红外实时检测技术,实现了发酵液中的底物(葡萄糖) 和产物(葡萄糖酸钠) 浓度的实时在线监控,进而利用该技术研究了不同初始葡萄糖浓度与不同糖耗速率以及产物合成速率之间的关系,发现300 g/L的初始糖浓度下葡萄糖酸钠的合成速率最大[10]。为了进一步研究黑曲霉生产葡萄糖酸钠在整个发酵阶段中产率和转化率的变化,研究人员进一步利用在线尾气质谱仪测定发酵过程尾气中氧气和二氧化碳组分,计算得到过程实时氧消耗速率(Oxygen uptake rate,OUR)、二氧化碳释放速率(Carbon evolution rate,CER) 和呼吸商(Respiratory quotient,RQ)。在工艺开发过程中采用磷元素的限制,菌体在后期稳定阶段生长几乎停滞,即菌体呼吸消耗葡萄糖以二氧化碳形式释放产生能量主要用于细胞维持代谢。与此同时,发酵过程中氧气消耗主要用于菌体呼吸代谢以及葡萄糖氧化酶生物催化。进一步,利用计量学关系(1摩尔葡萄糖酸钠合成需要消耗0.5摩尔氧气),可以通过在线参数计算得到实时葡萄糖酸钠的产率RP=0.436×(OUR?CER);然而,1摩尔葡萄糖消耗需要6摩尔氧气用于细胞呼吸,1摩尔葡萄糖转化成葡萄糖酸钠需要消耗0.5摩尔氧气,因此可以利用氧气的消耗速率来间接实时计算葡萄糖酸钠基于葡萄糖的得率

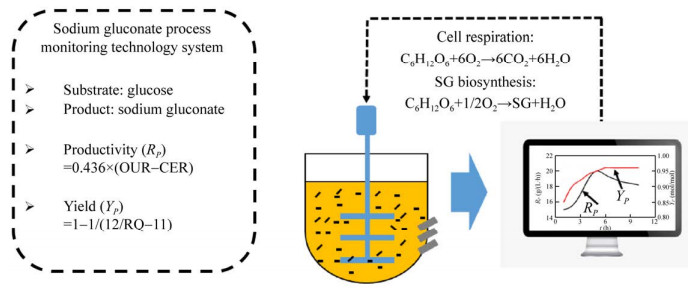 |
| 图 2 葡萄糖酸钠发酵过程关键指标在线检测系统[11] Fig. 2 Online detection system for key indicators of sodium gluconate fermentation process[11]. |
| 图选项 |
1.2 组合代谢参数实时在线监测系统红霉素是由红色糖多孢菌产生的一种大环内酯类抗生素,以红霉素为原料合成的各类衍生物具有重要的临床医用价值。在红霉素发酵过程中,正丙醇是重要的产物合成前体,其浓度过高会影响细胞活性,过低会限制红霉素生物合成,因此正丙醇残留量的实时精确测定以及实现在线反馈控制对发酵生产非常关键。电子嗅检测技术是一种新型挥发性物质检测技术,它通过模拟动物嗅觉的原理进行挥发性物质的检测。目前,电子嗅可以检测浓度在0.01 mg/L以上的挥发性气体,当尾气中挥发性组分超过电子嗅中敏感膜的检测阈值时,可以采用精准气体体积稀释法和大容量杯顶空抽气法进行间接测定。红霉素合成前体正丙醇是属于易挥发性的有机溶剂,因此可以借助电子嗅建立发酵尾气与发酵液中正丙醇浓度的线性关系。研究人员通过电子嗅监测体系,探究了发酵液中正丙醇浓度与红霉素产量的关联,实现了正丙醇补料的优化与控制,结果表明在50 L发酵罐内正丙醇浓度维持在1 000 mg/L,红霉素产量可以达到8 500单位[12]。
活菌细胞量是生物过程优化中关键的参数,如何进行生物过程活菌细胞量的定量分析,一直是影响生物过程工艺精确优化与控制的制约因素[13]。传统的浊度法、离心体积、菌体干重等无法区分活细胞和死细胞,进而计算得出的菌体量不能成为与其他生物过程的相关参数进行分析的可靠数据。在线活细胞传感仪的主要原理是利用活细胞在交变电场(100 kHz–20 MHz) 中产生极化现象,成为一个个极小的电容器,因此通过建立电容值和活细胞量的关联就可以实现发酵过程中活细胞的在线监测。研究人员已经将活细胞传感仪应用于红霉素发酵过程中,辅助优化葡萄糖和正丙醇补加策略的调节[14] (图 3)。研究结果表明,残留正丙醇浓度超过1.52 g/L会对菌体生长产生抑制,当补入的糖醇比例为4.3,补醇速率在0.125 g/(L?h)时对菌体生长、红霉素合成(10 500 U/mL) 以及A组分比例(Ery-A占85%) 的提高有利。在此基础上,进一步通过在线OUR的变化进行分段补醇调节,红霉素效价可进一步提升4%[14]。然而,活细胞传感器的应用需要关注整个发酵过程中菌体的形态变化,如生长和生产阶段菌体形态发生显著变化,需要针对不同阶段进行分段建模,从而提升过程菌浓在线监测的准确性。同时,交变电场及影响电场的金属器具、金属无机盐离子浓度,以及常规导电粒子浓度也会在一定程度上影响活细胞传感仪的精确性。
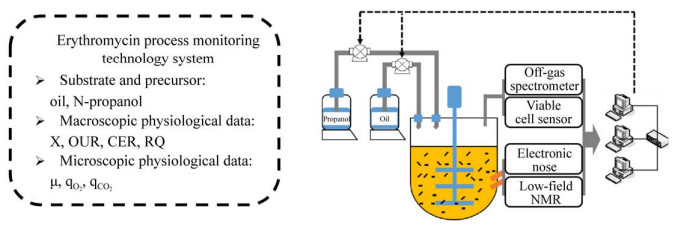 |
| 图 3 红霉素发酵过程组合代谢参数实时在线监测体系[12] Fig. 3 Real-time online monitoring system of combined metabolic parameters in erythromycin fermentation process[12]. |
| 图选项 |
2 细胞代谢模型指导发酵过程动态调控新技术发酵过程精细调控的难点在于发酵过程的可预测模型严重缺失。近年来随着组学技术的快速发展,发酵过程的多组学技术形成了大量的细胞微观代谢数据。然而,发酵过程中以在线传感技术为基础获取的表征细胞代谢特性的在线参数数据与多组学微观代谢数据的关联分析缺乏技术突破,严重制约着发酵过程优化技术的突破[15-16]。因此,在过程在线传感平台的基础上,亟待结合比较基因组学、代谢物组学、13C代谢通量分析等组学技术,以生物过程大数据为导向,构建不同规模细胞代谢模型,包括小规模细胞动力学模型、中等规模细胞中心代谢网络模型、大规模基因组代谢网络模型,系统解析工业生产过程中细胞代谢作用机制,并理性、高效地应用于发酵过程的系统优化以及潜在生产靶点的挖掘和改造(图 4),实现生物学模型指导下环境扰动与工程学的最优适配[17]。
 |
| 图 4 细胞代谢模型指导发酵过程动态调控新技术 Fig. 4 Dynamic regulation of fermentation process guided by cellular metabolic model. |
| 图选项 |
2.1 细胞代谢模型指导工业规模全局调控发酵技术在葡萄糖酸钠发酵过程中,氧气作为一种特殊底物,不仅用于菌体呼吸代谢,而且是葡萄糖氧化酶氧化葡萄糖生成葡萄糖酸钠的直接底物。因此,供氧水平对黑曲霉生产葡萄糖酸钠发酵过程具有重要影响。在葡萄糖酸钠分批发酵过程,研究人员发现在底物葡萄糖充足的条件下,供氧水平越高,OUR越高,底物消耗速率越高,发酵周期越短,同时整个发酵过程得率越高。然而,在菌丝生长停止阶段,葡萄糖酸钠转入稳定合成时,过高的供氧反而使产物得率下降。因此,研究人员提出了两阶段OUR控制策略进行分批发酵,最终发酵得率达到了94%,超过了常规分批发酵的最高产率88%[18]。
黑曲霉属于丝状真菌,工业规模发酵过程高菌浓时发酵液粘度很高,不利于气液传质,因此如何控制其发酵过程菌丝形态对于发酵罐内物质运输以及产物合成至关重要[19-20]。研究人员通过在15 L种子培养罐中调控不同的剪切环境获得从菌球至分散菌丝的种子液,结果发现在分批发酵模式下,分散状菌丝相比较于大菌球发酵时葡萄糖酸钠的生产速率提高了74%,发酵周期缩短了15 h[21]。工业规模的葡萄糖酸钠发酵模式通常采用分批发酵或半连续培养,然而在该模式下,放罐前菌体活力很高,同时总的葡萄糖氧化酶活力在发酵结束时仍然升高,因此循环利用这些菌体和酶具有潜在的工业应用价值。研究人员首先采用半连续带放工艺(连续流加底物,分批式部分放出产物) 考察了连续发酵模式的可行性,进一步通过建立以陶瓷膜截留菌体进行葡萄糖酸钠的连续发酵工艺(图 5)[22]。在此基础上,以发酵过程在线参数OUR和溶氧的相互变化情况判断发酵过程的限制性因素,从细胞全局氧代谢调控角度对细胞耗氧能力和设备供氧能力进行调节,通过基于营养组分优化的菌体生长调控策略、基于种子质量优化的菌型控制策略、基于发酵罐搅拌桨型优化和发酵液流变特性优化的供氧调控策略,利用模型实现调控,并通过在线产率分析验证优化策略,最终在工业规模(120 m3) 反应器形成从分批发酵到半连续发酵再到连续发酵的生产新工艺(图 5),使得发酵产能提高至传统工艺4倍以上,葡萄糖酸钠转化率(0.984 mol/mol) 接近理论转化率(1.0 mol/mol)。
 |
| 图 5 模型指导下的工业规模全局氧调控的葡萄糖酸钠连续发酵新技术[22] Fig. 5 A new technology of continuous fermentation of sodium gluconate with global oxygen regulation on an industrial scale under the guidance of model[22]. |
| 图选项 |
2.2 不同规模细胞代谢模型指导,创建工业规模细胞代谢活性组合调控技术虽然研究人员在菌株基因改造和发酵过程培养工艺优化等方面开展了大量研究,但由于对胞内代谢机制的了解不清楚,常常造成基因改造与发酵工艺优化相互脱节,进而成为进一步提高相关产品发酵水平的限制性因素[23]。例如,针对工业红霉素发酵过程中复杂碳源(底物葡萄糖和豆油、前体正丙醇) 利用规律不清晰、细胞代谢调控氮磷营养组分不明确的关键问题,研究人员在实时检测底物豆油、在线检测活细胞量和前体正丙醇的基础上,系统构建了比较基因组学平台、代谢物组检测平台、非稳态13C代谢通量分析平台[24]等,在基因组规模代谢网络模型、中心代谢网络模型和细胞动力学模型指导下(图 6),系统解析了工业生产菌高效生产红霉素的作用机制[25-29]以及前体正丙醇的代谢去向[30],发现正丙醇利用途径中改造靶点(sucC),红霉素生产速率与胞内丙酰辅酶A代谢物池呈正相关的作用规律[31]。进一步通过控制比生长速率以及比菌体底物吸收速率来提高生产效率,改造菌种小试发酵水平实现红霉素水平提高45%以上,工业规模(370 m3) 红霉素产量较初始水平提高30%以上,实现显著的经济效益。
 |
| 图 6 模型指导下的红霉素发酵过程细胞代谢活性组合调控技术 Fig. 6 Model-guided combined regulation technology of cell metabolic activity during erythromycin fermentation. |
| 图选项 |
3 模型化视角下工业生物过程理性放大新方法实验室获得的高产菌种实现产业化必须经历发酵过程放大,而传统的发酵过程放大方法采用逐级放大的方式,导致放大效率低下、放大周期长,严重制约着高产菌种的产业化应用。除此之外,发酵过程放大的不可预测性也是导致放大效率低下的主要原因[32]。因此,亟待解决此难题,笔者所在的研究团队在早期放大理论基础上,探索工业规模反应器内非均匀流场条件下细胞的生理学响应,基于此提出工业规模反应器限制性条件“情景再现”的缩小放大(Scale-down/scale-up) 新方法,通过在实验室规模反应器内再现工业规模非均匀的流场环境,进而优化过程工艺实现大规模应用[33]。从而提出了模型化视角下工业生物过程理性放大新方法(图 7)。
 |
| 图 7 模型化视角下工业生物过程理性放大新方法 Fig. 7 A new method of rational scale-up of industrial bioprocess from the perspective of modeling. |
| 图选项 |
3.1 整合死亡动力学-流体动力学模型实现植物细胞大规模培养预测与评估工业规模反应器内进行的发酵过程,除了受到菌种生产能力限制外,还受到反应器内各种工程参数的影响,具体来说包括反应器内物质混合效率、气液相间传质、剪切力大小的制约[34-35]。红花是预防和治疗心脏病的常用草药。随着市场需求的增加,悬浮培养逐渐成为高效、稳定生产该药用植物红花细胞最有潜力的方法。然而,在大规模搅拌式生物反应器中,细胞培养过程常常伴随着活性低、延滞期长、生长缓慢等问题。其中,流场剪切是导致植物细胞悬浮培养工业放大困难的主要原因之一,因此对流场剪切环境与细胞生长死亡动力学相互作用的认识至关重要。研究人员首先建立了流场剪切下红花细胞比死亡速率动力学模型,并发现红花细胞耐受剪切力的阈值为平均剪切力0.55 Pa和最大剪切力4.00 Pa,超过这个阈值,细胞生长将受到影响。其次,根据能量耗散/循环时间(EDCF) 的概念,基于Euler-Lagrange法,量化了细胞经历轨迹上受到的局部剪切力大小与受到剪切的频率[36]。此外还将该方法拓展到植物细胞培养过程放大,将反应器流体力学模型与细胞剪切死亡动力学模型整合,成功实现了红花细胞在100 L规模反应器内放大的预测,突破了植物细胞放大效率低的困境,相应放大工艺在企业得到成功放大(图 8)。然而,该模型只涉及了红花细胞生物量的变化,尚未考虑植物细胞次级代谢产物合成途径的动力学特性。后续可以进行模型拓展,进一步实现植物细胞放大过程次级代谢产物合成能力的预测,为工业生物反应器设计以及过程评估提供支撑。
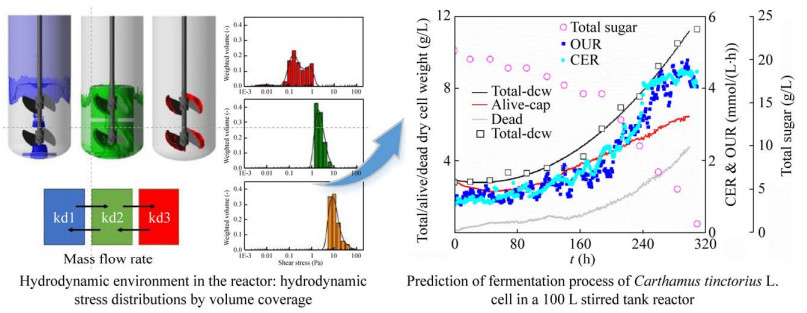 |
| 图 8 基于植物细胞剪切致死动力学的流场整合放大技术[36] Fig. 8 Flow field integrated scale-up technology based on plant cell death dynamics[36]. |
| 图选项 |
3.2 整合代谢-流体动力学模型实现工业青霉素发酵过程全生命周期预测与评估在将一株改良菌种或一个工艺优化策略从实验室规模放大到工业规模时,细胞工厂和胞外环境之间的复杂关系常常会被忽视,最终导致放大结果不理想甚至失败[37]。在大规模反应器内,由于功率输入和生物反应器结构限制,细胞会有很长的运动轨迹,加之高的细胞代谢活性,大规模培养条件常常是一个不均一的体系,表现在大规模反应器内存在溶氧、底物、pH以及剪切梯度问题。研究表明在绝大多数情况下,在大规模反应器内细胞周期性地经历这些波动环境会导致产物的得率、效价和产率降低[38-40];也有报道发现,波动环境有利于丝状真菌形成良好的菌丝形态,有利于营养物质混合和传质,进而有利于产物的合成[41-43]。这种放大过程存在的不确定性直接影响了理性放大策略的制定。
在大规模青霉素发酵过程中,由于混合与传质的限制,生物反应器内会形成环境梯度如底物浓度梯度、剪切梯度、溶氧梯度等,产黄青霉菌会随着流体周期性地经历这些梯度环境,常常会造成菌体得率降低、产率降低以及副产物的形成增加[39-40, 44]。为了更好地对大规模青霉素发酵过程产黄青霉胞内代谢响应以及青霉素生产性能进行全生命周期预测与评估。研究人员首先建立了高产产黄青霉DS17690的9-池代谢结构化动力学模型。该模型主要由5个代谢物池、4个胞内酶量池以及将其连接的10个动力学反应构成。该模型可以对细胞应对秒级至数天的环境波动进行描述[45]。同时,进一步整合细胞代谢模型与反应器流体动力学模型,基于Euler-Lagrange法,追踪并统计产黄青霉细胞在大规模流场中的运动轨迹,该整合模型成功用于工业规模青霉素发酵罐中细胞代谢和生产性能的预测与评估(图 9)[46]。然而,前期9-池模型参数估计和模型结构是基于葡萄糖为唯一碳源限制性稳态恒化培养以及稀释率线性降低下胞内代谢物浓度数据。在大规模发酵罐内,菌体会经历不同的运动轨迹,如细胞会周期性地经历高糖低氧、低糖高氧区域,生长速率随之增加或者降低。因此模型优化与升级还需要进一步获取:a) 周期性底物浓度波动;b) 周期性溶氧浓度波动;c) 稀释率(或者比生长速率) 线性升高等波动环境下的代谢信息。同时,拓展的模型需要在真实模拟大规模反应器流场信息的缩放(Scale-down) 反应器内进行验证。
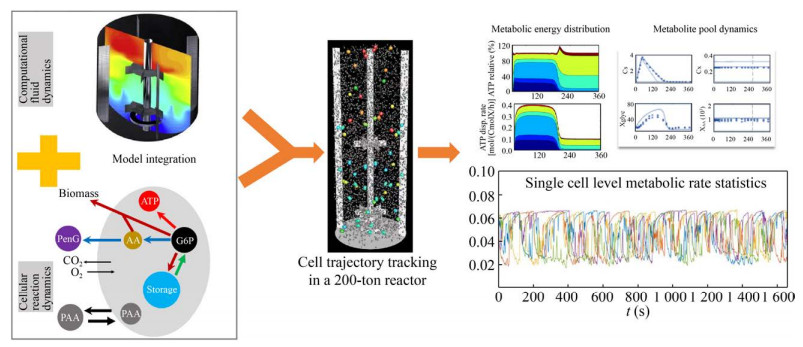 |
| 图 9 代谢-流场模型整合下的工业青霉素发酵过程全生命周期预测与评估[46] Fig. 9 Prediction and evaluation of the whole lifecycle of industrial penicillin fermentation process under the integration of metabolism and flow field model[46]. |
| 图选项 |
4 展望工业生物过程的高效理性放大一直是一个科学难题,而大规模反应器内波动的环境正是导致放大困难的根源。当在小试规模优化的菌株或者工艺转移到大规模反应器内进行实际工业生产时,如果对细胞和所处流场环境之间的复杂关系理解不够深入,可能会导致放大效果不好甚至失败。生物制造技术和产业是世界各国的竞争焦点,近年来,我国高性能发酵菌株自主构建能力不断提升,因此发酵过程精准优化与高效放大技术成为制约我国发酵产业快速发展的主要难题及技术瓶颈。生物制造技术是社会可持续发展的重要保证,生物制造技术的提升是粗放型传统制造业向高端、智能、绿色方向发展,是实现生物制造“大国”向“强国”转变的必经之路。
当前工业发酵过程面临研究系统的复杂程度与已掌握知识的局限性的矛盾,出现“数据超载”情况,因此,如何利用发酵过程中产生的海量数据是过程研究中的重大关键问题;同时,产品生产过程表现为工艺环节多、单机人流、物料介入频繁,因此,如何实现高品质系统服务与生产工艺决策解决低碳节能降耗与高污染问题是当前绿色生物制造领域迫切需要解决的重要课题。为此,需要改变生物过程研究数据处理的思维方法与理念,抛开“小数据时代”统计学方法的局限性,采用全部数据概念,开展以数据驱动的大数据相关分析研究,形成新的数据处理理念与研究程序;从生物学与工程学最适匹配的角度,利用智能软仪表分析发酵过程大数据,智能诊断实时过程限制瓶颈,精确实现过程智能控制与优化,建成基于生物过程大数据的微观和宏观代谢相结合以及细胞生理特性和反应器流场特性相结合的智能绿色生物制造优化和放大技术体系。
参考文献
| [1] | 石维忱, 李惠钰. 中国生物发酵产业的"十三五": 更个性更绿色更高端[EB/OL]. 中国科学报, (2015-12-29). http://news.sciencenet.cn/htmlnews/2015/12/335021.shtm. |
| [2] | 卢涛, 关丹, 胡修玉, 等. 我国生物发酵产业发展现状及发展趋势. 工业微生物, 2015, 45(3): 62-66. Lu T, Guan D, Hu XY, et al. Development status and trends of bio-fermentation industry in China. Ind Microbiol, 2015, 45(3): 62-66 (in Chinese). DOI:10.3969/j.issn.1001-6678.2015.03.011 |
| [3] | 石维忱, 关丹, 卢涛. 中国生物发酵产业现状与发展建议. 精细与专用化学品, 2014, 22(9): 7-11. Shi WC, Guan D, Lu T. Present situation and the development suggestions on China's biological fermentation industry. Fine Spec Chem, 2014, 22(9): 7-11 (in Chinese). DOI:10.3969/j.issn.1008-1100.2014.09.002 |
| [4] | 卢涛, 石维忱. 我国生物发酵产业现状分析与发展策略. 生物产业技术, 2019(2): 5-8. Lu T, Shi WC. Current situation analysis and development strategy of biological fermentation industry in China. Biotechnol Bus, 2019(2): 5-8 (in Chinese). |
| [5] | 白京羽, 林晓锋, 丁俊琦. 我国生物产业发展现状及政策建议. 中国科学院院刊, 2020, 35(8): 1053-1060. Bai JY, Lin XF, Ding JQ. Development status and policy suggestions of China's biological industry. Bull Chin Acad Sci, 2020, 35(8): 1053-1060 (in Chinese). |
| [6] | 高振, 段珺, 黄英明, 等. 中国生物制造产业与科技现状及对策建议. 科学管理研究, 2019, 37(5): 68-75. Gao Z, Duan J, Huang YM, et al. Research on current situation of bio manufacturing industry and science and technology in China. Sci Manage Res, 2019, 37(5): 68-75 (in Chinese). |
| [7] | Liu D, Mannan AA, Han YC, et al. Dynamic metabolic control: towards precision engineering of metabolism. J Ind Microbiol Biotechnol, 2018, 45(7): 535-543. DOI:10.1007/s10295-018-2013-9 |
| [8] | Delvigne F, Takors R, Mudde R, et al. Bioprocess scale-up/down as integrative enabling technology: from fluid mechanics to systems biology and beyond. Microb Biotechnol, 2017, 10(5): 1267-1274. DOI:10.1111/1751-7915.12803 |
| [9] | Brunner V, Siegl M, Geier D, et al. Biomass soft sensor for a Pichia pastoris fed-batch process based on phase detection and hybrid modeling. Biotechnol Bioeng, 2020, 117(9): 2749-2759. DOI:10.1002/bit.27454 |
| [10] | 史梦菲, 林伟璐, 赵伟, 等. 中红外在线监测技术在黑曲霉发酵过程中的应用. 食品科技, 2017, 42(8): 288-295. Shi MF, Lin WL, Zhao W, et al. Online monitoring of Aspergillus niger fermentation process using FT-MIR. Food Sci Technol, 2017, 42(8): 288-295 (in Chinese). |
| [11] | Lu F, Wang ZJ, Zhao W, et al. A simple novel approach for real-time monitoring of sodium gluconate production by on-line physiological parameters in batch fermentation by Aspergillus niger. Bioresour Technol, 2016, 202: 133-141. DOI:10.1016/j.biortech.2015.11.077 |
| [12] | Zhao HT, Pang KY, Lin WL, et al. Optimization of the n-propanol concentration and feedback control strategy with electronic nose in erythromycin fermentation processes. Proc Biochem, 2016, 51(2): 195-203. DOI:10.1016/j.procbio.2015.12.001 |
| [13] | Li L, Wang ZJ, Chen XJ, et al. Optimization of polyhydroxyalkanoates fermentations with on-line capacitance measurement. Bioresour Technol, 2014, 156: 216-221. DOI:10.1016/j.biortech.2014.01.042 |
| [14] | Guo Q, Chu J, Zhuang YP, et al. Controlling the feed rate of propanol to optimize erythromycin fermentation by on-line capacitance and oxygen uptake rate measurement. Bioprocess Biosyst Eng, 2016, 39(2): 255-265. DOI:10.1007/s00449-015-1509-1 |
| [15] | Argelaguet R, Velten B, Arnol D, et al. Multi-Omics factor analysis-a framework for unsupervised integration of multi-omics data sets. Mol Syst Biol, 2018, 14(6): e8124. |
| [16] | Ma AJ, McDermaid A, Xu J, et al. Integrative methods and practical challenges for single-cell multi-omics. Trends Biotechnol, 2020, 38(9): 1007-1022. DOI:10.1016/j.tibtech.2020.02.013 |
| [17] | Yeoh JW, S/O Jayaraman S, Tan SGD, et al. A model-driven approach towards rational microbial bioprocess optimization. Biotechnol Bioeng, 2020, 118(1): 305-318. |
| [18] | Ping KK, Wang ZJ, Lu F, et al. Effect of oxygen supply on the intracellular flux distribution and a two-stage OUR control strategy for enhancing the yield of sodium gluconate production by Aspergillus niger. J Chem Technol Biotechnol, 2016, 91(5): 1443-1451. DOI:10.1002/jctb.4741 |
| [19] | Veiter L, Kager J, Herwig C. Optimal process design space to ensure maximum viability and productivity in Penicillium chrysogenum pellets during fed-batch cultivations through morphological and physiological control. Microb Cell Fact, 2020, 19(1): 33. DOI:10.1186/s12934-020-1288-5 |
| [20] | Veiter L, Rajamanickam V, Herwig C. The filamentous fungal pellet—relationship between morphology and productivity. Appl Microbiol Biotechnol, 2018, 102(7): 2997-3006. DOI:10.1007/s00253-018-8818-7 |
| [21] | Lu F, Ping KK, Wen L, et al. Enhancing gluconic acid production by controlling the morphology of Aspergillus niger in submerged fermentation. Proc Biochem, 2015, 50(9): 1342-1348. DOI:10.1016/j.procbio.2015.04.010 |
| [22] | Lu F, Li C, Wang ZJ, et al. High efficiency cell-recycle continuous sodium gluconate production by Aspergillus niger using on-line physiological parameters association analysis to regulate feed rate rationally. Bioresour Technol, 2016, 220: 433-441. DOI:10.1016/j.biortech.2016.08.062 |
| [23] | Tajsoleiman T, Mears L, Krühne U, et al. An industrial perspective on scale-down challenges using miniaturized bioreactors. Trends Biotechnol, 2019, 37(7): 697-706. DOI:10.1016/j.tibtech.2019.01.002 |
| [24] | Hong M, Huang MZ, Chu J, et al. Impacts of proline on the central metabolism of an industrial erythromycin-producing strain Saccharopolyspora erythraea via 13C labeling experiments. J Biotechnol, 2016, 231: 1-8. DOI:10.1016/j.jbiotec.2016.05.026 |
| [25] | Chen Y, Wang ZJ, Chu J, et al. Significant decrease of broth viscosity and glucose consumption in erythromycin fermentation by dynamic regulation of ammonium sulfate and phosphate. Bioresour Technol, 2013, 134: 173-179. DOI:10.1016/j.biortech.2013.02.023 |
| [26] | Zou X, Xia JY, Chu J, et al. Real-time fluid dynamics investigation and physiological response for erythromycin fermentation scale-up from 50 L to 132 m3 fermenter. Bioprocess Biosyst Eng, 2012, 35(5): 789-800. DOI:10.1007/s00449-011-0659-z |
| [27] | Chen CC, Hong M, Chu J, et al. Blocking the flow of propionate into TCA cycle through a mutB knockout leads to a significant increase of erythromycin production by an industrial strain of Saccharopolyspora erythraea. Bioprocess Biosyst Eng, 2017, 40(2): 201-209. DOI:10.1007/s00449-016-1687-5 |
| [28] | Chen Y, Wang ZJ, Chu J, et al. The glucose RQ-feedback control leading to improved erythromycin production by a recombinant strain Saccharopolyspora erythraea ZL1004 and its scale-up to 372-m3 fermenter. Bioprocess Biosyst Eng, 2015, 38(1): 105-112. DOI:10.1007/s00449-014-1248-8 |
| [29] | Zou X, Li WJ, Zeng W, et al. An assessment of seed quality on erythromycin production by recombinant Saccharopolyspora erythraea strain. Bioresour Technol, 2011, 102(3): 3360-3365. DOI:10.1016/j.biortech.2010.11.065 |
| [30] | Chen Y, Huang MZ, Wang ZJ, et al. Controlling the feed rate of glucose and propanol for the enhancement of erythromycin production and exploration of propanol metabolism fate by quantitative metabolic flux analysis. Bioprocess Biosyst Eng, 2013, 36(10): 1445-1453. DOI:10.1007/s00449-013-0883-9 |
| [31] | Hong M, Mou H, Liu XY, et al. 13C-assisted metabolomics analysis reveals the positive correlation between specific erythromycin production rate and intracellular propionyl-CoA pool size in Saccharopolyspora erythraea. Bioprocess Biosyst Eng, 2017, 40(9): 1337-1348. DOI:10.1007/s00449-017-1792-0 |
| [32] | Wang G, Haringa C, Noorman H, et al. Developing a computational framework to advance bioprocess scale-up. Trends Biotechnol, 2020, 38(8): 846-856. DOI:10.1016/j.tibtech.2020.01.009 |
| [33] | Wang G, Chu J, Noorman H, et al. Prelude to rational scale-up of penicillin production: a scale-down study. Appl Microbiol Biotechnol, 2014, 98(6): 2359-2369. DOI:10.1007/s00253-013-5497-2 |
| [34] | Verma R, Mehan L, Kumar R, et al. Computational fluid dynamic analysis of hydrodynamic shear stress generated by different impeller combinations in stirred bioreactor. Biochem Eng J, 2019, 151: 107312. DOI:10.1016/j.bej.2019.107312 |
| [35] | McClure DD, Liu ZH, Barton GW, et al. Oxygen transfer in pilot-scale contactors: an experimental and computational investigation into the effect of contactor design. Chem Eng J, 2018, 344: 173-183. DOI:10.1016/j.cej.2018.03.067 |
| [36] | Liu Y, Wang ZJ, Xia JY, et al. Application of Euler-Lagrange CFD for quantitative evaluating the effect of shear force on Carthamus tinctorius L. cell in a stirred tank bioreactor. Biochem Eng J, 2016, 114: 209-217. DOI:10.1016/j.bej.2016.07.006 |
| [37] | Wang Y, Chu J, Zhuang YP, et al. Industrial bioprocess control and optimization in the context of systems biotechnology. Biotechnol Adv, 2009, 27(6): 989-995. DOI:10.1016/j.biotechadv.2009.05.022 |
| [38] | Lara AR, Galindo E, Ramírez OT, et al. Living with heterogeneities in bioreactors. Mol Biotechnol, 2006, 34(3): 355-381. DOI:10.1385/MB:34:3:355 |
| [39] | Wang G, Wu BF, Zhao JF, et al. Power input effects on degeneration in prolonged penicillin chemostat cultures: a systems analysis at flux, residual glucose, metabolite, and transcript levels. Biotechnol Bioeng, 2018, 115(1): 114-125. DOI:10.1002/bit.26447 |
| [40] | Wang G, Zhao JF, Haringa C, et al. Comparative performance of different scale-down simulators of substrate gradients in Penicillium chrysogenum cultures: the need of a biological systems response analysis. Microb Biotechnol, 2018, 11(3): 486-497. DOI:10.1111/1751-7915.13046 |
| [41] | Bhargava S, Wenger KS, Marten MR. Pulsed addition of limiting-carbon during Aspergillus oryzae fermentation leads to improved productivity of a recombinant enzyme. Biotechnol Bioeng, 2003, 82(1): 111-117. DOI:10.1002/bit.10548 |
| [42] | Bhargava S, Wenger KS, Marten MR. Pulsed feeding during fed-batch Aspergillus oryzae fermentation leads to improved oxygen mass transfer. Biotechnol Progr, 2003, 19(3): 1091-1094. DOI:10.1021/bp025694p |
| [43] | Bhargava S, Nandakumar MP, Roy A, et al. Pulsed feeding during fed-batch fungal fermentation leads to reduced viscosity without detrimentally affecting protein expression. Biotechnol Bioeng, 2003, 81(3): 341-347. DOI:10.1002/bit.10481 |
| [44] | De Jonge LP, Buijs NAA, Ten Pierick A, et al. Scale-down of penicillin production in Penicillium chrysogenum. Biotechnol J, 2011, 6(8): 944-958. DOI:10.1002/biot.201000409 |
| [45] | Tang WJ, Deshmukh AT, Haringa C, et al. A 9-pool metabolic structured kinetic model describing days to seconds dynamics of growth and product formation by Penicillium chrysogenum. Biotechnol Bioeng, 2017, 114(8): 1733-1743. DOI:10.1002/bit.26294 |
| [46] | Haringa C, Tang WJ, Wang G, et al. Computational fluid dynamics simulation of an industrial P. chrysogenum fermentation with a coupled 9-pool metabolic model: towards rational scale-down and design optimization. Chem Eng Sci, 2018, 175: 12-24. |
