
 , 汤青林1
, 汤青林1

1. 西南大学 园艺园林学院,重庆 400715;
2. 重庆市农业科学研究院,重庆 401329
收稿日期:2019-09-16;接收日期:2019-12-18;网络出版时间:2020-01-06
基金项目:重庆市自然科学基金(Nos. cstc2019jcyj-zdxmX0022, cstc2019jcyj-msxmX0335)资助
摘要:芥菜HDA9是去乙酰化酶家族成员,能通过开花信号整合子(SOC1、AGL24)调控开花时间,但其深入的分子调控机制仍不清楚。利用重叠延伸PCR将芥菜HDA9的3个关键活性位点(Asp172、His174和Asp261)分别突变为Ala,构建氨基酸位点突变体HDA9D172A、HDA9H174A和HDA9D261A。进一步将突变体融合到pGADT7载体,酵母单杂交表明,HDA9突变后仍能与开花整合子SOC1、AGL24的启动子结合。双荧光素酶系统深入检测发现,尽管HDA9D172A、HDA9H174A和HDA9D261A与SOC1、AGL24启动子的结合仍存在,但作用强度均显著减弱。由此暗示,芥菜HDA9的第172、174和261这3个关键活性位点可在一定程度上调节它与开花整合子的相互作用。这为HDA9开花分子调控及功能解析等深入研究奠定了基础。
关键词:芥菜去乙酰化酶9开花信号整合子相互作用
Mutant construction of HDA9 and its interactions with promoters of flowering integrator SOC1 and AGL24 in Brassica juncea
Junli Zhang1, Wei Jiang1, Shengnan Li1, Wenwen Zhou1, Zhimin Wang1, Dayong Wei1, Hebing Wang2

 , Qinglin Tang1
, Qinglin Tang1

1. College of Horticulture and Landscape Architecture, Southwest University, Chongqing 400715, China;
2. Chongqing Academy of Agricultural Sciences, Chongqing 401329, China
Received: September 16, 2019; Accepted: December 18, 2019; Published: January 6, 2020
Supported by: Natural Science Foundation of Chongqing, China (Nos. cstc2019jcyj-zdxmX0022, cstc2019jcyj-msxmX0335)
Corresponding author: Hebing Wang. Tel: +86-23-65705208; E-mail: 26498118@qq.com;
Qinglin Tang. Tel: +86-23-68251274; Email: swutql@163.com.
Abstract: HDA9, a member of the deacetylase family, plays a vital role in regulating plant flowering time through flowering integrator SOC1 and AGL24. However, it remains elusive how HDA9 interacts with SOC1 and AGL24 in flowering time control. Here, HDA9 was cloned in Brassica juncea and then its three active sites were separately replaced with Ala via overlap extension PCR. Thus, mutants of HDA9D172A, HDA9H174A and HDA9D261A were constructed and fused into the pGADT7 vector. The yeast one-hybrid assays indicated that HDA9 mutants remained the interactions with the promoters of SOC1 and AGL24. Furthermore, the aforementioned results were confirmed in the dual luciferase assays. Interestingly, the DNA-protein interactions were weakened significantly due to the mutation in the three active sites of HDA9. It suggested that flowering signal integrator SOC1 and AGL24 were regulated by the key amino acid residues of 172th, 174th and 261th in HDA9. Our results provide valuable information for the in-depth study of the biological function and molecular regulation of HDA9 in Brassica juncea flowering time control.
Keywords: Brassica junceaHDA9flowering signal integratorinteraction
芥菜(Brassica juncea Coss.)是十字花科重要蔬菜作物,开花时间提前或延迟,不仅影响产品器官的产量和品质,还会影响品种选育进程。因此,有关芥菜抽薹开花调控研究一直是科研工作者关注焦点。开花时间受光周期途径、春化途径、赤霉素途径和自主途径等调控。Histone deacetylase 9 (HDA9)属于去乙酰化酶家族(HDACs)之中RPD3/DAD1亚家族成员,具有典型的组蛋白去乙酰化酶结构域,其酶活性的发挥需要Zn2+的存在[1-2]。HDACs在植物开花调控、防御反应和逆境适应等多个发育事件中起着至关重要的作用[3]。去乙酰酶基因HDA9在拟南芥茎尖、花蕾和种子中表达量较高[4-5]。
HDA9基因参与拟南芥开花时间控制[6],转基因超量表达HDA9会延迟植株开花时间,而其功能缺失则提前开花[4]。HDA9可逆地调节组蛋白的乙酰化水平。拟南芥HDA9通过介导染色质重构来抑制Flowering locus T (FT)上游激活因子Agamous-like 19 (AGL19)的活性,从而延迟短日照条件下植株的开花时间[4]。FT编码蛋白是成花素因子,主要在叶片中合成,通过筛管运输到茎顶端分生组织(SAM),促进开花[7-9]。由此说明:FT促进开花的功能受到HDA9的调控。另外,Suppressor of overexpression of constans 1 (SOC1)和Agamous-like 24 (AGL24)是MIKC型转录因子[10-11],可促进花分生组织形成,也可调节开花时间[12],它们和FT均是开花信号整合子[11, 13-14]。那么,SOC1和AGL24的开花促进作用是否也受去乙酰化酶HDA9的调节?彼此之间精细的分子调控机制如何?
本实验室最近发现芥菜HDA9不能直接作用于SOC1和AGL24蛋白,但可与SOC1和AGL24的启动子结合,调节开花[5]。然而,芥菜HDA9蛋白究竟依靠哪些氨基酸位点调节该蛋白-DNA相互作用来参与开花调节,目前仍不清楚。
HDACs是典型的含Zn2+酶,前人研究表明,在人体中有3个氨基酸(D178、H180和D267)负责螯合HDAC8的活性位点Zn2+,它们中任何一个发生突变都会影响去乙酰化酶的活性[15-16]。将这3个氨基酸突变为丙氨酸,会导致该去乙酰化酶的活性完全丧失,说明它们是调节该去乙酰化酶功能的关键氨基酸位点[17]。这些氨基酸位点在去乙酰化酶家族中高度保守。与此类似,另一个去乙酰化酶Histone deacetylase 5 (HDA5)中这3个位点(D198、H200和D291)突变后也会丧失功能[17]。本研究中通过序列比对发现,芥菜HDA9的这3个氨基酸活性位点分别在第172、174、261位。那么,这些位点突变是否可改变它与开花整合子SOC1、AGL24启动子的相互作用,迄今未见报道。为此,本研究分别构建芥菜HDA9中这3个位点的突变体HDA9D172A、HDA9H174A和HDA9D261A,利用酵母单杂交系统和双荧光素酶系统分析HDA9突变体与SOC1、AGL24启动子的相互作用。这为深入解析去乙酰化酶HDA9调控开花时间的分子机制奠定了基础。
1 材料与方法1.1 材料试验材料芥菜“QJ”和本氏烟来源于重庆市蔬菜学重点实验室,种植于RXZ型人工气候箱。
高保真酶EasyPfu DNA Polymerase由北京全式金生物技术有限公司提供;质粒提取试剂盒以及胶回收纯化试剂盒由OMEGA公司提供。酵母菌株Y1HGold、酵母单杂交质粒(pGADT7、pAbAi、p53-AbAi)和Aureobasidin A (简称AbA)均购自Clontech公司。农杆菌菌株GV3101、双萤光素酶载体pGreenⅡ62-SK、pGreenⅡ0800- LUC和pSoup由本实验室保存并提供。芥菜SOC1启动子、AGL24启动子的酵母融合载体pAbAi-SOC1和pAbAi-AGL24及其酵母转化菌液均由实验室保存并提供。
1.2 芥菜HDA9的序列分析与突变体构建NCBI搜索HDAC家族成员hsHDAC8以及拟南芥HDA2、HDA5、HDA6、HDA15、HDA18和HDA19 (GenBank登录号分别为:NC_000023.11、NC_003076.8、NC_003076.8、NC_003076.8、NC_003074.8、NC_003076.8和NC_003075.7)。DNAMAN软件氨基酸序列比对,寻找HDAC家族保守的活性位点。
以芥菜cDNA为模板,以FHDA9/RHDA9 (表 1)为引物扩增目的片段HDA9,胶回收并连接克隆载体,经过PCR检测、双酶切鉴定和测序验证后提取质粒。以连接HDA9基因的克隆载体为模板,利用重叠延伸PCR技术(表 2),经琼脂糖凝胶电泳后回收第一、二轮目的片段产物,并等量混合作为模板进行第三轮PCR,回收目的片段并筛选阳性克隆,测序鉴定并提取质粒备用。
表 1 实验所用引物[18]Table 1 Primers used in this study[18]
| Primer name | Primer sequence (5′-3′) |
| FHDA9 | GAGATGCGGTCCAAGGAC |
| RHDA9 | CGCATCGTTATCGTTGTC |
| FHDA9-AD | CGCCATATGGAGATGCGGTCCAAGGAC |
| RHDA9-AD | CGCGGATCCCGCATCGTTATCGTTGTC |
| FHDA9-SK | GCTCTAGAGAGATGCGGTCCAAGGAC |
| RHDA9-SK | CGCGGATCCCGCATCGTTATCGTTGTC |
| Fm1 | GATATAGCTGTTCATCACGG |
| Rm1 | CCGTGATGAACAGCTATATC |
| Fm2 | GATGTTGCTCACGGTGATGG |
| Rm2 | CCATCACCGTGAGCAACATC |
| Fm3 | GGAGCAGCTTCACTAGCAAG |
| Rm3 | CTTGCTAGTGAAGCTGCTCC |
| T7 | TAATACGACTCACTATAGGGCG |
| 3′AD | AGATGGTGCACGATGCACAG |
| Note: the mutated sites are underlined. | |
表选项
表 2 HDA9突变体构建[18]Table 2 Mutant construction of HDA9 in Brassica juncea[18]
| Primer combinations for PCR | Mutation amino acid | Mutants | ||
| First round PCR | Second round PCR | Third round PCR | ||
| FHDA9-AD/Rm1 | Fm1/RHDA9-AD | FHDA9-AD/RHDA9-AD | 172D_172A | HDA9D172A |
| FHDA9-AD/Rm2 | Fm2/RHDA9-AD | FHDA9-AD/RHDA9-AD | 174H_174A | HDA9H174A |
| FHDA9-AD/Rm3 | Fm3/RHDA9-AD | FHDA9-AD/RHDA9-AD | 261D_261A | HDA9D261A |
表选项
1.3 HDA9突变体酵母载体构建用NdeⅠ和BamHⅠ双酶切上述突变体质粒及酵母表达载体pGADT7,然后连接并转化大肠杆菌,经T7和3′AD引物组合(表 1) PCR检测后,提取重组质粒,双酶切鉴定并送测序验证。酵母重组质粒分别记为pGADT7-HDA9D172A、pGADT7-HDA9H174A和pGADT7-HDA9D261A。芥菜SOC1、AGL24启动子的重组质粒pAbAi-SOC1和pAbAi-AGL24由本实验室前期已构建,可直接用于本研究。
1.4 HDA9突变体双荧光素酶载体构建以FHDA9-SK和RHDA9-SK为引物组合进行PCR扩增,亚克隆芥菜HDA9突变体,并连接到双荧光素酶表达载体pGreenⅡ62-SK,经XbaⅠ和BamHⅠ双酶切和测序验证后分别命名为pGreenⅡ62-SK-HDA9D172A、pGreenⅡ62-SK- HDA9H174A和pGreenⅡ62-SK-HDA9D261A。芥菜SOC1、AGL24启动子的重组质粒pGreenⅡ0800- LUC-SOC1和pGreenⅡ0800-LUC-AGL24由本实验室前期构建,已转GV3101菌株(含pSoup质粒),可直接用于本研究。
1.5 酵母单杂交鉴定蛋白-DNA互作参考酵母单杂交试剂盒操作手册,以pAbAi- SOC1、pAbAi-AGL24的Y1HGold转化子菌株为样本,分别制备酵母感受态细胞。将pGADT7-HDA9D172A、pGADT7-HDA9H174A和pGADT7-HDA9D261A分别转入上述感受态细胞,获得酵母融合子Y1HGold (SOC1+HDA9D172A)、Y1HGold (SOC1+HDA9H174A)和Y1HGold (SOC1+ HDA9D261A)、Y1HGold (AGL24+HDA9D172A)、Y1HGold (AGL24+HDA9H174A)和Y1HGold (AGL24+HDA9D261A)。在SD/Leu和SD/Leu/AbA培养基上28 ℃培养3-5 d,观察是否有菌落出现。同时,将p53-AbAi和pGADT7-53质粒共转化到Y1HGold作为阳性对照;将质粒pAbAi-SOC1和pGADT7质粒共转化Y1HGold作为SOC1启动子的阴性对照;将pAbAi-AGL24和pGADT7质粒共转化Y1HGold作为AGL24启动子的阴性对照。按本实验室前期分别筛选出的SOC1和AGL24启动子在酵母平板上的AbA抑菌浓度(分别为100 ng/mL和350 ng/mL)配制酵母培养基。将上述酵母菌液分别稀释1倍、10倍和50倍后,点样于SD/-Leu平板及其AbA抗性酵母平板SD/-Leu/AbA100或SD/-Leu/AbA350,检测HDA9突变体与SOC1、AGL24启动子之间是否相互作用。
1.6 双荧光素酶检测蛋白-DNA互作将载体pGreenⅡ62-SK-HDA9D172A、pGreenⅡ62- SK-HDA9H174A、pGreenⅡ62-SK-HDA9D261A和pGreenⅡ62-SK分别转化GV3101菌株(含pSoup质粒)。单菌落经PCR阳性鉴定后,扩大培养,按OD600的比值1︰9将pGreenⅡ0800-LUC-SOC1或pGreenⅡ0800-LUC-AGL24分别与pGreenⅡ62- SK-HDA9D172A、pGreenⅡ62-SK-HDA9H174A和pGreenⅡ62-SK-HDA9D261A菌液混匀,作为实验组。pGreenⅡ0800-LUC-SOC1或pGreenⅡ0800- LUC-AGL24分别与pGreenⅡ62-SK-HDA9菌液按OD600比值1︰9混匀,作为阳性对照。同样将pGreenⅡ0800-LUC-SOC1或pGreenⅡ0800-LUC- AGL24分别与pGreenⅡ62-SK混匀后作为阴性对照。分别侵染本氏烟叶片后60 h取样,置于GloMax?-Multi+多功能检测仪,测定双荧光素酶并计算酶活性比值,SPSS软件方差分析,LSD法多重比较,显著性水平为0.01。
2 结果与分析2.1 芥菜HDA9序列分析及其突变体克隆芥菜HDA9基因cDNA序列为1 284 bp,编码426个氨基酸。参考Luo等将此与拟南芥HDA2、HDA5、HDA6、HDA9、HDA15、HDA18以及hsHDAC8序列比对[17]:HDAC家族成员的酶活性位点高度保守,分别为Asp (D)、His (H)和Asp (D),其中芥菜HDA9的这3个位点分别位于第172位、174位和261位(图 1)。利用重叠延伸PCR技术分别将上述位点突变为Ala (A),构建芥菜HDA9的3个突变体HDA9D172A、HDA9H174A和HDA9D261A。PCR扩增产物电泳检测和测序结果(图 2)均表明,上述HDA9突变体构建成功。ExPASy SWISS- MODEL同源建模和蛋白结构预测表明,芥菜HDA9的这3个突变体均不会改变蛋白三维空间结构。
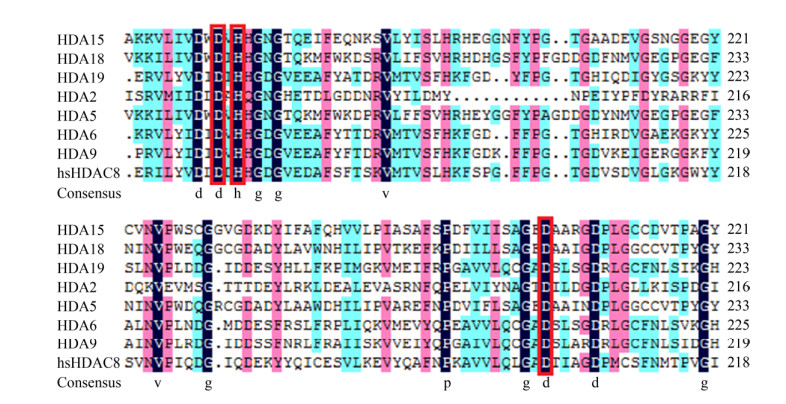 |
| 图 1 芥菜HDA9和拟南芥菜HDA2、HDA5、HDA6、HDA15、HDA18及人hsHDAC8催化结构域[17] Fig. 1 The conserved catalytic sites of Brassica juncea HDA9 compared with Arabidopsis thaliana HDA2, HDA5, HDA6, HDA15, HDA18, HDA19 and human hsHDAC8[17]. The red boxes indicate three conserved amino acids that are responsible for chelating Zn2+ in hsHDAC8. |
| 图选项 |
 |
| 图 2 芥菜HDA9的3个突变体(HDA9D172A、HDA9H174A和HDA9D261A)的突变区域测序峰图 Fig. 2 Sequencing peak maps in the mutation sections of HDA9D172A, HDA9H174A and HDA9D261A. Rectangular boxes indicate the mutation sites of HDA9D172A, HDA9H174A and HDA9D261A in (A), (B) and (C), respectively. |
| 图选项 |
2.2 重组载体构建与鉴定将上述芥菜HDA9的3个突变体分别融合到酵母表达载体pGADT7,构建酵母融合质粒pGADT7-HDA9D172A、pGADT7-HDA9H174A和pGADT7-HDA9D261A。经NdeⅠ和BamHⅠ双酶切鉴定和测序表明,目的片段的序列及插入方向完全正确。此外,酵母质粒pAbAi-SOC1和pAbAi-AGL24为本实验室前期构建,可直接用于后续酵母单杂交检测。
将芥菜HDA9的3个突变体融合到双荧光素酶载体pGreenII 62-SK,获重组载体pGreenⅡ62- SK-HDA9D172A、pGreenⅡ62-SK-HDA9H174A和pGreenⅡ62-SK-HDA9D261A。经PCR检测正确的阳性菌落扩大培养并提取重组质粒,然后双酶切鉴定和测序分析,结果表明上述融合载体构建成功。此外,pGreenⅡ0800-LUC-SOC1和pGreenⅡ0800- LUC-AGL24载体已由本实验室前期构建,可直接用于后续实验。
2.3 芥菜HDA9突变体与SOC1、AGL24启动子酵母单杂交鉴定本实验室蒋炜等发现芥菜HDA9能与开花整合子SOC1和AGL24的启动子相互作用[5]。但是,去乙酰化酶HDA9是否会利用其关键活性位点调控它与开花整合子的作用?为此,本研究深入检测芥菜HDA9活性位点的一系列突变体与开花整合子的相互作用。
将酵母重组质粒pGADT7-HDA9D172A、pGADT7-HDA9H174A和pGADT7-HDA9D261A分别转化到酵母猎物菌株Y1H (pAbAi-SOC1)或Y1H (pAbAi-AGL24),作为实验处理组;空载体pGADT7也转化到酵母猎物菌株作为阴性对照;质粒pGADT7-p53转化到Y1H (p53-AbAi)作为阳性对照。所有处理组合、阳性对照和阴性对照均可以在营养缺陷培养基SD/-Leu上生长(图 3-4),说明重组质粒成功转入酵母菌,可用于后续实验。
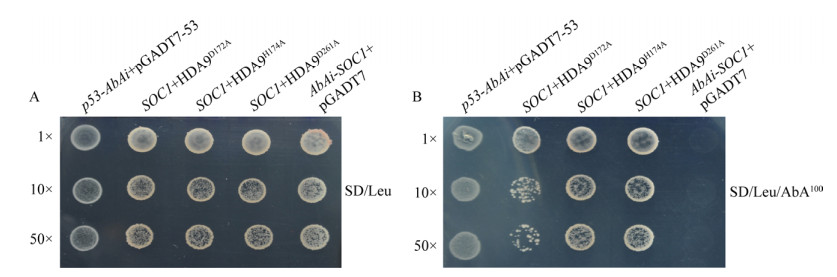 |
| 图 3 芥菜HDA9突变体与SOC1启动子酵母单杂交 Fig. 3 Interaction identification between SOC1 promoter and HDA9 mutants via yeast one-hybrid. Growth of the fusion yeast strain with different dilutions on the defect medium SD/-Leu (A) and SD/-Leu/AbA100 (B). |
| 图选项 |
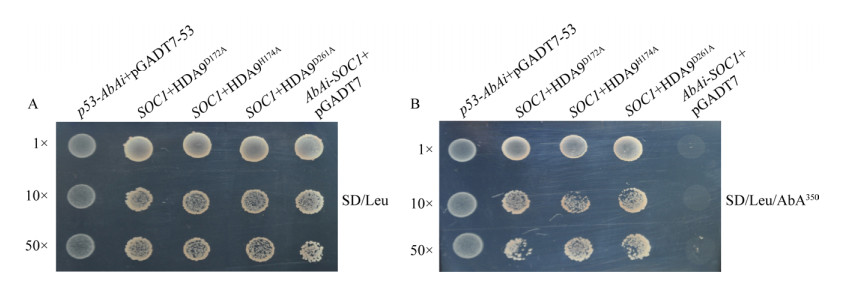 |
| 图 4 芥菜HDA9突变体与AGL24启动子酵母单杂交 Fig. 4 Interaction identification between AGL24 promoter and HDA9 mutants via yeast one-hybrid. Growth of the fusion yeast strain with different dilutions on the defect medium SD/-Leu (A) and SD/-Leu/AbA100 (B). |
| 图选项 |
将上述酵母杂交菌分别稀释1倍、10倍和50倍后点样于SD/-Leu/AbA抗性培养基进一步检测。结果表明,Y1H (SOC1+HDA9D172A)、Y1H (SOC1+HDA9H174A)和Y1H (SOC1+HDA9D261A)均能在SD/-Leu/AbA100平板生长且呈现白色菌落;阳性对照Y1H (p53-AbAi+pGADT7-53)也可在该平板长出白色酵母菌;但阴性对照不能生长(图 3)。由此说明突变体HDA9D172A、HDA9H174A和HDA9D261A仍能够与开花整合子SOC1的启动子相互作用。
同样,将酵母杂交融合菌Y1H (AGL24+ HDA9D172A)、Y1H (AGL24+HDA9H174A)、Y1H (AGL24+HDA9D261A)以及阳性对照菌株Y1H (p53-AbAi+pGADT7-53)分别涂布于SD/-Leu/ AbA350平板,也都可长出白色酵母菌;但阴性对照不能生长(图 6)。由此表明,HDA9D172A、HDA9H174A和HDA9D261A突变体与另一个开花整合子AGL24的启动子仍能够互作。
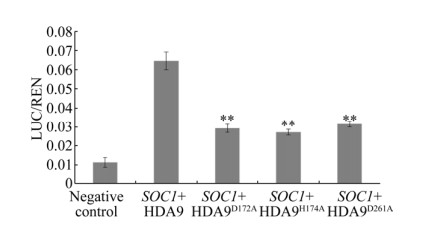 |
| 图 6 芥菜HDA9突变体与SOC1启动子作用的双荧光素酶检测 Fig. 6 Interaction identification of HDA9 mutants and SOC1 promoter via dual luciferase system. The experiments were conducted at three replicates per experiment and the data was analyzed at P < 0.01. Double stars (**) showed extremely significant differences compared with positive and negative controls. |
| 图选项 |
综上分析可知,芥菜去乙酰化酶HDA9的3个活性位点(第172、174和261位)突变之后并不会导致它与开花整合子SOC1、ALG24的相互作用消失。
2.4 芥菜HDA9突变体与SOC1、AGL24启动子双荧光素酶鉴定利用双荧光素酶系统进一步检测芥菜HDA9活性位点突变之后与开花信号整合子的作用关系,设计了双荧光素酶检测系统的实验(图 5)。
 |
| 图 5 双荧光素酶检测系统的实验设计示意图 Fig. 5 Schematic diagram of experimental design of dual luciferase detection system. |
| 图选项 |
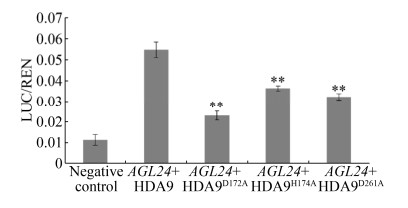
将pGreenⅡ62-SK-HDA9D172A、pGreenⅡ62- SK-HDA9H174A和pGreenⅡ 62-SK-HDA9D261A分别与pGreenⅡ0800-LUC-SOC1菌液混匀作为实验处理组合;pGreenⅡ62-SK-HDA9和pGreenⅡ 62-SK分别与pGreenⅡ0800-LUC-SOC1菌液混匀,作为阳性和阴性对照。结果表明,HDA9突变体组合的酶活性比值(LUC/REN)均极显著高于阴性对照,但又极显著低于HDA9未突变的阳性对照(图 6)。由此说明,芥菜HDA9蛋白突变之后仍然能够与开花整合子SOC1结合,但结合强度会显著降低。
同样,将pGreenⅡ62-SK-HDA9D172A、pGreenⅡ62- SK-HDA9H174A和pGreenII62-SK-HDA9D261A分别与pGreenⅡ0800-LUC-AGL24菌液混匀,浸染本氏烟,检测酶活性及比值(图 7),结果表明,HDA9D172A、HDA9H174A和HDA9D261A均能够与AGL24的启动子结合,但结合强度也显著降低。
 |
| 图 7 芥菜HDA9突变体与AGL24启动子作用的双荧光素酶检测 Fig. 7 Interaction identification of HDA9 mutants and AGL24 promoter via dual luciferase system. The experiments were conducted at three replicates per experiment and the data was analyzed at P < 0.01. Double stars (**) showed extremely significant differences compared with positive and negative controls. |
| 图选项 |
综上表明,芥菜HDA9第172、174和261位的氨基酸突变后,会显著降低其与开花整合子SOC1、AGL24启动子的结合强度。由此暗示,芥菜HDA9的这3个关键位点在一定程度上调节其与SOC1、AGL24启动子的结合作用。这为基于去乙酰化酶HDA9调控芥菜开花时间等深入研究提供了新的突破口。
3 讨论3.1 HDA9与RPD3/HDA1亚家族成员高度保守去乙酰化酶HDACs参与基因表达、DNA修复和应激反应等[19]。真核生物中HDAC家族可分为3个亚族:RPD3/HDA1 (Reduced potassium dependence 3/Histone deacetylase 1)、SIR2 (Silent information regulator 2)和HD2 (Histone deacetylase 2)[20-21]。其中,RPD3/HDA1亚族又进一步分为3类:Ⅰ类包括HDA19、HDA6、HDA7和HDA9;Ⅱ类包括HDA5、HDA15和HDA18;Ⅲ类仅包括HDA2[3, 22]。本研究克隆的芥菜HDA9属于RPD3/HDA1亚族第Ⅰ类,与HDAC家族成员具有高度的保守性,3个关键活性位点与拟南芥HDA2、HDA5、HDA6、HDA15、HDA18以及人类hsHDAC8完全一致,分别为天冬氨酸、组氨酸和天冬氨酸,它们分别位于芥菜HDA9蛋白的第172、174和261位。
3.2 HDA9介导开花信号整合子调控开花时间拟南芥HDA9基因突变后会打破种子休眠并加速种子萌发[23],也可调节大量非生物胁迫应答基因的表达水平[24]。拟南芥HDA9也可参与开花时间调控[4-5]。HDA9与AHL22相互作用并调节FT基因表达,控制开花[25]。另外,开花信号整合子SOC1和AGL24整合光周期、春化等多条开花途径。本实验室前期研究发现,芥菜HDA9不能与SOC1和AGL24蛋白相互作用,但是可与其启动子相互结合,调节开花时间[5]。此外,拟南芥hdf5突变体植株中FLC和MAF1表达增加;HDA5能够与FLD、FVE蛋白相互作用,也能与HDA6蛋白互作[17]。HDA5和HDA6可通过调节FLC基因的表达调控开花时间[26]。在拟南芥hda5和hda6突变植株中,2个下游开花整合子FT和SOC1的转录水平均降低[17]。由此暗示,HDA9与HDA5、HDA6类似,通过调节开花整合子的基因表达调控开花时间。
3.3 HDA9通过其关键活性位点调控开花整合子Vannini等研究表明,在人类HDAC8的3个酶活性位点中(Zn2+螯合位点),每一个氨基酸位点突变均会影响蛋白结合底物,因此导致酶活性完全丧失[16]。与此类似,拟南芥HDA5的这3个保守位点(D198、H200、D2)被丙氨酸替换后,体外表达的GST-HDA5原核蛋白也会失去酶活性。由此表明HDA5的第198、200和291位均为金属离子螯合所必需[17]。Luo等对拟南芥HDA5组蛋白去乙酰酶的研究表明,它的3个保守氨基酸分别突变成丙氨酸后,失去了组蛋白去乙酰基酶活性[17]。另外,在野生芥菜ALS基因突变的抗除草剂研究中,发现第23号野生芥菜株系,它的ALS编码蛋白的122位点突变成丙氨酸后,导致ALS酶的敏感性降低,显示出对除草剂的抗性[27]。李素云等在人体鼻咽癌组织STGC3基因研究中,STGC3基因单碱基突变,丝氨酸突变为丙氨酸时,突变的STGC3蛋白质不改变功能基团[28]。以上述研究为借鉴,本实验将芥菜HDA9的3个活性位点突变成丙氨酸,并对突变体蛋白结构预测,结果表明,芥菜HDA9的这3个突变体均不会改变蛋白三维空间结构和亲水性。本研究中利用酵母单杂交和双荧光素酶系统发现,芥菜HDA9的3个突变体HDA9D172A、HDA9H174A和HDA9D261A仍然与SOC1、AGL24的启动子结合,但是结合强度会显著削弱。由此暗示,芥菜HDA9的第172、174和261位氨基酸能在一定程度上调控其与开花整合子的相互作用。如果将这些位点突变成疏水性且羧基解离常数接近的亮氨酸或异亮氨酸后又会如何调控开花整合子呢?或者换成其他亲水或酸性氨基酸会有怎样的生物学功能?由此可见,去乙酰化酶HDA9调控抽薹开花的精细作用机制仍需后续深入研究。
参考文献
| [1] | Pandey R, Müller A, Napoli CA, et al. Analysis of histone acetyltransferase and histone deacetylase families of Arabidopsis thaliana suggests functional diversification of chromatin modification among multicellular eukaryotes. Nucleic Acids Res, 2002, 30(23): 5036-5055. DOI:10.1093/nar/gkf660 |
| [2] | Han ZF, Wang QP, Luo XJ. Characteristic and function of histone deacetylases in plants. Chin J Biochem Mol Biol, 2017, 33(10): 1008-1013 (in Chinese). 韩召奋, 王秋苹, 罗鑫娟. 植物组蛋白去乙酰化酶的特性及功能. 中国生物化学与分子生物学报, 2017, 33(10): 1008-1013. |
| [3] | Hollender C, Liu ZC. Histone deacetylase genes in Arabidopsis development. Integr Plant Biol, 2008, 50(7): 875-885. DOI:10.1111/j.1744-7909.2008.00704.x |
| [4] | Kang MJ, Jin HS, Noh YS, et al. Repression of flowering under a noninductive photoperiod by the HDA9-AGL19-FT module in Arabidopsis. New Phytol, 2015, 206(1): 281-294. DOI:10.1111/nph.13161 |
| [5] | Jiang W, Wei DY, Zhou WW, et al. HDA9 interacts with the promoters of SOC1 and AGL24 involved in flowering time control in Brassica juncea. Biochem Biophys Res Commun, 2018, 499(3): 519-523. DOI:10.1016/j.bbrc.2018.03.180 |
| [6] | Kim W, Latrasse D, Servet C, et al. Arabidopsis histone deacetylase HDA9 regulates flowering time through repression of AGL19. Biochem Biophys Res Commun, 2013, 432(2): 394-398. DOI:10.1016/j.bbrc.2012.11.102 |
| [7] | Corbesier L, Vincent C, Jang S, et al. FT protein movement contributes to long-distance signaling in floral induction of Arabidopsis. Science, 2007, 316(5827): 1030-1033. DOI:10.1126/science.1141752 |
| [8] | Jaeger KE, Wigge PA. FT protein acts as a long-range signal in Arabidopsis. Curr Biol, 2007, 17(12): 1050-1054. DOI:10.1016/j.cub.2007.05.008 |
| [9] | Notaguchi M, Abe M, Kimura T, et al. Long-distance, graft-Transmissible action of Arabidopsis FLOWERING LOCUS T protein to promote flowering. Plant Cell Physiol, 2008, 49(11): 1645-1658. DOI:10.1093/pcp/pcn154 |
| [10] | Fernandez DE, Wang CT, Zheng YM, et al. The MADS-Domain factors AGAMOUS-LIKE15 and AGAMOUS-LIKE18, along with SHORT VEGETATIVE PHASE and AGAMOUS-LIKE24, are necessary to block floral gene expression during the vegetative phase. Plant Physiol, 2014, 165(4): 1591-1603. DOI:10.1104/pp.114.242990 |
| [11] | Li CC, Ma GP, Xie T, et al. Analysis of interactions between AGL18 family members and flowering time integrator factor SOC1 in Brassica juncea. Acta Horticult Sin, 2017, 44(3): 463-474 (in Chinese). 李朝闯, 马关鹏, 谢婷, 等. 芥菜AGL18家族成员与开花整合子SOC1的互作分析. 园艺学报, 2017, 44(3): 463-474. |
| [12] | Lee H, Suh SS, Park E, et al. The AGAMOUS-LIKE 20 MADS domain protein integrates floral inductive pathways in Arabidopsis. Genes Dev, 2000, 14(18): 2366-2376. DOI:10.1101/gad.813600 |
| [13] | Lee JH, Yoo SJ, Park SH, et al. Role of SVP in the control of flowering time by ambient temperature in Arabidopsis. Genes Dev, 2007, 21(4): 397-402. DOI:10.1101/gad.1518407 |
| [14] | Li D, Liu C, Shen LS, et al. A repressor complex governs the integration of flowering signals in Arabidopsis. Dev Cell, 2008, 15(1): 110-120. |
| [15] | Lombardi PM, Cole KE, Dowling DP, et al. Structure, mechanism, and inhibition of histone deacetylases and related metalloenzymes. Curr Opin Struct Biol, 2011, 21(6): 735-743. DOI:10.1016/j.sbi.2011.08.004 |
| [16] | Vannini A, Volpari C, Filocamo G, et al. Crystal structure of a eukaryotic zinc-dependent histone deacetylase, human HDAC8, complexed with a hydroxamic acid inhibitor. Proc Natl Acad Sci USA, 2004, 101(42): 15064-15069. DOI:10.1073/pnas.0404603101 |
| [17] | Luo M, Tai R, Yu CW, et al. Regulation of flowering time by the histone deacetylase HDA5 in Arabidopsis. Plant J, 2015, 82(6): 925-936. DOI:10.1111/tpj.12868 |
| [18] | Jiang W. Cloning, expression of HDA9 and AGL19 and their mechanism in regulating key flowering integrators of Brassica juncea[D]. Chongqing: Southwest University, 2018 (in Chinese). 蒋炜.芥菜HDA9和AGL19克隆、表达及其与核心开花整合子的作用机制研究[D].重庆: 西南大学, 2018. |
| [19] | Hassig CA, Schreiber SL. Nuclear histone acetylases and deacetylases and transcriptional regulation: HATs off to HDACs. Curr Opin Chem Biol, 1997, 1(3): 300-308. DOI:10.1016/S1367-5931(97)80066-X |
| [20] | Yang XJ, Seto E. HATs and HDACs: from structure, function and regulation to novel strategies for therapy and prevention. Oncogene, 2007, 26(37): 5310-5318. DOI:10.1038/sj.onc.1210599 |
| [21] | Liu XC, Yang SG, Zhao ML, et al. Transcriptional repression by histone deacetylases in plants. Mol Plant, 2014, 7(5): 764-772. DOI:10.1093/mp/ssu033 |
| [22] | Alinsug MV, Yu CW, Wu KQ, et al. Phylogenetic analysis, subcellular localization, and expression patterns of RPD3/HDA1 family histone deacetylases in plants. BMC Plant Biol, 2009, 9: 37. DOI:10.1186/1471-2229-9-37 |
| [23] | van Zanten M, Z?ll C, Wang Z, et al. HISTONE DEACETYLASE 9 represses seedling traits in Arabidopsis thaliana dry seeds. Plant J, 2014, 80(3): 475-488. DOI:10.1111/tpj.12646 |
| [24] | Zheng Y, Ding Y, Sun X, et al. Histone deacetylase HDA9 negatively regulates salt and drought stress responsiveness in Arabidopsis. J Exp Bot, 2016, 67(6): 1703-1713. DOI:10.1093/jxb/erv562 |
| [25] | Yun J, Kim YS, Jung JH, et al. The AT-hook motif-containing protein AHL22 regulates flowering initiation by modifying FLOWERING LOCUS T chromatin in Arabidopsis. J Biol Chem, 2012, 287(19): 15307-15316. DOI:10.1074/jbc.M111.318477 |
| [26] | Yu CW, Liu X, Luo M, et al. HISTONE DEACETYLASE6 interacts with FLOWERING LOCUS D and regulates ?owering in Arabidopsis. Plant Physiol, 2011, 156(1): 173-184. DOI:10.1104/pp.111.174417 |
| [27] | Khaledi R, Fayaz F, Kahrizi D, et al. PCR-based identification of point mutation mediating acetolactate synthase-inhibiting herbicide resistance in weed wild mustard (Sinapis arvensis). Mol Biol Rep, 2019, 46(5): 5113-5121. DOI:10.1007/s11033-019-04967-5 |
| [28] | Li SY, Liu HQ, Liu F, et al. Construction of the STGC3 recombinant mutation vector and its expression in CNE2 cells. Chin J Anat, 2019, 42(5): 453-457 (in Chinese). 李素云, 刘慧晴, 刘芳, 等. STGC3基因突变载体的构建及其在CNE2细胞中的表达. 解剖学杂志, 2019, 42(5): 453-457. DOI:10.3969/j.issn.1001-1633.2019.05.005 |
