
 , 李桂林
, 李桂林 郑州伊美诺生物技术有限公司,河南 郑州 450016
收稿日期:2019-09-19;接收日期:2019-11-08
通讯作者:Qiaohui Zhao. Tel: +86-371-67122637; E-mail: zhaoqiaohui@autobio.com.cn.
摘要:为了实现在体外制备巨细胞病毒-免疫球蛋白M (CMV-IgM)和探讨不同信号肽对CMV-IgM表达的影响,通过RLM-RACE技术钓取杂交瘤细胞基因序列,构建人鼠嵌合CMV-IgM表达载体,并通过PCR方法将5种不同的分泌型信号肽(SigA–SigE)代替CMV-IgM自身信号肽(SigF),利用中国仓鼠卵巢细胞(CHO)作为宿主细胞进行体外表达。对纯化后的CMV-IgM进行SDS-PAGE、SEC-HPLC和酶联免疫吸附试验(ELISA)确定其蛋白表达水平与免疫反应性,最终成功制备出910 kDa的重组蛋白,且研究表明,5种信号肽(SigA–SigE)的人鼠嵌合CMV-IgM表达量较CMV 6#细胞株自身信号肽SigF相比,分别提高了6.72、5.19、1.44、1.85、1.98倍。这将对人鼠嵌合CMV-IgM的开发提供理论基础,且为提高CMV-IgM表达量的研究工作提供了新思路。
关键词:巨细胞病毒-免疫球蛋白M人鼠嵌合信号肽表达
Effects of different signal peptides on the secretion of human-mouse chimeric CMV-IgM
Yamin Cui, Xiaoping Tian, Qiaohui Zhao

 , Guilin Li
, Guilin Li Zhengzhou Immuno Bio-Tech Co., Ltd, Zhengzhou 450016, Henan, China
Received: September 19, 2019; Accepted: November 8, 2019
Abstract: In order to prepare human-mouse chimeric cytomegalovirus-immunoglobulin M (CMV-IgM) in vitro and study the effects of different signal peptides on the secretion of CMV-IgM, genes were amplified from hybridoma cell line using RLM-RACE to construct the expression vector of chimeric CMV-IgM. Then, the signal peptide of SigF itself was replaced by five different secreted signal peptides (SigA–SigE) by PCR method, and the CHO cell was chosen as host cell for in vitro expression. SDS-PAGE, SEC-HPLC and ELISA experiments were carried out to evaluate the protein expression level and immunoreactivity of the purified CMV-IgM. A 910 kDa recombinant protein was successfully prepared and signal peptides (SigA–SigE) had an increased expressed CMV-IgM, which were 6.72, 5.19, 1.44, 1.85 and 1.98 times higher than that of the CMV 6# cell signal peptide SigF. In summary, this work provides a theoretical basis for the development of human-mouse chimeric CMV-IgM, and a novel route to increase the expression level of CMV-IgM.
Keywords: CMV-IgMhuman-mouse chimericsignal peptideexpression
巨细胞病毒(Cytomegalovirus,CMV)是一种常见的人类病毒病原体,属β疱疹病毒亚科。巨细胞病毒感染可导致严重后果,它会使得免疫力低的孕妇容易感染这类病毒,并导致胎儿流产、死胎、先天残障[1-3]。据统计,妊娠期巨细胞病毒活动性感染是导致婴儿出生缺陷和发育障碍的主要病毒原因。因此,巨细胞病毒-免疫球蛋白M (Cytomegalovirus-immunoglobulin M,CMV-IgM)对于孕期及新生儿原发性感染和非原发性感染(再激活或再感染)的检测十分必要[4]。目前对CMV-IgM的检测主要是通过酶联免疫吸附试验,由于其操作简单、快速和设备要求低等原因,成为最常用的诊断方法之一。CMV-IgM作为阳性质控品在体外诊断中有着重要作用[5]。而当前,阳性对照品CMV-IgM大多以收集的高值大样血浆配制得到,由于临床高值较难收集导致阳性资源匮乏,无法进行大规模制备。
中国仓鼠卵巢细胞(Chinese hamster ovary, CHO)细胞是目前最常用、工业化生产最成功的哺乳动物细胞表达系统[6]。CHO细胞表达的最大优点在于表达的外源蛋白质经过一系列的加工修饰,与天然的蛋白质分子非常接近。然而,由于哺乳动物细胞表达系统培养复杂、耗时、成本昂贵且IgM亚型抗体作为多聚体表达量较低[4],因此,如何提高产量以降低生产成本成为诸多研究者们的研究重点。
分泌表达是CHO细胞表达基因工程重组蛋白的主要途径,在外源基因转录水平达到瓶颈时,提高细胞分泌能力明显有助于重组蛋白表达量的提升。CHO细胞表达外源蛋白质过程中,mRNA翻译形成的蛋白质前体N端的信号肽与信号肽识别因子结合,在信号肽识别因子的帮助下进入内质网进行下一步的修饰,合适的信号肽有助于重组蛋白表达量的提高[7-10]。
本研究在已报道的基础上[11-14],通过RLM-RACE技术钓取杂交瘤细胞基因序列,与人源Fc段进行拼接,构建人鼠嵌合CMV-IgM表达载体,并通过PCR方法将5种不同的分泌型信号肽(SigA–SigE)代替CMV-IgM自身信号肽(SigF),利用CHO作为宿主细胞进行体外表达。对纯化后的CMV-IgM进行SDS-PAGE、SEC-HPLC和ELISA实验确定其蛋白表达水平与免疫活性。这将对人鼠嵌合CMV-IgM的开发提供理论基础,且为提高CMV-IgM表达量的研究工作提供了新思路。
1 材料与方法1.1 材料1.1.1 细胞株、菌种及载体质粒分泌抗p52抗原的小鼠杂交瘤细胞株CMV 6#由本实验室研制并保存;Expi CHO购自Gibco;载体质粒pCMV3载体由北京义翘购买并改造后获得;大肠杆菌Top 10感受态细胞购自天根生化科技(北京)有限公司。
1.1.2 主要试剂Trizol试剂、FirstChoice? RLM-RACE Kit购自Invitrogen公司;限制性核酸内切酶Hind Ⅲ、XbaⅠ、T4 DNA Ligase、转染试剂Expifectamine CHO、补料培养基(OptiPRO SFM)和基础培养基ExpiCHO-S expression medium均购自Thermo公司;质粒提取试剂盒和琼脂糖凝胶回收试剂盒购自Omega公司;Protein L亲和层析凝胶购自GE公司;p52抗原购自Sigma公司,pp65抗原购自上海允麦生物科技有限公司;PCR引物均由生工生物工程(上海)股份有限公司合成。
1.1.3 仪器PCR仪(Thermo Fisher, Veriti Thermal Cycler);琼脂糖水平电泳仪(北京六一,DYCP-32B);台式离心机(Sigma,3-30K);超净工作台(苏净安泰,SW-CJ-2D);细胞摇床(科耐,ISF1-XC);细胞计数仪(上海睿钰生物,IC 1000);AKTA purifier (AKTA purifierTM UPC10);酶标仪(安图,LUMO型)。
1.2 方法1.2.1 杂交瘤细胞RNA提取与反转录收集5×106个生长状态良好的CMV 6#杂交瘤细胞。采用Trizol试剂一步法提取总RNA;取RNA (2 μL)用质量分数为2%琼脂糖凝胶电泳分析其完整性,同时用紫外分光光度计测定RNA的浓度。以其作为模板取5 μg,按照反转录试剂盒(RevertAid First Strand cDNA Synthesis Kit,Thermo)说明书操作,将反转录产物在?20 ℃保存。
1.2.2 引物设计与合成原始细胞株经鉴定为鼠源IgG1亚型(Isotyping Kit for Mouse Monoclonal Antibody北京义翘试剂盒),从NCBI中获得鼠IgG1亚型轻重链Fc段恒定区序列(LC028384.1与LC028385.1),设计能分别扩增重链与轻链可变区的下游内外引物(表 1)。
表 1 引物设计Table 1 Design of primer
| Primer name | Sequence (5′–3′) |
| 5′ RACE outer primer | GCTGATGGCGATGAATGAACACTG a |
| 5′ RACE inner primer | CGCGGATCCGAACACTGCGTTTGCTGGCTTTGATG a |
| 3′ RACE outer primer | GCGAGCACAGAATTAATACGACT a |
| 3′ RACE inner primer | CGCGGATCCGAATTAATACGACTCACTATAGG a |
| Gene specific-H outer primer | GACAGTCACTGAGCTGCTCAG b |
| Gene specific-H inner primer | GTGTGCACACCGCTGGACAGG b |
| Gene specific-L outer primer | GCTGTTATGTCGTTCATACTC b |
| Gene specific-L inner primer | CAGTCCAACTGTTCAGGACGC b |
| a: provided by the Kit. b: PCR primer design. | |
表选项
1.2.3 CMV 6#单抗含信号肽可变区基因的克隆使用RLM-RACE法联合巢氏PCR扩增目的片段。重链与轻链可变区基因反应条件:分别使用外引物(5′ RACE outer primer、Gene specific-H outer primer与Gene specific-L outer primer、3′ RACE outer primer) (表 1),94 ℃变性30 s,60 ℃退火30 s,72 ℃延伸30 s,共35个循环;分别以外引物的PCR产物为模板,使用内引物(5′ RACE inner primer、Gene specific-H inner primer与Gene specific-L inner primer、3′ RACE inner primer)进行PCR扩增,获得重/轻链可变区目的基因序列,反应条件同外引物一致。凝胶纯化回收目的片段,按DNA A-Tailing kit说明书加“A”尾,分别与pMD18-T载体连接,转化感受态大肠杆菌Top 10,阳性克隆经PCR鉴定后,各挑选5个进行测序,用VBASE软件进行比对分析。
1.2.4 人鼠嵌合CMV-IgM真核表达载体构建以1.2.3中阳性克隆的质粒为模板,分别使用引物SigF-F、Overlap-H-R和SigF-F、Overlap-L-R (表 2)扩增,获得带CMV 6#自身信号肽的轻重链可变区基因序列;与本实验室合成的人IgM重链恒定区编码序列(Overlap-H-F、H-R扩增获得)和人Kappa轻链恒定区编码序列的PCR产物(Overlap-L-F、L-R扩增获得)进行拼接,分别获得人鼠嵌合CMV-IgM基因的重链和轻链完整目的基因序列。用Hind Ⅲ和XbaⅠ对重/轻链目的基因及载体pCMV3进行酶切,并连接获得带自身信号肽的质粒CMV-MH-pCMV3和CMV-L- pCMV3 (图 1),送生工生物工程(上海)股份有限公司测序,验证目的基因正确性。
表 2 构建不同信号肽人鼠嵌合CMV-IgM的引物序列Table 2 Primer sequences for constructed human-mouse chimeric CMV-IgM with different signal peptides
| Primers | Sequence (5′–3′) |
| SigA-HF | cccAAGCTTATGTACCGCATGCAGCTGCTGTCCTGCATCGCGCTGAGCCTGGCGCTGGTTACCAACTCCGAGGTGCAACTGGTGGAGTCTG |
| SigA-LF | cccAAGCTTATGTACCGCATGCAGCTGCTGTCCTGCATCGCGCTGAGCCTGGCGCTGGTTACCAACTCCGACATTCTGATGACCCAGTCTC |
| SigB-HF | cccAAGCTTATGACTCGCCTGACGGTACTGGCACTGCTGGCAGGTCTGCTGGCATCCTCTCGTGCGGAGGTGCAACTGGTGGAGTCTG |
| SigB-LF | cccAAGCTTATGACTCGCCTGACGGTACTGGCACTGCTGGCAGGTCTGCTGGCATCCTCTCGTGCGGACATTCTGATGACCCAGTCTC |
| SigC-HF | cccAAGCTTATGGAGACTGACACGCTGCTGCTGTGGGTCCTGCTGCTGTGGGTACCAGGTAGCACTGGTGACGAGGTGCAACTGGTGGAGTCTG |
| SigC-LF | cccAAGCTTATGGAGACTGACACGCTGCTGCTGTGGGTCCTGCTGCTGTGGGTACCAGGTAGCACTGGTGACGACATTCTGATGACCCAGTCTC |
| SigD-HF | cccAAGCTTATGGATTGGACTTGGCGTGTATTCTGCCTGCTGGCTGTAACTCCAGGTGCTCACCCGGAGGTGCAACTGGTGGAGTCTG |
| SigD-LF | cccAAGCTTATGGATTGGACTTGGCGTGTATTCTGCCTGCTGGCTGTAACTCCAGGTGCTCACCCGGACATTCTGATGACCCAGTCTC |
| SigE-HF | cccAAGCTTATGGCACGTCCACTGTGTACGCTGCTGCTGCTGATGGCTACTCTGGCAGGTGCTCTGGCAGAGGTGCAACTGGTGGAGTCTG |
| SigE-LF | cccAAGCTTATGGCACGTCCACTGTGTACGCTGCTGCTGCTGATGGCTACTCTGGCAGGTGCTCTGGCAGACATTCTGATGACCCAGTCTC |
| SigF-F | cccAAGCTTATGAAGCTGCCTGTACGTCTG |
| Overlap-H-R | GTAGGGGCGCTGGCTGAGGAGACTGTGAGAGTGGTC |
| Overlap-H-F | CACAGTCTCCTCAGCCAGCGCCCCTACACTGTTTC |
| H-R | gcTCTAGATTATCAGTAGCAAGTTCCGGCTG |
| Overlap-L-R | CAGCCACCGTACGCCGTTTTATTTCCAGCTTGGTC |
| Overlap-L-F | GGAAATAAAACGGCGTACGGTGGCTGCACCATCTG |
| L-R | gcTCTAGATTACTAACACTCTCCCCTGTTG |
表选项
 |
| 图 1 人鼠嵌合CMV-IgM真核表达载体的构建 Fig. 1 Construction of human-mouse chimeric CMV-IgM expression vector. |
| 图选项 |
从已报道文献中选取高效表达外源蛋白质的5种分泌型信号肽序列(表 3),以构建好的CMV-MH-pCMV3为模板,分别利用引物Sig(A-E)-HF、H-R扩增目的基因,获得带有5种不同信号肽(A-E)的人鼠嵌合CMV-IgM重链基因序列。采用同样方法,以CMV-L-pCMV3为模板,分别利用引物Sig(A–E)-LF、L-R获得5′端带有不同信号肽的轻链目的基因;分别将带有不同信号肽的CMV-IgM重/轻链目的基因片段与载体pCMV3经Hind Ⅲ和XbaⅠ酶切,并连接获得带Sig(A–E)信号肽的人鼠嵌合CMV-IgM表达载体,将融合不同信号肽的目的基因进行测序,验证其正确性。
表 3 信号肽的氨基酸序列及来源Table 3 The amino acid sequence of signal peptide and its origin
| Signal peptides | Sequence | Source | GenBank number |
| A | MYRMQLLSCIALSLALVTNS | Human IL-2 | NP_000577.2 |
| B | MTRLTVLALLAGLLASSRA | Azurocidinpreproprotein | NP_001691 |
| C | METDTLLLWVLLLWVPGSTGD | Mouse Ig Kappa | / |
| D | MDWTWRVFCLLAVTPGAHP | Immunoglobulin heavy chain | AAA52897 |
| E | MARPLCTLLLLMATLAGALA | Cystatin-S precursor | NP_001890 |
| F | MKLPVRLLVLMFWIPASSS | Natural signal peptide | / |
表选项
1.2.5 细胞转染与表达瞬时转染前1 d,将Expi CHO细胞按照3×106 cells/mL密度接种于6个SF125摇瓶中,30 mL/瓶;按照ExpifectamineTM CHO转染试剂盒说明书稀释质粒DNA和脂质体(转染效率 > 90%),以1 μg:4 μL比例瞬时转染Expi CHO细胞,24 h后添加补料。培养9 d,细胞活力降至60%–70%左右,收获上清,进行纯化。具有同一种信号肽的轻重链重组质粒为一种组合,共表达6种蛋白(SigA–SigF)。此蛋白表达实验重复3次。
1.2.6 Protein L柱纯化与SDS-PAGE检测Protein L填料柱子用水和平衡缓冲液(0.02 mol/L PBS,pH 7.4)平衡后,6种不同信号肽的重组抗体细胞上清(SigA–SigF),分别经0.45 μm滤膜过滤后上样,上样后再次平衡,用解离缓冲液(0.1 mol/L柠檬酸钠,pH 2.3)洗脱蛋白,收集解离峰,使用超微量分光光度计来检测蛋白浓度,并通过SDS-PAGE、SEC-HPLC方法检测蛋白表达水平。
1.2.7 ELISA检测人鼠嵌合CMV-IgM的免疫反应性选择最佳信号肽分泌的目的蛋白进行ELISA监测。分别包被1 μg/mL检测抗原(p52、pp65),4 ℃孵育过夜;PBST洗涤4次后,用2% BSA于37 ℃封闭1 h;洗涤后加入初始浓度为100 μg/mL的CMV-IgM,以1/3梯度稀释,37 ℃孵育1 h;洗涤后加入HRP标记的羊抗人二抗,37 ℃孵育1 h;洗涤后加入TMB显色液显色10 min,加入终止液(H2SO4,2 mol/L),轻轻振荡用酶标仪读取OD450值。
2 结果与分析2.1 CMV 6#可变区序列分析及不同信号肽表达质粒的构建与鉴定采用RLM-RACE技术联合巢式PCR法扩增出含有抗体重、轻链可变区基因片段(VH与VL),琼脂糖凝胶电泳分析可见约350 bp的条带(图 2),大小与预期一致,经序列分析(表 4),重链可变区基因长度为336 bp,轻链可变区基因长度为342 bp;经鼠源可变区与人源恒定区(CH与CL) PCR拼接后,6种不同信号肽(可变区序列5′端)构建的人鼠嵌合CMV-IgM重链(1–6)和轻链片段(7–12)经琼脂糖凝胶电泳分析,可见约1 775 bp和750 bp大小的片段,均与预期一致(图 2)。经测序证实重组质粒构建正确。
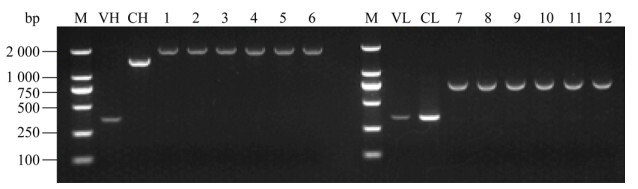 |
| 图 2 人鼠嵌合CMV-IgM基因凝胶电泳分析 Fig. 2 Gel electrophoretic profile of human-mouse chimeric antibody gene CMV-IgM. M: DNA marker; VH: variable region of heavy chain; CH: constant region of heavy chain; VL: variable region of light chain; CL: constant region of light chain; 1–6: the heavy chain fragment of SigA-SigF overlap PCR; 7–12: the light chain fragment of SigA-SigF overlap PCR. |
| 图选项 |
表 4 CMV 6#单抗可变区的序列Table 4 Sequences of CMV 6# monoclonal antibody variable region
| Variable region | Sequence of amino acid |
| Heavy chain variable region | EVQLQQSGPELVKPGASVKMSCKASGYTFTSYVMHWVKQKPGQGLEWIGYINPYNDGSKFNEKFKGKATLTSDKSSSTANMELSSLTSEDSAVYYCARGIYANGSSYWTAYWGQGTLVTVSA |
| Light chain variable region | DVVMTQTPLTLSVTIGQPASISCKSSQSLLDSDGKTYLNWLLQRPGQSPKRLIYLASKLDSGVPDRFTGSGSGTDFTLKISRVEAEDLGVYYCWQGTHFPQTFGGGTKLEIK |
表选项
2.2 细胞状态与蛋白表达量监测细胞转染后,隔天开始监测细胞密度与存活率(图 3A–B),结果显示:人鼠嵌合CMV-IgM转染Expi CHO细胞后,第1天细胞密度达到高峰期(9.6×106 cells/mL),随后细胞密度与存活率均开始逐步下降,第9天收获目的蛋白。经Protein L柱纯化后,根据蛋白纯度换算其表达量,结果表明:在本研究6种信号肽比较中,A信号肽引导CMV-IgM分泌的能力最强,自身信号肽F引导目的蛋白分泌的能力最弱,表达量最高相差6.72倍(图 3C)。
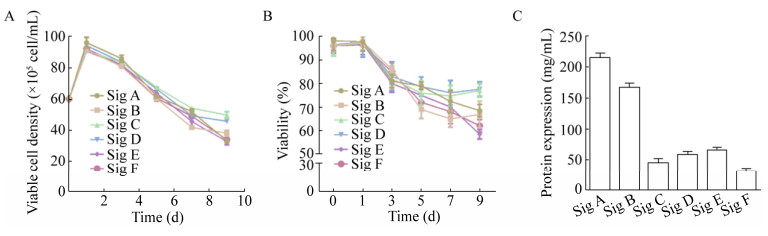 |
| 图 3 细胞状态与蛋白表达(A:活细胞密度;B:细胞存活率;C:各自信号肽分泌蛋白的表达量,n=3) Fig. 3 Overview of selected cells and protein expression (SigA–SigF). During the process all cultures were daily analyzed regarding their viable cell concentration (VCD). (A) Viable cell density. (B) Cell viability. (C) The respective expression mean value were calculated for signal peptide A–F (n=3). |
| 图选项 |
2.3 SDS-PAGE与SEC-HPLC检测蛋白纯度根据SDS-PAGE分析6种不同信号肽(SigA–SigF)分泌的抗体蛋白大小与纯度(图 4A–B),结果显示:目的蛋白CMV-IgM在还原剂(DTT)处理后胶图显示重链分子量大小为70 kDa左右,轻链分子量大小为25 kDa左右,与预期相符;经Image Lab软件对电泳图各泳道分析,不同信号肽(SigA–SigF)表达CMV-IgM的纯度(重轻链之和占泳道中总条带的比值)分别为93.1%、93.7%、93.1%、97.8%、98.5%、98.6% (图 4A)。非还原状态下,抗体蛋白均显示一条明显主带。在主带下方有少量次带存在;且不同信号肽分泌表达的蛋白构型无显著差异(图 4B)。选择CMV-IgM (SigA)经分子筛高效液相色谱法(SEC-HPLC)检测显示:纯化后的CMV-IgM蛋白在天然状态大多为聚体形式存在,大小在670 kDa与1 340 kDa之间,与预期相符;且存在少部分单体形式(大小在200 kDa左右) (图 4C)。
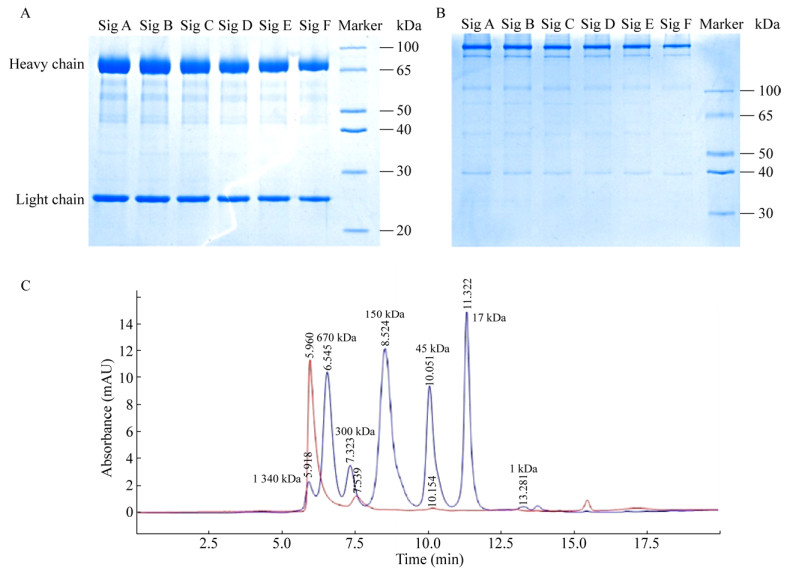 |
| 图 4 不同信号肽(SigA–SigF)纯化后CMV-IgM蛋白SDS-PAGE与SEC-HPLC分析 Fig. 4 SDS-PAGE and SEC-HPLC profile of purified CMV-IgM with SigA–SigF. (A) Reduced of samples. (B) Non-reduced of samples. (C) SEC-HPLC (red line: CMV-IgM sample, blue line: 1 340 kDa, 670 kDa, 300 kDa, 150 kDa, 45 kDa, 17 kDa, 1 kDa). |
| 图选项 |
2.4 ELISA检测CMV-IgM的免疫反应性分别用p52和pp65包被酶联板,使用最佳信号肽SigA分泌的抗体蛋白CMV-IgM-SigA通过ELISA进行检测,结果见图 5,CMV-IgM可以与p52和pp65结合。表明所制备的人鼠嵌合CMV-IgM具有良好的免疫反应性。
 |
| 图 5 ELISA鉴定Expi CHO表达的人鼠嵌合CMV-IgM Fig. 5 Identification of CMV-IgM antibody expressed by Expi CHO through ELISA. |
| 图选项 |
3 讨论CMV为巨细胞病毒,CMV-IgM为早期感染的重要指标,对新生儿的健康具有非常重要的意义[15],因此CMV-IgM的检测尤为重要。临床广泛采用的ELISA技术具有灵敏度高、特异性好、试剂稳定及成本低廉等优点[16]。因此表达CMV-IgM成了一个可行的策略,重组蛋白表达量的高低直接关系到后续诊断产业的研发乃至最终的经济效益及社会效益。本文研制的人鼠嵌合CMV-IgM,可作为酶联免疫检测试剂盒阳性对照品,利用捕获法来定性检测人血清或血浆中的CMV-IgM[17]。
传统的用于克隆抗体可变区基因的方法是用一组简并引物进行扩增[18],而抗体可变区基因高度可变,简并引物很难与所有的抗体可变区序列完全匹配,结果可能导致无法扩增或扩增出的序列发生突变。鉴于此,本研究采用RLM-RACE法钓取目的基因,不仅能扩增出目的基因可变区序列和信号肽序列,还能扩增出5′-UTR[19-21]。
IgM亚型抗体为五聚体,分子量较大,装配完全时理论大小在800–900 kDa,且一般为高度糖基化状态(每个亚基有5–6个潜在的糖基化位点)[22–23]。CHO细胞已被成功用于生产聚合IgM亚型抗体,但产量较低[24],给后续的纯化带来一定难度,因此需要通过其他策略来增加其表达量。研究表明,改造信号肽是一种有效增加重组蛋白表达量的方式[10]。信号肽序列辅助翻译的前体蛋白质进入内质网,蛋白质进入内质网中信号肽被切割,蛋白质分子进行加工修饰,成熟的蛋白质中不包含信号肽序列。信号肽对CHO细胞的生长状态、生长活率与外源基因的转录几乎没有影响,却明显改变了外源蛋白质在培养基中的分泌表达。据已有报道,选择不同的信号肽可以明显改善CHO中蛋白质的分泌[12]。本研究在制备人鼠嵌合CMV-IgM的同时,进一步研究信号肽优化对其表达分泌的影响。选择6种不同来源的信号肽序列(SigA–SigF)进行亚克隆构建并在CHO细胞中瞬时表达,结果表明,A信号肽融合到CMV-IgM基因的N端而构建的表达载体在CHO细胞中可以有效引导人鼠嵌合CMV-IgM释放到细胞外,通过各信号肽蛋白表达分泌结果显示,信号肽对抗体蛋白分泌表达的影响较大。综上所述,本研究制备人鼠嵌合CMV-IgM并初步探索信号肽对提升蛋白表达的影响,这对于作为质控品通过血清学研究判断人体对巨细胞病毒感染的免疫情况以及是否初次感染有着重要的意义。
参考文献
| [1] | Gerna G, Lilleri D. Human cytomegalovirus (HCMV) infection/re-infection: development of a protective HCMV vaccine. New Microbiol, 2019, 42(1): 1-20. |
| [2] | Goderis J, de Leenheer E, Smets K, et al. Hearing loss and congenital CMV infection: a systematic review. Pediatrics, 2014, 134(5): 972-982. DOI:10.1542/peds.2014-1173 |
| [3] | Williams EJ, Gray J, Luck S, et al. First estimates of the potential cost and cost saving of protecting childhood hearing from damage caused by congenital CMV infection. Arch Dis Child-Fetal, 2015, 100(6): F501-F506. DOI:10.1136/archdischild-2014-306756 |
| [4] | Drew RJ, Stapleton P, Abu H, et al. Pregnancy outcomes of mothers with detectable CMV-specific IgM antibodies: a three-year review in a large irish tertiary referral maternity hospital. Infect Dis Obstet Gynecol, 2015, 2015: 218080. |
| [5] | Prince HE, Lapé-Nixon M, Brenner A, et al. Potential impact of different cytomegalovirus (CMV) IgM assays on an algorithm requiring IgM reactivity as a criterion for measuring CMV IgG avidity. Clin Vaccine Immunol, 2014, 21(6): 813-816. DOI:10.1128/CVI.00106-14 |
| [6] | Kishishita S, Katayama S, Kodaira K, et al. Optimization of chemically defined feed media for monoclonal antibody production in Chinese hamster ovary cells. J Biosci Bioeng, 2015, 120(1): 78-84. DOI:10.1016/j.jbiosc.2014.11.022 |
| [7] | Ramezani A, Maymand EM, Yazdanpanah-Samani M, et al. Improving Pertuzumab production by gene optimization and proper signal peptide selection. Protein Expr Purif, 2017, 135: 24-32. DOI:10.1016/j.pep.2017.04.013 |
| [8] | Mori A, Hara S, Sugahara T, et al. Signal peptide optimization tool for the secretion of recombinant protein from Saccharomyces cerevisiae. J Biosci Bioeng, 2015, 120(5): 518-525. DOI:10.1016/j.jbiosc.2015.03.003 |
| [9] | Kober L, Zehe C, Bode J. Optimized signal peptides for the development of high expressing CHO cell lines. Biotechnol Bioeng, 2013, 110(4): 1164-1173. DOI:10.1002/bit.24776 |
| [10] | Knappskog S, Ravneberg H, Gjerdrum C, et al. The level of synthesis and secretion of Gaussia princeps luciferase in transfected CHO cells is heavily dependent on the choice of signal peptide. J Biotechnol, 2007, 128(4): 705-715. DOI:10.1016/j.jbiotec.2006.11.026 |
| [11] | Ebadat S, Ahmadi S, Ahmadi M, et al. Evaluating the efficiency of CHEF and CMV promoter with IRES and Furin/2A linker sequences for monoclonal antibody expression in CHO cells. PLoS ONE, 2017, 12(10): e0185967. DOI:10.1371/journal.pone.0185967 |
| [12] | Haryadi R, Ho S, Kok YJ, et al. Optimization of heavy chain and light chain signal peptides for high level expression of therapeutic antibodies in CHO cells. PLoS ONE, 2015, 10(2): e0116878. DOI:10.1371/journal.pone.0116878 |
| [13] | Chromikova V, Mader A, Steinfellner W, et al. Evaluating the bottlenecks of recombinant IgM production in mammalian cells. Cytotechnology, 2014, 67(2): 343-356. |
| [14] | Lombana TN, Dillon M, Bevers III J, et al. Optimizing antibody expression by using the naturally occurring framework diversity in a live bacterial antibody display system. Sci Rep, 2015, 5: 17488. DOI:10.1038/srep17488 |
| [15] | Boppana SB, Ross SA, Shimamura M, et al. Saliva polymerase-chain-reaction assay for cytomegalovirus screening in newborns. New Engl J Med, 2011, 364(22): 2111-2118. DOI:10.1056/NEJMoa1006561 |
| [16] | Zelini P, Fornara C, Furione M, et al. Determination of anti-p52 IgM and anti-gB IgG by ELISA as a novel diagnostic tool for detection of early and late phase of primary human cytomegalovirus infections during pregnancy. J Clin Virol, 2019, 120: 38-43. DOI:10.1016/j.jcv.2019.09.006 |
| [17] | De Carolis S, Tabacco S, Rizzo F, et al. Association between false-positive TORCH and antiphospholipid antibodies in healthy pregnant women. Lupus, 2017, 27(5): 841-846. |
| [18] | Coloma MJ, Hastings A, Wims LA, et al. Novel vectors for the expression of antibody molecules using variable regions generated by polymerase chain reaction. J Immunol Methods, 1992, 152(1): 89-104. DOI:10.1016/0022-1759(92)90092-8 |
| [19] | Liu XW, Gorovsky MA. Mapping the 5′ and 3′ ends of Tetrahymena thermophila mRNAs using RNA ligase mediated amplification of cDNA ends (RLM-RACE). Nucl Acid Res, 1993, 21(21): 4954-4960. DOI:10.1093/nar/21.21.4954 |
| [20] | Wang Chen, Fang Jinggui. RLM-RACE, PPM-RACE, and qRT-PCR: an integrated strategy to accurately validate miRNA target genes. Methods Mol Biol, 2015, 1296: 175-186. |
| [21] | Gibb Ewan A. Mapping free-standing homing endonuclease promoters using 5′RLM-RACE. Methods Mol Biol, 2014, 1123: 69-76. DOI:10.1007/978-1-62703-968-0_5 |
| [22] | Breen LD, Pu?i?-Bakovi? M, Vu?kovi? F, et al. IgG and IgM glycosylation patterns in patients undergoing image-guided tumor ablation. Biochim Biophys Acta, 2016, 1860(8): 1786-1794. DOI:10.1016/j.bbagen.2016.01.011 |
| [23] | Kumagai T, Palacios A, Casadevall A, et al. Serum IgM glycosylation associated with tuberculosis infection in mice. mSphere, 2019, 4(2): e00684-18. |
| [24] | Tchoudakova A, Hensel F, Murillo A, et al. High level expression of functional human IgMs in human PER. C6? cells. mAbs, 2009, 1(2): 163-171. DOI:10.4161/mabs.1.2.7945 |
