

1. 江南大学 食品科学与技术国家重点实验室,江苏 无锡 214122;
2. 江南大学 生物工程学院,江苏 无锡 214122;
3. 江南大学 工业生物技术教育部重点实验室,江苏 无锡 214122
收稿日期:2019-06-14;接收日期:2019-06-24
基金项目:江苏省科技支撑计划社会发展项目(No. BE2018623),广东省重点领域研发计划(No. 2019B020218001),国家轻工技术与工程一流学科自主课题(No. LITE2018-08)资助
摘要:L-2-氨基丁酸(L-ABA)是一种重要的化工原材料和手性医药中间体,为了实现L-ABA的高效生产,本研究在大肠杆菌Escherichia coli BL21 (DE3)中分别表达大肠杆菌来源的苏氨酸脱氨酶(Threonine deaminase,TD)、苏云金芽孢杆菌来源的亮氨酸脱氢酶(Leucine dehydrogenase,LDH)和博伊丁假丝酵母来源的甲酸脱氢酶(Formate dehydrogenase,FDH),构建体外级联酶催化反应实现L-苏氨酸向L-ABA的转化,体系中TD、LDH和FDH添加最适比例为1:1:0.2。为了简化生产工艺,将3种酶在一株菌E. coli 3FT+L中共表达并实现上述配比,在30 L发酵罐中用E. coli 3FT+L全细胞转化12 h,L-ABA的产量为68.5 g/L,底物L-苏氨酸的摩尔转化率达到99.0%。该工艺路线绿色高效,为未来大规模生产L-ABA提供借鉴。
关键词:L-2-氨基丁酸三酶级联共表达重组菌全细胞转化L-苏氨酸
Production of L-2-aminobutyric acid from L-threonine using a trienzyme cascade
Yan Fu1,2, Junxuan Zhang1,2, Xuerong Fu1,2, Yuchen Xie1,2, Hongyu Ren1,2, Jia Liu1, Xiulai Chen1, Liming Liu1,2,3


1. State Key Laboratory of Food Science & Technology, Jiangnan University, Wuxi 214122, Jiangsu, China;
2. School of Biotechnology, Jiangnan University, Wuxi 214122, Jiangsu, China;
3. Key Laboratory of Industrial Biotechnology, Ministry of Education, Jiangnan University, Wuxi 214122, Jiangsu, China
Received: June 14, 2019; Accepted: June 24, 2019
Supported by: The Key Technologies R & D Program of Jiangsu Province (No. BE2018623), The Key Field R & D Program of Guangdong Province (No. 2019B020218001), The National First-class Discipline Program of Light Industry Technology and Engineering (No. LITE2018-08)
Corresponding author: Liming Liu. Tel/Fax: +86-510-85197875; E-mail: mingll@jiangnan.edu.cn.
Abstract: L-2-aminobutyric acid (L-ABA) is an important chemical raw material and chiral pharmaceutical intermediate. The aim of this study was to develop an efficient method for L-ABA production from L-threonine using a trienzyme cascade route with Threonine deaminase (TD) from Escherichia. coli, Leucine dehydrogenase (LDH) from Bacillus thuringiensis and Formate dehydrogenase (FDH) from Candida boidinii. In order to simplify the production process, the activity ratio of TD, LDH and FDH was 1:1:0.2 after combining different activity ratios in the system in vitro. The above ratio was achieved in the recombinant strain E. coli 3FT+L. Moreover, the transformation conditions were optimized. Finally, we achieved L-ABA production of 68.5 g/L with a conversion rate of 99.0% for 12 h in a 30-L bioreactor by whole-cell catalyst. The environmentally safe and efficient process route represents a promising strategy for large-scale L-ABA production in the future.
Keywords: L-2-aminobutyric acidtrienzyme cascadeco-expressed recombinant bacteriawhole-cell catalystL-threonine
L-2-氨基丁酸(L-ABA)作为一种非天然氨基酸和重要的医药中间体,广泛应用于药物合成领域,如抑菌抗结核药物盐酸乙胺丁醇[1-2]、新型抗癫痫药物左乙拉西坦和布瓦西坦[3]等。L-ABA合成方法包括化学法和生物法。化学法主要采用酮丁酸还原法[4]、脱硫反应法[5]、卤代氨解法[6-7]、化学拆分法[8],但缺点是易形成消旋体,不利于手性化合物的合成,且反应条件严苛、环境污染严重、不易进行工业化生产。生物法因反应条件温和、立体选择性高和绿色环保等特点而广受关注,其中生物发酵法是对生产L-苏氨酸的大肠杆菌Escherichia coli进行代谢改造,在含有30 g/L葡萄糖的培养基中合成5.4 g/L的L-ABA[9]。另一方法是生物酶催化法,包括腈水解酶法、转氨酶法和氨基酸脱氢酶法等。腈水解酶法是以DL-氨基丁腈为底物,直接水解L-氨基丁腈获得L-ABA,或通过腈水合酶结合L-氨基酸酰胺酶将L-氨基丁腈转化成L-ABA[10]。转氨酶法是以2-酮丁酸(2-OBA)及提供氨基供体的L-天冬氨酸或L-谷氨酸等为底物,通过氨基转移酶或者氨基酸脱氢酶制备L-ABA,这一方法缺点是副产物草酰乙酸容易脱羧得到丙酮酸,进而生成副产物L-丙氨酸,不利于后续分离纯化[11-12]。L-氨基酸脱氢酶法是借助于中间型高温放线菌Thermoactinomyces intermedius的亮氨酸脱氢酶(LDH)将2-OBA转化为36 g/L L-ABA,产率达到88%[12]。但由于2-OBA成本高且不稳定,因此,研究人员利用苏氨酸脱氨酶(TD)将较为廉价的L-苏氨酸转化为生产2-OBA,在此基础上通过过量表达LDH和辅酶NADH再生用酶甲酸脱氢酶(FDH),高效制备L-ABA。如Tao等[13]在E. coli BL21 (DE3)中分别过表达TD、LDH、FDH,转化体系中需要同时添加3种湿菌体,采用“一锅法”在30 L转化体系中将30 mol L-苏氨酸转化为29.2 mol L-ABA,产率为97.3%。
脱氢酶法具有底物成本低廉和反应不可逆等优点,但是上述研究的催化体系中通常需要添加多种酶液,并进行酶活优化配比[12-13],增加了工艺的复杂性和生产成本,若将TD、LDH和FDH这3种酶在单一细胞中表达,可以简化生产工艺便于对反应条件进行精确调整和优化。本研究利用TD、LDH和FDH构建了体外催化L-苏氨酸生产L-ABA的级联路径,在E. coli BL21中对3种酶共表达方式进行优化,构建了重组菌株E. coli 3FT+L,实现三酶的协调稳定表达,并对转化体系进行优化,最终实现了L-ABA的高效生产。
1 材料与方法1.1 材料1.1.1 菌株和质粒本研究使用的质粒pET28a、pETDuet、pRSFDuet均购自Novagen公司,使用的菌株见表 1。
表 1 本文所用的菌株Table 1 Strains used in this work
| Strains | Relevant characteristics | References |
| E. coli BL21(DE3) | F- ompT hsdSB (rB- mB-) gal dcm (DE3) | Novagen |
| BL21-BsTD | E. coli BL21 (DE3)(pET28a-BsilvA) | This study |
| BL21-CgTD | E. coli BL21 (DE3)(pET28a-CgilvA) | This study |
| BL21-EcTD | E. coli BL21 (DE3)(pET28a-EcilvA) | This study |
| BL21-BtLDH | E. coli BL21 (DE3)(pET28a-BtleuB) | This study |
| BL21-BsLDH | E. coli BL21 (DE3)(pET28a-BsleuB) | This study |
| BL21-BlLDH | E. coli BL21 (DE3)(pET28a-Blldh) | This study |
| BL21-MtLDH | E. coli BL21 (DE3)(pET28a-MtleuB) | This study |
| BL21-TiLDH | E. coli BL21 (DE3)(pET28a-Tildh) | This study |
| BL21-CbFDH | E. coli BL21 (DE3)(pET28a-Cbfdh) | This study |
| E. coli FT+L | E. coli BL21 (DE3) (pRSFDuet-BtleuB +pETDuet-fdh-EcilvA) | This study |
| E. coli 2FT+L | E. coli BL21 (DE3) (pRSFDuet-BtleuB +pETDuet-fdh-fdh-EcilvA) | This study |
| E. coli 3FT+L | E. coli BL21 (DE3) (pRSFDuet-BtleuB +pETDuet-fdh-fdh-fdh-EcilvA) | This study |
| E. coli 4FT+L | E. coli BL21 (DE3) (pRSFDuet-BtleuB +pETDuet-fdh-fdh-fdh-fdh-EcilvA) | This study |
表选项
1.1.2 实验试剂分子生物学工具酶、SDS-PAGE Protein Marker、质粒提取试剂盒、胶回收试剂盒等分子生物学试剂购自TaKaRa有限公司;2-OBA和L-ABA标准品购自Sigma公司;异丙基-β-D-硫代半乳糖(IPTG)、硫酸卡那霉素(Kan)、氨苄青霉素(Amp)购自生工生物工程(上海)股份有限公司;其余常规试剂购自国药集团。
1.2 方法1.2.1 重组菌株的构建使用特异性引物分别从不同微生物中克隆编码TD、LDH和FDH的目的基因,限制内切酶双酶切目的条带,然后连接于同样双酶切的表达载体pET28a获得重组质粒,将构建完成质粒导入E. coli BL21 (DE3)后获得基因工程菌株。
构建共表达菌株时,从苏云金芽孢杆菌Bacillus thuringiensis基因组中克隆编码LDH的基因leuB,连接于高拷贝质粒pRSFDuet,构建重组质粒pRSFDuet-BtleuB;将博伊丁假丝酵母Candida boidinii来源的fdh基因连接于pETDuet,构建重组质粒pETDuet-Cbfdh,从E. coli K12基因组中克隆编码TD的基因ilvA连接于质粒pETDuet-fdh,构建重组质粒pETDuet-fdh-EcilvA,将上述两种重组质粒导入E. coli BL21 (DE3),在含有Amp和Kan的平板上筛选阳性克隆,得到双质粒共表达菌株E. coli FT+L。
E. coli FT+L菌株中重复表达fdh基因,即在pETDuet-fdh-EcilvA质粒上分别通过一步克隆试剂盒连接不同个数的fdh基因构建质粒pETDuet- 2fdh-EcilvA、pETDuet-3fdh-EcilvA和pETDuet- 4fdh-EcilvA。
1.2.2 培养基与培养方法LB培养基:胰蛋白胨10 g/L,酵母粉5 g/L,NaCl 10 g/L,用于质粒的构建、扩增和种子液的培养。
TB培养基:甘油4 g/L,胰蛋白胨12 g/L,酵母粉24 g/L,KH2PO4 2.31 g/L,K2HPO4 12.54 g/L,用于重组菌株发酵培养。
补料培养基:甘油500 g/L,MgSO4·7H2O 30 g/L。
种子培养条件:从斜面保藏培养基中接一环菌种至25 mL LB培养基中,根据重组菌选择压力添加100 μg/mL Kan或Amp,37 ℃、200 r/min振荡培养10 h。
摇瓶培养与诱导条件:取1 mL的种子培养液接种于25 mL TB培养基中,根据重组菌选择压力添加100 mg/L Kan或Amp,37 ℃、200 r/min培养OD600至0.6时,添加100 mg/L的IPTG于25 ℃下诱导8–12 h。
发酵罐培养与诱导条件:将种子液按照5%接种量转接于发酵罐,初始发酵温度37 ℃、500 r/min下培养至OD600为12–14时,溶氧突然上升,此时开始流加补料培养基,通过补料控制溶氧水平在30%–40%,当OD600在25左右时,添加5 g/L的乳糖于25 ℃下诱导,总发酵周期24 h,发酵结束后发酵液经4 ℃离心收集菌体。
1.2.3 共表达重组菌转化条件250 mL摇瓶转化条件优化:转速为200 r/min,温度为30 ℃,根据不同条件添加不同酶活TD、LDH、FDH,不同浓度的L-苏氨酸,甲酸铵与苏氨酸摩尔浓度比为1:1,NAD+ 30 mg/L,使用20 mmol/L磷酸盐缓冲液(pH 7.5)定容至20 mL。
30 L发酵罐全细胞转化条件:搅拌转速400 r/min,通气量15 L/min,温度37 ℃,用4 mol/L NaOH溶液控制pH 8.0,湿菌体20 g/L,L-苏氨酸80 g/L,甲酸铵与苏氨酸摩尔浓度比为1:1,NAD+为30 mg/L,反应体积为15 L。
1.2.4 酶活测定单酶表达重组菌株使用冻干菌体或纯酶检测酶活。共表达菌株超声破碎细胞,离心取上清液检测粗酶液酶活。TD、LDH、FDH的酶活性测定参考文献报道[14-16]。
1.2.5 检测方法高效液相色谱法检测L-Thr、2-OBA和L-ABA浓度[13-14]。
2 结果与分析2.1 L-苏氨酸合成L-ABA的级联反应设计与体外构建如图 1所示,L-苏氨酸转化生产L-ABA的反应分为两步:第一步是利用L-苏氨酸脱氨酶(L-threonine deaminase,TD,EC 4.3.1.19)将L-苏氨酸脱去羟基和氨基转化为2-OBA;第二步反应利用亮氨酸脱氢酶(Leucine dehydrogenase, LDH, EC1.4.1.9)将2-OBA的羰基不对称还原为氨基生成L-ABA。由于第二步是氧化还原反应,需要辅酶NADH参与,因此在设计级联反应时需要偶联辅酶再生系统。
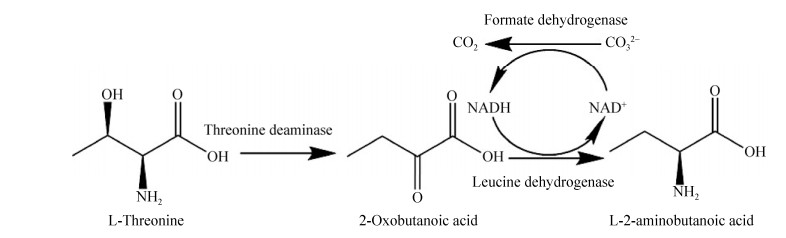 |
| 图 1 L-苏氨酸合成L-ABA级联反应的设计[13] Fig. 1 Cascade catalyzed for synthesis L-ABA from L-Thr[13]. |
| 图选项 |
通过Brenda数据库(https://www.brenda-enzymes.org/),选取来源于枯草芽孢杆菌Bacillus subtilis、谷氨酸棒杆菌Corynebacterium glutamicum和E. coli K12的TD,因其具有较高的比酶活[17],将3种酶基因克隆表达于E. coli BL21中,构建获得重组菌株BL21-BsTD、BL21-CgTD和BL21-EcTD。摇瓶发酵14 h收集湿菌体冷冻干燥,测定不同来源的TD对L-苏氨酸活性,BL21- BsTD、BL21-CgTD和BL21-EcTD的冻干细胞对L-苏氨酸的比活力分别为2.04、3.21 U/mg、15.8 U/mg,因此选择来源于E. coli的EcTD用于第一步转化反应。采用类似的策略,将来源于B. thuringiensis、B. subtilis、地衣芽孢杆菌Bacillus licheniformis、热醋穆尔氏菌Moorella thermoacetica、T. intermedius的亮氨酸脱氢酶LDH[12, 18],分别克隆表达于E. coli BL21构建重组菌株BL21-BtLDH、BL21-BsLDH、BL21-BlLDH、BL21-MtLDH、BL21-TiLDH。摇瓶发酵14 h收集湿菌体冷冻干燥,测定不同菌株的LDH对2-OBA的酶活,其中BL21-BsLDH和BL21-BlLDH对2-OBA无催化活性,BL21-BtLDH、BL21-MtLDH和BL21-TiLDH的冻干细胞对2-OBA比活力分别为1.56、0.28、1.01 U/mg,因此选择B. thuringiensis来源的BtLDH用于第二步转化。由于C. boidinii来源的CbFDH具有广泛的工业应用潜力[19-20],因此在E. coli BL21(DE3)中表达C. boidinii来源fdh构建重组菌BL21-CbFDH,比活力为1.38 U/mg。
使用镍柱将EcTD、BtLDH和CbFDH进行蛋白质纯化(图 2A),将纯化所获得的纯酶添加到5 mL的体外转化体系中,添加10 g/L底物L-苏氨酸,采用LC-MS结构鉴定转化液中是否催化合成了L-ABA,对转化液中产物进行检测,L-ABA分子量为103.1,使用阴离子色谱检测分子量为102.05 (图 2B),证明获得目标产物L-ABA,说明采用EcTD、BtLDH和CbFDH级联催化L-苏氨酸生成L-ABA是可行的。为了获得更高的转化率,对体外转化体系的3种酶的浓度及其配比进行优化。L-苏氨酸浓度为50 g/L,固定EcTD酶活为12 U/mL,优化EcTD与BtLDH酶活比例,结果如图 2C所示,在EcTD与BtLDH酶活比为1.0:1–2.0:1时,L-ABA产量((40.7±0.2) g/L)和摩尔转化率(94.0%±0.5%)达到较高水平。固定EcTD与BtLDH酶活比为1:1 (固定LDH酶活为12 U/mL),体系中添加BtLDH与CbFDH酶活比为1:0.05–1:0.3,结果如图 2D所示。当酶活比例为1:0.2–1:0.3时,L-ABA产量达到40.0 g/L以上,当低于该比例时,L-ABA产量和摩尔转化率均下降,说明体系中FDH酶活至少达到LDH的20%及以上,才能够保证提供充足的辅酶NADH。因此确定EcTD、BtLDH和CbFDH最佳比例为1:1:0.2,此时酶添加量最低且能够保证L-苏氨酸高效转化。
 |
| 图 2 体外催化TD、LDH和FDH酶活比例优化 Fig. 2 Optimization of activity ratio of EcTD/BtLDH and BtLDH/CbFDH in vitro. (A) SDS-PAGE analysis of purified protein. (B) Analysis of the product with LC-MS. (C) Effect of different activity ratios of EcTD/BtLDH on L-ABA production. (D) Effect of different activity ratios of BtLDH/CbFDH on L-ABA production. |
| 图选项 |
2.2 三酶级联菌株的构建与优化为了进一步简化工艺,将EcTD、BtLDH和CbFDH在E. coli BL21(DE3)中共表达,使用pRSFDuet质粒连接BtleuB,质粒pETDuet将fdh与EcilvA串联表达,构建重组菌株E. coli FT+L,菌体破碎后进行蛋白电泳验证,结果如图 3A所示。EcTD、BtLDH和CbFDH理论蛋白分子量分别为56.2、39.8、40.4 kDa,目的蛋白条带大小符合预期,由于BtLDH和CbFDH蛋白分子量相近,出现重叠条带。对重组菌E. coli FT+L的催化性能进行评价,在20 mL体系中添加L-苏氨酸10– 50 g/L,底物与湿菌体质量比为2.5:1。当L-苏氨酸浓度从10增加至50 g/L时,摩尔转化率从95.0%降至45.2%,而中间产物2-OBA浓度从0.43 g/L上升至25.8 g/L (图 3B)。其原因是3种酶的酶活不均衡导致2-OBA无法持续转化为L-ABA,进一步测定湿细胞中3种酶的酶活,在E. coli FT+L湿细胞中,EcTD、BtLDH和CbFDH酶活分别为1508.8、885.0、117.1 U/g,酶活比为1.7:1:0.13,与体外最佳比例为1:1:0.2不符,CbFDH酶活偏低导致NADH再生效率低下,转化通路不平衡,导致中间产物出现积累,因此对E. coli FT+L进行表达水平优化。
 |
| 图 3 重组菌株E. coli FT+L的构建与转化效果评价 Fig. 3 Construction of E. coli FT+L. (A) SDS-PAGE analysis of strain E. coli FT+L from cell-free extracts. (B) Effect of substrate concentration on L-ABA production by strain E. coli FT+L. |
| 图选项 |
重复表达目标基因可以显著提高目标酶的酶活[21-22],在E. coli FT+L中重复表达fdh基因2–4次获得重组菌株E. coli 2FT+L、E. coli 3FT+L和E. coli 4FT+L,蛋白电泳图谱如图 4所示,表达的目的蛋白条带大小与理论值一致,菌株构建成功。检测E. coli FT+L、E. coli 2FT+L、E. coli 3FT+L和E. coli 4FT+L湿菌体中EcTD、BtLDH和CbFDH酶活,结果如图 5A所示。随着fdh 重复次数的增加,CbFDH酶活从117.1 U/g分别上升至164.6、179.0、191.9 U/g,EcTD酶活从1 508.8 U/g分别下降至1 158.0、855.9、706.3 U/g,BtLDH酶活呈略微下降的趋势。结果显示,E. coli 3FT+L中EcTD、BtLDH和CbFDH酶活比接近1:1:0.2。以E. coli 3FT+L为催化剂,L-ABA产量达到42.4 g/L,摩尔转化率达到98.0%,质量转化率为84.8%,未检测到L-Thr积累,2-OBA残留仅0.23 g/L(图 5B),表明反应体系中辅酶NADH供应正常,3种酶实现均衡协调表达。
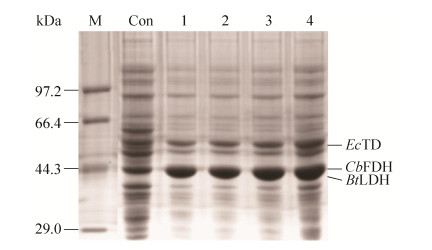 |
| 图 4 fdh重复表达菌株的SDS-PAGE分析 Fig. 4 SDS-PAGE analysis of recombinant strains with fdh gene duplicated for different copies. Lane M: marker; lane Con: control E. coli BL21 (DE3); lane 1–4: recombination strain E. coli FT+L, E. coli 2FT+L, E. coli 3FT+L, E. coli 4FT+L. |
| 图选项 |
 |
| 图 5 fdh基因重复表达菌株酶活检测与转化效果评价 Fig. 5 Optimization of co-expressed strain in the activity ratio of EcTD/BtLDH/CbFDH in vivo. (A) The assay of enzymes activity in recombinant strains with fdh gene duplicated for different copies. (B) Effect of different fdh copies on L-ABA production. |
| 图选项 |
2.3 5 L发酵罐上E. coli 3FT+L生产L-ABA条件优化为了进一步提高L-ABA的生产效率,5 L发酵罐上对转化条件进行优化。固定湿菌体质量为25 g/L,不同L-苏氨酸浓度(70–90 g/L)对L-ABA生产的影响如图 6A所示。当苏氨酸浓度达到80 g/L时,L-ABA产量达到最高为62.6 g/L,摩尔转化率为90.4%,继续增加L-苏氨酸的浓度,L-ABA产量不再增加。在此基础上,固定L-苏氨酸浓度为80 g/L,不同湿菌体浓度(15–35 g/L)对L-ABA生产的影响如图 6B所示。当添加湿菌体为20 g/L时,L-ABA产量达到63.7 g/L,摩尔转化率为92.0%,继续增加湿菌体质量,L-ABA产量也不增加。
 |
| 图 6 L-苏氨酸和菌体浓度对L-ABA产量及转化率的影响 Fig. 6 Effect of mass ratio of L-Thr (A) and wet cell weight (B) on L-ABA production. |
| 图选项 |
考察不同温度对E. coli 3FT+L全细胞级联催化性能的影响,在E. coli 3FT+L湿菌体20 g/L、L-苏氨酸80 g/L时,研究不同转化温度(25–45 ℃)对L-ABA生产的影响,当转化最适温度为37 ℃,16 h时摩尔转化率达到96.5%;当转化温度低于37 ℃,转化周期延长至22 h以上;当转化温度为45 ℃时,摩尔转化率只能达到88.2% (图 7A)。于是在37 ℃下考察不同pH对全细胞转化生产L-ABA的影响,在pH 7.0–8.5范围内,L-ABA摩尔转化率均能达到95.0%以上,在最适pH为8.0时转化周期最短为14 h,L-ABA摩尔转化率达到98.2% (图 7B)。
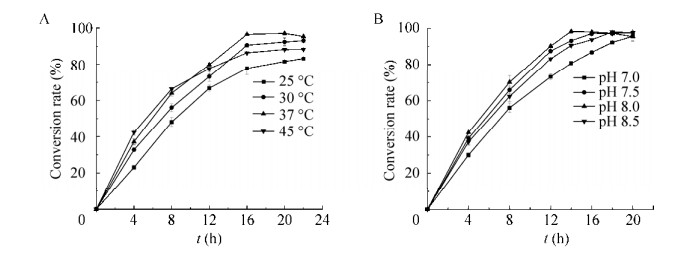 |
| 图 7 温度和pH对转化反应的影响 Fig. 7 Effect of reaction temperature (A) and pH (B) on the whole-cell catalyst. |
| 图选项 |
2.4 30 L发酵罐规模化生产L-ABA在30 L发酵罐上采用分批补料的方式培养E. coli 3FT+L,随着菌体浓度不断增加,酶活不断提高,发酵24 h湿菌体浓度达到105.9 g/L,此时发酵液中EcTD、BtLDH和CbFDH的酶活分别达到114.7、101.0、22.3 U/mL (图 8A),EcTD、BtLDH和CbFDH酶活比为1:1:0.2。
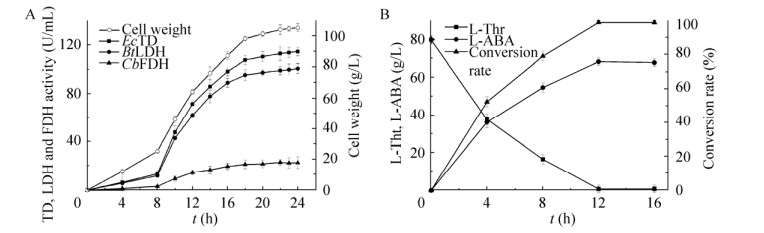 |
| 图 8 E. coli 3FT+L高密度发酵与转化生产L-ABA Fig. 8 High density fermentation process of E. coli 3FT+L (A) and whole-cell catalyst production of L-ABA (B). |
| 图选项 |
30 L发酵罐中转化体积为15 L,E. coli 3FT+L湿菌体20 g/L,L-苏氨酸80 g/L,温度37 ℃,使用NaOH调节pH为8.0,随着转化时间的增加,L-ABA逐渐积累,当12 h时L-ABA产量最高达到68.5 g/L,摩尔转化率达到99.0%,质量转化率达到85.6%,L-ABA生产速率为5.71 g/(L·h) (图 8B)。
3 结论利用TD、LDH和FDH三酶级联转化L-苏氨酸生产L-ABA,目前存在辅因子NADH再生用酶的效率较低、多酶催化的转化速率协同性差、需要培养多种基因工程菌使成本高等问题。针对上述问题,本研究开发了一种高效简约制备L-ABA工艺路线,采用一次性投料,转化体系中添加单一细胞E. coli 3FT+L 20 g/L,转化12 h,L-ABA产量达到68.5 g/L,摩尔转化率达99.0%,为后续酶法规模化生产L-ABA奠定一定的理论基础。
参考文献
| [1] | Goncalves RSB, da Silva ET, de Souza N, et al. An environmentally friendly, scalable and highly efficient synthesis of (S, S)-ethambutol, a first line drug against tuberculosis. Lett Org Chem, 2015, 12(7): 478-481. DOI:10.2174/1570178612666150521235908 |
| [2] | Bai GY, Chen LG, Xing P, et al. Synthesis of ethambutol. Fine Chem, 2004, 21(12): 943-945, 949 (in Chinese). 白国义, 陈立功, 邢鹏, 等. 乙胺丁醇的合成. 精细化工, 2004, 21(12): 943-945, 949. DOI:10.3321/j.issn:1003-5214.2004.12.018 |
| [3] | Shin JS, Kim BG. Transaminase-catalyzed asymmetric synthesis of L-2-aminobutyric acid from achiral reactants. Biotechnol Lett, 2009, 31(10): 1595-1599. DOI:10.1007/s10529-009-0057-7 |
| [4] | Fujii C, Yasui M, Ishimathu Y. Process for production of (+)-2-amino-1-butanol: US, 3979457, 1976-09-07. |
| [5] | Zhou XB, Xu GY, Zhou Y, et al. Synthesis of anticonvulsant drug levetiracetam. Fine Chem Intermed, 2005, 35(2): 27-28 (in Chinese). 周先波, 徐广宇, 周伊, 等. 抗癫痫治疗药物左乙拉西坦的合成研究. 精细化工中间体, 2005, 35(2): 27-28. DOI:10.3969/j.issn.1009-9212.2005.02.008 |
| [6] | Yin XQ, Sun F, Ge SX. Development of synthesis of α-aminobutyric acid. Fine Chem Intermed, 2010, 40(1): 12-14 (in Chinese). 尹先清, 孙芳, 葛胜祥. α-氨基丁酸化学合成研究进展. 精细化工中间体, 2010, 40(1): 12-14. |
| [7] | Jeffery EA, Meisters A. Electrochemical synthesis of amino acids by reductive amination of keto acids. Ⅰ. Reduction at mercury electrodes. Aust J Chem, 1978, 31(1): 73-78. DOI:10.1071/CH9780073 |
| [8] | Synoradzki L, Ru?kowski P, Berna? U. Tartaric acid and its O-acyl derivatives. Part 1. Synthesis of tartaric acid and O-acyl tartaric acids and anhydrides. Org Prep Proced Int, 2005, 37(1): 37-63. DOI:10.1080/00304940509355401 |
| [9] | Zhang KC, Li H, Cho KM, et al. Expanding metabolism for total biosynthesis of the nonnatural amino acid L-homoalanine. Proc Natl Acad Sci USA, 2010, 107(14): 6234-6239. DOI:10.1073/pnas.0912903107 |
| [10] | Fotheringham IG, Grinter N, Pantaleone DP, et al. Engineering of a novel biochemical pathway for the biosynthesis of L-2-aminobutyric acid in Escherichia coli K12. Bioorgan Med Chem, 1999, 7(10): 2209-2213. DOI:10.1016/S0968-0896(99)00153-4 |
| [11] | Li T, Kootstra AB, Fotheringham IG. Nonproteinogenic α-amino acid preparation using equilibrium shifted transamination. Orga Proc Res Dev, 2002, 6(4): 533-538. DOI:10.1021/op025518x |
| [12] | Galkin A, Kulakova L, Yoshimura T, et al. Synthesis of optically active amino acids from alpha-keto acids with Escherichia coli cells expressing heterologous genes. Appl Environ Microbiol, 1997, 63(12): 4651-4656. DOI:10.1128/AEM.63.12.4651-4656.1997 |
| [13] | Tao RS, Jiang Y, Zhu FY, et al. A one-pot system for production of L-2-aminobutyric acid from L-threonine by L-threonine deaminase and a NADH-regeneration system based on L-leucine dehydrogenase and formate dehydrogenase. Biotechol Lett, 2013, 36(4): 835-841. |
| [14] | Umbarger HE, Brown B. Threonine deamination in Escherichia coli. Ⅱ. Evidence for two L-threonine deaminases. J Bacteriol, 1957, 73(1): 105-112. DOI:10.1128/JB.73.1.105-112.1957 |
| [15] | Ansorge MB, Kula MR. Production of recombinant L-leucine dehydrogenase from Bacillus cereus in pilot scale using the runaway replication system E. coli[piet98]. Biotechnol Bioeng, 2000, 68(5): 557-562. DOI:10.1002/(SICI)1097-0290(20000605)68:5<557::AID-BIT10>3.0.CO;2-J |
| [16] | Berríos-Rivera SJ, Bennett GN, San KY. Metabolic engineering of Escherichia coli: increase of NADH availability by overexpressing an NAD+-dependent formate dehydrogenase. Metab Eng, 2002, 4(3): 217-229. DOI:10.1006/mben.2002.0227 |
| [17] | Yu XF, Li Y, Wang XY. Molecular evolution of threonine dehydratase in bacteria. PLoS ONE, 2013, 8(12): e80750. DOI:10.1371/journal.pone.0080750 |
| [18] | Song W, Wang JH, Wu J, et al. Asymmetric assembly of high-value α-functionalized organic acids using a biocatalytic chiral-group-resetting process. Nat Commun, 2018, 9: 3818. DOI:10.1038/s41467-018-06241-x |
| [19] | Zhang C, Xing XH. Research progress in cofactor regeneration systems. Chin J Biotech, 2004, 20(6): 811-816 (in Chinese). 张翀, 邢新会. 辅酶再生体系的研究进展. 生物工程学报, 2004, 20(6): 811-816. DOI:10.3321/j.issn:1000-3061.2004.06.001 |
| [20] | Zhao HM, van der Donk WA. Regeneration of cofactors for use in biocatalysis. Curr Opin Biotechnol, 2003, 14(6): 583-589. DOI:10.1016/j.copbio.2003.09.007 |
| [21] | Hepworth LJ, France SP, Hussain S, et al. Enzyme cascades in whole cells for the synthesis of chiral cyclic amines. ACS Catal, 2017, 7(4): 2920-2925. DOI:10.1021/acscatal.7b00513 |
| [22] | Qian YY, Liu J, Song W, et al. Production of β-alanine from fumaric acid using a dual-enzyme cascade. ChemCatChem, 2018, 10(21): 4984-4991. DOI:10.1002/cctc.201801050 |
