
 , 张晓梅4, 史劲松4, 许正宏1,2,3
, 张晓梅4, 史劲松4, 许正宏1,2,3 1. 江南大学 工业生物技术教育部重点实验室,江苏 无锡 214122;
2. 江南大学 粮食发酵与工艺技术国家工程实验室,江苏 无锡 214122;
3. 江南大学 生物工程学院,江苏 无锡 214122;
4. 江南大学 药学院,江苏 无锡 214122
收稿日期:2019-02-22;接收日期:2019-07-02;网络出版时间:2019-12-11
基金项目:轻工技术与工程国际一流学科建设项目(No. LITE2018-11),高等学校学科创新引智计划(No. 111-2-06),江南大学合成生物系统与生物智造国际联合实验室项目,江苏省六大人才高峰项目(No. 2015-SWYY-006),江苏高校品牌专业建设工程项目(TAPP)资助
通讯作者:Guoqiang Xu. Tel: +86-510-85327353; E-mail: xuguoqiang@jiangnan.edu.cn.
摘要:γ-聚谷氨酸在食品、化妆品、生物医药等领域具有广泛的应用,目前主要的生产菌株是谷氨酸依赖型菌株,在生产过程中需要添加谷氨酸作为前体,因而生产γ-聚谷氨酸的成本较高。文中主要研究从糖质原料一步法发酵合成γ-聚谷氨酸的生产工艺。首先,从产γ-聚谷氨酸的菌株枯草芽孢杆菌中克隆γ-聚谷氨酸合成酶的基因簇pgsBCA,在谷氨酸棒杆菌模式菌株ATCC13032中进行诱导型和组成型表达,结果显示,仅诱导型表达菌株可以积累γ-聚谷氨酸,产量为1.43 g/L。进一步对诱导条件进行优化,确定诱导时间为2 h,IPTG浓度为0.8 mmol/L,γ-聚谷氨酸产量为1.98 g/L。在此基础上,在一株高产谷氨酸的谷氨酸棒杆菌F343中外源表达pgsBCA,对重组菌进行发酵,结果表明,在摇瓶发酵中γ-聚谷氨酸产量达到10.23 g/L,在5 L发酵罐中产量达到20.08 g/L;继而对γ-聚谷氨酸进行分子量测定,结果显示,产自F343重组菌的γ-聚谷氨酸的重均分子量比产自枯草芽孢杆菌的提高34.77%。文中构建了一步法发酵糖质原料生产γ-聚谷氨酸的新途径,同时为开发其潜在应用奠定了基础。
关键词:γ-聚谷氨酸谷氨酸棒杆菌一步法发酵糖质原料pgsBCA
γ-Polyglutamic acid production in Corynebacterium glutamicum using sugar by one-step fermentation
Cheng Hui1,2,3, Chen Yuanyuan1,2,3, Zhu Yaxin1,2,3, Cao Rong1,2,3, Xu Guoqiang1,2,3

 , Zhang Xiaomei4, Shi Jinsong4, Xu Zhenghong1,2,3
, Zhang Xiaomei4, Shi Jinsong4, Xu Zhenghong1,2,3 1. Key Laboratory of Industrial Biotechnology of Ministry of Education, Jiangnan University, Wuxi 214122, Jiangsu, China;
2. National Engineering Laboratory for Cereal Fermentation Technology, Jiangnan University, Wuxi 214122, Jiangsu, China;
3. School of Biotechnology, Jiangnan University, Wuxi 214122, Jiangsu, China;
4. School of Pharmaceutical Sciences, Jiangnan University, Wuxi 214122, Jiangsu, China
Received: February 22, 2019; Accepted: July 2, 2019; Published: December 11, 2019
Supported by: Program of National First-class Discipline Program of Light Industry Technology and Engineering (No. LITE2018-11), Program of Introducing Talents of Discipline to Universities (No. 111-2-06), International Joint Research Laboratory for Engineering Synthetic Biosystems for Intelligent Biomanufacturing at Jiangnan University, the Six Talent Peaks Project in Jiangsu Province (No. 2015-SWYY-006), Top-notch Academic Programs Project of Jiangsu Higher Education Institutions (TAPP)
Abstract: γ-polyglutamic acid (γ-PGA) is widely used in food processing, cosmetic production, medicinal industry, etc. Currently, the production strains used in fermentation process are commonly glutamic acid-dependent, which results in extra cost. In this study, a de novo way of producing γ-PGA from sugars was reported. To this end, the γ-polyglutamate synthase gene cluster pgsBCA was cloned from the natural γ-PGA-producing strain Bacillus subtilis (ATCC 6051-U), and was constitutively and inducibly expressed in Corynebacterium glutamicum ATCC 13032. Only inducible expression of pgsBCA can lead to the generation of γ-PGA with a titer of 1.43 g/L from glucose, without any supplementation of glutamic acid. The production was further elevated to 1.98 g/L upon optimization of the induction conditions with the induction time at 2 h post-inoculation and the IPTG concentration of 0.8 mmol/L. Moreover, to achieve a higher titer of γ-PGA, pgsBCA was inducibly expressed in C. glutamicum F343, which shows a paramount glutamate production capacity. The final γ-PGA production reached 10.23 g/L in shake flasks and 20.08 g/L in a 5-L fermentor using glucose as the substrate. The weight-average molecular weight (Mw) of γ-PGA from recombinant strain F343 showed 34.77% higher than that produced by B. subtilis. This study provides a novel way of producing γ-PGA from sugars directly and potentiates new applications of γ-PGA in the future.
Keywords: γ-polyglutamateCorynebacterium glutamicumone-step fermentationsugarpgsBCA
γ-聚谷氨酸(γ-PGA)是一种由L-谷氨酸和D-谷氨酸单体聚合成的生物聚合物,分为γ-L-PGA (仅由L-谷氨酸单体聚合而成)、γ-D-PGA (仅由D-谷氨酸单体聚合而成)、γ-LD-PGA (由D-谷氨酸、L-谷氨酸两种单体聚合而成)。γ-PGA具有高水溶性、良好的生物降解特性、较强的增稠能力、对高金属离子具有优异的吸收性和结合能力等性质[1]。近年来,γ-PGA广泛应用于食品、化妆品、生物医学、环境保护等领域。在食品工业中,γ-PGA可以用作食品补充剂、增强剂、冷冻保护剂和减油剂[2-3];在医药领域,γ-PGA因其良好的生物兼容性和无细胞毒性,可以作为重要的生物医药材料(如抗凝血材料和药物载体)[4];在环境保护领域,γ-PGA作为絮凝剂用来除去污水中的重金属离子[5]。此外,大分子的γ-聚谷氨酸可以提高幼苗的胁迫耐受性,增加种子萌发率[6],在农业生产中有重要用途。
已报道的γ-PGA合成方法有化学合成法、肽合成法、生物转化法和微生物发酵法。与其他方法相比,微生物发酵法具有许多优点,包括廉价的原料、较小的环境污染、较高的天然产物纯度和温和的反应条件[2, 7]。在微生物发酵法中,目前主要的生产菌株是枯草芽孢杆菌Bacillus subtilis和地衣芽孢杆菌Bacillus licheniformis,两者均为谷氨酸依赖型菌株,在发酵过程中需添加外源谷氨酸作为前体物质。例如,浙江大学Huang等[8]在10 L发酵罐中采用高密度发酵工艺,利用枯草芽孢杆菌生产γ-聚谷氨酸,最高产量101.1 g/L,但发酵过程中需添加30 g/L的谷氨酸和40 g/L酵母浸出物,流加750 g/L的葡萄糖,生产成本较高。为解决上述问题,研究人员尝试从自然界中筛选非谷氨酸依赖型菌株,Geng等从发酵食品中分离获得不依赖于谷氨酸的解淀粉芽孢杆菌LL3[9],Shin等从非巴氏灭菌的酱油中分离出非谷氨酸依赖型菌株枯草芽孢杆菌C1[10],但均存在γ-聚谷氨酸产量不高、菌株遗传背景不清晰、不易进行基因操作等缺点。除此之外,Cao等[11]利用代谢工程手段,从解淀粉芽孢杆菌LL3中克隆γ-PGA合成酶基因pgsBCA,分别在大肠杆菌JM109和谷氨酸棒杆菌ATCC13032中成功表达,但是,其基因工程菌发酵产γ-PGA产量较低。
在芽孢杆菌Bacillus sp.中,γ-PGA合成酶是γ-聚谷氨酸合成的关键酶。在枯草芽孢杆菌中已鉴定出γ-PGA合成途径关键酶编码基因pgsB、pgsC、pgsA和pgsE,其中PgsB和PgsC是ATP依赖型酶,催化γ-PGA聚合,在PgsA存在下,其活性得到进一步增强[13],而在无PgsA存在下,枯草芽孢杆菌可以过量产生具有富含L-谷氨酸的单体比率的γ-PGA[14]。在炭疽杆菌中编码γ-PGA的合成酶基因簇为capBCAE[7, 12]。由capE编码的47个氨基酸的肽位于炭疽杆菌膜上,Candela等认为CapE与CapA可能存在互动,在γ-聚谷氨酸合成中具介导γ-PGA转运的作用[15-16],决定合成的γ-PGA被保留或释放。来源于枯草芽孢杆菌的PgsE也被命名为YwtC,它类似于CapE,有关PgsE蛋白在γ-PGA合成中的作用报道较少。Ashiuchi等在枯草芽孢杆菌分别敲除pgsB、pgsC、pgsA,发现敲除菌株无法合成γ-PGA,由此推断编码γ-PGA合酶复合物的关键基因为pgsBCA。本研究以产L-谷氨酸的谷氨酸棒杆菌为底盘微生物,外源表达来源于B. subtilis ATCC6051-U γ-PGA合成酶基因簇pgsBCA,以期实现在不添加外源谷氨酸的条件下,直接利用葡萄糖一步法合成γ-聚谷氨酸。
1 材料与方法1.1 菌株与质粒菌株:Bacillus subtilis从ATCC购买,菌株号为ATCC 6051-U,是γ-聚谷氨酸合成酶的基因簇pgsBCA的来源菌株。谷氨酸棒杆菌F343由江南大学郑璞教授提供,谷氨酸棒杆菌ATCC13032由本实验室保藏。
质粒:pZM1由美国伦斯勒理工学院Mattheos A. G. Koffas教授惠赠。
1.2 培养基与试剂LB-Glu培养基(g/L):蛋白胨10,酵母膏5,NaCl 5,葡萄糖1 (LB-Glu平板加入2%的琼脂),pH 7.0–7.2。
种子培养基(g/L):玉米浆35,葡萄糖25,K2HPO4 1.5,MgSO4 0.6,FeSO4 0.005,MnCl2·4H2O 0.005,尿素2.5 (分消,过滤除菌),pH 7.2–7.3,每250 mL三角瓶中装液25 mL。
发酵培养基(g/L):葡萄糖120,玉米浆10,K2HPO4 1.0,MgSO4 0.6,FeSO4·7H2O 0.002,MnCl2·4H2O 0.002,尿素7.0 (分消,过滤除菌),硫胺素7.5×10–5,pH 7.2–7.3,500 mL三角瓶装液量为50 mL。
三乙胺乙腈:三乙胺1.4 mL,乙腈8.6 mL,混匀(现配现用)。
PITC乙腈:PITC 25 μL,乙腈2 mL (不超过7 d)。
1.3 培养条件1) 活化培养条件:从保菌管中吸取菌液2–5 μL,在LB-Glu培养基中进行划线,谷氨酸棒杆菌及本文所涉及的所有谷氨酸棒杆菌基因工程菌株32 ℃下培养32 h,枯草芽孢杆菌30 ℃下培养12 h。
2) 种子培养条件:从活化平板上挑取单菌落,接入种子培养基,谷氨酸棒杆菌及其基因工程菌株在往复式摇床中,120 r/min、32 ℃培养24 h,枯草芽孢杆菌在回旋式摇床中30 ℃下培养12 h。
3) 发酵培养条件:
谷氨酸棒杆菌及枯草芽孢杆菌:从种子培养基中取1.0 mL于50 mL发酵培养基中,在往复式摇床中120 r/min 37 ℃培养至发酵结束。
本文所涉及的所有谷氨酸棒杆菌基因工程菌:从种子培养基中取2.5 mL于发酵培养基中,在往复式摇床中120 r/min、32 ℃培养,添加诱导剂IPTG后32 ℃下培养1 h,将温度调为37 ℃。
5 L发酵罐的培养条件:5 L发酵罐装液量为3.5 L,用25%氨水和25%稀盐酸流加调节初始pH为7.2,发酵罐转速为300 r/min,到发酵稳定期将转速设置成与溶氧关联,使溶氧维持在30%,通气量为1 vvm,接种量为10%,36 ℃下发酵12 h,在39 ℃培养至48 h。
1.4 构建重组质粒pZM1-pgsB、pZM1-pgsC、pZM1-pgsA以B. subtilis ATCC 6051-U的基因组为模板,分别以pgsB-NdeⅠF/pgsB-BamHⅠ-R、pgsC-NdeⅠ- F/pgsC-BamHⅠ-R、pgsA-NdeⅠ-F/pgsA-BamHⅠ-R为引物(序列见表 1),PCR扩增出带酶切位点的目的基因pgsB、pgsC、pgsA片段。将酶切的目的基因pgsB片段与双酶切(NdeⅠ、BamHⅠ)线性化的载体pZM1用T4 DNA连接酶进行过夜连接,并转化到大肠杆菌JM109感受态细胞中,在含有25 mg/L的卡那霉素(Kan) LB-Glu抗性平板上进行筛选,获得的转化子经菌落PCR验证及酶切验证,得到正确的转化子,再用同样的方法将pgsC、pgsA分别连接到载体pZM1中。
表 1 本研究中所用的引物序列Table 1 Primers used in this study
| Primer name | Sequence (5′–3′) |
| pgsB-NdeⅠ-F | TATACATATGTGGTTACTCATTATAGCCTGTGC |
| pgsB-BamHⅠ-R | CGCGGATCCCTAGCTTACGAGCTGCTTAACCTTG |
| pgsB-R1 | CCATGACATCCATGTGGTCTTCTAAAAC |
| pgsB-F2 | GTTTTAGAAGACCACATGGATGTCATGG |
| pgsC-NdeⅠ-F | TATACATATGTTCGGATCAGATTTATACATCG |
| pgsC-BamHⅠ-R | CGCGGATCCTTAAATTAAGTAGTAAACAAACATGATAGC |
| pgsA-NdeⅠ-F | TATACATATGAAAAAAGAACTGAGCTTTCAT |
| pgsA-BamHⅠ-R | CGCGGATCCTTATTTAGATTTTAGTTTGTCGCTATG |
| 16S-R | ATATCAGGAGGAACACCAAT |
| 16S-F | ACTACCAGGGTATCTAATCC |
| PgsBCA-R | AAGCCAATATCGGTGTTA |
| PgsBCA-F | TATAAGGAATAGTAGCGGTAA |
表选项
1.5 RT-PCR分别培养携带组成型和诱导型质粒的谷氨酸棒杆菌基因工程菌株(C. glutamicum ATCC 13032 pZM1 (Peftu) pgsBCA、C. glutamicum ATCC 13032 pZM1 (Ptac) pgsBCA),收集两者对数生长期(8 h、16 h、24 h)的菌体,液氮研磨并用Trizol?试剂提取出总RNA,以Revert Aid First Strand cDNA Synthesis Kit (TaKaRa)逆转录出的cDNA为模板,以C. glutamicum ATCC 13032的16S rRNA用作内部参考基因,以相应的基因引物(表 1)进行荧光定量PCR。
1.6 分析方法1.6.1 生物量的检测将各个取样点的样品稀释至OD600值为0.2–0.8,量取200 μL,用核酸蛋白仪在波长600 nm处测取吸光度。
1.6.2 谷氨酸含量的检测1) 氨基酸的衍生化
将不同取样点的样(或氨基酸标样) 12 000 r/min离心10 min取上清200 μL,置于1.5 mL离心管中,12 000 r/min离心5 min,加入三乙胺乙腈和PITC乙腈各100 μL,混匀,反应1–2 h,加入任己烷400 μL,剧烈振荡后放置10 min,取下层PITC-氨基酸溶液,用0.45 μm针式过滤器过滤,取滤液100 μL加入到400 μL的水中,稀释混匀,加入进样瓶[17]。
2) 高效液相色谱(HPLC)分析
流动相A(2 L):15.2 g乙酸钠,加入1 850 mL超纯水溶解后用冰醋酸调pH至6.5,0.45 μm过滤膜抽滤,然后加入140 mL HPLC级乙腈,混匀,超声30 min。
流动相B:80%乙腈水溶液。
柱温40 ℃,波长250 nm。
色谱柱:Hypersil ODS-C18 4 mm×125 mm。
1.6.3 γ-聚谷氨酸含量的检测样品处理:将发酵液12 000 r/min离心15 min,取上清,稀释适当倍数,用0.45 μm过滤膜过滤,取500 μL于2 mL进样瓶中,待测[18]。
色谱柱:TSKgel super Aw 4000、TSKgel super Aw 5000。
流动相:0.3 mol/L Na2SO4,用冰醋酸调节流动相pH至4.0左右[18]。
柱温:35 ℃,进样量50 μL。
检测器:Waters液相RID示差检测器。
1.6.4 葡萄糖含量的检测通过HPLC检测分析,HPLC仪器为Waters 1515,检测器为示差检测器。
1.6.5 NMR的检测条件1H-NMR用VARIAN-300核磁共振仪测定,工作频率为299.95 MHz,以D2O为溶剂,50 ℃下采样2 s,延迟时间10 s。
2 结果与分析2.1 以菌株C. glutamicum ATCC13032为底盘微生物外源表达pgsBCA2.1.1 γ-PGA生产菌株的构建为研究谷氨酸棒杆菌一步法发酵糖质原料生产γ-聚谷氨酸,根据方法1.4构建了诱导型表达载体pZM1(Ptac)pgsB、pZM1(Ptac)pgsC、pZM1 (Ptac)pgsA。随后用酶AvrⅡ、SalⅠ酶切质粒pZM1(Ptac)pgsC获得元件Ptac-lacO-RBS-pgsC-T7 (图 1),同时以酶NheⅠ、SalⅠ双酶切获得的线性质粒pZM1(Ptac)pgsB为载体,由于NheⅠ与AvrⅡ为一对同尾酶,故用T4 DNA连接酶将上述元件和载体于4 ℃过夜连接,得到重组质粒pZM1(Ptac)pgsBC。在此质粒基础上用相同方法连接上元件Ptac-lacO-RBS-pgsA-T7,得到重组质粒pZM1(Ptac)pgsBCA,将重组质粒转化到大肠杆菌JM109后,提取质粒作为模板,并用酶AvrⅡ和SalⅠ进行双酶切验证。条带大小与pgsBCA理论大小(3 500 bp)相符,pZM1(Ptac)全长8 304 bp,条带验证结果与理论大小相符,为正确重组质粒(图 2)。
 |
| 图 1 重组质粒pZM1(Ptac)pgsBCA的构建过程 Fig. 1 Construction of recombinant plasmid pZM1 (Ptac) pgsBCA. |
| 图选项 |
 |
| 图 2 重组质粒pZM1(Ptac/eftu)pgsBCA的酶切验证 Fig. 2 Identification of recombinant plasmids with enzyme digestion. M: DNA marker; 1: pZM1(Ptac)pgsBCA; 2: pZM1(Peftu)pgsBCA. |
| 图选项 |
用酶AvrⅡ和SalⅠ双酶切质粒pZM1(Ptac)pgsBCA获得含有γ-PGA合成酶基因pgsBCA的元件,同时以酶NheⅠ、SalⅠ双酶切获得组成型线性载体pZM1(Peftu),将上述所得元件和线性载体用T4 DNA连接酶于4 ℃过夜连接,构建携带组成型表达载体的重组质粒pZM1(Peftu)pgsBCA,所得两个质粒经金唯智生物技术有限公司测序,结果正确。将上述验证正确的组成型和诱导型重组质粒分别电转入C. glutamicum ATCC 13032中,在含有25 μg/L的卡那霉素抗性平板中进行筛选,挑取转化子进行菌落PCR,验证正确。
2.1.2 产物核磁共振鉴定图 3A是纯化得到发酵产物的1H核磁共振谱,从图中可见谱峰的化学位移。其中水的化学位移为4.810 ppm;化学位移为H 2.056–2.203 ppm的是γ-聚谷氨酸分子式(图 3B)中2号质子的特征谱峰,2号H质子由于与1号α位手性碳原子上的H质子相耦合而生成双峰;图 3B中3号(γ位)氢质子的个数与2号(β位)的氢质子个数相同,因此是一个峰面积为2号双峰面积之和的单峰,其化学位移为H 2.480 ppm (图 3A);1号处氢质子与手性碳原子相连,受羧基的影响而使其向低磁场移动,化学位移为H 3.985 ppm (图 3A)。从图 3A可以看出,该化合物的氢谱信号峰并不多,α位的羧基向高磁场位移,说明发酵产物中存在γ-酰胺键,产物为γ-聚谷氨酸,这与陈雄等[19]的研究结果保持一致。
 |
| 图 3 发酵产物的核磁共振鉴定(A:产自C. glutamicum ATCC13032 pZM1(Ptac)pgsBCA的γ-PGA的核磁共振氢谱图;B: γ-PGA的结构式) Fig. 3 Nuclear magnetic resonance identification of fermentation products. (A) Molecular structure of γ-PGA. (B) NMR of γ-PGA from C. glutamicum ATCC 13032 pZM1(Ptac)pgsBCA. |
| 图选项 |
通过对产自重组菌C. glutamicum ATCC 13032 pZM1(Ptac)pgsBCA的发酵产物的NMR检测,γ-聚谷氨酸中的γ-酰胺键上的特殊氢峰1、2、3号峰都能被检测到,说明C. glutamicum ATCC 13032 pZM1(Ptac)pgsBCA发酵的聚合物是通过γ位上的羧基形成的肽键,是γ-聚谷氨酸。说明已成功在谷氨酸棒杆菌中异源表达合成酶基因pgsBCA,发酵生成γ-聚谷氨酸。
2.1.3 摇瓶发酵特性评价将重组菌C. glutamicum ATCC 13032 pZM1 (Ptac) pgsBCA按方法1.3进行发酵,结果如图 4所示,发酵到16 h,菌株由对数生长期进入到稳定期,生物量在24 h达到OD600 12.33(图 4A)。发酵进行到48 h,γ-聚谷氨酸产量最高,达到1.43 g/L (图 4C),同时(48 h)谷氨酸含量达到10.63 g/L (图 4D),葡萄糖剩余量为47.0 g/L (图 4B)。发酵液中谷氨酸含量较多,这可能与γ-聚谷氨酸的合成机制有关。Ashiuchi等[20]认为由pgsBCA编码的γ-聚谷氨酸合酶由催化部位定位在细胞膜上,因此发酵液中谷氨酸含量较多可能是因为在C. glutamicum ATCC 13032中的胞内谷氨酸大量外排,而未被聚合。也有****认为L-谷氨酸在聚合之前需在L-谷氨酸激酶的催化下被活化,以获得聚合的额外能量,L-谷氨酸激酶较少或酶活不够高也可能是原因之一。
 |
| 图 4 C. glutamicum ATCC 13032 pZM1(Ptac)pgsBCA摇瓶发酵性能 Fig. 4 Fermentation performance by C. glutamicum ATCC 13032 pZM1(Ptac)pgsBCA in flask. (A) The curve of biomass. (B) The curve of residual glucose. (C) The curve of γ- PGA content. (D) The curve of glutamate content. |
| 图选项 |
将验证正确的重组子C. glutamicum ATCC 13 032 pZM1(Peftu)pgsBCA在上述发酵培养基(添加25 μg/L卡那霉素)中发酵,发酵液无明显粘度,通过HPLC在检测方法1.6.3下测γ-聚谷氨酸含量,并未检测到目标产物。
2.1.4 IPTG添加时间及浓度的优化异丙基硫代半乳糖苷(IPTG)和乳糖均是乳糖操纵子的有效诱导剂。乳糖有双效作用,既能作为诱导剂,又可以作碳源,在诱导过程中很不稳定;IPTG由于不被菌体代谢,诱导效率高,诱导效果持续稳定而受到广泛应用,然而IPTG对于细胞具有潜在的毒性,因此适宜的诱导时间对重组菌发酵产γ-PGA较为重要。因此,采用单因素实验优化IPTG的诱导时间(0 h、2 h、3 h、4 h、5 h)和诱导浓度(0 mmol/L、0.2 mmol/L、0.4 mmol/L、0.6 mmol/L、0.8 mmol/L、1.0 mmol/L、1.2 mmol/L),探究其对γ-PGA产量的影响。
由图 5A可知,在0 h进行诱导时,谷氨酸棒杆菌基因工程菌不能积累γ-PGA,随着诱导时间的延长,γ-PGA的产量先上升后下降,在2 h诱导时,γ-PGA的产量最高,为1.76 g/L,较3 h添加IPTG时的产量(1.48 g/L)上升了18.92%。在此基础上,通过单因素实验优化IPTG的添加浓度,结果如图 5B所示。随着IPTG浓度的增加,γ-PGA的产量先上升后下降,当IPTG的浓度为0.8 mmol/L时,γ-PGA的产量最高,为1.98 g/L,较添加浓度为1.0 mmol/L时的产量增加了12.50%。因此通过对诱导条件的优化,确定其较优的诱导条件为:在发酵2 h时进行诱导,诱导浓度为0.8 mmol/L。
 |
| 图 5 诱导条件的优化(A:诱导时间的优化;B:诱导浓度的优化) Fig. 5 Optimization of induction conditions. (A): Optimization of induction time. (B): Optimization of induction concentration. |
| 图选项 |
2.2 以工业菌株C. glutamicum F343为底盘微生物外源表达pgsBCAC. glutamicum ATCC 13032作为谷氨酸棒杆菌的模式菌株,具有清晰的遗传背景,但其谷氨酸产量较低。因此,我们选用一株高产谷氨酸的工业菌株C. glutamicum F343作为底盘微生物,以期提高γ-聚谷氨酸产量。
将上述验证正确的重组质粒pZM1(Ptac)pgsBCA转化到谷氨酸棒杆菌F343感受态中,以含有25 μg/L卡那霉素的LB-Glu抗性平板进行筛选,挑出转化子进行菌落PCR,验证结果正确。
2.2.1 底盘微生物C. glutamicum F343发酵产L-谷氨酸的发酵特性研究谷氨酸作为γ-聚谷氨酸的前体物质,提高出发菌株F343的谷氨酸产量是高产γ-聚谷氨酸的重要基础。因此我们首先进行F343菌株发酵产谷氨酸的研究,在发酵过程中,分别每4 h、8 h用pH试纸检测发酵液pH,并用1%的无菌尿素调节pH在7.2–7.3之间。分别测定了菌体生物量、葡萄糖消耗量和谷氨酸产量,结果如图 6所示。
 |
| 图 6 C. glutamicum F343摇瓶发酵性能 Fig. 6 Fermentation performance by C. glutamicum F343 in flask. (A) The curve of biomass. (B) The curve of residual glucose. (C) The curve of glutamate content. |
| 图选项 |
从图 6C可知,从12 h到36 h,谷氨酸含量迅速增加,相同时间点上,通过每4 h调节一次pH的谷氨酸含量比每8 h调节一次pH的谷氨酸含量显著提高,在36 h时,通过每4 h调节一次pH的谷氨酸含量达到11.05 g/L,相比8 h调节一次pH,提高了60.72%。说明F343产谷氨酸的发酵过程中,实时调控pH是谷氨酸高产的关键。从糖耗的曲线图 6B中可以看出,在每4 h调节一次pH与每8 h调节一次pH的条件下,F343菌株对碳源的利用无明显差异。不同的pH调节对菌株生长的影响如图 6A所示,从图中可已看出,在不同的pH调节时菌体生长都呈S型曲线,在0 h到8 h之间,两种pH调节对生物量无显著影响,但在12 h到36 h之间,每4 h调节一次pH的生物量提高显著。其中,在36 h时,每4 h调节一次pH的生物量达到OD600为27.58,相比每8 h调节一次pH的生物量(OD600为23.02)提高19.80%。说明F343菌体的生长对pH很敏感,这与Zheng等[21]的研究结果保持一致。
为进一步提高C. glutamicum F343的谷氨酸产量,作者在实验方法1.3的5 L发酵罐的培养条件下开展了谷氨酸棒杆菌的罐上发酵实验。结果如图 7所示,C. glutamicum F343菌体在16 h达到生长稳定期,生物量OD600达到50.00,较摇瓶发酵水平的生物量OD600 (26.00)提高了92.30%,同时葡萄糖在16 h时被迅速消耗,剩余量为27.60 g/L。谷氨酸在12 h之后开始积累,到32 h间积累迅速,在32 h达到44.61 g/L,在发酵结束时(48 h),谷氨酸含量达到47.61 g/L,较摇瓶水平(11.08 g/L)提高了3.29倍。以上结果显示,谷氨酸棒杆菌F343是一株对发酵液pH敏感的菌株,通过对发酵pH的实时控制显著提升了谷氨酸的产量,为谷氨酸棒杆菌发酵生产γ-PGA提供了充足的前体物质。Zheng等通过两阶段控制C. glutamicum F343发酵过程中的pH,在最初的26 h内,pH值控制在7.3和7.5之间,在最后4 h内,pH值控制在7.2和7.5之间,使谷氨酸含量显著提高,说明C. glutamicum F343对发酵pH较为敏感。本实验结果与其结果一致[21]。
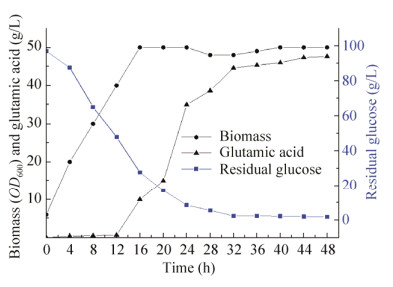 |
| 图 7 C.glutamicumF343在5 L发酵罐水平的发酵性能 Fig. 7 Fermentation profile of C. glutamicum F343 in 5 L Fermentor. |
| 图选项 |
2.2.2 F343重组菌摇瓶发酵性能评价在方法1.3的培养条件下,考察了菌株C. glutamicum F343 pZM1(Ptac)pgsBCA的发酵特性。如图 7A所示,发酵进行到24 h时,菌株C. glutamicum F343 pZM1(Ptac)pgsBCA已经进入稳定期,菌体生物量OD600达到11.46,同时,谷氨酸和γ-聚谷氨酸的产量也迅速增加,分别达到6.90 g/L (图 8D)和8.79 g/L (图 8C),同一时间点上(24 h),葡萄糖含量由最初的120.0 g/L下降到77.6 g/L。随着发酵时间的延长,谷氨酸和γ-聚谷氨酸进一步积累,发酵进行到48 h时,γ-聚谷氨酸的产量达到最高10.23 g/L (图 8C),较C. glutamicum ATCC 13032 pZM1(Ptac)pgsBCA的产量(1.98 g/L)提高了4.16倍,这可能是因为底盘微生物C. glutamicum F343较C. glutamicum ATCC13032的产谷氨酸能力更强,在摇瓶水平上,C. glutamicum F343的谷氨酸产量约为C. glutamicum ATCC 13032的10倍(数据未显示),为γ-聚谷氨酸的合成提供了较为充足的前体物质。在36 h时谷氨酸积累达到最高11.10 g/L (图 8D),随着发酵时间的延长,谷氨酸和γ-PGA均有部分下降,在96 h时,谷氨酸、γ-PGA以及葡萄糖含量分别为7.86 g/L、9.07 g/L和49.6 g/L。
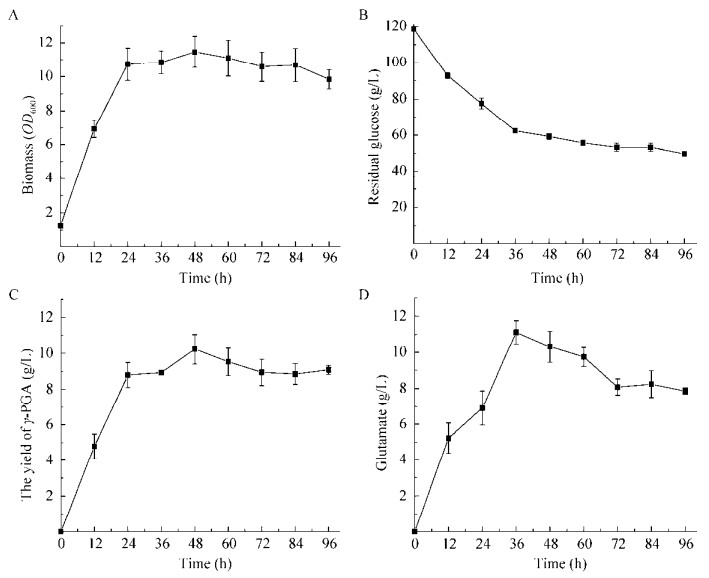 |
| 图 8 C. glutamicum F343 pZM1(Ptac)pgsBCA摇瓶发酵性能 Fig. 8 Fermentation performance by C. glutamicum F343 pZM1(Ptac)pgsBCA in flask. (A) The curve of biomass. (B) The curve of residual glucose. (C) The curve of γ- PGA content. (D) The curve of glutamate content. |
| 图选项 |
γ-聚谷氨酸产量较48 h的产量下降11.34%,此实验结果分别与Huang等[8]在B. subtilis和Regestein等[22]在B. licheniformis中的研究保持一致,即在发酵过程中γ-PGA的含量受环境和微生物生长等影响而减少,这也可能是因为谷氨酸棒杆菌里存在一种类似于CWlO的细胞壁水解酶,这种酶广泛存在于各种细菌中,且其调控机理不清晰[23]。
在方法1.3条件下,考察了C. glutamicum F343 pZM1(Ptac)pgsBCA发酵罐水平的发酵性能,结果如图 9所示,由图可以看出,菌株在24 h进入稳定期,生物量在48 h达到OD600 27.00,与摇瓶水平上的生物量OD600 (11.46)相比,提高了1.35倍,与5 L发酵罐水平上的C. glutamicum F343的生物量(OD600为50.00)相比,下降了46%;谷氨酸产量在16 h之前迅速增加,在16 h之后产量相对稳定,在40 h谷氨酸的积累量最大,为18.00 g/L,较摇瓶水平上的谷氨酸积累量(6.90 g/L)提高了1.61倍;γ-PGA的产量先上升后下降,在24 h达到最高产量20.08 g/L,较摇瓶水平上的产量(10.23 g/L)提高了1.03倍;葡萄糖的含量在发酵过程中逐渐降低,在48 h时,其葡萄糖剩余量为12.0 g/L,γ-PGA产物得率为0.19 g/g。
 |
| 图 9 C. glutamicum F343 pZM1(Ptac)pgsBCA发酵罐水平的发酵性能 Fig. 9 Fermentation profile of C. glutamicum F343 pZM1(Ptac)pgsBCA in 5 L fermentor. |
| 图选项 |
2.3 产物分子量的测定分别对产自菌株B. subtilis ATCC6051-U和C. glutamicum F343 pZM1(Ptac)pgsBCA的γ-PGA进行醇沉,低温烘干,加水溶解后用20 kDa的透析袋进行透析后冷冻干燥,获得白色纯化样品,用流动相稀释至适当倍数,采用凝胶渗透色谱(GPC)法分别检测其分子量,两者的数均分子量(Mn)分别为9.24×105 (±21.60%) Da和1.01×106 (±6.31%) Da。重均分子量(Mw)分别为1.20×106 (±11.17%) Da和1.61×106 (±2.48%) Da。产自C. glutamicum F343 pZM1(Ptac)pgsBCA的γ-PGA分子量较B. subtilis的相比较,重均分子量提高了34.77%。峰顶处分子量的大小由Mp表征,结合表 2中的数据,产自谷氨酸棒杆菌F343重组菌的γ-PGA的Mp (1.80×106(±1.14%) Da)较对照菌株的Mp (1.19×106(±4.97%) Da)提高了51.26%。
表 2 产自B. subtilis ATCC6051-U和C. glutamicum F343 pZM1(Ptac)pgsBCA的γ-PGA分子量比较Table 2 Molecular weight of γ-PGA from B. subtilis ATCC6051-U and C. glutamicum F343 pZM1(Ptac)pgsBCA
| Strains | Molecular weight | |||
| Mn(×105 Da) | Mp(×106 Da) | Mw(×106 Da) | Mz(×106 Da) | |
| B. subtilis ATCC6051-U | 9.24(±21.60%) | 1.19(±4.97%) | 1.20(±11.17%) | 1.67(±26.57%) |
| F343pZM1(Ptac)-pgsBCA | 10.10(±6.31%) | 1.80(±1.42%) | 1.61(±2.48%) | 2.45(±5.79%) |
表选项
从图 10A中,我们可以看出B. subtilis ATCC 6051-U所产的γ-PGA的GPC峰图有2个峰,在12 min存在1个峰使峰图不成正态分布曲线,说明其分子量的分布不均一,而由图 10B可知,其峰型接近正态分布图,无叉开的小峰,较图 10A相比,其γ-PGA分子量的分散性较差,即F343 pZM1(Ptac)pgsBCA所产的γ-PGA均一性较B. subtilis ATCC6051-U好。
 |
| 图 10 凝胶渗透色谱检测(A:产自B. subtilis ATCC6051-U的γ-PGA的凝胶渗透色谱;B:产自C. glutamicum F343 pZM1(Ptac)pgsBCA的γ-PGA的凝胶渗透色谱) Fig. 10 Detection by gel permeation chromatography. (A) GPC of γ-PGA from B. subtilis fermentation production. (B) GPC of γ-PGA from C. glutamicum F343 pZM1(Ptac)pgsBCA fermentation production. |
| 图选项 |
3 讨论γ-聚谷氨酸在现代农业、生物医药、化妆品行业、环保行业及食品行业有着广泛的应用,目前主要生产菌株为谷氨酸依赖型菌株,发酵过程中需添加外源谷氨酸,具有生产成本较高的问题。目前,对γ-聚谷氨酸合成酶的异源重组表达获得的γ-聚谷氨酸产量仍处于较低水平。
本研究首次利用合成生物学技术构建了两株重组菌株,分别是诱导型菌株C. glutamicum ATCC13032 pZM1 (Ptac)pgsBCA和组成型菌株C. glutamicum ATCC13032 pZM1(Peftu)pgsBCA。进一步发酵结果表明,仅诱导型菌株可以成功产γ-PGA。为探究其原因,采用qRT-PCR技术,比较了组成型和诱导型重组菌株中pgsBCA基因转录水平上的差异,如图 11所示,pgsBCA基因在诱导型菌株中的转录强度较组成型相比较弱,在8 h、16 h、24 h分别下降了57.05%、66.27%、45.28%。导致组成型菌株不生产γ-PGA的可能原因是pgsBCA基因的过早或过强表达不利于γ-PGA的合成。在对IPTG的诱导时间的优化结果(图 5A)也支持这一假设,即在0 h开始诱导时,诱导型菌株不生产γ-PGA,在2 h之后诱导,γ-PGA的产量下降,即γ-PGA的产量对诱导时间较为敏感,诱导时间不同pgsBCA的表达时间也有所差异,这与枯草芽孢杆菌中的诱导表达机制一致[10]。在γ-PGA生产菌株枯草芽孢杆菌中,pgs操纵子的完全启动需要SwrAA和磷酸化形式的DegU(DegU~P)共存[24],DegU (DegU~P)或SwrAA单独存在仅对pgs操纵子的转录和γ-PGA的生成有微弱影响[25],因此,γ-PGA合成酶是需要在菌体特定的生长期启动表达。通过NMR定性检测发酵产物结构,发现发酵产物是具有γ酰胺键的γ-PGA。将诱导型菌株C. glutamicum F343 pZM1(Ptac)pgsBCA发酵到48 h,γ-聚谷氨酸达到最高产量1.43 g/L (图 4C)。2010年,Cao等[26]在C. glutamicum ATCC13032中外源表达来自B. licheniformis NK-03的γ-聚谷氨酸合成酶基因pgsBCA,产量达到0.69 g/L,与之相比,本研究达到的产量提高了约2倍。
 |
| 图 11 组成型及诱导型工程菌株pgsBCA基因转录水平的比较 Fig. 11 Comparison of transcript levels of pgsBCA gene in constitutive and inducible engineering strains. |
| 图选项 |
为进一步提高γ-PGA的产量,本研究提出通过提高底盘微生物的产谷氨酸能力来提高γ-PGA产量的策略,选用一株高产谷氨酸的谷氨酸棒杆菌F343为底盘微生物,构建重组菌C. glutamicum F343 pZM1 (Ptac)pgsBCA。通过对底盘微生物C. glutamicum F343谷氨酸发酵性能的探究,发现C. glutamicum F343菌株是一株对发酵pH较敏感的菌株。在本文的发酵条件下γ-PGA产量大幅度提高,最终摇瓶产量达到10.23 g/L,耗糖56.62 g/L (48 h),5 L发酵罐的产量达到20.08 g/L,耗糖108.0 g/L。在枯草芽孢杆菌的生产菌株中,目前γ-PGA最高产量为101.1 g/L[8],发酵过程中需添加30 g/L的谷氨酸和40 g/L酵母浸出物,流加750 g/L的葡萄糖;在地衣芽孢杆菌中γ-PGA最高的产量是45.73 g/L[27],但其消耗糖80 g/L,添加外源谷氨酸和柠檬酸各20 g/L、18 g/L,而谷氨酸的成本价约为工业葡萄糖的4倍,因此如果通过发酵优化等策略进一步提高菌株C. glutamicum F343 pZM1(Ptac)pgsBCA直接利用葡萄糖发酵产γ-PGA的产量,将有望节约γ-PGA的发酵成本。除此之外,地衣芽孢杆菌和枯草芽孢杆菌主要原料为甘油,因此本研究在直接利用葡萄糖为原料生产γ-PGA上具有很大优势。
最后,本研究纯化出产自C. glutamicum F343 pZM1(Ptac) pgsBCA和B. subtilis ATCC6051-U的γ-PGA,测得其重均分子量较B. subtilis ATCC6051-U产的天然γ-PGA的相比提高了34.77%,推测可能由于在枯草芽孢杆菌中存在γ-PGA降解基因ggt、cwlO、pgdS[28-29]。不同的相对分子质量的γ-聚谷氨酸的用途也各不相同,例如相对分子质量在2 kDa时常应用在现代农业中[30-31],在45-60 kDa的γ-PGA是良好的药物载体[32],化妆品级的集中在80–120 kDa[33],200 kDa左右的主要用作抑菌剂和絮凝剂[34],目前已经可以通过各类酶解法、碱水解法等方法控制其相对分子质量[35]。因此我们发酵所获得的高分子量的γ-PGA具有很大的应用潜力,为其在化妆品、医药等各个行业的应用奠定了良好的基础。
参考文献
| [1] | Hsueh YH, Huang KY, Kunene SC, et al. Poly-γ-glutamic acid synthesis, gene regulation, phylogenetic relationships, and role in fermentation. Int J Mol Sci, 2017, 18(12): 2644. DOI:10.3390/ijms18122644 |
| [2] | Luo ZT, Guo Y, Liu JD, et al. Microbial synthesis of poly-γ-glutamic acid:current progress, challenges, and future perspectives. Biotechnol Biofuels, 2016, 9: 134. |
| [3] | Sung MH, Park C, Kim CJ, et al. Natural and edible biopolymer poly-γ-glutamic acid:synthesis, production, and applications. Chem Rec, 2005, 5(6): 352-366. |
| [4] | Clarke DE, Pashuck ET, Bertazzo S, et al. Self-Healing, self-assembled β-sheet peptide poly (γ-glutamic acid) hybrid hydrogels. J Am Chem Soc, 2017, 139(21): 7250-7255. DOI:10.1021/jacs.7b00528 |
| [5] | Yao J, Xu H, Wang J, et al. Removal of Cr (Ⅲ), Ni (Ⅱ) and Cu (Ⅱ) by poly (γ-glutamic acid) from Bacillus subtilis NX-2. J Biomater Sci, Polym Ed, 2007, 18(2): 193-204. DOI:10.1163/156856207779116702 |
| [6] | Lei P, Pang X, Feng XH, et al. The microbe-secreted isopeptide poly-γ-glutamic acid induces stress tolerance in Brassica napus L.seedlings by activating crosstalk between H2O2 and Ca2+. Sci Rep, 017, 7: 41618. DOI:10.1038/srep41618 |
| [7] | Ashiuchi M. Microbial production and chemical transformation of poly-γ-glutamate. Microb Biotechnol, 2013, 6(6): 664-674. DOI:10.1111/1751-7915.12072 |
| [8] | Huang J, Du YM, Xu GH, et al. High yield and cost-effective production of poly (γ-glutamic acid) with Bacillus subtilis. Eng Life Sci, 2011, 11(3): 291-297. DOI:10.1002/elsc.201000133 |
| [9] | Geng WT, Cao MF, Song CJ, et al. Complete genome sequence of Bacillus amyloliquefaciens LL3, which exhibits glutamic acid-independent production of poly-γ-glutamic acid. J Bacteriol, 2011, 193(13): 3393-3394. |
| [10] | Shin IL, Wu JY, Wu PJ, et al. An unusual bioconjugate of glycerol and poly (γ-glutamic acid) produced by Bacillus subtilis C1. J Microbiol Biotechnol, 2005, 15(5): 919-923. |
| [11] | Cao MF, Geng WT, Liu L, et al. Glutamic acid independent production of poly-γ-glutamic acid by Bacillus amyloliquefaciens LL3 and cloning of pgsBCA genes. Bioresour Technol, 2011, 102(5): 4251-4257. |
| [12] | Ashiuchi M, Kamei T, Misono H. Poly-γ-glutamate synthetase of Bacillus subtilis. J Mol Catal B:Enzym, 2003, 23(26): 101-106. DOI:10.1016/S1381-1177(03)00076-6 |
| [13] | Gomez Leonard C, Housewright RD, Thorne CB. Effects of some metallic ions on glutamyl polypeptide synthesis by Bacillus Subtilis. J Bacteriol, 1958, 76(5): 499-503. |
| [14] | Sawada K, Araki H, Takimura Y, et al. Poly-L-gamma-glutamic acid production by recombinant Bacillus subtilis without pgsA gene. AMB Express, 2018, 8: 110. DOI:10.1186/s13568-018-0636-x |
| [15] | Ashiuchi M, Soda K, Misono H. A poly-γ-glutamate synthetic system of Bacillus subtilis IFO 3336:gene cloning and biochemical analysis of poly-γ-glutamate produced by Escherichia coli clone cells. Biochem Biophys Res Commun, 1999, 263(1): 6-12. DOI:10.1006/bbrc.1999.1298 |
| [16] | Candela T, Mock M, Fouet A. CapE, a 47-amino-acid peptide, is necessary for Bacillus anthracis polyglutamate capsule synthesis. J Bacteriol, 2005, 187(22): 7765-7772. |
| [17] | Zhang XM, Lai LH, Xu GQ, et al. Effects of pyruvate kinase on the growth of Corynebacterium glutamicum and L-serine accumulation. Process Biochem, 2017, 55: 32-40. |
| [18] | Wu Q, Xu H, Xu L, et al. Biosynthesis of poly (γ-glutamic acid) in Bacillus subtilis NX-2:regulation of stereochemical composition of poly (γ-glutamic acid). Process Biochem, 2006, 41(7): 1650-1655. DOI:10.1016/j.procbio.2006.03.034 |
| [19] | Chen X.Highyield of poly-γ-glutamic acid from Bacillus subtilis and its application[D].Wuhan: Huazhong Agricultural University, 2005. 陈雄.枯草芽胞杆菌高产聚-γ-谷氨酸及其应用研究[D].武汉: 华中农业大学, 2005. |
| [20] | Ashiuchi M, Kamei T, Song JJ, et al. Physiological and biochemical characteristics of poly γ-glutamate synthetase complex of Bacillus subtilis. Eur J Biochem, 2001, 268(20): 5321-5328. DOI:10.1046/j.0014-2956.2001.02475.x |
| [21] | Zheng P, Liu M, Liu XD, et al. Genome shuffling improves thermotolerance and glutamic acid production of Corynebacteria glutamicum. World J Microbiol Biotechnol, 2012, 28(3): 1035-1043. |
| [22] | Regestein Née Meissner L, Arndt J, Palmen TG, et al. Investigation of poly (γ-glutamic acid) production via online determination of viscosity and oxygen transfer rate in shake flasks. J Biol Eng, 2017, 11: 23. DOI:10.1186/s13036-017-0065-4 |
| [23] | Mitsui N, Murasawa H, Sekiguchi J. Disruption of the cell wall lytic enzyme CwlO affects the amount and molecular size of poly-γ-glutamic acid produced by Bacillus subtilis (natto). J Gen Appl Microbiol, 2011, 57(1): 35-43. |
| [24] | Stanley NR, Lazazzera BA. Defining the genetic differences between wild and domestic strains of Bacillus subtilis that affect poly-γ-DL-glutamic acid production and biofilm formation. Mol Microbiol, 2005, 57(4): 1143-1158. DOI:10.1111/j.1365-2958.2005.04746.x |
| [25] | Osera C, Amati G, Calvio C, et al. SwrAA activates poly-γ-glutamate synthesis in addition to swarming in Bacillus subtilis. Microbiology, 2009, 155(7): 2282-2287. |
| [26] | Cao MF, Song CJ, Jin YH, et al. Synthesis of poly (γ-glutamic acid) and heterologous expression of pgsBCA genes. J Mol Catal B:Enzym, 2010, 67(12): 111-116. |
| [27] | Mitsunaga H, Meissner L, Palmen T, et al. Metabolome analysis reveals the effect of carbon catabolite control on the poly (γ-glutamic acid) biosynthesis of Bacillus licheniformis ATCC 9945. J Biosci Bioeng, 2016, 121(4): 413-419. DOI:10.1016/j.jbiosc.2015.08.012 |
| [28] | Feng J, Gao WX, Gu YY, et al. Functions of poly-γ-glutamic acid (γ-PGA) degradation genesin γ-PGA synthesis and cell morphology maintenance. Appl Microbiol Biotechnol, 2014, 98(14): 6397-6407. DOI:10.1007/s00253-014-5729-0 |
| [29] | Scoffone V, Dondi D, Biino G, et al. Knockout of pgdS and ggt genes improves γ-PGA yield in B. subtilis. Biotechnol Bioeng, 2013, 110(7): 2006-2012. |
| [30] | Lei P, Xu ZQ, Ding Y, et al. Effect of poly (γ-glutamic acid) on the physiological responses and calcium signaling of rape seedlings (Brassica napus L.) under cold stress. J Agric Food Chem, 2015, 63(48): 10399-10406. DOI:10.1021/acs.jafc.5b04523 |
| [31] | Xu ZQ, Lei P, Feng XH, et al. Analysis of the metabolic pathways affected by poly (γ-glutamic Acid) in Arabidopsis thaliana based on geneChip microarray. J Agric Food Chem, 2016, 64(32): 6257-6266. DOI:10.1021/acs.jafc.6b02163 |
| [32] | Ye HF, Jin L, Hu RZ, et al. Poly (γ, L-glutamic acid)-cisplatin conjugate effectively inhibits human breast tumor xenografted in nude mice. Biomaterials, 2006, 27(35): 5958-5965. DOI:10.1016/j.biomaterials.2006.08.016 |
| [33] | Liu X, Liu F, Liu SY, et al. Poly-γ-glutamate from Bacillus subtilis inhibits tyrosinase activity and melanogenesis. Appl Microbiol Biotechnol, 2013, 97(22): 9801-9809. |
| [34] | Bhat AR, Irorere VU, Bartlett T, et al. Improving survival of probiotic bacteria using bacterial poly-γ-glutamic acid. Int J Food Microbiol, 2015, 196: 24-31. DOI:10.1016/j.ijfoodmicro.2014.11.031 |
| [35] | ShaYY, Zhang YT, Qiu YB, et al. Efficient biosynthesis of low-molecular-weight poly-γ-glutamic acid by stable overexpression of PgdS hydrolase in Bacillus amyloliquefaciens NB. J Agric Food Chem, 2019, 67(1): 282-290. |
