
 , 王得明2, 樊乐2
, 王得明2, 樊乐2 1. 华东理工大学 生物反应器工程国家重点实验室,上海 200237;
2. 齐鲁制药 (内蒙古) 有限公司,内蒙古 呼和浩特 010000
收稿日期:2019-05-19;接收日期:2019-09-29;网络出版时间:2019-10-25
通讯作者:Yingping Zhuang. Tel: +86-21-64251257; E-mail: ypzhuang@ecust.edu.cn.
摘要:中国是世界上最大的也是唯一的阿维菌素原料生产国,但在工业规模生产中与同类型大环内酯类抗生素相比其产量相对偏低。文中通过研究不同氮源对阿维链霉菌生长、代谢的影响,发现氮源在发酵中后期对菌丝活性、菌丝浓度以及阿维菌素B1a的合成都有较为显著的影响。在100 L生物反应器中,于发酵中后期基于二氧化碳释放速率(CER)控制补入酵母粉,效价达到8 697 mg/L,与原工艺相比,提高了26.9%。这一结论若在实际工业生产中应用,有望带来实际的经济效益。
关键词:阿维链霉菌阿维菌素酵母粉二氧化碳释放速率
Effect of nitrogen on avermectins biosynthesis and its fermentation optimization based on carbon-dioxide evolution rate
Xu Yao1, Wu Tao1, Guo Meijin1, Zhuang Yingping1

 , Wang Deming2, Fan Le2
, Wang Deming2, Fan Le2 1. State Key Laboratory of Bioreactor Engineering, East China University of Science and Technology, Shanghai 200237, China;
2. Qilu Pharmaceutical(Inner Mongolia)Co., Ltd., Hohhot 010000, Inner Mongolia, China
Received: May 19, 2019; Accepted: September 29, 2019; Published: October 25, 2019
Abstract: China is now the largest and only producer of avermectin in the world. However, its current yield is still lower than other similar antibiotics. Therefore, we studied the effect of nitrogen on the growth and the synthesis ability of B1a to improve the overall yield. Nitrogen had significant effects on the cell activity, PMV of Streptomyces avermitilis and the synthesis of B1a in the middle and later phase of fermentation. Additional feeding yeast powder based on carbon-dioxide evolution rate in a 100-L bioreactor significantly improved the synthesis of B1a. The production of avermectin reached 8 697 mg/L, 26.9% higher than the original process. In short, this study will serve in production enhancement of avermectin at industrial production.
Keywords: Streptomyces avermitilisavermectinyeast powdercarbon-dioxide evolution rate (CER)
阿维菌素(Avermectin,AVM)是由阿维链霉菌Streptomyces avermitilis生产的一类具有除虫作用的聚酮类大环内酯类抗生素,被广泛地运用于农业与畜牧业中杀虫除螨。阿维菌素有8种天然组分,分别为A1a、A2a、B1a、B2a、A1b、A2b、B2a、B2b,其中B1a的除虫活性最好,商品阿维菌素中的主要成分是B1a组分。目前,我国已是世界上最大的阿维菌素原料生产国,但普遍存在产量较低、发酵周期长等问题。自阿维菌素被发现以来,研究者们对其合成途径[1-2]以及合成途径中相关基因[2-5]进行了大量研究,并对阿维菌素产生菌进行了基因工程改造。诱变育种的方法也广泛地运用于提高菌种的生产能力[6-8]。除了从基因层面对阿维链霉菌进行改造提高阿维菌素的产素能力,研究者们也试图通过对发酵过程的精准调控实现提高产量的目的,开发了一系列基于残糖[9]、pH、摄氧率(Oxygen uptake rate,OUR)[10-11]、乙醇合成速率[12]等控制补糖的发酵过程调控策略,达到提高产物合成目的。
阿维链霉菌是一种丝状菌,培养基成分、培养条件、反应器供氧都会对菌丝形态造成较大的影响,菌丝形态也会在一定程度上影响产物B1a的合成。菌体生长与产物合成都伴随着摄氧率(OUR)与二氧化碳释放速率(CER)的变化,在参数相关分析中可以根据OUR、CER、溶解氧(DO)、pH等参数的相关关系判断菌体所处的不同代谢阶段、菌体活性等信息。目前,在阿维菌素发酵过程补料控制中主要通过控制发酵中后期补糖时间以及补糖量来提高阿维菌产量,梁剑光等[11]基于在线OUR补加葡萄糖,在130 m3工业规模上将阿维菌素产量提高到5 228 mg/L;樊乐[13]通过过程补加淀粉液化液将残糖控制在较高水平,成功地将阿维菌素效价提高到6 530 mg/L。陈凝等在对阿维链霉菌形态对产物合成的影响中发现阿维菌素发酵过程中维持菌球尺寸大小有利于产物的合成[14],酵母粉等有机氮源中的氮源物质、微量元素以及少量生长因子有利于维持菌体活性。本研究在发酵过程基于残糖补糖工艺的基础上,主要探究的是不同氮源对产物合成的影响,找到合适的氮源用于后期补料,以期达到提高B1a产量的目的;与OUR相比,CER主要涉及到呼吸代谢中碳平衡,与所利用的碳源的还原度关系不大,所以本研究利用CER的变化与菌体活性变化具有相关性特点,在发酵过程中基于CER进行补料调控。
1 材料与方法1.1 材料1.1.1 菌种阿维链霉菌Streptomyces avermitilis 82由齐鲁制药(内蒙古)有限公司提供。
1.1.2 培养基斜面固体培养基:可溶性淀粉4 g/L,酵母浸粉3 g/L,麦芽浸粉10 g/L,CoCl2·6H2O 5 mg/L,琼脂20 g/L,pH 7.3。
摇瓶种子培养基:玉米淀粉30 g/L,黄豆饼粉8 g/L,花生饼粉10 g/L,酵母浸粉4 g/L,CoCl2·6H2O 0.03g/L,α-淀粉酶0.04 g/L。
摇瓶发酵培养基:玉米淀粉120 g/L,黄豆饼粉28 g/L,酵母粉10 g/L,(NH4)2SO4 0.25 g/L,CaCO3 0.8g/L,CoCl2·6H2O 0.02 g/L,NaMoO4 0.022 g/L,MnSO4 0.002 2 g/L,α-淀粉酶0.1 g/L。
种子罐培养基:玉米淀粉33–40 g/L,豆饼粉8–15 g/L,酵母粉4–6 g/L,酵母膏4–5 g/L,花生饼粉10 g/L,CoCl2·6H2O 0.03 g/L,有机硅0.42 g/L,GPE 0.42 g/L。
发酵罐培养基:玉米淀粉155–160 g/L,豆饼粉26–30 g/L,酵母粉11–13 g/L,(NH4)2SO4 0.4 g/L,CaCO3 1.1 g/L,CoCl2·6H2O 0.024 g/L,NaMoO4 0.027g/L,MnSO4 0.001 9 g/L,α-淀粉酶0.4 g/L,有机硅0.16 g/L,GPE 0.16 g/L。
1.2 测定方法效价测定:准确称取发酵液1.00 g,加无水甲醇15 mL,置于超声波清洗仪中超声萃取30 min,离心过滤取滤液用HPLC法测定B1a效价。色谱条件:Agilent高效液相色谱仪;C18柱;流动相甲醇︰水(V/V)=9︰1;流速1 mL/min;柱温30 ℃;进样量20 μL;检测波长245 nm。
压缩体积比(Packed mass volume,PMV)测定:采用离心法计算,取10 mL发酵液,4 000 r/min离心10 min,计算固体物质所占比例。
总糖与还原糖的测定:采用DNS法;氨基氮测定采用甲醛滴定法;溶磷测定采用钼酸铵分光光度法。
黏度测定采用NDJ-8S型数字黏度计测定;葡萄糖测定采用SGD-Ⅳ型测糖仪测定。
1.3 培养方法斜面培养:取200 μL经过快速解冻的甘油管保藏的孢子悬液于装有固体培养基的茄子瓶中,涂布均匀,于28 ℃隔水式恒温培养箱静置培养7 d。
种瓶培养:采用斜面挖块接种,用无菌铲从孢子已经成熟的斜面上挖取1 cm2大小菌苔接种到种子培养基中,于28 ℃、240 r/min培养36–40 h。
发酵摇瓶培养:按照5%的接种量将种子液接种于发酵培养基中,28 ℃、240 r/min旋转式摇床培养10 d。
100 L反应器发酵培养:种子罐为50 L反应器,发酵罐为100 L反应器(反应器为上海国强生化工程装备有限公司产品,配备控制系统、尾气分析系统以及具备数据采集与分析功能的BIOSTAR软件包),其装液量分别为25 L和50 L;发酵罐接种量为10%,培养温度28 ℃,培养周期330 h。
2 结果与分析2.1 不同氮源对阿维菌素生物合成的影响酵母粉、酵母膏、玉米浆以及硫酸铵是在微生物发酵工业中常使用的几种速效氮源,其中酵母膏是酵母细胞经过破壁水解之后的产物,所以其营养成分相对酵母粉要更加丰富也更加便于利用。考察了酵母粉、酵母膏、玉米浆以及少量无机氮源硫酸铵对阿维菌素B1a生物合成的影响。
对比分析酵母粉、酵母膏、玉米浆以及硫酸铵这4种物质作为氮源时,过程PMV、总糖、溶磷、氨基氮、B1a变化如图 1 (A、B、C、D、E)所示,从图中可以看出以酵母膏作为主要氮源的实验组在初级生长阶段48 h之前菌体量迅速上升,期间伴随着总糖的快速消耗以及氨基氮和溶磷的快速下降,到48 h PMV明显高于其他实验组,其PMV达到55%,但是随着发酵的进行,72 h之后,PMV开始持续显著下降,可能是菌丝前期快速生长会形成菌核相对密实且大的菌球,此时菌球中心的菌丝因为传质以及传氧受到限制而自发裂解,造成PMV的快速下降。由于前期菌体快速生长消耗了大量糖以及氮源物质,后期维持菌体代谢依旧需要消耗大量的能源物质,所以其后期耗糖量较大,但是产物阿维菌素B1a的合成速率却不高,大量的碳源都用于维持自身代谢而并非流向产物合成相关途径。
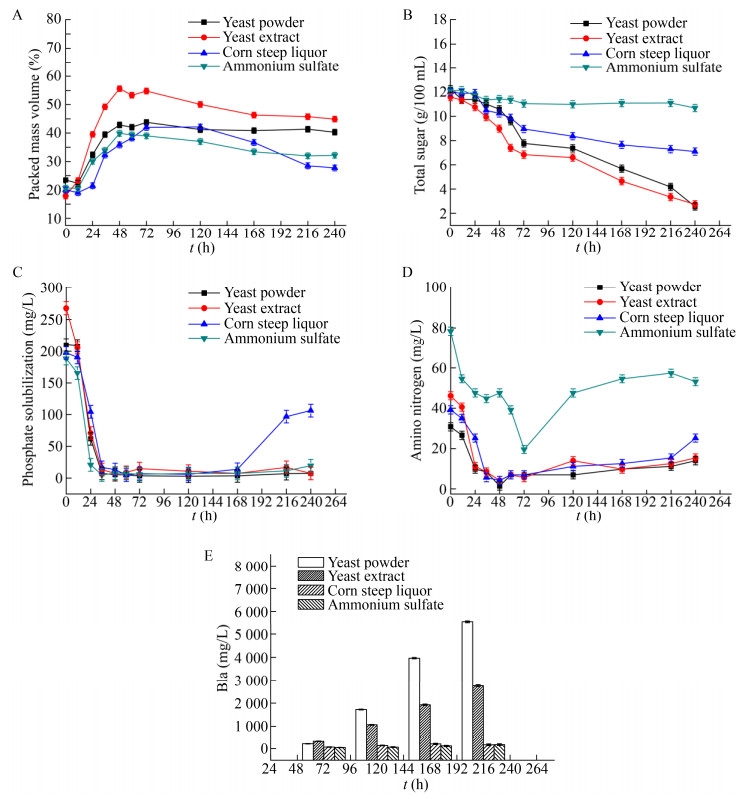 |
| 图 1 不同氮源对PMV (A)、总糖(B)、溶磷(C)、氨基氮(D)以及B1a (E)浓度的影响 Fig. 1 Effects of nitrogen on the PMV (A), total sugar (B), residual soluble phosphate (C), amino nitrogen (D) and B1a concentration (E). |
| 图选项 |
以玉米浆和以0.5%硫酸铵替代培养基中的部分酵母粉的实验组表现出严重的产物抑制现象,两组都在发酵中后期菌球外菌丝松散脱落,大部分菌球裂解自溶,造成菌浓明显下降,这些从发酵中后期氨基氮和溶磷开始回升可以得到验证。在60 h之前,玉米浆组的糖耗与酵母粉组基本一致,最大菌浓也基本一致,但是60 h进入产素期以后可以明显观察到耗糖速率开始小于酵母粉组并且几乎没有产物的合成,此过程可能是由于玉米浆的部分代谢产物对阿维菌素的生物合成会有一定的影响。当用0.5%硫酸铵替代培养基中部分酵母粉之后,整个发酵过程中耗糖速都明显低于其他组,特别是在72 h之后,培养基中总糖基本不再下降,同时也几乎不生产阿维菌素B1a,郑梦杰等[15]研究了铵根离子对阿维菌素生物合成的影响,其结果表明在整个发酵过程中,铵根离子能够抑制包括淀粉酶以及参与糖代谢相关酶的活性从而抑制产物的合成。
从结果来看,以酵母粉作为氮源的实验组表现出较强的产物合成能力,产素过程中一直保持较快的增长速度。发酵初期菌丝处于快速生长阶段,48 h PMV达到43%,与酵母膏组相比其最大值较低,但是整个发酵过程中PMV能够维持在40%左右,次级代谢阶段也能保持相对稳定的耗糖速率以及较快的产物合成速率,这可能是由于工业酵母粉微溶于水,没有经过水解等处理,其中营养物质相对酵母膏释放速度较慢,所以前期菌丝不会出现疯长的情况,主要形成较为均匀的菌球,整个过程中菌球也较小而均匀,陈凝等[14]通过研究菌形对阿维菌素合成的影响时发现,在发酵中后期保持一定的菌球尺寸确实有利于产物阿维菌素的合成,与本实验结果一致。由于酵母粉相对迟效,在发酵后期依旧能够给菌体提供足够的氮源用于提供前体氨基酸以及维持菌体的自身代谢,保持一定的菌球尺寸以及相对稳定的PMV。
庄英萍等[16]在进行红霉素的发酵调控中发现,氮源中的部分碳骨架可以用于合成菌体结构,并且这对次级代谢产生目的产物有一定的影响,菌体前期以部分黄豆饼粉作为碳源合成菌体的实验组比前期单纯使用葡萄糖合成菌体的对照组的最终放罐效价要高60%。通过分析以上不同氮源以及测定的各离线参数,可以发现不同种类的氮源对阿维菌素的合成有着重要的影响,尤其是在发酵中后期保证足够的氮源维持细胞代谢活性以及提供足够的前体氨基酸[1]可以促进产物的合成。
2.2 基于CER补加酵母粉的补料策略在2.1的摇瓶实验中已经探究了不同氮源对阿维菌素合成的影响,与其他氮源相比,酵母作为氮源的实验组产物Bla浓度最高。推测其原因是使用速效氮源的实验组到了发酵后期由于受到氮源限制,造成菌体活性降低,菌球裂解,菌球外层菌丝脱落,菌球尺寸大幅度降低,菌浓降低,从而严重影响到产物合成能力。基于此,在发酵中后期基于残糖补加碳源的原始工艺的基础上基于CER额外补充酵母粉以维持发酵中后期的PMV、菌丝活性以及较高的产物合成速率。酵母粉中除了含有大量的氮源之外还有细胞生长所必需的微量元素以及生长因子,因此在发酵中后期补加酵母粉能够维持菌浓,保证菌的活性以及为产物合成提供必需的氮源。
对照组按照原工艺从130 h之后根据残糖浓度补加淀粉液化液,在发酵中后期将残糖控制在2 g/L以上。实验组在对照组的基础上额外补入酵母粉将CER维持在相对稳定的水平。从图 2中可以明显看到实验组与对照组在补料之前效价基本同步增长,其他各项参数包括最大菌浓、溶磷以及CER基本同步变化。130 h补料之后效价开始出现分叉点,实验组保持较快的产物合成速度,耗糖速率开始加快,CER回升并且在整个发酵过程中能够维持在4 mmol/(L·h)左右,这说明额外的氮源补入可以维持细胞代谢活性,从过程菌浓来看,两组实验在200 h以前菌浓变化基本一致,150–200 h之间CER却存在一定差异,说明在菌体量基本一致的情况下,额外补入酵母粉的实验组菌的代谢活力要明显优于只补碳源的对照组,相对应的实验组的产物合成速率也要高于对照组。到330 h发酵结束,实验组的效价达到8 697 mg/L,对照组效价为6 852 mg/L,实验组效价较对照组高出26.9%。
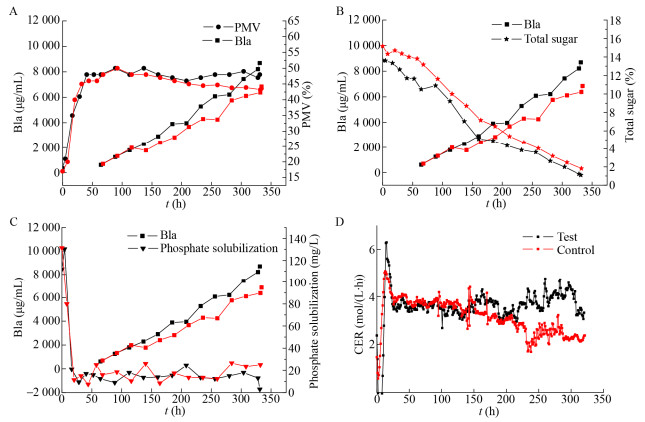 |
| 图 2 不同补料方式下阿维菌素合成过程中B1a与PMV (A)、B1a与总糖(B)、B1a与溶磷(C)以及CER (D)的变化 Fig. 2 Effect of different feeding methods on the tread between Bla and PMV (A), Bla and total sugar (B), Bla and phosphate solubilization (C) and CER (D) of S. avermitilis. |
| 图选项 |
另外,值得注意的是,实验组在200 h以及275 h出现了两次明显的效价不长的现象,从各代谢参数中可以发现伴随着这一现象的同时发酵液中溶磷也有所升高。怀疑造成效价增长停止的现象的最主要因素就是补料过程中带入了过量的无机磷盐。无机磷盐在代谢水平上对链霉菌有着严格的调控[17]。从大量的实验经验中可以发现当培养基中溶解磷含量高于10 mg/L时,会直接造成产物停止合成,所以在阿维菌素发酵中后期补料的原材料时,应该严格控制其中无机磷的含量。
3 讨论本研究对比了4种常见氮源对阿维菌素合成的影响,发现不同氮源对阿维链霉菌的菌丝生长、菌形以及产物合成有较大的影响,其中酵母膏在前期促进菌丝的快速生长,菌浓甚至可以达到50%以上,发酵液黏度过大导致传氧和传质受到影响,造成菌丝形态向发散状态发展;有大量的实验表明最有利于阿维菌素合成的是大小均匀、中间菌核较为紧密的菌球,发酵中后期由于受到底物限制,菌丝活性下降,菌球裂解造成菌浓的快速下降,导致发酵中后期产物合成速度下降。当初始培养基中硫酸铵含量超过0.5%的时候就会在产素期间表现出强烈的产物抑制作用,所以在阿维菌素的发酵过程中要严格控制无机铵盐的含量。当以酵母粉作为氮源的时候,由于酵母粉中的氮源相比酵母膏来说要相对缓释,既避免了前期菌丝的疯长,也为发酵中后期提供足够的氮源维持细胞活性以及产物合成所必需的氨基酸等前体物质。以酵母粉作为氮源的实验组中菌球大小均匀合适,并且在整个发酵过程中能够维持一定的菌球尺寸,有利于产物的合成。以上实验表明,氮源物质在前期菌丝生长以及后期产物合成期间对于维持菌体活性以及菌体形态都有很重要的影响,后期为菌体提供足够的氮源物质能有效提高菌体活性、维持菌体形态以及提高产物的合成。基于以上实验结论,在100 L小试规模上根据在线参数CER补加酵母粉,将发酵过程中后期CER控制在4 mmol/(L·h)的水平,补加酵母粉之后能够促进糖的吸收利用,维持菌体活性,维持菌体浓度以及一定的菌球尺寸并且可以大幅度提高B1a效价,最终实验组产物B1a浓度达到8 697 mg/L,较对照组提高26.9%。
He等[18]发现在链霉菌中普遍存在的氮源调控因子GlnR不但是氮源全局调控因子,还可以通过链霉菌中的特异性途径直接调节阿维菌素的合成,GlnR蛋白可以特异性激活阿维菌素合成过程中的一个正调控因子AveR的转录,促进阿维菌素的合成。GlnR响应环境中氮源变化,表达量增大,随着GlnR蛋白表达量的增大可以特异性激活aveR从而促进阿维菌素的合成。本实验结果中氮源对于产物合成的促进作用是否是由于受到glnR基因的调控还需要进一步研究及验证。
本文在基于残糖补加氮源的基础上,基于过程CER补加酵母粉成功将B1a效价从6 852 mg/L提高至8 697 mg/L,提高了26.9%,这一实验结果有望在实际生产中有较好的应用。
参考文献
| [1] | Ikeda H, ōmura S. Avermectin biosynthesis. Chem Rev, 1997, 97(7): 2591-2610. |
| [2] | Ikeda H, Kotaki H, Omura S. Genetic studies of avermectin biosynthesis in Streptomyces avermitiiis. J Bacteriol, 1987, 169(12): 5615-5621. DOI:10.1007/BF02899907 |
| [3] | Ikeda H, Ishikawa J, Hanamoto A, et al. Complete genome sequence and comparative analysis of the industrial microorganism Streptomyces avermitilis. Nat Biotehnol, 2003, 21(5): 526-531. DOI:10.1038/nbt820 |
| [4] | Kitani S, Ikeda H, Sakamoto T, et al. Characterization of a regulatory gene, aveR, for the biosynthesis of avermectin in Streptomyces avermitilis. Appl Microbiol Biotechnol, 2009, 82(6): 1089-1096. DOI:10.1007/s00253-008-1850-2 |
| [5] | Li M, Chen Z, Zhang X, et al. Enhancement of avermectin and ivermectin production by overexpression of the maltose ATP-binding cassette transporter in Streptomyces avermitilis. Bioresour Technol, 2010, 101(23): 9228-9235. |
| [6] | Wang SY, Bo YH, Chen JH, et al. Effects of heavy-ion beam irradiation on avermectin B1a and its analogues production by Streptomyces avermitilis. Eng Life Sci, 2018, 18(10): 711-720. DOI:10.1002/elsc.201800094 |
| [7] | Song XQ, Zhang Y, Zhu XD, et al. Mutation breeding of high avermectin B1a-producing strain by the combination of high energy carbon heavy ion irradiation and sodium nitrite mutagenesis based on high throughput screening. Biotechnol Biopr Eng, 2017, 22(5): 539-548. |
| [8] | You DW, Chen J, Chu J, et al. Screening of high-yield avermectins producing strain by complex mutation. Chin J Antibiot, 2005, 30(3): 143-146, 158 (in Chinese). 攸德伟, 谌颉, 储炬, 等. 复合诱变筛选avermectins高产菌株. 中国抗生素杂志, 2005, 30(3): 143-146, 158. |
| [9] | Ikeda H, Kotaki H, Tanaka H, et al. Involvement of glucose catabolism in avermectin production by Streptomyces avermitilis. Antimicrob Agents Chemother, 1988, 32(2): 282-284. |
| [10] | Liang JG, Chu XH, Xiong ZQ, et al. Oxygen uptake rate regulation during cell growth phase for improving avermectin B1a batch fermentation on a pilot scale (2 m3). World J Microbiol Biotechnol, 2011, 27(11): 2639-2644. |
| [11] | Liang JG, Chu XH, Chu J, et al. Oxygen uptake rate (OUR) control strategy for improving avermectin B1a production during fed-batch fermentation on industrial scale (150 m3). African J Biotechnol, 2010, 9(42): 7186-7191. |
| [12] | Chen J, Zhang SL, Chu J, et al. Ethanol evolution rate:a new parameter to determine the feeding rate for the production of avermectins by Streptomyces avermitilis. Biotechnol Lett, 2004, 26(2): 109-113. |
| [13] | Fan L.Avermectin strain screening and optimization of fermentation process[D].Hohhot: Inner Mongolia University, 2017(in Chinese). 樊乐.阿维菌素生产菌种的选育及发酵工艺的优化[D].呼和浩特: 内蒙古大学, 2017. |
| [14] | Chen N, Wang YH, Chu J, et al. Effects of medium composition and feeding strategy on morphology of Streptomyces avermitilis in avermectin fermentation. J Huazhong Agric Univ, 2007, 26(4): 469-501 (in Chinese). 陈凝, 王永红, 储炬, 等. 培养基成分和补料对阿维菌素发酵过程中除虫链霉菌菌丝形态的影响. 华中农业大学学报, 2007, 26(4): 469-501. |
| [15] | Zheng MJ, Bai XF. Mechanism of ammonia ion restraining the avermectin biosynthesis. Chin J Antibiot, 2006, 26(3): 171-175, 183 (in Chinese). 郑梦杰, 白秀峰. 铵离子抑制avermectin生物合成的机理. 中国抗生素杂志, 2006, 26(3): 171-175, 183. |
| [16] | Zhuang YP, Chu J, Zhang SL, et al. Parameter correlation analysis and optimization of process in the early period of erythromycin fermentation. J East China Univ Sci Technol (Nat Sci), 2004, 30(6): 636-639 (in Chinese). 庄英萍, 储炬, 张嗣良, 等. 红霉素发酵过程前期参数相关分析及调控. 华东理工大学学报:自然科学版, 2004, 30(6): 636-639. |
| [17] | Mendes MV, Tunca S, Antón N, et al. The two-component phoR-phoP system of Streptomyces natalensis:Inactivation or deletion of phoP reduces the negative phosphate regulation of pimaricin biosynthesis. Metabol Eng, 2007, 9(2): 217-227. |
| [18] | He JM, Zhu H, Zheng GS, et al. Direct involvement of the master nitrogen metabolism regulator GlnR in antibiotic biosynthesis in Streptomyces. J Biol Chem, 2016, 291(51): 26443-26454. |
