

温州医科大学 检验医学院 生命科学学院,浙江 温州 325035
收稿日期:2019-09-22;接收日期:2019-12-05;网络出版时间:2019-12-25
基金项目:国家自然科学基金(No. 81573110),国家卫生健康委员会科研基金(No. WKJ-ZJ-1928),温州市重大科技专项(No. ZJ2017014),重庆市技术创新与应用发展专项(No. cstc2019jscx-msxmX0431)资助
摘要:人信号淋巴细胞激活分子F7 (SLAMF7/CS1)是一种细胞表面糖蛋白,在多发性骨髓瘤细胞中高度表达。已有研究表明CS1是多发性骨髓瘤较为灵敏且特异的生物标志物。CAR-T细胞免疫疗法是治疗多发性骨髓瘤的新方法,其中CS1 CAR-T细胞免疫疗法针对复发性难治性多发性骨髓瘤有较好的疗效。为了检测CS1 CAR-T细胞上CS1 CAR的表达效率和探寻CAR-T细胞免疫疗法的辅助手段,文中制备了一种CS1-Fc融合蛋白。首先利用PCR技术从已有质粒中扩增得到CS1的胞外段序列,再通过重叠延伸PCR与人IgG1-Fc段相连。将重组片段连接至pMH3真核表达载体上,经酶切鉴定和DNA测序后,将重组质粒pMH3-CS1-Fc-his转染至中国仓鼠卵巢细胞(CHO-S)。经G418加压筛选和流式细胞术鉴定,证实CS1-Fc融合蛋白在CHO-S细胞中获得了表达。利用镍柱对CS1-Fc融合蛋白进行纯化,经Western blotting鉴定,融合蛋白的分子量约为70 kDa。流式细胞术和细胞计数分析结果显示,CS1-Fc融合蛋白能有效检测CS1 CAR的表达效率,证实了CS1-Fc融合蛋白对CS1 CAR-T细胞具有活化、促增殖及促分泌细胞因子的作用。本研究结果为多发性骨髓瘤细胞免疫治疗CAR-T细胞的体外检测和效能强化奠定了实验基础。
关键词:人信号淋巴细胞激活分子F7 (SLAMF7/CS1)CS1-Fc融合蛋白真核表达嵌合抗原受体T细胞多发性骨髓瘤
Eukaryotic expression, protein purification and biological effects research of human CS1-Fc fusion protein
Ruzhang Chen, Xitong Wang, Yanchen Li, Jimin Gao


School of Laboratory Medicine and Life Sciences, Wenzhou Medical University, Wenzhou 325035, Zhejiang, China
Received: September 22, 2019; Accepted: December 5, 2019; Published: December 25, 2019
Supported by: National Natural Science Foundation of China (No. 81573110), Science Foundation of National Health Commission of the People's Republic of China (No. WKJ-ZJ-1928), Science and Technology Major Projects of Wenzhou (No. ZJ2017014), Technology Innovation and Application Development Major Projects of Chongqing (No. cstc2019jscx-msxmX0431)
Corresponding author: Jimin Gao. Tel: +86-577-86699341; E-mail: jimingao64@yahoo.com.
Abstract: Signaling lymphocyte activation family 7 (SLAMF7/CS1) is a cell surface glycoprotein that is highly expressed in multiple myeloma cells. CS1 is a sensitive and specific biomarker for multiple myeloma. CAR-T cell immunotherapy is a new method for the treatment of multiple myeloma. CS1 CAR-T cell immunotherapy has good effect on relapsed refractory multiple myeloma. To detect the expression efficiency of CS1 CAR on CS1 CAR-T cells and to find an auxiliary means to CAR-T cell immunotherapy, we prepared a CS1-Fc fusion protein. First, the extracellular domain of CS1 was amplified from the existing plasmid by PCR and ligated with human IgG1-Fc fragment by overlap extension PCR. The recombinant fragment was ligated into pMH3 eukaryotic expression vector. After restriction enzyme digestion and DNA sequencing, the pMH3-CS1-Fc-his recombinant plasmid was successfully constructed. The recombinant plasmid was transfected into Chinese hamster ovary cell (CHO-S) by liposome. The expression of the CS1-Fc fusion protein in CHO-S cells was identified by flow cytometry after G418 pressure screening. Next, the CS1-Fc fusion protein was purified by nickel column. Western-blot analysis showed that molecular weight of the fusion protein was about 70 kDa was identified by Western blotting. The CS1-Fc fusion protein couldeffectively detect the expression rate of CS1 CAR and promote the activation, proliferation andcytokines secretion of the CS1 CAR-T cells. The results will lay the experimental foundation for the in vitro detection and potentiation of CAR-T cells in multiple myeloma treated with CS1 CAR-T cell.
Keywords: human signaling lymphocyte activation family 7 (SLAMF7/CS1)CS1-Fc fusion proteineukaryotic expressionCAR-Tmultiple myeloma
多发性骨髓瘤(Multiple myeloma,MM)是一种恶性浆细胞病,其特征在于骨髓中的恶性浆细胞异常增生以及单克隆免疫球蛋白或轻链(M蛋白)过度生成[1]。在美国,每年每100 000人发病约5例,多发性骨髓瘤发病率约占所有血液系统恶性肿瘤的10%[2]。在众多的免疫疗法中,嵌合抗原受体T细胞(Chimeric antigen receptor T cells,CAR-T)免疫疗法已经发展成为一种潜在的抗癌疗法,特别是在复发/难治性多发性骨髓瘤中,它表现出很高的缓解率和无进展生存期的延长[3-5]。嵌合抗原受体(Chimeric antigen receptors,CARs)是一种跨膜融合蛋白,由位于胞外的抗原识别域和位于胞内的T细胞活化域及连接两者的铰链区三部分组成。CAR-T细胞是经过基因修饰表达CARs的T细胞[6]。CAR-T细胞与单克隆抗体(mAbs)相同点是两者均是针对特定的细胞表面抗原。理想情况下,它应仅在肿瘤细胞中表达而不在健康组织中表达[7]。与单克隆抗体不同的是,CAR-T细胞不仅能够杀死靶细胞,而且它可以在患者体内持续存在,并诱导发生针对靶抗原的持久免疫应答[4, 8]。
CS1 (CD2 subset 1)也称为信号淋巴细胞活化家族成员7 (Signalling lymphocytic activation molecule F7,SLAMF7),它是一种细胞表面糖蛋白,在多发性骨髓瘤细胞中高度表达,自然杀伤细胞(NK)表达较低,但在正常组织中不表达[9-10]。这使其成为多发性骨髓瘤免疫治疗的理想靶点。美国希望之城医疗中心Wang等研究结果证实在小鼠模型中CS1 CAR-T细胞具有有效的抗肿瘤活性。在体外试验中,加入来那度胺可通过共刺激效应提高CS1 CAR-T细胞的免疫功能。在体内试验中,来那度胺可提高CS1 CAR-T细胞的抗肿瘤活性及持久性[11]。在体外杀伤原发性骨髓瘤细胞实验中,MM患者和健康人的CS1 CAR-T细胞表现出高效的杀伤活性。此外,在异种移植小鼠模型中,CS1 CAR-T细胞能显著抑制髓质和髓外骨髓瘤。重要的是,CS1 CAR-T细胞不仅可以特异性识别多发性骨髓瘤细胞,同时还可以保留CS1低表达的免疫细胞[12]。
Fc-融合蛋白(Fc-fusion proteins)是指利用基因工程技术将免疫球蛋白(IgG、IgA等)的可结晶段(Fragment crystallizable,Fc)与某种具有生物学活性的功能蛋白分子融合而产生的新型蛋白[13]。融合蛋白的Fc段可延长功能蛋白在血浆内的半衰期、提高分子的稳定性,且可与细胞表面的Fc受体特异性结合,发挥相应的生物学功能[14]。据报道,研究人员制备了一种癌胚抗原-Fc融合蛋白(CEA-Fc),发现它可用于检测和激活CEA CAR-T细胞[15]。Ag-Fc融合蛋白亦可用于检测CAR-T细胞表面CARs表达以及用作选择性离体扩增剂。对于CAR-T细胞免疫疗法,获得大规模CAR-T细胞(多达1011个细胞)至关重要。通过用固定的Ag-Fc选择性激活CAR-T细胞,可以诱导细胞扩增[15]。组氨酸标签(His-tag)被广泛用作融合标签,凭借此组氨酸肽段与二价金属离子(镍、锌等)的螯合作用,便于用金属螯合亲和层析纯化蛋白质,也可以用针对组氨酸肽段的抗体来检测该融合蛋白[16]。
根据Ag-Fc融合蛋白和His-tag标签的特性,我们计划制备一种CS1-Fc-his融合蛋白,并验证它对CS1 CAR-T细胞的生物学效应。本研究拟通过构建表达CS1-Fc融合蛋白的CHO-S细胞获得CS1-Fc融合蛋白,初步验证CS1-Fc融合蛋白对CS1 CAR的生物学效应,为CS1 CAR-T细胞的检测提供有效的方法,同时也为增强CS1 CAR-T细胞的效能及扩增打下基础。
1 材料与方法1.1 材料pMH3真核表达质粒和CHO-S细胞(中国仓鼠卵巢细胞)由本实验室保存;人CS1 DNA片段由韩家淮实验室惠赠;人IgG1 Fc片段由本实验室保存;CS1 CAR慢病毒浓缩液由本实验室制备;Escherichia coli Trans5α感受态细胞购自上海桑尼生物技术公司;PCR试剂、胶回收试剂盒和DNA marker购自Genstar公司;限制性核酸内切酶EcoRⅠ和NotⅠ购自NEB公司;质粒小提试剂盒购自OMEGA公司;TAE、氨苄青霉素(Ampicillin)和考马斯快速染色液购自北京索莱宝科技有限公司;引物合成及DNA序列测序均由上海桑尼生物技术公司完成;Ni-NTA柱填料购自美国GE Healthcare公司;Lip2000和G418购自Thermo公司;Bio-CS1 Protein购自ACRO公司;抗人CS1和抗His-tag单克隆抗体购自Abcam公司;APC-SA、FITC-抗人IgG1 Fc、PB-抗人CD69、PB-Live/Dead和APC-抗人CS1等流式抗体购自BioLegend公司。
1.2 方法1.2.1 引物设计与合成文中所用引物见表 1。
表 1 试验所用引物Table 1 Primers used in the study
| Name of primer | Primer sequence (5′–3′) | Restriction site |
| pMH3-F-EcoRI-CS1 | TTTAACCGAAGAATTCGCCACCATGGCTGGTTCCCCAACAT | EcoRⅠ |
| R-linker1-CS1 | CCTCCTCCTGATCCTCCTCCCATGGAGGAATCTGGGTC | |
| F-linker1-Fc | GGAGGAGGATCAGGAGGAGGA | |
| pMH3-R-NotI-his | AAGATCTATGCGGCCGCT | NotⅠ |
| Note: underlined sequences are restriction enzyme sites. | ||
表选项
1.2.2 重组质粒pMH3-CS1-linker-FC-his的构建将PCR扩增得到的CS1胞外端与Fc片段(尾部加His-tag)进行重叠延伸PCR,用限制性内切酶EcoRⅠ和NotⅠ对本实验室保存的重组质粒pMH3-CD19进行双酶切,回收pMH3载体。将产物纯化得到的CS1-linker-Fc-his基因扩增产物与pMH3载体连接,将连接后的产物转化至Trans5α感受态大肠杆菌,挑选阳性克隆,经质粒提取获得重组质粒pMH3-CS1-linker-Fc-his。
1.2.3 融合蛋白表达细胞CS1-Fc-CHO-S的构建及筛选按照Lip2000说明书将重组质粒pMH3-CS1-linker-Fc-his转染至CHO-S细胞,培养24 h后更换含遗传霉素(G418,浓度为1 mg/mL)、不含其他抗生素的DMEM/F12培养基,进行加压筛选,同时用未转染的CHO-S作为对照,继续培养10–14 d。挑取单克隆至96孔板,在含G418的DMEM/F12培养基继续培养。待细胞长满时,吸取上清液作蛋白免疫点杂交(Dot blot),取5 μL培养基上清液点于NC膜上,自然风干后,封闭,抗his抗体孵育,洗膜,山羊抗鼠HRP-IgG孵育,洗膜,曝光。选择点杂交阳性的孔用含G418的DMEM/ F12完全培养基制备细胞悬液(10细胞/1 mL),按每孔0.1 mL细胞悬液接种(即每孔1 cell)。2轮有限稀释后,作胞内染色,通过流式细胞分析鉴定细胞中融合蛋白的表达。
1.2.4 CS1-Fc-CHO-S的鉴定和CS1-Fc融合蛋白的纯化及鉴定96孔板每孔铺0.1×106个细胞,加入适量的DMEM/F12完全培养基,待细胞贴壁过夜,以1:1 000的比例加入高尔基体阻断剂,4–6 h后转入V型底96孔板,PB-Live/Dead染料(1:1 000) 4 ℃避光孵育15 min后,固定破膜,APC抗人CS1抗体(1:400) 4 ℃避光孵育30 min,FACS缓冲液清洗2次,重悬后待流式细胞分析。收集细胞培养上清液,采用Ni-NTA亲和层析柱对CS1-Fc融合蛋白进行纯化、SDS-PAGE分析和Western blotting鉴定。
1.2.5 流式细胞术检测CS1 CAR的表达用Dynabeads CD3/CD28提取健康人的T细胞,将实验室制备的CS1 CAR慢病毒浓缩液按1:1 000的比例稀释于X-VIVO培养基,4 h后换液,继续培养5 d。将细胞转入V型底96孔板,2 500 r/min、4 ℃离心3 min,弃上清,对照孔细胞中加入50 μL FACS缓冲液配制的Biotin-CS1 (稀释比为1:400),实验孔加入50 μL FACS缓冲液配制的CS1-FC融合蛋白,4 ℃避光孵育40 min。清洗1次,弃上清,每孔加入5 μL FACS缓冲液配制的抗体(APC-抗人CS1和FITC-抗人IgG1 Fc抗体稀释比分别为1:400和1:200),4 ℃避光孵育15 min。清洗2次,弃上清,最后每孔用200 μL的FACS缓冲液重悬混匀,待流式细胞分析。
1.2.6 T细胞早期活化分子CD69的检测以0.1×106个CS1 CAR-T细胞铺96孔板,每孔100 μL,加入可溶CS1-Fc (10 μg/mL、50 μg/mL、100 μg/mL)或BSA (10 μg/mL、50 μg/mL、100 μg/mL),放入细胞培养箱中培养24 h,或将细胞铺在提前包被CS1-Fc的96孔板(用DPBS将蛋白稀释至5 μg/mL,100 μL/孔,4 ℃包被过夜后DPBS清洗2遍,吸干液体即可),放入细胞培养箱中培养24 h,设置不加蛋白的对照组。取出细胞转入V型底96孔板,2 500 r/min、4 ℃离心3 min,弃上清,每孔加入50 μL的PB-抗人CD69抗体(1:200稀释),4 ℃避光染色15 min。清洗2次,弃上清,最后每孔用200 μL FACS缓冲液重悬混匀,进行流式细胞分析。
1.2.7 细胞因子IFN-γ的检测以100 μL含0.1×106个CS1 CAR-T细胞铺96孔板,分别加入CS1-Fc (100 μg/mL)或加入CS1-Fc (DPBS稀释至5 μg/mL,100 μL/孔),4 ℃包被过夜。放入细胞培养箱中培养24 h后,加入高尔基体阻断剂及细胞刺激剂(PMA+离子霉素),培养4 h。设置不加蛋白的对照组。取出细胞转入V型底96孔板,2 500 r/min、4 ℃离心3 min,弃上清,PB-Live/Dead染料(1:1 000) 4 ℃避光孵育15 min后,4%多聚甲醛(PFA)避光4 ℃固定20 min。1×BD Wash常温避光孵育30 min,离心后每孔孵育50 μL的APC-抗人IFN-γ抗体(1:200稀释),4 ℃避光染色40 min。清洗2次,弃上清,最后每孔用200 μL的FACS缓冲液重悬混匀,待流式细胞分析。
1.2.8 细胞增殖实验将含CS1 CAR-T细胞的Ep管置于磁力架上,放置3 min,磁珠将吸附靠近磁力架的管壁上,小心吸出细胞悬液。用计数板计数,实验组用含100 μg/mL融合蛋白的X-VIVO培养基(对照组用不含融合蛋白的X-VIVO培养基)将细胞稀释,每孔以100 μL含0.1×106个CS1 CAR-T细胞铺96孔板,37 ℃培养箱培养。每两天在显微镜下观察细胞状态,计数板计数,并加入用含融合蛋白的X-VIVO培养基确保融合蛋白浓度为100 μg/mL。
1.2.9 统计学分析数据代表至少3次独立实验结果。实验数据用x±s来表示,统计学分析使用非配对t检验,数据统计分析和图表制作均采用Graphpad Prism 7.0,差异在P < 0.05时被认为具有统计学意义。(*P < 0.05,**P < 0.01,***P < 0.001,****P < 0.000 1)。
2 结果与分析2.1 重组质粒pMH3-CS1-Fc-his的构建及鉴定以人CS1线性DNA (全长1 005 bp)为模板,PCR扩增1–678 bp,其中包含信号肽(66 bp)和胞外段(612 bp)。再经重叠延伸PCR分别将人Fc段与CS1相连。CS1-linker-Fc-his片段全长为1 479 bp,N端为CS1片段,中间有一段24 bp的linker,之后是693 bp的人Fc段,C端为His标签。CS1-linker-Fc-his的结构示意图见图 1A。用限制性内切酶EcoRⅠ和NotⅠ对重组质粒pMH3-CD19进行双酶切,与CS1-linker-Fc-his片段进行连接,从而构建得到重组质粒pMH3-CS1-Fc-his。用限制性内切酶EcoRⅠ和NotⅠ对其进行双酶切,可见插入的CS1-linker-Fc-his (1 479 bp)片段(图 1B)。将质粒送测序,测序结果与基因序列一致,说明该质粒构建成功。
 |
| 图 1 重组质粒pMH3-CS1-linker-Fc-his的构建及鉴定 Fig. 1 Construction and identification of recombinant plasmid pMH3-CS1-linker-Fc-his. (A) Schematic diagram of CS1-linker-Fc-his. (B) Restriction enzyme digestion of recombinant plasmid pMH3-CS1-linker-Fc-his. M: DNA marker; 1–2: recombinant plasmid pMH3-CS1-linker-Fc-his. |
| 图选项 |
2.2 CS1-Fc-CHO-S细胞株的构建及鉴定将重组质粒pMH3-CS1-Fc-his通过脂质体转染至CHO-S细胞,经1 mg/mL G418筛选2周后,取上清液进行蛋白斑点杂交,以mGM-CSF-his作为阳性对照,可见转染的CHO-S细胞表达融合蛋白(图 2A)。在显微镜下挑取单克隆至96孔板,在含1 mg/mL G418的培养基中培养2周,取上清液作点杂交,筛选出表达CS1-Fc融合蛋白的CHO-S单克隆细胞(CS1-Fc-CHO),14号孔信号最强(图 2B)。将阳性细胞作第一次有限稀释,培养2周后,取上清液作点杂交,32号孔信号最强(图 2C)。第2次有限稀释后,可见大多数孔阳性信号均较强,C10号孔为最强(图 2D)。将C10孔的细胞扩大培养后,进行胞内染色检测,证实CS1-Fc融合蛋白表达的阳性率可达到99.9%以上(图 3),说明该细胞株构建成功。
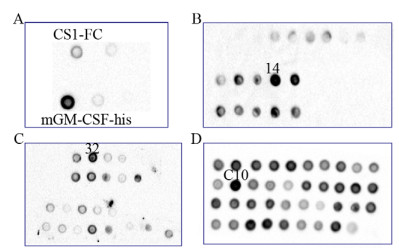 |
| 图 2 蛋白斑点杂交筛选表达CS1-Fc融合蛋白的CHO-S细胞 Fig. 2 Screening of CHO-S cells expressing CS1-Fc fusion protein by protein dot blotting. |
| 图选项 |
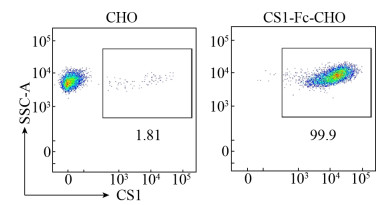 |
| 图 3 流式细胞术检测CS1-Fc-CHO-S细胞株的阳性表达率 Fig. 3 Expression of CS1-Fc in CHO-S cells analyzed by flow cytometry. |
| 图选项 |
2.3 CS1-Fc融合蛋白纯化及鉴定将收集的上清液经0.22 μm滤器过滤后,进行镍柱亲和层析纯化。经SDS-PAGE鉴定,CS1-Fc融合蛋白以单体(70 kDa)和二聚体(140 kDa)为主(图 4A)。蛋白印迹(抗His-tag抗体)结果显示,CS1-Fc融合蛋白的分子量大小为70 kDa (图 4B),CS1-Fc融合蛋白能与抗人CS1抗体发生特异性反应(图 4C)。
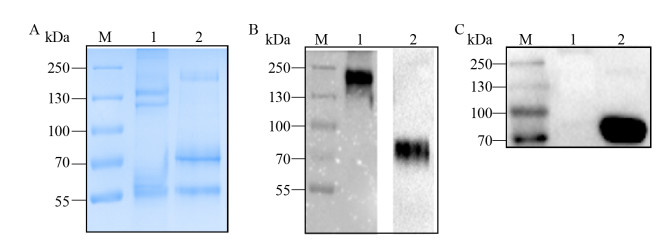 |
| 图 4 CS1-Fc融合蛋白的SDS-PAGE与Western blotting分析 Fig. 4 SDS-PAGE and Western blotting analysis of CS1-Fc fusion protein. (A) The analysis of SDS-PAGE. (B) The analysis of Western blotting (anti-his tag). (C) The analysis of Western blotting (anti-human CS1). M: protein marker; 1: non-reducing CS1-Fc fusion protein; 2: reduced CS1-Fc fusion protein. |
| 图选项 |
2.4 CS1-Fc融合蛋白检测CS1 CAR的表达CS1-Fc融合蛋白的CS1部分可以作为抗原部分与CS1 CAR结合,Fc片段可以作为检测抗原被FITC-抗人IgG1 Fc流式所检测,因而可能具有检测CS1 CAR表达效率的能力。我们分离了外周血PMBC,通过Dynabeads分离T细胞。培养24 h后,将制备的CS1 CAR慢病毒转导至T细胞中,培养5 d后,取部分T细胞,在磁力架上将beads脱掉,对T细胞上CS1 CAR的表达效率进行流式细胞分析。结果显示,CS1-FC融合蛋白与商品化Biotin-CS1的检测结果相似(图 5),这表明CS1-Fc融合蛋白具有较好地检测CS1 CAR表达效率的能力。
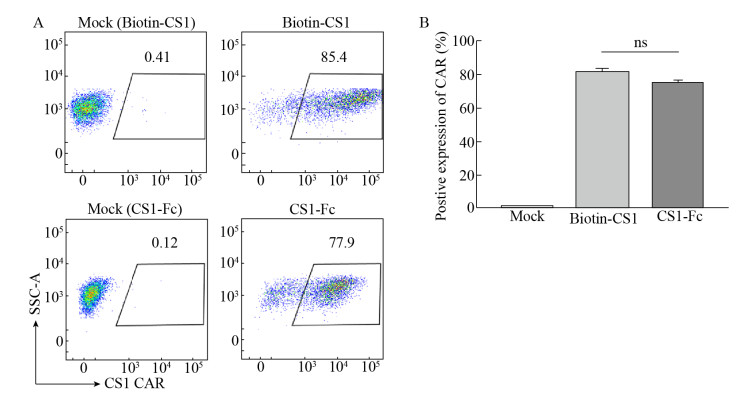 |
| 图 5 CS1-Fc融合蛋白检测CS1 CAR-T细胞上CS1 CAR的表达率 Fig. 5 Detection of CS1 CAR expression rate on CS1 CAR-T cells by CS1-Fc fusion protein. (A) The analysis of flow cytometry. Mock: T cell. (B) Comparison of detection effects of Biotin-CS1 and CS1-Fc. ns: not significant. |
| 图选项 |
2.5 CS1-Fc融合蛋白的生物学效应为了验证CS1-Fc融合蛋白对CS1 CAR-T细胞的生物学效应,我们从细胞活化、细胞因子及增殖等方面进行了实验。
2.5.1 CS1-Fc融合蛋白对CS1 CAR-T细胞的激活作用将BSA和CS1-Fc融合蛋白以10 μg/mL、50 μg/mL、100 μg/mL的浓度梯度与CS1 CAR-T细胞在37 ℃、5% CO2条件下共孵育24 h后,用流式细胞术对细胞早期活化标志CD69的表达进行检测。研究结果显示,与CS1-Fc融合蛋白共孵育24 h后,CS1 CAR-T细胞表面CD69表达明显升高。与BSA组相比,差异有统计学意义(P < 0.001) (图 6)。CS1 CAR-T细胞与固相结合的CS1-Fc (包被浓度为5 μg/mL)共孵育24 h后,CD69的表达率为70.7% (图 7)。表明固相结合的CS1-Fc融合蛋白能更有效地激活CS1 CAR-T细胞。
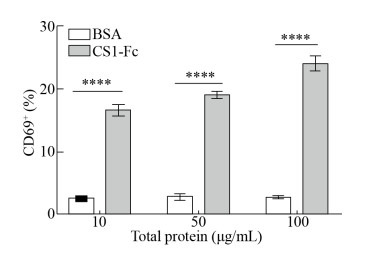 |
| 图 6 CS1-Fc融合蛋白与CS1 CAR-T细胞共孵育后早期活化标志CD69的表达率 Fig. 6 Expression of early activation marker CD69 after CS1-Fc fusion protein was co-incubated with CS1 CAR-T cells. ****P < 0.000 1. |
| 图选项 |
 |
| 图 7 不同形式CS1-Fc融合蛋白与CS1 CAR-T细胞共孵育后早期活化标志CD69表达率的流式分析 Fig. 7 Flow cytometry analysis of early activation marker CD69 expression rate after co-incubation of CS1-Fc fusion protein with CS1 CAR-T cells. Mock: no protein; CS1-Fc: souble CS1-Fc (100 μg/mL); pCS1-Fc: plate-bound CS1-Fc. |
| 图选项 |
2.5.2 CS1-Fc融合蛋白对CS1 CAR-T细胞的促细胞因子分泌作用将健康人的T细胞与CS1-Fc共孵育24 h,并将CS1 CAR-T细胞分别与可溶性形式的CS1-Fc (100 μg/mL)和固相结合的CS1-Fc (5 μg/mL)共孵育24 h,以细胞刺激剂(PMA+离子霉素)作为对照。流式细胞分析结果显示,CS1-Fc不能促进健康人的T细胞分泌IFN-γ,而不同形式的CS1-Fc均能特异性地促进CS1 CAR-T细胞分泌IFN-γ,差异有统计学意义(P < 0.001) (图 8和9)。
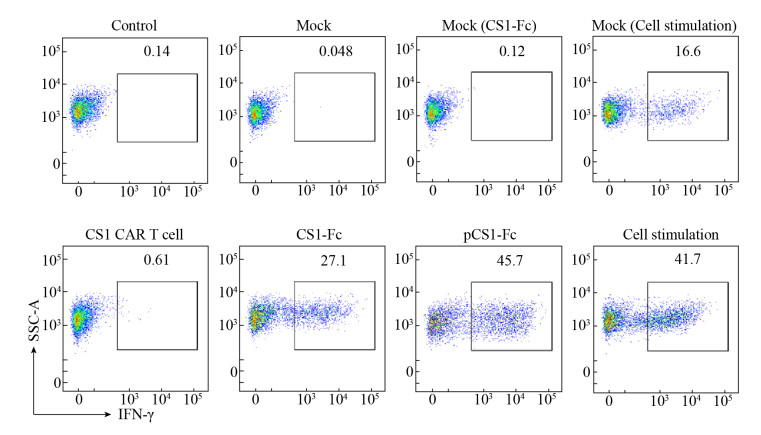 |
| 图 8 不同形式CS1-Fc融合蛋白与CS1 CAR-T细胞共孵育后细胞因子IFN-γ表达率的流式分析 Fig. 8 Flow cytometry analysis of cytokine IFN-γ expression rate after co-incubation of CS1-Fc fusion protein with CS1 CAR-T cells. Mock: T cell; CS1-Fc: souble CS1-Fc; pCS1-Fc: plate-bound CS1-Fc; cell stimulation: PMA+Ionomycin. |
| 图选项 |
 |
| 图 9 不同形式CS1-Fc融合蛋白与CS1 CAR-T细胞共孵育后细胞因子IFN-γ表达率的统计分析 Fig. 9 Statistical analysis of expression rate of cytokine IFN-γ after co-incubation of CS1-Fc fusion protein with CS1 CAR-T cells. Mock: T cell; CS1-Fc: souble CS1-Fc; pCS1-Fc: plate-bound CS1-Fc; cell stimulation: PMA+ Ionomycin. *P < 0.1, ***P < 0.001, **** P < 0.000 1. |
| 图选项 |
2.5.3 CS1-Fc融合蛋白对CS1 CAR-T细胞的促增殖作用将CS1 CAR-T细胞与CS1-Fc共孵育,同时设置未加蛋白组为对照,每两天计数并加入培养基和蛋白,使蛋白浓度达到100 μg/mL,共孵育7 d。结果显示,加入CS1-Fc融合蛋白的CS1 CAR-T细胞数目明显增加,与未加蛋白组相比,差异有显著统计学意义(P < 0.001) (图 10)。
 |
| 图 10 CS1-Fc融合蛋白与CS1 CAR-T细胞共孵育后细胞数目的统计分析 Fig. 10 Statistical analysis of cell number after CS1-Fc fusion protein co-incubation with CS1 CAR-T cells. **P < 0.01, **** P < 0.000 1, ns: not significant. |
| 图选项 |
3 讨论CAR-T细胞是经过基因修饰表达CARs的T细胞[6]。CARs是模块化的,其中每个功能结构域都允许部分替代,具有很强的通用性。例如,多种靶抗原结合部分,包括单链抗体(scFv)和纳米抗体,可以充当CARs的配体结合结构域。与天然的T细胞受体(TCR)复合物不同的是,CARs可以识别抗原而不需要经过主要组织相容性复合物(MHC)分子的提呈,使CARs能够结合更广泛的抗原,包括可溶性抗原[17]。靶向不同抗原的CAR-T细胞具有结合这些可溶性抗原的能力,并产生生物学效应[18-20]。德国维尔茨堡大学Gogishvili等研究证实在体外试验中,CS1 CAR-T细胞对于未经治疗的、难治复发型患者的多发性骨髓瘤(MM)细胞都表现出快速细胞溶解作用。此外,在小鼠活体试验中,CS1 CAR-T细胞对骨髓内外MM细胞均具有抑制活性[12]。
我们制备的CS1-Fc融合蛋白由CS1的胞外区和人IgG1的Fc段组成。结果显示出CS1-Fc融合蛋白能特异性结合CS1抗体,同时也能结合CS1 CAR。我们通过CS1-Fc融合蛋白与CS1 CAR T细胞孵育,再利用FITC-抗人IgG1Fc抗体检测CS1 CAR-T细胞上CS1 CAR的表达,检测效果与商品化的Biotin-CS1相差无几,且CS1-Fc融合蛋白中的Fc段可延长半衰期,不容易变质,而商品化的Biotin-CS1价格昂贵,容易变质。我们提供的这种检测CS1 CAR表达的手段,能够在体外培养阶段检测CS1 CAR的表达。
现有研究表明,CS1 CAR-T细胞可以在体外杀死高表达CS1的多发性肿瘤细胞[12]。CAR-T细胞的杀靶能力强弱与它的活化有密切的关系。CD69亦称为激活诱导分子(AIM),是NK细胞信号传导基因复合体家族的成员。CD69可作为共刺激信号促进T细胞进一步活化和增殖。静止的T淋巴细胞一般不表达CD69,T细胞通过TCR接受CD3/TCR复合物、佛波醇乙酯(PMA)、植物血凝素(PHA)等刺激信号后,细胞表面即合成和表达一些新的糖蛋白,包括CD69、IL-2受体CD25、转铁蛋白受体CD71,这些分子被称为活化标志,其中最早表达的是CD69[21]。我们的研究结果显示,CS1-Fc融合蛋白在与CS1 CAR-T细胞共孵育后,CS1 CAR-T细胞上的CD69表达水平明显升高,提示CS1-Fc融合蛋白能特异地激活CS1 CAR-T细胞。我们的研究还显示CS1-Fc融合蛋白以固相结合形式相较可溶形式的CS1-Fc融合蛋白能更有效地活化CS1 CAR,原因可能在于IgG对聚苯乙烯等固相具有较强的吸附力,结合多发生在Fc段,因而CS1部分可更好地暴露而被CS1 CAR所识别。
CS1 CAR-T细胞免疫疗法的主要困难在于体内外增强CS1 CAR-T细胞的生存和扩增。目前,CAR-T细胞培养是依赖于抗CD3抗体(单独或与抗CD28抗体组合)和细胞因子。对于CAR-T细胞免疫疗法来说,如何获得大规模的CAR-T细胞至关重要[22]。已有研究表明,在适当的条件下,活化的T细胞可以通过同源抗原再活化以达到扩增[23-24]。我们的研究结果显示,CS1-Fc融合蛋白可以在可溶形式下促进CS1 CAR-T细胞的增殖,推测这种选择性增殖是由于融合蛋白的CS1片段被CS1 CAR所识别并结合,活化了CS1 CAR-T细胞。
本研究首次通过质粒构建、脂质体转染和G418加压筛选等方法成功地构建了CS1-Fc-CHO-S细胞,并运用镍柱亲和层析分离纯化制备了CS1-Fc融合蛋白。我们发现CS1-Fc融合蛋白能有效地检测CS1 CAR-T细胞中CS1 CAR的表达,并且表现出在体外某些条件下特异性激活CS1 CAR-T细胞、促进增殖和细胞因子分泌的能力。CS1-Fc融合蛋白是否可在体内作用于CS1 CAR-T细胞有待进一步研究的验证。
参考文献
| [1] | Al-Hujaily EM, Oldham RAA, Hari P, et al. Development of novel immunotherapies for multiple myeloma. Int J Mol Sci, 2016, 17(9): 1506. DOI:10.3390/ijms17091506 |
| [2] | Palumbo A, Bringhen S, Ludwig H, et al. Personalized therapy in multiple myeloma according to patient age and vulnerability: a report of the European Myeloma Network (EMN). Blood, 2011, 118(17): 4519-4529. DOI:10.1182/blood-2011-06-358812 |
| [3] | Kumar SK, Dispenzieri A, Lacy MQ, et al. Continued improvement in survival in multiple myeloma: changes in early mortality and outcomes in older patients. Leukemia, 2014, 28(5): 1122-1128. DOI:10.1038/leu.2013.313 |
| [4] | June CH, O'Connor RS, Kawalekar OU, et al. CAR T cell immunotherapy for human cancer. Science, 2018, 359(6382): 1361-1365. DOI:10.1126/science.aar6711 |
| [5] | Hudecek M, Einsele H. Myeloma CARs are rolling into the clinical arena. Blood, 2016, 128(13): 1667-1668. DOI:10.1182/blood-2016-08-729467 |
| [6] | Mikkilineni L, Kochenderfer JN. Chimeric antigen receptor T-cell therapies for multiple myeloma. Blood, 2017, 130(24): 2594-2602. DOI:10.1182/blood-2017-06-793869 |
| [7] | Morgan RA, Yang JC, Kitano M, et al. Case report of a serious adverse event following the administration of T cells transduced with a chimeric antigen receptor recognizing ERBB2. Mol Ther, 2010, 18(4): 843-851. DOI:10.1038/mt.2010.24 |
| [8] | Brentjens RJ, Rivière I, Park JH, et al. Safety and persistence of adoptively transferred autologous CD19-targeted T cells in patients with relapsed or chemotherapy refractory B-cell leukemias. Blood, 2011, 118(18): 4817-4828. DOI:10.1182/blood-2011-04-348540 |
| [9] | Di Bernardo A, Macor P, Guarnotta C, et al. Humoral immunotherapy of multiple myeloma: perspectives and perplexities. Exp Opin Biol Ther, 2010, 10(6): 863-873. DOI:10.1517/14712591003774063 |
| [10] | Malaer JD, Mathew PA. CS1 (SLAMF7, CD319) is an effective immunotherapeutic target for multiple myeloma. Am J Cancer Res, 2017, 7(8): 1637-1641. |
| [11] | Wang XL, Walter M, Urak R, et al. Lenalidomide enhances the function of CS1 chimeric antigen receptor-redirected T cells against multiple myeloma. Clin Cancer Res, 2018, 24(1): 106-119. DOI:10.1158/1078-0432.CCR-17-0344 |
| [12] | Gogishvili T, Danhof S, Prommersberger S, et al. SLAMF7-CAR T cells eliminate myeloma and confer selective fratricide of SLAMF7+ normal lymphocytes. Blood, 2017, 130(26): 2838-2847. DOI:10.1182/blood-2017-04-778423 |
| [13] | Jafari R, Zolbanin NM, Rafatpanah H, et al. Fc-fusion proteins in therapy: an updated view. Curr Med Chem, 2017, 24(12): 1228-1237. |
| [14] | Ghose S, Hubbard B, Cramer SM. Binding capacity differences for antibodies and Fc-fusion proteins on protein A chromatographic materials. Biotechnol Bioeng, 2007, 96(4): 768-779. DOI:10.1002/bit.21044 |
| [15] | Ma QZ, DeMarte L, Wang YW, et al. Carcinoembryonic antigen-immunoglobulin Fc fusion protein (CEA-Fc) for identification and activation of anti-CEA immunoglobulin-T-cell receptor-modified T cells, representative of a new class of Ig fusion proteins. Cancer Gene Ther, 2004, 11(4): 297-306. DOI:10.1038/sj.cgt.7700685 |
| [16] | Structural Genomics Consortium, Architecture et Fonction des Macromolécules Biologiques, Berkeley Structural Genomics Center, et al. Protein production and purification. Nat Methods, 2008, 5(2): 135-146. DOI:10.1038/nmeth.f.202 |
| [17] | Chang ZL, Lorenzini MH, Chen XM, et al. Rewiring T-cell responses to soluble factors with chimeric antigen receptors. Nat Chem Biol, 2018, 14(3): 317-324. DOI:10.1038/nchembio.2565 |
| [18] | Irving BA, Weiss A. The cytoplasmic domain of the T cell receptor ζ chain is sufficient to couple to receptor-associated signal transduction pathways. Cell, 1991, 64(5): 891-901. DOI:10.1016/0092-8674(91)90314-O |
| [19] | Letourneur F, Klausner RD. T-cell and basophil activation through the cytoplasmic tail of T-cell-receptor zeta family proteins. Proc Natl Acad Sci USA, 1991, 88(20): 8905-8909. DOI:10.1073/pnas.88.20.8905 |
| [20] | Romeo C, Seed B. Cellular immunity to HIV activated by CD4 fused to T cell or Fc receptor polypeptides. Cell, 1991, 64(5): 1037-1046. DOI:10.1016/0092-8674(91)90327-U |
| [21] | Marzio R, Mau?l J, Betz-Corradin S. CD69 and regulatiof the immune function. Immunopharmacol Immunotoxicol, 1999, 21(3): 565-582. DOI:10.3109/08923979909007126 |
| [22] | Schwartzentruber DJ, Hom SS, Dadmarz R, et al. In vitro predictors of therapeutic response in melanoma patients receiving tumor-infiltrating lymphocytes and interleukin-2. J Clin Oncol, 1994, 12(7): 1475-1483. DOI:10.1200/JCO.1994.12.7.1475 |
| [23] | Beecham EJ, Ma QZ, Ripley R, et al. Coupling CD28 co-stimulation to immunoglobulin T-cell receptor molecules: the dynamics of T-cell proliferation and death. J Immunother, 2000, 23(6): 631-642. DOI:10.1097/00002371-200011000-00004 |
| [24] | Iezzi G, Karjalainen K, Lanzavecchia A. The duration of antigenic stimulation determines the fate of naive and effector T cells. Immunity, 1998, 8(1): 89-95. DOI:10.1016/S1074-7613(00)80461-6 |
