

1. 天津大学 化工学院 教育部合成生物学前沿科学中心 系统生物工程教育部重点实验室,天津 300072;
2. 天津大学 天津化学化工协同创新中心,天津 300072
收稿日期:2019-01-03;接收日期:2019-03-25
基金项目:国家自然科学基金(No. 21676190)资助
摘要:在由氧化葡萄糖酸杆菌和普通生酮古龙酸杆菌构建的维生素C两菌一步发酵体系中,为了强化氧化葡萄糖酸杆菌对普通生酮古龙酸杆菌生长和产酸的促进作用,文中在氧化葡萄糖酸杆菌中构建硫辛酸合成功能模块。由含硫辛酸功能模块的氧化葡萄糖酸杆菌和普通生酮古龙酸杆菌组成的两菌一步体系,能减轻普通生酮古龙酸杆菌单菌培养时的生长抑制,强化两菌的互作关系,使维生素C前体(2-酮基-L-古龙酸,2-KGA)的产量提高到73.34 g/L(对照组为59.09 g/L),醇酸转化率提高到86.0%。研究结果为进一步优化维生素C两菌一步发酵体系提供了新思路。
关键词:一步发酵氧化葡萄糖酸杆菌普通生酮古龙酸杆菌硫辛酸
Biosynthesis of α-lipoic acid in Gluconobacter oxydans increases the production of vitamin C by one-step fermentation
Yu Liu1,2, Enxu Wang1,2, Caihui Pan1,2, Xiutao Dong1,2, Mingzhu Ding1,2


1. Key Laboratory of Systems Bioengineering (Ministry of Education), Frontier Science Center for Synthetic Biology, School of Chemical Engineering and Technology, Tianjin University, Tianjin 300072, China;
2. Collaborative Innovation Center of Chemical Science and Engineering (Tianjin), Tianjin University, Tianjin 300072, China
Received: January 3, 2019; Accepted: March 25, 2019
Supported by: National Natural Science Foundation of China (No. 21676190)
Corresponding author: Mingzhu Ding. Tel: +86-22-60973987; E-mail: mzding@tju.edu.cn.
Abstract: In a one-step fermentation system of vitamin C production with Gluconobacter oxydans and Ketogulonicigenium vulgare, a functional module of α-lipoic acid biosynthesis was constructed in G. oxydans. The engineered G. oxydans was co-cultured with K. vulgare to enhance the growth and 2-keto-L-gulonic acid (2-KGA) production of K. vulgare. This one-step fermentation system alleviated the growth inhibition during the mono-culture of K. vulgare and strengthened the interaction between the two bacteria. Moreover, the yield of vitamin C precursor (2-KGA) increased to 73.34 g/L (the control group was 59.09 g/L), and the conversion of D-sorbitol to 2-KGA increased to 86.0%. This study provides a new idea for further optimizing the one-step fermentation system of vitamin C production.
Keywords: one-step fermentationGluconobacter oxydansKetogulonicigenium vulgareα-lipoic acid
维生素C作为一种高效的抗氧化剂有着异乎寻常的作用,甚至对肿瘤细胞有抑制作用[1-2]。现今为止,工业生产中主要采用“微生物二步发酵法”生产维生素C[3]。然而,在第二步发酵中,普通生酮古龙酸杆菌(Ketogulonicigenium vulgare,小菌)作为产酸菌单独生长长势很弱,需要依靠芽孢杆菌属Bacillus spp.等伴生菌株维持其良好的生长状态和生产效率。关于伴生菌是如何促进小菌生长与产酸的研究,国内外****都很关注。例如,基于系统生物学和生物信息学分析揭示了两菌间相互作用机理[4-7],从小菌生长受到氧化胁迫以及伴生菌解除小菌氧化胁迫等方面进行解析等[8-11]。这些研究都为进一步提高维生素C产量和解析微生物混菌间相互作用方式提供了巨大支持。基于响应面法和遗传算法优化的人工神经网络两种优化模型,Yang等[12]优化了生产2-KGA的混菌发酵培养基成分,将2-KGA产量提高到71.21 g/L。Wang等[13]基于简化的代谢途径构建了K. vulgare的宏观动力学模型,并将反应速率耦合到生物反应器模型中,揭示了混合培养物中K. vulgare和巨大芽孢杆菌Bacillus megaterium两种微生物的生长动力学。Zhang等[14]通过引入种群理论在宏观上模拟了K. vulgare和B. megaterium这两种菌株的相互作用,发现这两种菌株之间的相互作用类型偏向捕食关系。K. vulgare是捕食者,B. megaterium是被捕食者。Zhu等[15]的研究表明B. megaterium菌株中孢子的形成和孢子的稳定性对2-KGA的生物合成有着关键作用。此外,Liu等[16]通过多阶段控制策略,向K. vulgare发酵培养基中添加B. megaterium的细胞内裂解物和细胞外培养液,发现适量的B. megaterium细胞内裂解物和细胞外培养液确实促进了K. vulgare的生长和2-KGA的产生,进一步揭示了芽孢杆菌在生物合成2-KGA的过程中发挥着重要的伴生作用。
然而,常用的伴生菌株多为某芽孢杆菌属,其部分菌株会与主要的小菌或者一步菌存在竞争效应,如植物内生芽孢杆菌Bacillus endophyticus含有代谢L-山梨醇的基因,会与氧化葡萄糖酸杆菌Gluconobacter oxydans竞争代谢底物[17],导致最终醇酸转化率的降低。所以,如果能找到一种伴生菌,既可以促进小菌的生长和产酸,又可以消灭菌株间的竞争效应,将极具应用价值。本课题组在前期的研究中,尝试构建由K. vulgare和G. oxydans组成的两菌体系来实现维生素C一步发酵,因G. oxydans含代谢山梨糖的相关基因,为了消除G. oxydans与K. vulgare的竞争效应,将G. oxydans中与山梨糖代谢相关的脱氢酶进行单基因和双基因的敲除。研究结果表明,敲除基因的G. oxydans确实对K. vulgare的生长和产酸有一定的促进作用[18]。基于传统二步发酵法,Gao等[19]通过基因工程的手段,将K. vulgare中与2-酮基-L-古龙酸(2-KGA)合成相关的关键酶基因,例如山梨糖和山梨酮脱氢酶基因,以不同的组合方式构建到G. oxydans菌中,在工程菌G. oxydans中实现了以山梨醇为底物合成2-KGA的单菌一步发酵,2-KGA产量达4.9 g/L。D-葡萄糖是常用原料里最价廉易得的,而不管是传统二步发酵法还是改进后的一步发酵法的最大的缺陷是未能以D-葡萄糖为生产原料。Anderson等[20]发明了一种以D-葡萄糖为原料实现2-KGA的生物合成方法。该方法通过欧文氏菌Erwinia sp.将D-葡萄糖转化为2, 5-二酮基-D-葡萄糖酸(2, 5-KDG),然后再经棒杆菌Corynebacterium sp.转化为2-KGA,在10 L的发酵罐上总转化率可达84.6%。虽然该方法有着很好的应用前景,但中间产物2, 5-KDG的不稳定性使得该技术难以推广运用,所以通过山梨醇、山梨糖和山梨酮脱氢酶生产2-KGA依然是最优化的方法。
研究表明,某些氨基酸、叶酸、还原型谷胱甘肽等单一物质的添加有助于产酸菌的生长和产酸[21-24]。另外,吡咯喹啉醌(Pyrroloquinoline quinone,PQQ)作为一种辅酶在山梨醇脱氢过程中起到了重要的作用。杜等[25]研究发现,在生产2-KGA所涉及的菌种中,不仅G. oxydans菌中山梨醇脱氢酶的表达需要以PQQ为辅酶[26],K. vulgare菌中的山梨糖和山梨酮脱氢酶的表达也需要以PQQ为辅酶。关于上述结论的前一部分,Miyazaki等[27]在大肠杆菌中也得到了同样的结果,表明导入来源于G. oxydans的山梨醇脱氢酶确实是辅酶PQQ依赖性酶。所以辅酶PQQ在2-KGA的生产过程中有着重要的辅助作用。随着生物技术的发展,越来越多的基因代谢模型被构建分析出来[28]以及全基因组测序信息的公开[29],为研究者们进一步设计和构建更高效的工程化菌株提供了理论基础。
硫辛酸(Alpha lipoic acid)作为丙酮酸脱氢酶系的六大辅因子之一[30],先被还原为二氢硫辛酸,随后在二氢硫辛酸脱氢酶作用下脱氢为氧化型。丙酮酸脱氢酶系由丙酮酸脱氢酶(Pyruvate decarboxynase,E1)、二氢硫辛酸乙酰基转移酶(Dihydrolipoamide acetyltransferase,E2)、二氢硫辛酸脱氢酶(Dihydrolipoamide dehydrogenase,E3)三种酶组成。二氢硫辛酸作为一种强还原剂,能够再生被氧化了的抗氧化剂,如抗坏血酸盐、谷胱甘肽、辅酶Q和维生素E等,从而参与细胞内多种氧化还原反应[31-32]。硫辛酸的生物合成有两条路径,一是通过脂肪酸合成路径的分支进行,二是辛酸从头合成。两条路径合成的辅酶硫辛酸最终都结合在二氢硫辛酸乙酰基转移酶(E2)和甘氨酸剪切系统H蛋白(Glycine cleavage system protein H)上,进而发挥辅酶作用[33]。其中,脂肪酸合成路径又可通过两条线路合成辅酶硫辛酸,本研究按照辛酰-酰基载体蛋白先经硫辛酰基合成酶(LipA)催化后,再经硫辛酰基转移酶(LipB)催化合成辅酶硫辛酸这一路径进行实验设计。因此,本研究通过在G. oxydans中构建硫辛酸功能模块,强化G. oxydans和K. vulgare组成的以D-山梨醇为底物的维生素C两菌一步发酵体系,以期提高两菌一步发酵体系的醇酸转化率以及减少伴生菌的竞争效应。
1 材料与方法1.1 菌株本实验使用的菌株:一步菌:氧化葡萄糖酸杆菌Gluconobacter oxydans H24;小菌:普通生酮古龙酸杆菌Ketogulonicigenium vulgare;均由华北制药集团馈赠。
1.2 培养基与培养条件1.2.1 培养基G. oxydans种子培养基成分:D-山梨醇2%,酵母浸粉0.3%,牛肉膏0.3%,玉米浆0.6%,尿素0.1%,蛋白胨1%,KH2PO4 0.1%,MgSO4 0.02%,CaCO3 0.1%。pH 7.0,121 ℃灭菌20 min。G. oxydans摇瓶单菌发酵培养使用以及混菌摇瓶发酵培养使用。
K. vulgare种子培养基成分:L-山梨糖2%,酵母浸粉0.3%,牛肉膏0.3%,玉米浆0.6%,尿素0.1%,蛋白胨1%,KH2PO4 0.1%,MgSO4 0.02%,CaCO3 0.1%。pH 7.0,121 ℃灭菌20 min。其中L-山梨糖单独灭菌。K. vulgare摇瓶单菌发酵培养使用。
发酵罐培养基成分:D-山梨醇8%,玉米浆1%,KH2PO4 0.1%,MgSO4 0.02%,CaCO3 0.1%,尿素1.2%,pH 7.0。121 ℃灭菌20 min。
1.2.2 培养条件种子培养:一级种子培养,取300 μL甘油菌加入50 mL摇瓶培养基中,将其放入30 ℃、250 r/min摇床。G. oxydans振荡培养24 h,K. vulgare振荡培养48 h。二级种子培养,取一级种子5 mL (10%的接种量)至50 mL摇瓶培养基中,将其放入30 ℃、250 r/min摇床。G. oxydans振荡培养24 h,K. vulgare振荡培养48 h。
摇瓶发酵培养:按10%接种量将一定二级种子液接入50 mL摇瓶发酵液中,将其置于30 ℃、250 r/min的摇床振荡培养。G. oxydans单菌摇瓶发酵32 h左右,K. vulgare单菌摇瓶发酵30 h左右。G. oxydans和K. vulgare混菌摇瓶发酵48 h左右。
发酵罐培养:按10%的接种量(300 mL)将一定二级种子液接入到5 L的发酵罐中,总装液量为3 L,其中包括2.7 L (含240 g D-山梨醇)的发酵罐培养基,大约发酵48 h左右。设定发酵罐温度为30 ℃,pH值调至7.0,空气流量设定为1.5 vvm,转速设置500 r/min,补料时间设置为接菌3 h后开始连续恒速流加,补料速度为每25 s补1 s,补料为120 g D-山梨醇,补料量为500 mL。
1.3 G. oxydans和K.vulgare的单菌摇瓶生长检测光密度法:取1 mL发酵液,在高速离心机中,12 000 r/min离心3 min,将上清移除干净,同时向保留的细胞沉淀中加入1 mL 0.1 mol/L的HCl,吹吸振荡均匀,12 000 r/min离心3 min,倒上清,得到除去碳酸钙的细胞沉淀。取1 mL ddH2O重悬细胞沉淀,根据菌株实际生长情况进行稀释,最后使用紫外可见分光光度计测定菌液在波长600 nm处的吸光度,记作OD600。
1.4 2-KGA的测定取1 mL发酵液,在高速离心机中,12 000 r/min离心3 min,将上清转移至新的1.5 mL EP管中,根据实际情况用流动相(0.5 mmol/L H2SO4)稀释上清液,用高效液相色谱法测定2-KGA的含量。液相设备:泵的型号为Waters 2695,示差检测器为Waters 2414,色谱柱为Bio-Rad HPX-87H;运行条件:检测器温度50 ℃,柱温65 ℃,流速0.6 mL/min。
1.5 G. oxydans感受态细胞的制备和电转化将G. oxydans甘油菌经活化后,接种于固体平板,培养16-20 h;收集全部细胞于50 mL离心管中,迅速冰浴30 min;4 ℃、4 500 r/min离心10 min,弃去上清;然后,先用10 mL预冷的10%甘油洗细胞2次,再用0.5 mL预冷的10%甘油重悬细胞,分装现用或冻存于–80 ℃冰箱。在冰浴条件下,每50 μL G. oxydans感受态细胞中加入5–10 μL目的质粒,待目的质粒与细胞充分接触后转移至冰浴的电转杯中;设定电转条件:电压1.8 kV,电击时间4-6 ms为正常,电击后在无菌条件下迅速加入1 mL无抗种子培养基进行细胞复苏;置于摇床中(30 ℃、180 r/min)培养3–4 h,在低速离心机中,4 500 r/min离心1 min,倒掉多余上清,将剩100 μL左右的菌液重悬并涂布于含庆大霉素(Gen)抗性的固体种子培养基上,置于30 ℃培养箱中培养1–2 d获得转化子。
1.6 混菌体系中G. oxydans和K. vulgare菌体数量的测定利用荧光定量PCR计数法测定混菌体系中G. oxydans和K. vulgare的群体数量。利用TIANGEN的细菌基因组DNA提取试剂盒(离心柱型),进行基因组提取,并以此为DNA模板。
根据G. oxydans和K. vulgare基因组中16S rDNA序列设计引物,分别为K. vulgare: F:5'-AAT GCCAGTCGTCAGGTTGCTT-3',R:5'-CTAGGC CGGTCCTGTAATGTCA-3';G. oxydans:F:5'-GG AAACTGGAGCTAATACCG-3',R:5'-GCTGATC ATCCTCTCAAACC-3'。
利用TIANGEN的RealMaster Mix (SYBR Green)试剂盒进行荧光定量PCR。PCR反应总体系为20 μL,其中包括DNA模板2 μL,10 μmol/L上下引物各0.4 μL,RealMaster Mix/SYBR Solution混合缓冲液9 μL,加超纯水补齐至20 μL。反应程序设定为:94 ℃,2 min;94 ℃,20 s;(Tm+2 ℃),30 s;68 ℃,30 s,40个循环。溶解曲线:95 ℃,5 s;60 ℃,1 min;40 ℃,30 s。
1.7 G. oxydans菌株中相关基因转录水平的测定采用SYBR Green荧光定量PCR方法检测G. oxydans菌株中相关基因的相对表达水平。样品为摇瓶发酵28 h时离心收集的菌体,并用液氮速冻。采用TIANGEN的RNAprep pure培养细胞/细菌总RNA提取试剂盒提取样本RNA,具体操作按产品说明书进行。采用Roche公司的Transcriptor First Strand cDNA Synthesis Kit进行cDNA反转录,操作详见产品说明书。采用TransGen公司的TransStart Top Green qPCR SuperMix进行qPCR反应,操作详见产品说明书的两步法。内参基因选用16S rRNA,每个样品重复3次。采用2–??Ct法计算目的基因的相对表达量[34]。
2 结果与分析2.1 外加硫辛酸对普通生酮古龙酸杆菌发酵的影响目前,在2-KGA的生产过程中,K. vulgare因其生长缺陷而导致单独培养困难,很多研究都在尝试通过添加外源物质提高其生长能力。本研究首先尝试将硫辛酸作为外源因子添加,验证其对普通生酮古龙酸杆菌单菌以及在两菌一步发酵体系中生长和产酸的影响。
2.1.1 外加硫辛酸对普通生酮古龙酸杆菌单菌发酵的影响为了验证外加硫辛酸对K. vulgare单菌生长和产酸的影响,在种子培养基中添加经过滤除菌得到的终浓度为0.64 mg/L硫辛酸[35]进行K. vulgare单菌摇瓶发酵的培养,测定发酵过程中细胞密度(OD600值)的变化(图 1A)以及胞外2-KGA的积累(图 1B)。根据发酵结果,我们发现外加硫辛酸对K. vulgare的生长具有明显的促进作用,但是对2-KGA产量的提高却十分有限。
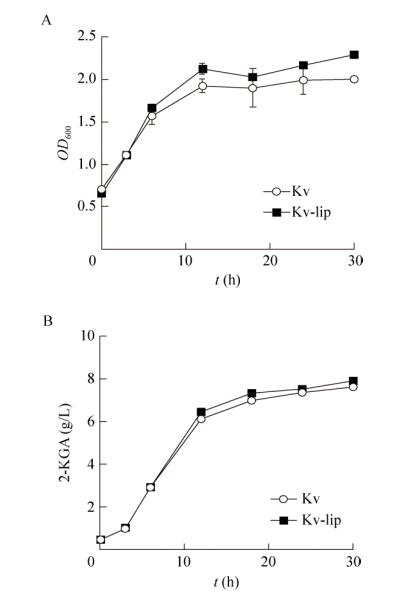 |
| 图 1 外加硫辛酸对普通生酮古龙酸杆菌单菌发酵的影响 Fig. 1 Effect of the addition of α-lipoic acid in the mono-culture system. (A) OD600. (B) 2-KGA production. |
| 图选项 |
在摇瓶中发酵培养30 h后,实验组Kv-lip的OD值达到2.29,相比与对照组Kv的OD值(2.00)提高了12.7%;而实验组胞外2-KGA的浓度为6.84 g/L,较对照组仅提高了4.17%。上述结果表明,外加硫辛酸因促进了K. vulgare的细胞生长,从而促进了K. vulgare生产2-KGA的能力;然而,因没有伴生菌配合的情况下以及摇瓶发酵本身限制限速过多,从而导致2-KGA含量提升有限。
2.1.2 外加硫辛酸对两菌一步发酵生产2-KGA的影响随后,我们探究了外加硫辛酸对由G. oxydans和K. vulgare组成的两菌一步发酵生产2-KGA的影响。参照实验室原有的工艺条件,接菌比例G. oxydans:K. vulgare为1:4 (体积比)的条件下,在一步发酵种子培养基中添加终浓度为0.5、1.0、2.0和4.0 mg/L的硫辛酸,以未加硫辛酸为空白对照,测定该混菌发酵体系中2-KGA的产量(图 2)。由图 2可知,在相同条件下,其中外加1.0 mg/L硫辛酸对混菌体系的产酸达到了12.6 g/L,相比于原始体系的11.2 g/L,提高了11.1%。说明外加适当浓度的硫辛酸确实对一步发酵混菌体系的产酸具有明显的促进作用。我们推测,由于一步发酵过程中多了G. oxydans菌的配合,G. oxydans菌的存在对K. vulgare菌的生长和产酸产生了积极影响,从而导致外加适当浓度的硫辛酸对一步发酵混菌体系生长和产酸的促进作用比对K. vulgare单菌而言有明显提升。
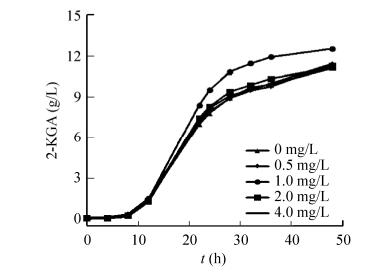 |
| 图 2 外加硫辛酸对一步发酵混菌体系的影响 Fig. 2 Effect of the addition of α-lipoic acid in the co-culture system. |
| 图选项 |
2.2 氧化葡萄糖酸杆菌中硫辛酸功能模块的构建和验证硫辛酸功能模块的构建过程如图 3A所示。以G. oxydans基因组为模板,扩增常用强启动子tufB以及硫辛酸合成途径中两个关键酶的基因lipA (EC=2.8.1.8)和lipB (EC=2.3.1.181),并利用重叠延伸PCR (OE PCR)的方法将三者拼接;然后,用带Hind Ⅲ的上引物和带EcoRⅠ的下引物进行目标片段克隆,最后通过酶切连接的方式(EcoRⅠ/Hind Ⅲ)构建到广宿主游离质粒pBBR1MCS-5上,构成了完整合成途径的Hind Ⅲ- tufB-lipA-lipB-EcoRⅠ模块(lipAB模块),该模块的构建质粒如图 3B所示。该过程在中间宿主E. coli DH5α中完成的,随后将重构好的质粒经电转导入到G. oxydans H24中。在含Gen的固体平板上筛选转化子,提取相应的质粒进行KpnⅠ单酶切和KpnⅠ/SacⅠ双酶切验证(图 3C)后测序得到相应正确的工程化G. oxydans H24菌株。
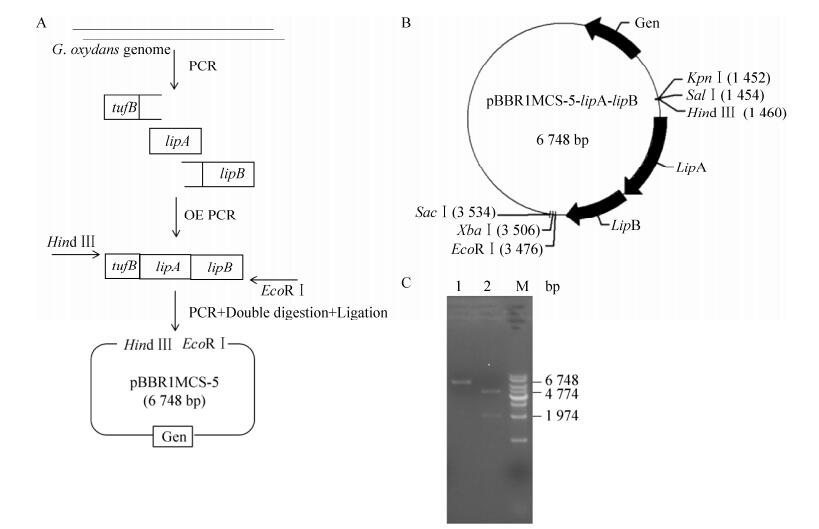 |
| 图 3 硫辛酸合成模块构建及验证图 Fig. 3 Construction and identification of α-lipoic acid synthesis modules. (A) Schematic diagram for α-lipoic acid synthesis modules. (B) Plasmid map. (C) Enzyme-cut verification chart. 1: single digestion; 2: double digestion. |
| 图选项 |
2.3 硫辛酸功能模块效果验证2.3.1 发酵罐中不同接菌比例条件的探究在混菌发酵中,接菌比例的确定对研究结果非常重要。在不同接种比例的条件下,发酵结果存在着显著的差异。为了探究G. oxydans和K. vulgare在发酵罐水平的最适接种比例,本研究设定了5种不同的比例(体积比),G. oxydans:K. vulgare分别为1:4、1:2、2:1、4:1和8:1。发酵结果如图 4A所示,可以看出不同的接菌比例对最终的发酵结果有着显著的影响。同时,根据现有结果推测,利用G. oxydans和K. vulgare在发酵罐水平实现一步混菌发酵的最适接菌比例为4:1 (G. oxydans:K. vulgare)。
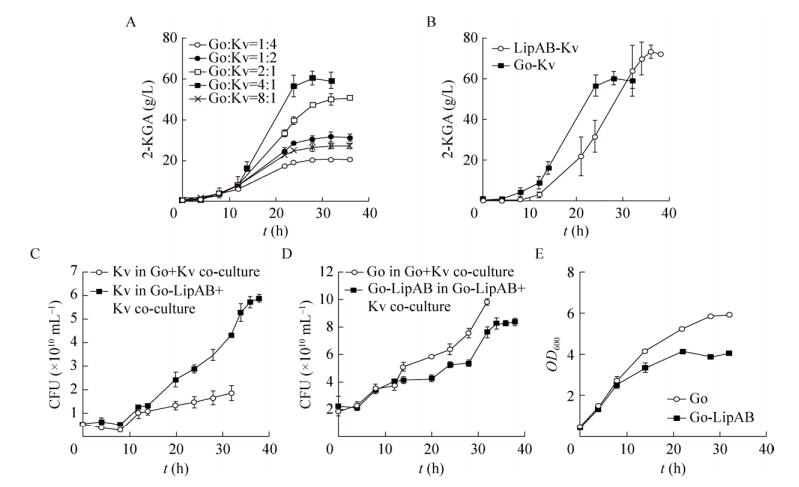 |
| 图 4 硫辛酸功能模块的验证 Fig. 4 Verification of α-lipoic acid functional modules. (A) Effect of different inoculum ratios in 5 L fermenter for one-step fermentation of G. oxydans and K. vulgare. (B) G. oxydans:K. vulgare=4:1, the effect of G. oxydans with α-lipoic acid functional module for one-step fermentation system. (C) The density of K. vulgare in the Go+Kv and Go-LipAB+Kv co-culture system. (D) The density of G. oxydans in the Go+Kv and Go-LipAB+Kv co-culture system. (E) The effect of G. oxydans with α-lipoic acid functional module for mono-culture system. |
| 图选项 |
2.3.2 硫辛酸功能模块的验证在确定最适比例后,将构建的工程菌株与产酸菌以及原始菌株与产酸菌组成两组混菌体系,分别为LipAB组(实验组)和Go组(对照组)。在接种最优比例4:1 (G. oxydans:K. vulgare)的条件下,验证硫辛酸功能模块对混菌发酵罐发酵的影响。
由图 4B可以证明导入硫辛酸功能模块的G. oxydans菌株对一步混菌发酵体系的产酸具有明显促进作用。在相同的发酵罐条件下,表达硫辛酸功能模块的LipAB组的产酸量达到了73.34 g/L,相比较于Go组的产量59.09 g/L,增长了19.43%。基于上述两种混菌体系的发酵罐产酸结果,我们进一步探究了LipAB组与Go组两组混菌体系中菌群数量变化。利用荧光定量PCR的方法对发酵过程中不同取样点的两菌菌数进行测定,如图 4C所示,在发酵前期(0–14 h) K. vulgare在Go+Kv体系和在Go-LipAB+Kv体系的生长状态相似,群体数量有轻微下降的趋势;从14 h开始,K. vulgare在Go+Kv体系的生长要明显优于在Go-LipAB+Kv体系的生长。在32 h时,K. vulgare在Go-LipAB+Kv体系的群体密度达到了(4.32±0.13)×1010 CFU/mL,约为K. vulgare在Go+Kv体系群体密度的2.29倍。上述结果表明,在由Go-LipAB和K. vulgare组成的两菌一步发酵体系中,Go-LipAB不仅促进了K. vulgare的产酸,还促进了K. vulgare的生长。我们推测,在G. oxydans菌株中生成的辅酶硫辛酸可能与二氢硫辛酸乙酰基转移酶(E2)或甘氨酸剪切系统H蛋白结合发挥了作用,刺激了丙酮酸脱酸生成乙酰辅酶A,增加了K. vulgare代谢中的相关酶活力,从而增强了K. vulgare的生长和产酸[36]。同时,依据图 4B的变化趋势,我们可以看出,导入硫辛酸功能模块的G. oxydans在提升混菌发酵体系产酸量的同时,也改变了混菌体系的发酵周期。从图 4B中的趋势可知,尽管LipAB组最终的产酸量较高,但实验的发酵周期长,在36 h左右才结束发酵,相比较于Go组在28 h左右结束,延迟了8 h。此外,LipAB组的静止期较长,开始发酵产酸的时间较晚。我们推测,导入硫辛酸功能模块虽然提升了一步菌辅助产酸菌生长和产酸的能力,但同时,功能模块本身加重了G. oxydans菌株的生长负担。如图 4D所示,在0–12 h,G. oxydans在Go+Kv体系和在Go-LipAB+Kv体系的生长状态基本一致;然而,从12 h后,G. oxydans在Go+Kv体系的生长要明显优于在Go-LipAB+Kv体系的生长。在32 h时,导入硫辛酸功能模块的G. oxydans菌株在Go-LipAB+Kv体系的菌体密度比原始G. oxydans菌株在Go+Kv的菌体密度低22.4%。此外,还在G. oxydans单菌摇瓶发酵中得到了相似的结果,验证了我们的推测,如图 4E所示,在2% D-山梨醇条件下,与LipAB组相比,发酵结束时,对照组中G. oxydans单菌摇瓶生长的OD600是导入硫辛酸功能模块LipAB组的1.44倍。综上所述,在其他培养条件一致的情况下,导入硫辛酸功能模块的G. oxydans菌株无论是单菌摇瓶发酵,还是与K. vulgare组成的两菌一步混菌发酵,均加重了G. oxydans菌株自身的生长负担;根据文献报道[37],硫辛酸合成会消耗一部分总细胞脂肪酸合成能力,这也可能是影响G. oxydans菌株生长的另一原因。因此,以上两种情况均可造成LipAB组发酵周期的延长。此外,LipAB组静止期较长可能与发酵前期K. vulgare的数量有关,因为此时间段K. vulgare的数量有轻微下降的趋势。
2.3.3 硫辛酸功能模块在转录水平上的验证从2.3.2的结果可知,导入硫辛酸功能模块的G. oxydans菌株确实在混菌发酵产酸方面表现出明显的优势,于是进行了更深层次的探究。在生物体内,辛酰-酰基载体蛋白通过硫辛酰基合成酶(LipA)催化后,再由硫辛酰基转移酶(LipB)催化合成辅酶硫辛酸。随后,合成的硫辛酸通过结合在二氢硫辛酸乙酰基转移酶(E2)以及甘氨酸剪切系统H蛋白上,进而发挥辅酶作用[33]。因此,首先将原始G. oxydans菌株(Go)和导入的硫辛酸功能模块的G. oxydans菌株(Go-LipAB)进行单菌发酵培养,取发酵时间28 h的样品进行相关基因的转录水平的探究,包括与硫辛酸合成相关的LipA和LipB,以及以硫辛酸为辅酶发挥作用的二氢硫辛酸乙酰基转移酶(E2)和甘氨酸剪切系统H蛋白。如图 5所示,与硫辛酸合成相关的硫辛酰基合成酶(LipA)和硫辛酰基转移酶(LipB)在导入硫辛酸功能模块G. oxydans菌株的表达量分别是原始G. oxydans菌株的2.27倍和2.99倍。此外,以硫辛酸为辅酶发挥作用的二氢硫辛酸乙酰基转移酶(E2)的表达量是原始G. oxydans菌株的1.95倍,甘氨酸剪切系统H蛋白是原始菌株的2.31倍。可以看出,与硫辛酸功能模块相关的基因均有一定程度的上调。因此,我们推测由于硫辛酸功能模块在G. oxydans菌株的表达,从而促进了以硫辛酸为辅酶的蛋白的表达,因而在混菌发酵产酸时表现出明显的优势。
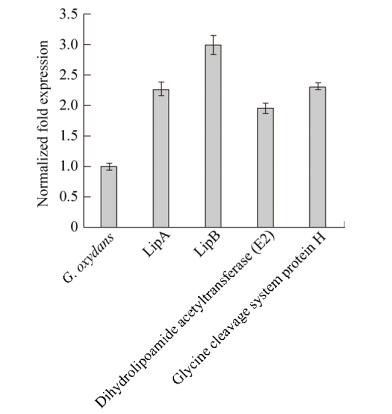 |
| 图 5 在G. oxydans中探究与硫辛酸合成和功能相关基因的表达水平 Fig. 5 The expression levels of genes with alpha-lipoic acid were investigated in G. oxydans. |
| 图选项 |
3 结论本研究首次在维生素C发酵体系中,构建了具有硫辛酸功能模块的G. oxydans工程菌株,并对由G. oxydans和K. vulgare组成的两菌一步发酵体系进行研究。此方法以D-山梨醇为底物,发酵参数控制在初始3 L装液量,30 ℃,500 r/min,pH控制7.0,通气1.5 vvm,在总接种量为10% (其中G. oxydans为8%,K. vulgare为2%)的条件下,实验组含硫辛酸功能模块的两菌一步发酵体系中的醇酸转化率最高,达到了86.0%,证明了硫辛酸功能模块对两菌一步发酵的促进作用。因此,与传统“二步发酵”法90%以上的醇酸转化率相比,该两菌一步发酵法具有巨大的潜能,为进一步优化维生素C发酵体系、实现一步发酵的工业化应用奠定基础。并且,在8% D-山梨醇的条件下,与二步发酵相比,该一步发酵避免了二次灭菌的问题,将发酵周期从二步发酵的48 h缩短到现在的36 h。这不仅简化了生产工艺,降低了能耗,还有望进一步提高设备利用率,降低生产成本。
因此,以G. oxydans和K. vulgare组成的两菌一步发酵体系的功能还需进一步强化。从本研究可知,G. oxydans和K. vulgare组成的两菌体系可以很好地配合生产2-KGA;然而,G. oxydans和K. vulgare在发酵过程中的菌种间关系及作用机制还需进一步研究明晰;同时,还可根据本文的G. oxydans和K. vulgare一步发酵研究结果,对菌株进行理性设计和改造,从而为进一步提高一步发酵体系的功能提供理论依据。
参考文献
| [1] | Yun J, Mullarky E, Lu CY, et al. Vitamin C selectively kills KRAS and BRAF mutant colorectal cancer cells by targeting GAPDH.Science, 2015, 350(6266): 1391–1396.DOI: 10.1126/science.aaa5004 |
| [2] | Cimmino L, Dolgalev I, Wang YB, et al. Restoration of TET2 function blocks aberrant self-renewal and leukemia progression.Cell, 2017, 170(6): 1079–1095.DOI: 10.1016/j.cell.2017.07.032 |
| [3] | Wei DZ, Yuan WK, Yin GL, et al. Studies on kinetic model of vitamin C two-step fermentation process.Chin J Biotech, 1992, 8(3): 277–282.(in Chinese). 魏东芝, 袁渭康, 尹光琳, 等. 维生素C二步发酵过程动力学模型的研究.生物工程学报, 1992, 8(3): 277-282. |
| [4] | Ma Q, Zhou J, Zhang WW, et al. Integrated proteomic and metabolomic analysis of an artificial microbial community for two-step production of vitamin C.PLoS ONE, 2011, 6(10): e26108.DOI: 10.1371/journal.pone.0026108 |
| [5] | Zhou J, Ma Q, Yi H, et al. Metabolome profiling reveals metabolic cooperation between Bacillus megaterium and Ketogulonicigenium vulgare during induced swarm motility.Appl Environ Microbiol, 2011, 77(19): 7023–7030.DOI: 10.1128/AEM.05123-11 |
| [6] | Ding MZ, Zou Y, Song H, et al. Metabolomic analysis of cooperative adaptation between co-cultured Bacillus cereus and Ketogulonicigenium vulgare.PLoS ONE, 2014, 9(4): e94889.DOI: 10.1371/journal.pone.0094889 |
| [7] | Zhou J, Yi H, Wang LL, et al. Metabolomic analysis of the positive effects on Ketogulonigenium vulgare growth and 2-keto-L-gulonic acid production by reduced glutathione.OMICS, 2012, 16(7/8): 387–396. |
| [8] | Bai L. Mechanisms of the mutualism between Bacillus endophyticus and Ketogulonicigenium vulgare[D]. Shenyang: Shenyang Agricultural University, 2017 (in Chinese). 白玲.内生芽孢杆菌与普通生酮基古龙酸杆菌互作机制的研究[D].沈阳: 沈阳农业大学, 2017. |
| [9] | Lü SX, Liao L, Zhang YH. Research progress on the oxidative stress relieving of acid-producing strain by companion strain in vitamin C mixed cultures fermentation.J Shenyang Agric Univ, 2017, 48(6): 641–646.(in Chinese). 吕淑霞, 廖林, 张云鹤. Vc混菌发酵中伴生菌解除产酸菌氧化胁迫的研究进展.沈阳农业大学学报, 2017, 48(6): 641-646. |
| [10] | Zhu YB. Mechanisms in the mutualism between Bacillus megaterium and Ketogulonigenium vulgare[D]. Wuxi: Jiangnan University, 2012 (in Chinese). 朱益波.巨大芽孢杆菌与普通生酮基古龙酸菌互生作用研究[D].无锡: 江南大学, 2012.http://cdmd.cnki.com.cn/Article/CDMD-10295-1013136442.htm |
| [11] | Liao L. Mechanisms on the oxidative stress relieving of Ketogulonicigenium vulgare by Rhodotorula mucilaginosa in vitamin C mixed culture fermentation[D]. Shenyang: Shenyang Agricultural University, 2018 (in Chinese). 廖林. Vc混菌发酵中胶红酵母解除普通生酮基古龙酸杆菌氧化胁迫的研究[D].沈阳: 沈阳农业大学, 2018.http://cdmd.cnki.com.cn/Article/CDMD-10157-1018993219.htm |
| [12] | Yang Y, Gao M, Yu XD, et al. Optimization of medium composition for two-step fermentation of vitamin C based on artificial neural network-genetic algorithm techniques.Biotechnol Biotechnol Equip, 2015, 29(6): 1128–1134.DOI: 10.1080/13102818.2015.1063970 |
| [13] | Wang T, Sun JB, Yuan JQ. Modeling and parameters identification of 2-keto-L-gulonic acid fed-batch fermentation.Bioprocess Biosyst Eng, 2015, 38(4): 605–614.DOI: 10.1007/s00449-014-1300-8 |
| [14] | Zhang ZX, Sun JW, Yuan JQ. Investigating the interaction between Gluconobacter oxydans and Bacillus megaterium for 2-keto-L-gulonic acid biosynthesis in the two-step vitamin C fermentation.J Shanghai Jiaotong Univ (Sci), 2015, 20(3): 281–285.DOI: 10.1007/s12204-015-1622-y |
| [15] | Zhu YB, Liu J, Du GC, et al. Sporulation and spore stability of Bacillus megaterium enhance Ketogulonigenium vulgare propagation and 2-keto-L-gulonic acid biosynthesis.Bioresour Technol, 2012, 107: 399–404.DOI: 10.1016/j.biortech.2011.12.080 |
| [16] | Liu J, Hu SB, Chang F, et al. Effects of the accompany strain on the fermentation performance of Ketogulonigenium vulgare.J Taizhou Polytech Coll, 2013, 13(2): 76–78.(in Chinese). 刘杰, 胡少斌, 常芳, 等. 伴生菌对普通生酮基古龙酸菌发酵的影响.泰州职业技术学院学报, 2013, 13(2): 76-78.DOI:10.3969/j.issn.1671-0142.2013.02.026 |
| [17] | Jia N, Du J, Ding MZ, et al. Genome sequence of Bacillus endophyticus and analysis of its companion mechanism in the Ketogulonigenium vulgare-Bacillus strain consortium.PLoS ONE, 2015, 10(8): e0135104.DOI: 10.1371/journal.pone.0135104 |
| [18] | Wang EX, Ding MZ, Ma Q, et al. Reorganization of a synthetic microbial consortium for one-step vitamin C fermentation.Microb Cell Fact, 2016, 15: 21.DOI: 10.1186/s12934-016-0418-6 |
| [19] | Gao LL, Hu YD, Liu J, et al. Stepwise metabolic engineering of Gluconobacter oxydans WSH-003 for the direct production of 2-keto-L-gulonic acid from D-sorbitol.Metab Eng, 2014, 24: 30–37.DOI: 10.1016/j.ymben.2014.04.003 |
| [20] | Anderson S, Marks CB, Lazarus R, et al. Production of 2-keto-L-gulonate, an intermediate in L-ascorbate synthesis, by a genetically modified Erwinia herbicola.Science, 1985, 230(4722): 144–149.DOI: 10.1126/science.230.4722.144 |
| [21] | Huang Z, Zou W, Liu J, et al. Glutathione enhances 2-keto-L-gulonic acid production based on Ketogulonicigenium vulgare model iWZ663.J Biotechnol, 2013, 164(4): 454–460.DOI: 10.1016/j.jbiotec.2013.01.007 |
| [22] | Ma Q, Zhang WW, Zhang L, et al. Proteomic analysis of Ketogulonicigenium vulgare under glutathione reveals high demand for thiamin transport and antioxidant protection.PLoS ONE, 2012, 7(2): e32156.DOI: 10.1371/journal.pone.0032156 |
| [23] | Leduc S, De Troostembergh JC, Lebeault JM. Folate requirements of the 2-keto-L-gulonic acid-producing strain Ketogulonigenium vulgare LMP P-20356 in l-sorbose/CSL medium.Appl Microbiol Biotechnol, 2004, 65(2): 163–167.DOI: 10.1007/s00253-004-1562-1 |
| [24] | Pan CH, Wang EX, Jia N, et al. Reconstruction of amino acid biosynthetic pathways increases the productivity of 2-keto-L-gulonic acid in Ketogulonicigenium vulgare-Bacillus endophyticus consortium via genes screening.J Ind Microbiol Biotechnol, 2017, 44(7): 1031–1040.DOI: 10.1007/s10295-017-1928-x |
| [25] | Du J, Bai W, Song H, et al. Combinational expression of sorbose/sorbosone dehydrogenases and cofactor pyrroloquinoline quinone increases 2-keto-L-gulonic acid production in Ketogulonigenium vulgare-Bacillus cereus consortium.Metab Eng, 2013, 19: 50–56.DOI: 10.1016/j.ymben.2013.05.006 |
| [26] | Wang PP, Xia Y, Li JH, et al. Overexpression of pyrroloquinoline quinone biosynthetic genes affects L-sorbose production in Gluconobacter oxydans WSH-003.Biochem Eng J, 2016, 112: 70–77.DOI: 10.1016/j.bej.2016.04.011 |
| [27] | Miyazaki T, Tomiyama N, Shinjoh M, et al. Molecular cloning and functional expression of D-sorbitol dehydrogenase from Gluconobacter suboxydans IFO3255, which requires pyrroloquinoline quinone and hydrophobic protein SldB for activity development in E. coli.Biosci, Biotechnol, Biochem, 2002, 66(2): 262–270.DOI: 10.1271/bbb.66.262 |
| [28] | Zou W, Liu LM, Zhang J, et al. Reconstruction and analysis of a genome-scale metabolic model of the vitamin C producing industrial strain Ketogulonicigenium vulgare WSH-001.J Biotechnol, 2012, 161(1): 42–48.DOI: 10.1016/j.jbiotec.2012.05.015 |
| [29] | Jia N, Ding MZ, Du J, et al. Insights into mutualism mechanism and versatile metabolism of Ketogulonicigenium vulgare Hbe602 based on comparative genomics and metabolomics studies.Sci Rep, 2016, 6: 23068.DOI: 10.1038/srep23068 |
| [30] | Xu Y, Zhou X, Shi CL, et al. α-Lipoic acid protects against the oxidative stress and cytotoxicity induced by cadmium in HepG2 cells through regenerating glutathione regulated by glutamate-cysteine ligase.Toxicol Mech Methods, 2015, 25(8): 596–603. |
| [31] | Moini H, Packer L, Saris NEL. Antioxidant and prooxidant activities of α-lipoic acid and dihydrolipoic acid.Toxicol Appl Pharmacol, 2002, 182(1): 84–90.DOI: 10.1006/taap.2002.9437 |
| [32] | Packer L, Kraemer K, Rimbach G. Molecular aspects of lipoic acid in the prevention of diabetes complications.Nutrition, 2001, 17(10): 888–895.DOI: 10.1016/S0899-9007(01)00658-X |
| [33] | Ruan LJ, Hu ZC, Zheng YG. Research advances in biosynthesis of alpha-lipoic acid for antioxidant.Fine Specialty Chem, 2012, 20(7): 49–53.(in Chinese). 阮丽娟, 胡忠策, 郑裕国. 抗氧化剂α-硫辛酸的生物合成研究进展.精细与专用化学品, 2012, 20(7): 49-53.DOI:10.3969/j.issn.1008-1100.2012.07.021 |
| [34] | Livak KJ, Schmittgen TD. Analysis of relative gene expression data using real-time quantitative PCR and the 2-ΔΔCT method.Methods, 2001, 25(4): 402–408.DOI: 10.1006/meth.2001.1262 |
| [35] | Xiong XH, Zhang WC, Wang JH, et al. Method for promoting growth and acid production of Ketogulonigenium vulgare: CN, CN102321698B. 2013-05-08 (in Chinese). 熊向华, 张惟材, 汪建华, 等.一种促进酮古龙酸菌生长和产酸的方法: 中国, CN102321698B. 2013-05-08. |
| [36] | Pan CH. The engineered Ketogulonigenium vulgare enhanced interaction with companion Bacillus strain[D]. Tianjin: Tianjin University, 2017 (in Chinese). 潘才慧.工程化改造酮古龙酸杆菌强化混菌间的互作关系[D].天津: 天津大学, 2017.http://cdmd.cnki.com.cn/Article/CDMD-10056-1018013810.htm |
| [37] | Cronan JE. Biotin and lipoic acid: synthesis, attachment, and regulation.EcoSal Plus, 2008, 3(1).DOI: 10.1128/ecosalplus.3.6.3.5 |
