

1. 内蒙古农业大学 兽医学院,内蒙古 呼和浩特 010018;
2. 农业部动物疾病临床诊疗技术重点实验室,内蒙古 呼和浩特 010018;
3. 内蒙古农牧业科学院 动物营养研究所,内蒙古 呼和浩特 010030
收稿日期:2018-08-25;接收日期:2018-12-28;网络出版时间:2019-02-19
基金项目:国家自然科学基金(No. 31260560),现代农业(奶牛)产业技术体系建设专项(No. CARS-36),内蒙古自治区应用技术研究与开发资金计划(No. 201602051)资助
摘要:固态下酵母自溶可以有效促进菌体内多种活性物质的释放,进而提高酵母类产品的品质。通过优化自溶温度、自溶时间及自溶促进剂锌离子浓度以获得固态发酵下酵母自溶的最佳工艺,对固态发酵物料中游离氨基酸、可溶性蛋白、α-氨基氮含量和A260/A280等指标的分析来确定固态酵母自溶工艺条件,在此基础上以自溶温度40 ℃、50 ℃、55 ℃;作用时间12、18、24 h;锌离子添加浓度2、4、8 mg/kg设置L9(33)正交试验,进一步优化固态酵母自溶的工艺参数。结果表明酵母自溶的最佳工艺条件为:自溶温度55 ℃、作用时间18 h、锌离子浓度2 mg/kg,此时其可溶性蛋白含量可达9.31 mg/g、游离氨基酸14.36 mg/g、α-氨基氮10.16 μg/g、A260/A280为1.73。经工艺优化后,可显著提高酵母自溶产物可溶性蛋白、游离氨基酸和α-氨基氮的含量,从而明显提高了复合菌培养物的品质。
关键词:固态发酵酵母自溶工艺条件
Optimization of yeast autolysis under solid-state fermentation conditions
Xing Su1,2,3, Zheng Zhang1,2,3, Qiwei Zhang1,2,3, Jingjing Yang1,2,3, Min Gao3, Honglian Hu3, Dacheng Liu1,2,3


1. College of Veterinary, Inner Mongolia Agricultural University, Hohhot 010018, Inner Mongolia, China;
2. Key Laboratory of Clinical Diagnosis and Treatment Technology in Animal Disease, Ministry of Agriculture, Hohhot 010018, Inner Mongolia, China;
3. Animal Nutrition Institute, Inner Mongolian Academy of Agriculture and Animal Sciences, Hohhot 010030, Inner Mongolia, China
Received: August 25, 2018; Accepted: December 28, 2018; Published: February 19, 2019
Supported by: National Natural Science Foundation of China (No. 31260560), China Agriculture Research System (No. CARS-36), Inner Mongolia Autonomous Region Applied Technology Research and Development Funding Plan (No. 201602051)
Corresponding author: Dacheng Liu. Tel: +86-471-4311295; E-mail: nmgldc@163.com.
Abstract: Yeast autolysis under solid-state fermentation can effectively promote the release of various active substances, thereby improving the quality of yeast products. The optimal process for yeast autolysis under solid-state fermentation was obtained by optimizing the autolysis temperature, autolysis time and the zinc ion concentration. We analyzed the indexes of free amino acid, soluble protein and α-amino nitrogen in the fermentation material, as well as A260/A280 ratio to determine yeast autolysis process conditions in the solid-state fermentation. On the basis of the obtained data, L9 (33) orthogonal test was designed to optimize the solid-state fermentation parameters for yeast autolysis: temperature at 40, 50 and 55 ℃; time 12, 18 and 24 h; zinc ion concentration 2, 4 and 8 mg/kg. The optimum process conditions for yeast autolysis were: autolysis temperature 55 ℃, time 18 h, zinc ion concentration 2 mg/kg, and soluble protein content reached 9.31 mg/g, free amino acid 14.36 mg/g, α-amino nitrogen 10.16 μg/g and A260/A280 1.73. After optimization of the process, the soluble protein, free amino acid and α-amino nitrogen contents of the yeast autolysis production can be significantly increased, thereby obviously improving the quality of the composite culture.
Keywords: solid-state fermentationyeast autolysisprocess conditions
酵母自溶是指活性酵母细胞内的蛋白酶、核酸酶、碳水化合物水解酶在特定条件下被激活后,作用于相应的底物,从而将胞内大分子物质如多糖、氨基酸、蛋白质、多肽、核酸、核苷酸等降解成能通过酵母细胞壁的小分子营养物质,释放到体外的过程[1-3]。研究者们通过超声波、温差法[4],或添加NaCl、乙醇、锌离子等化学物质[5-7],或采用外加酶[8]等方法来提高酵母自溶得率。对酵母自溶的研究多数是围绕自溶温度、时间和促进剂展开的,提高自溶温度、作用时间可以大幅提高氨基氮得率[9]。杨建梅等[4]研究表明自溶温度50 ℃、自溶24 h、NaCl添加量达3%时,啤酒酵母自溶液中总糖量、游离氨基氮含量达到最大。在酵母自溶过程中添加适量的锌离子浓度可提高游离氨基氮、氨基酸的含量[10],啤酒酿造中锌离子可激活酶的活性、促进糖化、发酵等[11]。赵志云等[5]研究发现,当锌离子添加量为0.8 mg/L、1.6 mg/L时可加速酵母自溶,添加量为0.2–0.4 mg/L时,可延缓酵母自溶。尽管对酵母自溶条件的研究甚多,但多数是在液态条件下进行的,而对固态发酵下酵母自溶条件研究报道较少。课题组研制的复合菌培养物是在固态发酵下获得的,该制剂含有甘露聚糖、β-葡聚糖、多肽、氨基酸、核酸等多种营养活性物质[12],这些营养物质能够刺激动物肠胃内的微生物增殖,促进动物健康生长,进而达到提高饲料利用率和改善动物性能的目的,并且营养活性物质的含量决定着复合菌培养物的功效[13]。固态发酵过程中促进酵母自溶可有利于上述营养活性物的产生。酵母自溶时可释放多种活性营养物质,用某一种物质含量的变化作为判定酵母自溶程度的依据并不全面。蛋白质的酶促降解是酵母自溶过程中最重要的生化反应,其水解产物主要是一些蛋白质、多肽、氨基酸等,对蛋白质及其水解产物的测定能及时反映酵母变化情况[14-15],其中可溶性蛋白、游离氨基酸、α-氨基氮等物质会随着酵母自溶程度的加强而不断释放到细胞外。A260/A280是一个综合反映蛋白质和核酸类物质含量关系的物理量,随着自溶程度的增大,自溶所产生核酸物质所占比例越来越大,A260/A280值逐渐增大[16]。本研究通过对上述4个指标的测定来研究固态发酵下自溶温度、时间和促溶剂对酵母自溶的影响,为固态条件下酵母自溶和营养活性物质的生产提供理论依据。
1 材料与方法1.1 活性酵母的制备将酿酒酵母菌XR4和BC分别接种于麦芽汁液体培养基中,30 ℃、180 r/min活化培养48 h。枯草芽孢杆菌A15接种于营养肉汤液体培养基中,37 ℃、180 r/min活化培养24 h,4 ℃原容器内保存待用。其中,酿酒酵母菌(编号XR4、BC)、枯草芽孢杆菌(编号A15),均来源于内蒙古农业大学兽医学院反刍动物微生态制剂课题组菌种库。
1.2 酵母发酵饲料的制备根据课题组前期的研究结果,本试验发酵料配方由15%麸皮、40%玉米、6%米糠、15%枣粉、4%玉米皮、15%豆粕和一定量的复合无机盐组成[12]。
1.3 发酵时自溶温度和时间优化按固态发酵组方称取500 g发酵底物置于不锈钢盒中,每个自溶温度下3个平行样,接水量约为45%,复合菌接种量为20%,其比例BC:XR4:A15为2:2:1,将湿的双层纱布盖于发酵盒口,30 ℃恒温培养箱中发酵28 h后,分别转至40 ℃、45 ℃、50 ℃、55 ℃、60 ℃恒温培养箱中进行酵母菌自溶。在自溶0 h、6 h、12 h、18 h、24 h、30 h时分别从上述各温度发酵盒的4个角及中央5个位置共取样5 g,每个自溶温度、时间下取3个平行样于100 mL三角瓶中。加入45 mL去离子水10倍稀释,经漩涡振荡仪振荡10 min,经4层脱脂棉纱布过滤后,再用0.45 μm细菌过滤器二次过滤,测定滤液中可溶性蛋白、游离氨基酸、α-氨基氮、A260/A280比值。
1.4 添加锌离子试验优化在发酵料配制时,将锌离子加入发酵液内,其添加浓度分别为0、0.1、2、4、8 mg/kg。根据1.3试验结果确定自溶温度,自溶时间0、6、12、18、24、30 h,以上述相同的方法取样并测定可溶性蛋白等4项指标。
1.5 测定方法A260/A280:紫外分光光度计测得A260与A280处吸光光度值[16]。
可溶性蛋白测定:采用BCA法测定[17]。
α-氨基氮测定:采用茚三酮法测定[18]。
游离氨基酸测定:采用分光光度法测定[19]。
1.6 数据统计与分析利用Excel对数据进行基础处理,用SAS 9.0软件中的ANOVA对数据差异性进行分析,试验结果以平均值标准误(x±s)表示,用DPS 14.0数据处理系统中的Topsis法对数据进行综合评价。
2 结果与分析2.1 不同温度和作用时间对酵母自溶可溶性蛋白含量的影响由表 1可知,在0–18 h内,温度为55 ℃、60 ℃时,随着自溶时间的延长,可溶性蛋白含量逐渐增加,18 h后各组的变化并没有表现出明显的规律。在40 ℃、50 ℃条件下,自溶24 h、30 h时的可溶性蛋白含量显著高于0–12 h (P < 0.05)。60 ℃时,自溶18 h、24 h、30 h的可溶性蛋白含量显著高于0–12 h (P < 0.05)。随着温度的增加,可溶性蛋白含量也呈增长趋势。自溶24 h、30 h时,50 ℃、55 ℃和60 ℃条件下可溶性蛋白含量差异不显著(P > 0.05),但显著高于40 ℃、45 ℃组(P < 0.05)。总之,在50 ℃、55 ℃、60 ℃条件下进行酵母自溶,可溶性蛋白含量显著高于40 ℃、45 ℃组(P < 0.05),三者之间并无显著差异(P > 0.05),自溶进行到18–30 h时,效果较为彻底。
表 1 不同温度和作用时间对可溶性蛋白质含量的影响(mg/g)Table 1 Effects of different temperature and time points on soluble protein contents (mg/g)
| 40 ℃ | 45 ℃ | 50 ℃ | 55 ℃ | 60 ℃ | |
| 0 h | 4.90±1.20BCa | 4.86±0.45Ca | 4.66±0.69Ca | 5.07±1.06Ca | 4.61±0.29Ea |
| 6 h | 4.53±0.75BCc | 5.10±0.63Cbc | 6.24±0.44BCab | 5.72±0.92Cabc | 6.89±0.74Da |
| 12 h | 4.23±0.20Cd | 5.71±0.45BCc | 5.33±0.43Ccd | 7.30±0.94BCb | 9.32±1.07Ca |
| 18 h | 5.69±0.28ABc | 6.63±0.80Bc | 7.65±0.94Bc | 10.05±2.20Ab | 12.45±1.31Aa |
| 24 h | 6.17±0.30Ab | 6.49±0.57Bb | 10.67±1.80Aa | 9.80±1.38ABa | 10.08±1.15BCa |
| 30 h | 6.10±0.51Ac | 7.92±0.31Ab | 10.70±0.32Aa | 10.37±1.80Aa | 11.67±1.06ABa |
| The different uppercase letters of the same column data showed significant difference (P < 0.05). The different lowercase letters of the same peer data showed significant difference (P < 0.05). | |||||
表选项
2.2 不同温度和作用时间对酵母自溶游离氨基酸含量的影响由表 2可知,在0–18 h内,随着自溶时间的延长,温度为50 ℃、55 ℃、60 ℃时,游离氨基酸含量逐渐上升,18 h以后,55 ℃组表现为先降低再升高的趋势,而40 ℃、50 ℃、60 ℃组呈先升高后降低的态势。在40 ℃条件下,自溶18 h、24 h、30 h的游离氨基酸含量显著高于0–12 h (P < 0.05)。在60 ℃条件下,自溶24 h、30 h的游离氨基酸含量显著高于0–18 h (P < 0.05)。随着作用时间的延长和自溶温度的升高,游离氨基酸含量均呈逐渐增加的趋势。自溶30 h时,55 ℃、60 ℃温度组游离氨基酸含量差异不大(P > 0.05),但显著高于40 ℃、45 ℃、50 ℃组(P < 0.05)。综合来看,在55 ℃、60 ℃条件下进行酵母自溶,游离氨基酸含量显著高于40 ℃、45 ℃、50 ℃组(P < 0.05),当自溶进行到24–30 h,游离氨基酸含量显著高于0–18 h (P < 0.05)。
表 2 不同温度和作用时间对游离氨基酸含量的影响(mg/g)Table 2 Effects of different temperature and time points on free amino acid contents (mg/g)
| 40 ℃ | 45 ℃ | 50 ℃ | 55 ℃ | 60 ℃ | |
| 0 h | 8.04±2.01Bb | 11.07±3.75Ca | 9.86±2.73Cb | 10.38±2.76Dab | 12.44±4.01Ca |
| 6 h | 7.76±0.97Bc | 13.69±7.22Cc | 15.75±4.46BCbc | 24.48±3.75Ca, | 25.67±6.41Ba |
| 12 h | 10.55±1.81Bb | 15.89±4.04BCab | 17.93±4.53BCab | 21.45±1.77Ca | 23.49±6.46Ba |
| 18 h | 16.15±1.64Ac | 12.91±1.85Cc | 23.89±6.56ABb | 32.26±2.17Ba | 27.31±3.54Bab |
| 24 h | 20.54±3.67Ad | 23.61±4.99ABcd | 29.87±2.29Ab | 27.82±2.47BCbc | 42.74±0.78Aa |
| 30 h | 17.05±4.79Ac | 27.57±5.54Ab | 28.80±5.41Ab | 42.19±6.59Aa | 40.61±3.12Aa |
| The different uppercase letters of the same column data showed significant difference (P < 0.05). The different lowercase letters of the same peer data showed significant difference (P < 0.05). | |||||
表选项
2.3 不同温度和作用时间对酵母自溶α-氨基氮含量的影响由表 3可知,在0–30 h内,随着自溶时间的延长,温度为40–60 ℃时,α-氨基氮含量呈逐渐上升态势。在40 ℃、45 ℃条件下,自溶30 h时,α-氨基氮含量显著高于0–24 h (P < 0.05)。在50 ℃条件下,自溶24 h、30 h时,α-氨基氮含量显著高于0–18 h (P < 0.05)。在60 ℃条件下,自溶18、24、30 h时,α-氨基氮含量显著高于0–12 h (P < 0.05)。随着自溶温度的升高,α-氨基氮含量也逐渐增加,当温度达到55 ℃时,增长趋于平缓。自溶6 h时,50 ℃、55 ℃、60 ℃组的α-氨基氮含量著高于40 ℃、45 ℃组(P < 0.05)。自溶18 h、24 h,温度为60℃时,α-氨基氮含量著高于40–55 ℃组(P < 0.05)。总之,55 ℃、60 ℃条件下进行酵母自溶时,α-氨基氮含量显著高于40 ℃、45 ℃、50 ℃组(P < 0.05)。当自溶进行到18–30 h,α-氨基氮含量显著高于0–12 h (P < 0.05)。
表 3 不同温度和作用时间对α-氨基氮含量的影响(μg/g)Table 3 Effects of different temperature and time points on α-amino nitrogen contents (μg/g)
| 40 ℃ | 45 ℃ | 50 ℃ | 55 ℃ | 60 ℃ | |
| 0 h | 5.89±0.18CDa | 4.53±20Ec | 5.10±0.17Cb | 5.29±0.17Eb | 5.38±0.51Dab |
| 6 h | 5.19±0.52Db | 5.29±0.23Cb | 7.63±0.22Ba | 6.93±39Da | 7.63±0.52Ca |
| 12 h | 6.02±0.37Cc | 5.73±0.42CDc | 7.67±0.32Bb | 8.71±0.40Ca | 8.99±0.30Ba |
| 18 h | 5.92±0.47Dd | 6.19±0.20Cd | 8.32±0.42Bc | 9.09±0.21BCb | 10.07±0.27Aa |
| 24 h | 8.23±0.25Bc | 8.83±0.36Bbc | 10.61±0.65Aa | 9.47±0.53Bb | 10.54±0.59Aa |
| 30 h | 9.91±0.49Ac | 10.35±0.27Abc | 11.08±0.43Ab | 11.84±0.27Aa | 10.08±0.48Ab |
| The different uppercase letters of the same column data showed significant difference (P < 0.05). The different lowercase letters of the same peer data showed significant difference (P < 0.05). | |||||
表选项
2.4 不同温度和作用时间对酵母自溶A260/A280值的影响由表 4可知,在0–18 h内,随着自溶时间的延长,温度为50–60 ℃时,A260/A280值呈增大趋势。温度为50 ℃时,自溶18 h、24 h时A260/A280值显著大于0–18 h (P < 0.05)。温度为55 ℃时,自溶18 h、24 h、30 h时,A260/A280值显著大于0–12 h (P < 0.05)。自溶18 h、24 h、30 h时,50 ℃、55 ℃和60 ℃ 3个温度组之间的A260/A280值无显著差异(P > 0.05),但均显著大于40 ℃、45 ℃组(P < 0.05)。总体来讲,50 ℃、55 ℃、60 ℃条件下进行酵母自溶,A260/A280显著高于40 ℃、45 ℃组(P < 0.05),三者之间并无显著差异(P > 0.05)。自溶18–30 h时,A260/A280显著高于0–12 h (P < 0.05)。
表 4 不同温度和作用时间对A260/A280值的影响Table 4 Effects of different temperature and acting time points on A260/A280 values
| 40 ℃ | 45 ℃ | 50 ℃ | 55 ℃ | 60 ℃ | |
| 0 h | 1.59±0.01Db | 1.70±0.04BCa | 1.73±0.02Ca | 1.75±0.02Da | 1.69±0.04Ca |
| 6 h | 1.60±0.04Dc | 1.77±0.03ABb | 1.79±0.01Bb | 1.79±0.01CDb | 1.85±0.01Aba |
| 12 h | 1.67±0.02Cb | 1.68±0.02Cb | 1.80±0.01Ba | 1.80±0.01CDa | 1.81±0.02Ba |
| 18 h | 1.72±0.01ABb | 1.73±0.02BCb | 1.90±0.01Aa | 1.84±0.06BCa | 1.85±0.02Aba |
| 24 h | 1.68±0.01BCc | 1.76±0.01ABb | 1.91±0.05Aa | 1.90±0.01ABa | 1.84±0.01Aba |
| 30 h | 1.76±0.01Ac | 1.82±0.02Ab | 1.76±0.02BCc | 1.92±0.01Aa | 1.89±0.03Aa |
| The different uppercase letters of the same column data showed significant difference (P < 0.05). The different lowercase letters of the same peer data showed significant difference (P < 0.05). | |||||
表选项
2.5 不同锌离子浓度对可溶性蛋白含量的影响由图 1可知,锌离子浓度为2–4 mg/kg,自溶18–24 h时,随着锌离子浓度增加,可溶性蛋白含量呈增加态势。自溶6 h时,4 mg/kg组可溶性蛋白含量显著高于0–2 mg/kg组、8 mg/kg组(P < 0.05)。当锌离子添加量为8 mg/kg,自溶至12、18、24、30 h时,可溶性蛋白含量显著高于0–4 mg/kg组(P < 0.05)。总体来看,当锌离子添加量为4–8 mg/kg,可溶性蛋白含量显著增高。
 |
| 图 1 不同锌离子浓度对可溶性蛋白含量的影响 Fig. 1 Effects of different zinc ion concentrations on soluble protein contents. The different capital letters showed significant difference in the different time in same group (P < 0.05). The different small letters showed significant difference of different group in the same time (P < 0.05) |
| 图选项 |
2.6 不同锌离子浓度对游离氨基酸含量的影响由图 2可知,锌离子浓度为0–2 mg/kg,自溶0–30 h时,游离氨基酸含量的变化无明显规律。当浓度在2–8 mg/kg,自溶12–30 h时,随着锌离子浓度的增加,游离氨基酸含量也呈增加态势。4、8 mg/kg组在自溶进行至6、12和30 h时游离氨基酸含量显著高于0、0.1和2 mg/kg组(P < 0.05)。综合来看,当锌离子添加量为4–8 mg/kg时,游离氨基酸含量增加显著。
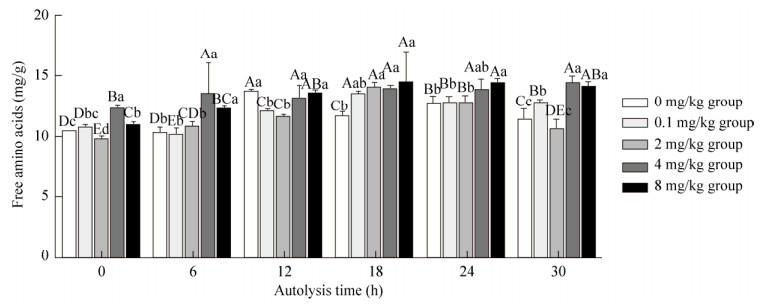 |
| 图 2 不同锌离子浓度对游离氨基酸含量的影响 Fig. 2 Effects of different zinc ion concentrations on free amino acid contents. The different capital letters showed significant difference in the different time in same group (P < 0.05). The different small letters showed significant difference of different group in the same time (P < 0.05) |
| 图选项 |
2.7 不同锌离子浓度对α-氨基氮含量的影响由图 3可知,锌离子浓度为0–2 mg/kg,自溶0–30 h时,α-氨基氮含量变化未表现出明显规律。当浓度为2–8 mg/kg,自溶6–30 h时,随着锌离子浓度增加,α-氨基氮含量呈增长趋势。自溶6 h时,2 mg/kg组、4 mg/kg组和8 mg/kg组的α-氨基氮含量差异不显著(P > 0.05),但显著高于0 mg/kg组、0.1 mg/kg组(P < 0.05)。自溶18、30 h时,4 mg/kg组和8 mg/kg组的α-氨基氮含量显著高于0–2 mg/kg组(P < 0.05)。综合来看,当锌离子添加量为4–8 mg/kg,自溶0–18 h时,α-氨基氮含量显著高于0–2 mg/kg组(P < 0.05)。
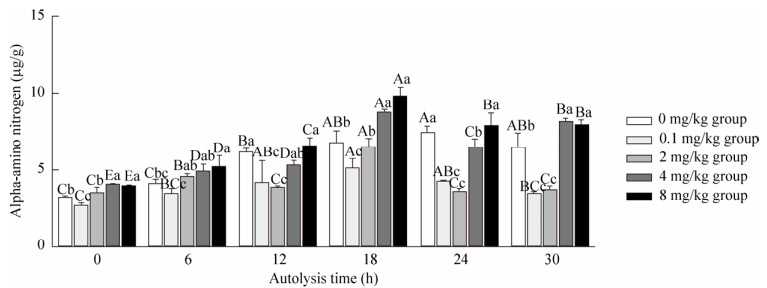 |
| 图 3 不同锌离子浓度对α-氨基氮含量的影响 Fig. 3 Effects of different zinc ion concentrations on α-amino nitrogen contents. The different capital letters showed significant difference in the different time in same group (P < 0.05). The different small letters showed significant difference of different group in the same time (P < 0.05) |
| 图选项 |
2.8 不同锌离子浓度对A260/A280值的影响由图 4可知,自溶6、12 h时,0.1、2和4 mg/kg三组A260/A280无显著差异(P > 0.05)。自溶6–24 h时,8 mg/kg组的A260/A280比值显著高于0–4 mg/kg组(P < 0.05)。总体来看,当锌离子添加量为8 mg/kg,自溶0–24 h时,A260/A280比值显著高于0–4 mg/kg组(P < 0.05)。
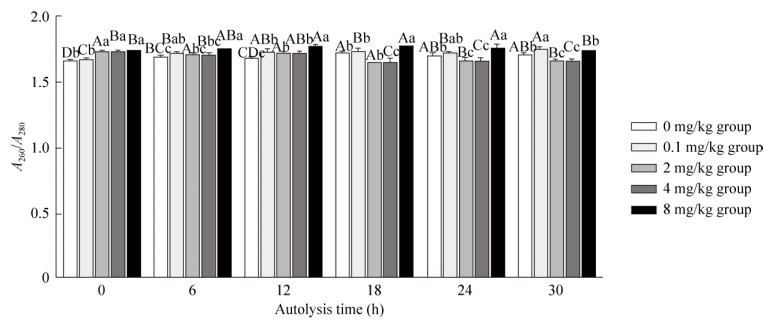 |
| 图 4 不同锌离子浓度对A260/A280值的影响 Fig. 4 Effects of different zinc ion concentrations on A260/A280 values. The different capital letters showed significant difference in the different time in same group (P < 0.05). The different small letters showed significant difference of different group in the same time (P < 0.05) |
| 图选项 |
2.9 自溶条件正交试验根据1.3、1.4试验结果及对发酵饲料感官评定,确定自溶温度为40、50、55 ℃,自溶时间为12、18、24 h,锌离子添加浓度为2、4、8 mg/kg,进行L9 (33)三因素三水平正交试验。
由表 5可知,以可溶性蛋白、α-氨基氮含量为衡量指标时,自溶影响因素的主次顺序分别是A > C > B,即温度为最关键因素,锌离子浓度的影响最小,优化组合为A2B2C2。以游离氨基酸含量为衡量指标时,自溶影响主次顺序是B > A > C,优化组合为A3B2C1。以A260/A280为衡量指标时,自溶影响主次顺序是A > B > C,优化组合为A2B3C。随着温度的升高,可溶性蛋白、α-氨基氮含量呈先增高后降低的趋势。当温度升至50 ℃时,可溶性蛋白、游离氨基酸的含量及A260/A280的比值均达到峰值,随着温度的继续升高,增长趋势较为平缓或略降低。50–55 ℃时,自溶12–18 h,4项测定指标含量逐渐增加,18–24 h时呈降低态势。当锌离子浓度逐渐增加,自溶50 ℃时,可溶性蛋白、游离氨基酸、A260/A280等指标都呈增加趋势。综合上述结果,当温度为50–55 ℃、自溶时间12–18 h、锌离子浓度2–4 mg/kg时,各组合自溶效果彻底。
表 5 不同温度、作用时间、锌离子添加量正交试验结果及极差分析表Table 5 Orthogonal test results and range analysis of different temperature and acting time points and zinc ion addition
| Test number | Test factor | Result | ||||||
| Autolysis temperature A (℃) | Zinc ion addition B (mg/kg) | Autolysis time C (h) | Soluble protein content (mg/g) | Free aminoacids (mg/g) | A260/A280 | Alpha-amino nitrogen (μg/g) | ||
| 1 | 1(40) | 1(2) | 1(12) | 7.81±0.34E | 13.52±0.29ABC | 1.69±0.01C | 5.21±1.68D | |
| 2 | 1 | 2(4) | 2(18) | 8.38±0.27D | 11.94±0.09C | 1.59±0.02E | 9.56±0.27AB | |
| 3 | 1 | 3(8) | 3(24) | 5.69±0.13F | 9.78±0.09D | 1.68±0.01C | 5.65±0.10D | |
| 4 | 2(50) | 1 | 3 | 8.73±0.11CD | 12.84±0.63BC | 1.65±0.04D | 9.55±0.38AB | |
| 5 | 2 | 2 | 1 | 9.62±0.43A | 13.25±1.05ABC | 1.72±0.01B | 9.19±0.29ABC | |
| 6 | 2 | 3 | 2 | 9.84±0.14A | 14.56±2.52AB | 1.76±0.01A | 9.10±0.10ABC | |
| 7 | 3(55) | 1 | 2 | 9.31±0.09AB | 14.36±0.27AB | 1.73±0.01AB | 10.16±0.26A | |
| 8 | 3 | 2 | 3 | 8.98±0.03BC | 14.78±0.10A | 1.75±0.01AB | 8.25±0.17C | |
| 9 | 3 | 3 | 1 | 9.31±0.63AB | 14.15±0.19AB | 1.66±0.02CD | 8.52±0.06BC | |
| K1 | 7.29 | 8.62 | 8.91 | |||||
| K2 | 9.39 | 8.99 | 9.18 | Soluble protein content | ||||
| K3 | 9.20 | 8.28 | 7.80 | A > C > B | ||||
| R | 1.91 | 0.71 | 1.38 | A2B2C2 | ||||
| K1 | 11.74 | 10.52 | 13.64 | |||||
| K2 | 13.55 | 13.32 | 13.62 | Free amino acids | ||||
| K3 | 14.43 | 12.83 | 12.46 | B > A > C | ||||
| R | 2.69 | 2.80 | 1.18 | A3B2C1 | ||||
| K1 | 1.65 | 1.69 | 1.69 | |||||
| K2 | 1.71 | 1.68 | 1.69 | A260/A280 | ||||
| K3 | 1.72 | 1.70 | 1.69 | A > B > C | ||||
| R | 0.07 | 0.01 | 0.00 | A2B3C | ||||
| K1 | 6.81 | 7.64 | 7.64 | |||||
| K2 | 9.28 | 9.00 | 9.60 | Alpha-amino nitrogen | ||||
| K3 | 8.97 | 7.75 | 7.81 | A > C > B | ||||
| R | 2.47 | 1.36 | 1.96 | A2B2C2 | ||||
| The different uppercase letters of the same column data showed significant different (P < 0.05). | ||||||||
表选项
2.9.1 正交试验Topsis综合分析结果由表 6可知,经过DPS软件Topsis法对多试验、多指标进行分析后,得到固态发酵下酵母自溶最佳工艺条件:自溶温度55 ℃、自溶时间18 h、锌离子添加浓度为2 mg/kg,此时可溶性蛋白含量为9.31 mg/g、游离氨基酸14.36 mg/g、α-氨基氮10.16 μg/g、A260/A280为1.73。
表 6 正交试验Topsis综合分析结果Table 6 Orthogonal test results of Toss synthesis
| Sample | D+ | D- | Statistics CI | Ranking |
| 1 | 0.212 693 3 | 0.124 927 3 | 0.370 022 6 | 8 |
| 2 | 0.098 992 2 | 0.204 556 7 | 0.673 884 0 | 7 |
| 3 | 0.267 323 4 | 0.026 380 5 | 0.089 820 1 | 9 |
| 4 | 0.071 715 5 | 0.220 843 0 | 0.754 867 8 | 4 |
| 5 | 0.055 829 1 | 0.234 347 7 | 0.807 603 1 | 3 |
| 6 | 0.043 362 3 | 0.251 510 7 | 0.852 945 9 | 2 |
| 7 | 0.022 624 1 | 0.266 586 8 | 0.921 773 1 | 1 |
| 8 | 0.080 359 8 | 0.217 411 5 | 0.730 129 2 | 6 |
| 9 | 0.073 597 2 | 0.218 574 9 | 0.748 103 2 | 5 |
表选项
3 讨论3.1 温度对酵母自溶的影响酵母自溶的本质是一种酶促反应,是在菌体内蛋白酶、碳水化合物水解酶及其他酶类的参与下进行的,每一种酶都有适合自己的温度。这些酶在一个特定的温度条件下,催化达到一个最佳平衡点,发挥最佳的催化效率,因此温度是酵母自溶最关键的因素。喻轶等[8]研究表明,当自溶温度为55 ℃时,氨基酸态氮溶出率达到最大。孙向军等[20]发现自溶温度在40–56 ℃范围内蛋白质与氨基酸溢出量持续升高,到56 ℃左右开始下降,表明56 ℃是蛋白质与氨基酸溢出的最佳温度。杨建梅等[4]发现,当自溶温度为55 ℃时,游离氨基酸态氮得率、上清液总糖分含量和抽提物得率均达到最大。本试验中,当自溶温度逐渐增高时,发酵产物中可溶性蛋白含量、游离氨基酸及α-氨基氮的含量也呈现增加的趋势,当自溶温度为50–60 ℃时,各项指标的增长趋于平缓。正交试验结果中,50 ℃温度组各测定指标含量较其他组均处于较高水平,表明虽然增加温度可以增大酵母自溶程度,但并不是温度越高越好。酵母细胞A、B、C、D四个部分的酵母蛋白酶,在急剧的自溶作用下,这些酶的活性都得到了很大的提高。外切肽酶A的最适温度为30–35 ℃,内切肽酶B、C为50 ℃左右,酶D为60 ℃左右[21]。试验中当温度达到50 ℃时,各项评定指标含量与55 ℃、60 ℃之间已无明显差异。结合固态微生物发酵饲料实际生产工艺,自溶适宜温度为50–55 ℃。
3.2 时间对酵母自溶的影响试验初期先将物料放在30 ℃条件下发酵28 h后,然后将此状态的物料放在不同的温度条件下进行自溶,因此在自溶起始点时游离氨基酸、α-氨基氮等指标含量就出现了明显差异。酵母细胞自溶需要一定的时间,只有细胞自溶后,胞内的各类水解酶系才能被活化发挥作用。自溶过程中,酵母细胞内容物是不断溢出的,时间过长会染杂菌而时间过短不能有效地获取细胞内容物。本试验研究表明,随着自溶时间的延长,发酵产物中可溶性蛋白、游离氨基酸等指标含量也随之增加。当自溶时间为0–12 h各测定指标增长缓慢,12–24 h时增长迅速,24–30 h增长趋于平缓或降低趋势。田小群等[22]研究发现,自溶温度50 ℃时,时间越长,氨基氮含量越高,但24 h后氨基氮含量上升基本趋于平稳。相同条件下,汤务霞等[23]也有同样发现。自溶初期,只有少量分子量小的氨基酸和肽类才有可能透过细胞壁而释放到胞外,因此初期可溶性蛋白、游离氨基酸等的含量也较低。在自溶进行到中、后期,即自溶12–24 h时,酵母细胞内的蛋白水解酶、碳水化合物酶与相应底物充分反应,酶促反应速率已经达到较高的水平,产物中可溶性蛋白等的含量也逐渐增加。当自溶时间为24–30 h,各项测定指标的上升趋势趋于平缓或略微降低,表明当酶促反应进行到最后时期,底物已经被相应的酶类彻底降解。随着自溶时间的进一步延长,可溶性蛋白、游离氨基酸等含量已经达到极限,因此自溶时间不宜过长,结合固态微生物发酵饲料实际生产工艺,自溶适宜温度为12–24 h。
3.3 锌离子浓度对酵母自溶的影响由试验可知,当锌离子浓度增大时,各项测定指标含量也随之增加。分析其原因,锌是酿酒酵母维持生长代谢所必需的微量元素[24-25]。酿酒酵母在麦芽汁中生长迅速并累积锌离子用于细胞生长代谢及细胞繁殖。Susan等[26]研究发现,Zn2+浓度并不能影响细胞的生长,但可以影响发酵速率,适当浓度Zn2+与酵母细胞相互作用时可提高酵母发酵速率。锌离子不足时,会导致发酵停滞。在一定条件下,锌离子浓度增加可加速酵母自溶[27]。然而锌离子浓度也不是越高越好,汪志君等[28]研究发现,当锌离子添加过量时,会对酵母细胞有毒害作用,影响细胞增殖及活性。过量的锌离子会导致酵母细胞代谢副产物高级醇、双乙酰等活性物质含量降低,从而使得酵母发酵度降低。景晓莉等[29]发现,当酿造液锌离子浓度为5 mg/L时,酿造液中α-氨基氮和氨基酸含量分别提高了3.5 mg/L和56 mg/L,同时提高了酵母的活力与发酵度。本试验中,当锌离子添加浓度为2–8 mg/kg时,游离氨基酸、α-氨基氮等活性物质含量较其他组均有显著提高,这是因为锌离子作为促进剂使酶蛋白保持特定的结构,更好地与底物结合,提高底物的分解速率,从而使蛋白质生成更多的氨基酸类物质,同时可提高酵母发酵性能及酵母活性。结合正交试验结果,固态发酵工艺选取锌离子浓度为2–4 mg/kg。
3.4 A260/A280值对酵母自溶的影响A260/A280比值是一个综合反映蛋白质和核酸类物质含量关系的物理量,若比值高则说明有RNA,若比值低则说明样品中有蛋白质存在,DNA纯品的A260/A280为1.8[30]。本试验中,在自溶初期,因为酵母释放的蛋白质类物质比较多,所以A260/A280值较小。随着时间的延长,A260/A280值也随之增大,核酸类物质所占比例增大,表明自溶程度也在逐渐增大,这与许维娜等[16]的研究结果一致。随着温度的增加,A260/A280也在增大。当温度升到50 ℃时,A260/A280值与55 ℃、60 ℃组无显著差异(P > 0.05),但显著高于45 ℃与40 ℃组(P < 0.05)。表明当温度为50 ℃时,为酶促反应最适温度,此温度下酵母自溶程度已经达到最大。锌离子浓度的适当增加,A260/A280值也逐渐增大,表明锌离子加速了酵母自溶的过程。
4 结论本试验固态发酵条件下酵母自溶的优化工艺为:自溶温度55 ℃、作用时间18 h、锌离子浓度为2 mg/kg,此时自溶代谢产物中可溶性蛋白含量为9.31 mg/g、游离氨基酸为14.36 mg/g、α-氨基氮为10.16 μg/g、A260/A280为1.73。
参考文献
| [1] | Wang M, Zheng FY, Liu CF, et al. Research on evaluation index of autolytic ability in brewing yeast.Sci Technol Food Ind, 2009, 30(10): 73–75.(in Chinese). 王敏, 郑飞云, 刘春风, 等. 啤酒酵母自溶分析评价指标的研究.食品工业科技, 2009, 30(10): 73-75. |
| [2] | Premsler T, Zahedi RP, Lewandrowski U, et al. Recent advances in yeast organelle and membrane proteomics.Proteomics, 2009, 9(20): 4731–4743.DOI: 10.1002/pmic.v9:20 |
| [3] | Borchani C, Fonteyn F, Jamin G, et al. Enzymatic process for the fractionation of baker's yeast cell wall (Saccharomyces cerevisiae).Food Chem, 2014, 163: 108–113.DOI: 10.1016/j.foodchem.2014.04.086 |
| [4] | Yang JM, Li H, Du JH. Autolysis conditions of waste brewer's yeast.China Brew, 2012, 31(2): 95–99.(in Chinese). 杨建梅, 李红, 杜金华. 啤酒废酵母自溶条件的研究.中国酿造, 2012, 31(2): 95-99.DOI:10.3969/j.issn.0254-5071.2012.02.027 |
| [5] | Zhao ZY, Du JH. The effect of zinc ion addition on yeast autolysis in beer.Liquor Mak, 2015, 42(6): 71–76.(in Chinese). 赵志云, 杜金华. 添加锌离子对啤酒酵母自溶的影响.酿酒, 2015, 42(6): 71-76.DOI:10.3969/j.issn.1002-8110.2015.06.027 |
| [6] | Li Y, Bao QB, Kong L, et al. Optimums of food-grade yeast extract processing technology.Food Ind, 2011(5): 62–65.(in Chinese). 李杨, 包清彬, 孔凌, 等. 酵母抽提物自溶工艺优化.食品工业, 2011(5): 62-65. |
| [7] | Zeng D, Huang JM. Studying of yeast extrac used in dissolved substances from the Pichia pastoris.J Ferment Technol, 2011, 40(3): 9–11.(in Chinese). 曾栋, 黄金明. 毕赤酵母自溶物酵母抽提物的研究.发酵科技通讯, 2011, 40(3): 9-11.DOI:10.3969/j.issn.1674-2214.2011.03.004 |
| [8] | Yu Y, Chen Y, Li Q, et al. Optimization of Debaryomyces hansenii autolysis condition through wastewater from monosodium glutamate.Sci Technol Food Ind, 2017, 38(12): 140–145.(in Chinese). 喻轶, 陈园, 黎琪, 等. 味精废水培养汉逊德巴利酵母的自溶条件优化.食品工业科技, 2017, 38(12): 140-145. |
| [9] | Jiang XW, Luo XM, Liu YL. Study on autolysis conditions of spent brewer yeast by changing temperature.Sci Technol Food Ind, 2003, 24(4): 48–50.(in Chinese). 蒋雪薇, 罗晓明, 刘永乐. 啤酒废酵母变温自溶条件的研究.食品工业科技, 2003, 24(4): 48-50. |
| [10] | Jiang H, Li HJ, Zhang JJ. Effect of zinc ion on beer brewing.Beer Sci Technol, 2014(7): 32–34.(in Chinese). 蒋虹, 李红捷, 张京菁. 锌离子对啤酒酿造的影响.啤酒科技, 2014(7): 32-34.DOI:10.3969/j.issn.1008-4819.2014.07.008 |
| [11] | Zhu ZF. Roles of zinc ions in beer brewing and its control.Liquor-Mak Sci Technol, 2003(6): 65–66.(in Chinese). 祝忠付. 锌离子在啤酒酿造中的作用与控制.酿酒科技, 2003(6): 65-66.DOI:10.3969/j.issn.1001-9286.2003.06.021 |
| [12] | Zhang JL. Effect of turned material process and different strains of combination on nutricines content of compound bacteria solid state fermentation[D]. Hohhot: Inner Mongolia Agricultural University, 2015 (in Chinese). 张锦玲.翻料工艺及不同菌种组合对复合菌固态发酵活性物质含量的影响[D].呼和浩特: 内蒙古农业大学, 2015. |
| [13] | Guo P, Zhang LM, Zhang Z, et al. Study on the microbial fermentation feed formula and its turning process of dairy cows.China Anim Husband Veter Med, 2016, 43(10): 2598–2607.(in Chinese). 郭鹏, 张立明, 张政, 等. 奶牛微生物发酵饲料组方及其配套翻料工艺的研究.中国畜牧兽医, 2016, 43(10): 2598-2607. |
| [14] | Ibano?lu S. Influence of tempering with ozonated water on the selected properties of wheat flour.J Eng, 2001, 48(4): 345–350. |
| [15] | Gaou I, Dubois M, Pfohl-Leszkowicz A, et al. Safety of Oxygreen?, an ozone treatment on wheat grains. Part 1. A four-week toxicity study in rats by dietary administration of treated wheat.Food Addit Contam, 2005, 22(11): 1113–1119.DOI: 10.1080/02652030500307156 |
| [16] | Xu WN. Study on the evaluation and mechanism of autolysis in lager brewer's yeasts[D]. Wuxi: Jiangnan University, 2014 (in Chinese). 许维娜.啤酒酵母自溶评价及机理研究[D].无锡: 江南大学, 2014. |
| [17] | Li HM, Peng SM, Li L, et al. Studies on four conventional methods for protein determination.Chin J Biochem Pharm, 2008, 29(4): 277–278.(in Chinese). 李海玲, 彭书明, 李凛, 等. 4种常用蛋白浓度测定方法的比较.中国生化药物杂志, 2008, 29(4): 277-278. |
| [18] | National Development and Reform Commission of the People's Republic of China. QB/T1686-2008 Barley malt.Beijing: China Light Industry Press, 2008(in Chinese). 中华人民共和国国家发展和改革委员会. QB/T1686- 2008啤酒麦芽.北京: 中国轻工业出版社, 2008. |
| [19] | Wang EZ. Method for measuring amino acid concentration and amino acid diagnose reagent kit: CN, CN101082569A. 2007-12-05 (in Chinese). 王尔中.氨基酸浓度的测定方法及氨基酸诊断试剂盒: 中国, CN101082569A. 2007-12-05. |
| [20] | Sun XJ, Yao XM, Zhang W. A study on condition of yeast autolysis.J Shanghai Agric College, 2000, 18(1): 36–39.(in Chinese). 孙向军, 姚晓敏, 张伟. 酵母细胞自溶条件的研究.上海农学院学报, 2000, 18(1): 36-39.DOI:10.3969/j.issn.1671-9964.2000.01.007 |
| [21] | Li X, Peng L, Wang Y, et al. The study of yeast autolysis.China Brew, 2001, 20(5): 17–19.(in Chinese). 李祥, 彭莉, 王毅, 等. 酵母自溶研究.中国酿造, 2001, 20(5): 17-19.DOI:10.3969/j.issn.0254-5071.2001.05.006 |
| [22] | Tian XQ, Tu JX, Li HP. Study on autolysis of amino acid solution from waste beer yeast.J Beer Sci Technol, 2011(7): 27–29.(in Chinese). 田小群, 涂京霞, 李惠萍. 啤酒废酵母自溶制备氨基酸液的研究.啤酒科技, 2011(7): 27-29.DOI:10.3969/j.issn.1008-4819.2011.07.012 |
| [23] | Tang WX. Study on autolysis conditions of waste brewer's yeast.Sichuan Food Ferment Technol, 2006, 42(5): 31–33.(in Chinese). 汤务霞. 啤酒废酵母自溶条件的研究.四川食品与发酵, 2006, 42(5): 31-33. |
| [24] | Eide DJ. Zinc transporters and the cellular trafficking of zinc.Biochim Biophys Acta, 2006, 1763(7): 711–722.DOI: 10.1016/j.bbamcr.2006.03.005 |
| [25] | de Nicola R, Walker GM. Accumulation and cellular distribution of zinc by brewing yeast.Enzyme Microb Technol, 2009, 44(4): 210–216.DOI: 10.1016/j.enzmictec.2008.11.008 |
| [26] | Bromberg SK, Bower PA, Duncombe GR, et al. Requirements for zinc, manganese, calcium, and magnesium in wort.J Am Soc Brew Chem, 1997, 55(3): 123–128. |
| [27] | Li DN. On the environmental factors leading to yeast death and autolysis in beer fermentation process.Sci Technol Innovation Herald, 2008(5): 153.(in Chinese). 李德宁. 论啤酒发酵过程中导致酵母死亡及自溶的环境因素.科技创新导报, 2008(5): 153.DOI:10.3969/j.issn.1674-098X.2008.05.146 |
| [28] | Wang ZJ, Yu XH, Fang WM. Effects of wort containing abundant ferrum and zinc on metabolic by product of beer yeast.Liquor-Mak Sci Technol, 2003(5): 73–76.(in Chinese). 汪志君, 余晓红, 方维明. 富铁、富锌麦汁对啤酒酵母代谢副产物的影响.酿酒科技, 2003(5): 73-76.DOI:10.3969/j.issn.1001-9286.2003.05.025 |
| [29] | Jing XL. Effects of constant and trace ions in brewing water on beer brewing[D]. Lanzhou: Gansu Agricultural University, 2006 (in Chinese). 景晓莉.酿造水中的常量离子、微量离子对啤酒酿造的影响[D].兰州: 甘肃农业大学, 2006. |
| [30] | Jin LQ. Biochemistry.Beijing: People's Health Publishing House, 2007(in Chinese). 金丽琴. 生物化学.北京: 人民卫生出版社, 2007. |
