
 , 薛金爱2, 李润植2
, 薛金爱2, 李润植2

1 山西农业大学 生命科学学院,山西 太谷 030801;
2 山西农业大学 分子农业与生物能源研究所,山西 太谷 030801
收稿日期:2018-06-08;接收日期:2018-07-20 基金项目:国家自然科学基金(Nos. 30971806, 31201266, 31401430),国家农业部“948”项目(No. 2014-Z39),山西省煤基重点科技攻关项目(No.FT-2014-01),山西省重点科技项目(No. 201603D312005),山西省留学归国人员科研基金项目(No. 2015-064)资助
摘要:为提高大豆Glycine max种子含油量和营养品质,文中以二酰甘油酰基转移酶1 (Diacylglycerol acyltransferase 1,DGAT1)基因为遗传修饰靶标。将来自高油植物斑鸠菊Vernonia galamensis L.编码DGAT1酶蛋白的cDNA克隆VgDGAT1A在大豆种子特异超表达。连续选择获得高代(T7) VgDGAT1A转基因大豆株系。转基因株系表型鉴定显示,在大豆种子发育中期(30-45 DAF),VgDGAT1A高表达,相应地DGAT酶活性是非转基因野生型和空载体转化对照的7.8倍。转基因成熟种子含油量比对照提高了5.1%,淀粉含量比对照减少2%-3%,蛋白质含量与对照无显著差异。此外,转基因大豆种子百粒重(14.5 g)和种子萌发率(95.6%)与对照亦无明显差异。种子油脂脂肪酸成分分析显示,转基因大豆种子油中抗氧化的油酸(C18:1Δ9)含量比对照提高8.2%,相应地易氧化的亚油酸(C18:2Δ9, 12)和亚麻酸(C18:3Δ9, 12, 15)分别减少6%和2%。这些数据表明,种子特异超表达外源VgDGAT1A基因,打破了大豆种子含油量和蛋白质含量的负连锁,显著提高种子含油量且未导致蛋白含量降低。转基因大豆种子重量和萌发率亦未显负效应,而且种子油脂抗氧化性和营养品质得以改善。研究表明应用这一高酶活性VgDGAT1A的基因工程是提高种子含油量和改善油脂品质的一条有效途径。
关键词:大豆 斑鸠菊 种子营养品质 二酰甘油酰基转移酶1 (DGAT1) 种子特异表达 脂肪酸和油脂含量
Seed-specific expression of heterologous gene DGAT1 increase soybean seed oil content and nutritional quality
Fei Zhang1, Xiuqing Gao2, Jingjie Zhang2, Baoling Liu2, Hongmei Zhang1

 , Jinai Xue2, Runzhi Li2
, Jinai Xue2, Runzhi Li2

1 College of Life Science, Shanxi Agricultural University, Taigu 030801, Shanxi, China;
2 Institute of Molecular Agriculture and Bioenergy, Shanxi Agricultural University, Taigu 030801, Shanxi, China
Received: June 8, 2018; Accepted: July 20, 2018
Supported by: National Natural Science Foundation of China (Nos. 30971806, 31201266, 31401430), National Department of Agriculture "948" Program (No. 2014-Z39), Coal-based Key Sci-Tech Project of Shanxi Province, China (No. FT-2014-01), Key Project of The Key Research and Development Program of Shanxi Province, China (No. 201603D312005), Research Project Supported by Shanxi Scholarship Council of China (No. 2015-064)
Corresponding author:Hongmei Zhang. Tel: +86-354-6286908; E-mail: tgzhhm@163.com
Runzhi Li. Tel: +86-354-6288344; E-mail: rli2001@126.com
Abstract: Enhancing soybean (Glycine max) oil production is crucial to meet the market demand of vegetable oil. Diacylglycerol acyltransferase (DGAT) catalyzes the final acylation reaction of triacylglycerol (TAG) synthesis, acting as one of the rate-limiting enzymes for oil biosynthesis in plant seeds. Here, a cDNA clone VgDGAT1A encoding the DGAT1 protein was isolated from the high oil plant Vernonia galamensis. VgDGAT1A was specifically overexpressed in soybean seeds, and several high-generation transgenic lines (T7) were obtained by continuous selection. qPCR analysis showed that VgDGAT1A was highly expressed in the mid-development stage (30-45 DAF) of the transgenic seeds. Accordingly, the DGAT enzyme activity in the transgenic seeds was increased by 7.8 folds in comparison with the wild-type controls. Seed oil and starch contents were, respectively, increased by 5.1% (Dry weight) and reduced by 2%-3% in the transgenic soybeans. Importantly, protein content was not significantly different between transgenic and control seeds. Seed weight and germination rate of the transgenic lines exhibited no negative effect. Fatty acid profiling demonstrated that antioxidant oleic acid (C18:1Δ9) content in the transgenic seed oil was elevated by 8.2% compared to the control, and correspondingly, easily-oxidized linoleic acid (C18:2Δ9, 12) and linolenic acid (C18:3Δ9, 12, 15) were decreased by 6% and 2% respectively. Taken together, seed-specific overexpression of an exogenous VgDGAT1A gene can break the negative linkage of oil and protein contents in soybean seeds, indicating that engineering of this highly-active DGAT enzyme is an effective strategy to improve oil yield and nutritional value in oilseeds.
Keywords: soybean (Glycine max) Vernonia galamensis seed nutritional quality diacylglycerol acyltransferase 1 (DGAT1) seed-specific expression fatty acid and oil content
大豆(Glycine max L.Merr)是我国和世界主要粮油作物之一,富含蛋白质(约40%),氨基酸种类多,钙磷铁含量丰富,油脂含量高(约20%)。大豆油除了作为人类食用油的主要来源之外,还用于生产生物柴油、食品和化工品等[1]。现今全球28%的植物油来源于大豆油,而且大豆油的市场消费量逐年增长[2]。培育高油大豆品种和提高大豆油产量是应对全球大豆油市场需求的有效途径。然而,常规育种手段难以克服种子油含量与蛋白含量负相关的缺点,不易培育获得种子油脂和蛋白质含量双高的大豆品种。
植物种子油主要为三酰甘油(Triacylglycerol,TAG)。TAG在细胞内质网上合成并储存于油体内。在相关酶的催化下,甘油分子3个碳原子(sn-1、-2和-3)依次分别结合一个长链脂肪酸酰基而形成TAG。二酰基甘油酰基转移酶(Diacylglycerol acyltransferase,DGAT)参与TAG合成的最后一步酰化反应,是TAG合成的限速酶。DGAT (EC2.3.1.20)将结合于CoA分子的长链脂肪酸酰基转移到二酰甘油(sn-1, 2-diacylglycerol,DAG)的sn-3位置而生成TAG。根据DGAT的结构、亚细胞定位等信息,可将其分为3种类型:DGAT1、DGAT2和DGAT3。DGAT1和DGAT2为膜结合蛋白酶,但二者序列不具同源性[3-4]。现已在拟南芥Arabidopsis thaliana、油菜Brassica napus和大豆等植物中分离到编码有功能的DGAT1或DGAT2基因。DGAT3又称胞质DGAT (Cyto DGAT),为可溶性酶蛋白,最初从花生Arachis hypogaea种子中分离获得,且具有DGAT酶活性[5]。拟南芥、亚麻荠Camelina sativa和大豆等一些油料作物也发现DGAT3的同源序列,但还未有功能验证[1, 6]。全基因组分析显示大豆基因组编码多个拷贝的DGAT1、DGAT2和DGAT3序列[1],迄今仅有GmDGAT1A (Glyma13g16560)和GmDGAT1B (Glma17g06120)的功能得到鉴定。GmDGAT1A和1B均在大豆种子油脂大量积累时期高表达,预示着二者在大豆种子油脂合成积累中起重要作用。
用模式植物拟南芥和其他油料作物为受体的转基因试验表明,超表达不同来源的DGAT基因能提高种子含油量,但效应有差异。Jako等研究发现,拟南芥AtDGAT1突变体AS11中种子含油量下降20%-40%,过表达AtDGAT1导致种子含油量和千粒重提高[7]。过表达源于旱金莲Tropaeolum majus L.的TmDGAT1转基因拟南芥种子油含量提高3.5%[8]。烟草Nicotiana tabacum L. NtDGAT1基因沉默的转基因烟草成熟种子油含量减少9%-49%[9]。陆地棉GhDGAT1沉默引起棉籽种仁含油量下降3.13%[10]。Taylor等报道超表达拟南芥AtDGAT1和甘蓝型油菜的BnDGAT1可使油菜Brassica napus种子含油量分别提高2.5%和5%[11]。将BnDGAT1在油菜种子中超表达,种子油含量提高14%,而且转基因植株耐旱性增强[12]。同一作物不同的DGAT1等位基因其效应也存在差异。Zheng等发现,过表达来自低油玉米的ZmDGAT1基因导致转基因玉米种胚含油量提高12.4%,而表达来自高油玉米的ZmDGAT1基因,转基因玉米种胚含油量提高26.1%[13]。
超表达DGAT基因亦可提高大豆种子含油量。Lardizabal等在大豆中过表达密码子优化的一种真菌Umbelopsis ramanniana UrDGAT2基因,使大豆种子含油量提高了1.5%[14],但是种子蛋白含量小幅降低。种子特异表达来自芝麻Sesamum indicum的SiDGAT1,转基因大豆种子含油量提高1.75%[15],未报道种子蛋白含量是否变化。Roesler等对大豆GmDGAT1 (Glyma.17G053300)部分编码序列进行修饰(替换了14个氨基酸)获得酶活性提高的突变体,将野生型GmDGAT1和突变型GmDGAT1分别在大豆体细胞胚中表达,体细胞胚含油量分别提高5%和10%。一年一点大田试验结果显示,突变型GmDGAT1转基因成熟种子含油量提高3%,蛋白质含量未减少,然而可溶性碳水化合物含量降低1.9%[16]。可见,超表达外源DGAT或大豆本身DGAT基因均可提高大豆种子油脂积累,尽管效应有差异。
本课题组前期从高油野生植物斑鸠菊Vernoniagalamensis L. (含油量约60%)发育种子中分离到编码DGAT1的cDNA克隆(VgDGAT1A, GenBank登录号:EF653277)。多种体内和体外酶学试验证明VgDGAT1A酶活性高于大豆等油料作物DGAT1活性5倍多[17-19],是我们所检测来源不同的数种DGAT1酶活性最高者。苑丽霞等将VgDGAT1A导入油料作物亚麻荠并使其高表达,转基因纯合系亚麻荠种子含油量从野生型的37%提高到46%-51%[20]。在棉籽中超表达VgDGAT1A亦显著提高了棉花种子含油量[21]。此外,在烟草茎叶等营养器官异源过表达VgDGAT1A可使烟叶等营养组织TAG含量从野生型的2.1% (干基)提高到9.8%[22]。这些结果表明,VgDGAT1在油料作物遗传改良及代谢工程上具有重要应用价值,VgDGAT1A的异源表达不仅可提高种子含油量,而且还能显著提高植株营养器官油脂富集。
在我们前期培育获得种子特异表达VgDGAT1A转基因大豆材料基础上[23],本研究重点对连续筛选获得的高代(T7)遗传稳定的转基因大豆材料进行表型分析;通过实时荧光定量PCR检测VgDGAT1A在大豆发育种子中的表达谱;提取种子细胞微体膜结合蛋白、并检测样品中DGAT酶活性;分别检测转基因大豆种子油脂及脂肪酸成分、蛋白和淀粉含量,以及种子干重、种子萌发率等表型。与非转化的对照植株相比,种子特异超表达VgDGAT1A基因的稳定转基因系成熟种子含油量平均提高5.1%,且蛋白含量(41%)不降低,种子重量和种子萌发等农艺性状未显负效应。本研究为全面解析大豆油脂合成积累机制及调控网络提供了新知识,亦为大豆等油料作物油脂品质改良提供理论及技术支撑。
1 材料与方法1.1 目的基因及大豆遗传转化本实验所用的转基因受体大豆种质材料为大豆品种Jack。用于大豆遗传转化的外源基因来自高油野生植物斑鸠菊Vernoniagalamensis、编码二脂酰甘油酰基转移酶1 (Diacylglycerolacyltransferase 1,DGAT1)的cDNA克隆(VgDGAT1A)(GenBank登录号:EF653277)。构建种子特异表达载体,采用基于体细胞再生体系的粒子轰击法对大豆Jack进行遗传转化[23]。本实验所检测的转VgDGAT1A基因大豆高代材料(T7)由山西农业大学分子农业与生物能源研究所培育和保存。转VgDGAT1A基因大豆材料(T7)种植于山西农业大学农作站网室,正常田间管理至种子收获。
1.2 转VgDGAT1A基因大豆T7植株的DNA检测以4周龄的大豆幼苗(4-6片真叶)为试材,取新鲜幼叶为样品,采取改良版的CTAB法[24]提取叶片DNA。用Primer Premier 5.0引物设计软件设计PCR所用引物(表 1),设计时应避免引物二聚体的出现,引物由TSINGKE Biological Technology公司合成。PCR反应采用2×Taq PCR StarMix with Loading Dye试剂盒(Genstar公司)。反应体系包括正向和反向引物各1 μL (10 nmol/L),10 μL 2×Taq PCRStarMix混合,1 μL DNA和7 μL ddH2O。PCR反应程序为:94 ℃ 2 min;94 ℃ 30 s,58 ℃ 30 s,72 ℃ 30 s,30个循环。PCR产物用1%琼脂糖凝胶电泳检测。
表 1 PCR检测转VgDGAT1A大豆植株的引物Table 1 Primers of PCR test for VgDGAT1A-transgnic soybeans
| Primer name | Primer sequence (5′-3′) | Size (bp) |
| VgDGAT1A-F | TGCGACTCATACAGGATTCAAC | 22 |
| VgDGAT1A-R | AAATGTGTCCCTTGGGTTTGT | 21 |
| qRT-PCR-F | CCACTTGCTGCCTACATT | 18 |
| qRT-PCR-R | CGAGACGCCTGATAGAAC | 18 |
| GmActin-F | AAGCTGTTCTCTCCTTGTACGCC | 23 |
| GmActin-R | GCACAGTGTGAGACACACCATCA | 23 |
表选项
1.3 转基因大豆VgDGAT1A的表达分析使用Total RNA Extractor试剂盒(BBI Life Science公司)提取总RNA。取大豆开花后(Day after flowering,DAF) 12、25、35、45、50、60 d的种子为样品,在液氮中充分研磨,然后进行总RNA提取。将所得到的RNA样品置于-80 ℃保存备用。使用cDNA Synthesis Kit反转录试剂盒(Genstar公司)合成cDNA。用2×增强型染料实时荧光定量PCR预混液(GenStar公司)进行qRT-PCR。反应体系包括:正向和反向引物(定量引物见表 1)各1 μL (10 nmol/L),25 μL 2×RealStar GreenPower Mixture混合,1μL DNA,1 μL ROX Reference Dye(50×),21 μL RNase-free H2O。每个样品至少做6个生物学重复。反应程序为:95 ℃ 10 min;95 ℃ 15 s,59 ℃ 1 min,72 ℃ 30 s,40个循环。以大豆管家基因Actin作内参(内参引物见表 1),采用2-ΔΔCq来计算目的基因相对表达水平。
取8周龄转基因大豆根、茎、叶、花(花被未开启)和豆荚为样品,在液氮中充分研磨,然后进行总RNA提取。将所得到的RNA样品置于-80 ℃保存备用。使用cDNA Synthesis Kit反转录试剂盒(Genstar公司)合成cDNA。用不同器官和35 d种子的cDNA样品进行半定量RT-PCR检测。体系包括:正向和反向引物(定量引物见表 1)各1 μL (10 nmol/L),10 μL 2×Taq PCRStarMix混合,1 μL DNA和7 μL ddH2O。PCR反应程序为:94 ℃ 2 min;94 ℃ 30 s,58 ℃ 30 s,72 ℃ 30 s,25个循环。PCR产物用1%琼脂糖凝胶电泳检测。
1.4 VgDGAT1A转基因大豆发育种子的DGAT酶活性分析依据Yu等[18]描述的方法进行微体蛋白分离和DGAT酶活性分析。主要步骤包括:取足量的发育中期大豆种子样品(500-800 mg),置于液氮中研磨成粉末状,加入提取缓冲液(100 mmol/L HEPES-KOH,pH 7.4,0.32 mol/L蔗糖,1 mmol/L EDTA,1 mmol/L二硫苏糖醇),冰上继续研磨。将研磨所得细胞混液过滤后离心(10 000 r/min,20 min),取上清液超高速离心(105 000 r/min,1 h),获得粗酶液样品。用提取液重新悬浮微体蛋白,测蛋白浓度并将各样品蛋白浓度标定一致便于后续分析。
DGAT酶活性测试所用放射性底物均从Sigma公司定制,包括1-[14C]16:0-CoA(56 mCi/mmol)、1-[14C]18:0-CoA(56 mCi/mmol)、1-[14C]18:1-CoA(56 mCi/mmol),16CDAG (56 mCi/mmol)和18C DAG (56 mCi/mmol)。非放射性标记的CoAs、ATP、CoASH以及TAG标样等酶活性测试化学药品购自Sigma公司。酶活性测试反应体系(500μL):微体蛋白(富集DGAT) 100-200 μg,90 mmol/L HEPES-NaOH,0.5 mmol/L ATP,0.5 mmol/L CoASH,1 mmol/L MgCl2,200 μm 14Clabeled sn-1,2 di18:1 (溶于0.02%Tween 20,V/V,10 nCi/nmol),18或40 μm 14C-labeledacyl-CoA (10 nCi/nmol)。反应体系在pH 7.4、30 ℃水浴振荡(100 r/min)反应30-60 min。加入二氯甲烷:异丙醇(1:2)终止反应。分层后取有机相用硅胶G板进行TLC层析,分离和纯化放射性标记TAGs。层析介质为已烷:二乙醚:乙酸(70:30:1,V/V/V)。用放射性TCL扫描仪查看TCL板上放射性条带,并将条带刮下,用液体闪烁计数器检测各样品的放射性TAG条带的放射强度,每个样品至少做6个生物学重复,计算样品所含DGAT酶活性(pmol/min·mg蛋白)。
1.5 大豆种子油脂脂肪酸成分测定参照Li等[25]的方法提取大豆种子脂肪酸并进行甲酯化反应。使用Agilent 7890B气相色谱仪对提取的大豆油甲酯化样品进行分析,VF-23MS毛细管色谱柱30 m×0.25 m×0.25 μm。载气为高纯氮气,分流比为30:1,进样口温度250 ℃,进样体积为1 μL。程序升温:初始温度为110 ℃,运行3 min,以4 ℃/min升至220 ℃后运行15 min,FID检测器温度为260 ℃,尾吹气氮气45 mL/min,空气450 mL/min,氢气40 mL/min。每个样品至少做6个生物学重复。
1.6 大豆种子含油量、蛋白及淀粉含量、百粒重和发芽率的测定种子含油量的测定采用氯仿甲醇法。利用分析天平分别准确称取50 mg粗研的野生型大豆Jack和VgDGAT1A转基因大豆种子粉末,加入石英砂后充分研磨。研磨后置于50 mL离心管中,加入7.5 mL甲醇:氯仿(2:1)溶液,置于37 ℃的摇床抽提24 h,离心后收集上层有机相。剩余的样品残渣再加入7.5 mL甲醇:氯仿(2:1)溶液重复抽提12 h,并离心收集上层有机相。同理进行第3次抽提后合并3次的有机相。加入5 mL氯仿、9 mL 1%的NaCl溶液,使得最后甲醇:氯仿:H2O的比例为2:2:1.8。混匀后8 000 r/min离心10 min,收集下层有机相到称重的玻璃管中,氮气吹干后称出玻璃管及脂肪酸的总重量。每个样品至少做6个生物学重复。
蛋白含量测定采用考马斯亮蓝法,淀粉含量测定采用蒽酮比色法。每个样品至少做6个生物学重复。
百粒重测定:用分析天平对野生型的Jack大豆和VgDGAT1A转基因大豆进行百粒重测定,每个样品至少做6个生物学重复。
发芽率测定:野生型的Jack大豆和VgDGAT1A转基因大豆各选用150粒种子,放置于铺有专用发芽滤纸的培养皿内,30粒/皿,置于25 ℃恒温培养箱内。发芽率测定期间,每天定时检查保持滤纸湿润。以胚根突破种皮,长度达到种子长度的1/2作为发芽标准,统计发芽数量并计算发芽率。
上述所有测试数据均使用SPSS软件进行统计学分析,差异显著性用t-test检验。
2 结果与分析2.1 高代VgDGAT1A转基因大豆植株的DNA检测以高代转基因大豆植株的核DNA为模板,PCR检测VgDGAT1A基因(1 828bp),凝胶电泳分离PCR产物(图 1),在第7代大豆材料中,共检测大豆植株2 000株,检测出含转基因的植株有1 988株,占99.4%,表明试验用转基因高代大豆材料已基本纯合,且目的基因遗传稳定。
 |
| 图 1 VgDGAT1A转基因大豆的PCR检测 Figure 1 PCR test for VgDGAT1A DNA in the transgenic soybeans. "+" represents the positive plasmid; "-" represents wild-type soybean (negative control); "1-22" represents VgDGAT1A-transgenic soybean plants. |
| 图选项 |
2.2 外源基因VgDGAT1A在大豆发育种子中的表达分析检测大豆发育种子总RNA提取质量显示,A260/A280范围在1.97-2.01,条带清晰、没有弥散带、质量好,可以用于后续cDNA第一链合成及qRT-PCR实验。对转基因大豆根、茎、叶、花、豆荚和种子RNA样品进行半定量RT-PCR检测(图 2),仅在大豆种子中检测到VgDGAT1A的高表达。这说明在高代转基因大豆材料中目的基因按试验设计仅在发育种子中有效高表达,且遗传稳定。对转基因大豆种子发育不同阶段样品中VgDGAT1A的表达进行荧光定量PCR检测(图 3),结果显示,VgDGAT1A基因表达随种子发育呈现先升高再降低的单峰曲线。VgDGAT1A在大豆种子发育前期(12-25 DAF)和后期(60DAF)表达量低,在发育中期(35-50 DAF)高量表达。VgDGAT1A高量表达时期与大豆种子油脂快速积累时期相吻合,这预示着VgDGAT1A在转基因大豆种子油脂合成积累过程起重要作用。
 |
| 图 2 转基因大豆VgDGAT1A基因在不同器官和组织中表达的半定量RT-PCR分析 Figure 2 Semi-quantitative RT-PCR analysis of VgDGAT1A gene expression in different organs and tissues of transgenic soybean. "+" is a positive plasmid positive control; "R", "St", "L", "F", "P", "Se" represent transgenic soybean root (R), stem (St), leaf (L), flower (F), soybean pod (P) and 35 d seeds (Se), respectively. |
| 图选项 |
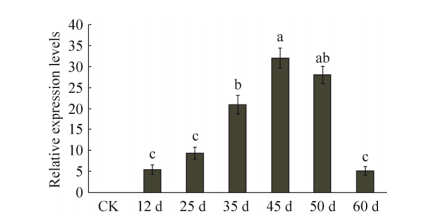 |
| 图 3 转基因大豆种子不同发育时期VgDGAT1A基因的表达水平 Figure 3 Relative expression levels of VgDGAT1A gene in different developing stages of transgenic soybean seeds. "CK" is the wild-type Jack soybean; "12 d", "25 d", "35 d", "45 d", "50 d" and "60 d" are the time of seed development after flowering. Relative expression levels are shown as x±s. Letters a, b, c, indicate significant differences at the level of P < 0.05. |
| 图选项 |
2.3 VgDGAT1A转基因大豆发育种子的DGAT酶活性检测我们前期研究已证明VgDGAT1A能够催化二酰甘油(DAG)连接来自酰基-CoA的脂肪酸酰基生成三酰甘油(TAG) [17-18]。为鉴定转VgDGAT1A基因大豆发育种子是否表达VgDGAT1A蛋白并正确行使催化功能,分别检测了野生型Jack和T7代转VgDGAT1A基因大豆发育种子中的DGATx酶活性。不同的反应底物DAG和酰基-CoA分子分别用[14C]放射性标记。将萃取获得的富集VgDGAT1酶蛋白的微体膜蛋白和放射性底物加入反应体系,通过检测反应体系生成放射性TAG的多少和速率来测定DGAT酶活性(图 4)。与非转基因的野生型大豆相比,转VgDGAT1A基因大豆种子中DGAT酶活性提高了约7.8倍左右。特别是以18:1-CoA和18:1-DAG为底物时,DGAT酶活性最高。这表明外源VgDGAT1A基因不仅稳定高效表达,所编码的蛋白也能正确生成,且具有极高的DGAT酶活性,尤其是对18:1-CoA有较高的底物选择性。
 |
| 图 4 VgDGAT1A转基因大豆与野生型Jack发育种子的DGAT酶活性检测 Figure 4 Detection of DGAT enzyme activity in developing seeds of VgDGAT1A-transgenic soybean and wild Jack. "Jack" represents wild-type soybean, "Empty vector" represents the empty-vector transformants, and "VgDGAT1A" stands for VgDGAT1A-transgenic soybean. DGAT enzyme activity (Triacylglycerides formed) are shown as x±s. **indicates significant different between transgenics and wild-type soybeans at the level of P < 0.01. |
| 图选项 |
2.4 VgDGAT1A转基因大豆种子不同发育时期油脂成分的分析为检测外源VgDGAT1A超表达是否对大豆种子油脂成分产生影响,我们应用GC测试对照(非转基因野生型Jack和和空载体转化大豆)和高代转基因种子不同发育时期油脂样品主要脂肪酸含量。结果显示(图 5A-C),与野生型(Jack)和空载体转化样品相比,VgDGAT1A转基因大豆种子发育早期(25 DAF)各脂肪酸含量无明显差异(P < 0.01)。在种子发育中期(45 DAF),油酸(C18:1Δ9)含量上升,到后期时(55 DAF)油酸含量比对照提高了8.2%。然而,亚油酸(C18:2Δ9, 12)和亚麻酸(C18:3Δ9, 12, 15)含量在种子发育中期高于对照,在种子发育后期比对照分别降低4%和2%。棕榈酸(C16:0)和硬脂酸(C18:0)含量在转基因种子和对照种子间无显著差异。转基因大豆种子油酸含量提高和亚油酸及亚麻酸含量降低可明显改善大豆油抗氧化性和营养品质。
 |
| 图 5 大豆种子不同发育时期的油脂成分含量 Figure 5 Fatty acid content in deferent development stages of soybean seeds. (A), (B) and (C) indicate the seed samples taken from soybean plants at 25, 45, and 55 DAF respectively. "Jack" represents wild-type soybean, "Empty vector" represents the empty-vector transformants, and "VgDGAT1A" stands for VgDGAT1A-transgenic soybean. Fatty acid contents (% total oil) are shown as x±s. ** and * indicates significant different between transgenics and wild-type soybeans at the level of P < 0.01 and P < 0.05, respectively. |
| 图选项 |
2.5 VgDGAT1A转基因大豆种子总油脂、蛋白质及淀粉含量的分析为检测超表达VgDGAT1A基因是否引起大豆种子油脂、蛋白质及淀粉合成积累的变化,我们分别测试了T7代转基因大豆株系收获的成熟种子含油量、蛋白质及淀粉含量。如图 6所示,与野生型(Jack)品种相比,VgDGAT1A转基因大豆种子总油脂含量提高4%-9%,平均提高了5.1%。蛋白质含量在对照(含量39.94%)和转基因大豆种子间无显著差异(P < 0.05),尽管部分转基因株系的蛋白含量略高于对照1%左右。转基因大豆种子淀粉含量比对照种子(10%)减少2%-3%。这表明VgDGAT1A在大豆种子特异高效表达显著提高种子储藏油脂合成积累,并没有以降低蛋白质合成为代价,而是引起淀粉合成减少。淀粉含量降低不影响大豆种子作为油脂和优质蛋白的市场价值。
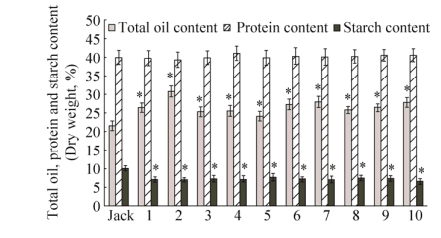 |
| 图 6 VgDGAT1A转基因大豆种子的油脂、蛋白质和淀粉含量 Figure 6 Contents of total oil, protein and starch in the VgDGAT1A-transgenic soybean seeds. "Jack" is non-transgenic wild-type soybean seed, and "1-10" represent the VgDGAT1A-transgenic soybean lines. Total oil, protein and strach contents (Dry weight) are shown as x±s. *indicates significant different between transgenics and wild-type soybeans at the level of P < 0.05. |
| 图选项 |
2.6 VgDGAT1A转基因大豆种子重量和发芽率的分析为了分析种子特异超表达VgDGAT1A基因是否对大豆的产量等农艺性状产生影响,进一步定量检测了T7代转基因大豆株系收获的成熟种子百粒重和萌发率等表型。就百粒重而言(图 7A),VgDGAT1A转基因大豆与野生型相比没有显著差异(P < 0.01),尽管有部分转基因株系百粒重提高。种子萌发率测试(图 7B-D)表明,VgDGAT1A转基因大豆与野生型相比无明显差异。这些数据至少表明,种子特异超表达VgDGAT1A基因没有对大豆种子重量和萌发等农艺性状造成负影响。
 |
| 图 7 VgDGAT1A转基因大豆与野生型Jack种子的百粒重及萌发率 Figure 7 100-seed weight and germination rate of the VgDGAT1A-transgenic and wild-type Jack seeds. (A) 100-seed weight of the VgDGAT1A-transgenic and wild-type Jack seeds. (B) Germination rate of the VgDGAT1A-transgenic and wild-type Jack seeds. (C-D) Germination and growth of the VgDGAT1A-transgenic and wild-type Jack seeds. "Jack" is non-transgenic wild-type soybean seed, and "1-10" represents the VgDGAT1A-transgenic soybean lines.100-seed weight and germination rate are shown as x±s. |
| 图选项 |
3 讨论就大豆等普通油料作物而言,培育种子含油量和蛋白质含量双高的种质,可显著提高其作为优异油脂和蛋白质资源的市场价值,始终是油料作物遗传改良的主要目标之一。然而,种子含油量和蛋白质含量遗传上呈负相关[26],常规育种方法少有获得高油或高蛋白种质、且同时保持蛋白或种子油含量不降低。迄今,绝大多数商业化的大豆品种含油量和蛋白含量分别维持在20%和40%左右[27-28]。
为打破种子含油量和蛋白含量的负相关,不少研究致力于对参与油料作物油脂生物合成的相关酶及调节蛋白进行基因修饰。如前所述,控制TAG合成最后一步酰基化反应的DGAT酶基因是一个重要靶标。种子特异超表达DGAT导致油菜Brassica napus种子含油量提高2%-5%[8, 11-12],玉米种胚含油量提高12%-26%[13, 29]。相应地,这些DGAT转基因种子蛋白含量小幅降低。在大豆种子特异表达来自真菌拉曼毛霉Umbelopsisramanniana的UrDGAT2A基因,种子含油量比对照提高1.5%,蛋白质含量亦发生减少,尽管转基因种子产量与对照相比没有明显差异[14]。在玉米籽粒中超表达来自真菌粗糙脉孢菌Neurospora crassa的NcDGAT2基因,导致玉米籽粒含油量比对照(4%)上升0.5%-0.9%,但对种子萌发及幼苗生长有负效应[29]。上述这些DGAT转基因种子油脂肪酸成分未检测到显著改变。
商用大豆品种种子油脂肪酸组成中亚油酸(18:2Δ9, 12)含量占总油脂50%以上,这种高亚油酸的油脂易氧化,导致营养品质减低。单不饱和的油酸(18:1Δ9)兼具饱和脂肪酸和多聚不饱和脂肪酸特性,富含油酸的油脂其抗氧化性和营养品质最佳[30-31]。在提高大豆种子油含量的同时,若能大幅增加油酸含量,就可显著提高大豆油的商业价值和健康营养功能。Zheng等在玉米种子胚中特异表达玉米本身DGAT1-2的高油等位基因ASKC281B1,导致玉米籽粒含油量比野生型对照提高0.9%-1.3%,同时引起油酸含量上升18%,亚油酸含量减低13.7%[13]。美洲榛Corylus americana种子油含量为60%,其中油酸含量高达79%。将来自美洲榛的编码CaDGAT1的cDNA克隆在大豆体细胞胚中特异表达,体细胞胚含油量由野生型7.6%提高到10%-12%。与野生型相比,转基因大豆体细胞油酸含量由17.9%上升到27%,而亚油酸含量相应降低了6%-9%[16]。将对油酰基有底物特异性的大豆GmDGAT1 (Glyma.17G053300)突变体在大豆体细胞胚中表达,体细胞胚含油量提高了10%,收获的成熟种子含油量比野生型提高了3%。而且种子蛋白含量未减,但可溶性碳水化合物含量降低了1.9%。与对照相比,成熟转基因大豆种子油酸含量提高到23%-28%,亚油酸和亚麻酸含量分别减少4%和6%[16]。可见,超表达DGAT提高种子油脂积累的幅度以及对脂肪酸组成、蛋白含量等其他农艺性状的影响大小在不同植物上的效应有差异,这可能与DGAT的来源、使用的种子特异启动子、DGAT酶活性和受体植物种类不同有关。
本实验室前期从一种野生菊科油料植物斑鸠菊Vernoniagalamensis发育种子中分离到编码DGAT1的cDNA克隆(VgDGAT1A),一系列试验证明VgDGAT1A是迄今检测的活性较高的一个DGAT酶蛋白,且对油酰基-CoA有底物特异性[17-19, 22]。本研究应用大豆储藏蛋白Glysin种子特异启动子驱动VgDGAT1A在大豆发育种子中超表达,对高代转基因大豆株系表型分析显示,成熟种子含油量比对照提高了5.1%,蛋白质含量与对照无显著差异(P < 0.05) (图 6),尽管部分转基因系种子蛋白含量有所升高。这表明种子特异超表达外源VgDGAT1A基因,打破了大豆种子含油量和蛋白质含量的负连锁,显著提高种子含油量并未以降低蛋白积累为代价。转基因大豆种子含油量显著提高,显然得益于VgDGAT1A在种子发育中期即油脂快速合成积累期高量表达(图 3)和DGAT酶活性急剧增加(图 4)。DGAT酶活性显著提升,势必催化更多的DAG和酰基-CoA分子生成TAG而扩充油脂库容量。TAG贮存量扩大将促使上游更多的光合产物用于油脂合成,但油脂合成增加并未影响到用于蛋白质合成的碳源供给。为检测用于油脂合成增加所需的额外碳源是否来自于其他储藏化合物合成的减少,我们测试了VgDGAT1A超表达的大豆成熟种子淀粉含量,与对照相比,淀粉含量平均减少了约3% (图 6)。与之相类似的是,Lardizabal等对UrDGAT2A转基因大豆种子检测发现寡聚糖类化合物相应降低[14],以及Roesler等发现CaDGAT1转基因大豆可溶性碳水化合物含量降低[16]。多糖类化合物减少所节省的碳源很可能部分地用于种子油脂合成。未来仍需设计精细试验分析超表达DGAT后种子内部碳源是如何分配于不同物质合成积累途径的。
与上述Roesler等[16]报道相似,本研究还显示,VgDGAT1A超表达的大豆成熟种子油脂肪酸成分发生了显著改变。转基因大豆种子油的油酸(C18:1Δ9)含量由对照18.1%提高到26.9%,相应地易氧化的亚油酸(C18:2Δ9, 12)和亚麻酸(C18:3Δ9, 12, 15)分别减少6%和2% (图 5)。油酸含量提高可能与导入的VgDGAT1A酶蛋白对油酰基-CoA底物有高选择性相关。对VgDGAT1A转基因大豆DGAT酶活性检测发现,转基因大豆的DGAT酶对18:1-CoA底物选择性高于对照7倍多(图 4)。显然对18:1-CoA底物高选择性来源于VgDGAT1A酶蛋白。该酶蛋白能高效地将新合成的18:1-CoA油酰基直接迅速转移至DAG而生成更多的18:1-TAG,相应地减少了18:1-CoA油酰基转入PC (Phosphatidylcholine)分子,再经FAD2 (Fatty aciddesaturase 2)和FAD3(Fatty acid desaturase 3)催化依次生成18:2和18:3-TAG的积累量。因此,应用DGAT策略改良油料作物时,最好选择酶活性强且对油酰基-CoA底物特异性高的DGAT酶。这样就可获得种子含油量和油酸含量均高的优异种质。DGAT1作为一种酶蛋白,在动物、植物、微生物细胞内均存在和行使功能,未见报道该酶蛋白产生过敏反应[32]和DGAT1异源表达产生毒性反应[33]。此外,VgDGAT1A转基因大豆种子百粒重和种子萌发率亦未显负效应(图 7),预示着这些稳定遗传的优异转基因品系种子产量至少不低于对照的产量。下一步应进行多点多年的大田实验,检测这些品系产量等农艺性状。
总之,种子特异超表达编码高酶活性的VgDGAT1A基因显著提高了大豆种子油含量,且打破了种子油脂含量与蛋白含量的负连锁,未对蛋白质合成积累和种子重量和萌发等农艺性状造成负影响。更为重要的是,转基因大豆种子油脂抗氧化性和营养品质显著改善。本研究结果为全面解析大豆等油料作物种子油脂等储藏物合成积累调控机制及遗传改良提供了参考。
参考文献
| [1] | Li RZ, Hatanaka T, Yu KS, et al. Soybean oil biosynthesis: role of diacylglycerol acyltransferases.Funct Integr Genomics, 2013, 13(1): 99–113.DOI: 10.1007/s10142-012-0306-z |
| [2] | Qi WD, Shang MR. Research on China's soybean industry development.Chin Agric Sci Bull, 2014, 30(17): 88–96.(in Chinese). 祁旺定, 尚明瑞. 中国大豆产业发展问题研究.中国农学通报, 2014, 30(17): 88-96.DOI:10.11924/j.issn.1000-6850.2013-2902 |
| [3] | Cases S, Stone SJ, Zhou P, et al. Cloning of DGAT2, a second mammalian diacylglycerol acyltransferase, and related family members.J Biol Chem, 2001, 276(42): 38870–38876.DOI: 10.1074/jbc.M106219200 |
| [4] | Lardizabal KD, Mai JT, Wagner NW, et al. DGAT2 is a new diacylglycerol acyltransferase gene family: purification, cloning, and expression in insect cells of two polypeptides from Mortierella ramanniana with diacylglycerol acyltransferase activity.J Biol Chem, 2001, 276(42): 38862–38869.DOI: 10.1074/jbc.M106168200 |
| [5] | Saha S, Enugutti B, Rajakumari S, et al. Cytosolic triacylglycerol biosynthetic pathway in oilseeds. Molecular cloning and expression of peanut cytosolic diacylglycerol acyltransferase.Plant Physiol, 2006, 141(4): 1533–1543.DOI: 10.1104/pp.106.082198 |
| [6] | Yuan LX, Mao X, Zhao K, et al. Characterisation of phospholipid: diacylglycerol Acyltransferases (PDATs) from Camelina sativa and their roles in stress responses.Biol Open, 2017, 6(7): 1024–1034.DOI: 10.1242/bio.026534 |
| [7] | Jako C, Kumar A, Wei YD, et al. Seed-specific over-expression of an Arabidopsis cDNA encoding a diacylglycerol acyltransferase enhances seed oil content and seed weight.Plant Physiol, 2001, 126(2): 861–874.DOI: 10.1104/pp.126.2.861 |
| [8] | Xu JY, Francis T, Mietkiewska E, et al. Cloning and characterization of an acyl-CoA-dependent diacylglycerol acyltransferase 1 (DGAT1) gene from Tropaeolum majus, and a study of the functional motifs of the DGAT protein using site-directed mutagenesis to modify enzyme activity and oil content.Plant Biotechnol J, 2008, 6(8): 799–818.DOI: 10.1111/pbi.2008.6.issue-8 |
| [9] | Zhang FY, Yang MF, Xu YN. Silencing of DGAT1 in tobacco causes a reduction in seed oil content.Plant Sci, 2005, 169(4): 689–694.DOI: 10.1016/j.plantsci.2005.05.019 |
| [10] | Liu ZJ, Zhang Y, Wang YM, et al. Construction and transformation of RNAi vector of gene GhDGAT1 in upland cotton.J China Agric Univ, 2013, 18(5): 1–8.(in Chinese). 刘正杰, 张园, 王玉美, 等. 陆地棉GhDGAT1基因干涉载体构建与遗传转化.中国农业大学学报, 2013, 18(5): 1-8. |
| [11] | Taylor DC, Zhang Y, Kumar A, et al. Molecular modification of triacylglycerol accumulation by over-expression of DGAT1 to produce canola with increased seed oil content under field conditions.Botany, 2009, 87(6): 533–543.DOI: 10.1139/B08-101 |
| [12] | Weselake RJ, Shah S, Tang MG, et al. Metabolic control analysis is helpful for informed genetic manipulation of oilseed rape (Brassica napus) to increase seed oil content.J Exp Bot, 2008, 59(13): 3543–3549.DOI: 10.1093/jxb/ern206 |
| [13] | Zheng PZ, Allen WB, Roesler K, et al. A phenylalanine in DGAT is a key determinant of oil content and composition in maize.Nat Genet, 2008, 40(3): 367–372.DOI: 10.1038/ng.85 |
| [14] | Lardizabal K, Effertz R, Levering C, et al. Expression of Umbelopsis ramanniana DGAT2A in seed increases oil in soybean.Plant Physiol, 2008, 148(1): 89–96.DOI: 10.1104/pp.108.123042 |
| [15] | Wang ZK, Huang WJ, Chang JM, et al. Overexpression of SiDGAT1, a gene encoding acyl CoA: diacylglycerol acyltransferase from -Sesamum indicum. L. increases oil content in transgenic Arabidopsis and soybean.Plant Cell Tissue Organ Cult, 2014, 119(2): 399–410.DOI: 10.1007/s11240-014-0543-z |
| [16] | Roesler K, Shen B, Bermudez E, et al. An improved variant of soybean type 1 diacylglycerol acyltransferase increases the oil content and decreases the soluble carbohydrate content of soybeans.Plant Physiol, 2016, 171(2): 878–893. |
| [17] | Yu KS, McCracken CT Jr, Li RZ, et al. Diacylglycerol acyltransferases from Vernonia and Stokesia prefer substrates with vernolic acid.Lipids, 2006, 41(6): 557–566.DOI: 10.1007/s11745-006-5005-x |
| [18] | Yu KS, Li RZ, Hatanaka T, et al. Cloning and functional analysis of two type 1 diacylglycerol acyltransferases from Vernonia galamensis.Phytochemistry, 2008, 69(5): 1119–1127.DOI: 10.1016/j.phytochem.2007.11.015 |
| [19] | Li RZ, Yu KS, Hatanaka T, et al. Vernonia DGATs increase accumulation of epoxy fatty acids in oil.Plant Biotechnol J, 2010, 8(2): 184–195.DOI: 10.1111/pbi.2010.8.issue-2 |
| [20] | Yuan LX, Mao X, Gao CY, et al. Seed-specific over-expression of a diacylglycerol acyltransferase 1 gene (VgDGAT1) increase seed oil accumulation in Camelina sativa.Plant Physiol J, 2015, 51(5): 668–678.(in Chinese). 苑丽霞, 毛雪, 高昌勇, 等. 种子特异表达二酰甘油酰基转移酶基因(VgDGAT1)提高亚麻荠种子油脂积累.植物生理学报, 2015, 51(5): 668-678. |
| [21] | Wang AK. Sudy on genetic transformation and expression of VgDGAT1 in cotton (Gossypium hirsutum L.)[D]. Hangzhou: Zhejiang University, 2013 (in Chinese). 王安可.棉花转VgDGAT1基因的遗传转化和表达研究[D].杭州: 浙江大学, 2013.http://www.wanfangdata.com.cn/details/detail.do?_type=degree&id=Y2298400 |
| [22] | Gao CY, Mao X, Shang HQ, et al. Enhanced oil accumulation in tobacco (N. tobacum L.) leaves by ectopic overexpression of VgDGAT1a for renewable biofuel oil.Curr Sci, 2018, 114(6): 1246. |
| [23] | Li RZ, Yu KS, Wu YM, et al. Vernonia DGATs can complement the disrupted oil and protein metabolism in epoxygenase-expressing soybean seeds.Metab Eng, 2012, 14(1): 29–38.DOI: 10.1016/j.ymben.2011.11.004 |
| [24] | Murray MG, Thompson WF, Wendel JF, et al. Rapid isolation of high molecular weight plant DNA.Nucleic Acids Res, 1980, 8(19): 4321–4325.DOI: 10.1093/nar/8.19.4321 |
| [25] | Li RZ, Yu KS, Hildebrand DF. DGAT1, DGAT2 and PDAT expression in seeds and other tissues of epoxy and hydroxy fatty acid accumulating plants.Lipids, 2010, 45(2): 145–157.DOI: 10.1007/s11745-010-3385-4 |
| [26] | Clemente TE, Cahoon EB. Soybean oil: genetic approaches for modification of functionality and total content.Plant Physiol, 2009, 151(3): 1030–1040.DOI: 10.1104/pp.109.146282 |
| [27] | Eskandari M, Cober ER, Rajcan I. Genetic control of soybean seed oil: Ⅱ. QTL and genes that increase oil concentration without decreasing protein or with increased seed yield.Theor Appl Genet, 2013, 126(6): 1677–1687.DOI: 10.1007/s00122-013-2083-z |
| [28] | Sonah H, O'Donoughue L, Cober E, et al. Identification of loci governing eight agronomic traits using a GBS-GWAS approach and validation by QTL mapping in soya bean.Plant Biotechnol J, 2015, 13(2): 211–221.DOI: 10.1111/pbi.2015.13.issue-2 |
| [29] | Oakes J, Brackenridge D, Colletti R, et al. Expression of fungal diacylglycerol acyltransferase2 genes to increase kernel oil in maize.Plant Physiol, 2011, 155(3): 1146–1157.DOI: 10.1104/pp.110.167676 |
| [30] | Gillingham LG, Harris-Janz S, Jones PJH. Dietary monounsaturated fatty acids are protective against metabolic syndrome and cardiovascular disease risk factors.Lipids, 2011, 46(3): 209–228.DOI: 10.1007/s11745-010-3524-y |
| [31] | Brink J, Ludtke SJ, Kong YF, et al. Experimental verification of conformational variation of human fatty acid synthase as predicted by normal mode analysis.Structure, 2004, 12(2): 185–191.DOI: 10.1016/j.str.2004.01.015 |
| [32] | Leamy AK, Hasenour CM, Egnatchik RA, et al. Knockdown of triglyceride synthesis does not enhance palmitate lipotoxicity or prevent oleate-mediated rescue in rat hepatocytes.Biochim Biophys Acta (BBA)-Mol Cell Biol Lipids, 2016, 1861(9): 1005–1014.DOI: 10.1016/j.bbalip.2016.05.013 |
| [33] | Liu L, Shi XJ, Bharadwaj KG, et al. DGAT1 expression increases heart triglyceride content but ameliorates lipotoxicity.J Biol Chem, 2009, 284(52): 36312–36323.DOI: 10.1074/jbc.M109.049817 |
