

1 山西农业大学 农学院,山西 太谷 030801;
2 山西农业大学 文理学院,山西 太谷 030801;
3 山西农业大学 经济管理学院,山西 太谷 030801;
4 山西省农业科学院 作物科学研究所,山西 太原 030000
收稿日期:2017-11-20;接收日期:2018-04-08; 网络出版时间:2018-04-18 基金项目:现代农业产业技术体系专项资金(No. GARS-08-G10),山西有机旱作农业关键技术研究与示范(No. 201703D211002-8),山西省优秀博士来晋工作奖励资金(No. SXYBKY201731)资助
摘要:为寻找抗绿豆象绿豆种子中的重要抗虫成分,以抗虫绿豆晋绿7号、B20及感虫绿豆潍绿2117为试验材料,采用蛋白质双向电泳(2-DE)和质谱技术,对抗、感虫绿豆中差异蛋白及功能进行了鉴定与分析。结果表明,抗、感虫绿豆中差异蛋白表达量超过2.5倍的点共有15个。其中6个蛋白点通过数据库得到了成功鉴定,涉及3种蛋白质,分别为8S球蛋白(α亚型和β亚型)、核酮糖1, 5-二磷酸羧化酶/加氧酶(RuBis CO)亚基结合蛋白和合成淀粉酶与胰蛋白酶两种抑制剂的前体多肽链。蛋白点B49 (即8S球蛋白α亚型)和B31 (RuBis CO亚基结合蛋白)在抗、感虫绿豆中的差异表达量分别达到10 000倍和23倍。抗虫绿豆中8S球蛋白α亚型及β亚型、RuBis CO伴侣蛋白及胰蛋白酶抑制剂的前体作为抗虫物质影响了绿豆象的生长发育甚至导致其死亡,与抗虫性的量效关系及联合效应还需进一步验证。
关键词:抗虫绿豆 感虫绿豆 双向电泳 差异蛋白
Separation and identification of differential protein in the insect-resistant and insect-susceptible mungbean
Xiaofang Cheng1,2, Hongmin Wang3, Yaowen Zhang4, Xianhong Zhang1


1 College of Agriculture, Shanxi Agricultural University, Taigu 030801, Shanxi, China;
2 College of Arts and Sciences, Shanxi Agricultural University, Taigu 030801, Shanxi, China;
3 College of Economics and Management, Shanxi Agricultural University, Taigu 030801, Shanxi, China;
4 Institute of Crop Science, Shanxi Academy of Agricultural Sciences, Taiyuan 030000, Shanxi, China
Received: November 20, 2017; Accepted: April 8, 2018; Published: April 18, 2018
Supported by: China Agriculture Research Systems (No. GARS-08-G10), Key Technology Research and Demonstration Project of Organic Dryland farming in Shanxi Province (No. 201703D211002-8), Funding Awards for Outstanding Doctors Volunteering to Work in Shanxi Province (No. SXYBKY201731)
Corresponding author:Xianhong Zhang. E-mail: zxh6288@sina.com
Abstract: In order to find the insect-resistant composition and differentially expressed proteins of mungbean, Jinlv No.7, B20 and Weilv 2117 were used as experimental materials, and the differential proteins and functions of mungbean varieties that are resistant and susceptible to bruchids were compared and analyzed by two dimensional gel electrophoresis (2-DE) and identified by mass spectrometry. Among the samples, 15 protein spots showed a more than 2.5 times reproducible up-regulated, significance 6 of them were successfully identified by the database, and involved three kinds of proteins. They are the alpha and beta subtype 8S globulin, ribulose-1, 5-bisphosphate carboxylase/oxygenase (RuBis CO) subunits binding protein and the precursor peptide chains for amylase inhibitor and trypsin inhibitor. The protein expressions of B49 (alpha subtype 8S globulin) and B31 (RuBis CO subunits binding protein) of insect-resistant mungbean were 10 000 and 23 times higher than that of insect-susceptible mungbeans. It stunted the growth and even death of the Callosobruchus chinensis L. that alpha and beta subtype 8S globulin and RuBis CO subunits binding protein and precursor peptide chains for amylase inhibitor and trypsin inhibitor of insect-resistant mungbean, the bruchid resistance effect of these three proteins need to further verified in terms of the quantity and the combined effect.
Key words: insect-resistant mungbean insect-susceptible mungbean two-dimensional electrophoresis differential expressed proteins
绿豆象Callosobruchus chinensis L.,属鞘翅目(Bruchidae)豆象科(Coleoptera)。主要危害绿豆Vigna radiata、豌豆Pisum sativum、豇豆Vigna unguiculata、红小豆Vigna angularis等食用豆类,尤对绿豆危害最为严重[1]。植物在长期进化过程中形成了一定的抗虫机制,目前已知参与抗虫防御体系的物质主要有氰化物、生物碱、萜烯和蛋白质[2-3]。Sugawara等曾从完全抗豆象的绿豆野生种TC1966中分离出2种环肽生物碱,认为它们与抗豆象有关[4],但后来Kaga等否认了环肽生物碱抗豆象的观点[5];Kaga等从TC1966中分离出一种对豆象有毒性的肽化合物“GIF-5”;Lin等发现一种富含半胱氨酸的VRCRP (Vigna radiata cysteine rich protein)蛋白,该蛋白对绿豆象幼虫有致死作用[6]。
蛋白质组学及其技术已成为蛋白质组功能和应用研究的基本手段。其中,聚丙烯酰胺凝胶双向电泳(Two-dimensional polyacrylamide gel electrophoresis,2-DE)以其在同一块胶上可同时分离数千甚至上万种蛋白的优势,在蛋白质组学研究中一直处于核心地位[7];肽质量指纹图谱是近年来采用基质辅助激光解吸电离飞行时间质谱测量法(Matrix-assistedlaser desorption ionization time of flight mass spectrometry,MALDI-TOF MS)发展起来的新型技术,其优点是操作简便、灵敏度高、与很多蛋白分离方法相匹配,运用这两大技术可研究不同时空领域发挥功能的蛋白质组。因此,这些蛋白质组学技术已成为对差异蛋白质进行比较和鉴定的主要方法。
前期研究表明,绿豆晋绿7号和B20对绿豆象具有高抗性[8],这些抗虫绿豆是否是由于某些特殊蛋白而对绿豆象具有抗性作用目前还未见报道。为初步了解抗虫绿豆抗绿豆象的生理生化机制,选取对绿豆象抗性有显著差异的3个绿豆品种作为研究对象,采用2-DE比较分析抗、感绿豆象绿豆种子中的差异蛋白,并结合MALDI-TOF MS技术和蛋白质数据库检索,进行抗、感绿豆象绿豆种子中差异蛋白的研究,以期为明确抗虫绿豆的抗虫成分提供理论依据。
1 材料与方法1.1 材料1.1.1 供试绿豆绿豆品种晋绿7号(92%抗虫)、B20(100%抗虫)、潍绿2117 (100%感虫)由山西省农业科学院作物研究所提供。
1.1.2 主要试剂及仪器蛋白酶抑制剂PMSF为Amresco公司产品;十二烷基磺酸钠、三氟乙酸、胰酶为Promega公司产品;低熔点琼脂糖、胶条覆盖油为Usb产品。真空干燥机(上海一恒科学仪器有限公司DZF-6020)、扫描仪(MICROTEK ScanMaker i800)、电泳槽(GE ETTAN DALTsix)、分光光度计(上海沛欧318C+)、冷冻离心机(湘仪H5050R)、超声仪(宁波新芝生物科技股份有限公司Ningbo Scientz Biotechnology Co., LTD JY96-Ⅱn)、等电聚焦仪(GE ETTAN IPGPHOR3)、Autoflex speedTM MALDI-TOF-TOF质谱仪(德国布鲁克Bruker Dalton)。
1.2 方法1.2.1 绿豆蛋白样品制备将绿豆研成粉末后,加入含等体积Tris饱和酚蛋白的提取液,振荡离心后,取上清,再加醋酸铵甲醇溶液振荡,取沉淀–20 ℃过夜,次日离心并弃上清,用甲醇和丙酮分别洗涤沉淀,将沉淀室温干燥即得蛋白质团块,–80 ℃保存备用。
1.2.2 一向等点聚焦蛋白溶解后,Bradford法定量测定蛋白[9],依定量所得数据取相应量的蛋白质,分析胶(银染)和质谱胶(考染)的上样量分别为120 μg和1 200 μg。干胶条室温20 ℃泡胀12 h后记录胶条号码。一向等电聚焦,程序为:S1 stp 500 V 1 h,S2 grd 1 000 V 1 h,S3 grd 8 000 V 3 h,S4 stp 8 000 V 5.36 h,整个聚焦过程中所用总电压约为60 kVh。等电聚焦完成后,置于平衡管,于–70 ℃保存胶条。
1.2.3 二向SDS-PAGE灌胶器装好并调节水平后,加入12.5% SDS-PAGE凝胶液,用饱和正丁醇压平液面,凝固过夜。各平衡管加平衡液平衡2次后,进行二向电泳,程序为:S1 2 W/gel 60 min,S2 17 W/gel直到溴酚蓝迁移至凝胶底部。每个样品重复3次,凝胶采用银染和考染法染色。
1.2.4 图像采集与分析凝胶采用256灰阶透视扫描模式,于分辨率为200 dpi的扫描仪上扫描后,使用ImageMaster 2D platinum 5.0 (GE)软件对凝胶进行分析。
1.2.5 质谱鉴定将差异蛋白点挖出,置于离心管进行胶内酶切、肽段抽提、点靶后利用Autoflex speedTM MALDI-TOF-TOF质谱仪进行质谱分析,flexAnalysis软件(Bruker Dalton)过滤基线峰、识别信号峰,并采用BioTools (Bruker Dalton)软件搜索NCBI数据库获得蛋白质相关信息。
2 结果与分析2.1 抗、感绿豆种子总蛋白的双向电泳分离图谱预实验中,采用pH 3–10的IPG胶条对感虫绿豆潍绿2117进行双向电泳(图 1),结果显示,绿豆蛋白主要分布在pH 4–7范围内,因此,为提高双向电泳图谱的分辨率,选用pH 4–7的IPG胶条对抗、感绿豆进行双向电泳。经多次实验,构建了分辨率高、重复性较好的抗虫绿豆(晋绿7号、B20)和感虫绿豆(潍绿2117)的蛋白质二维电泳图谱(图 2)。由图 2可知,供试绿豆的蛋白质在2个方向都得到较好的分离,且较低含量的蛋白也能清晰显现出来。
 |
| 图 1 感虫绿豆潍绿2117种子蛋白质的2-DE图谱 Figure 1 2-DE maps of seed proteins from susceptible mungbean Weilv 2117 to bruchids. |
| 图选项 |
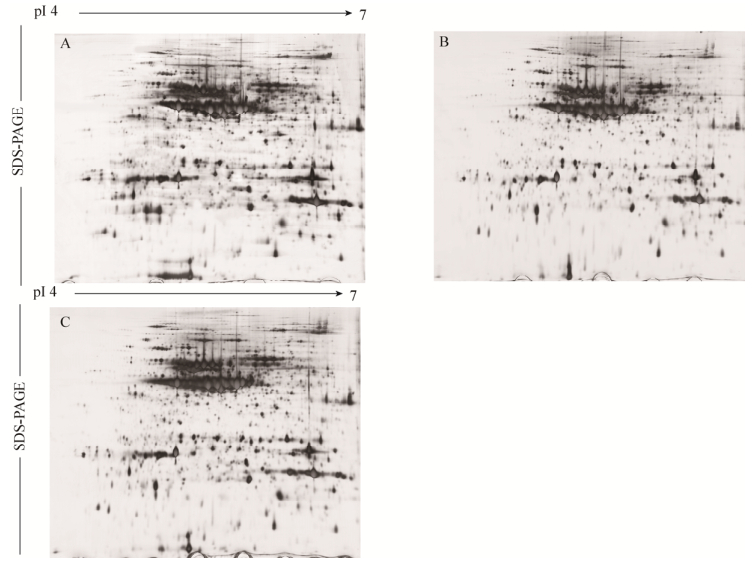 |
| 图 2 抗虫绿豆与感虫绿豆种子蛋白的2-DE图谱(第一向用pH4–7的胶条等电聚焦,第二向采用12.5%的SDS-PAGE进行分离,A、B、C分别代表潍绿2117号、晋绿7号、B20) Figure 2 2-DE maps of seed proteins from resistance and susceptible mungbean to bruchids. The first dimension was run using a pH gradient from 4 to 7, and the second dimension was a 12.5% SDS-PAGE. A, B and C corresponding to Weilv 2117, Jinlv No. 7, B20. |
| 图选项 |
2.2 抗、感绿豆差异蛋白点的质谱鉴定与分析对抗、感3组绿豆的2-DE图谱(图 2)进行ImageMaster 2D platinum 5.0 (GE)软件凝胶自动匹配和蛋白点差异筛选,结果显示,2个抗虫绿豆品种晋绿7号和B20蛋白表达量都上调的蛋白点共有28个,表达量上调2.5倍以上的共15个蛋白点,其中,达到10 000倍的有2个,分别为B47和B49,其余各点仅表现为量的差异(图 3) (每个蛋白点的量是指构成这个点的所有像素强度值的总和)。
 |
| 图 3 抗、感绿豆种子差异蛋白点(箭头所指为差异蛋白点) Figure 3 Principal differentiated protein spots from insect-resistant and insect-susceptible mungbean. The differentiated spots are marked by arrows. |
| 图选项 |
对15个差异蛋白点经切胶后挖点、脱色、还原及进一步的烷基化回收,并用胰蛋白酶酶解,抽提酶解肽段进行萃取和ZipTip脱盐处理,并利用MALDI-TOF MS质谱对获得的蛋白进行肽质量指纹图谱鉴定分析。通过UniProt数据库鉴定,抗虫品种蛋白表达量为感虫品种10 000倍的2个蛋白斑点中只有B49得到成功鉴定,为8S球蛋白;超过2.5倍被成功鉴定出共5个蛋白点,分别为B13、B31、B34、B41和B56 (表 1)。其中,B13、B49和B56属同一种蛋白质,均为8S球蛋白α亚型,B56和B49具有相同的等电点和分子量,而B13与它们只是等电点相同而分子量不同;B34为8S球蛋白β亚型,与前3个蛋白点的等电点和分子量均不相同;蛋白点B31为1, 5-二磷酸羧化酶/加氧酶亚基结合蛋白,作为陪伴蛋白帮助RuBis CO在体内正确折叠组装;B41为合成淀粉酶抑制剂和胰蛋白酶抑制剂的前体多肽链。还有2个分子量相同而等电点不同的未知蛋白(B20、B21),另外7个蛋白点(B58、B48、B47、B38、B25、B12、B39)在UniProt数据库中没有得到验证。
表 1 抗、感绿豆种子差异蛋白点的鉴定结果Table 1 Identification of differentially expressed protein spots from insect-resistant and insect-susceptible mungbean
| Spot number | Accession number | Protein name | Mr/pI | Sequence coverage (%) | Score | Function |
| B13 | Q198W5_VIGRA | Alpha subtype 8S globulin protein | 5.85/51 944 | 36 | 103 | Nutrient storage |
| B20 | V7BRF6_PHAVU | Uncharacterized protein | 5.20/65 239 | 25 | 133 | |
| B21 | V7BRF6_PHAVU | Uncharacterized protein | 5.56/65 239 | 31 | 172 | |
| B31 | G3E7M5_SOYBN | RuBis CO subunits binding protein | 5.12/61 804 | 22 | 108 | Chaperonin |
| B34 | Q198W3_VIGRA | Beta subtype 8S globulin protein | 6.49/51 751 | 43 | 66 | Nutrient storage |
| B49 | Q198W4_VIGRA | Alpha subtype 8S globulin protein | 5.58/51 599 | 13 | 80 | Nutrient storage |
| B56 | Q198W4_VIGRA | Alpha subtype 8S globulin protein | 5.58/51 599 | 29 | 241 | Nutrient storage |
| B41 | P16159 | Precursor peptide chains for | 5.38/16 122 | 31 | 68 | Compound amylase inhibitor and trypsin inhibitor |
表选项
3 讨论目前,双向电泳和质谱技术已成为生物学领域对细胞或组织内蛋白质进行分离和鉴定的核心技术。本研究采用双向电泳和质谱技术,结合UniProt蛋白质数据库,成功鉴定出抗、感虫绿豆的15个差异蛋白点,其中抗虫绿豆与感虫绿豆蛋白表达差异为10 000倍的蛋白点有2个,分别为α亚型8S球蛋白和未知蛋白;抗虫绿豆与感虫绿豆蛋白表达差异为23倍的蛋白点有1个,是核酮糖1, 5-二磷酸羧化酶/加氧酶(RuBis CO)亚基结合蛋白。
据报道,8S球蛋白α亚型与大豆β伴大豆球蛋白约有61%的序列一致性,与大豆β伴大豆球蛋白β肽链序列有71.4%的一致性[10-11]。大豆抗原中的主要致敏因子β伴大豆球蛋白可导致饲料中的蛋白质利用率降低,而不利于畜禽的生长发育,尤其是对于低龄动物,因其肠道发育不成熟,严重者会引起小肠绒毛脱落[12]。在本研究中,抗虫绿豆品种中4个8S球蛋白α亚型及β亚型的表达量均为感虫绿豆2.5倍以上,其中一个8S球蛋白α亚型蛋白点达10 000倍,推测抗虫绿豆中8S球蛋白α亚型及β亚型可能与大豆β伴大豆球蛋白有同样的作用,影响到绿豆象对蛋白的吸收利用,尤其是在卵发育为幼虫初期,严重影响了幼虫对营养的正常吸收,从而阻碍了绿豆象的正常生长发育。我们的前期实验表明,当绿豆象取食抗虫绿豆后,绿豆种子内存在大量低龄死亡幼虫,且成虫羽化率显著下降[13],推测可能与这些抗虫品种中含有较多的抗虫性8S球蛋白有关。
核酮糖1, 5-二磷酸羧化酶/加氧酶伴侣蛋白(RuBis CO), 即分子伴侣60 (Cpn60),也能作为细胞表面受体与各种配体和细菌作用,作为毒素发挥作用[14-17]。据报道,昆虫体内的RuBis CO伴侣蛋白与细菌的生长繁殖密切相关[18-20]。在本试实中,抗虫绿豆RuBis CO伴侣蛋白表达量是感虫绿豆的23倍,当绿豆象取食抗虫绿豆后其体内RuBis CO伴侣蛋白增多,是促进了绿豆象体内细菌的繁殖,或与其他配体结合形成毒素导致绿豆象发育受阻甚至死亡,还有待进一步验证,核酮糖1, 5-二磷酸羧化酶/加氧酶伴侣蛋白与绿豆象的互作机制还有待进一步研究。
胰蛋白酶抑制剂(Trypsin inhibitor,TI)是一类具有抑制胰蛋白酶活性的多肽或蛋白质,也是参与抗虫防御体系中最重要的蛋白质之一[21]。据报道,豇豆籽粒内所含的胰蛋白酶抑制剂对四纹豆象生长发育有很好的阻滞作用,且对其他鳞翅目和部分鞘翅目害虫如玉米根甲Diabrotica undocinpunctata、棉铃象甲Anthonomus grandis、杂拟谷盗Tribolium confusum等也有抑制作用[22]。Bowman-Birk型胰蛋白酶抑制剂(BBI)可抑制甜菜夜蛾Spodoperaexigua幼虫肠道内的胰蛋白酶活性,使幼虫体重变轻、发育历期延长[23]。BBI对棉铃虫Helicoverpa armigera Hubner的抗营养效应在于它激活和抑制了棉铃虫体内的蛋白酶活性,导致其体内蛋白酶之间的相互协调性遭到破坏,使进入中肠的蛋白质不能有效消化吸收,从而使昆虫的正常生长发育受阻[24],据报道,绿豆胰蛋白酶抑制剂Lys片段活性中心序列在体外成功地合成了对furin蛋白有强抑制活力的16肽[25],表明胰蛋白酶抑制剂的前体加工酶的前体肽具有特异性抑制剂的功能。本研究中,抗虫绿豆合成胰蛋白酶抑制剂的前体物质含量显著高于感虫绿豆,其抗虫作用可能是这些前体物质本身或其在绿豆象体内合成蛋白酶抑制剂抑制了绿豆象体内的蛋白酶活性,从而使绿豆象的生长发育受到影响。
综上所述,在抗、感虫绿豆中差异较大的蛋白点8S球蛋白α和β亚型、RuBis CO伴侣蛋白及胰蛋白酶抑制剂的前体,在抗虫绿豆中存在的作用可能是作为抗虫物质中一种单独作用或几种物质联合作用,影响了绿豆象的生长发育甚至导致死亡,这些差异蛋白与抗虫性的量效关系及联合效应还需要进一步验证。
参考文献
| [1] | Wang Y, Talekar NS, Chen B, et al. Study on the influence of legume varieties on the growth and oviposition preference of Callosobruchus chinensis (L.).J Yunnan Agric Univ, 2010, 25(1): 34–39.(in Chinese). 王燕, TalekarNS, 陈斌, 等. 绿豆象在不同豆类上的生长发育及产卵选择性研究.云南农业大学学报, 2010, 25(1): 34-39. |
| [2] | Wang XF, Gao WQ, Liu JF, et al. Plant defensive strategies and environment-driven mechanisms.Chin J Ecol, 2015, 34(12): 3542–3552.(in Chinese). 王小菲, 高文强, 刘建锋, 等. 植物防御策略及其环境驱动机制.生态学杂志, 2015, 34(12): 3542-3552. |
| [3] | Zhang B, Liu Y, Zhang YH, et al. Research progress in regulatory mechanism and proteomics of plant induced insect resistance.Hebei J For Orch Res, 2016, 31(3): 239–244.(in Chinese). 张斌, 刘洋, 张玉贺, 等. 植物诱导抗虫性的调控机制及蛋白组学研究进展.河北林果研究, 2016, 31(3): 239-244. |
| [4] | Sugawara F, Ishimoto M, Le-Van N, et al. Insecticidal peptide from mungbean: a resistant factor against infestation with azuki bean weevil.J Agric Food Chem, 1996, 44(10): 3360–3364.DOI: 10.1021/jf960166c |
| [5] | Kaga A, Ishimoto M. Genetic localization of a bruchid resistance gene and its relationship to insecticidal cyclopeptide alkaloids, the vignatic acids, in mungbean (Vigna radiata L.Wilczek).Mol Gen Genet, 1998, 258(4): 378–384.DOI: 10.1007/s004380050744 |
| [6] | Lin C, Chen CS, Horng SB. Characterization of resistance to Callosobruchus maculatus (Coleoptera: Bruchidae) in mungbean variety VC6089A and its resistance-associated protein VrD1.J Econ Entomol, 2005, 98(4): 1369–1373.DOI: 10.1603/0022-0493-98.4.1369 |
| [7] | Abbott A. A post-genomic challenge: learning to read patterns of protein synthesis.Nature, 1999, 402(6763): 715–720. |
| [8] | Zhu HJ, Zhao XY, Yan HB, et al. Breeding of bruchid resistant mung bean variety Jinlyudou 7.J Shanxi Agric Sci, 2012, 40(6): 606–607, 612.(in Chinese). 朱慧珺, 赵雪英, 阎虎斌, 等. 抗豆象绿豆新品种晋绿豆7号的选育.山西农业科学, 2012, 40(6): 606-607, 612. |
| [9] | Bradford MM. A rapid and sensitive method for the quantitation of microgram quantities of protein utilizing the principle of protein-dye binding.Anal Biochem, 1976, 72(1/2): 248–254. |
| [10] | Bernardo AEN, Garcia RN, Adachi M, et al. [Vigna radiate (L.) Wilczek]: cloning and characterization of its cDNA isoforms, expression in Escherichia coli, purification, and crystallization of the major recombinant 8S isoform.J Agric Food Chem, 2004, 52(9): 2552–2560.DOI: 10.1021/jf0305938 |
| [11] | Liu H, Kang YF. Research progress on globulins of edible legumes.Cer Oil, 2013, 26(5): 5–8.(in Chinese). 刘红, 康玉凡. 食用豆类球蛋白研究进展.粮食与油脂, 2013, 26(5): 5-8. |
| [12] | Wang JX, Qin GX, Long GH, et al. Stability and immunoreactivity of β-conglycinin to hydrolysis in vitro.Chin J Anim Sci, 2014, 50(9): 45–49.(in Chinese). 王锦欣, 秦贵信, 龙国徽, 等. Β-伴大豆球蛋白酶解物的抗消化性及免疫活性变化的研究.中国畜牧杂志, 2014, 50(9): 45-49. |
| [13] | Cheng XF, Zhang YW, Zhang XH. Effects of insect-resistant mung bean on development and activities of several enzymes of Chinese bean weevil Callosobruchus chinensis L. (Coleoptera: Bruchidae).J Plant Protect, 2017, 44(3): 420–426.(in Chinese). 成小芳, 张耀文, 张仙红. 抗虫绿豆对绿豆象生长发育及体内几种酶活性的影响.植物保护学报, 2017, 44(3): 420-426. |
| [14] | Yong ZH. In vitor reassembly of ribulose-1, 5- bisphosphate carboxylase/oxygenase and the function of chaperone[D]. Beijing: Chinese Academy of Sciences, 2007 (in Chinese). 勇振华. 核酮糖-1, 5-二磷酸羧化酶/加氧酶的体外重组及分子陪伴蛋白的功能[D]. 北京: 中国科学院, 2007. |
| [15] | Ashida H, Danchin A, Yokota A. Was photosynthetic RuBisCO recruited by acquisitive evolution from RuBisCO-like proteins involved in sulfur metabolism?.Res Microbiol, 2005, 156(5/6): 611–618. |
| [16] | Chen HM, Chen Y, Wang D, et al. The role of ribulose-1, 5-bisphosphate carboxylase/oxygenase activase in resistance of plant to abiotic stresses.Plant Physiol J, 2016, 52(11): 1637–1648.(in Chinese). 陈候鸣, 陈跃, 王盾, 等. 核酮糖-1, 5-二磷酸羧化酶/加氧酶活化酶在植物抗逆性中的作用.植物生理学, 2016, 52(11): 1637-1648. |
| [17] | Zhou L. Study on agronomic traits and resistance to salt of rice lines over-expressed chloroplast Chaperonin 60[D]. Hangzhou: Zhejiang University, 2015 (in Chinese). 周丽. 水稻叶绿体伴侣蛋白Cpn60超表达株系农艺性状和抗盐性研究[D]. 杭州: 浙江大学, 2015. |
| [18] | Henderson B, Fares MA, Lund PA. Chaperonin 60: a paradoxical, evolutionarily conserved protein family with multiple moonlighting functions.Biol Rev, 2013, 88(4): 955–987.DOI: 10.1111/brv.12037 |
| [19] | Horwich AL, Apetri AC, Fenton WA. The GroEL/GroES cis cavity as a passive anti-aggregation device.FEBS Lett, 2009, 583(16): 2654–2662.DOI: 10.1016/j.febslet.2009.06.049 |
| [20] | Sakamoto M, Ohkuma M. Usefulness of the hsp60 gene for the identification and classification of Gram-negative anaerobic rods.J Med Microbiol, 2010, 59(11): 1293–1302.DOI: 10.1099/jmm.0.020420-0 |
| [21] | Ruan JJ, Yan J, Han XY, et al. Extraction of trypsin inhibitor from walnut seeds by reverse micelle and study on anti-insect.J Environ Entomol, 2016, 38(2): 418–423.(in Chinese). 阮景军, 严俊, 韩学易, 等. 反胶束法萃取核桃胰蛋白酶抑制剂及其抗虫研究.环境昆虫学报, 2016, 38(2): 418-423. |
| [22] | Xu HL, Zhai HL, Wang F, et al. Cowpea trypsin inhibitor gene (cpti) and its application in insect resistance transgenic plants.J Agric Sci Technol, 2008, 10(1): 18–27.(in Chinese). 徐鸿林, 翟红利, 王锋, 等. 豇豆胰蛋白酶抑制剂基因(cpti)及其在抗虫转基因作物中的应用.中国农业科技导报, 2008, 10(1): 18-27. |
| [23] | Broadway RM, Duffey SS. Plant proteinase inhibitors: mechanism of action and effect on the growth and digestive physiology of larval Heliothis zea and Spodoptera-exiqua.J Insect Physiol, 1986, 32(10): 827–833.DOI: 10.1016/0022-1910(86)90097-1 |
| [24] | Wang CL, Zhang YZ, Sun ZG. Progress on the research of Bowman-Birk soybean trypsin inhibitor.Soybean Sci, 2007, 26(5): 757–761.(in Chinese). 王长良, 张永忠, 孙志刚. Bowman-Birk型大豆胰蛋白酶抑制剂研究进展.大豆科学, 2007, 26(5): 757-761. |
| [25] | Qi RF. The gene cloning and expression of mung bean trypsin inhibitor[D]. Lanzhou: Northwest Normal University, 2005 (in Chinese). 祁瑞峰. 绿豆胰蛋白酶抑制剂的基因克隆及其表达[D]. 兰州: 西北师范大学, 2005. |
