

武汉科技大学 生命科学与健康学院,湖北 武汉 430065
收稿日期:2017-09-21;接收日期:2017-12-27; 网络出版时间:2018-01-10 基金项目:国家自然科学基金(No. 31371385)资助
摘要:本研究旨在人绒毛膜促性腺激素(hCG)的结合多肽的基础上应用嫁接抗体技术制备抗hCG单域抗体,简化单域抗体制备过程,提高多肽生化稳定性。利用单域抗体通用骨架(cAbBCII10),以hCG结合多肽取代互补决定区CDR1或CDR3,合成cAbBCII10嫁接抗体全基因序列并与sfGFP基因序列融合后,插入到带有His标签的原核表达载体pET30a(+)中,成功构建了pET30a-(His6)-cAbBCII10-CDR1/hCGBP1-sfGFP与pET30a-(His6)-cAbBCII10-CDR3/hCGBP3-sfGFP融合蛋白表达质粒。将重组质粒转化大肠杆菌BL21 (DE3),用IPTG诱导表达融合蛋白,得到高表达量的可溶性融合蛋白。利用Ni-NTA亲和柱纯化得到纯蛋白,应用SDS-PAGE鉴定纯化的蛋白为正确表达的目标蛋白。通过抗原抗体结合实验,发现hCG结合多肽嫁接到单域抗体通用骨架的互补决定区CDR1或CDR3后都有抗原结合活性,具有相似的抗体滴度,且嫁接到CDR3后的抗原结合活性比CDR1要高(2–3倍)。嫁接抗体基本保留了所用单域抗体框架较为稳定的生化特性,具有一定的热稳定性和较好的碱耐受性,同时,所接入的hCG结合片段对hCG具有较特异的结合活性,为进一步优化抗原结合多肽嫁接抗体技术制备抗hCG单域抗体提供了可靠的实验基础。
关键词:hCG 单域抗体 嫁接抗体 CDR1 CDR3 融合蛋白 表达纯化
Preparation of anti-hCG single domain antibody by antibody grafting technique using an antigen-binding peptide
Jing Peng, Qiong Wang, Xiaoling Cheng, Mengwen Liu, Mei Wang, Huawei Xin


College of Life Science and Health, Wuhan University of Science and Technology, Wuhan 430065, Hubei, China
Received: September 21, 2017; Accepted: December 27, 2017; Published: January 10, 2018
Supported by: National Natural Science Foundation of China (No. 31371385)
Corresponding author:Huawei Xin. Tel: +86-27-68893368; E-mail: xinhuawei@wust.edu.cn
Abstract: We used the antibody grafting technology to prepare anti-hCG single-domain antibodies on the basis of antigen-binding peptide to simplify the single-domain antibody preparation process and improving the biochemical stability of peptide. By using a universal single-domain antibody backbone (cAbBCII10), CDR1 or CDR3 was replaced by the hCG-binding peptide, and the grafted antibody gene sequences were synthesized and cloned into the prokaryotic expression vector pET30a(+) in fusion with a C-terminal sfGFP gene, i.e. pET30a-(His6)-cAbBCII10-CDR1/hCGBP1-sfGFP and pET30a-(His6)-cAbBCII10-CDR3/hCGBP3-sfGFP. The recombinant plasmids were transformed into E. coli BL21(DE3), and the fusion proteins were induced by IPTG. Highly soluble recombinant fusion proteins were obtained and purified by Ni-NTA affinity column. SDS-PAGE confirmed the purified protein as the target protein. The antigen-antibody binding assay showed that both the CDR1 and CDR3 grafted antibodies have hCG-binding activities. While the titers of the two grafted antibodies were similar, the binding affinity of CDR3 grafted antibody was higher than that of CDR1 grafted protein (about 2–3 times). The grafted antibodies retained the relatively high biochemical stability of the single-domain antibody backbone and were relatively thermostable and alkaline tolerant. The obtained antibodies also had a relatively high antigen-binding specificity to hCG. This study provided a reliable experimental basis for further optimization of anti-hCG single domain antibody by antibody grafting technology using antigen-binding peptide.
Key words: hCG single domain antibody grafted antibody CDR1 CDR3 fusion protein expression and purification
单域抗体是由天然缺乏轻链的重链抗体改造而来的一类小型化抗体,具有结构简单、分子量小、易于异源表达、同时与抗原结合的特异性和亲和力高等优点[1-3]。近年来单域抗体在生物工程技术领域受到人们的重视,其应用在逐渐推广。经典的单域抗体制备过程包括应用驼科动物等可天然产生重链抗体的动物作为免疫宿主、通过抗原免疫、然后进行抗体基因库构建、特异抗体筛选和克隆、大肠杆菌等异源表达等步骤[4-5]。改进的方案包括利用非免疫动物来源的抗体基因库或半合成、全合成抗体基因库进行抗原靶标的抗体筛选[6-7]。这两种方法均存在步骤繁琐、费时费力等缺点。
hCG分子是人妊娠过程中产生的重要的标志性激素分子,在某些肿瘤中也发现存在过表达[8-9]。其蛋白结构已经通过晶体结构解析等方法得到较深入的了解。应用单域抗体技术制备hCG单域抗体的工作也开始有人进行尝试[10]。本研究结合过去人们在hCG结合多肽筛选工作和对单域抗体的通用骨架的选择、测试工作的成果基础上[11-12],尝试将hCG结合多肽嫁接到单域抗体通用骨架的互补决定区CDR1或CDR3,测试改造后的单域抗体结合抗原的活性,为建立结合多肽嫁接抗体技术制备抗原特异单域抗体的方法提供实验支持。
1 材料与方法1.1 材料pET30a(+)质粒、pET30a(+)-sfGFP质粒、DP-GFP (一种GFP结合蛋白,本实验室制备)、LHB (促黄体生成素β亚基)+hCG-α转染293T细胞分泌上清、大肠杆菌BL21 (DE3)均为本实验室保存。Taq酶、各种限制性内切酶购自TaKaRa公司。质粒提取试剂盒、胶回收试剂盒、PCR Clean up试剂盒购自Axygen公司。Ni-NTA亲和柱购自生工生物工程(上海)股份有限公司。IPTG、考马斯亮蓝R-250购自AMRESCO公司。T4 DNA连接酶、蛋白marker购自Thermo Scientific公司。DNA marker购自东盛生物公司。基因合成由杭州金唯智公司完成。DNA测序由武汉擎科有限公司完成。BCA蛋白含量检测试剂盒购自碧云天。JEG-3细胞购于武汉普诺赛生命科技有限公司。酶标板购自BIOFIL公司。小牛血清购自四季青公司。SpectraMax i3x多功能酶标仪购自Molecular Devices。
1.2 质粒的构建全基因合成anti-hCG-α基因片段[13],在其上、下游分别引入BamH Ⅰ和Hind Ⅲ酶切位点,将其与pET30a(+)质粒均用BamH Ⅰ和Hind Ⅲ进行双酶切,然后用T4 DNA连接酶将酶切后经胶回收纯化的anti-hCG-α和pET30a(+) DNA于22 ℃连接2 h,转化大肠杆菌BL21(DE3)。挑取单菌落培养后提取质粒进行BamH Ⅰ和Hind Ⅲ双酶切鉴定,并将双酶切鉴定正确的阳性克隆进行DNA测序鉴定。
全基因合成cAbBCII10-CDR1/hCGBP1、cAbBCII10-CDR3/hCGBP3的基因片段[14-15],在其上、下游分别引入BamH Ⅰ和Sal Ⅰ酶切位点,将其与pET30a-sfGFP质粒均用BamH Ⅰ和Sal Ⅰ进行双酶切,然后用T4 DNA连接酶将酶切后经胶回收纯化的cAbBCII10-CDR1/hCGBP1、cAbBCII10-CDR3/ hCGBP3和pET30a-sfGFP于22 ℃连接2 h,转化大肠杆菌BL21(DE3)挑取单菌落培养后提取质粒进行BamH Ⅰ和Sal Ⅰ与BamH Ⅰ和Hind Ⅲ两种双酶切鉴定,并将双酶切鉴定正确的阳性克隆进行DNA测序鉴定。
1.3 抗体融合蛋白的诱导表达将DNA测序正确的阳性克隆菌于37 ℃培养至OD600为0.6?0.8时,加入IPTG至终浓度为0.25 mmol/L,诱导上述3种融合蛋白表达。取诱导后的菌液,10 000 r/min离心2 min,弃上清收集菌体沉淀,一部分菌体直接加入SDS-PAGE电泳样品处理液,用于检测全菌蛋白;另一部分加入9倍体积的缓冲液Buffer H (20 mmol/L Tris-HCl,pH 8.0,1 mol/L NaCl,10%甘油,10 mmol/L β-巯基乙醇,30 mmol/L咪唑)冰浴超声破碎30 min,然后10 000 r/min离心20 min,取上清和沉淀进行电泳检测。用12% SDS-PAGE和考马斯亮蓝染色检测菌体全蛋白与超声破碎上清和沉淀中的融合蛋白。
1.4 抗体融合蛋白的纯化与鉴定在最佳诱导条件下(16 ℃,120 r/min)诱导融合蛋白的表达。收集诱导后菌体超声破碎的上清液,利用Ni-NTA亲和柱,按照产品说明书进行纯化。分别收集亲和柱穿透峰和洗脱峰,进行12%的SDS-PAGE。然后收集洗脱峰透析去除咪唑。
1.5 抗体融合蛋白浓度的测定取1.2 mL蛋白标准配制液加入到一管蛋白标准(30 mg BSA)中,充分溶解后配制成25 mg/mL的蛋白标准溶液。取20 μL 25 mg/mL蛋白标准加入980 μL稀释液即可配制成0.5 mg/mL蛋白标准。PBS稀释标准品。根据样品数量和标准曲线所用孔数12个,按50体积BCA试剂A加1体积BCA试剂B (50:1)配制适量BCA工作液,充分混匀。将标准品按0、1、2、4、8、12、16、20 μL加到96孔板的标准品孔中,PBS补足到20 μL。加适当体积样品到96孔板的样品孔中,加PBS到20 μL。各孔加入200 μL BCA工作液,37 ℃放置30 min后测定吸光度。
1.6 抗体融合蛋白的抗原结合活性测定包被:用PBS与含5%的小牛血清配置成包被缓冲液,用PBS包被缓冲液将anti-hCG-α稀释至蛋白质含量为1 μg/mL。在每个聚苯乙烯板的反应孔中加0.1 mL,4 ℃过夜。次日,弃去孔内溶液,用PBS洗涤缓冲液洗3次,每次3 min (简称洗涤,下同)。
加样:加一定梯度稀释JEG-3细胞分泌上清0.1 mL于上述已包被之反应孔中,37 ℃孵育1 h。然后洗涤。同时空白孔作对照。
加抗体-sfGFP融合蛋白:于各反应孔中,分别加入同浓度的cAbBCII10-CDR1/hCGBP1-sfGFP和cAbBCII10-CDR3/hCGBP3-sfGFP 0.1 mL,37 ℃孵育0.5–1 h,洗涤3次。
测定GFP荧光强度:于各反应孔中,加入0.2 mL的PBS,于酶标仪上测定,激发光波长为488 nm,荧光检测波长为525 nm。
1.7 抗体融合蛋白的稳定性试验分别将cAbBCII10-CDR1/hCGBP1-sfGFP和cAbBCII10-CDR3/hCGBP3-sfGFP与足量的DP-GFP (一种GFP结合蛋白)混匀,保证GFP标签的稳定性。
取等份的上述混合物分别置于4 ℃、16 ℃、37 ℃、42 ℃、65 ℃、80 ℃的水浴中保温30 min,取出待恢复至室温。各取100 μL上清于聚苯乙烯板中,测定其荧光强度,分析抗体融合蛋白的热稳定性。
分别取等份上述混合物,用伯瑞坦-罗宾森(Britton-Robinson)广泛缓冲液调pH至4.0、5.0、6.0、7.0、8.0、9.0、10.0,4 ℃放置30 min,取出待恢复至室温。各取100 μL于聚苯乙烯板中,测定其荧光强度,分析抗体融合蛋白的酸碱稳定性。
1.8 抗体融合蛋白的滴度测定包被后,加一定相同浓度JEG-3细胞分泌上清0.1 mL于上述已包被的反应孔中,37 ℃孵育1 h,然后洗涤,同时空白孔作对照。于各反应孔中,分别加入一定稀释的cAbBCII10-CDR1/ hCGBP1-sfGFP和cAbBCII10-CDR3/hCGBP3-sfGFP 0.1mL,37 ℃孵育0.5–1 h,洗涤3次。测定GFP荧光强度。
1.9 抗体融合蛋白的抗原结合特异性测定包被后,分别加一定稀释浓度JEG-3细胞分泌上清和LHB+hCG-α转染293T细胞分泌上清0.1 mL于上述已包被的反应孔中,37 ℃孵育1 h,然后洗涤,同时空白孔作对照。加抗体-sfGFP融合蛋白。测定GFP荧光强度。
2 结果与分析2.1 原核表达载体的构建pET30a-anti-hCG-α重组子经酶切鉴定后得到两条目的带,大小约为5.3 kb和400 bp;pET30α-cAbBCII10-hCGBP1/3-sfGFP重组子经BamH Ⅰ和Sal Ⅰ酶切鉴定后得到两条目的带,大小约为6.1 kb和400 bp,pET30a-cAbBCII10-hCGBP1/3-sfGFP重组子经BamH Ⅰ和Hind Ⅲ酶切鉴定后得到两条目的带,大小约为5.3 kb和1.2 kb,分别与质粒和抗体基因及抗体融合蛋白基因片段的预期分子量一致(图 1)。将酶切鉴定正确的质粒进行DNA测序鉴定,测序结果与预期的序列一致,证明3个重组质粒构建成功。
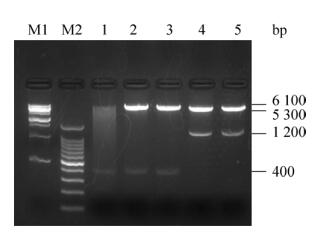 |
| 图 1 重组质粒pET30a-anti-hCG-α和pET30a-cAbBCII10-hCGBP1/3-sfGFP的构建 Figure 1 Construction of pET30a-anti-hCG-α and pET30a-cAbBCII10-hCGBP1/3-sfGFP recombinant plasmids. M1: 1 kb DNA marker; M2: 100 bp DNA marker; 1: pET30a-anti-hCG-α digested with BamH Ⅰand Hind Ⅲ; 2, 3: pET30a-cAbBCII10-hCGBP1/3-sfGFP digested with BamH Ⅰ and Sal Ⅰ; 4, 5: pET30a-cAbBCII10-hCGBP1/3-sfGFP digested with BamH Ⅰ and Hind Ⅲ. |
| 图选项 |
2.2 融合蛋白的诱导表达分析将pET30a-anti-hCG-α、pET30a-cAbBCII10-CDR1/hCGBP1-sfGFP、pET30a-cAbBCII10-CDR3/ hCGBP3-cAbBCII10-sfGFP重组质粒转化大肠杆菌BL21(DE3),在IPTG诱导前后收集细菌进行SDS-PAGE分析,结果如图 2所示。经IPTG诱导后,在3组样品中均获得了目标蛋白的高表达,并且大部分存在于细菌裂解液的上清中,为可溶性蛋白,仅有少量在沉淀中。
 |
| 图 2 anti-hCG-α和cAbBCII10-hCGBP1/3-sfGFP融合蛋白的表达 Figure 2 Expression of anti-hCG-α and cAbBCII10-hCGBP1/3-sfGFP fusion proteins. (A) Expression of anti-hCG-α usion proteins. M: protein marker; 1: before induction; 2: after induction; 3: supernatant; 4: precipitate. (B) Expression of cAbBCII10-hCGBP1-sfGFP fusion proteins. M: protein marker; 1: before induction; 2: after induction; 3: supernatant; 4: precipitate. Expression of cAbBCII10-hCGBP3-sfGFP fusion proteins. 5: before induction; 6: after induction; 7: supernatant; 8: precipitate. |
| 图选项 |
2.3 融合蛋白的纯化与鉴定pET30a-anti-hCG-α、pET30a-cAbBCII10-CDR1/ hCGBP1-sfGFP、pET30a-cAbBCII10-CDR3/hCGBP3-cAbBCII10-sfGFP大量表达菌超声破碎后,收集上清,使用Ni-NTA亲和柱纯化后,最终得到高纯度的融合蛋白,结果如图 3所示。通过计算,可知图 3中anti-hCG-α融合蛋白实际分子量约为25 kDa,蛋白理论分子量为22 kDa左右,二者基本相符;cAbBCII10-hCGBP1/3-sfGFP融合蛋白实际分子量约为54 kDa,蛋白理论分子量为55 kDa左右,二者基本相符。
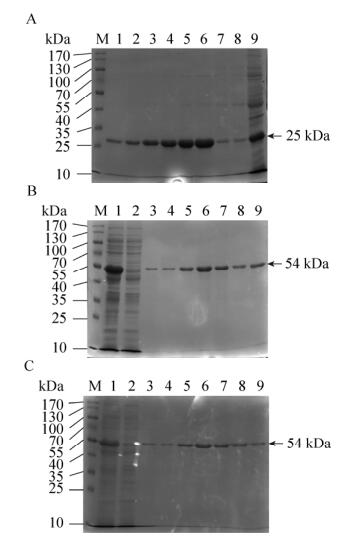 |
| 图 3 anti-hCG-α和cAbBCII10-hCGBP1/3-sfGFP融合蛋白的纯化 Figure 3 Purification of anti-hCG-a and cAbBCII10-hCGBP1/3-sfGFP fusion proteins. (A) Purification of anti-hCG-a fusion proteins. M: protein marker, 1–6: eluents of Ni-NTA affinity chromatography resin; 7–8: flow-through of Ni-NTA affinity chromatography resin; 9: total protein. M: protein marker. (B) Purification of cAbBCII10-hCGBP1-sfGFP fusion proteins. M: protein marker; 1: total protein; 2: flow-through of Ni-NTA affinity chromatography resin; 3–9: eluents of Ni-NTA affinity chromatography resin. (C) Purification of cAbBCII10-hCGBP1/3-sfGFP fusion proteins. 1: total protein; 2, 3: flow-through of Ni-NTA affinity chromatography resin; 4–9: eluent of Ni-NTA affinity chromatography resin. |
| 图选项 |
2.4 融合蛋白的浓度测定及抗体融合蛋白的抗原结合活性分析通过BSA蛋白测定法可以得出pET30a-anti-hCG-α、pET30a-cAbBCII10-CDR1/hCGBP1-sfGFP、pET30a-cAbBCII10-CDR3/hCGBP3-sfGFP三个融合蛋白的浓度分别为0.65、2.43、3.60 mg/mL。
以anti-hCG-a蛋白作为捕获抗体,以cAbBCII10-CDR1/hCGBP1-sfGFP或cAbBCII10-CDR3/hCGBP3-sfGFP为探测抗体测定与hCG的结合活性,结果如图 4所示。二者对hCG皆有一定结合活性,CDR3嫁接抗体(hCGBP3)的抗原结合活性比CDR1嫁接抗体(hCGBP1)约高2–3倍。
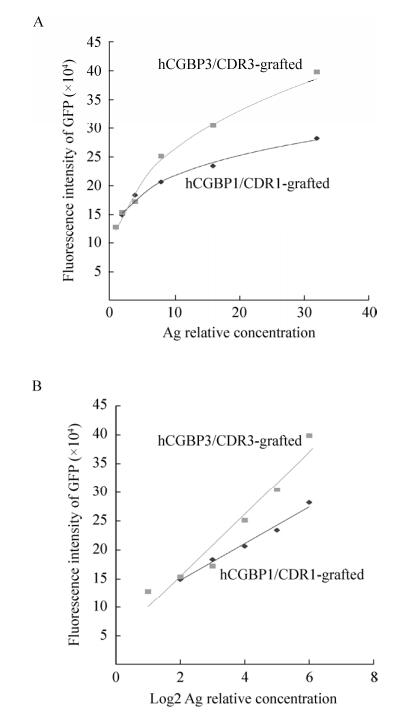 |
| 图 4 融合蛋白cAbBCII10-hCGBP1/3-sfGFP结合hCG的活性测定 Figure 4 Determination of hCG-binding affinity of cAbBCII10-hCGBP1/3-sfGFP fusion proteins. (A) HCG-binding curve against Ag relative concentration. (B) HCG-binding curve against log2 of Ag relative concentration. |
| 图选项 |
2.5 抗体融合蛋白的稳定性通过图 5A可以看出,温度对两种抗体融合蛋白cAbBCII10-hCGBP1/3-sfGFP的稳定性均有很大影响。其稳定性在42 ℃以内基本不变,在65 ℃时几乎完全丧失稳定性。
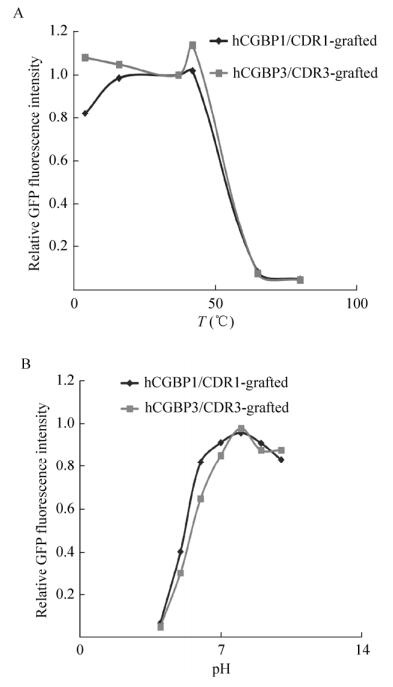 |
| 图 5 抗体融合蛋白的稳定性测定 Figure 5 Determination of the stability of cAbBCII10-hCGBP1/3-sfGFP fusion proteins. (A) Relative protein stability at different temperatures. (B) Relative protein stability at different pH. |
| 图选项 |
同样的,通过图 5B可以看出,pH对两种抗体融合蛋白cAbBCII10-hCGBP1/3-sfGFP也有很大影响。融合蛋白的稳定性在pH < 7的范围内随pH的降低而降低,在pH 4时几乎丧失稳定性,在pH 8–10的范围内稳定性只有少量下降(10%–20%)。
2.6 抗体融合蛋白的滴度以梯度稀释的cAbBCII10-CDR1/hCGBP1-sfGFP或cAbBCII10-CDR3/hCGBP3-sfGFP为探测抗体测定与hCG的结合活性,结果如图 6所示,cAbBCII10-hCGBP1/3-sfGFP这两种抗体融合蛋白的滴度约为1:15。
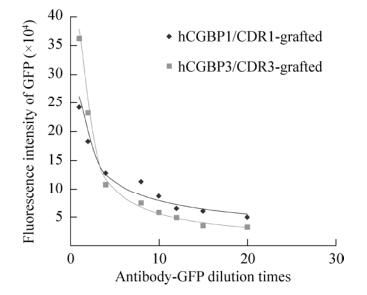 |
| 图 6 抗体融合蛋白的滴度测定 Figure 6 Determination of the titers of cAbBCII10-hCGBP1/3-sfGFP fusion proteins. |
| 图选项 |
2.7 抗体融合蛋白的抗原结合特异性以JEG-3培养细胞上清液或LHB+hCG-α转染的293T细胞上清液作为抗原,以cAbBCII10-CDR1/ hCGBP1-sfGFP或cAbBCII10-CDR3/hCGBP3-sfGFP为探测抗体,测定、比较对两种相似抗原(hCG和LH)的结合特异性,结果如图 7所示,两种抗体融合蛋白对hCG和结合活性都高于对LH的结合活性,对LH有一定的交叉结合活性;cAbBCII10-CDR3/hCGBP3-sfGFP对hCG的结合特异性较高。
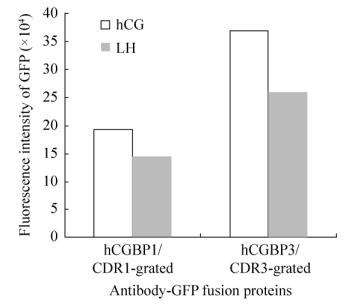 |
| 图 7 抗体融合蛋白的抗原结合特异性测定 Figure 7 Determination of antigen-binding specificity of cAbBCII10-hCGBP1/3-sfGFP fusion proteins. Binding affinities of cAbBCII10-hCGBP1/3-sfGFP fusion proteins to hCG and LH were compared. |
| 图选项 |
3 讨论应用单域抗体骨架、抗原结合肽取代CDR可变区的方法制备新嫁接抗体的技术是一种改善结合多肽的生化性能的重要手段。近年来已有相关的研究报道,嫁接后的抗体分子比游离多肽具有更好的生化稳定性,可胜任多种细胞内外应用[16-17]。单域抗体骨架具有结构简单、CDR区易于进行改造操作的优点,作为嫁接抗体的骨架逐渐受到人们的重视。在本研究中,我们应用单域抗体的一个通用骨架cAbBCII10[15],通过将hCG分子的结合多肽嫁接到CDR1或CDR3区,检测其对抗原分子的结合活性,获得了具有一定亲和力的CDR1或CDR3嫁接抗体形式,其中,CDR3比CDR1嫁接抗体结合抗原的效果好。
CDR3通常是抗体分子结合抗原的主要决定区域,因此被作为人工改造抗体的首选区域。如有文献报道,通过CDR3区随机化,筛选获得了可结合重要医药靶标的抗体分子[11];Inoue等通过类似筛选方法获得了针对不同抗原的CDR3改造抗体分子[18],本研究也显示CDR3嫁接抗体的抗原结合活性强。但是也有少数例外的情况,如Hattori等在用无机分子的结合多肽制备的嫁接抗体时,发现CDR3嫁接抗体不能结合抗原分子,而CDR1嫁接抗体具有很高的抗原结合活性,推测是由于多肽链的构象不适当所致[16]。
嫁接到抗体CDR区的多肽的构象与游离多肽相比通常会发生改变,由于抗体骨架的刚性限制,嫁接多肽的空间活动受到限制,从而使其在某一构象或动态构象区域活动,这可能会增强或减弱其对抗原的识别与结合[19]。我们注意到cAbBCII10通用骨架的CDR1区的周边有较多的GGS序列,可能会赋予CDR1多肽更大的活动空间;而CDR3可能受到更多的限制从而获得更加稳定的构象。哪一个更适合多肽结合抗原,应视结合多肽空间构象是否与抗原表面更加契合决定。
我们所采用的通用骨架的CDR2区域对于抗体分子的骨架稳定性起着重要作用,已有实验显示,如将CDR2区的氨基酸残基改变后,其蛋白质的稳定性下降[16],因此,在本研究中我们没有重复这一尝试。CDR1或CDR3嫁接的抗体分子稳定性较好。单域抗体通常具有较好的生化特性,并易于进行异源表达,可溶性好。我们用大肠杆菌表达的嫁接抗体均表现出较高的可溶性,同时有少量包涵体形成,其中CDR1嫁接抗体较CDR3嫁接抗体有较多的包涵体。尽管嫁接抗体与大多数天然单域抗体相比,有少量包涵体形成,但与其他类型的抗体如单链抗体ScFV相比,其表达量和可溶性的差异都非常显著。我们的嫁接抗体的可溶性的变化应是受嫁接多肽的结构与构象影响,嫁接改造的CDR区域通常因缺乏与抗体框架区或CDR区等其他区域的关联(如形成二硫键)[20-21],从而可能影响了其可溶性等生化性能。我们获得的嫁接抗体具有一定的热稳定性和较好的碱耐受性,在一定程度上保留了所用单域抗体框架较为稳定的特性。
嫁接抗体对抗原的结合活性由所接入的多肽片段决定,在本研究中,我们所接入的hCG结合片段对hCG具有较特异的结合活性,但同时与相似抗原LH有一定的交叉结合活性,仍需进一步优化以提高其对hCG的结合特异性,在以后的工作中可通过结合多肽的突变扫描等方法进行尝试。
参考文献
| [1] | Muyldermans S. Single domain camel antibodies: current status.J Biotechnol, 2001, 74(4): 277–302. |
| [2] | Cui HQ, Wang QM. Progress in single-domain antibody derived from heavy chain antibody.Chin J Biotech, 2005, 24(3): 497–501.(in Chinese). 崔华清, 王清明. 基于重链抗体构建的单域抗体研究进展.生物工程学报, 2005, 24(3): 497-501. |
| [3] | Liu S, Li J, Liang XG, et al. Research advance in single-domain antibody.Qianren Biol, 2015, 2(3): 26–38.DOI: 10.12677/QRB.2015.23004 |
| [4] | Tanaka T, Rabbitts TH. Intracellular antibody capture (IAC) methods for single domain antibodies.Methods Mol Biol, 2012, 911: 151–173. |
| [5] | Broekgaarden M, van Vught R, Oliveira S, et al. Site-specific conjugation of single domain antibodies to liposomes enhances photosensitizer uptake and photodynamic therapy efficacy.Nanoscale, 2016, 8(12): 6490–6494.DOI: 10.1039/C6NR00014B |
| [6] | Nelson AL, Dhimolea E, Reichert JM, et al. Development trends for human monoclonal antibody therapeutics.Nat Rev Drug Dis, 2010, 9(10): 767–774.DOI: 10.1038/nrd3229 |
| [7] | Chi XY, Yu CM, Chen W. Single B cell monoclonal antibody technologies and applications.Chin J Biotech, 2012, 28(6): 651–660.(in Chinese). 迟象阳, 于长明, 陈薇. 单个B细胞抗体制备技术及应用.生物工程学报, 2012, 28(6): 651-660. |
| [8] | Chan JK, Tian CQ, Teoh D, et al. Survival after recurrence in early-stage high-risk epithelial ovarian cancer: a gynecologic oncology group study.Gynecol Oncol, 2010, 116(3): 307–311.DOI: 10.1016/j.ygyno.2009.10.074 |
| [9] | Kugasia IR, Alkayem M, Patel JB. A rare case of beta-hCG production by a solitary fibrous tumor of the pleura.Am J Case Rep, 2014, 15: 518–522.DOI: 10.12659/AJCR.891171 |
| [10] | Nand KN, Gupta JC, Panda AK, et al. Development of a recombinant hCG-specific single chain immunotoxin cytotoxic to hCG expressing cancer cells.Protein Expr Purif, 2015, 106: 10–17.DOI: 10.1016/j.pep.2014.10.008 |
| [11] | Yan JR, Li GH, Hu YH, et al. Construction of a synthetic phage-displayed nanobody library with CDR3 regions randomized by trinucleotide cassettes for diagnostic applications.J Trans Med, 2014, 12(1): 343.DOI: 10.1186/s12967-014-0343-6 |
| [12] | Yan JR, Wang PY, Zhu M, et al. Characterization and applications of nanobodies against human procalcitonin selected from a novel na?ve nanobody phage display library.J Nanobiotechnol, 2015, 13(1): 33.DOI: 10.1186/s12951-015-0091-7 |
| [13] | Bond CJ, Marsters JC, Sidhu SS. Contributions of CDR3 to VHH domain stability and the design of monobody scaffolds for naive antibody libraries.J Mol Biol, 2003, 332(3): 643–655.DOI: 10.1016/S0022-2836(03)00967-7 |
| [14] | Ding XK, Yang KL. Antibody-free detection of human chorionic gonadotropin by use of liquid crystals.Anal Chem, 2013, 85(22): 10710–10716.DOI: 10.1021/ac400732n |
| [15] | Saerens D, Pellis M, Loris R, et al. Identification of a universal VHH framework to graft non-canonical antigen-binding loops of camel single-domain antibodies.J Mol Biol, 2005, 352(3): 597–607.DOI: 10.1016/j.jmb.2005.07.038 |
| [16] | Hattori T, Umetsu M, Nakanishi T, et al. High affinity anti-inorganic material antibody generation by integrating graft and evolution technologies: potential of antibodies as biointerface molecules.J Biol Chem, 2010, 285(10): 7784–7793.DOI: 10.1074/jbc.M109.020156 |
| [17] | Li HN, Yan JR, Ou WJ, et al. Construction of a biotinylated cameloid-like antibody for lable-free detection of apolipoprotein B-100.Biosens Bioelectron, 2015, 64: 111–118.DOI: 10.1016/j.bios.2014.08.060 |
| [18] | Inoue H, Suganami A, Ishida I, et al. Affinity maturation of a CDR3-grafted VHH using in silico analysis and surface plasmon resonance.J Biochem, 2013, 154(4): 325–332.DOI: 10.1093/jb/mvt058 |
| [19] | Haidar JN, Yuan QA, Zeng L, et al. A universal combinatorial design of antibody framework to graft distinct CDR sequences: a bioinformatics approach.Proteins, 2012, 80(3): 896–912.DOI: 10.1002/prot.v80.3 |
| [20] | Govaert J, Pellis M, Deschacht N, et al. Dual beneficial effect of interloop disulfide bond for single domain antibody fragments.J Biol Chem, 2012, 287(3): 1970–1979.DOI: 10.1074/jbc.M111.242818 |
| [21] | Zabetakis D, Anderson GP, Bayya N, et al. Contributions of the complementarity determining regions to the thermal stability of a single-domain antibody.PLoS ONE, 2013, 8(10): e77678.DOI: 10.1371/journal.pone.0077678 |
