
 , 曾毅1
, 曾毅1

1 北京工业大学 生命科学与生物工程学院,北京 100124;
2 中国疾病预防控制中心 环境与健康相关产品安全研究所,北京 100123
收稿日期:2017-07-05;接收日期:2017-08-25; 网络出版时间:2017-06-09 基金项目:国家自然科学基金(No. 81202976),北京市教委项目(No. KM201510005029),国家科技重大专项项目(No. 2014ZX10005002-007)资助
摘要:旨在建立一个细胞-细胞融合系统,高效筛选对HIV-1病毒细胞-细胞间传播有抑制作用的药物。构建了pEGFP-Tat质粒,将pEGFP-Tat质粒和HIV-1包膜质粒共转染HEK-293T细胞,成为表达Tat蛋白和包膜蛋白的效应细胞,然后与表达CD4及辅助受体和β-半乳糖苷酶、荧光素酶双报告基因的靶细胞TZM-bl融合,建立了细胞-细胞融合系统,并进行条件优化,确定了最佳的融合体系。用阳性融合抑制剂maraviroc以及没有融合抑制作用的AZT和raltegravir作用于该体系,证明该系统可以特异性有效筛选具有细胞融合抑制作用的药物。用该系统测试了8个样本,发现两种样品对融合有一定的抑制作用。该方法背景值低,特异性强,可用来高效筛选具有切断HIV-1病毒细胞-细胞间传播作用的抗病毒药物。
关键词:HIV-1 细胞-细胞融合 进入抑制剂 药物筛选
Tat-based cell-cell fusion method for screening HIV-1 fusion inhibitors
Xiaoli Wang1, Yishu Yang1, Sisi Shen1, Xianliang Wang2, Tian Feng1, Qin Hu1

 , Yi Zeng1
, Yi Zeng1

1 College of Life Science and Bioengineering, Beijing University of Technology, Beijing 100124, China;
2 National Institute of Environmental Health Chinese Center for Disease Control and Prevention, Beijing 100123, China
Received: July 5, 2017; Accepted: August 25, 2017; Published: June 9, 2017
Supported by: National Natural Science Foundation of China (No. 81202976), Scientific Research Project of Beijing Educational Committee (No. KM201510005029), National Science and Technology Major Project of the Ministry of Science and Technology of China (No. 2014ZX10005002-007)
Corresponding author:Qin Hu. Tel: +86-10-67396212; E-mail: hq07616@bjut.edu.cn
Yi Zeng. Tel: +86-10-67392780; E-mail: zengyicdc@sina.com
Abstract: An HIV-1 cell-cell fusion system was developed to screen HIV-1 entry inhibitors that block cell-cell fusion. In this system, the pEGFP-Tat plasmid was constructed and cotransfected into effector cells (HEK-293T) with HIV-1 envelope plasmid. TZM-bl cell, a genetically engineered cell line that expresses CD4, CXCR4, CCR5 as well as Tat-inducible β-galactosidase and luciferase reporter gene, was used as target cell. Thus, the co-culture of target cells and effector cells allows the cell fusion via Env and the activity of the fusion inhibitor can be quantified by measuring the reporter protein expression. The experimental parameters were optimized and 11 anti-HIV-1 agents including CCR5 antagonist maraviroc, reverse transcription inhibitor zidovudine (AZT) and integrase inhibitor raltegravir were tested. The result showed that the system exhibited high specificity and sensitivity. Two of eight tested anti-HIV-1 agents were found to block the cell-cell fusion. The system is suitable for efficient screening of HIV-1 cell-cell fusion inhibitors.
Key words: HIV-1 cell-cell fusion entry inhibition drug screening
艾滋病(Acquired immunodeficiency syndrome,AIDS)是由人免疫缺陷病毒(Human immuno-deficiency virus,HIV)引起的一种逐步摧毁人体免疫系统、严重威胁人类健康和生存的重大传染性疾病。发现30多年来,至今仍无法彻底治愈[1-3]。许多研究致力于发现新型的抗HIV病毒药物和治疗方案[4-6]。
HIV-1在体内的复制可通过病毒颗粒感染靶细胞或者通过已感染HIV的细胞感染靶细胞。后者称为细胞介导的病毒传播途径,许多研究认为该途径对HIV体内传播非常重要,其感染效率比病毒粒子感染高出多个数量级[7-10]。因此,阻断该传播途径对HIV的治疗有重大意义。
细胞与细胞融合系统是筛选细胞介导的HIV传播阻断剂的有效手段。目前具有融合阻断作用的上市药物为T-20和Maraviroc (Mar),这些药物已经存在耐药性等问题[11-13]。许多研究建立了不同效应细胞-靶细胞的融合系统,采用不同的HIV Env质粒和不同的检测指标[14-18],有的研究报道发现了一些具有融合抑制作用的化合物[14, 17, 19],但没有深入研究的报道。曾祥凤等[20]建立的将H9慢性感染细胞和MT2细胞进行细胞融合的筛选方法,需要加入钙荧光素,其可能对细胞生长有影响,而且融合和非融合细胞均有绿色荧光,靠人为区分,主观因素大,背景值高,终点检测用p24试剂盒,价格昂贵,成本高。李珉珉等建立了基于细胞-细胞融合的HIV进入抑制剂非感染性筛选方法,将两种细胞融合后,直接观察合胞体的形成[21],该方法灵敏性不高,主观因素大。
HIV的包膜蛋白gp120和gp41,非共价结合成三聚体,在病毒表面或感染的细胞表面形成突起。在辅助受体CCR5或CXCR4等协助下,gp120蛋白识别靶细胞的CD4分子并与其结合,gp120与gp41分离,gp41构象发生变化,暴露出融合功能区并插入到靶细胞膜中,导致病毒包膜或感染的细胞膜同靶细胞膜的融合[22-24]。HIV的Tat蛋白在细胞蛋白复合物的参与下,与HIV的长末端重复序列(LTR)中的TAR RNA相互作用,调节HIV基因的表达。TZM-bl细胞株来自子宫颈癌细胞HeLa,高表达CXCR4分子,稳定表达CD4分子和CCR5分子。该细胞导入了荧光素酶报告基因和大肠杆菌β-gal报告基因,由LTR控制。Tat蛋白与LTR结合可诱导报告基因表达。
本研究建立了一种高效筛选HIV细胞融合抑制剂的检测方法(图 1)。首先构建了表达GFP蛋白和Tat蛋白的表达载体,该质粒与HIV的Env质粒共转染HEK-293T细胞,获得高表达HIV-1包膜蛋白和Tat蛋白的效应细胞。TZM-bl细胞作为靶细胞。当两种细胞共培养时,效应细胞表面的包膜蛋白识别结合靶细胞的CD4、CCR5和/或CXCR4受体,两种细胞发生融合,Tat蛋白扩散到靶细胞,激活报告基因,产生两种报告蛋白β-半乳糖苷酶和荧光素酶。通过蓝斑计数或荧光素酶检测反映融合情况。当两种细胞融合时,加入待测样本,如果报告基因表达减弱或缺失,则说明该样本具有阻断细胞融合的作用。用已明确作用靶点的HIV上市药物评价了该筛选系统,证明该方法可有效测定药物是否具有细胞融合抑制特性。
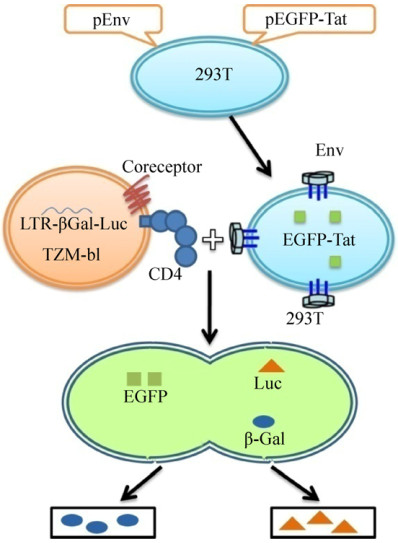 |
| 图 1 HIV-1包膜介导的细胞-细胞融合系统原理 Figure 1 Assay scheme for HIV-1 Env-mediated cell-cell fusion. The effector cells (HEK-293T) that express Env and Tat protein, were co-cultured with target cells (TZM-bl). The Cell-cell fusion enables the diffusion of Tat protein to target cells and thus activated the transcription of the Tat-inducible reporter gene. The efficiency of fusion was quantitated by reporter protein measurement. |
| 图选项 |
1 材料与方法1.1 材料1.1.1 细胞、质粒HEK-293T细胞、TZM-bl细胞由中国疾病控制中心病毒病研究所惠赠。质粒HIV-NL4.3和HIV-1 B亚型包膜质粒pREJO4541.67 Env (编号为11035,本文以11035-Env表示)由NIH AIDS Reagent Repository获得。质粒HIV-NL4.3携HIV-1 B亚型毒株全长基因组,用以获取tat基因序列,质粒pREJO4541.67 Env表达HIV-1包膜蛋白Env基因序列。
1.1.2 载体和试剂pGEM-T载体和pEGFP-C3载体、反转录试剂盒、转染试剂FUGENE 6、Bright-glo荧光素酶检测试剂盒等购自Promega公司;BamH Ⅰ、Xho Ⅰ限制性内切酶及PCR相关试剂购自TaKaRa公司;质粒小提试剂盒购自天根生化科技(北京)有限公司;CCK8试剂盒购自日本同仁化学研究所。引物合成及基因测序由生工生物工程(上海)股份有限公司完成。亚铁氰化钾、铁氰化钾等化学试剂购自国药集团化学试剂北京有限公司。
1.1.3 测定药物Mar、AZT、Raltegravir (Ral)购自MCE公司。Myr购自国药集团化学试剂北京有限公司;HZ、BS、QQ购自北京同仁堂药店;HPB、KH为本实验室合成;ZL-1为进行临床Ⅱ期测试的药物。
1.2 方法1.2.1 pEGFP-Tat真核表达质粒的构建及鉴定引物设计:以HIV-1 NL4.3的tat基因序列为模板,设计、合成引物,扩增含有两个外显子的tat基因序列。上游引物为:5′-CTCGAGAGCCAC CATGGAGCCAGTAGATCCT-3′,引入XhoⅠ酶切位点;下游引物为:5′-GGATCCAATTCCTTCGGG CCTGT-3′,引入BamHⅠ酶切位点。
pEGFP-Tat质粒的构建:从转染了HIV-1 NL4.3质粒的HEK-293T细胞中提取总RNA,以该RNA为模板,RT-PCR扩增tat基因,纯化回收PCR产物,连接到pGEMT载体,构建pGEMT-Tat质粒。将pGEMT-Tat质粒进行XhoⅠ、BamH Ⅰ双酶切,回收纯化tat酶切片段。tat的回收产物和pEGFP-C3载体连接、转化、扩增提取,得到pEGFP-Tat质粒,该质粒进行酶切及测序鉴定。
1.2.2 细胞-细胞融合系统的建立取对数生长期HEK-293T细胞接种六孔板。第2天将pEGFP-Tat质粒和11035-Env包膜质粒转染HEK-293T细胞,制备效应细胞。第3天取对数生长期的靶细胞TZM-bl接种到96孔板。第4天,收集转染了质粒的HEK-293T效应细胞,制成单细胞悬液,加入接种有TZM-bl细胞的96孔板中,两种细胞共培养24 h后,荧光显微镜摄像(Observer A1,Zeiss,德国)。报告蛋白β-半乳糖苷酶用蓝斑染色试剂检测[25],用1%甲醛,0.2%戊二醛固定液固定样本,用2 μmol/L亚铁氰化钾、0.2 μmol/L铁氰化钾、2 μmol/L氯化镁、40 μg/mL X-gal染色液染色,荧光显微镜(IX71,Olympus,日本) ImagPro软件进行蓝斑计数。荧光素酶检测按照Bright-glo荧光素酶试剂盒步骤操作,多功能酶标(Enspire,PE,美国)测定荧光素酶值。
1.2.3 细胞-细胞融合系统条件优化优化HEK-293T效应细胞的制备条件:取对数生长期HEK-293T细胞按照3×105个细胞/孔接种六孔板。第2天,将pEGFP-Tat质粒和11035-Env质粒转染HEK-293T细胞。根据tat:env质粒不同的量设不同实验组,24 h、48 h、72 h荧光显微摄像及流式细胞术测定转染情况,确定最佳转染条件。
将对数生长期TZM-bl靶细胞制备成单细胞悬液,加入96孔培养板,每孔10 000个细胞,贴壁0、2、6、24 h时加入效应细胞,共孵育24 h,荧光显微镜摄像及报告基因检测测定细胞融合情况,确定靶细胞最佳贴壁时间。
对数生长期的TZM-bl细胞按照10 000个/孔接种96孔板,贴壁24 h。将HEK-293T效应细胞制成单细胞悬液,按照效应细胞和靶细胞数目比例为0.5:1、1:1、2:1、4:1的比例加入96孔板中,两种细胞共培养24 h后,荧光显微镜摄像及报告蛋白检测测定细胞融合情况,确定两种细胞最佳比例。
1.2.4 细胞融合系统筛选融合抑制剂的特异性将HIV-1上市药物Mar、AZT和Ral 10倍比稀释成一系列的浓度梯度,与效应细胞同时加入靶细胞中孵育。同时设立融合阳性对照组(FC,只有效应细胞和靶细胞孵育)和空白对照组(Mock,只转染了pEGFP-Tat质粒的HEK-293T细胞和靶细胞孵育)。24 h后,用蓝斑染色法和荧光素酶法分别测定细胞融合情况。
1.2.5 细胞融合系统筛选具有融合抑制作用的样本取对数生长期TZM-bl细胞接种96孔板,第2天加入不同浓度梯度的待测样本,培养24 h,CCK8检测药物对细胞的毒性作用。细胞死亡率在10%以下认为无细胞毒性。将待测样本无细胞毒剂量作为最高浓度稀释为系列浓度梯度,与效应细胞同时加入靶细胞共孵育24 h,Mar作为阳性对照药物,AZT为阴性对照药物。检测报告基因,计算融合抑制率。
融合抑制率(%) = (FC组蓝斑数-加药组蓝斑数) / (FC组蓝斑数-Mock组蓝斑数) ×100。
1.2.6 数据统计分析所有实验数据均为3次或以上重复实验结果,用GraphPad PRISM6.0绘图及进行统计学分析,P < 0.05认为差异有统计学意义。
2 结果与分析2.1 真核表达质粒pEGFP-Tat的构建HIV-1 NL4.3质粒转染HEK-293T细胞,反转录PCR扩增tat片段,电泳图见图 2A。在250 bp附近有明显的扩增条带,tat片段为261 bp,与预期结果相符。构建真核表达克隆pEGFP-Tat,酶切鉴定,所得片段长度与预期结果相符(图 2B)。将pEGFP-Tat酶切结果正确的阳性克隆送上海生工进行测序,测序结果序列比对后完全正确。
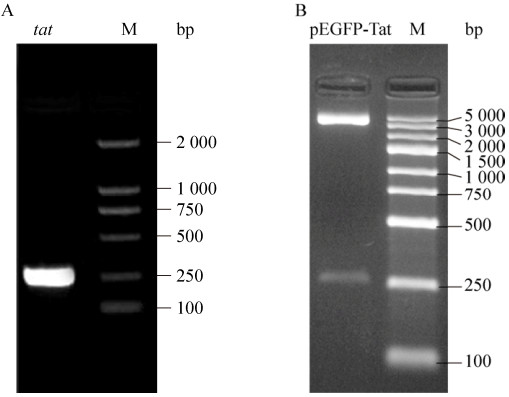 |
| 图 2 tat基因PCR产物与各重组质粒酶切鉴定 Figure 2 Agarose gel electrophoresis of PCR amplified tat gene and the restrictive endonuclease analysis of constructed plasmids. (A) PCR amplification of tat gene. (B) pEGFP-Tat digested with BamHⅠand XhoⅠ. |
| 图选项 |
2.2 细胞-细胞融合系统将11035-Env和pEGFP-Tat两种质粒共转染HEK-293T细胞,Env质粒表达包膜蛋白,pEGFP-Tat质粒表达Tat蛋白和GFP荧光蛋白,GFP的亮度和表达率反映了蛋白表达量的多少,表达率越高,转染效率越高。将转染了质粒的HEK-293T效应细胞与TZM-bl细胞共培养以后,两种细胞两两融合或多个相互融合,形成大的合胞体或多核细胞,显微镜明场观察(图 3C),多为巨型细胞,细胞边缘不整齐,模糊不清,颗粒增多,形态多样,呈叠层生长,荧光观察,有些细胞中呈现多个绿色荧光体,蓝斑染色发现有的细胞含有一个蓝斑,有的含有多个蓝色斑点。只转染了Tat蛋白的HEK-293T细胞与TZM-bl细胞共孵育后(图 3B),显微镜明场下没有巨型细胞,只有单个的细胞,荧光观察,只能看到单个荧光的HEK-293T细胞,细胞蓝斑染色未见蓝色斑点。
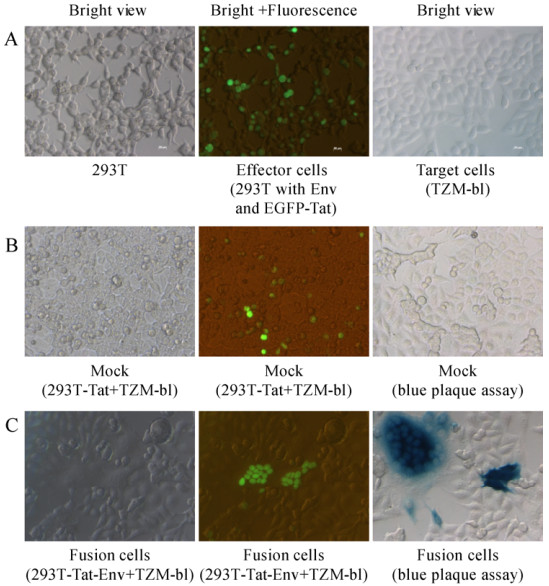 |
| 图 3 细胞-细胞融合系统显微镜摄像分析(200×) Figure 3 Direct visualization of cell-cell fusion system (200×). The effector cells (HEK-293T) were developed by co-transfection of pEGFP-Tat and p11035-Env plasmids. (A) The optical imaging of effector cells and target cells (TZM-bl) without fusion. Two cell types were co-cultured for 24 h and analysed for Tat expression as well as blue plaques under fluorescence microscope. (B) HEK-293T cells that transfected with only pEGFP-Tat were used as mock group. (C) HEK-293T and TZM-bl fusion group. |
| 图选项 |
2.3 细胞-细胞融合条件的优化2.3.1 pEGFP-Tat质粒与11035-Env包膜质粒转染量的影响不同量的Tat质粒和Env质粒共转染HEK-293T细胞。从图 4A、4B可知,当Tat质粒1 μg、Env质粒0.5 μg时,荧光强度最强,转染效率最高。共转染24、48、72 h显微镜下观察荧光强度,发现48 h比24 h强,与72 h无显著差异(结果未显示),因此选取转染后48 h进行融合实验。
2.3.2 TZM-bl细胞贴壁时间对融合效率的影响在TZM-bl细胞贴壁0、2、6、24 h时加入效应细胞,共孵育24 h后,进行蓝斑染色,发现随着贴壁时间延长,蓝斑数增多,24 h为最高(图 4C)。结果提示靶细胞贴壁时间对两种细胞的融合效果有显著影响,本系统选取贴壁24 h后进行细胞融合。
 |
| 图 4 细胞-细胞融合条件优化 Figure 4 Optimization of cell-cell fusion system. (A) Titration of the ratio of pEGFP-Tat: 11035-Env on transfection efficiency by fluorescence microscopy (100×). (B) Titration of the ratio of pEGFP-Tat: 11035-Env on transfection efficiency by flow cytometry. (C) The optimal seeding time of TZM-bl cells prior to co-culture with HEK-293T cells. (D) The ratios of 293T: TZM-bl cells on the fusion efficiency. All data were expressed as x±s(n≥3). |
| 图选项 |
2.3.3 效应细胞与靶细胞的数量对细胞融合的影响TZM-bl细胞10 000个/孔接种96孔板,24 h后加入不同量的HEK-293T效应细胞共培养,24 h后蓝斑计数(图 4D)。随着效应细胞的增多,融合的蓝斑细胞数增多,当每孔加到20 000个效应细胞,即HEK-293T与TZM-bl细胞为2:1时,蓝斑数最多,融合效率最高,随着效应细胞的增加,当二者比例为4:1时,融合效率下降,蓝斑数降低,因此选取效应细胞与靶细胞的数目分别为20 000和10 000作为最佳融合条件。
2.4 细胞-细胞融合系统药物筛选的特异性将已知不同靶点的上市药物Mar、AZT和Ral作用于该细胞融合系统。Mar为CCR5抑制剂,具有抑制细胞-细胞融合的作用,AZT为逆转录酶抑制剂,Ral为整合酶抑制剂,二者均没有融合抑制功能。由图 5可知,无论是蓝斑计数法还是荧光素酶法,Mar高剂量组测定值与融合对照组(FC)相比,有显著性差异(P < 0.05),说明其具有抑制融合的作用,而且结果还显示Mar与融合存在剂量效应关系。AZT和Ral组与FC组相比,无显著性差异(P > 0.05),没有融合抑制作用。实验结果与各药物抗病毒作用的靶点相符合,表明该方法筛选细胞融合抑制剂有良好的特异性。
 |
| 图 5 细胞-细胞融合系统可行性及特异性检测 Figure 5 The validation of the cell-cell fusion system. (A) The system was validated with 3 FDA-approved anti-HIV-1 drugs, including CCR5 antagonist maraviroc (positive control), reverse transcription inhibitor zidovudine (AZT) and integrase inhibitor raltegravir (negative controls). The fusion efficiency was detected using blue plaque assay (A) and luciferase assay (B). All data were expressed as x±s (n≥3); ** P < 0.05 (Student's t tests). FC: fusion control, refers to 293T-Tat-Env and TZM-bl co-culture group; Mock refers to 293T-Tat and TZM-bl co-culture group. |
| 图选项 |
2.5 药物的筛选用该系统测试了6种天然药物(包括提取物)及两种合成的化合物,本实验室前期研究发现这些样本在细胞水平具有一定的HIV-1抑制作用。细胞融合系统测定发现,有两种药物Myr和KH对融合有一定的抑制作用,高剂量组抑制率达到50%以上,半数抑制浓度为7.483 μg/mL和5.646 μg/mL,提示这两种药物可能通过抑制融合作用发挥抗病毒作用,其他几种药物的抗病毒作用与细胞融合无关(图 6A和6B)。
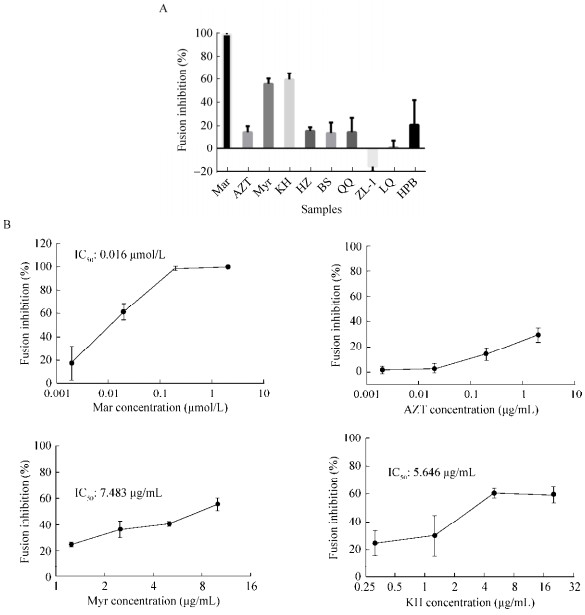 |
| 图 6 融合系统测定样本 Figure 6 The screening for fusion inhibitor using cell-cell fusion system. (A) Ten anti-HIV-1 agents were tested in the cell-cell fusion system. Mar: 0.2 μmol/L; AZT: 0.2 μg/mL; Myr: 10 μg/mL; KH: 20 μg/mL; HZ: 150 μg/mL; BS: 150 μg/mL; QQ: 100 μg/mL; ZL-1: 100 μg/mL; LQ: 150 μg/mL. (B) The dose-effect curves of Mar, AZT, Myr and KH on HIV-1 cell-cell fusion. All data were expressed as x±s(n≥3). |
| 图选项 |
3 讨论本研究利用Env蛋白介导细胞-细胞融合,Tat蛋白反式激活因子与LTR相互作用,调控报告基因的表达,建立了一个高效的细胞融合系统。我们构建了EGFP-Tat蛋白表达质粒,EGFP作为指示蛋白,评价效应细胞产生的效率。当两种细胞共培养时,效应细胞表面的gp120、gp41识别靶细胞的CD4、CCR5和/或CXCR4受体,发生细胞融合,Tat蛋白扩散到靶细胞,激活报告基因。影响上述过程中任一或多个蛋白活性,或者影响蛋白之间相互作用过程,都会导致报告基因的变化。因此该方法筛选的有抑制作用的样品,可能作用于某个融合靶点,也可能作用多个靶点,可广泛筛选具有切断细胞-细胞传播作用的药物。用Mar作为阳性药,AZT和Ral为阴性药,评价细胞融合系统筛选抑制剂的有效性。实验结果证实该系统可有效筛选融合抑制剂,特异性强,背景值低。蓝斑染色法和荧光素酶两种方法检测结果一致。
利用HEK-293T细胞作为效应细胞,该细胞株可以高效表达外源蛋白,表达率可达60%以上,保证了效应细胞的高效性。EGFP作为指示蛋白,通过荧光显微镜,可以实时快速反映转染蛋白表达情况和细胞融合情况,流式细胞仪检测还可以确定表达了Tat、Env蛋白效应细胞的比例,不同于De-Chun Cheng等[14, 21]建立的系统,只有进行到细胞融合的终点才能评价此次实验融合情况。
Tat调控蛋白只有通过融合作用才能进入靶细胞调控报告基因的表达,非特异性低。该方法有荧光素酶和β-半乳糖苷酶双报告基因系统,均可反映样本对融合的抑制情况。用荧光素酶试剂盒测定,灵敏度高,时间短,出结果快;基于β-半乳糖苷酶特性进行的细胞蓝斑染色,背景值低,特异性强,检测成本低。两种指标同时检测,可排除样本对某种报告蛋白直接影响带来的假阳性,提高检测的特异性。但对报告蛋白直接影响的样本很少,因此通常只采取一种检测方法即可。用不同的HIV包膜蛋白质粒与Tat质粒进行转染,可以建立不同HIV包膜的细胞-细胞融合系统,筛选针对某一HIV亚型的细胞融合抑制剂,优于用表达Env、Tat的细胞系作为效应细胞的筛选方法[26-27]。但同时这也成为该方法不足之处,效应细胞蛋白瞬时表达,增加筛选的时间和系统的变异性。但由于HEK-293T细胞转染效率高,经多次重复实验,转染率差异在3%以内,对融合效果检测影响不显著。
用该系统筛选了8个样本,Mar为融合阳性药物对照,AZT为融合阴性药物对照。首先用CCk8方法检测药物的细胞毒性,用药物的无毒剂量进行融合筛选实验,排除药物的细胞毒性对融合的影响,发现天然化合物Myr和化学合成物质KH具有显著抑制融合作用,最高剂量的抑制率在50%以上,IC50分别为7.483 μg/mL和5.646 μg/mL,为筛选具有融合作用的药物提供了有效的方法。
参考文献
| [1] | Burki T. Claims of a cure for HIV come under fire.Lancet Infect Dis, 2017, 17(5): 484–485.DOI: 10.1016/S1473-3099(17)30200-1 |
| [2] | Liu C, Ma X, Liu B, et al. HIV-1 functional cure: will the dream come true?.BMC Med, 2015, 13: 284.DOI: 10.1186/s12916-015-0517-y |
| [3] | Deeks SG, Lewin SR, Havlir DV. The end of AIDS: HIV infection as a chronic disease.Lancet, 2013, 382(9903): 1525–1533.DOI: 10.1016/S0140-6736(13)61809-7 |
| [4] | Carrillo MA, Zhen A, Zack JA, et al. New approaches for the enhancement of chimeric antigen receptors for the treatment of HIV.Transl Res, 2017, S1931-5244(17): 30233–30235. |
| [5] | Kwarteng A, Ahuno ST, Kwakye-Nuako G. The therapeutic landscape of HIV-1 via genome editing.AIDS Res Ther, 2017, 14(1): 32.DOI: 10.1186/s12981-017-0157-8 |
| [6] | Malik T, Chauhan G, Rath G, et al. "Fusion and binding inhibition" key target for HIV-1 treatment and pre-exposure prophylaxis: targets, drug delivery and nanotechnology approaches.Drug Deliv, 2017, 24(1): 608–621.DOI: 10.1080/10717544.2016.1228717 |
| [7] | Casartelli N. HIV-1 cell-to-cell transmission and antiviral strategies: an overview.Curr Drug Targets, 2016, 17(1): 65–75. |
| [8] | Smith SA, Derdeyn CA. New connections: cell-to-cell HIV-1 transmission, resistance to broadly neutralizing antibodies, and an envelope sorting motif.J Virol, 2017, 91(9): e00149–17. |
| [9] | Sattentau Q. Avoiding the void: cell-to-cell spread of human viruses.Nat Rev Microbiol, 2008, 6(11): 815–826.DOI: 10.1038/nrmicro1972 |
| [10] | Sattentau QJ. Cell-to-cell spread of retroviruses.Viruses, 2010, 2(6): 1306–1321.DOI: 10.3390/v2061306 |
| [11] | Wei XP, Decker JM, Liu HM, et al. Emergence of resistant human immunodeficiency virus type 1 in patients receiving fusion inhibitor (T-20) monotherapy.Antimicrob Agents Chemother, 2002, 46(6): 1896–1905.DOI: 10.1128/AAC.46.6.1896-1905.2002 |
| [12] | Greenberg ML, Cammack N. Resistance to enfuvirtide, the first HIV fusion inhibitor.J Antimicrob Chemother, 2004, 54(2): 333–340.DOI: 10.1093/jac/dkh330 |
| [13] | Jiang XW, Feyertag F, Meehan CJ, et al. Characterizing the diverse mutational pathways associated with R5-tropic maraviroc resistance: HIV-1 That uses the drug-bound CCR5 coreceptor.J Virol, 2015, 89(22): 11457–11472.DOI: 10.1128/JVI.01384-15 |
| [14] | Cheng DC, Zhong GC, Su JX, et al. A sensitive HIV-1 envelope induced fusion assay identifies fusion enhancement of thrombin.Biochem Biophys Res Commun, 2010, 391(4): 1780–1784.DOI: 10.1016/j.bbrc.2009.12.155 |
| [15] | Kramer S, Buontempo P, Agrawal S, et al. Imaging-based assay for identification and characterization of inhibitors of CXCR4-tropic HIV-1 envelope-dependent cell-cell fusion.J Biomol Screen, 2011, 16(6): 668–675.DOI: 10.1177/1087057111403480 |
| [16] | Herschhorn A, Finzi A, Jones DM, et al. An inducible cell-cell fusion system with integrated ability to measure the efficiency and specificity of HIV-1 entry inhibitors.PLoS ONE, 2011, 6(11): e26731.DOI: 10.1371/journal.pone.0026731 |
| [17] | Herschhorn A, Gu C, Espy N, et al. A broad HIV-1 inhibitor blocks envelope glycoprotein transitions critical for entry.Nat Chem Biol, 2014, 10(10): 845–852.DOI: 10.1038/nchembio.1623 |
| [18] | Symeonides M, Lambelé M, Roy NH, et al. Evidence showing that tetraspanins inhibit HIV-1-induced cell-cell fusion at a post-hemifusion stage.Viruses, 2014, 6(3): 1078–1090.DOI: 10.3390/v6031078 |
| [19] | Marin M, Du YH, Giroud C, et al. High-throughput HIV-cell fusion assay for discovery of virus entry inhibitors.Assay Drug Dev Technol, 2015, 13(3): 155–166.DOI: 10.1089/adt.2015.639 |
| [20] | Zeng XF, Zeng YY, Li HX. A novel method for rapid screening of anti-HIV drugs in vitro.J Jinan Univ: Med Ed, 2006, 27(2): 233–238.(in Chinese). 曾祥凤, 曾耀英, 李海仙. 体外快速筛选抗HIV药物的一种新方法.暨南大学学报:医学版, 2006, 27(2): 233-238. |
| [21] | Li MM, Li L, Jiang SB, et al. A non-infectious assay for detecting HIV Env-induced cell-cell fusion.J Jinan Univ: Med Ed, 2007, 28(6): 576–580.(in Chinese). 李珉珉, 李琳, 姜世勃, 等. 基于细胞-细胞融合的HIV进入抑制剂非感染性筛选方法的研究.暨南大学学报:医学版, 2007, 28(6): 576-580. |
| [22] | Esté JA, Telenti A. HIV entry inhibitors.Lancet, 2007, 370(9581): 81–88.DOI: 10.1016/S0140-6736(07)61052-6 |
| [23] | Blumenthal R, Durell S, Viard M. HIV entry and envelope glycoprotein-mediated fusion.J Biol Chem, 2012, 287(49): 40841–40849.DOI: 10.1074/jbc.R112.406272 |
| [24] | Eckert DM, Kim PS. Mechanisms of viral membrane fusion and its inhibition.Annu Rev Biochem, 2001, 70: 777–810.DOI: 10.1146/annurev.biochem.70.1.777 |
| [25] | Kimpton J1, Emerman M. Detection of replication-competent and pseudotyped human immunodeficiency virus with a sensitive cell line on the basis of activation of an integrated beta-galactosidase gene.J Virol, 1992, 66(4): 2232–2239. |
| [26] | Li MM, Xia CL, Mao QC, et al. A non-infectious and quantitative cell-based bioassay for screening HIV entry inhibitors targeting HIV envelope proteins.J South Med Univ, 2010, 30(5): 941–944.(in Chinese). 李珉珉, 夏承来, 毛芹超, 等. 靶向包膜蛋白的HIV进入抑制剂非感染性定量筛选方法的研究.南方医科大学学报, 2010, 30(5): 941-944. |
| [27] | Chong HH, Yao X, Qiu ZL, et al. Discovery of critical residues for viral entry and inhibition through structural Insight of HIV-1 fusion inhibitor CP621-652.J Biol Chem, 2012, 287(24): 20281–20289.DOI: 10.1074/jbc.M112.354126 |
