

1 湖北大学 生命科学学院 生物资源绿色转化湖北省协同创新中心 湖北省环境微生物工程技术研究中心,湖北 武汉 430062;
2 绿康生化股份有限公司,福建 浦城 353400
收稿日期:2017-12-18;接收日期:2018-01-16 基金项目:国家重点基础研究发展计划(973计划) (No. 2015CB150505)资助
摘要:杆菌肽是微生物产生的由11种氨基酸残基组成的广谱性抗生素,前体物的供应可能是限制杆菌肽高产的重要因素。文中通过支链氨基酸(异亮氨酸、亮氨酸、缬氨酸)的添加实验考察了前体物质支链氨基酸对杆菌肽高产的影响,证实了异亮氨酸(Ile)和亮氨酸(Leu)的添加可以提高杆菌肽的效价,其中Ile的添加对杆菌肽效价提高的效果较为明显。随后,文中以地衣芽胞杆菌DW2为出发菌株,分别构建了支链氨基酸转运蛋白YhdG的缺失和强化表达菌株。发酵结果表明,转运蛋白YhdG缺失工程菌DW2△yhdG的杆菌肽效价达到917.35 U/mL,与原始菌DW2相比提高了11%,而强化YhdG则会使杆菌肽效价下降25%。最后通过分析胞内胞外支链氨基酸含量,发现缺失转运蛋白YhdG能够在发酵中后期显著提高胞内支链氨基酸含量,表明氨基酸转运蛋白YhdG在地衣芽胞杆菌DW2中可能发挥着氨基酸输出的功能。综上,文中通过缺失转运蛋白YhdG显著提高了地衣芽胞杆菌胞内支链氨基酸的供给水平,从而提高了杆菌肽效价,为杆菌肽高产菌株的构建提供了一种新的策略。
关键词:杆菌肽 地衣芽胞杆菌 支链氨基酸 转运蛋白YhdG
Enhanced production of bacitracin by knocking out of amino acid permease gene yhdG in Bacillus licheniformis DW2
Yang Li1, Fei Wu1, Dongbo Cai1, Yangyang Zhan1, Junhui Li2, Xiaobin Chen2, Huichao Chen2, Shouwen Chen1, Xin Ma1


1 Environmental Microbial Technology Center of Hubei Province, Hubei Collaborative Innovation Center for Green Transformation of Bio-Resources, College of Life Sciences, Hubei University, Wuhan 430062, Hubei, China;
2 Lifecome Biochemistry Co. Ltd, Pucheng 353400, Fujian, China
Received: December 18, 2017; Accepted: January 16, 2018
Supported by: National Basic Research Program of China (973 Program) (No. 2015CB150505)
Corresponding author:Xin Ma. Tel: +86-27-88668081; E-mail: maxin@hubu.edu.cn
Abstract: Bacitracin is a broad-spectrum polypeptide antibiotic, which is formed by 11 amino acids residues. Precursor amino acids supply might be the limit factor during bacitracin fermentation. First, our results demonstrated that increasing Ile and Leu supplies were regarded as the efficient strategies for the enhanced titer of bacitracin. Then, the amino acid permease YhdG, which was identified as the BCAA permease, was deleted and overexpressed in DW2, respectively. Our results showed that knocking out of permease YhdG could improve bacitracin production remarkablely. The bacitracin titer of the yhdG deficient strain DW2△yhdG reached 917.35 U/mL by flask fermentation, increased by 11% compared with that of DW2. In addition, the bacitracin titer was decreased by 25% in the YhdG overexpressed strain. Meanwhile, the intracellular concentrations of BCAA were higher than DW2 during the biosynthesis of bacitracin. The above results suggested that the permease YhdG might act as an exporter for branched chain amino acids in B. licheniformis DW2. Taken together, the increasing intracellular concentrations of branched chain amino acids by deleting amino acid permease YhdG could improve bacitracin titer. This study provided a new strategy for high-level production of bacitracin.
Key words: bacitracin Bacillus licheniformis branched chain amino acids amino acid permease YhdG
杆菌肽是一种主要由枯草芽胞杆菌和地衣芽胞杆菌产生的广谱性抗生素,由11种氨基酸残基组成,包括Orn、D-Phe、His、D-Asp、Asn、Lys、D-Glu、Cys、Leu、Ile和Val[1-4]。作为一种广谱性抗生素,杆菌肽能通过抑制细菌细胞壁的合成从而抑制革兰氏阳性细菌和部分革兰氏阴性菌[2, 5],另外杆菌肽几乎不会在动物的肠道内被吸收,因此被广泛应用于饲料添加[6-7]。
杆菌肽在动物饲料添加方面具有巨大的市场前景,但是其合成效率低,严重影响了杆菌肽的产量和市场开发。目前,杆菌肽的高产主要是通过高产菌株的选育和发酵条件的优化来实现的[8-9],而高产菌株的选育主要是通过传统的诱变方法,如紫外诱变、化学诱变等,但这些手段提高杆菌肽的产量有限,并且高产性状极不稳定,容易发生回复突变[10]。因此,通过代谢工程手段选育杆菌肽高产菌株具有重要的理论意义和应用价值[11]。之前的研究表明,提高前体物质的供应可以提高次级代谢产物的产量,因此通过代谢工程手段提高杆菌肽的前体氨基酸的供应,有望提高杆菌肽的产量[12-13]。
本实验室前期通过氨基酸添加实验发现在培养基中添加杆菌肽合成前体氨基酸Cys、Ile、Leu、Lys和Glu等均可以提高杆菌肽的产量,其中Ile的添加可以显著提高杆菌肽的产量[6]。因此,通过代谢工程手段提高前体氨基酸的供给水平可能是提高杆菌肽生产水平的有效策略[13-15]。转运蛋白是影响细胞内氨基酸供应的重要因素,其可以通过影响前体氨基酸胞内胞外的分布从而影响目标产物的高产[16-18]。枯草芽胞杆菌中,BcaP (YhdG)负责包括支链氨基酸在内的多种氨基酸的转运,并且是Ile最有效的转运蛋白,负责Ile的摄入[19-21]。杆菌肽发酵原料主要为豆粕等蛋白质资源,菌体如何高效利用胞外氨基酸是提高菌体高效合成杆菌肽的关键因素之一。本研究重点围绕转运蛋白YhdG开展研究,通过研究不同表达水平的氨基酸转运蛋白YhdG对杆菌肽发酵效价的影响,从而构建杆菌肽高产菌株,并为构建高效利用豆粕资源的杆菌肽重组菌株奠定基础。
1 材料与方法1.1 菌株本研究作用的菌株质粒见表 1,其中出发菌株地衣芽胞杆菌DW2由福建浦城绿康生化股份有限公司提供,菌种保藏于中国典型培养物保藏中心,菌株保藏号:CCTCC M2011344。本研究所使用的引物见表 2。
表 1 本研究所用的菌株和质粒Table 1 The strains and plasmids used in this study
| Strains and plasmids | Relevant characteristics | Sources |
| Strains | ||
| E. coli DH5α | F- Φ80d/lacZΔM15, Δ(lacZYA-argF) U169, recA1, endA1, hsdR17 (rK-, mK+), phoA, supE44, λ-, thi-1, gyrA96, relA1 | TaKaRa Co., Ltd |
| B. licheniformis DW2 | Industrial strain for bacitracin (CCTCC M2011344) | CCTCC |
| DW2/pHY300 | DW2 harboring plasmid pHY300PLK | This study |
| DW2/pHY-yhdG | DW2 harboring plasmid pHY-yhdG | This study |
| DW2△yhdG | Deletion of yhdG in DW2 | This study |
| Plasmids | ||
| pHY300PLK | E. coli-Bacillus shuttle vector; Ampr in E. coli, Tcr in both E. coli and B. subtilis | Lab collection |
| pHY-yhdG | Plasmid pHY300PLK harboring gene yhdG | This study |
| T2(2)-ori | E. coli-B. licheniformis shuttle vector, for gene konckout | Lab collection |
| T2-yhdG | T2(2)-ori derivative containing homologous arms for yhdg knockout | This study |
表选项
表 2 本研究所用的引物Table 2 The primers used in this study
| Primer name | Primer sequence (5′-3′) |
| pHY-L | CAGATTTCGTGATGCTTGTC |
| pHY-R | GTTTATTATCCATACCCTTAC |
| T2-L | ATGTGATAACTCGGCGTA |
| T2-R | GCAAGCAGCAGATTACGC |
| pHY-yhdG-1 | GCTCTAGATGATAGGTGGTATGTTTTCG |
| pHY-yhdG-2 | CATTTGCTGTTTTCCCATGTGTACATTCCTCTCTTAC |
| pHY-yhdG-3 | GTAAGAGAGGAATGTACACATGGGAAAACAGCAAATG |
| pHY-yhdG-4 | ATCCGTCCTCTCTGCTCTTTTATATACTTCTAGCATGC |
| pHY-yhdG5 | GCATGCTAGAAGTATATAAAAGAGCAGAGAGGACGGAT |
| pHY-yhdG-6 | GGAATTCCGCAATAATGCCGTCGCACT |
| T2-yhdG-1 | CGGGCGGAAATGCTTGAT |
| T2-yhdG-2 | GCTCTAGAGCTCTGAAGAAATCGGTAAAG |
| T2-yhdG-3 | CCAAGATCAGCCATTCATACGACGGTGCTGCCCATAAA |
| T2-yhdG-4 | TTTATGGGCAGCACCGTCGTATGAATGGCTGATCTTGG |
| T2-yhdG-5 | CGAGCTCCCGGCTTGATGATAAAGGTA |
| T2-yhdG-6 | CGGAATACCCGCTTCGTG |
表选项
1.2 主要试剂限制性内切酶(EcoRⅠ、XbaⅠ、SacⅠ)、T4 DNA连接酶、Taq DNA聚合酶、溶菌酶、DNA分子量标准(如DL15000 Marker,DL5000 Marker,DL2000 Marker)购自TaKaRa公司;Fastpfu DNA酶购自北京全式金生物技术有限公司;DNA凝胶回收试剂盒购自上海赛百盛公司;质粒小提试剂盒购自北京庄盟国际生物基因科技有限公司;引物合成及序列测定由北京澳科公司完成;琼脂糖为Biowest产品;D-甘露醇、D-山梨醇均为武汉华顺生物技术公司进口分装产品;高效液相色谱使用的甲醇及乙腈为色谱纯;酵母抽提物、胰蛋白胨购自英国Oxoid公司;氯化钠、硫酸铵等试剂购自国药集团化学试剂有限公司;豆粕、玉米淀粉、轻质碳酸钙由福建浦城绿康生化有限公司提供。
1.3 培养基LB固体培养基:酵母抽提物0.5%,胰蛋白胨1%,NaCl 1%,琼脂粉2%,pH 7.2。
LB液体培养基:酵母抽提物0.5%,胰蛋白胨1%,NaCl 1%,pH 7.2。
杆菌肽发酵培养基:豆粕10%,玉米淀粉4.5%,轻钙0.6%,硫酸铵0.1%,pH 7.0。
1.4 工程菌的构建1.4.1 转运蛋白YhdG游离强化表达工程菌的构建游离表达工程菌DW2/pHY-yhdG的构建步骤如下:首先以枯草芽胞杆菌168基因组为模板扩增P43启动子,以地衣芽胞杆菌DW2基因组DNA为模板扩增氨基酸转运蛋白基因yhdG和淀粉酶基因amyL终止子TamyL,通过Splicing Overlap Extension (SOE)-PCR (SOE-PCR)连接成目的片段,然后通过限制性内切酶EocRⅠ/XbaⅠ将目的片段插入游离表达载体pHY300PLK中,构成游离表达载体pHY-yhdG,最后将重组载体电转化至地衣芽胞杆菌DW2中,获得基因yhdG游离表达工程菌DW2/pHY-yhdG。
1.4.2 转运蛋白YhdG缺失工程菌的构建转运蛋白YhdG缺失工程菌的构建是依据同源重组的原理,通过温敏性穿梭载体T2(2)-ori实现的[22-23],具体步骤如下:以地衣芽胞杆菌DW2基因组DNA为模板,扩增出转运蛋白基因yhdG的上下游同源臂,PCR产物回收,通过SOE-PCR将上下游连接到一起,并将连接到一起的片段通过SacⅠ和XbaⅠ双酶切插入温敏型穿梭质粒T2(2)-ori中,获得敲除载体T2-yhdG。将敲除载体T2-yhdG电转化到地衣芽胞杆菌DW2中,然后挑取阳性克隆子,加入到含20 μg/mL的卡那青霉素,于180 r/min、45 ℃的条件下传代培养数代,直至发生单交换。最后将成功发生单交换的阳性克隆子接到不含抗性的LB中,于180 r/min、37 ℃的条件下传代培养数代,直至发生双交换。通过PCR验证和DNA测序分析,获得yhdG缺失工程菌DW2△yhdG。
1.5 发酵方法菌种活化:挑取甘油管保藏的地衣芽胞杆菌菌种,于含有相应抗性或无抗性的LB平板上稀释涂布,37 ℃培养12 h,挑取单菌落再在相应的LB平板上划线,37 ℃培养12 h。
种子培养:从LB固体培养基上挑取单菌落接种至20 mL LB液体培养基(250 mL摇瓶),230 r/min、37 ℃振荡培养8-10 h。
摇瓶发酵培养:发酵培养基用250 mL三角瓶装液量20 mL,接种量5%,转速230 r/min,37 ℃培养,发酵时长为48 h。每株发酵菌株至少设置3个摇瓶重复。
1.6 杆菌肽效价测定本实验杆菌肽效价采用高效液相色谱(HPLC)方法测量,使用Agilent 1260液相色谱仪检测[6-7]。
色谱柱:Eclipse Plus C18 column (4.6 mm × 150 mm, 3.5 μm)。
流动相:A:B=35:65 (A相:100 mL磷酸盐缓冲液(pH 6.0)中加入300 mL蒸馏水;B相:520 mL甲醇与40 mL乙腈混合均匀,V/V),流速:1.0 mL/min,柱温30 ℃;紫外检测器波长:254 nm;进样量20 μL。
1.7 氨基酸检测方法样品前处理方法如下。胞外样品:将发酵液置于2 mL离心管内,12 000 r/min离心10 min,取上清液保存于4 ℃冰箱;胞内样品:取15 mL发酵液,2 000 r/min、4 ℃离心5 min。取出8 mL上清于20 mL离心管中,快速加入0 ℃预冷的2.5%氯化钠(W/V)溶液10 mL,迅速混匀后,10 000 r/min、4 ℃离心5 min,去上清。剩余细胞团用2.5%碳酸铵(W/V,4 ℃)溶液洗涤2次,加入3 mL 80%甲醇(V/V)抽提5 min,10 000 r/min、4 ℃离心5 min,收集上清,冻干,4 ℃保存。
样品衍生化方法:胞内冻干样品加600 μL蒸馏水溶解,从中取出500 μL,胞外样品直接取500 μL,加入10 μL 7 mol/L氢氧化钠溶液使pH呈碱性,再加500 μL无水乙醇与吡啶的混合液(无水乙醇:吡啶=4:1),轻轻振荡均匀。加100 μL氯甲酸乙酯(ECF),超声1 min。再加100 μL ECF,超声1 min。加500 μL含1% ECF的氯仿和200 μL饱和碳酸氢钠,振荡1 min,加40 μL内标溶液后移至2 mL离心管,静置5 min,3 000 r/min离心5 min。取下层至预先装有无水硫酸钠粉末的1.5 mL离心管中。3 000 r/min离心5 min,将上清液用移液器转入气相瓶中,待检测。
氨基酸用气相色谱(GC)方法测量,使用Agilent 7890A气相色谱仪检测[6]。
色谱柱:Agilent HP-5 column (30 m×0.32 mm× 0.25 μm);载气为氮气,柱流速:1.5 mL/min;样品进样量为1 μL,不分流进样;进样口温度为280 ℃;柱温程序:起始温度70 ℃,保持5 min,以10 ℃ /min速度升温至280 ℃,保持5 min,全过程31 min;检测器:氢火焰离子化检测器(FID),温度280 ℃。载气流量:30 mL/min,氢气流量:30 mL/min,空气流量:300 mL/min。
1.8 数据处理每个实验重复3个平行,采用Origin9.0进行数据处理和显著性分析;采用SPSS 18.0进行数据处理和统计分析,其中显著性分析选用Duncan多范围检验法。
2 结果与分析2.1 外源支链氨基酸添加对地衣芽胞杆菌DW2杆菌肽发酵效价的影响首先研究了在杆菌肽发酵的不同时间点添加支链氨基酸对杆菌肽效价的影响。选取的时间点为0、6、12、18、24 h,支链氨基酸的添加浓度为0.08 g/L。杆菌肽发酵结果表明,分别在18 h时添加Ile和在24 h添加Leu时杆菌肽的效价最高(图 1A和图 2A),相比于对照组分别提高了16%和6%。而添加Val对杆菌肽的效价基本没有影响(图 3)。随后,研究了添加不同浓度的Ile和Leu对杆菌肽效价的影响。添加浓度为0.04、0.08、0.12 g/L,添加时间分别为18 h和24 h。发酵结果表明,当Ile添加浓度为0.08 g/L时,杆菌肽的效价最高,达到900.7 U/mL,相比于对照组提高了17% (图 1 B);当Leu添加浓度为0.04 g/L时,杆菌肽的效价最高,达到871.6 U/mL,相比于对照组提高了7% (图 2 B)。说明Ile和Leu的添加可以提高杆菌肽效价,其中Ile的添加效果较为明显。
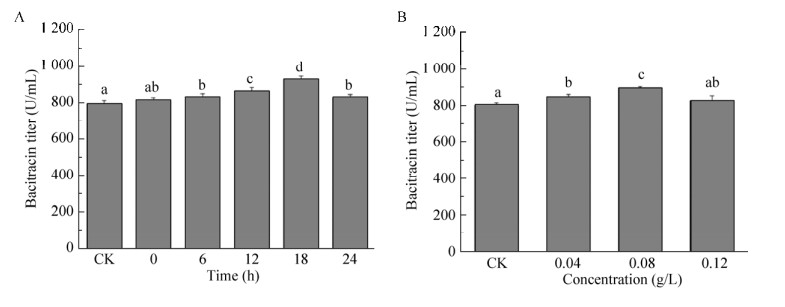 |
| 图 1 外源Ile添加对地衣芽胞杆菌DW2杆菌肽发酵效价的影响(A:不同时间点添加0.08 g/L Ile对杆菌肽发酵效价影响;B:18 h添加不同浓度的Ile对杆菌肽发酵效价影响) Figure 1 Effects of Ile addition on the bacitracin production. (A) The effects of 0.08 g/L Ile addition at different time on bacitracin production. (B) The effects of different concentrations of Ile addition at 18 h on bacitracin production. The different letters indicated the significant differences of bacitracin titers when Isoleucine addition (P < 0.05). |
| 图选项 |
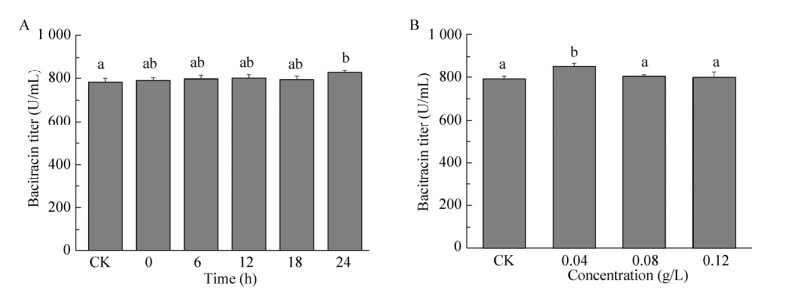 |
| 图 2 外源Leu添加对地衣芽胞杆菌DW2杆菌肽发酵效价的影响(A:不同时间点添加0.08 g/L Leu对杆菌肽发酵效价影响;B:24 h添加不同浓度的Leu对杆菌肽发酵效价影响) Figure 2 Effects of Leu addition on the bacitracin production. (A) The effects of 0.08 g/L Leu addition at different time on bacitracin production. (B) The effects of different concentrations of Leu addition at 24 h on bacitracin production. The different letters indicated the significant differences of bacitracin titers when Leucine addition (P < 0.05). |
| 图选项 |
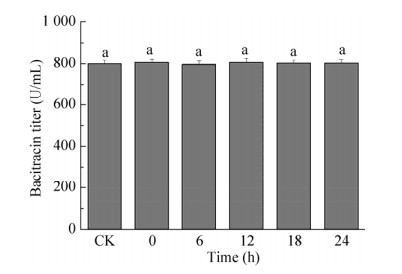 |
| 图 3 外源Val添加对地衣芽胞杆菌DW2杆菌肽发酵效价的影响 Figure 3 Effects of Val addition on the bacitracin production. The different letters indicated the significant differences of bacitracin titers when Valine addition (P < 0.05). |
| 图选项 |
2.2 不同表达水平转运蛋白YhdG对地衣芽胞杆菌DW2杆菌肽发酵效价的影响上述支链氨基酸添加实验结果表明,提高Ile和Leu的供给可以提高杆菌肽的效价,其中Ile的添加可以显著提高杆菌肽效价。转运蛋白是影响胞内氨基酸供应的重要因素,枯草芽胞杆菌中支链氨基酸转运蛋白YhdG负责向细胞内转运包括支链氨基酸在内的多种氨基酸,并且被认为是最有效的Ile摄取转运蛋白[19]。因此,我们为了探究转运蛋白YhdG对杆菌肽发酵效价的影响,分别构建了yhdG游离强化表达工程菌DW2/ pHY-yhdG和yhdG缺失工程菌DW2△yhdG。随后进行杆菌肽发酵,发酵结果如图 4所示,转运蛋白YhdG缺失后可以提高杆菌肽效价,DW2△yhdG杆菌肽效价达到917.35 U/mL,与原始菌DW2相比提高了11%。强化表达YhdG后,杆菌肽效价有所下降,相比于对照菌株DW2/pHY300降低了25%。上述结果表明,yhdG的缺失有利于杆菌肽的合成,这与我们预期的结果相反。
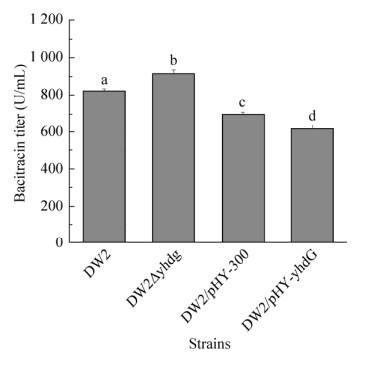 |
| 图 4 不同表达水平的转运蛋白YhdG对地衣芽胞杆菌杆菌肽发酵效价的影响 Figure 4 Effect of different expression levels of permease YhdG on bacitracin yield. The different letters indicated the significant differences of bacitracin titers among recombinant strains (P < 0.05). |
| 图选项 |
为了确定转运蛋白YhdG的表达水平的确会影响杆菌肽效价,我们检测了yhdG游离强化表达工程菌DW2/pHY-yhdG和yhdG缺失工程菌DW2△yhdG中基因yhdG在发酵30 h (杆菌肽快速合成期)的转录水平。结果如图 5所示,DW2△yhdG中基因yhdG的转录水平为0,说明该基因在DW2△yhdG被成功敲除。而DW2/pHY-yhdG中yhdG的转录水平为对照菌株DW2/pHY300的32.65倍,说明YhdG强化表达菌株中yhdG的转录水平显著提高。以上结果进一步说明yhdG表达量越低,越有利于杆菌肽的合成。
 |
| 图 5 yhdG缺失和强化对yhdG转录水平的影响 Figure 5 Effects of deficiency and overexpression of yhdG on the yhdG transcriptional level. ?P < 0.05 and ??P < 0.01 indicate the significance levels between recombinant strains and control strain. |
| 图选项 |
2.3 转运蛋白基因yhdG缺失对杆菌肽发酵过程不同时期胞内外支链氨基酸浓度的影响为了进一步确证转运蛋白YhdG是通过影响胞内外支链氨基酸浓度从而影响杆菌肽效价的,我们随后检测了DW2△yhdG和出发菌株DW2在杆菌肽合成不同时期的胞内、胞外氨基酸含量。通过检测杆菌肽发酵过程中24 h (杆菌肽合成初期)、30 h (杆菌肽快速合成期)和48 h (发酵终点)的胞内外支链氨基酸浓度,发现与对照菌相比,工程菌DW2△yhdG的胞内、胞外的支链氨基酸浓度在杆菌肽合成初期基本一致,但是在杆菌肽快速合成期和发酵终点时,胞内支链氨基酸的浓度远高于对照菌株地衣芽胞杆菌DW2。如图 6所示,在30 h杆菌肽快速合成时期,DW2△yhdG胞内支链氨基酸(异亮氨酸、缬氨酸和亮氨酸)的浓度分别达到24.51、11.18、21.25 μg/mL,分别比地衣芽胞杆菌DW2提高了6.27、5.36、5.9倍;而在48 h发酵终点,DW2△yhdG胞内支链氨基酸(异亮氨酸、缬氨酸和亮氨酸)的浓度分别为22.59、14.54、25.18 μg/mL,仍然比对照菌株地衣芽胞杆菌DW2的支链氨基酸浓度提高了5.34、23.69、3.6倍。上述结果表明缺失转运蛋白YhdG的确可以提高胞内支链氨基酸尤其是Ile和Leu的供应,从而达到提高杆菌肽产量的效果。与此同时,DW2△yhdG的胞外支链氨基酸含量在30 h和48 h时与DW2相比都出现了下降。DW2△yhdG胞内胞外支链氨基酸的检测结果表明,转运蛋白YhdG在地衣芽胞杆菌DW2中的功能可能为负责将胞内的支链氨基酸转运到胞外,这与人们之前在枯草芽胞杆菌中得出的结论相反。
 |
| 图 6 缺失转运蛋白YhdG对地衣芽胞杆菌菌株发酵过程中胞内胞外支链氨基酸的影响(A:24 h胞内支链氨基酸浓度;B:30 h胞内支链氨基酸浓度;C:48 h胞内支链氨基酸浓度;D:24 h胞外支链氨基酸浓度;E:30 h胞外支链氨基酸浓度;F:48 h胞外支链氨基酸浓度) Figure 6 Effects of deleting YhdGon the concentrations of intracellular and extracellular BCAA. (A) Concentrations of intracellular amino acids at 24 h. (B) Concentrations of intracellular amino acids at 30 h. (C) Concentrations of intracellular amino acids at 48 h. (D) Concentrations of extracellular amino acids at 24 h. (E) Concentrations of extracellular amino acids at 30 h. (F) Concentrations of extracellular amino acids at 48 h. *P < 0.05;**P < 0.01. |
| 图选项 |
有研究表明YhdG在枯草芽胞杆菌中,除了负责支链氨基酸的摄入,还参与丙氨酸(Ala)、苏氨酸(Thr)、丝氨酸(Ser)、半胱氨酸(Cys)和天冬氨酸(Asp)的转运。因此,我们随后检测了20种常见氨基酸的其他17种氨基酸,其中精氨酸没有检测到。氨基酸检测结果发现DW2△yhdG的胞内Ala、甘氨酸(Gly)、脯氨酸(Pro)和甲硫氨酸(Met)的含量在杆菌肽合成后期高于DW2(图 7)。这表明在地衣芽胞杆菌DW2中氨基酸转运蛋白YhdG并不是支链氨基酸的特异性转运蛋白,其功能可能为负责将胞内氨基酸运输到胞外。
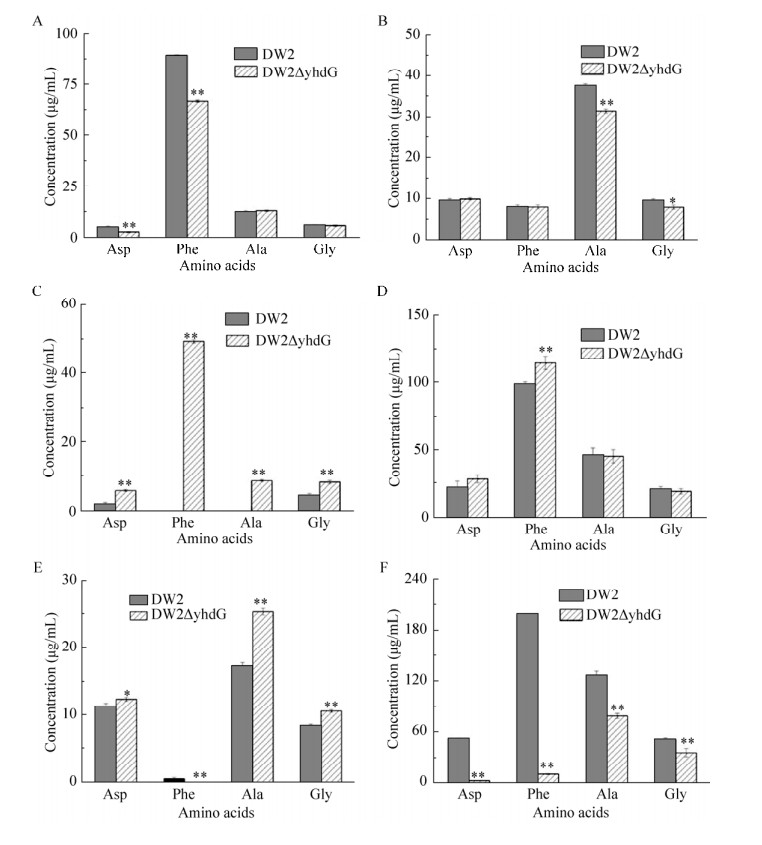 |
| 图 7 缺失转运蛋白YhdG对地衣芽胞杆菌杆菌肽发酵过程的其他氨基酸的影响(A:24 h胞内氨基酸浓度;B:30 h胞内氨基酸浓度;C:48 h胞内氨基酸浓度;D:24 h胞外氨基酸浓度;E:30 h胞外氨基酸浓度;F:48 h胞外氨基酸浓度) Figure 7 Effect of deficiency of yhdG on the transportation of other amino acids during the bacitracin fermentation. (A) Concentrations of intracellular amino acids at 24 h. (B) Concentrations of intracellular amino acids at 30 h. (C) Concentrations of intracellular amino acids at 48 h. (D). Concentrations of extracellular amino acids at 24 h. (E) Concentrations of extracellular amino acids at 30 h; (F) Concentrations of extracellular amino acids at 48 h. *P < 0.05, **P < 0.01. |
| 图选项 |
2.4 地衣芽胞杆菌DW2△yhdG发酵过程曲线上述实验结果表明,工程菌DW2△yhdG的杆菌肽效价高于DW2,并且氨基酸检测结果显示其胞内Ile和Leu含量在杆菌肽合成时期的确大幅度提高。随后,为了进一步探究YhdG缺失对发酵过程中菌体生长及杆菌肽合成的影响,我们检测了工程菌DW2△yhdG及对照菌株DW2在发酵过程中的生物量和杆菌肽效价的变化曲线。结果如图 8所示,DW2△yhdG在发酵过程中的生物量略高于原始菌DW2,其原因可能是因为转运蛋白YhdG缺失后,导致胞内支链氨基酸的含量提高,进而提高了支链脂肪酸的合成能力,从而提高了DW2△yhdG发酵过程生物量[24]。与此同时,yhdG缺失菌株在整合发酵过程中的效价都高于对照菌株DW2,这进一步证实了缺失转运蛋白基因yhdG可以提高杆菌肽发酵效价。综上所述,DW2△yhdG具有作为杆菌肽高产菌株的巨大潜力,而缺失转运蛋白YhdG是一种提高杆菌肽产量的合理策略。
 |
| 图 8 工程菌DW2△yhdG在发酵过程中生物量和效价变化曲线 Figure 8 The biomass and bacitracin titer of DW2△yhdG during fermentation. |
| 图选项 |
3 结论本研究首先通过支链氨基酸添加实验证实了提高Ile和Leu的供应可以提高杆菌肽效价,尤其是Ile的添加会显著提高杆菌肽效价。随后通过代谢工程手段敲除了地衣芽胞杆菌氨基酸转运蛋白YhdG,获得了一株高产杆菌肽的地衣芽胞杆菌工程菌DW2△yhdG,其杆菌肽效价达到917.35 U/mL,与原始菌DW2相比提高了11%,并且其生物量也略高于DW2。该研究结果表明DW2△yhdG具有作为杆菌肽高产菌株的巨大潜力,为杆菌肽高产菌株的改造提供了一种新的策略。
支链氨基酸都是杆菌肽的组成氨基酸,但氨基酸添加实验结果却发现只有Ile和Leu添加会提高杆菌肽的效价,其中Ile效果较为显著,而Val添加基本不会影响杆菌肽的效价。同时,其他杆菌肽组成氨基酸添加实验发现,除了Ile和leu外,只有Glu、Cys和Lys的添加会提高杆菌肽的效价[6],这可能与杆菌肽的组成成分和杆菌肽发酵培养基中豆粕中的氨基酸组含量有关。杆菌肽含有A、B1、B2、C......G等多种组分,其中A、B1、B2约占95%以上的生物活性,其中A拥有最高的生物活性[3],而分析杆菌肽A、B1、B2发现A与B1中有两个Ile残基,而Val只在B2中出现。同时,分析杆菌肽发酵培养基中豆粕的氨基酸含量发现,Ile、Leu和Val的比例分别为2.45%、3.70%和2.29%[6],可能相比于细胞生长和合成杆菌肽的需求量,Ile和Leu仍然不足,而Val却已经基本能满足生长和杆菌肽合成所需,这就导致Ile和Leu的添加可以提高杆菌肽效价,而Val添加基本没有影响。
此外,前期研究发现,在枯草芽胞杆菌中转运蛋白YhdG负责通过支链氨基酸的摄入来维持胞内支链氨基酸的供给,因此yhdG的缺失使胞内氨基酸的浓度降低,从而影响氨基酸的供给和目的产物的合成。然而,本研究发现在地衣芽胞杆菌缺失转运蛋白基因yhdG后,胞内支链氨基酸浓度显著提高,胞外支链氨基酸浓度明显降低。以上结果表明,yhdG的缺失提高了胞内支链氨基酸尤其是Ile和Leu的供给水平,与此同时,yhdG缺失菌株中杆菌肽的产量有所提高。另外,当强化表达YhdG时,杆菌肽的产量显著下降,说明强化YhdG的表达降低了胞内氨基酸的供给水平,从而影响了杆菌肽的合成。综上所述,转运蛋白YhdG在地衣芽胞杆菌DW2中的功能可能为负责将胞内的支链氨基酸转运到胞外以维持支链氨基酸的平衡,这与人们之前在枯草芽胞杆菌中得到的结论相反[25-27]。与此同时,我们也检测了20种常见氨基酸中的其余17种氨基酸,发现DW2△yhdG的胞内Ala、Gly、Pro和Met的含量在杆菌肽合成后期高于DW2,由此说明YhdG并不是支链氨基酸的特异性转运蛋白,这与人们之前在枯草芽胞杆菌中得出的结论相一致[19]。
参考文献
| [1] | Drablos F, Nicholson DG, Ronning M. EXAFS study of zinc coordination in bacitracin A.Biochim Biophys Acta, 1999, 1431(2): 433–442.DOI: 10.1016/S0167-4838(99)00064-3 |
| [2] | Hancock RE. Mechanisms of action of newer antibiotics for Gram-positive pathogens.Lancet, 2005, 5(4): 209–218.DOI: 10.1016/S1473-3099(05)70051-7 |
| [3] | Tsuji K, Robertson JH. Improved high-performance liquid chromatographic method for polypeptide antibiotics and its application to study the effects of treatments to reduce microbial levels in bacitracin powder.J Chromatogr, 1975, 112: 663–672.DOI: 10.1016/S0021-9673(00)99995-3 |
| [4] | Azevedo EC, Rios EM, Fukushima K, et al. Bacitracin production by a new strain of Bacillus subtilis. Extraction, purification, and characterization.Appl Biochem Biotechnol, 1993, 42(1): 1–7.DOI: 10.1007/BF02788897 |
| [5] | Pollock TJ, Thorne L, Yamazaki M, et al. Mechanism of bacitracin resistance in gram-negative bacteria that synthesize exopolysaccharides.J Bacteriol, 1994, 176(20): 6229–6237.DOI: 10.1128/jb.176.20.6229-6237.1994 |
| [6] | Wang Q, Zheng H, Wan X, et al. Optimization of inexpensive agricultural by-products as raw materials for bacitracin production in Bacillus licheniformis DW2.Appl Biochem Biotechnol, 2017, 183(4): 1146–1157.DOI: 10.1007/s12010-017-2489-1 |
| [7] | Wang D, Wang Q, Qiu Y, et al. Untangling the transcription regulatory network of the bacitracin synthase operon in Bacillus licheniformis DW2.Res Microbiol, 2017, 168(6): 515–523.DOI: 10.1016/j.resmic.2017.02.010 |
| [8] | Chen X, Xie FL, Zeng XN, et al. Supplementations of ornithine and KNO3 enhanced bacitracin production by Bacillus licheniformis LC-11.Ann Microbiol, 2014, 64(2): 509–514.DOI: 10.1007/s13213-013-0682-1 |
| [9] | Sharma CK, Sharma M. Up Scaling strategies to improve the industrial production of bacitracin at Largescale.Med Chem, 2017, 17(9): 1548–1556. |
| [10] | Aftab MN, Ikram Ul H, Baig S. Systematic mutagenesis method for enhanced production of bacitracin by Bacillus licheniformis mutant strain UV-MN-HN-6.Brazil J Microbiol, 2012, 43(1): 78–88.DOI: 10.1590/S1517-83822012000100009 |
| [11] | Wang Z, wang Y, Xie F, et al. Improvement of acetoin reductase activity enhances bacitracin production by Bacillus licheniformis.Proc Biochem, 2014, 49(12): 2039–2043.DOI: 10.1016/j.procbio.2014.08.017 |
| [12] | Gunnarsson N, Eliasson A, Nielsen J. Control of fluxes towards antibiotics and the role of primary metabolism in production of antibiotics//Brakhage AA, ed. Molecular Biotechnolgy of Fungal beta-Lactam Antibiotics and Related Peptide Synthetases. Advances in Biochemical Engineering/Biotechnology. Berlin: Springer, 2004, 88: 137-178. |
| [13] | Wohlleben W, Mast Y, Muth G, et al. Synthetic biology of secondary metabolite biosynthesis in actinomycetes: Engineering precursor supply as a way to optimize antibiotic production. FEBS Lett, 2012, 586(15): 2171–2176.DOI: 10.1016/j.febslet.2012.04.025 |
| [14] | Gomez C, Horna DH, Olano C, et al. Amino acid precursor supply in the biosynthesis of the RNA polymerase inhibitor streptolydigin by Streptomyces lydicus.J Bacteriol, 2011, 193(16): 4214–4223.DOI: 10.1128/JB.05062-11 |
| [15] | Qiu JF, Zhuo Y, Zhu DQ, et al. Overexpression of the ABC transporter AvtAB increases avermectin production in Streptomyces avermitilis.Appl Microbiol Biot, 2011, 92(2): 337–345.DOI: 10.1007/s00253-011-3439-4 |
| [16] | Hosie AH, Poole PS. Bacterial ABC transporters of amino acids.Res Microbiol, 2001, 152(3/4): 259–270. |
| [17] | Park JH, Oh JE, Lee KH, et al. Rational design of Escherichia coli for L-isoleucine production.ACS Synth Biol, 2012, 1(11): 532–540.DOI: 10.1021/sb300071a |
| [18] | Ma Q, Zhang QW, Xu QY, et al. Systems metabolic engineering strategies for the production of amino acids.Synth Syst Biotechnol, 2017, 2(2): 87–96.DOI: 10.1016/j.synbio.2017.07.003 |
| [19] | Belitsky BR. Role of branched-chain amino acid transport in Bacillus subtilis CodY activity.J Bacteriol, 2015, 197(8): 1330–1338.DOI: 10.1128/JB.02563-14 |
| [20] | Belitsky BR, Brinsmade SR, Sonenshein AL. Intermediate levels of Bacillus subtilis CodY activity are required for derepression of the branched-chain amino acid permease, BraB.PLoS Genet, 2015, 11(10): e1005600.DOI: 10.1371/journal.pgen.1005600 |
| [21] | Belitsky BR, Sonenshein AL. Contributions of multiple binding sites and effector-independent binding to CodY-mediated regulation in Bacillus subtilis.J Bacteriol, 2011, 193(2): 473–484.DOI: 10.1128/JB.01151-10 |
| [22] | Cai DB, Wang H, He PH, et al. A novel strategy to improve protein secretion via overexpression of the SppA signal peptide peptidase in Bacillus licheniformis.Microb Cell Fact, 2017, 16: 70.DOI: 10.1186/s12934-017-0688-7 |
| [23] | Zhu CJ, Xiao F, Qiu YM, et al. Lichenysin production is improved in codY null Bacillus licheniformis by addition of precursor amino acids.Appl Microbiol Biot, 2017, 101(16): 6375–6383.DOI: 10.1007/s00253-017-8352-z |
| [24] | Bentley GJ, Jiang W, Guaman LP, et al. Engineering Escherichia coli to produce branched-chain fatty acids in high percentages.Metab Eng, 2016, 38: 148–158.DOI: 10.1016/j.ymben.2016.07.003 |
| [25] | Liebs P, Riedel K, Graba JP, et al. Formationof some extracellular enzymes during the exponential growth of Bacillus subtilis.Folia Microbiol, 1988, 33: 88–95.DOI: 10.1007/BF02928073 |
| [26] | Molle V, Nakaura Y, Shivers RP, et al. Additional targets of the Bacillus subtilis global regulator CodY identified by chromatin immunoprecipitation and genome-wide transcript analysis.J Bacteriol, 2003, 185(6): 1911–1922.DOI: 10.1128/JB.185.6.1911-1922.2003 |
| [27] | Hengst CD, Groeneveld M, Kuipers OP, et al. Identification and functional characterization of the Lactococcus lactis CodY-regulated branched-chain amino acid permease BcaP (CtrA).J Bacteriol, 2006, 188(9): 3280–3289.DOI: 10.1128/JB.188.9.3280-3289.2006 |
