
 , 堵国成2,4
, 堵国成2,4
 , 陈坚3,4
, 陈坚3,41 江南大学 工业生物技术教育部重点实验室,江苏 无锡 214122;
2 江南大学 糖化学与生物技术教育部重点实验室,江苏 无锡 214122;
3 江南大学 粮食发酵工艺与技术国家工程实验室,江苏 无锡 214122;
4 江南大学 生物工程学院,江苏 无锡 214122
收稿日期:2018-01-10;接收日期:2018-02-26; 网络出版时间:2018-03-14 基金项目:江苏省产学研前瞻性联合研究项目(No. BY2016022-39),国家自然科学基金(No. 31470160)资助
摘要:葡萄糖氧化酶(Glucose oxidase,简称GOD)可氧化葡萄糖生产葡萄糖酸及其衍生物,在新型无抗饲料添加剂的开发中具有良好的应用潜力,但其生产加工过程中尚存在热稳定差的瓶颈问题。本研究采用融合双亲短肽技术提高葡萄糖氧化酶的热稳定性,分别选取8种不同氨基酸长度、不同Linker连接的双亲短肽(Self-assembling peptides,SAPs)融合至黑曲霉来源的葡萄糖氧化酶的N端,构建了8种融合型酶SAP1-GS-GOD、SAP1-PT-GOD、SAP2-PT-GOD、SAP3-PT-GOD、SAP4-PT-GOD、SAP5-PT-GOD、SAP6-PT-GOD、SAP7-PT-GOD,并在毕赤酵母GS115中异源表达。获得的连接PT Linker的融合酶在60 ℃下孵育60 min后的相对酶活均高于初始酶。其中,融合酶SAP5-PT-GOD在60 ℃下孵育30 min的相对酶活为67%,是相同处理条件下初始酶相对酶活的10.9倍。同时,融合酶SAP1-PT-GOD、SAP2-PT-GOD、SAP3-PT-GOD、SAP5-PT-GOD的Kcat/Km值较初始酶均有进一步的提高。研究表明,在葡萄糖氧化酶的N端融合以PT为Linker的目标双亲短肽能有效提高葡萄糖氧化酶的热稳定性,通过对融合酶分子内作用力进行分析,酶分子内氢键的增加对融合酶热稳定性的提高效果最为显著。上述研究获得的热稳定性提高的融合葡萄糖氧化酶及其效果机制分析对提高酶在加工和应用过程中的活性具有重要的研究意义和应用价值。
关键词:融合蛋白 双亲短肽 葡萄糖氧化酶 热稳定性
Enhancing thermal stability of glucose oxidase by fusing amphiphilic short peptide
Chunhui Ren1,4, Juan Zhang1,4

 , Guocheng Du2,4
, Guocheng Du2,4
 , Jian Chen3,4
, Jian Chen3,4 1 Key Laboratory of Industrial Biotechnology, Ministry of Education, Jiangnan University, Wuxi 214122, Jiangsu, China;
2 Key Laboratory of Carbohydrate Chemistry and Biotechnology, Ministry of Education, Jiangnan University, Wuxi 214122, Jiangsu, China;
3 National Engineering Laboratory for Cereal Fermentation Technology, Jiangnan University, Wuxi 214122, Jiangsu, China;
4 College of Bioengineering, Jiangnan University, Wuxi 214122, Jiangsu, China
Received: January 10, 2018; Accepted: February 26, 2018; Published: March 14, 2018
Supported by: The Project of Jiangsu Province and Research Prospective Joint Research (No. BY2016022-39), National Natural Science Foundation of China (No. 31470160)
Corresponding author:Juan Zhang. Tel: +86-510-85918309; E-mail: zhangj@jiangnan.edu.cn
Guocheng Du. E-mail: gcdu@jiangnan.edu.cn
Abstract: Glucose oxidase catalyzes the oxidation of β-D-glucose to gluconic acid and its derivatives, thus shows a great potential in the development of antibiotic-free feed. However, its production and processing still have the problem of poor thermal stability of enzyme activity. In this study, fusion of amphiphilic peptide technology was used to improve the stability of glucose oxidase. Herein, eight self-assembling peptides with different amino acid lengths and Linkers were fused to the N terminus of the glucose oxidase, yielding eight chimeric fusions SAP1-GS-GOD, SAP1-PT-GOD, SAP2-PT-GOD, SAP3-PT-GOD, SAP4-PT-GOD, SAP5-PT-GOD, SAP6-PT-GOD and SAP7-PT-GOD. Then, the 8 recombinant proteins were expressed in P. pastoris GS115. After separation and purification, the stability of glucose oxidase at 60 ℃was determined. The relative enzyme activities of the PT Linker-linked fusion enzyme incubated at 60 ℃ for 60 min were higher than those of the original enzyme, and the relative activity of SAP5-PT-GOD was 67% at 60 ℃ for 30 min, which was 10.9 times higher than that of the initial enzyme with the same treatment. Among them, the Kcat/Km value of SAP1-PT-GOD, SAP2-PT-GOD, SAP3-PT-GOD and SAP5-PT-GOD of the fusion enzyme was further improved than that of the initial enzyme. Through the analysis of the intramolecular force of the fusion enzyme, the increase of the thermal stability of the fusion enzyme is mainly due to the increase of the hydrogen bond. In summary, the study indicates that translational fusion of self-assembling peptides with PT Linker was able to augment the thermo-stability of glucose oxidase, which has certain potential in the production and application of glucose oxidase. The glucose oxidase with improved thermostability obtained in the above study and the related mechanism will play an important role in improving the activity of related enzymes in the proceeding of processing and application.
Key words: fused protein amphiphilic peptide glucose oxidase thermal stability
葡萄糖氧化酶(Glucose oxidase,GOD)是同型二聚体结构,每个亚基分为两个不同的结构域:一个区域主要由β-折叠组成,以非共价键与黄素腺嘌呤二核苷酸(FAD)辅酶分子紧密结合;另一个区域则由4个α-螺旋支撑1个反平行的β-折叠组成,可与底物β-D-葡萄糖结合[1]。该酶能将β-D-葡萄糖催化氧化成葡萄糖酸内酯与过氧化氢,其中葡萄糖酸内酯能够在非酶促反应下转化成葡萄糖酸。葡萄糖氧化酶作为工业酶制剂中的重要成员之一,在食品工业、生物传感器和酶生物燃料电池方面都有广泛应用[2]。
近年来,葡萄糖氧化酶作为替代抗生素的新型饲料酶制剂,具有保护动物肠道、促进消化吸收、提高动物机体免疫力等多种功能[4]。目前,用于饲料行业的葡萄糖氧化酶年需求量可达30万t,年总产值在100亿元以上,其需求量也以每年10%–30%的速度逐年递增[3]。饲料酶等添加剂的制作过程通常需要经过造粒工艺,在该过程中会由于瞬间高温而对酶的活性造成影响。因此,提高GOD的热稳定性,可以有效降低催化反应过程中用于温度控制的水电能耗,并提高GOD制剂化产品的酶活性能,具有良好的应用前景。
目前,提高酶热稳定性的方法主要有非理性设计(如DNA改组、易错PCR、体外随机重组等)以及理性设计(如借助计算机辅助设计突变位点进行定点突变等)。Zheng等利用定向进化提高了木聚糖酶的热稳定性,其最适温度也提高了10 ℃。Yuan等通过增加南极假丝酵母脂肪酶催化活性中心位点的刚性来提高酶的热稳定性,利用迭代饱和突变,获得的突变体D223G/L278M在48 ℃下半衰期增加为野生酶的13倍。但是,由于前者需要建立合适的高通量筛选方法,而后者需要对酶分子结构进行大量的计算模拟,均难以保障方法的高效性和普适性。双亲自组装肽(Self-assembling peptides,SAPs)是由相互交替的亲水性和疏水性氨基酸组成,能够聚集形成有序的纳米结构,主要应用于纳米技术领域、细胞培养和分子电子学。双亲自组装肽的功能取决于氨基酸序列的排列顺序、肽链的长度及其所处环境的理化条件,从而形成各种纳米结构,包括纳米囊泡、纳米管和纳米阀门。近年来,利用SAPs改造酶特性的尝试引起了广泛的关注。Liu等在脂肪氧合酶的N端融合酿酒酵母Zuotin蛋白等来源的6种自组装双亲短肽(SAPs),使该酶在55 ℃的半衰期提高了2.3?4.5倍。进一步的研究表明,Linker的种类对融合酶的性质也有较大的影响[6]。
前人研究表明,毕赤酵母具有翻译后修饰的潜力,并与蛋白质折叠加工、二硫键的形成、特定类型脂质的添加和O-端与N-端糖基化有关,它不仅克服了原核表达系统背景蛋白多、不能表达结构复杂的蛋白质、表达质粒易丢失等缺陷,同时还弥补了高等真核表达系统操作复杂、表达水平低和产业化生产成本高的不足,具有其他酵母表达系统无法比拟的优越之处。在本研究前期的研究中,Gu等已成功将GOD基因在毕赤酵母中表达,同时通过模块化策略获得了高产GOD的菌株,在3 L罐上发酵酶活达到1 972.9 U/mL,是目前报道的GOD的最高酶活水平,本研究是之前研究的延续和深化。本研究选择了8种SAPs,融合于GOD的N端,在毕赤酵母中进行了异源表达。与之前研究中仅用于大肠杆菌表达系统的融合双亲短肽重组酶相比,本研究中以真核生物毕赤酵母作为表达宿主,这对融合酶热稳定性提升策略而言是一次有效的尝试,另外,研究获得的热稳定性提高的GOD融合酶对拓展新型无抗饲料的应用功效亦具有重要的意义。
1 材料与方法1.1 材料1.1.1 菌株与质粒大肠杆菌Escherichia coli DH5α,毕赤酵母Pichia pastoris GS115,重组质粒pPIC9k-GOD。
1.1.2 主要试剂实验中所用的限制性内切酶SnaBⅠ、NotⅠ购自Thermo公司。Prime STAR (HS) DNA聚合酶、T4 DNA连接酶、PCR产物纯化试剂盒等购自TaKaRa公司。SDS-PAGE凝胶试剂盒、蛋白电泳marker购自碧云天公司。实验所用蛋白胨、酵母粉为Oxoid公司购买。筛菌所用遗传霉素G418购自上海生物工程有限公司,引物合成及测序也均由上海生工有限公司完成。其他常规试剂为国产分析纯。
1.1.3 培养基LB:10 g/L胰蛋白胨,5 g/L酵母粉,10 g/L NaCl,pH 7.0。
YPD:10 g/L酵母膏,20 g/L蛋白胨,10 g/L葡萄糖。
MD:13.4 g/L YNB,0.4 mg/L生物素,20 g/L葡萄糖。
BMGY:10 g/L酵母膏,20 g/L蛋白胨,10 g/L甘油,0.1 mmol/L磷酸缓冲液(pH 6.0),13.4 g/L YNB,0.4 mg/L生物素。
BMMY:10 g/L酵母膏,20 g/L蛋白胨,10 g/L甲醇,0.1 mmol/L磷酸缓冲液(pH 6.0),13.4 g/L YNB,0.4 mg/L生物素。
YPD-G418:YNB 13.4 g/L,生物素0.4 mg/L,葡萄糖20 g/L。添加遗传霉素0.25、1.00、2.00、3.00、4.00 mg/mL,用于阳性转化子拷贝数的筛选。
1.2 方法1.2.1 毕赤酵母工程菌Pichia pastoris GS115 (pPIC9K-SAPs-GOD)的构建SAPs的编码基因由江南大学刘松老师惠赠,编码基因序列如表 1所示。同时,针对SAP1的3′端分别引入GS基因和PT基因,针对SAP2、SAP3、SAP4、SAP5、SAP6和SAP7其3′端均引入PT基因。GS基因和PT基因序列见表 2。
表 1 双亲短肽的氨基酸序列Table 1 Amino acid sequences of the self-assembling peptides
| SAPs | Amino acid sequence |
| SAP1 | AEAEAKAKAEAEAKAK |
| SAP2 | AEAEAKAKAEAEAKAKAEAEAKAKAE AEAKAKAEAEAKAKAEAEAKAK |
| SAP3 | AEAEAHAHAEAEAHAH |
| SAP4 | VNYGNGVSCSKTKAPTGARHSKNVILP EPTALFLVSPALLVRVASAVAHLLRRRPRPRRPPRLRP |
| SAP5 | DWLKAFYDKVAEKLKEAFKVEPLRADWLKAFYDKVAEK LKEAF |
| SAP6 | DWLKAFYDKVAEKLKEAFGLLPVLEDWLKAFYDKVAEK LKEAF |
| SAP7 | DWLKAFYDKVAEKLKEAFNGGARLAD WLKAFYDKVAEKLKEAF |
| Note: the linker sequences between the same SAP are marked out of the underline. | |
表选项
表 2 Linker的种类及特性Table 2 Types and characteristics of the linker
| Linker | Amino acid sequence | Characteristics |
| PT linker | PTPPTTPTPPTTPTPTP | Rigid |
| GS linker | GGGGSGGGGSGGGGS | Flexible |
表选项
用表 3中引物扩增SAP1-GS-GOD、SAP1-PT- GOD、SAP2-PT-GOD、SAP3-PT-GOD、SAP4-PT- GOD、SAP5-PT-GOD、SAP6-PT-GOD、SAP7-PT- GOD基因,通过在引物5′和3′端引入线性化pPIC9k-GOD载体末端的同源序列,使得插入片段扩增产物的5′和3′最末端分别带有和线性化克隆载体两末端对应的完全一致的序列(15 bp),其中使用SnaB Ⅰ酶切线性化载体。
表 3 引物序列Table 3 Primer sequences used in this study
| Primer name | Primer sequence (5′–3′) |
| SAP1-GS-F | GAGGCTGAAGCTTACGCAGAAGCAGAAGCGAAAGC |
| SAP1-GS-R | TTCAATGCCATTTACTGGGGTCGGAGTCGGG |
| SAP1-PT-F | GAGGCTGAAGCTTACGCAGAAGCAGAAGCGAAAGC |
| SAP1-PT-R | TTCAATGCCATTTACAGATCCACCTCCACCAGAACC |
| SAP2-PT-F | GAGGCTGAAGCTTACCATCATCATCATCATCATGCAGAA |
| SA2P-PT-R | TTCAATGCCATTTACTGGGGTCGGAGTCGGG |
| SAP3-PT-F | GAGGCTGAAGCTTACCATCATCATCATCATCATGCAGAA |
| SAP3-PT-R | TTCAATGCCATTTACTGGGGTCGGAGTCGGG |
| SAP4-PT-F | GAGGCTGAAGCTTACGTGAATTACGGTAACGGCGTT |
| SAP4-PT-R | TTCAATGCCATTTACTGGGGTCGGAGTCGGG |
| SAP5-PT-F | GAGGCTGAAGCTTACGATTGGCTGAAGGCTTTTTATGA |
| SAP5-PT-R | TTCAATGCCATTTACTGGGGTCGGAGTCGGG |
| SAP6-PT-F | GAGGCTGAAGCTTACGATTGGCTGAAGGCTTTTTATGA |
| SAP6-PT-R | TTCAATGCCATTTACTGGGGTCGGAGTCGGG |
| SAP7-PT-F | GAGGCTGAAGCTTACGATTGGCTGAAGGCTTTTTATGA |
| SAP7-PT-R | TTCAATGCCATTTACTGGGGTCGGAGTCGGG |
| Note: the underlined part of the table is the homologous arm sequence that is consistent with the two terminal sequence of the linearized vector. | |
表选项
将用SnaBⅠ酶切线性化载体和要插入的短肽的序列利用一步克隆法进行同源重组,重组的反应体系见表 4。其中,SAPs-GOD融合表达质粒的构建如图 1所示。
表 4 线性化质粒与短肽序列融合的反应体系Table 4 The reaction system for the linearized plasmids and the short peptids
| Reaction system | Amount |
| 5× CEⅡBuffer | 2 μL |
| Linearized pPIC9k-GOD | 221 ng |
| SAPs | 20 ng |
| ExnaseTMⅡ | 1 μL |
| ddH2O | Add water to 10 μL |
表选项
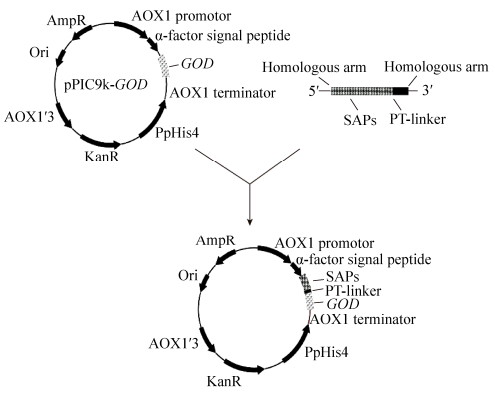 |
| 图 1 pPIC9k-SAPS-GOD重组表达质粒的构建 Figure 1 Construction of pPIC9k-SAPs-GOD. |
| 图选项 |
将重组后的质粒pPIC9k-SAPs-GOD转化至E. coli DH5α感受态细胞中,将转化后的菌液涂布到含有氨苄青霉素的固体LB平板中培养。菌落PCR验证呈阳性的克隆菌株,提取其质粒送到上海生物工程有限公司进行测序。将上述构建得到的重组质粒pPIC9k-SAPs-GOD用快切酶Bgl Ⅱ线性化,将线性化之后的质粒按照毕赤酵母转化手册进行转化。
1.2.2 重组菌的发酵挑取转化后MD板上的转化子25个到含G418抗性的YPD平板上(G418抗性浓度梯度为1、2、3、4 mg/mL),挑取4 mg/mL浓度的抗性YPD板上的重组菌5–10个进行摇瓶发酵。
种子培养:挑取YPD平板上的单菌落到25 mLYPD液体培养基(250 mL摇瓶)中于30 ℃、220 r/min条件下培养18?20 h。
摇瓶发酵:将种子液按10%接入50 mL BMGY培养基中(500 mL摇瓶),30 ℃、220 r/min培养24 h,将所有菌体离心并用等体积生理盐水洗涤2遍,离心,将全部菌体转入到BMMY培养基中。BMMY培养基初始甲醇添加量为1%,在30 ℃、220 r/min条件下诱导产酶,之后每24 h添加1%的甲醇,同时每隔24 h取少量样品进行酶活力测定。
1.2.3 葡萄糖氧化酶的纯化将发酵液在8 000 r/min条件下离心10 min,取上清。将上清液用25 kDa的透析袋在0 ℃ Tris-HCl缓冲液中透析过夜。将透析后所得的酶液用HitrapTM Q HP柱纯化。使用AKTA蛋白纯化仪进行蛋白分离纯化,柱纯化条件如下:用10倍柱体积的缓冲液A (20 mmol/L Tris-HCl缓冲液,pH 7.0)平衡阴离子柱,并以1 mL/min的流速进样;等待进样结束后,使用5个柱体积的缓冲液A冲平柱子;并以0?100%的缓冲液B (20 mmol/L Tris-HCl+100 mmol/L NaCl缓冲液,pH 7.0)以3 mL/min的流速进行线性洗脱。在60?80 mmol/L NaCl浓度时出现紫外吸收峰,对出现紫外吸收峰的样品进行收集,测定酶活,并于4 ℃条件下保存酶液。
1.2.4 葡萄糖氧化酶酶活的测定葡萄糖氧化酶GOD酶活的测定:先后加入2.5 mL邻联茴香胺、0.3 mL 18%葡萄糖、0.1 mL辣根过氧化物酶,于35 ℃条件下保温2 min,然后加入0.1 mL酶液,35 ℃条件下反应3 min,并用2 mol/L的硫酸终止反应。其中酶活测定过程中所需各溶液的配置如下:1)柠檬酸缓冲液(pH 6.0):一水合柠檬酸(C6H8O7·H2O) 3.95 g/L,二水合柠檬酸钠(Na3C6H5O7·2H2O) 23.82 g/L,调节pH为6.0;2)邻联茴香胺溶液:1 g邻联茴香胺加在100 mL甲醇中搅拌溶解制成浓缩存储液。现用现配,取0.1 mL浓缩液加入到上述柠檬酸缓冲液12 mL中混匀;3) 18%葡萄糖水溶液:葡萄糖180 g/L;4)辣根过氧化物酶液:根据不同产品实际稀释至100 U/mL。
葡萄糖氧化酶GOD酶活的定义:每分钟转化1 μmol葡萄糖为葡萄糖酸和过氧化氢所需的酶量为一个单位,用U表示。其中葡萄糖氧化酶酶活的计算方法如下:
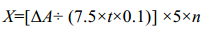 |
1.2.5 SDS-PAGE分析SDS-PAGE分析使用碧云天试剂盒SDS-PAGE预制胶,方法参照使用说明书。并使用0.1%考马斯亮蓝R-250进行染色。
1.2.6 蛋白浓度测定蛋白浓度测定使用碧云天Bradford试剂盒,方法参照使用说明书。同时通过酶活和蛋白浓度计算出葡萄糖氧化酶的比酶活。
1.2.7 葡萄糖氧化酶最适反应温度和温度稳定性的测定最适反应温度的测定:将纯化后的GOD酶液置于相同的测定体系中,在不同的温度(20 ℃、25 ℃、30 ℃、35 ℃、40 ℃、45 ℃、50 ℃、55 ℃、60 ℃、65 ℃、70 ℃、80 ℃)条件下,测定其酶活。并将最高酶活值作为100%。
温度稳定性的测定:将纯化后的GOD酶液分别在60 ℃条件下热浴60 min,每隔10 min测定其相对酶活。将未热浴处理的酶活作为100%。
1.2.8 葡萄糖氧化酶最适反应pH和pH稳定性的测定最适反应pH的测定:将纯化后的GOD酶液置于相同的测定体系中,在pH 2.0?9.0 (pH 2.0? 8.0 20 mmol/L柠檬酸-磷酸氢二钠缓冲液,pH 9.0 20 mmol/L Tris-HCl缓冲液)条件下,测定其酶活。并将最高酶活值作为100%。
pH稳定性的测定:将纯化后的GOD酶液分别在pH 2.0?9.0条件下于35 ℃保温处理1 h,并测定其相对酶活。将最高酶活值作为100%。
1.2.9 葡萄糖氧化酶动力学参数的测定葡萄糖氧化酶GOD动力学参数的测定按照乒乓机制的双底物(β-D-葡萄糖和氧气)反应进行。GOD在氧化反应中可以催化不同底物,如氧、醌类物,而在还原反应中对底物β-D-葡萄糖专一性严格。本研究中在测定动力学常数时,反应体系中的氧使用对苯醌代替。反应中葡萄糖底物的浓度范围为0?200 mmol/L,对苯醌底物浓度范围为0?10 mmol/L。利用乒乓反应动力学方程双倒数作图法求出酶的动力学参数。本研究中的酶学常数均是针对葡萄糖底物作为主要研究对象。动力学方程如下:
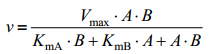 |
2 结果与分析2.1 葡萄糖氧化酶与双亲短肽融合酶的制备双亲自组装肽(Self-assembling peptides,SAPs)由相互交替的亲水性和疏水性氨基酸形成,能够聚集形成有序的纳米结构。本研究选用常见的GS柔性Linker和PT刚性Linker,首先将SAP1分别与柔性Linker和刚性Linker进行连接,然后与GOD进行融合。将这两株重组菌进行发酵,并将发酵液进行纯化,测定其相关酶学性质,发现连接柔性Linker时融合酶的热稳定性较连接刚性Linker时差,因此在之后的改造研究中,将SAPs均与刚性Linker PT进行连接。
将初始酶与融合酶的发酵上清进行分离纯化,使用阴离子柱HitrapTM Q HP对其进行纯化,在60?80 mmol/L NaCl浓度时出现紫外吸收峰,并对出现紫外吸收峰的样品进行收集。SDS-PAGE结果如图 2所示。
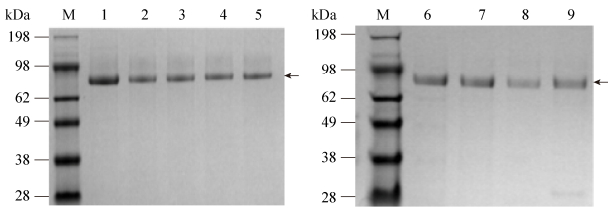 |
| 图 2 GOD纯化后的SDS-PAGE图谱 Figure 2 SDS-PAGE analysis of the purified GOD. M: molecular weight standard of protein; lane 1: initial enzyme; lane 2: SAP1-GS-GOD; lane 3: SAP1-PT-GOD; lane 4: SAP2-PT-GOD; lane 5: SAP3-PT-GOD; lane 6: SAP4-PT-GOD; lane 7: SAP5-PT-GOD; lane 8: SAP6-PT-GOD; lane 9: SAP7-PT-GOD. |
| 图选项 |
2.2 融合酶动力学参数分析为了研究融合双亲短肽对重组葡萄糖氧化酶的影响,本研究考察了各个融合酶的动力学参数。如表 5所示,融合酶SAP1-PT-GOD、SAP2-PT- GOD、SAP3-PT-GOD、SAP4-PT-GOD、SAP5-PT- GOD、SAP6-PT-GOD的Km值较初始酶均明显降低,其中SAP2-PT-GOD最为显著,Km值仅为初始酶的56%。同时,融合酶SAP2-PT-GOD、SAP5- PT-GOD的催化效率较初始酶提高最为显著,较初始酶分别提升了40%和27%。
表 5 初始酶及融合酶的比酶活和动力学常数Table 5 Kinetic parameters and specific activities of initial GOD and fusion enzymes
| Enzyme | Vmax (mmol/(L·mg·s)) | Km (mmol/L) | Kcat (1/s) | Kcat/Km (mmol/(L?s)) |
| Initial enzyme | 5.52±0.28 | 33.77±1.55 | 577.13±1.10 | 17.09 |
| SAP1-GS-GOD | 1.95±0.11 | 20.42±1.78 | 272.68±1.24 | 13.35 |
| SAP1-PT-GOD | 4.05±0.26 | 19.08±1.87 | 357.67±2.21 | 18.74 |
| SAP2-PT-GOD | 2.93±0.21 | 20.96±1.67 | 499.56±1.31 | 23.83 |
| SAP3-PT-GOD | 1.98±0.13 | 20.62±1.72 | 395.36±2.09 | 19.17 |
| SAP4-PT-GOD | 2.13±0.16 | 32.00±1.70 | 478.40±1.62 | 14.82 |
| SAP5-PT-GOD | 2.85±0.22 | 20.68±1.54 | 447.45±1.29 | 21.64 |
| SAP6-PT-GOD | 1.94±0.09 | 27.18±1.13 | 400.05±1.70 | 14.72 |
| SAP7-PT-GOD | 1.88±0.26 | 33.95±1.21 | 449.11±2.27 | 13.23 |
| Note: the kinetic constants of these enzymes are all directed towards substrate glucose. The kinetic parameters of the enzyme are the average of the 3 experimental results, and the error is less than 5%. | ||||
表选项
2.3 融合SAPs对葡萄糖氧化酶最适反应温度及其温度稳定性的影响为了测定初始GOD和融合酶最适反应温度及其热稳定性的差异,我们选择温度梯度20 ℃?80 ℃测定其最适温度,并于60 ℃进行热处理60 min,测定其耐高温的能力。如图 3A所示,融合酶SAP1-GS-GOD的最适温度为30 ℃,SAP1-PT-GOD、SAP2-PT-GOD、SAP3-PT-GOD融合酶和初始酶的最适温度均为35 ℃,SAP4-PT-GOD的最适温度为40 ℃,SAP5-PT- GOD、SAP6-PT-GOD和SAP7-PT-GOD的最适温度为45 ℃。由图 3B可得,将初始酶和融合酶在60 ℃条件下处理60 min,60 min后连接PT Linker的融合酶的酶活残留较初始酶均有所提高,只有连接GS Linker的融合酶的酶活残留较初始酶降低。其中,融合酶SAP5-PT-GOD在60 ℃热处理30 min后,其残留酶活为67%,是相同热处理条件下初始酶的10.9倍。其他融合酶SAP1-PT-GOD、SAP2-PT-GOD、SAP3-PT- GOD、SAP4-PT-GOD、SAP6-PT-GOD、SAP7-PT- GOD在60 ℃热处理30 min后,相对初始酶的残留酶活分别提高了1.8、2.0、1.7、2.6、3.8和2.6倍。综上,通过对比SAP1-GS-GOD和SAP1-PT-GOD,可以看出双亲短肽与酶之间连接刚性Linker PT在热稳定性方面要比连接柔性Linker GS效果好。
 |
| 图 3 温度对初始GOD与SAPs-GOD融合酶的活性(A)与稳定性(B)的影响 Figure 3 Effects of temperature on the activity and stability of initial GOD and SAPs-GOD. (A) Effects of temperature on the activity of initial GOD and SAPs-GOD. (B) Effects of 60 ℃ on the stability of initial GOD and SAPs-GOD. |
| 图选项 |
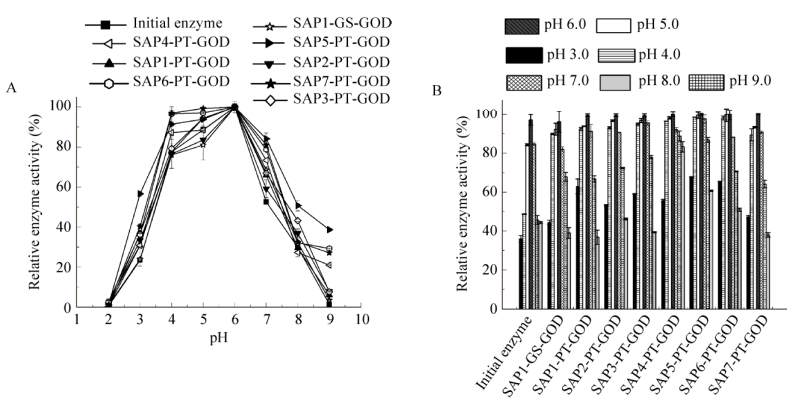
2.4 融合SAPs对葡萄糖氧化酶最适反应pH及其pH稳定性的影响由图 4A可知,融合酶与初始酶的最适pH,均为6.0,但融合酶pH的范围有所拓宽。通过对比SAP1-GS-GOD和SAP1-PT-GOD (图 4 B),可以看出双亲短肽与酶之间连接刚性Linker PT在pH稳定性方面要比连接柔性Linker GS效果好。连接刚性Linker PT的融合酶在pH 4.0?6.0的范围内,其相对酶活均在90%以上,明显高于初始酶。
 |
| 图 4 pH对初始GOD与SAPs-GOD融合酶的活性(A)和稳定性(B)的影响 Figure 4 Effects of pH on the activity and stability of initial GOD and SAPs-GOD. (A) Effects of pH on the activity of initial GOD and SAPs-GOD. (B) Effects of pH on the stability of initial GOD and SAPs-GOD. |
| 图选项 |
2.5 融合SAPs对葡萄糖氧化酶热稳定性提高的机制根据前人研究,将短肽融合到酶的N端或C端提高酶分子稳定性的机制主要为:分子局部刚性增加和酶分子的寡聚作用[15]。本研究使用PIC在线服务器分析了融合酶SAPs-GOD分子内作用力的变化(表 6)。根据表 6结果可以看出,融合酶SAP2-PT-GOD中的疏水相互作用较初始酶增加了2个,SAP4-PT-GOD、SAP5-PT-GOD、SAP6- PT-GOD和SAP7-PT-GOD中的疏水相互作用较初始酶均增加了6个。根据已有研究,疏水性是蛋白质单体发生聚集的主要作用力。此外,大量关于嗜热蛋白的研究表明,寡聚能够增强蛋白质单体间的相互作用并固定N端、C端及高柔性loop,从而提高蛋白质的热稳定性。因此,本研究认为短肽自身的疏水性使融合酶发生不同程度的寡聚,从而导致了融合酶热稳定性的增加。另外,SAP2-PT-GOD分子中的总氢键较初始酶增加了3个,SAP1-GS-GOD分子中的总氢键较初始酶降低了2个,SAP1-PT-GOD和SAP3-PT-GOD融合酶中的总氢键没有变化,SAP4-PT-GOD、SAP5-PT-GOD、SAP6-PT-GOD和SAP7-PT-GOD融合酶中的总氢键较初始酶有所下降。通过对融合酶和初始酶氢键类型与数目变化的具体分析,SAP4-PT-GOD、SAP5-PT-GOD、SAP6-PT-GOD和SAP7-PT-GOD融合酶中主链与主链之间的氢键较初始酶增加了19个,其他种类的氢键数目均有不同程度的下降,对照2.3中的结果,这4种酶的热稳定性提高最为明显。因此,融合酶中主链与主链之间氢键的增加是这几种融合酶热稳定性增加的主要原因,其他类型氢键对融合酶的热稳定性影响不大。以上结果分析表明,分子内作用力的改变可能是融合酶热稳定性提高的原因,其中分子内疏水相互作用及主链与主链之间的氢键的增加对本研究中融合酶热稳定性的影响最为显著[24-25]。
表 6 初始GOD及SAPs-GOD融合酶分子内作用力分析Table 6 Analysis of intramolecular interaction of initial GOD and SAPs-GOD fusion enzymes
| Intramolecular force | Initial enzyme | SAP1-GS- GOD | SAP1-PT- GOD | SAP2-PT- GOD | SAP3-PT- GOD | SAP4-PT- GOD | SAP5-PT- GOD | SAP6-PT- GOD | SAP7-PT- GOD |
| Hydrophobic interaction | 501 | 501 | 501 | 503 | 501 | 507 | 507 | 507 | 507 |
| Main chain-main chain hydrogen bonds | 600 | 596 | 600 | 598 | 600 | 619 | 619 | 619 | 619 |
| Main chain-side chain hydrogen bonds | 286 | 294 | 286 | 296 | 286 | 272 | 272 | 272 | 272 |
| Side chain-side chain hydrogen bonds | 281 | 275 | 281 | 276 | 281 | 243 | 243 | 243 | 243 |
| Ionic interactions | 45 | 45 | 45 | 46 | 45 | 44 | 44 | 44 | 44 |
| Disulfide bonds | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 | 1 |
表选项
另外,SAP1-GS-GOD和SAP1-PT-GOD的Linker分别为柔性和刚性,使用刚性的Linker更有利于GOD热稳定性的提高。对于由刚性Linker PT连接的7种融合酶,SAP2-PT-GOD、SAP4-PT- GOD、SAP5-PT-GOD、SAP6-PT-GOD和SAP7-PT- GOD的热稳定性较SAP1-PT-GOD、SAP3-PT- GOD提高得多,表明融合短肽的长度可能是影响热稳定性的另一重要因素,且连接的双亲短肽其氨基酸长度越长融合酶热稳定性提升越多[15]。
3 讨论随着葡萄糖氧化酶在食品、医药、饲料等领域越来越多的应用,由于在工业化大规模生产及应用过程中,温度的调控具有迟滞性,同时酶的制剂化过程中对酶的活性造成较大程度的损害。因此提高葡萄糖氧化酶的热稳定性具有重大的意义。本研究利用自组装双亲短肽融合到葡萄糖氧化酶的N端,有效地提高了葡萄糖氧化酶的热稳定性,同时对于其pH稳定性也有一定程度的提高。研究表明,连接PT Linker的融合酶的热稳定性较连接GS Linker高,双亲短肽的氨基酸序列越长融合酶的热稳定性越高。综上表明,通过调整双亲短肽连接Linker的种类以及短肽氨基酸序列的长度,可以获得热稳定性显著提高的融合酶。此外,相较之前仅以大肠杆菌等原核生物作为表达宿主进行的研究,本研究将真核生物毕赤酵母作为表达宿主,对应用双亲短肽融合技术提高真核生物外源蛋白表达的酶学稳定性具有一定的理论意义和应用价值。
参考文献
| [1] | Bankar SB, Bule MV, Singhal RS, et al. Glucose oxidase—an overview.Biotechnol Adv, 2009, 27(4): 489–501.DOI: 10.1016/j.biotechadv.2009.04.003 |
| [2] | Dubey MK, Zehra A, Aamir M, et al. Improvement strategies, cost effective production, and potential applications of fungal glucose oxidase (GOD): current updates.Front Microbiol, 2017, 8: 1032.DOI: 10.3389/fmicb.2017.01032 |
| [3] | Blazic M, Kovacevic G, Prodanovic O, et al. Yeast surface display for the expression, purification and characterization of wild-type and B11 mutant glucose oxidases.Protein Expr Purif, 2013, 89(2): 175–180.DOI: 10.1016/j.pep.2013.03.014 |
| [4] | Zhang HL, Li J. Enzyme preparation feed additive—glucose oxidase.Chin Feed Addit, 2014(9): 15–16.(in Chinese). 张洪丽, 李娟. 酶制剂类饲料添加剂——葡萄糖氧化酶.中国饲料添加剂, 2014(9): 15-16. |
| [5] | Huo F, Song DZ, Tang SW. Application of glucose oxidase in feed.Feed and Husbandry, 2014(4): 37–40.(in Chinese). 霍芳, 宋道祯, 汤少伟. 葡萄糖氧化酶在饲料中的应用进展.饲料与畜牧, 2014(4): 37-40. |
| [6] | Fang JC, You RQ, Song C, et al. Production of glucose oxidase and its application in feed industry.Feed Rev, 2015(10): 1–7.(in Chinese). 方军成, 尤瑞祺, 宋聪, 等. 葡萄糖氧化酶的生产及其在饲料工业中的应用.饲料博览, 2015(10): 1-7.DOI:10.3969/j.issn.1001-0084.2015.10.001 |
| [7] | Yu HR, Huang H. Engineering proteins for thermostability through rigidifying flexible sites.Biotechnol Adv, 2014, 32(2): 308–315.DOI: 10.1016/j.biotechadv.2013.10.012 |
| [8] | Dend ZM, Yang HQ, Shin HD, et al. Structure-based rational design and introduction of arginines on the surface of an alkaline α-amylase from Alkalimonas amylolytica for improved thermostability.Appl Microbiol Biotechnol, 2014, 98(21): 8937–8945.DOI: 10.1007/s00253-014-5790-8 |
| [9] | Fang ZM, Zhou P, Chang F, et al. Structure-based rational design to enhance the solubility and thermostability of a bacterial laccase Lac15.PLoS ONE, 2014, 9(7): e102423.DOI: 10.1371/journal.pone.0102423 |
| [10] | Padilla-Martínez SG, Martínez-Jothar L, Sampedro JG, et al. Enhanced thermal stability and pH behavior of glucose oxidase on electrostatic interaction with polyethylenimine.Int J Biol Macromol, 2015, 75: 453–459.DOI: 10.1016/j.ijbiomac.2015.02.005 |
| [11] | Zheng HC, Liu YH, Sun MZ, et al. Improvement of alkali stability and thermostability of Paenibacillus campinasensis Family-11 xylanase by directed evolution and site-directed mutagenesis.J Ind Microbiol Biotechnol, 2014, 41(1): 153–162.DOI: 10.1007/s10295-013-1363-6 |
| [12] | Xie Y, An J, Yang GY, et al. Enhanced enzyme kinetic stability by increasing rigidity within the active site.J Biol Chem, 2014, 289(11): 7994–8006.DOI: 10.1074/jbc.M113.536045 |
| [13] | Chen XY, Zaro JL, Shen WC. Fusion protein linkers: property, design and functionality.Adv Drug Deliv Rev, 2013, 65(10): 1357–1369.DOI: 10.1016/j.addr.2012.09.039 |
| [14] | Fatouros DG, Lamprou DA, Urquhart AJ, et al. Lipid-like self-assembling peptide nanovesicles for drug delivery.ACS Appl Mater Interfaces, 2014, 6(11): 8184–8189.DOI: 10.1021/am501673x |
| [15] | Lu XY, Liu S, Zhang DX, et al. Enhanced thermal stability and specific activity of Pseudomonas aeruginosa lipoxygenase by fusing with self-assembling amphipathic peptides.Appl Microbiol Biotechnol, 2013, 97(21): 9419–9427.DOI: 10.1007/s00253-013-4751-y |
| [16] | Zhao HL, Yao XQ, Xue C, et al. Increasing the homogeneity, stability and activity of human serum albumin and interferon-α2b fusion protein by linker engineering.Protein Expr Purif, 2008, 61(1): 73–77.DOI: 10.1016/j.pep.2008.04.013 |
| [17] | Amet N, Lee HF, Shen WC. Insertion of the designed helical linker led to increased expression of Tf-based fusion proteins.Pharm Res, 2009, 26(3): 523–528.DOI: 10.1007/s11095-008-9767-0 |
| [18] | Mu QX, Hu MR, Chen F, et al. High-level production of glucose oxidase by recombinant Pichia pastoris using a combined strategy.Chin J Biotech, 2016, 32(7): 986–990.(in Chinese). 牟庆璇, 胡美荣, 陈飞, 等. 采用混合策略提高葡萄糖氧化酶在毕赤酵母中的表达水平.生物工程学报, 2016, 32(7): 986-990. |
| [19] | Shen YN, Gu L, Zhang J, et al. Effects of mixed carbon sources on glucose oxidase production by recombinant Pichia pastoris.Chin J Biotech, 2013, 29(7): 927–936.(in Chinese). 沈伊娜, 顾磊, 张娟, 等. 双碳源流加对重组毕赤酵母高效表达葡萄糖氧化酶的影响.生物工程学报, 2013, 29(7): 927-936. |
| [20] | Gu L, Zhang J, Liu BH, et al. High-level extracellular production of glucose oxidase by recombinant Pichia pastoris using a combined strategy.Appl Biochem Biotechnol, 2015, 175(3): 1429–1447.DOI: 10.1007/s12010-014-1387-z |
| [21] | Bankar SB, Bule MV, Singhal RS, et al. Optimization of Aspergillus niger fermentation for the production of glucose oxidase.Food Bioprocess Technol, 2009, 2(4): 344–352.DOI: 10.1007/s11947-007-0050-x |
| [22] | Fung SY, Yang H, Bhola PT, et al. Self-assembling peptide as a potential carrier for hydrophobic anticancer drug ellipticine: complexation, release and in vitro delivery.Adv Funct Mater, 2009, 19(1): 74–83.DOI: 10.1002/adfm.v19:1 |
| [23] | Ge J, Lu DN, Yang C, et al. A lipase-responsive vehicle using amphipathic polymer synthesized with the lipase as catalyst.Macromol Rapid Commun, 2011, 32(6): 546–550. |
| [24] | Takano K, Okamoto T, Okada J, et al. Stabilization by fusion to the C-terminus of hyperthermophile Sulfolobus tokodaii RNase HI: a possibility of protein stabilization tag.PLoS ONE, 2011, 6(1): e16226.DOI: 10.1371/journal.pone.0016226 |
| [25] | Pearce FG, Dobson RCJ, Jameson GB, et al. Characterization of monomeric dihydrodipicolinate synthase variant reveals the importance of substrate binding in optimizing oligomerization.Biochim Biophys Acta, 2011, 1814(12): 1900–1909.DOI: 10.1016/j.bbapap.2011.07.016 |
