
 , 张惠文1, 张成刚1
, 张惠文1, 张成刚11 中国科学院沈阳应用生态研究所,辽宁 沈阳 110016;
2 中国科学院大学,北京 100049
收稿日期:2017-11-07; 网络出版时间:2018-01-31 基金项目:中国科学院战略性先导科技专项(A类) (No. XDA12020225),沈阳市科技计划项目(Nos. Z17-7-013, F14-150-9-00),国家科技重大专项重大新药创制项目(No. 2012ZX09102301-013)资助
摘要:CAR-T细胞疗法通过靶向识别肿瘤细胞表面抗原,特异性杀伤肿瘤细胞,近年来已经成为肿瘤免疫疗法的研究热点。通过基因工程方法构建靶向人类表皮生长因子受体2 (HER2)的CAR慢病毒表达质粒,以磷酸钙沉淀辅助多质粒共转染HEK293T细胞包装,制备CAR慢病毒颗粒lenti-car,感染人外周血单核细胞获得HER2靶向的CAR-T细胞,并分析其对HER2阳性和阴性肿瘤细胞的特异性抑制效果。研究结果表明,构建的CAR-T细胞可被HER-2阳性的肿瘤细胞特异性激活,分泌大量炎症性细胞因子IFN-γ和IL-2。在同样效靶比等处理条件下,构建的HER2靶向CAR-T细胞对HER2阳性的人卵巢癌细胞株SK-OV-3的生长抑制率为(58.47±1.72)%,显著高于对照组(P < 0.05);而对HER2阴性的人慢性髓原白血病细胞株K562的生长抑制率为(11.74±2.37)%,与对照组无显著差异(P > 0.05)。进一步,在K562细胞中转染人HER2表达载体使其成为HER2阳性,则HER2靶向CAR-T细胞对其的生长抑制率上升为(30.41±7.59)%,较HER2阴性K562具有明显差异(P < 0.05)。研究结果表明,构建的HER2靶向的第二代CAR-T细胞可选择性地抑制高表达HER2蛋白的肿瘤细胞的生长,暗示了其对HER2阳性肿瘤进行细胞免疫治疗的临床应用前景。
关键词:CAR-T细胞 人类表皮生长因子受体2 (HER2) 肿瘤 免疫治疗
Construction of HER2-specific CAR-T cells and in vitro analysis of their activity to suppress tumor cell growth
Yongqiang Li1,2, Songyuan Yao1,2, Yansheng Li1,2, Mingkai Xu1

 , Huiwen Zhang1, Chenggang Zhang1
, Huiwen Zhang1, Chenggang Zhang1 1 Institute of Applied Ecology, Chinese Academy of Sciences, Shenyang 110016, Liaoning, China;
2 University of Chinese Academy of Sciences, Beijing 100049, China
Received: November 7, 2017 ; Published: January 31, 2018
Supported by: Strategic Priority Research Program of the Chinese Academy of Sciences (No. XDA12020225), Science & Technology Projects of Shenyang Foundation of China (Nos. Z17-7-013, F14-150-9-00), Significant Creation of New Drugs Foundation of China (No. 2012ZX09102301-013)
Corresponding author:Mingkai Xu. Tel: +86-24-83970380; Fax: +86-24-83970381; E-mail: mkxu@iae.ac.cn
Abstract: CAR-T cell therapy that targets surface antigens to kill tumor cells specifically has recently become another cornerstone in tumor immunotherapy. In this study, a lentiviral expression plasmid of CAR targeting human epidermal growth factor receptor 2 (HER2) was constructed by genetic engineering. The recombinant plasmid was co-transfected with other packaging plasmids into HEK293T cells by calcium phosphate precipitation to generate lenti-car, which are CAR lentiviral particles. HER2-specific CAR-T cells were obtained by transducing human peripheral blood mononuclear cells with lenti-car. Their specific inhibitory effects on HER2-positive and HER2-negative tumor cells were analyzed in vitro. The constructed CAR-T cells were specifically activated by HER2-expressing tumor cells as indicated by secretion of IFN-γ and IL-2. The inhibitory rate on HER2-positive SK-OV-3 cell line was (58.47±1.72)%, significantly higher than that on the mock-treated control group (P < 0.05). The inhibitory rate on HER2-negative K562 cell lines was (11.74±2.37)%, which was not significantly different from that on the control group (P > 0.05). Furthermore, when we transfected a HER2-expressing vector into K562, the inhibitory rate increased to (30.41±7.59)%, which was higher than that on HER2-negative K562 (P < 0.05). Thus, the constructed second-generation HER2-specific CAR-T cells specifically suppressed growth of tumor cells overexpressing HER2 protein, suggesting that HER2-specific CAR-T cells might prove useful for immunotherapy of HER2-positive cancer.
Key words: CAR-T cells HER2 tumor immunotherapy
CAR-T细胞疗法(Chimeric antigen receptor T-cell immunotherapy)全称为嵌合抗原受体T细胞免疫疗法,是通过基因工程方法将识别肿瘤特异性抗原的单链抗体基因与T细胞信号转导区基因连接,再通过一定途径整合到T细胞中而获得。CAR-T细胞能够将抗体-抗原特异性结合能力以及T细胞介导的肿瘤杀伤功能结合于一体,在不依赖于主要组织相容性复合体的情况下,专一性地识别肿瘤特异性抗原,将信号通过胞内信号转导区传入T细胞,刺激T细胞增殖并杀伤肿瘤细胞[1-4]。目前,CAR-T细胞疗法已成为肿瘤免疫治疗领域的研究热点,尤其以CD19为靶点的CAR-T细胞治疗淋巴细胞白血病方面疗效更为突出[5-6]。2017年,美国FDA分别于8月和10月连续批准了诺华和吉利德旗下凯特公司的两款CAR-T产品应用于血液性肿瘤的临床治疗[7-8]。
CD19靶点多表达于如B细胞淋巴瘤等血液性肿瘤细胞表面,而在其他类肿瘤如实体瘤细胞表面并不显著高表达[9]。因此在实体瘤的免疫治疗领域,CAR-T进展较为缓慢,大多停留在临床实验阶段[10-11]。人表皮生长因子受体2 (Human epidermal growth factor receptor 2,HER2)是表皮生长因子受体家族的第二位成员。作为一种典型的肿瘤相关抗原,HER2的过表达对于肿瘤的发生、发展与转移起着关键性作用,也是肿瘤分级和评估预后的重要标志之一[12]。研究表明,HER2在人类正常机体组织中不表达或者微量表达,而在30%以上的肿瘤组织中会过量表达,且位于细胞表面,易被抗体识别,可作为肿瘤特异性治疗的理想靶点[13-14]。目前针对HER2开发的单克隆抗体类药物,如曲妥珠、帕妥珠等,已经被美国FDA批准上市应用于乳腺癌等实体瘤的临床治疗,并获得显著疗效,这证明HER2作为肿瘤免疫治疗靶点的重要价值[15]。而以HER2为靶点的CAR-T细胞免疫治疗策略,目前仅有少量Ⅰ期和Ⅱ期的临床报道[16],尚无被FDA批准的产品。
本文以抗HER2单链抗体为靶向分子,以第三代慢病毒为载体,构建靶向HER2的第二代CAR-T细胞,并分析其在体外对HER2阳性和阴性肿瘤细胞的特异性抑制效果,以评估其对HER2阳性肿瘤进行细胞免疫治疗的临床应用前景。
1 材料与方法1.1 材料1.1.1 实验材料抗HER2单链抗体(anti-HER2-scFv)表达质粒由加利福尼亚大学旧金山分校的James Marks教授惠赠并由本实验室保存[12];CD28质粒购自Genecopoeia公司;CD3ζ质粒由美国国立儿童健康与人类发育研究所的Allan Weissman博士通过Addgene分享(#11507)[17];慢病毒表达载体pCDH-CMV-EF1-GFP+Puro质粒(本文中简称为pCDH)购自System Biosciences公司;其他慢病毒包装质粒pMD2.G、pMDL-G/P-RRE和pRSV-REV均由瑞士洛桑联邦理工学院的Didier Trono博士通过Addgene分享(#12259、#12251、#12253)[18];HER2表达质粒perbB2-EGFP由奥地利因斯布鲁克医科大学的Offterdinger博士通过Addgene分享(#39321)[19];外周血单核细胞采集于健康志愿者;HEK293T细胞株、肿瘤细胞株SK-BR-3 (人乳腺腺癌细胞)、SK-OV-3(人卵巢癌细胞)、HepG2 (人肝癌细胞)、HT-29 (人结肠癌细胞)、Jurkat (人T淋巴细胞白血病细胞)、K562 (人慢性髓原白血病细胞)购自中国科学院上海细胞库。
1.1.2 实验试剂Taq DNA聚合酶、核酸限制性内切酶NheⅠ、NotⅠ、BamHⅠ、T4 DNA连接酶和DL2000 DNA分子量Marker购自TaKaRa大连公司;DNA分子量marker购自Invitrogen公司;1640细胞培养基、DMEM (高糖)细胞培养基、胰蛋白酶购自HyClone公司;胎牛血清购自CAPRICORN公司;酵母提取物、胰蛋白胨购自OXOID公司;NaCl、CaCl2购自Sigma公司;无内毒素质粒中量试剂盒购自AXYGEN公司;BCA蛋白含量检测试剂盒购自康为世纪公司;兔抗人HER2多克隆抗体、羊抗兔多克隆抗体、IL-2和抗人CD3抗体均为Abcam公司产品;人IFN-γ ELISA检测试剂盒、人IL-2 ELISA检测试剂盒、人淋巴细胞分离液均购自达科为公司;聚凝胺购自Millipore公司;MTS购自Promega公司;大肠杆菌stbl3由本实验室保存。
1.2 方法1.2.1 HER2 CAR慢病毒表达载体的构建分别以含CD28、CD3ζ和anti-HER2-scFv的质粒为模板,设计PCR引物(表 1)并进行PCR扩增。将纯化后的PCR扩增产物CD28和CD3ζ稀释100倍后,按照摩尔比1:1混合,以CD28-F、CD3ζ-R为引物,再进行第二轮PCR扩增,获得PCR产物CD28-CD3ζ。然后将纯化后的PCR产物CD28-CD3ζ用NotⅠ和BamHⅠ内切酶进行双酶切,将PCR产物anti-HER2-scFv用NheⅠ和NotⅠ内切酶进行双酶切,将慢病毒载体质粒pCDH用NheⅠ和BamHⅠ内切酶进行双酶切。将上述3种双酶切产物按照片段:片段:载体摩尔比为3:3:1的比例混合,在T4 DNA连接酶作用下过夜连接形成CAR的慢病毒表达质粒pCDH-car,并将连接产物全部转化大肠杆菌stbl3感受态细胞,用含50 μg/mL氨苄霉素的LB固体培养基筛选阳性克隆,并将阳性克隆进行测序鉴定。
表 1 构建质粒pCDH-car所用的PCR引物序列Table 1 Primer sequence for plasmid pCDH-car construction
| Primer name | Primer sequence (5?–3?) |
| scFv-F | TTAGCTAGCATGGCCCAGGTGCAGCTGGTGCAGTCT |
| scFv-R | TTCTGCGGCCGCACCTAGGACGGTGACCTTGGTC |
| CD28-F | AGGCGGCCGCAATTGAAGTTATGTATC |
| CD28-R | *TGCGCTCCTGCTGAACTTCACTCTGGAGCGATAGGCTGCGAAGTCGCG |
| CD3ζ-F | *AGAGTGAAGTTCAGCAGGAGCGCA |
| CD3ζ-R | AAGGATCCTGGCTGTTAGCGAGG |
| *Underlined letters are the complementary region. | |
表选项
1.2.2 慢病毒颗粒的包装制备将汇合度达到90%的HEK293T细胞传代于10 mm细胞培养皿中,加入含10%胎牛血清的DMEM高糖培养基,置于37 ℃、5% CO2条件下培养24 h。待细胞汇合度达到30%?40%时,更换新鲜含血清培养基,继续培养2 h后,将3种包装质粒pMD2.G (3.24 μg)、pMDL-G/P-RRE (4.5 μg)、pRSV-REV (2.25 μg)和CAR慢病毒表达质粒pCDH-car (11.52 μg)或空载体对照质粒pCDH-blank(11.52 μg)通过磷酸钙沉淀法共转染HEK293T细胞,包装CAR慢病毒颗粒lenti-car以及对照慢病毒颗粒lenti-blank。继续培养16 h后,更换新鲜培养基。24 h后在荧光显微镜下观察HEK293T细胞的GFP表达情况,48 h后收集上清,并用0.45 μm滤头过滤除去细胞碎片。过滤后的上清在超高速离心机中以20 000 r/min、4 ℃离心3 h,收集病毒颗粒沉淀,用无血清1640培养基重悬分装,保存于–70 ℃冰箱备用。
1.2.3 慢病毒颗粒的滴度测定将HEK293T细胞以5×103 cells/孔的密度接种于96孔板中,每孔含100 μL 10%胎牛血清的DMEM高糖培养基,置于37 ℃、5% CO2条件下培养过夜。分别吸取40 μL的lenti-car和lenti- blank慢病毒储液,加入360 μL含终浓度8 μg/mL的聚凝胺的DMEM高糖培养基(含10%胎牛血清)[20]。并以此10倍梯度稀释。小心从上述接种了HEK293T细胞的96孔板中吸除90 μL培养基上清,随后每孔加入上述梯度稀释的病毒颗粒溶液90 μL,每个稀释度3孔重复。继续培养24 h,吸除干净各孔培养基,并更换不含任何病毒颗粒的新鲜培养基,继续培养24 h,在倒置荧光显微镜下观察GFP信号。以能观察到荧光信号的最低稀释度为止,记录该孔中荧光细胞的个数,并以如下公式计算慢病毒储液滴度:
慢病毒储液滴度(TU/μL)=N/9×10(n-1)
N为能观察到荧光信号的最低稀释度孔中荧光细胞的个数,n为稀释倍数。
1.2.4 人外周血单核细胞(PBMC)的制备及慢病毒感染制备CAR-T细胞采集健康志愿者的新鲜外周血液,以Ficoll-hypaque (葡聚糖-泛影葡胺)密度梯度离心法分离得到PBMC。用含10%胎牛血清的1640培养基将PBMC重悬,按照4×106 cells/孔铺于6孔板中,加入终浓度为200 U/mL的IL-2和终浓度为50 ng/mL的抗CD3抗体[21],置于37 ℃、5% CO2条件下培养。培养过夜后,观察PBMC状态,向6孔板中分别加入lenti-car及lenti-blank慢病毒储液,并加入终浓度为8 μg/mL的聚凝胺[21],将6孔板2 500 r/min离心90 min,离心后继续培养。12 h后,2 500 r/min离心6孔板20 min,小心吸走1/2上清,再加入等量的新鲜培养基。继续培养48 h后,荧光显微镜下观察GFP表达情况,确定大部分PBMC被慢病毒感染,即为CAR-T细胞或对照T细胞。
1.2.5 HER2阳性肿瘤细胞株筛选将实验室冻存肿瘤细胞株SK-BR-3 (人乳腺腺癌细胞)、SK-OV-3 (人卵巢癌细胞)、HepG2(人肝癌细胞)、HT-29 (人结肠癌细胞)、Jurkat (人T淋巴细胞白血病细胞)、K562 (人慢性髓原白血病细胞)进行复苏、传代培养,待细胞状态良好、汇合度达到90%以上时,收集细胞于1.5 mL离心管中,8 000 r/min离心3 min,弃上清。用预冷PBS洗涤2次,8 000 r/min离心3 min,弃尽上清。加入100 μL RIPA细胞裂解液,反复吹打数次,12 000 r/min离心10 min,小心吸取上清保存,用BCA试剂盒测定蛋白浓度。以Western blotting检测各肿瘤细胞株的HER2蛋白表达量。经10% SDS-PAGE胶分离,转至PVDF膜,牛奶封闭1 h后,用兔抗人HER2抗体(1:5 000) 4 ℃孵育过夜。次日用TBST洗膜3次,每次3 min,再用HRP标记的羊抗兔IgG (1:2 000)室温孵育2 h,之后用TBST洗膜3次,每次3 min,去离子水洗膜2次,每次3 min。加入化学发光显色液后,在凝胶成像仪上曝光显色。
1.2.6 K562 HER2阳性细胞株的构建将HER2阴性肿瘤细胞株K562接种于6孔板中,以含10%胎牛血清的1640培养基培养24 h后,将培养基更换为opti-MEM培养基。继续培养2 h后,将24 μg的HER2表达质粒perbB2-EGFP和72 μL的转染试剂lip2000分别用opti-MEM培养基稀释至900 μL,室温静置5 min后,将质粒稀释液逐滴加入转染试剂稀释液中,小心混匀,室温静置。20 min后,将混合液按照每孔300 μL混合液的量加入含K562的6孔板中。培养6 h后,更换新鲜1640培养基(含10%胎牛血清)。继续培养24 h,荧光显微镜下观察GFP的表达情况,初步判断转染效果。48 h后,收集转染的K562细胞,一部分以Western blotting检测HER2表达水平,另一部分用于抗肿瘤活性检测实验。
1.2.7 HER2 CAR-T细胞与肿瘤细胞共培养后细胞因子IL-2和IFN-γ检测将感染了lenti-car慢病毒的CAR-T细胞和感染了lenti-blank慢病毒的对照T细胞,分别以4×105 cells/孔铺于96孔板中。将HER2阳性的SK-OV-3细胞、HER2阴性的K562细胞、经转染后的HER2阳性K562细胞分别以1×104 cells/孔加于各孔中。同时设置只加T细胞的阴性对照孔(加与实验孔等量的不经任何病毒感染的T细胞)。每孔设置3个重复。铺板的96孔板于37 ℃、5% CO2条件下培养24 h后,吸取培养基上清液,以1 500 r/min离心5 min除去细胞及细胞碎片,小心吸取上清液,按照ELISA试剂盒说明书方法检测细胞因子IFN-γ和IL-2的含量。
1.2.8 HER2 CAR-T细胞体外抑制肿瘤细胞生长活性的测定将感染了lenti-car慢病毒的CAR-T细胞和感染了lenti-blank慢病毒的对照T细胞,分别以4×105 cells/孔铺于96孔板中。将HER2阳性的SK-OV-3细胞、HER2阴性的K562细胞、经转染后的HER2阳性K562细胞分别以1×104 cells/孔加于各孔中。同时设置淋巴细胞本底释放孔(加与实验孔等量的T细胞),肿瘤细胞对照孔(仅加肿瘤细胞)及空白对照孔(仅加含10%血清的RPMI 1640)。每孔设置3个重复。将铺板后的96孔板于37 ℃、5% CO2条件下培养72 h,之后向每孔加入20 μL浓度为5 mg/mL的MTS,继续培养4 h。培养结束后,用酶标仪以测定波长490 nm和参比波长570 nm测定各实验孔吸光度值(OD)。并以如下公式计算生长抑制率。
生长抑制率=100%?[(实验孔?淋巴细胞本底释放孔)/(肿瘤细胞对照孔?空白对照孔)]×100%。
2 结果与分析2.1 HER2 CAR慢病毒表达载体的构建本文所构建的HER2靶向第二代CAR分子主要由3部分组成,分别是含CD3ζ的胞内区、含CD28的跨膜区以及含anti-HER2-scFv的胞外区(图 1A)。本研究所设计的CD28的后引物CD28-R与CD3ζ的前引物CD3ζ-F有互补区(表 1),所以可将CD28和CD3ζ的PCR产物等摩尔混合后,用引物CD28-F和CD3ζ-R直接PCR扩增出两个片段的连接产物,即CD28-CD3ζ。PCR产物在琼脂糖凝胶电泳上显示的条带大小与预期值一致(图 1B和1C)。阳性克隆的DNA测序结果与预期一致,表明CAR的慢病毒表达质粒pCDH-car构建正确。
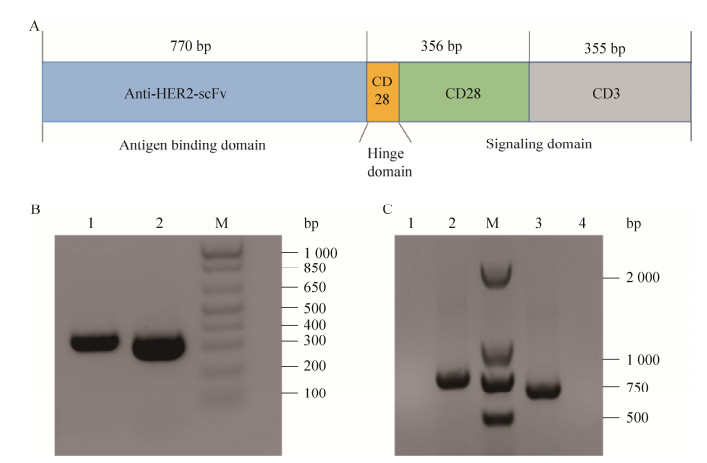 |
| 图 1 靶向HER2 CAR慢病毒表达载体的构建 Figure 1 Construction of HER2-specific CAR lentivirus. (A) Schematic diagram of HER2-specific CAR. (B) CD28 and CD3ζ PCR analyzed by agarose gel electrophoresis. 1: CD3ζ; 2: CD28. (C) CD28-CD3ζ and anti-HER2-scFv PCR analyzed by agarose gel electrophoresis. 1: anti-HER2-scFv PCR without templates; 2: anti-HER2-scFv; 3: CD28-CD3ζ; 4: CD28-CD3ζ PCR without templates. |
| 图选项 |
2.2 慢病毒颗粒的包装制备及滴度检测HEK293T细胞在经过磷酸钙沉淀法共转染40 h后,可在荧光倒置显微镜下观察到明显的绿色荧光信号(图 2A),约有80%的HEK293T细胞明显表达GFP蛋白。在培养48 h时收集上清液,用0.45 μm滤头过滤除去细胞碎片,超高速离心收集lenti-car和lenti-blank慢病毒颗粒,重悬并分装病毒储液。
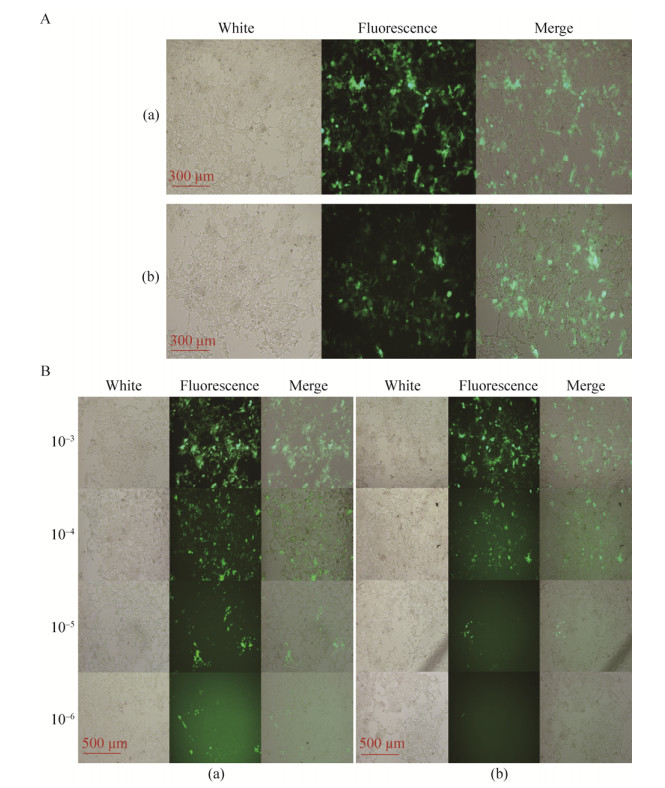 |
| 图 2 慢病毒颗粒的包装制备及滴度检测 Figure 2 Preparation and titer determination of lentivirus. (A) Lentivirus produced by transfecting HEK293T cells. a: lenti-blank; b: lenti-car. (B) HEK293T cells infected by lentivirus with gradient dilution. a: HEK293T cells infected by lenti-blank; b: HEK293T cells infected by lenti-car. |
| 图选项 |
以有限稀释法分析制备的慢病毒颗粒储液的病毒滴度。慢病毒感染后48 h,可在HEK293T细胞中观察到明显的绿色荧光信号,且随着稀释度的增高,荧光细胞数量逐渐降低(图 2B)。在第6稀释度,lenti-car和lenti-blank慢病毒感染组都可见明显可计数的荧光细胞。计算病毒滴度分别为:lenti-car慢病毒滴度1.67×105;lenti-blank慢病毒滴度3.56×105。
2.3 PBMC制备及PBMC的慢病毒转染新鲜制备的人PBMC细胞,先以抗CD3抗体和IL-2处理培养过夜进行激活。IL-2作为T细胞生长因子,有利于T细胞在体外长期存活,并刺激T细胞增殖;抗CD3抗体刺激T细胞活化,有利于后续的慢病毒转染[18]。PBMC激活后,加入慢病毒进行感染。48 h后,在荧光显微镜下可观察到成团状的绿色荧光细胞存在(图 3),这是PBMC经抗CD3抗体及IL-2激活和慢病毒感染后形成的T细胞增殖簇,暗示慢病毒载体携带的CAR基因已经成功整合入T细胞中,并形成CAR-T细胞簇。
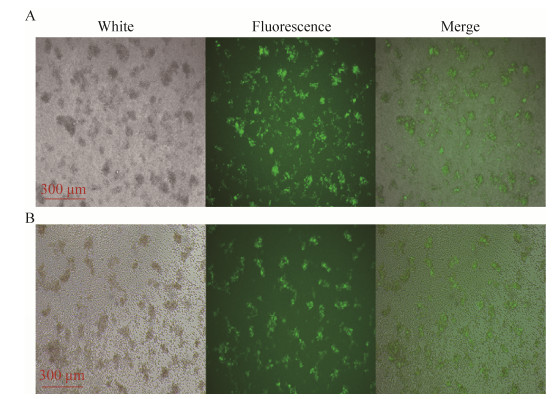 |
| 图 3 慢病毒感染PBMC Figure 3 PBMC infected by lentivirus. (A) PBMC infected by lenti- blank. (B) PBMC infected by lenti-car. |
| 图选项 |
2.4 HER2阳性肿瘤细胞株筛选及K562 HER2阳性细胞株的构建通过Western blotting检测(图 4A)可以看出,6株肿瘤细胞株中,有4株表达HER2蛋白,另外2株不表达,其中SK-OV-3和SK-BR-3在HER2条带处显色较深,为高表达HER2肿瘤细胞株,HepG2和HT-29条带相对较浅,为中等程度表达HER2细胞株,而K562和Jurkat在HER2蛋白处没有条带,为HER2阴性细胞株。借助于转染试剂lip2000将HER2表达质粒perbB2-EGFP转染K562细胞后,荧光显微镜下可观察到大约60%的K562细胞被转染带有荧光(图 4B);Western blotting检测显示,转染后的K562能够中等程度表达HER2蛋白(图 4C)。根据以上结果,选择HER2阳性的SK-OV-3、HER2阴性的K562细胞以及经perbB2-EGFP转染的K562细胞,用于肿瘤细胞生长抑制试验。
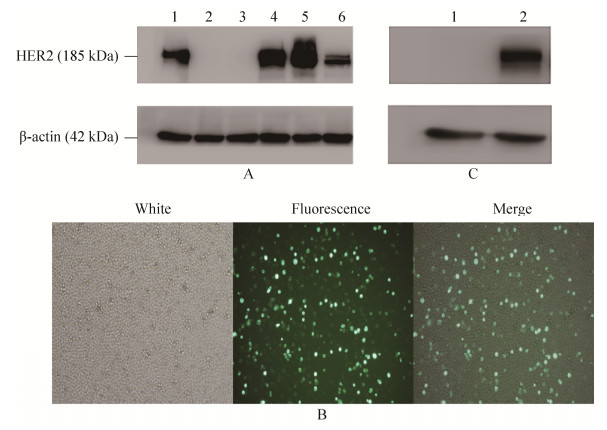 |
| 图 4 HER2阳性肿瘤细胞株筛选及K562 HER2阳性细胞株的构建 Figure 4 Selection of HER2 positive tumor cells and construction of HER2 positive K562. (A) HER2 expressing in tumor cells detected by Western blotting. 1: HT-29; 2: Jurkat; 3: K562; 4: SK-BR-3; 5: SK-OV-3; 6: HepG2. (B) K562 transfected with HER2 plasmid. (C) HER2 expressing in transfected K562. 1: untransfected K562; 2: transfected K562. |
| 图选项 |
2.5 HER2 CAR-T细胞与肿瘤细胞共培养后细胞因子IL-2和IFN-γ检测分别将lenti-car慢病毒感染的CAR-T细胞和lenti-blank慢病毒感染的对照T细胞与不同HER2表达的肿瘤细胞共培养,以ELISA试剂盒方法检测细胞因子IFN-γ和IL-2的分泌水平(图 5)。在不经任何病毒感染和处理的T细胞阴性对照组中,上清液中细胞因子IFN-γ和IL-2的含量低于相应的ELISA试剂盒检测限,未能检出。如图 5A所示,在与HER2阳性的SK-OV-3肿瘤细胞共培养时,CAR-T细胞分泌IFN-γ的量为(4 373.3±547.9) pg/mL,对照T细胞分泌IFN-γ的量为(243.1±28.2) pg/mL,两者具有显著差异(P < 0.05);与HER2阴性的K562肿瘤细胞共培养时,CAR-T细胞分泌IFN-γ的量为(204.3±15.5) pg/mL,对照T细胞的IFN-γ分泌量为(225.3±24.2) pg/mL,两者差异不显著(P > 0.05);而与表达HER2的K562共培养时,CAR-T细胞分泌IFN-γ的量为(1 575.6±272.8) pg/mL,显著高于对照T细胞的IFN-γ分泌量(157.7±28) pg/mL (P < 0.05)。如图 5B所示,在与SK-OV-3肿瘤细胞共培养时,CAR-T细胞分泌IL-2的量为(1 673.3±138.1) pg/mL,对照T细胞分泌IL-2的量为(143.3±28.2) pg/mL,两者具有显著差异(P < 0.05);与HER2阴性的K562肿瘤细胞共培养时,CAR-T细胞分泌IL-2的量为(103.3±16.5) pg/mL,对照T细胞的IL-2分泌量为(125.3±24.4) pg/mL,两者差异不显著(P > 0.05);而与表达HER2的K562共培养时,CAR-T细胞分泌IL-2的量为(742.3±117.4) pg/mL,显著高于对照T细胞的IL-2分泌量(137.6±8.1) pg/mL (P < 0.05)。以上结果表明,HER2 CAR-T细胞能够被表达HER-2的肿瘤细胞特异性激活,分泌炎症性细胞因子IFN-γ和IL-2,并对HER-2阳性的肿瘤细胞产生免疫毒性效应。
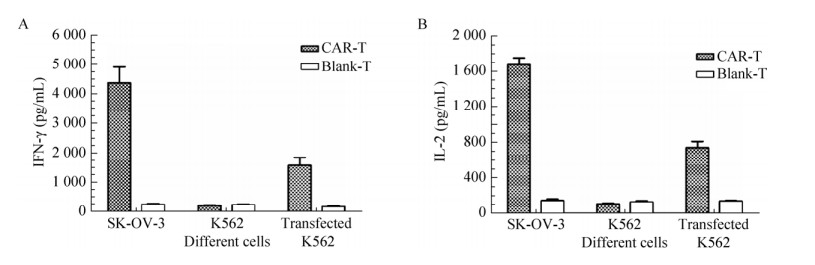 |
| 图 5 ELISA检测IFN-γ (A)和IL-2 (B) Figure 5 Detection of IFN-γ and IL-2 by ELISA. (A) IFN-γ. (B) IL-2. |
| 图选项 |
2.6 HER2 CAR-T细胞体外抗肿瘤活性测定以lenti-car慢病毒感染的CAR-T细胞和lenti-blank慢病毒感染的对照T细胞为效应细胞,通过MTS方法检测对不同HER2表达的肿瘤细胞的生长抑制作用。结果如图 6所示,对于HER2阳性的SK-OV-3肿瘤细胞,CAR-T对其生长抑制率为(58.47±1.72)%,而对照T细胞的生长抑制率仅为(8.42±1.97)%,两者具有显著差异(P < 0.05);而对于HER2阴性的K562肿瘤细胞,CAR-T对其生长抑制率为(11.74±2.37)%,对照T细胞的生长抑制率为(9.79±0.23)%,两者无显著差异(P > 0.05)。以上结果初步证明本文构建的CAR-T细胞对于HER2阳性肿瘤细胞可产生显著增强的生长抑制效果,具有HER2靶向性。
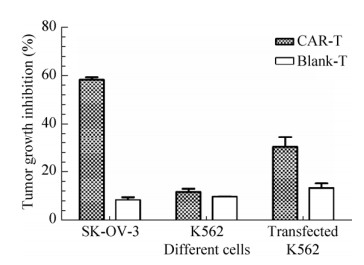 |
| 图 6 CAR-T细胞及对照组T细胞抗肿瘤活性 Figure 6 Antitumor activity of CAR-T cells and control T cells. |
| 图选项 |
为了进一步证明本文CAR-T的肿瘤细胞生长抑制效果是由肿瘤细胞HER2表达所决定的,将HER2阴性的K562细胞转染perbB2-EGFP质粒,使其表达HER2。结果如图 6所示,CAR-T对表达HER2的K562细胞的生长抑制率为(30.41±7.59)%,显著高于对不表达HER2的K562的(11.74±2.37)% (P < 0.05);对照T细胞对表达HER2的K562细胞的生长抑制率仅为(13.35±3.34)%,显著低于CAR-T生长抑制率(P < 0.05),且与对照T细胞对不表达HER2的K562细胞的抑制率(9.79±0.23)%相当(P > 0.05)。以上结果表明,HER2的表达是决定CAR-T产生肿瘤细胞生长抑制作用的关键因素,本文构建的CAR-T表现出明确的HER2靶向性,并且能够产生显著的肿瘤细胞生长抑制作用,具有进一步开发成为对HER2阳性肿瘤进行免疫细胞临床治疗的潜力。
3 讨论CAR-T细胞直接识别肿瘤表面特异性抗原,将信号通过胞内信号转导区传入T细胞,刺激T细胞增殖,并分泌穿孔素、颗粒酶及细胞因子等,发挥杀伤肿瘤细胞的作用[3, 22-23]。随着2017年两种CAR-T产品在美国获批[7-8],这使得CAR-T细胞技术在国内更加炙手可热,也使得肿瘤免疫治疗成为世界医药界的焦点。
CAR主要由3部分构成,分别是识别肿瘤表面抗原的胞外区、连接胞内区和胞外区的铰链跨膜区以及负责传导激活T细胞信号的胞内信号转导区[24],其中胞外区主要来源于单克隆抗体的单链可变区,跨膜区一般由二聚体膜蛋白如CD28、CD8等组成,而胞内区主要由T细胞受体的CD3ζ链组成[25-27]。自1989年CAR概念提出以来,CAR技术得到了不断改进与发展,目前已经发展到第三代[28]。3代CAR的区别主要在于胞内信号转导区:第一代CAR胞内信号转导区仅含有CD3ζ或FcRγ单一信号分子,但因缺乏共刺激因子而不能充分激活T细胞。第二代CAR胞内区在第一代CAR基础上增加了1种共刺激因子,能显著提高T细胞增殖能力和抗肿瘤效应。而第三代CAR则引入了2种以上的共刺激因子,能使T细胞持续增殖,对肿瘤杀伤能力更强[3-4, 29]。第三代CAR相对于第二代,更容易被肿瘤特异抗原所激活,反应强度更大,杀伤能力更强,但由于其过强的反应灵敏性,体内使用时容易造成脱靶效应,即可被非靶点的正常组织细胞所激活,并造成非靶向性的杀伤效应,产生副作用,临床治疗的风险更高,因此目前临床上应用的主要是第二代CAR[6, 16, 30]。本文构建的靶向HER2第二代CAR-T细胞,胞外区是anti-HER2-scFv,跨膜区为CD28,而胞内区是CD3ζ和CD28两个刺激因子,用于靶向杀伤高表达HER2蛋白的肿瘤细胞。
本文通过Western blotting方法,确定SK-OV-3和SK-BR-3为高表达HER2蛋白的肿瘤细胞株,而HT-29和HepG2为中等程度表达HER2蛋白细胞株,不表达HER2蛋白的细胞株为K562和Jurkat。为得出显著结果,故选择高表达和不表达细胞株作为后续实验研究对象。根据预实验结果,SK-OV-3相对于SK-BR-3更易活化,且生长速度快,更适合进行本研究的肿瘤细胞生长抑制实验,所以选择SK-OV-3为后续实验中HER2阳性靶细胞,而K562相对于Jurkat细胞体积更大,易计数,易收集,所以选择K562作为后续实验HER2阴性靶细胞。为进一步验证本文构建CAR-T细胞的作用靶点为HER2,消除不同种类细胞株对CAR-T细胞毒性可能存在的敏感性差异,通过转染HER2质粒进入K562细胞,构建了HER2阳性K562。但由于转染K562为瞬时转染,且转染效率不高,所以CAR-T细胞对HER2阳性K562杀伤作用提升程度有限,并低于SK-OV-3,但仍显著高于CAR-T细胞对HER2阴性K562杀伤作用。
本文以实验室保存的抗HER2抗体基因为基础,构建靶向HER的CAR-T细胞,该CAR-T细胞可被HER-2阳性的肿瘤细胞所特异性激活,分泌大量炎症性细胞因子IFN-γ和IL-2。其对HER2阳性的人卵巢癌细胞株SK-OV-3的生长抑制率为(58.47±1.72)%,显著高于对照组(P < 0.05);对HER2阴性的人慢性髓原白血病细胞株K562的生长抑制率为(11.74±2.37)%,与对照组无显著差异(P > 0.05);对构建的HER2阳性细胞K562的生长抑制率上升为(30.41±7.59)%,较HER2阴性K562具有明显差异(P < 0.05)。结果表明,本文构建的HER2靶向的第二代CAR-T细胞可选择性地抑制高表达HER2蛋白的肿瘤细胞的生长,具有靶向、安全、有效的特点,暗示了其对HER2阳性肿瘤进行细胞免疫治疗的临床应用前景。但该方法仍需进一步的荷瘤动物实验模型加以验证,这也是本研究团队未来工作的重点。
致谢: 诚挚感谢香港中文大学路钢教授对本研究给予的指导和在实验上提供的帮助,感谢美国国立儿童健康与人类发育研究所的Allan Weissman博士、瑞士洛桑联邦理工学院的Didier Trono博士和奥地利因斯布鲁克医科大学的Martin Offterdinge博士通过Addgene分享的质粒载体,感谢加利福尼亚大学旧金山分校的James Marks教授惠赠的抗HER2单链抗体(anti-HER2-scFv)表达质粒。
参考文献
| [1] | Maus MV, Haas AR, Beatty GL, et al. T cells expressing chimeric antigen receptors can cause anaphylaxis in humans.Cancer Immunol Res, 2013, 1(1): 26–31.DOI: 10.1158/2326-6066.CIR-13-0006 |
| [2] | Zhu XY, Yao JX. The CAR-T technology and its application.J Clin Hematol, 2015, 28(3): 428–431.(in Chinese). 朱昕赟, 姚军霞. CART技术及其临床应用.临床血液学杂志, 2015, 28(3): 428-431. |
| [3] | Gill S, Maus MV, Porter DL. Chimeric antigen receptor T cell therapy: 25 years in the making.Blood Rev, 2016, 30(3): 157–167.DOI: 10.1016/j.blre.2015.10.003 |
| [4] | Jaspers JE, Brentjens RJ. Development of CAR T cells designed to improve antitumor efficacy and safety.Pharmacol Ther, 2017, 178: 83–91.DOI: 10.1016/j.pharmthera.2017.03.012 |
| [5] | Maher J. Clinical immunotherapy of B-cell malignancy using CD19-targeted CAR T-cells.Curr Gene Ther, 2014, 14(1): 35–43.DOI: 10.2174/1566523213666131223130554 |
| [6] | Gauthier J, Yakoub-Agha I. Chimeric antigen-receptor T-cell therapy for hematological malignancies and solid tumors: clinical data to date, current limitations and perspectives.Curr Res Transl Med, 2017, 65(3): 93–102.DOI: 10.1016/j.retram.2017.08.003 |
| [7] | FDA approval brings first gene therapy to the United States[EB/OL]. [2017-10-30]. https: //www. fda. gov/ NewsEvents/Newsroom/PressAnnouncements/ucm574058. htm. |
| [8] | FDA approves CAR-T cell therapy to treat adults with certain types of large B-cell lymphoma[EB/OL]. [2017-10-30]. https: //www. fda. gov/NewsEvents/ Newsroom/PressAnnouncements/ucm581216. htm. |
| [9] | Davila ML, Brentjens RJ. CD19-Targeted CAR T cells as novel cancer immunotherapy for relapsed or refractory B-cell acute lymphoblastic leukemia.Clin Adv Hematol Oncol, 2016, 14(10): 802–808. |
| [10] | Jin C, Yu D, Essand M. Prospects to improve chimeric antigen receptor T-cell therapy for solid tumors.Immunotherapy, 2016, 8(12): 1355–1361.DOI: 10.2217/imt-2016-0125 |
| [11] | Newick K, O'Brien S, Moon E, et al. CAR T cell therapy for solid tumors.Annu Rev Med, 2017, 68(1): 139–152.DOI: 10.1146/annurev-med-062315-120245 |
| [12] | Ming-Kai X, Cheng-Gang Z. Gene expression and function study of fusion immunotoxin anti-Her-2-scFv-SEC2 in Escherichia coli.Appl Microbiol Biotechnol, 2006, 70(1): 78–84.DOI: 10.1007/s00253-005-0049-z |
| [13] | Tuefferd M, Couturier J, Vincentsalomon A, et al. HER2 status in ovarian carcinomas: a multicenter GINECO study of 320 patients.PLoS ONE, 2007, 2(11): e1138.DOI: 10.1371/journal.pone.0001138 |
| [14] | Sun M, Shi H, Liu C, et al. Construction and evaluation of a novel humanized HER2-specific chimeric receptor.Breast Cancer Res, 2014, 16(3): 1–10. |
| [15] | Martin V, Cappuzzo F, Mazzucchelli L, et al. HER2 in solid tumors: more than 10 years under the microscope; where are we now?.Future Oncol, 2014, 10(8): 1469–1486.DOI: 10.2217/fon.14.19 |
| [16] | Ahmed N, Brawley VS, Hegde M, et al. Human epidermal growth factor receptor 2 (HER2)-specific chimeric antigen receptor-modified T cells for the immunotherapy of HER2-positive sarcoma.J Clin Oncol, 2015, 33(15): 1688–1696.DOI: 10.1200/JCO.2014.58.0225 |
| [17] | Weissman AM, Hou D, Orloff DG, et al. Molecular cloning and chromosomal localization of the human T-cell receptor zeta chain: distinction from the molecular CD3 complex.Proc Natl Acad Sci USA, 1988, 85(24): 9709–9713.DOI: 10.1073/pnas.85.24.9709 |
| [18] | Dull T, Zufferey R, Kelly M, et al. A third-generation lentivirus vector with a conditional packaging system.J Virol, 1998, 72(11): 8463–8471. |
| [19] | Offterdinger M, Bastiaens PI. Prolonged EGFR signaling by ERBB2-mediated sequestration at the plasma membrane.Traffic, 2008, 9(1): 147–155.DOI: 10.1111/j.1600-0854.2007.00665.x |
| [20] | Zhang Y, He Q, Hu Z, et al. Long noncoding RNA LINP1 regulates repair of DNA double-strand breaks in triple-negative breast cancer.Nat Struct Mol Biol, 2016, 23(6): 522–530.DOI: 10.1038/nsmb.3211 |
| [21] | Schmueckhenneresse M, Omer B, Shum T, et al. Comprehensive approach for identifying the T Cell subset origin of CD3 and CD28 antibody-activated chimeric antigen receptor-modified T cells.J Immunol, 2017, 199(1): 348–362.DOI: 10.4049/jimmunol.1601494 |
| [22] | Cheadle EJ, Gornall H, Baldan V, et al. CAR T cells: driving the road from the laboratory to the clinic.Immunol Rev, 2014, 257(1): 91–106.DOI: 10.1111/imr.2013.257.issue-1 |
| [23] | Ramos CA, Savoldo B, Dotti G. CD19-CAR trials.Cancer J, 2014, 20(2): 112–118.DOI: 10.1097/PPO.0000000000000031 |
| [24] | Li S, Yang Z, Shen J, et al. Adoptive therapy with CAR redirected T cells for hematological malignancies.Sci China Life Sci, 2016, 59(4): 370–378.DOI: 10.1007/s11427-016-5036-3 |
| [25] | Sadelain M, Brentjens R, Riviere I. The basic principles of chimeric antigen receptor design.Cancer Discov, 2013, 3(4): 388–398.DOI: 10.1158/2159-8290.CD-12-0548 |
| [26] | Atanackovic D, Radhakrishnan SV, Bhardwaj N, et al. Chimeric antigen receptor (CAR) therapy for multiple myeloma.Br J Haematol, 2016, 172(5): 685–698.DOI: 10.1111/bjh.2016.172.issue-5 |
| [27] | Liu X, Zhang N, Shi H. Driving better and safer HER2-specific CARs for cancer therapy.Oncotarget, 2017, 8(37): 62730–62741. |
| [28] | Abate-Daga D, Davila ML. CAR models: next-generation CAR modifications for enhanced T-cell function.Mol Ther Oncolytics, 2016, 3: 16014–16020.DOI: 10.1038/mto.2016.14 |
| [29] | Yeku OO, Brentjens RJ. Armored CAR T-cells: utilizing cytokines and pro-inflammatory ligands to enhance CAR T-cell anti-tumour efficacy.Biochem Soc Trans, 2016, 44(2): 412–418.DOI: 10.1042/BST20150291 |
| [30] | Drent E, Themeli M, Poels R, et al. Reducing on-target off-tumor effects of CD38-chimeric antigen receptors by affinity optimization.Mol Ther, 2017, 25(8): 1946–1958.DOI: 10.1016/j.ymthe.2017.04.024 |
