
 , 刘静1, 周伟1, 郑维1, 金黎明1, 赵晶1, 赵朋超2, 范圣第1
, 刘静1, 周伟1, 郑维1, 金黎明1, 赵晶1, 赵朋超2, 范圣第11 大连民族大学 生命科学学院,辽宁 大连 116600;
2 河南科技大学 医学技术与工程学院,河南 洛阳 471023
收稿日期:2017-06-16;接收日期:2017-08-28 基金项目:中央高校基本科研业务费专项资金(No. DC201502020201)资助
摘要:环脂肽化合物因其独特的结构特点和生物活性在医药领域具有广泛的应用前景。本研究旨在从解淀粉芽孢杆菌Q-426发酵液中分离纯化获得高纯度的环脂肽单体,并对分离得到的环脂肽C-15 Bacillomycin D和C-16 Bacillomycin D的抗肿瘤活性及机制进行初步研究。首先,联合使用酸沉淀和双树脂层析去除大量杂质,然后通过制备型HPLC分离得到纯度较高的两种环脂肽,经ESI-MS/MS对其进行结构鉴定,分别确定为C-15 Bacillomycin D与C-16 Bacillomycin D。其次,将两种环脂肽单体及其1:1混合液(摩尔比)按不同浓度梯度作用于人癌细胞(Hela、MG、Hep-G2、HT-29),结果表明环脂肽对Hela与MG细胞增殖的抑制作用呈浓度依赖性,长链环脂肽的抑制率较短链环脂肽略高。最后,采用细胞划痕实验和PI染色法考察了C-16 Bacillomycin对细胞侵袭与迁移能力、细胞凋亡和周期的影响,结果显示,C-16 Bacillomycin D可有效影响细胞的迁移能力,诱导细胞凋亡呈浓度依赖性,且阻滞细胞G0G1期。
关键词:解淀粉芽孢杆菌Q-426 C-15 Bacillomycin D C-16 Bacillomycin D 抗肿瘤活性
Isolation, purification and antitumor activity of Bacillomycin D from Bacillus amyloliquefaciems Q-426
Chunshan Quan1

 , Jing Liu1, Wei Zhou1, Wei Zheng1, Liming Jin1, Jing Zhao1, Pengchao Zhao2, Shengdi Fan1
, Jing Liu1, Wei Zhou1, Wei Zheng1, Liming Jin1, Jing Zhao1, Pengchao Zhao2, Shengdi Fan1 1 College of Life Sciences, Dalian Minzu University, Dalian 116600, Liaoning, China;
2 School of Medical Technology and Engineering, Henan University of Science and Technology, Luoyang 471023, Henan, China
Received: June 16, 2017; Accepted: August 28, 2017
Supported by: the Fundamental Research Funds for the Central Universities (No. DC201502020201)
Corresponding author:Chunshan Quan. Tel: +86-411-87656219; Fax: +86-411-87656215; E-mail: mikyeken@dlnu.edu.cn
Abstract: Cyclic lipopeptide has extensive application prospect in the field of medicine due to its unique chemical structure and biological activity. This study aims to obtain high purity of cyclic lipopeptide monomer from Bacillus amyloliquefaciems strain Q-426, and illuminate preliminary antitumor mechanism of C-15 Bacillomycin D and C-16 Bacillomycin D. Firstly, crude cyclic lipopeptide solution was prepared by two-steps purification of acid precipitation and double-resins chromatography. In order to obtain purer product preparative HPLC was utilized to separate and purify cyclic lipopeptide. Component 1 and component 2 were detected as C-15 Bacillomycin D and C-16 Bacillomycin D by HPLC-MS and ESI-MS/MS. Secondly, the effect of C-15 Bacillomycin D, C-16 Bacillomycin D and their mixture (1:1, mol:mol) on cell proliferation was measured using human cancer cells (Hela, MG, Hep-G2 and HT-29). The cyclic peptide showed a dose dependent manner on the cell proliferation inhibition of Hela and MG cells. Finally, the results of the scratch wound healing assay and FACS analysis revealed that C-16 Bacillomycin D can effectively influence the cells migration and the cells treated with C-16 Bacillomycin D showed typical apoptotic morphology with the increase of drug concentration in the early apoptosis, late apoptosis percentage increased, and G0G1 arrest was induced significantly.
Key words: Bacillus amyloliquefaciems Q-426 C-15 Bacillomycin D C-16 Bacillomycin D antitumor activity
环脂肽是由微生物发酵产生的一类双亲性化合物,其一端由多个氨基酸组成肽环形成亲水基,另一端由脂肪烃链形成亲油基。它们具有独特的化学结构和生理功能。环脂肽的理化性质较为稳定,在高温高压处理后仍可保持较高的抗菌活性,对氯仿等有机溶剂有一定的耐受力,抗紫外线,对蛋白酶类不敏感。环脂肽类化合物主要由革兰氏阳性芽孢杆菌代谢产生,具有抗菌、抗肿瘤、抗炎、抗支原体、降低胆固醇等生物活性[1]。
芽孢杆菌产生的环脂肽化合物主要分为三大类,即表面活性素家族(Surfactins)、芬枯草菌素家族(Fengycin family)和伊枯草菌素家族(Iturin family)。表面活性素Surfactin是由Arima等[2]首次在 Bacillus subtilis 发酵产物中分离获得,具有抗病毒、抗肿瘤、抗支原体、抗真菌以及抗细菌活性,具有很强的表面活性[3]。它的化学结构特点是一个3-羟基脂肪酸连接在由7个氨基酸形成的肽链上,并以内酯键的形式构成环状。又由于其2位(Leu/Ile/Val)、4位(Val/Leu/Ile/Ala)和7位(Leu/Val/Ile)氨基酸残基的不同和脂肪酸链长短(C12–C16)的不同,出现了较多的类似物(包括同系物)[4]。芬枯草菌素由3-羟基脂肪酸与10个氨基酸形成的肽链组成,由肽链的第10位氨基酸上的羧基和第3位Tyr上的羟基缩合形成环状结构[5-7],已发现6种类型(Fengycin A、B、A2、B2、C和S)[8-9]。它对丝状霉菌有良好的抑制作用,但对酵母和细菌仅有微弱的活性[10-11]。伊枯草菌素家族包括伊枯草菌素(Iturin) A、C、D、E及其类似物芽孢菌霉素(Bacillomycin) D、L、F,芽孢菌肽素(Bacillopeptin)和抗霉枯草菌素(Mycosubtilin)[12-14]。它们的化学结构中都含有一个C14–C17脂肪酸链和由7个氨基酸组成的肽链,由脂肪酸上的氨基和肽链中C末端氨基酸的羧基形成酰胺键形成环状结构。
Bacillomycin D 是Iturin家族中的主要成员,1980年由Peypoux等首次从枯草芽孢杆菌发酵液中分离提取并确定其化学结构[15]。Bacillomycin D是由非核糖体肽合成酶(Non-ribosomal peptide synthetases,NRPSs)通过一种称为“多载体硫模板机制(Multiple carrier thiotemplate mechanism)”的方式合成[16-17]。芽孢杆菌全基因组序列分析结果表明,很多菌株都携带有Bacillomycin D合成酶基因序列,但其生物合成和调控机制尚不清楚。Bacillomycin D对酵母菌和丝状真菌具有较强的抑制作用,对细菌抑菌活性较弱,对于其抗病毒、抗肿瘤活性还鲜有报道。由于其对很多植物病原真菌具有很好的抑制作用,因此很多研究将其焦点放在生物防治的应用中。
由于环脂肽化合物具有广谱抗菌活性,其抗菌机理不同于目前上市的任何一类抗生素,临床上表现出高效、低毒、不易产耐药性的特点,使其在医药领域具有良好的应用前景。另外,多种环脂肽化合物表现出显著的抗肿瘤活性。但是,由于环脂肽类化合物的表面活性显著,发酵液中同时存在多种环脂肽及其同系物,并且溶液中的环脂肽所表现出的溶解性、极性和胶束状态会随着样品浓度、杂质种类和杂质数量的变化而变化,因此获得高纯度的产品难度很大[18]。目前,仅放线菌来源的环脂肽化合物达托霉素的开发较为成功,2003年9月首次在美国上市,用于万古霉素抗性的粪肠球菌(VRE)及对耐甲氧西林金黄色葡萄球菌(MRSA)等革兰氏阳性细菌感染导致的并发性皮肤感染和皮肤结构感染[19]。
解淀粉芽孢杆菌Q-426菌株由本研究室从堆肥中分离所得,能够代谢产生至少7种环脂肽化合物,对多种植物病原真菌具有较强的生物活性。前期研究中,我们鉴定了Q-426菌株基因组中存在的芬枯草菌素(Fengycins)和伊枯草菌素(Iturins)合成酶基因序列,并用生物信息学以及分子生物学软件对其合成酶序列进行了详细的分析。同时,综合利用抑菌活性、HPLC、HPLC-MS、随机突变、定向基因敲除和双向电泳等方法研究了对Bacillomycin D和Fengycins生物合成影响较显著的内外调控因子[20-23]。然而,由于该菌株同时产生多种环脂肽化合物,并且由于环脂肽的特殊化学结构,使得获得单一种类的高纯度的环脂肽样品较为困难,限制该菌及其代谢产物的应用。因此,本文对原有Q-426菌株环脂肽的分离纯化方法进行了改进,最终分别获得C-15 Bacillomycin D和C-16 Bacillomycin D,纯度均达到90%以上,同时,对其抗肿瘤活性及机制进行了初步探讨,为其在医药领域的应用奠定了基础。
1 材料与方法1.1 材料解淀粉芽孢杆菌Q-426为本实验室从堆肥样品中筛选分离获得并保藏。宫颈癌细胞Hela由大连医科大学肿瘤研究中心王丽娜馈赠,人神经胶质癌细胞MG由大连医科大学基础医学院冯斌教授馈赠,人肝癌细胞Hep-G2、人结肠癌细胞HT-29购于上海细胞库。
1.2 环脂肽粗提样品的制备将解淀粉芽孢杆菌Q-426划线培养于LB固体培养基上,37 ℃培养16 h,挑取生长较好的单菌落活化于20 mL LB液体培养基中,37 ℃、200 r/min振荡培养12–14 h,按1%接种于500 mL FM液体培养基(g/L;胰蛋白胨12.4,葡萄糖20,氯化钠5,K2HPO4 1.5,MnSO4·H2O 0.04,FeSO4·7H2O 1.7,MgCl2·6H2O 1.2,pH 9.0),30 ℃、180 r/min振荡发酵72–76 h。离心去除菌体,用6 mol/L盐酸溶液将上清液pH调至2.0,4 ℃静置过夜,8 000 r/min离心15 min去掉上清,用pH 1.8超纯水洗涤沉淀3次,以10% (V/V)的甲醇分别抽提3次,每次抽提2 h,离心收集甲醇抽提液。42 ℃减压蒸干,加入5 mL超纯水溶解,pH调至中性,12 000 r/min离心10 min除去沉淀,上清液经0.22 μm醋酸纤维滤膜过滤保存于4 ℃。
1.3 环脂肽的分离与纯化将上述环脂肽粗品通过双树脂联合层析去除大部分杂质,最后利用高效液相色谱分离纯化得到纯品,具体过程如下。向填有HD-8树脂的层析柱中加入500 μL环脂肽粗提样品,用50%甲醇以0.5 mL/min的流速冲洗树脂。冲洗过程中,当柱子流出端出现白色浑浊状流出液时开始收集,当流出液变澄清透明时停止收集。将收集的白色浑浊流出液经旋转蒸发除去甲醇,pH调至2.0,12 000 r/min离心5 min,除去上清,用500 μL的超纯水溶解,保存于4 ℃。
向已预处理好的HZ-20ss树脂中加入500 μL经HD-8处理过环脂肽粗样品,室温、100 r/min静态吸附8 h,将吸附样品的树脂进行装柱。用5 BV的50%甲醇以6 BV/h的流速冲洗柱子,再用12 BV的90%甲醇以3 BV/h的流速洗脱环脂肽,收集洗脱液。将洗脱液经42 ℃、旋转蒸发除去甲醇,用500 μL的超纯水溶解,经0.22 μm醋酸纤维素膜过滤保存于4 ℃。
经过HZ-20ss树脂处理的样品利用制备型高效液相色谱进一步纯化。所用色谱柱为ShodexAsahipak ODP-50 6D,检测波长为210 nm,进样量20 μL,所使用的流动相A为水(0.08%三氟乙酸,TFA);流动相B为80%乙腈水溶液(0.08% TFA)。流动相流速:0.7 mL/min;洗脱流程:0–31 min,流动相A含量变化从50%到13%,流动相B含量变化从50%到87%。
1.4 环脂肽的ESI-MS/MS分析质谱条件:气体温度350 ℃;VCap 3.5 kV,Capillay 0.078 μA,Chamber 14.58 μA;碰撞电压75 V,Slimmer 65 V,OCT射频电压峰值750 V。MS范围:100–1 500 m/z,acquisition rate/time:1 spectra/s,1 000 ms/spectrum,transients/ spectrum:5 976。MS/MS范围:50–1 100 m/z,acquisition rate/time:1 spectra/s、1 000 ms/spectrum,transients/ spectrum:5 976。
1.5 MTS法检测环脂肽对肿瘤细胞增殖的影响将肿瘤细胞接种于96孔板中,培养24 h,按梯度浓度加入环脂肽作用48 h,每孔加入20 μL MTS工作液,37 ℃孵育4 h,在490 nm读取吸光值。每个样品重复3次,对照组以1 mmol/L DMSO代替样品。细胞存活率=1–(对照组平均值–空白)– (实验组–空白)/(对照组平均值–空白)
1.6 Hela细胞划痕实验采用划痕实验检测环脂肽对Hela细胞迁移的影响。取12孔板,每孔加入约5×105细胞,其数量以过夜铺满为佳,隔日用移液器枪头在每孔中央纵轴及横轴方向各划一条创伤区域,用PBS清洗细胞3次,加入无血清培养液稀释不同浓度的环脂肽,每隔一段时间观察两侧细胞向中间迁移的情况并拍照。
1.7 PI染色法检测Hela细胞凋亡与周期取对数生长期的Hela细胞接种于6孔板(105个/mL),培养24 h,分别加入50 μg/mL和70 μg/mL的C-16 Bacillomycin D,对照组加入DMSO(与最高浓度样品等量),继续培养48 h,小心收集细胞培养液到1.5 mL无菌离心管内,再将胰酶消化收集的贴壁细胞悬液至同一离心管内,4 ℃、1 000 r/min离心5 min,弃上清。加入1 mL提前预冷的PBS重悬细胞,并转移至1.5 mL无菌离心管,4 ℃、1 000 r/min离心5 min,重复2次,最后用1 mL PBS重悬细胞。加入1 mL的70%冰乙醇,轻轻吹打混匀,4 ℃固定24 h。于4 ℃、1 000 r/min离心5 min,弃上清,用PBS洗细胞沉淀数次。在每个待检细胞样品中,加入500 μL PI染色工作液,轻轻重悬细胞沉淀,置于37 ℃避光水浴30 min。用流式细胞仪在激发波长488 nm波长处检测红色荧光,同时检测光散射情况。
2 结果与分析2.1 解淀粉芽孢杆菌Q-426环脂肽的分离纯化我们在之前建立的解淀粉芽孢杆菌Q-426环脂肽制备方法的基础上,对其分离纯化方法进行了补充修改,增加了双树脂处理步骤。在第一步酸沉淀并甲醇抽提过程中,除环脂肽类物质,还有一些易溶于有机溶剂的物质、杂蛋白及色素溶于甲醇中,因此此时环脂肽提取液呈棕黄色(图 1A-a)。粗提液接着用大孔型强酸阳离子交换树脂(HD-8)处理,由于环脂肽带有负电荷,所以HD-8树脂不能与环脂肽进行离子交换,故在酸性环境中环脂肽经过该树脂后以白色浑浊液的状态优先被冲洗下来,而大部分的杂质和色素类物质被HD-8树脂吸附,环脂肽粗品呈无色(图 1A-b)。接着将环脂肽样品经过HZ-20ss色谱柱,用甲醇溶液将活性物质洗脱下来,此步可进一步除去杂质和残留色素。
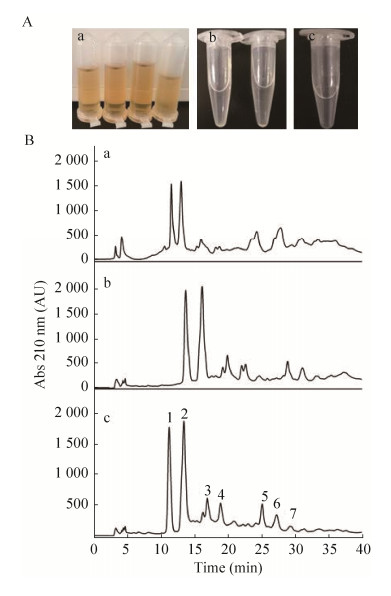 |
| 图 1 解淀粉芽孢杆菌Q-426环脂肽样品的分离纯化 Figure 1 Cyclic lipopeptides from B. amyloliquefaciens Q-426. (A) Products of lipopeptides. a: after methanol extraction; b: after treatment with HD-8 resin; c: after treatment with HD-8 and HZ-20ss resins. (B) HPLC chromatogram of cyclic lipopeptides purified by different method. a: after methanol extraction; b: after treatment with HD-8 resin; c: after treatment with HD-8 and HZ-20ss resins. Peaks 1–7 are main components with antifungal activity |
| 图选项 |
分别将甲醇抽提物、HD-8色谱柱流出液、HZ-20ss色谱柱流出液进行了HPLC检测,结果如图 1B所示,检测到共7组活性组分,可明显看出双柱联合处理后的样品组分杂质较少,分离度较好,基线稳定。根据峰面积归一化法计算得出组分1–7的产率分别为23.65%、36.29%、12.21%、9.80%、8.25%、7.79%和2.00%,相对于未纯化的粗提样品,活性组分产量(峰面积)均有提高,其中组分1和组分2的产率占总产一半以上,可将其单独制备,作进一步研究。
2.2 组分1和组分2的结构鉴定分别收集产率最大的组分1和组分2,HPLC检测结果表明其纯度分别为95.7%和93.1%,采用LC-ESI-MS方法测定分子量,如图 2所示,组分1得到两个离子峰,其m/z分别为1 045.556 8和1 067.537 3,分别推测为[M+H]+和[M+Na]+的分子离子峰;组分2得到两个离子峰,其m/z分别为1 059.574 2和1 081.556 8,分别推测为[M+H]+和[M+Na]+的分子离子峰。由于组分1和组分2的m/z相差为14,即-CH2-,猜测两个化合物互为同系物,且相差一个亚甲基。
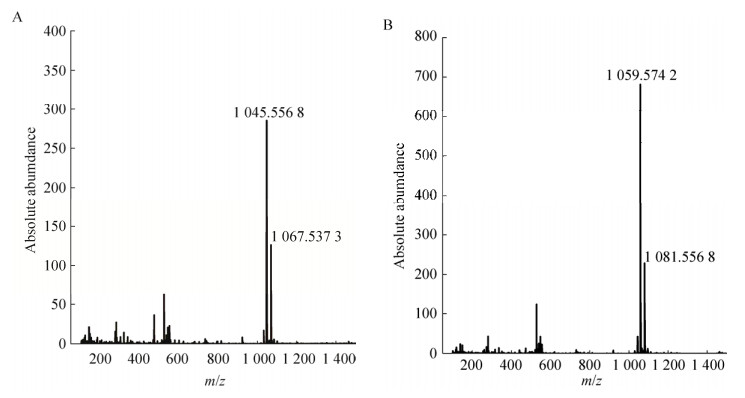 |
| 图 2 活性组分1和2的质谱图 Figure 2 Mass spectrometry of components 1 and 2. (A) Component 1. (B) Component 2 |
| 图选项 |
如图 3所示,环状肽链的断开较易发生于苏氨酸残基(Thr)的C末端、天门冬酰胺残基(Asn)和脯氨酸残基(Pro)之间的酰胺键。当前者发生断裂时会产生一些碎片离子,其m/z分别为944.5 (b5)、857.4 (b4)、631.4 (b3/y3)、517.2 (b2)、355.2 (b1)、240.2 (b0) (图 3A和B)。相应地,可以得到肽链的部分序列为N-Asn-Tyr-Asn-Pro-Glu-Ser-Thr-C。与此同时,Asn和Pro残基之间的肽键断开,获得了一些碎片离子(m/z):769.4 (b6)、656.4 (b7)、415.6 (b8)、947.5 (y1)、732.4 (y2)和392.2 (y4)。从而可以得到脂肪酸残基C和N末端的氨基酸残基序列,分别为N-Asn-Tyr-Asn-C和N-Pro-Glu-Ser-Thr-C (图 3A和C)。根据b0,脂肪酸残基的分子量240.2,即CH3(CH2)11CHNHCH2CO-,因此可以确定为C-15 β(3)-氨基脂肪酸,最终确定组分1为C-15 Bacillomycin D,同理分析组分2为C-16 Bacillomycin D (图 4)。
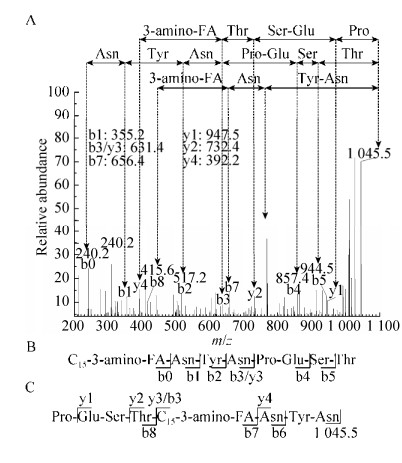 |
| 图 3 组分1单分子离子在m/z 1 045.5 Da的MS/MS分析 Figure 3 MS/MS analysis of a single peak obtianed at m/z 1 045.5 Da. (A) MS/MS profile. (B) Cleavage at C terminal of Thr. (C) Cleavage between Asn and Pro |
| 图选项 |
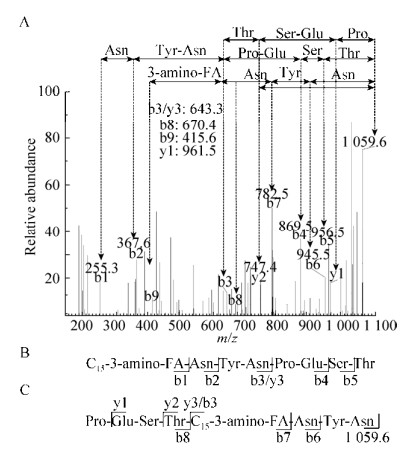 |
| 图 4 组分2单分子离子在m/z 1 059.6 Da的MS/MS分析 Figure 4 MS/MS analysis of a single peak obtianed at m/z 1 059.6 Da. (A) MS/MS profile. (B) Cleavage at C terminal of Thr. (C) Cleavage between Asn and Pro |
| 图选项 |
2.3 环脂肽对肿瘤细胞增殖的抑制作用MTS法检测结果显示,Bacillomycin D (C-15、C-16)混合物均能抑制Hela、MG、Hep-G2、HT-29四种肿瘤细胞的增殖。当Bacillomycin D混合液浓度为5 μg/mL时,Hela、MG、Hep-G2、HT-29四种细胞的存活率分别为75.00%、85.50%、33.15%和96.34%;当样品浓度为10 μg/mL时,存活率分别为64.50%、52.80%、33.09%和73.84%;当浓度为25 μg/mL时,存活率分别为25.60%、29.40%、24.30%和44.0%;当浓度为50 μg/mL时,存活率分别为5.30%、2.70%、20.24%和22.48%;当浓度为100 μg/mL时,肿瘤细胞存活率均低于20%,细胞增殖依次呈浓度依赖抑制。MTS细胞活性实验表明,相较之下,环脂肽对Hela细胞、MG细胞增殖抑制作用更加呈现浓度依赖性,即在相同作用时间下,细胞活力随着样品浓度的增加而逐渐降低(图 5)。
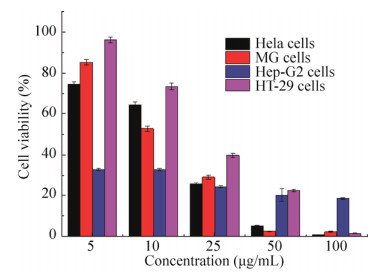 |
| 图 5 Bacillomycin D混合液对肿瘤细胞增殖的抑制作用 Figure 5 Inhibitory effect of Bacillomycin D mixture on the proliferation of tumor cells |
| 图选项 |
由于Bacillomycin D混合物对Hela细胞增殖的抑制作用明显,因此,分别考察了C-15 Bacillomycin D、C-16 Bacillomycin D和两者混合物对Hela细胞增殖的抑制作用(表 1)。C-16 Bacillomycin D的细胞抑制率略大于C-15 Bacillomycin D,而混合物的细胞抑制率又略大于C-16 Bacillomycin D。总之,长链环脂肽的抑制率较短链环脂肽略高,浓度达50 μg/mL时,细胞抑率可达55%以上,故后续试验选用C-16 Bacillomycin D进行细胞凋亡研究。
表 1 Hela细胞存活率(%)Table 1 Viability of Hela cells disposed by Bacillomycin D
| Concentration (μg/mL) | 5 | 10 | 25 | 50 | 100 |
| C-15 Bacillomycin D | 94.7 | 76.1 | 64.8 | 54.7 | 48.4 |
| C-16 Bacillomycin D | 87.1 | 81.4 | 71.0 | 58.6 | 52.9 |
| Bacillomycin Dmixture | 87.1 | 70.8 | 64.5 | 50.8 | 49.0 |
表选项
2.4 C-16 Bacillomycin D对Hela细胞侵袭和迁移的影响划痕实验是测定肿瘤细胞运动特性的方法之一。在体外培养的单层细胞上划痕使细胞致伤,加入样品后观察其对肿瘤细胞迁移的影响。肿瘤细胞在转移过程中需要侵袭和迁移能力使其顺利进入淋巴管和血管,并侵入其他器官与组织,细胞只能对相邻组织或器官侵袭,若想转移,还需特异性粘附因子等特异性物质及其他复杂过程协助,所以划痕实验可考察细胞致伤后是否还能愈伤,继续具备相应的侵袭与迁移能力。将不同浓度的C-16 Bacillomycin D作用于Hela细胞,如图 6所示,与DMSO相比,细胞的迁移能力明显减弱,并呈现浓度依赖性,70 μg/mL样品处理细胞24 h后,细胞迁移能力明显被抑制。
 |
| 图 6 C-16 Bacillomycin D对Hela细胞迁移能力的影响 Figure 6 Effect of C-16 bacillomycin D on Hela cell migration ability. (A) 0 h. (B) 24 h |
| 图选项 |
2.5 C-16 Bacillomycin D对Hela细胞凋亡和周期的影响利用细胞流式仪PI染色法检测C-16 Bacillomycin D对人乳腺癌Hela细胞凋亡影响结果表明,未用环脂肽处理的细胞主要为活细胞,随着药物浓度的增大凋亡早期细胞所占比例不断增加,凋亡晚期细胞所占比例也呈增加趋势,当达到一定浓度后凋亡早期细胞逐渐减少。
不同浓度C-16 Bacillomycin D作用于Hela细胞后,随浓度增加,G0G1期细胞比例逐渐减少,S期细胞比例逐渐增多,G2M期比例变化不大。在样品浓度为50 μg/mL时,G0G1期细胞比例从对照组的89.03%减至74.07%,浓度为70 μg/mL时,急剧减至22.81%,说明C-16 Bacillomycin D诱导G0G1期阻滞(图 7)。
 |
| 图 7 流式细胞术检测C-16 Bacillomycin D对Hela细胞周期影响 Figure 7 Cell cycle distribution of Hela cells treated with C-16 Bacillomycin D |
| 图选项 |
3 讨论解淀粉芽孢杆菌 B. amyloliquefaciens 是芽孢杆菌 Bacillus 属中的一员,与枯草芽孢杆菌 B. subtilis 亲缘性很高。多株解淀粉芽孢杆菌已被报道能够代谢产生多种环脂肽化合物,还有一些菌株的全基因测序结果表明其携带环脂肽合成基因[24]。截至目前,对解淀粉芽孢杆菌环脂肽的研究主要集中于其化合物结构的鉴定、发酵液或混合物的生物活性的测定以及发酵液或菌液在生物农药领域的应用等方面[25]。由于芽孢杆菌往往在其生长过程中代谢产生多种环脂肽或同类环脂肽的同系物,因此,对其单一化合物的生物活性的研究遇到瓶颈,阻碍了其在医药领域的研究和应用。环脂肽化合物由于其独特的结构特性及生物活性,已成为各大医药公司争相开发的对象,而目前只有达托霉素成功应用于医疗领域。达托霉素是玫瑰孢链霉菌发酵产物脂肽类化合物A21978C的N-癸酰基衍生物,为酸性环脂肽类抗生素,含有13个氨基酸,其中10个氨基酸形成环十脂肽,另外3个氨基酸与癸酰基相连形成侧链,结构复杂,很难进行化学合成。
为了获得纯度较高的环脂肽单体,本文对以前的制备工艺进行了优化,经过发酵、两步酸沉淀法、甲醇抽提、双树脂联合层析,从500 mL发酵液中分离纯化得到61 mg环脂肽混合物(主要成分为Iturins和Fengycins),7种环脂肽组分的产率分别为23.65%、36.29%、12.21%、9.80%、8.25%、7.79%和7.00%。其中,组分1与组分2的产率最大,经HPLC-MS和MS/MS分析鉴定为C-15 Bacillomycin D与C-16 Bacillomycin D。
Surfactin是由Arima从枯草芽孢杆菌IFO3039发酵液中发现的脂肽化合物,具有很强的表面活性,故命名为Surfactin。Surfactin也是由7个氨基酸和1个C13-C16脂肪酸链组成,但是与Bacillomycin D不同,其由脂肪酸的3位羟基和肽链C末端亮氨酸形成内酯键而构成环状结构。Surfactin除具有较强的表面活性外,还具有抗菌、抗病毒、抗支原体、抗肿瘤和抗炎活性。Kim等报道Surfactin对人结肠癌LoVo细胞增殖具有很强的抑制活性,其抑制活性呈浓度和时间依赖性,其IC50 (作用48 h)值为26 μmol/L,在80 μmol/L浓度下处理24 h可使80%以上的细胞发生凋亡。LoVo细胞经30 μmol/L Surfactin处理24 h后,G0/G1期的细胞增多10%,25%?30%的细胞被阻滞于细胞周期G0/G1期内。RT-PCR和Western blotting实验证明,Surfactin是通过抑制ERK和PI3K/Akt活性从而使LoVo细胞发生凋亡和细胞周期阻滞。Vollenbroich等测定了来源于枯草芽孢杆菌的Surfactin对Molt、HeP2、H9、Vero、MT-4等细胞增殖的影响,发现它们的IC50值在30?65 μmol/L [26]。Cao等研究了Surfactin对乳腺癌MCF-7细胞的增殖与凋亡的影响,发现Surfactin对乳腺癌细胞MCF-7的IC50值(作用48 h)为27.3 μmol/L,可引发细胞周期G2/M的阻滞,并且通过ROS/JNK信号通路来诱导细胞的凋亡[27-28]。
目前除Surfactins外,还没有其他环脂肽化合物单体是否具有抗肿瘤活性的报道。为研究解淀粉芽孢杆菌Q-426环脂肽对肿瘤细胞的抑制活性,本文选用MTS法检测C-15 Bacillomycin D、C-16 Bacillomycin D及两种环脂肽1:1混合液对不同肿瘤细胞增殖的抑制作用。将环脂肽混合液以不同浓度作用于Hela、MG、Hep-G2、HT-29细胞,经MTS法检测,样品对Hela和MG细胞呈浓度依赖性。C-16 Bacillomycin D的细胞抑制率略大于C-15 Bacillomycin D,而混合液的细胞抑制率又略大于C-16 Bacillomycin D。总之,长链肽的抑制率较短链肽的略高。Bacillomycin D混合液对Hela、MG、HT-29细胞的IC50值(作用48 h)分别为13.4、11.5、15.4 μmol/L,其抑制肿瘤细胞增殖的效率略高于Surfactin。
以MTS法检测C-16 Bacillomycin D对宫颈癌细胞Hela的增殖抑制,当其浓度为50 μg/mL时,细胞增殖抑制率可达55%以上,细胞凋亡率达59.1%;浓度为70 μg/mL时,细胞的迁移能力明显被抑制,细胞凋亡率达71.1%,G0G1期细胞的比例减少,S期细胞的比例增多,G2M期细胞的比例变化不大,则初步证实Bacillomycin D诱导G0G1期阻滞。Bacillomycin D引发Hela细胞凋亡的具体机制和信号通路还有待进一步研究。
新抗生素达托霉素的上市,使环脂肽类化合物成为医药研发的热点。但是目前对于环脂肽的研究主要集中在其抗菌活性的研究上,对其抗肿瘤活性的研究比较少。同时,不同种类环脂肽及其同系物与其生物活性之间的相互关系也不清楚,主要原因是由于很难得到纯度高且成分单一的产物。若利用基因编辑技术规划其生物合成路径,或利用代谢调控和分离技术可得到单一组分纯品,将加快环脂肽化合物在医药领域的基础及应用研究。
参考文献
| [1] | Zhao PC, Wang JH, Quan CS, et al. Progress on biosynthesis of antimicrobial peptides from Bacillus subtilis.China Biotechnol, 2010, 30(10): 108–113.(in Chinese). 赵朋超, 王建华, 权春善, 等. 枯草芽孢杆菌抗菌肽生物合成的研究进展.中国生物工程杂志, 2010, 30(10): 108-113. |
| [2] | Arima K, Kakinuma A, Tamura G. Surfactin, a crystalline peptidelipid surfactant produced by Bacillus subtilis: isolation, characterization and its inhibition of fibrin clot formation.Biochem Biophys Res Commun, 1968, 31(3): 488–494.DOI: 10.1016/0006-291X(68)90503-2 |
| [3] | Peypoux F, Bonmatin JM, Wallach J. Recent trends in the biochemistry of surfactin.Appl Microbiol Biotechnol, 1999, 51(5): 553–563.DOI: 10.1007/s002530051432 |
| [4] | Liu XY, Yang SZ, Mou BZ. Molecular structures of microbial lipopeptides.Biotechnol Bull, 2005, 21(4): 18–26.(in Chinese). 刘向阳, 杨世忠, 牟伯中. 微生物脂肽的结构.生物技术通报, 2005, 21(4): 18-26. |
| [5] | Koumoutsi A, Chen XH, Henne A, et al. Structural and functional characterization of gene clusters directing nonribosomal synthesis of bioactive cyclic lipopeptides in Bacillus amyloliquefaciens strain FZB42.J Bacteriol, 2004, 186(4): 1084–1096.DOI: 10.1128/JB.186.4.1084-1096.2004 |
| [6] | Nihorimbere V, Cawoy H, Seyer A, et al. Impact of rhizosphere factors on cyclic lipopeptide signature from the plant bene?cial strain Bacillus amyloliquefaciens S499.FEMS Microbiol Ecol, 2012, 79(1): 176–191.DOI: 10.1111/j.1574-6941.2011.01208.x |
| [7] | Vanittanakom N, Loeffler W, Koch U, et al. Fengycin-a novel antifungal lipopeptide antibiotic produced by Bacillus subtilis F-29-3.J Antibiot, 1986, 39(7): 888–901.DOI: 10.7164/antibiotics.39.888 |
| [8] | Sang-Cheol L, Kim SH, Park IH, et al. Isolation, purification, and characterization of novel fengycin S from Bacillus amyloliquefaciens LSC04 degrading-crude oil.Biotechnol Bioprocess Eng, 2010, 15(2): 246–253.DOI: 10.1007/s12257-009-0037-8 |
| [9] | Chen LL, Wang N, Wang XM, et al. Characterization of two anti-fungal lipopeptides produced by Bacillus amyloliquefaciens SH-B10.Bioresour Technol, 2010, 101(22): 8822–8827.DOI: 10.1016/j.biortech.2010.06.054 |
| [10] | Ongena M, Jourdan E, Adam A, et al. Surfactin and fengycin lipopeptides of Bacillus subtilis as elicitors of induced systemic resistance in plants.Environ Microbiol, 2007, 9(4): 1084–1090.DOI: 10.1111/emi.2007.9.issue-4 |
| [11] | Hofemeister J, Conrad B, Adler B, et al. Genetic analysis of the biosynthesis of non-ribosomal peptide-and polyketide-like antibiotics, iron uptake and biofilm formation by Bacillus subtilis A1/3.Mol Genet Genomics, 2004, 272(4): 363–378.DOI: 10.1007/s00438-004-1056-y |
| [12] | Maget-Dana R, Peypoux F. Iturins, a special class of pore-forming lipopeptides: biological and physicochemical properties.Toxicology, 1994, 87(1/3): 151–174. |
| [13] | Stein T. Bacillus subtilis antibiotics: structures, syntheses and specific functions.Mol Microbiol, 2005, 56(4): 845–857.DOI: 10.1111/j.1365-2958.2005.04587.x |
| [14] | Kajimura Y, Sugiyama M, Kaneda M. Bacillopeptins, new cyclic lipopeptide antibiotics from Bacillus subtilis FR-2.J Antibiot, 1995, 48(10): 1095–1103.DOI: 10.7164/antibiotics.48.1095 |
| [15] | Peypoux F, Marion F, Michel G, et al. Structure of bacillomycin D, a new antibiotic of the iturin Group.Eur J Biochem, 1981, 118(2): 323–327. |
| [16] | Shen QT, Chen XL, Sun CY, et al. Dissecting and exploiting nonribosomal peptide synthetases.Acta Biochim Biophys Sin, 2004, 36(4): 243–249.DOI: 10.1093/abbs/36.4.243 |
| [17] | Khan NH, Roets E, Hoogmartens J, et al. Quantitative analysis of oxytetracycline and related substances by high-performance liquid chromatography.J Chromatogr A, 1987, 405: 229–245.DOI: 10.1016/S0021-9673(01)81765-9 |
| [18] | Gu KB, Guan C, Xu JH, et al. Pilot-scale purification of lipopeptide from marine-derived Bacillus marinus.Chin J Biotech, 2016, 32(11): 1549–1563.(in Chinese). 顾康博, 管成, 许家慧, 等. 中试规模纯化海洋芽孢杆菌源脂肽类化合物.生物工程学报, 2016, 32(11): 1549-1563. |
| [19] | Kleinkauf H, Von D?hren H. Nonribosomal biosynthesis of peptide antibiotics.Eur J Biochem, 1990, 192(1): 1–15.DOI: 10.1111/ejb.1990.192.issue-1 |
| [20] | Zhao J, Zhao PC, Quan CS, et al. Comparative proteomic analysis of antagonistic Bacillus amyloliquefaciens Q-426 cultivated under different pH conditions.Biotechnol Appl Biochem, 2015, 62(4): 574–581.DOI: 10.1002/bab.2015.62.issue-4 |
| [21] | Zhao PC, Quan CS, Wang YG, et al. Bacillus amyloliquefaciens Q-426 as a potential biocontrol agent against Fusarium oxysporum f. sp. spinaciae.J Basic Microbiol, 2014, 54(5): 448–456.DOI: 10.1002/jobm.v54.5 |
| [22] | Zhao PC, Quan CS, Jin LM, et al. Sequence characterization and computational analysis of the non-ribosomal peptide synthetases controlling biosynthesis of lipopeptides, fengycins and bacillomycin D, from Bacillus amyloliquefaciens Q-426.Biotechnol Lett, 2013, 35(12): 2155–2163.DOI: 10.1007/s10529-013-1320-5 |
| [23] | Zhao PC, Quan CS, Jin LM, et al. Effects of critical medium components on the production of antifungal lipopeptides from Bacillus amyloliquefaciens Q-426 exhibiting excellent biosurfactant properties.World J Microbiol Biotechnol, 2013, 29(3): 401–409.DOI: 10.1007/s11274-012-1180-5 |
| [24] | Chen XH, Koumoutsi A, Scholz R, et al. Comparative analysis of the complete genome sequence of the plant growth-promoting bacterium Bacillus amyloliquefaciens FZB42.Nat Biotechnol, 2007, 25(9): 1007–1014.DOI: 10.1038/nbt1325 |
| [25] | Zhang DJ, Liu RF, Li YG, et al. Two new antifungal cyclic lipopeptides from Bacillus marinus B-9987.Chem Pharm Bull, 2010, 58(12): 1630–1634.DOI: 10.1248/cpb.58.1630 |
| [26] | Kim SY, Kim JY, Kim SH, et al. Surfactin from Bacillus subtilis displays anti-proliferative effect via apoptosis induction, cell cycle arrest and survival signaling suppression.FEBS Lett, 2007, 581(5): 865–871.DOI: 10.1016/j.febslet.2007.01.059 |
| [27] | Cao XH, Wang AH, Jiao RZ, et al. Surfactin induces apoptosis and G2/M arrest in human breast cancer MCF-7 cells through cell cycle factor regulation.Cell Biochem Biophys, 2009, 55(3): 163–171.DOI: 10.1007/s12013-009-9065-4 |
| [28] | Cao XH, Wang AH, Wang CL, et al. Surfactin induces apoptosis in human breast cancer MCF-7 cells through a ROS/JNK-mediated mitochondrial/ caspase pathway.Chem Biol Interact, 2010, 183(3): 357–362.DOI: 10.1016/j.cbi.2009.11.027 |
