

山西农业大学 食品科学与工程学院,山西 太谷 030801
收稿日期:2016-11-10;接收日期:2017-03-15 基金项目:山西省科技重点研发计划项目(No. 2015-TN-10) 资助
摘要: 本研究对水溶醇沉法提取的鸡腿菇粗多糖脱蛋白方法进行了比较,最终确定Sevage法为最优的脱蛋白方法。经DEAE-纤维素52离子交换及Sephadex G-200分子层析柱分级、纯化,最终得到2个主要的多糖组分Ccp-Ⅰ-A和Ccp-Ⅰ-B。理化性质测定结果表明,二者均为白色絮状固体,能溶于水,不溶于无水乙醇、丙酮等有机溶剂;与斐林试剂,CTAB、硫酸-咔唑、碘-碘化钾及三氯化铁反应均为阴性。GC测定结果可知Ccp-Ⅰ-A主要由甘露糖、葡萄糖和半乳糖组成,摩尔比为2.03:9.52:1;Ccp-Ⅰ-B主要由岩藻糖和半乳糖组成,其摩尔比为1:5.21。另外,Ccp-Ⅰ-A和Ccp-Ⅰ-B对DPPH和·OH显示出良好的清除能力,而且,相比于Ccp-Ⅰ-B,Ccp-Ⅰ-A的清除能力更高,当浓度为300 μg/mL,其对DPPH和·OH的清除能力可分别达到72.1%和55.3%。
关键词: 鸡腿菇多糖 纯化 理化性质 抗氧化
Separation, purification and antioxidant activity of polysaccharide from Coprinus comatus
Nü Xu, Tianzhen Zhang, Xufeng Chen, Hao Zhang, Rufu Wang


Food Science and Engineering College, Shanxi Agricultural University, Taigu 030801, Shanxi, China
Received: November 10, 2016; Accepted: March 15, 2017
Supported by: Research and Development Projects of Shanxi Provincial Science and Technology (No. 2015-TN-10)
Corresponding author:Rufu Wang. Tel: +86-354-6288325; E-mail: wrf558@126.com
Abstract: We compared the ways of deproteinization for crude polysaccharides of Coprinus comatus, and finally selected Sevage method as the optimal method. Two main fractions of Ccp-Ⅰ-A and Ccp-Ⅰ-B were obtained after DEAE-52 cellulose and Sephadex G-200 chromatography, both were white-floc, soluble in water, insoluble in absolute ethyl alcohol, acetone and other organic solvents. Additionally, Fehling reagent, CTAB, Sulphuric acid-carbazole, I-KI and FeCl3 reaction were all negative. GC analysis showed Ccp-Ⅰ-A was composed of mannitose, glucose and galactose in molar ratios of 2.03:9.52:1, whereas Ccp-Ⅰ-B was composed of fucose and galactose with molar ratios of 1:5.21. Antioxidant activity test showed that Ccp-Ⅰ-A and Ccp-Ⅰ-B had good scavenging abilities on DPPH and ·OH. Compared to Ccp-Ⅰ-B, the scavenging activity of Ccp-Ⅰ-A was much stronger, and the scavenging rate could reach 72.1% and 55.3% respectively when the concentration was 300 μg/mL.
Key words: Coprinus comatus polysaccharides purification physico-chemical property antioxidation
鸡腿菇,学名毛头鬼伞Coprinus comatus,是一种名贵的食用和药用真菌,味甘滑性平,有益脾、清心安神,经常食用有助消化、增加食欲和治疗痔疮[1]。现代研究结果还证实其具有降血糖[2-3]、提高免疫活性[4-5]和抗肿瘤[6]等生物学功能。鸡腿菇子实体含有丰富的糖类,总糖含量为57.65%,其中还原糖的含量为53.54%,多糖含量为4.11%,是鸡腿菇发挥生理功能的重要组成成分[7]。
目前关于鸡腿菇多糖活性的研究,大都是采用其多糖粗提物[8-9],并未对纯化、分级后的多糖各组分进行系统研究,而关于其单糖组分、物理化学性质及结构解析更加鲜有报道。本文主要对鸡腿菇子实体多糖组分进行了分离纯化,初步研究各多糖组分的理化性质及抗氧化生物活性,以期为鸡腿菇子实体多糖的开发提供理论依据。
1 材料与方法1.1 主要材料与试剂鸡腿菇子实体干粉由山西农业大学食用菌中心提供。DEAE-纤维素52购于Whatman公司。Sephadex G-200购于Pharmacia公司。DPPH购自北京索莱宝科技有限公司。
1.2 主要仪器设备F22E型可见分光光度计(上海精密科学仪器有限公司);HL-1型恒流泵(上海青浦沪西仪器厂);真空冷冻干燥机(德国KENDRO公司);TDL-4低速离心机(上海安亭科学仪器厂);HHS-21-4数显恒温水浴锅(上海博讯实业有限公司医疗设备厂);R201D-11旋转蒸发仪(郑州长城工贸有限公司);GC-2010型气相色谱仪(日本岛津仪器公司)。
1.3 方法1.3.1 鸡腿菇子实体多糖的提取准确称取一定质量的鸡腿菇子实体的干粉,放入圆底烧瓶中,按照料液比为1:25加入蒸馏水,混合均匀,在90 ℃水浴条件下浸提4 h,重复提取2次后,4 000 r/min离心15 min,取上清液,加入3倍体积的95%乙醇,4 ℃下醇沉过夜,之后4 000 r/min离心15 min,取沉淀真空冷冻干燥,研钵研碎即鸡腿菇粗多糖样品。采用苯酚-硫酸法和考马斯亮蓝染色法进行多糖和蛋白质含量的测定。
1.3.2 鸡腿菇子实体多糖的脱蛋白方法Sevage法脱蛋白:将1.3.1中得到的粗多糖样品配制成1%的粗多糖溶液,将粗多糖溶液与Sevage试剂(氯仿:正丁醇=4:1) 按4:1的比例混匀,振荡20 min后静置30 min,3 500 r/min离心20 min去沉淀,测定上清液中多糖含量和蛋白质含量。
三氯乙酸(TCA)法脱蛋白:将1.3.1中得到的粗多糖样品配制成1%的粗多糖溶液,向粗多糖溶液中加入终浓度为12%的TCA,振荡20 min后静置30 min,3 500 r/min离心15 min去沉淀,测定上清中多糖和蛋白质的含量。
鸡腿菇子实体多糖的柱层析:DEAE-纤维素52离子交换柱层析:鸡腿菇粗多糖经Sevage法去除蛋白质后,流水透析48 h (除去无机离子、低聚糖等杂质),采用旋转蒸发仪浓缩,使其浓度达到10 mg/mL。将1 mL浓缩好的鸡腿菇糖液加到处理好的DEAE-纤维素52离子交换柱(30 cm×2.0 cm)中,依次用浓度为0.15、0.25、0.35、0.45 mol/L NaCl的0.02 mol/L磷酸盐缓冲液(pH 7.4) 进行分段梯度洗脱,洗脱速率为36 mL/h,每管3 mL分布收集,每个梯度收集10管,即每个梯度的洗脱体积为30 mL。采用苯酚-硫酸法逐管检测多糖含量。
Sephadex G-200凝胶柱层析:经DEAE-纤维素52离子交换层析后得到的多糖峰值管中的收集液合并,浓缩5倍后经Sephadex G-200层析柱(50 cm×1.0 cm)层析,上样量为1 mL,用0.005 mol/L的磷酸盐缓冲液(pH 6.2) 进行洗脱,采用苯酚-硫酸法逐管检测多糖含量。
1.3.3 多糖基本理化性质测试纯化后的鸡腿菇多糖Ccp-Ⅰ-A和Ccp-Ⅰ-B在水、乙醇、乙醚、丙酮、氯仿、正丁醇等有机溶剂中的溶解度,进行斐林试剂反应,三氯化铁反应,CTAB反应和硫酸-咔唑反应,碘-碘化钾反应[10]。
1.3.4 多糖的单糖组成分析取待分析的Ccp-Ⅰ-A和Ccp-Ⅰ-B多糖样品10 mg于10 mL离心管中,加入2 mL CF3COOH (TFA),充氮气封管于120 ℃下油浴3 h。减压蒸干水解液,加甲醇反复处理5次,以除尽CF3COOH,真空干燥水解物,然后进行衍生化。
衍生物的制备(糖腈乙酰酯化衍生法):称取10 mg固体水解糖样、10 mg盐酸羟胺和1 mL无水吡啶,待溶解后于90 ℃下水浴反应30 min并间歇振荡。取出后冷却至室温,加入1 mL无水醋酸酐,于90 ℃下继续水浴反应30 min进行乙酰化。取出后在冰浴中迅速冷却,加入1 mL蒸馏水搅拌,用氯仿萃取3次,合并氯仿层,减压蒸干。
样品用1 mL氯仿溶解后,用0.22 μm有机微孔滤膜过滤备用。
气相色谱检测条件如下:
色谱柱:毛细管柱DB-17,30 m,I.D. 0.25 μm;载气:N2,流速:30 mL/min;燃气:H2,流速:40 mL/min;助燃气:空气,流速:400 mL/min;分流比:100:1;检测器:FID1;汽化室温度:320 ℃;检测器温度:320 ℃;色谱柱温度:190 ℃。
1.3.5 抗氧化活性总还原能力的测定:参考Oyaizu等[11]的方法并略做改动。基本操作步骤为:1 mL样品溶液,加入2.5 mL的0.2 mol/L磷酸缓冲液(pH 6.6) 和2.5 mL 1% K3[Fe(CN)6]于试管中混匀,50 ℃水浴中反应20 min,迅速冷却并加入2.5 mL 10% TCA,混匀后3 500 r/min离心10 min,取3 mL上清液加入0.6 mL 0.1% FeCl3混匀,再加3 mL蒸馏水摇匀,波长700 nm测定。以蒸馏水为空白对照,Vc为阳性对照。
DPPH自由基清除能力测定:取3 mL样品溶液,加入1 mL无水乙醇配制的DPPH溶液,振荡后室温条件下放置于暗处30 min,用无水乙醇调零,于517 nm波长处测定其吸光度(A1);空白组用3 mL无水乙醇代替样品溶液,其余处理同上,在517 nm下测定吸光度(A0);对照组用1 mL无水乙醇代替DPPH溶液,其余处理同上,在517 nm下测定吸光度(A2);以Vc作阳性对照。
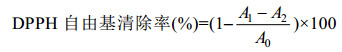 |
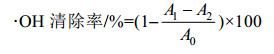 |
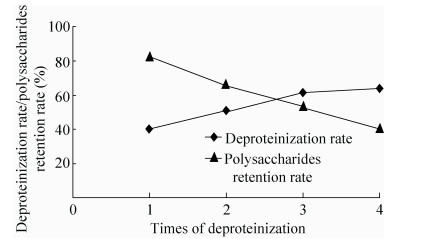 |
| 图 1 Sevage法脱蛋白结果 Figure 1 Results of deproteinization by Sevage method. |
| 图选项 |
2.1.2 TCA法脱蛋白TCA法脱蛋白的结果如图 2所示。由图 2可知,鸡腿菇多糖中蛋白质的脱除率随脱蛋白次数的增加而提高,当用此法重复脱蛋白2次以后,蛋白脱除率的增加幅度渐趋于平缓,而多糖保留率随脱蛋白次数的增加而降低,因此选择用TCA法脱蛋白2次,此时蛋白质脱除率为72.27%,多糖保留率为59.23%。
 |
| 图 2 TCA法脱蛋白结果 Figure 2 Results of deproteinization by TCA method. |
| 图选项 |
表 1试验结果显示采用Sevage法脱蛋白3次后得到的鸡腿菇多糖的抗氧化活性明显强于采用TCA法脱蛋白2次后的多糖。TCA法是根据蛋白质在有机溶剂中容易变性沉淀的特点将其除去,具有蛋白脱除率高、操作简单等优点。然而用此法脱除蛋白质时,低浓度的TCA可使变性蛋白在沉淀过程中吸附部分多糖,从而导致多糖的损失;高浓度的TCA会同时沉淀变性的游离蛋白和部分糖肽,并且会引起糖链的断裂导致部分多糖降解,进而对多糖的活性造成不利影响[6]。因此从保护多糖活性等角度出发,本文采用Sevage法脱蛋白。
表 1 采用两种方法脱蛋白后的鸡腿菇多糖的抗氧化活性比较Table 1 Antioxidant activity of Ccp-S3 and Ccp-T2
| Antioxidant activity | |||
| DPPH scavenging rate (%) | ·OH scavenging rate (%) | OD700 | |
| VC (300 μg/mL) | 70.0 | 30.0 | 1.20 |
| Ccp-S3 (300 μg/mL) | 27.1 | 10.1 | 0.21 |
| Ccp-T2 (300 μg/mL) | 20.0 | 8.2 | 0.15 |
| Ccp-S3: deproteinization three times by Sevage method; Ccp-T2: deproteinization two times by TCA method. | |||
表选项
2.2 鸡腿菇多糖的柱层析2.2.1 DEAE-纤维素52离子交换层析将经过脱蛋白和透析处理的鸡腿菇多糖样品,按照1.3.2中的方法进行DEAE-纤维素52离子交换层析,梯度洗脱,每个梯度收集10管,每管3 mL,用苯酚-硫酸法跟踪监测多糖含量,得到洗脱曲线,见图 3。其中1–10管为0.15 mol/L NaCl洗脱收集的组分,10–20管为0.25 mol/L NaCl洗脱收集的组分,20–30管为0.35 mol/L NaCl洗脱收集的组分,30–40管为0.45 mol/L NaCl洗脱收集的组分。共收集到3个主要洗脱峰依次命名为Ccp-Ⅰ、Ccp-Ⅱ和Ccp-Ⅲ。
 |
| 图 3 DEAE-52离子交换柱梯度洗脱图 Figure 3 Gradient elution of Coprinus polysaccharide by DEAE-52 cellulose chromatography. |
| 图选项 |
2.2.2 Sephadex G-200凝胶层析将经DEAE-纤维素52离子交换层析柱纯化后所得主要多糖洗脱峰Ccp-Ⅰ (9–14管)合并收集,浓缩5倍过Sephadex G-200层析柱,用0.005 mol/L的磷酸盐缓冲液(pH 6.2) 进行洗脱,苯酚-硫酸法跟踪监测多糖含量,洗脱曲线如图 4。收集到2个主要洗脱峰Ccp-Ⅰ-A和Ccp-Ⅰ-B。
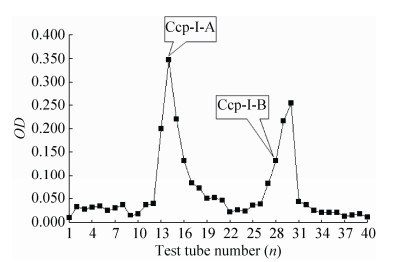 |
| 图 4 Sephadex G-200柱层析洗脱图 Figure 4 Elution of Ccp-Ⅰ by Sephadex G-200 chromatography. |
| 图选项 |
2.3 鸡腿菇多糖的一般理化性质鸡腿菇纯化多糖Ccp-Ⅰ-A和Ccp-Ⅰ-B的一般理化性质测定结果如表 2所示。Ccp-Ⅰ-A和Ccp-Ⅰ-B均为白色絮状固体,能溶于水,不溶于无水乙醇、乙醚、丙酮、氯仿及正丁醇等有机溶剂;两种多糖与斐林试剂和三氯化铁反应均为阴性,说明不含游离单糖和多酚类物质;与CTAB和硫酸-咔唑反应阴性,说明不含有糖醛酸;与碘-碘化钾反应阴性,说明不是淀粉类多糖。
表 2 鸡腿菇多糖的一般理化性质Table 2 The general physico-chemical property of Ccp-Ⅰ-A and Ccp-Ⅰ-B
| Ccp-Ⅰ-A | Ccp-Ⅰ-B | |
| Appearance | White-floc solid | White-floc solid |
| Solubility | ||
| Water | Soluble | Soluble |
| Ethyl alcohol | Insoluble | Insoluble |
| Ether | Insoluble | Insoluble |
| Acetone | Insoluble | Insoluble |
| Chloroform | Insoluble | Insoluble |
| N-butanol | Insoluble | Insoluble |
| Chemical Reaction | ||
| Fehling reagent | – | – |
| FeCl3 | – | – |
| CTAB | – | – |
| Sulphuric Acid-carbazole | – | – |
| I-KI | – | – |
| Note:“–”, negative. | ||
表选项
2.4 鸡腿菇多糖的单糖组成鸡腿菇纯化多糖Ccp-Ⅰ-A样品经酸水解并进行糖腈乙酸酯衍生化,在1.3.4的检测条件下所得结果如图 5和图 6所示。各单糖峰面积/对应分子量所得的比值即为各单糖的摩尔比,由分析可知,Ccp-Ⅰ-A由甘露糖、葡萄糖和半乳糖组成,摩尔比为2.03:9.52:1。相似地,吴艳兵等[13]采用高效阴离子色谱法(HPAEC),对经乙醇分级沉淀及DEAE Sephadex A-25离子交换纯化后的鸡腿菇子实体多糖组分CCP60中的单糖组成进行分析,结果表明其主要由葡萄糖和半乳糖组成。
 |
| 图 5 Ccp-Ⅰ-A多糖样品的气相色谱图 Figure 5 Gas chromatograms of Ccp-Ⅰ-A. |
| 图选项 |
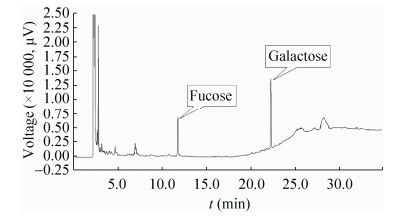 |
| 图 6 Ccp-Ⅰ-B多糖样品的气相色谱图 Figure 6 Gas chromatograms of Ccp-Ⅰ-B. |
| 图选项 |
Ccp-Ⅰ-B由岩藻糖和半乳糖组成,其摩尔比为1:5.21。姚毓婧等[14]也对鸡腿菇子实体多糖组分CC30w-l完全酸水解后进行HPAEC-PAD分析,结果表明其主要由岩藻糖和半乳糖组成,其摩尔比为1:4.02。Fan等[15]也曾在鸡腿菇菌丝体中获得岩藻半乳聚糖。另外,其他真菌也曾被报道存在岩藻半乳聚糖,如树舌Ganoderma applanatum中的岩藻半乳聚糖[16]、拟层孔菌属Fomitopsis fraxionea[17]、绒状火菇Flammulina velutipes[18]、猪苓Polyporus pinicola[19]、火绒蕈Polyporus fomentarius和桑黄Polyporus igniarius[20]中的甘露岩藻半乳聚糖,以及硫磺多孔菌Laetiporus sulphureus[21]中的岩藻甘露半乳聚糖。
2.5 鸡腿菇多糖两种组分的体外抗氧化活性2.5.1 Ccp-Ⅰ-A和Ccp-Ⅰ-B对DPPH的清除作用DPPH是一种稳定的自由基,且在乙醇溶液中517 nm处存在最大吸收峰。当DPPH遇到抗氧化剂等能提供质子的物质时,自由基被清除同时吸光度值降低。图 7为不同浓度下为Ccp-Ⅰ-A和Ccp-Ⅰ-B对DPPH的清除作用,可见,随着鸡腿菇多糖组分的浓度越高,对DPPH的清除作用越强,当浓度为300 μg/mL时,Ccp-Ⅰ-A和Ccp-Ⅰ-B对DPPH的清除率分别为72.1%和38.6%,高于分级纯化前Ccp-S3 (27.1%)的清除率,其中,Ccp-Ⅰ-A对DPPH的清除率与VC相当(70%) (表 1)。本文中报道的Ccp-Ⅰ-A对DPPH的清除率高于文献[22]报道中平菇多糖分级组分PSPO-1a (41%,1 mg/mL)的清除率,但低于灵芝菌糠[23]及茶树菇多糖[24]分级组分GRPS-2 (74.21%,100 μg/mL)和EPS-2 (88%,100 μg/mL)对DPPH的清除率。
 |
| 图 7 鸡腿菇多糖组分对DPPH的清除作用 Figure 7 Scavenging effects of polysaccharide components from Coprinus comatus on DPPH radicals. |
| 图选项 |
2.5.2 Ccp-Ⅰ-A和Ccp-Ⅰ-B对·OH的清除作用Ccp-Ⅰ-A和Ccp-Ⅰ-B对·OH的清除作用见图 8,由图 8可知鸡腿菇多糖组分对羟基自由基的清除效果也与浓度呈正相关。在浓度为300 μg/mL时,Ccp-Ⅰ-A和Ccp-Ⅰ-B对·OH自由基的清除率分别为55.3%和15.5%,高于分级纯化前Ccp-S3 (10.1%)的清除率,而且,Ccp-Ⅰ-A对·OH自由基的清除率高于VC(30%) (表 1)。本文中报道的Ccp-Ⅰ-A和Ccp-Ⅰ-B对DPPH的清除率高于文献[22]中报道的平菇多糖的分级组分PSPO-1a (10.5%,2.5 mg/mL)[22]的清除率;但低于灵芝菌糠[23]及茶树菇多糖[24]分级组分GRPS-2 (69.94%,100 μg/mL)和EPS-2 (90%,100 μg/mL)对羟基自由基的清除率。
 |
| 图 8 鸡腿菇多糖对·OH自由基的清除作用 Figure 8 Scavenging effects of polysaccharide components from Coprinus comatus on hydroxyl radicals radicals. |
| 图选项 |
2.5.3 Ccp-Ⅰ-A和Ccp-Ⅰ-B的还原力测定如图 9所示,在300 μg/mL时,Ccp-Ⅰ-A和Ccp-Ⅰ-B在700 nm处测得的还原力分别为0.55和0.22,远远低于同浓度下Vc的还原力(1.2) (表 1),并且也低于文献报道中灵芝菌糠和茶树菇多糖分级组分GRPS-2 (0.42,100 μg/mL)和EPS-2 (0.91,100 μg/mL)的还原力[23-24]。
 |
| 图 9 鸡腿菇多糖的还原力 Figure 9 Reducing power of polysaccharides components from Coprinus comatus. |
| 图选项 |
经分级纯化后多糖组分的抗氧化活性可能降低,也可能升高。对于前者,一方面可能是因为粗多糖在分级纯化过程中除去了许多具有抗氧化能力的糖蛋白、糖肽等活性成分而导致整体抗氧化能力下降[25];另一方面也可能是由于粗多糖中各级组分的协同作用使其具有较强的抗氧化能力,经柱层析分离后此协同作用减弱所致。对于后者,层析分级步骤使得某些具有强氧化活性的多糖单元等组分得到了富集与纯化,使得单位浓度的活性增强。另外,经柱层析分级纯化后的各种多糖组分的抗氧化活性大小也不相同,这可能与其各自的空间结构、所含糖单元类型及糖苷键构型、取代基不同有关[26]。
今后需对鸡腿菇两个分离纯化后的多糖组分进行进一步的结构解析及抗氧化活性的动物实验,深入研究其构效关系,为其作为天然抗氧化剂奠定一定理论基础,也为鸡腿菇水溶性多糖药物的开发及相关功能性食品的研制开辟一条新的路径。
参考文献
| [1] | Stojkovi? D, Reis FS, Barros L, et al. Nutrients and non-nutrients composition and bioactivity of wild and cultivated Coprinus comatus (O. F. Müll.) Pers.Food Chem Toxicol, 2013, 59: 289–296.DOI: 10.1016/j.fct.2013.06.017 |
| [2] | Liu YF, Zhao Y, Yang Y, et al. Structural characteristics and hypoglycemic activity of polysaccharides from Coprinus comatus.Bioact Carbohyd Diet Fibre, 2013, 2(2): 164–169.DOI: 10.1016/j.bcdf.2013.10.001 |
| [3] | Ding ZY, Lu YJ, Lu ZX, et al. Hypoglycaemic effect of comatin, an antidiabetic substance separated from Coprinus comatus broth, on alloxan-induced-diabetic rats.Food Chem, 2010, 121(1): 39–43.DOI: 10.1016/j.foodchem.2009.12.001 |
| [4] | Wang Y, Guan HQ, Ma XD. Effects of Maotou Guishan polysaccharide upon body fruit immunologic function in mice with immuno-suppression.Jilin J Trad Chin Med, 2010, 30(3): 260–261.(in Chinese). 王岩, 关洪全, 马贤德. 毛头鬼伞多糖对免疫抑制小鼠体液免疫功能的影响.吉林中医药, 2010, 30(3): 260-261. |
| [5] | Yu J, Cui PJ, Xing LG, et al. Effects of selenium-enriched mycelia powder from Coprinus comatus on immunity and antioxidation function in diabetic mice.Acta Nutr Sin, 2009, 31(2): 198–220.(in Chinese). 余杰, 崔鹏举, 邢立刚, 等. 富硒鸡腿菇菌粉对糖尿病小鼠免疫功能及抗氧化能力的影响.营养学报, 2009, 31(2): 198-220. |
| [6] | Jiang XG, Lian MX, Han Y, et al. Retraction notice to "Antitumor and immunomodulatory activity of a polysaccharide from fungus Coprinus comatus (Mull.: Fr.) Gray"[Int. J. Biol. Macromol 58 (2013) 349-353].Int J Biol Macromol, 2013, 61: 501.DOI: 10.1016/j.ijbiomac.2013.07.011 |
| [7] | Li B, Dobruchowska JM, Gerwig GJ, et al. Structural investigation of water-soluble polysaccharides extracted from the fruit bodies of Coprinus comatus.Carbohyd Polym, 2013, 91(1): 314–321.DOI: 10.1016/j.carbpol.2012.08.045 |
| [8] | Xu N, Li XM, Xie RJ, et al. Extraction and bioactivity of polysaccharide from Coprinus comatus.J Chin Inst Food Sci Tech, 2013, 13(7): 34–39.(in Chinese). 许女, 李向明, 谢瑞杰, 等. 鸡腿菇多糖的提取及生物活性的研究.中国食品学报, 2013, 13(7): 34-39. |
| [9] | Wu YB, Xie LY, Xie LH, et al. A preliminary study on anti-TMV activity of polysaccharide from Coprinus comatus.Chin Agr Sci Bull, 2007, 23(5): 338–341.(in Chinese). 吴艳兵, 谢荔岩, 谢联辉, 等. 毛头鬼伞多糖抗烟草花叶病毒(TMV)活性研究初报.中国农学通报, 2007, 23(5): 338-341. |
| [10] | Zhao HH. Study on the extraction, purification and antioxidant activities in vitro of polysaccharides from Okra[D]. Zhengzhou: Zhengzhou University, 2012 (in Chinese). 赵焕焕. 黄秋葵多糖提取纯化及体外抗氧化活性的探讨[D]. 郑州: 郑州大学, 2012.http://cdmd.cnki.com.cn/Article/CDMD-10459-1012351468.htm |
| [11] | Oyaizu M. Antioxidative activities of browning products of glucosamine fractionated by organic solvent and thin layer chromatography.Nipp Shok Kogyo Gakk, 1986, 35(11): 771–775. |
| [12] | Smirnoff N, Cumbes QJ. Hydroxyl radical scavenging activity of compatible solutes.Phytochemistry, 1989, 28(4): 1057–1060.DOI: 10.1016/0031-9422(89)80182-7 |
| [13] | Wu YB, Xie LY, Xie LH, et al. Physico-chemical characteristics and antioxidant activity in vitro of polysaccharide from Coprinus comatus.Acta Laser Biol Sin, 2007, 16(4): 438–442.(in Chinese). 吴艳兵, 谢荔岩, 谢联辉, 等. 毛头鬼伞(Coprinus comatus)多糖的理化性质及体外抗氧化活性.激光生物学报, 2007, 16(4): 438-442. |
| [14] | Yao YJ, Yang RZ, Zhang JS, et al. Optimum isolation and structural analysis of polysaccharide from the fruiting bodies of Coprinus comatus.Microbiol China, 2007, 34(6): 1071–1076.(in Chinese). 姚毓婧, 杨仁智, 张劲松, 等. 鸡腿菇子实体多糖分离纯化工艺及结构研究.微生物学通报, 2007, 34(6): 1071-1076. |
| [15] | Fan JM, Zhang JS, Tang QJ, et al. Structural elucidation of a neutral fucogalactan from the mycelium Coprinus comatus.Carbohyd Res, 2006, 341(9): 1130–1134.DOI: 10.1016/j.carres.2006.03.039 |
| [16] | Usui T, Iwasaki Y, Mizuno T. Isolation and characterization of two kinds of heterogalactan from the fruit bodies of ganodernra applannatum by employing a column of concan.Carbohyd Res, 1981, 92(1): 103–114.DOI: 10.1016/S0008-6215(00)85985-6 |
| [17] | Cho SM, Koshino H, Yu SH, et al. A mannofucogalactan, fomitellan A, with mitogenic effect from fruit bodies of Fomitella fraxinea (Imaz.).Carbohyd Res, 1998, 37(1): 13–18. |
| [18] | Mukumoto T, Yamaguchi H. The chemical structure of a mannofucogalactan from the fruit bodies of Flammulina velutipes (Fr.) Sing.Carbohyd Res, 1977, 59(2): 614–621.DOI: 10.1016/S0008-6215(00)83206-1 |
| [19] | Fraser RN, Karácsonyi S, Lindberg B. Polysaccharides elaborated by Polyporus pinicola (Fr).Acta Chem Scand, 1967, 21: 1783–1789.DOI: 10.3891/acta.chem.scand.21-1783 |
| [20] | Bj?rndal H, Lindberg B. Polysaccharides elaborated by Polyporus fomentarius (Fr.) and Polyporus igniarius (Fr.): part Ⅰ. Water-soluble neutral polysaccharides from the fruit bodies.Carbohyd Res, 1969, 10(1): 79–85.DOI: 10.1016/S0008-6215(00)81089-7 |
| [21] | Alquini G, Carbonero ER, Rosado FR, et al. Polysaccharides from the fruit bodies of the basidiomycete Laetiporus sulphureus (Bull.: Fr.) Murr.FEMS Microbiol Lett, 2004, 230(1): 47–52.DOI: 10.1016/S0378-1097(03)00853-X |
| [22] | Zhang YX. Extraction, characterization and antioxidant activities of polysaccharids from Pleurotus ostreatus[D]. Hefei: Anhui University, 2012 (in Chinese). 张云侠. 平菇多糖的提取、鉴定及其抗氧化活性研究[D]. 合肥: 安徽大学, 2012.http://cdmd.cnki.com.cn/Article/CDMD-10357-1012398813.htm |
| [23] | Zhai GY. Extraction, antioxidant, antiaging activity and characteristic of Ganoderma Lucidum residue polysaccharide[D]. Tai'an: Shandong Agricultural University, 2015 (in Chinese). 翟国印. 灵芝菌糠多糖的提取、抗氧化抗衰老活性与结构分析[D]. 泰安: 山东农业大学, 2015.http://cdmd.cnki.com.cn/Article/CDMD-10434-1015307057.htm |
| [24] | Hao L. Optimization and antioxidant activities of exopolysaccharide and intracellular Selenium polysaccharides by Agrocybe aegerita[D]. Tai'an: Shandong Agricultural University, 2014 (in Chinese). 郝龙. 茶树菇胞外多糖及胞内硒多糖的提取优化和抗氧化研究[D]. 泰安: 山东农业大学, 2014.http://cdmd.cnki.com.cn/Article/CDMD-10434-1014341573.htm |
| [25] | Zhong XK, Jin X, Lai FY, et al. Chemical analysis and antioxidant activities in vitro of polysaccharide extracted from Opuntia ficus indica Mill.cultivated in China.Carbohyd Polyml, 2010, 82(3): 722–727.DOI: 10.1016/j.carbpol.2010.05.042 |
| [26] | Li YY. Study on the separation, purification, structure and antioxidant activities in vitro of polysaccharides from Phyllanthus emblica.[D]. Fuzhou: Fujian Agriculture and Forestry University, 2010 (in Chinese). 李永裕. 余甘多糖分离纯化、结构和抗氧化活性研究[D]. 福州: 福建农林大学, 2010. |
