
 , 王艳春2
, 王艳春2

1 天津农学院 动物科学与动物医学学院,天津 300384;
2 军事医学科学院 生物工程研究所,北京 100071
作者简介:Yanchun Wang. Tel: +86-10-66948837; E-mail: springwyc@163.com
收稿日期:2016-03-10;接收日期: 2016-08-15
摘要: 为了比较不同锚钩蛋白基序结合活性,构建新型的鼠李糖乳杆菌颗粒表面展示系统。首先,用热酸处理法制备鼠李糖乳杆菌GEM (Gram-positive enhancer matrix,GEM) 颗粒,并通过电镜观察、RT-PCR检测和SDS-PAGE检测鉴定其处理效果;同时,利用大肠杆菌表达了锚定蛋白PA3-EGFP和P60-EGFP并将其与GEM颗粒共同孵育结合;最后,使用免疫印迹、电镜观察、荧光显微镜观察和荧光分光光度法评价鼠李糖乳杆菌GEM颗粒与锚定蛋白的结合效率。结果表明,使用10%的TCA处理鼠李糖乳杆菌得到了灭活的肽聚糖骨架 (GEM颗粒),经鉴定其大小形态均一,绝大部分无蛋白残留,3.8×106个GEM颗粒样品中的DNA拷贝数仅为32;免疫印迹和荧光显微镜观察均可检测到融合蛋白PA3-EGFP和P60-EGFP锚定在GEM颗粒上,且结合在GEM颗粒表面的锚定蛋白呈絮状。荧光分光光度计法检测结果显示锚定蛋白PA3-EGFP结合GEM的效率稍高于P60-EGFP,但差异不显著 (P>0.05)。以上结果表明由鼠李糖乳杆菌制得的GEM颗粒与锚定蛋白PA3、P60的结合效率良好,可用于构建新型的外源蛋白表面展示系统,进而为后续的细菌样颗粒疫苗的研究与应用奠定基础。
关键词: 鼠李糖乳杆菌LGG GEM颗粒 锚定蛋白 表面展示 鉴定
Construction of Lactobacillus rhamnosus GG particles surface display system
Su Runyu1, Nie Boyao1, Yuan Shengling2, Tao Haoxia2, Liu Chunjie2, Yang Bailiang1

 , Wang Yanchun2
, Wang Yanchun2

1 Animal Science and Animal Medicine College,Tianjin Agricultural University, Tianjin 300384, China;
2 Beijing Institute of Biotechnology,Beijing 100071, China
Received: March 10, 2016; Accepted: August 15, 2016
Corresponding authors:Bailiang Yang. E-mail: bailiangyang@163.com
Abstract: To describe a novel particles surface display system which is consisted of gram-positive enhancer matrix (GEM) particles and anchor proteins for bacteria-like particles vaccines, we treated Lactobacillus rhamnosus GG bacteria with 10% heated-TCA for preparing GEM particles, and then identified the harvested GEM particles by electron microscopy, RT-PCR and SDS-PAGE. Meanwhile, Escherichia coli was induced to express hybrid proteins PA3-EGFP and P60-EGFP, and GEM particles were incubated with them. Then binding of anchor proteins were determined by Western blotting, transmission electron microscopy, fluorescence microscopy and spectrofluorometry. GEM particles preserved original size and shape, and proteins and DNA contents of GEM particles were released substantially. The two anchor proteins both had efficiently immobilized on the surface of GEM. GEM particles that were bounded by anchor proteins were brushy. The fluorescence of GEM particles anchoring PA3 was slightly brighter than P60, but the difference was not significant (P>0.05). GEM particles prepared from L. rhamnosus GG have a good binding efficiency with anchor proteins PA3-EGFP and P60-EGFP. Therefore, this novel foreign protein surface display system could be used for bacteria-like particle vaccines.
Key words: Lactobacillus rhamnosus GG GEM particles anchor protein surface display identify
鼠李糖乳杆菌 (Lactobacillus rhamnosus GG,LGG) 为革兰氏阳性菌,是研究最广泛的乳酸菌之一,具有生长速度快、生物安全性高等优点,能够有效调节肠道菌群和提高机体免疫力[1]。近些年,在基因工程技术的推动下,关于包括鼠李糖乳杆菌在内的多种乳酸菌 (Lactis acid bacteria,LAB)已被成功用于疫苗抗原蛋白表达、疫苗抗原递送等方面的研究[2-4]。然而在食品生产和医疗健康的应用领域中,基因工程技术的应用受到了伦理和法律上的严格限制。因此,利用未经基因修饰手段获得的革兰氏阳性增强基质-蛋白锚钩 (Gram-positive enhancer matrix-protein anchor,GEM-PA) 表面展示系统越来越受到研究者的关注。GEM-PA系统是从乳酸菌表面展示技术衍生而来的非基因修饰的疫苗载体系统,该系统由革兰氏阳性菌细胞壁肽聚糖骨架 (GEM) 和蛋白锚钩 (PA) 组成,均为食品级元件,生物安全性高[5]。该系统的核心部分即为发挥结合作用的锚钩蛋白 (PA)[6],目前研究较多的是将乳酸乳球菌细胞壁水解酶(AcmA) 的C端结构域作为锚定蛋白[7],该结构域由3个细胞溶解酶基序(LysM)与间隔序列构成,命名为“PA3”[8-9]。其中,LysM结构域具有特异性非共价结合革兰氏阳性菌细胞壁肽聚糖的能力,因此外源蛋白可通过与PA3融合而获得锚定功能[10-11]。此外,由单核细胞增多性李斯特菌产生的分泌蛋白P60也具有类似的结构单元。有研究显示,其C端区域为Nlpc/p60家族结构域氨基酸基序,N端区域含有2个LysM和SH3结构域的氨基酸基序,可以预测P60蛋白的N端结构域也具有锚定细胞壁的功能[12],但目前尚无将P60蛋白N端基序作为表面展示颗粒疫苗锚定结构的相关报道。目前,运用乳酸乳球菌GEM-PA系统的亚单位或多肽疫苗已被证明在多种动物模型中能够激发机体的免疫保护,已成功用于疟原虫环孢子 (CSP)亚单位疫苗[13]、呼吸道合胞病毒疫苗[14]、人肺炎链球菌粘膜疫苗[15]和鼠疫LcrV亚单位疫苗等研制[16-17]。但该系统的主要缺点在于锚定蛋白与GEM颗粒的结合较松散,相对易解离,因此有必要开发设计结合能力更强的GEM-PA系统。本研究尝试选用鼠李糖乳杆菌GEM颗粒分别与锚定蛋白PA3和P60进行组合,旨在构建新型的GEM-PA系统,希望为研究安全、有效、廉价的细菌样颗粒疫苗提供新的思路。
1 材料与方法1.1 试验材料 鼠李糖乳杆菌GG (L. rhamnosus GG,LGG)由本实验室保存;原核表达载体pET28a-EGFP由本实验室保存[18];感受态细胞BL21(DE3)、pEASY?-Blunt Zero克隆载体、BCA蛋白定量试剂盒购自北京全式金公司;M.R.S肉汤培养基购自Oxoid公司;三氯乙酸 (TCA) 为国药集团产品;小鼠源GFP单抗及辣根过氧化物酶 (HRP)标记的羊抗小鼠二抗均为中杉金桥公司产品;ECL发光底物试剂为Engreen公司产品;IPTG诱导剂为Sigma公司产品;镍离子亲和柱为默克公司产品;SYBR-Green荧光染料与ROX为Kapa公司产品。
1.2 方法1.2.1 GEM颗粒的制备及电镜观察接种LGG到400 mL新鲜的M.R.S肉汤培养基中,30 ℃静置培养24 h。收集菌液,用无菌磷酸缓冲液 (PBS) 溶液洗涤并重悬混匀,用活菌计数法测定菌液浓度。然后加入1/5体积的10% TCA溶液,将细菌煮沸处理30 min得到GEM颗粒,并用PBS溶液洗涤3次。最后稀释至10 U/mL (1 U=2.5×109个),置-20 ℃保存。
离心收集保存的GEM颗粒,加入3%戊二醛 (0.075 mol/L PBS,pH 7.4) 溶液4 ℃固定 2 h,然后依次进行漂洗、后固定、漂洗、脱水、浸透、包埋、切片和染色,制作电镜切片,使用透射电镜 (HITACHI H-7650) 观察GEM颗粒的超微结构。
1.2.2 GEM颗粒核酸和蛋白的残留分析GEM颗粒样品中的DNA残留使用荧光定量PCR的方法进行。具体而言,首先根据LGG基因组的16S rRNA编码序列设计引物 (上游引物: 5'-GTGCTTGCATCTTGATTTAATTTT-3';下游引物:5'-TGCGGTTTTTGGATTTATGCG-3')进行PCR扩增,得到的DNA片段纯化回收后克隆至载体pEASY?-Blunt Zero,最后鉴定正确的质粒作为荧光定量PCR标准品。标准品进行10倍系列稀释用于建立标准曲线。同时取1 mL的GEM颗粒样品 (经计算约为3.8×106个) 进行荧光定量PCR检测,根据标准方程计算GEM样品中残留核酸的拷贝数。同时取LGG活菌基因组DNA作为阳性对照。此外,取GEM颗粒超声破碎,制样后进行SDS-PAGE检测,分析GEM颗粒中的蛋白残留情况,同时取LGG活菌的超声裂解物作为阴性对照。
1.2.3 锚定蛋白的表达及纯化经NCBI网站查询获得AcmA和P60的编码基因序列 (GI: 124491961和GI: 985140),分别取AcmA(224-437) (PA3)和P60(28-245)对应序列由金维智基因公司合成,并克隆至原核表达载体pET28a-EGFP中EGFP编码序列下游。然后将构建的原核表达载体pET28a-EGFP、pET28a-EGFP- PA3和pET28a-EGFP-P60分别转化至感受态细胞BL21 (DE3) 中。挑选阳性克隆接入含50 mg/L卡那霉素的LB液体培养基中,37 ℃摇床培养4 h,加入终浓度为1 mmol/L的IPTG,16 ℃过夜培养诱导。离心收集新鲜菌体,超声破碎后经SDS-PAGE检测分析目的蛋白的表达情况。使用镍离子亲和层析柱纯化蛋白,SDS-PAGE电泳分析纯化效果,BCA法测定蛋白浓度。
1.2.4 锚定蛋白与GEM颗粒的结合取保存的GEM颗粒分别与锚定蛋白PA3-EGFP与P60-EGFP结合,1 U的GEM颗粒中加入200 mg锚定蛋白,然后用PBS溶液重悬并定容至1 mL,室温振荡孵育30 min,用PBS离心洗涤3次,除去未结合的蛋白,最后用适量的PBS重悬。同时用EGFP蛋白与GEM颗粒结合作为对照。
1.2.5 免疫印迹鉴定取GEM颗粒与PA3-EGFP、P60-EGFP和EGFP蛋白结合后的样品,经SDS-PAGE电泳后,使用快速转膜仪转至NC膜上,将NC膜放入5%脱脂奶粉封闭液中封闭2 h。然后加入小鼠源GFP单抗 (1∶5 000),37 ℃孵育1 h。取出NC膜用PBST洗3次,加入辣根过氧化物标记的羊抗鼠二抗 (1∶5 000),37 ℃孵育1 h,最后使用凝胶成像系统ECL发光显影。
1.2.6 结合后GEM颗粒透射电镜观察取GEM颗粒与PA3-EGFP、P60-EGFP和EGFP蛋白结合后的样品,制作透射电镜样品,方法同“1.2.1”部分,通过透射电镜观察结合后GEM颗粒的超微结构变化。
1.2.7 结合后GEM颗粒荧光显微镜观察取适量的融合蛋白结合GEM颗粒样品,均匀涂布在洁净的载玻片上,室温晾干固定,使用荧光显微镜 (Nikon ECLIPSE Ti-S),在油镜下观察GEM颗粒表面绿色荧光发光情况。
1.2.8 结合后荧光强度检测取GEM颗粒与PA3-EGFP、P60-EGFP蛋白结合后的样品,使用适量的PBS溶液均匀重悬,并定容至600 mL,加至96孔黑色酶标板,每孔 200 μL,各设置3个复孔。荧光分光光度计检测每孔的荧光值及OD600,则结合物的荧光强度计算方式如下:荧光强度=荧光值 (RFU)/OD600。共进行3次重复试验,两组数据结果比较使用t检验进行统计分析,以P<0.05为差异有统计学意义。
2 结果与分析2.1 GEM颗粒制备后透射电镜观察透射电镜观察结果如图 1所示,与LGG细菌相比,经热酸处理得到的GEM颗粒中,胞膜结构已完全被破坏溶解,仅保留了革兰氏阳性菌的肽聚糖骨架,并维持了细菌的基本形态和大小。并且可以看出,GEM颗粒的表面较平滑,胞内呈均一的灰色。
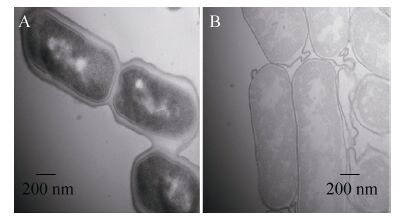 |
| 图 1 LGG-GEM颗粒透射电镜观察 (60 000×) Figure 1 The observation of LGG-GEM particles by transmission electron microscopy (60 000×). The scale bar represents 200 nm. (A) LGG bacteria. (B) LGG-GEM particles. |
| 图选项 |
2.2 SDS-PAGE检测GEM颗粒蛋白残留GEM颗粒超声破碎后经SDS-PAGE检测的结果如图 2所示,GEM样品泳道中仅有少量蛋白条带出现。该结果表明热酸处理LGG较彻底,绝大部分除去了细菌中蛋白质,用此方法制备GEM颗粒可行。
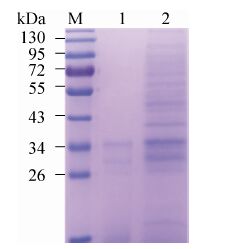 |
| 图 2 GEM颗粒的SDS-PAGE检测 Figure 2 SDS-PAGE analysis of GEM particles. M: protein marker; 1: LGG-GEM particles; 2: LGG bacterium. |
| 图选项 |
2.3 定量PCR检测GEM颗粒中核酸残留建立的荧光定量PCR标准曲线呈良好的线性关系,结果如图 3所示,其标准方程为Ct值= -3.402×浓度 (对数值)+35.589,(相对系数R2=0.998,扩增效率E(%)=96.756),其中标准质粒的起始拷贝数为1.77×109。样品检测结果如表 1所示,3次重复GEM颗粒样品的Ct平均值为34.813,则根据标准曲线计算得到3.8×106个GEM颗粒样品中的DNA拷贝数仅为32个。
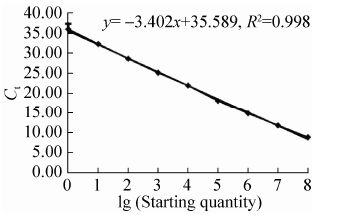 |
| 图 3 10倍梯度标准品质粒的RT-PCR标准曲线 Figure 3 Standard curve for serial 10-fold dilutions of the standard plasmid. |
| 图选项 |
表 1 LGG-GEM颗粒核酸含量检测结果Table 1 Results of real time PCR of DNA from LGG-GEM particles
| Sample | Ct value(x±s) | Start DNA loads |
| LGG genome DNA control LGG-GEM particles | 11.342±0.131 34.813±0.712 | 2.378×108 32 |
表选项
2.4 原核表达融合蛋白SDS-PAGE鉴定 经SDS-PAGE检测,融合蛋白PA3-EGFP和P60-EGFP经IPTG诱导表达情况良好,在超声裂解物的上清和沉淀中均有表达 (图 4A)。另外,纯化超声裂解物上清中的目的蛋白,经SDS-PAGE电泳检测,蛋白的大小基本正确,纯化后的目的蛋白PA3-EGFP和P60-EGFP大小分别约为51.4 kDa和52.0 kDa (图 4B)。
 |
| 图 4 融合蛋白的表达纯化分析 Figure 4 SDS-PAGE analysis of hybrid proteins. (A) SDS-PAGE analysis of hybrid proteins. M: protein marker; 1: BL21; 2: EGFP in the supernatant of lysate; 3: EGFP in the sediment of lysate; 4: PA3-EGFP in the supernatant of lysate; 5: PA3-EGFP in the sediment of lysate; 6: P60-EGFP in the supernatant of lysate; 7: P60-EGFP in the sediment of lysate. (B) SDS-PAGE analysis of purified hybrid proteins. M: protein marker; 1: purified PA3-EGFP; 2: purified P60-EGFP. |
| 图选项 |
2.5 GEM颗粒与融合蛋白结合后免疫印迹的鉴定融合蛋白PA3-EGFP、P60-EGFP分别与GEM颗粒结合后,利用融合蛋白N端的EGFP蛋白,通过免疫印迹法对融合蛋白与GEM的结合情况进行检测,结果表明锚定蛋白P60-EGFP、PA3-EGFP与GEM颗粒结合的效率良好 (泳道2,3)。作为阴性对照EGFP与GEM颗粒结合组 (泳道1) 只有微弱的条带,分析可能是试验过程中EGFP有少量的残留 (图 5)。
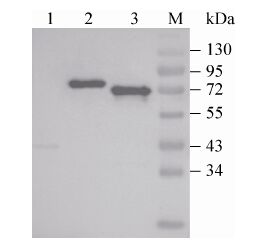 |
| 图 5 锚定蛋白与GEM结合后的免疫印迹鉴定 Figure 5 Western blotting analysis of GEM particles anchored with hybrid proteins. M: protein marker; 1: sample of GEM and EGFP; 2: sample of GEM and P60-EGFP; 3: sample of GEM and PA3-EGFP. |
| 图选项 |
2.6 结合后GEM颗粒透射电镜观察结果 GEM颗粒分别与PA3-EGFP、P60-EGFP和EGFP结合后,通过透射电镜观察GEM颗粒表面的结构变化。如图 6所示,与2种锚定蛋白结合后GEM颗粒的表面均可见大量的细小絮状结合物。
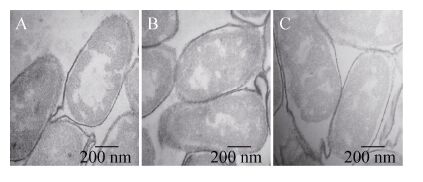 |
| 图 6 透射电镜观察锚定蛋白与GEM颗粒的结合情况 (80 000×) Figure 6 Transmission electron microscopy of binding anchor proteins (80 000×). The scale bar represents 200 nm. (A) Sample of GEM and PA3-EGFP. (B) Sample of GEM and P60-EGFP. (C) Sample of GEM and EGFP. |
| 图选项 |
2.7 结合后GEM颗粒荧光显微镜观察 在荧光显微镜下使用油镜观察GEM颗粒,结果如图 7所示,PA3-EGFP、P60-EGFP两种融合蛋白与GEM颗粒结合后,均出现绿色荧光的短杆菌状颗粒,表明融合蛋白PA3-EGFP、P60-EGFP与GEM颗粒的结合效率良好。EGFP与GEM颗粒处理组为阴性对照,视野中未发现荧光颗粒,说明单独的荧光蛋白EGFP不能与GEM颗粒结合,锚定蛋白是结合GEM颗粒的关键结构。
 |
| 图 7 荧光显微镜下观察锚定蛋白与GEM颗粒的结合 Figure 7 Fluorescence microscopy of binding anchor proteins. The scale bar represents 5 μm. (A) Sample of GEM and PA3-EGFP. (B) Sample of GEM and P60-EGFP. (C) Sample of GEM and EGFP. |
| 图选项 |
2.8 荧光分光光度计的检测 融合荧光蛋白的PA3-EGFP、P60-EGFP分别与制备的LGG-GEM颗粒孵育结合后,使用荧光分光光度计测定并计算GEM颗粒表层荧光强度,经t检验统计分析,两种GEM颗粒的荧光强度差异不显著 (P=0.68)。说明两种锚定蛋白均能较好地与GEM结合,且二者结合效率基本相当 (图 8)。
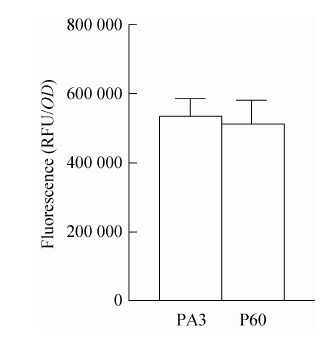 |
| 图 8 结合锚定蛋白的GEM颗粒荧光强度检测 Figure 8 Spectrofluorometry of GEM particles binding with the anchor proteins. |
| 图选项 |
3 讨论 本研究构建的GEM-PA系统通过展示外源蛋白,建立了非基因修饰的颗粒疫苗平台。其中,选用了鼠李糖乳杆菌LGG作为GEM-PA展示系统的载体颗粒的制备原料,大量研究认为该菌的安全性极高且能有效维持消化系统健康和免疫功能[19]。在类似的研究中发现,乳酸菌在热酸处理下,能够快速地释放胞内胞外的有机物质,只剩下保持原细菌形态的肽聚糖空 壳[20-21]。然而有研究发现,细菌表面的磷脂酸和磷壁酸类酯等物质会阻碍LysM (细胞溶解酶基序) 与肽聚糖的识别,造成结合减少[22-23],因此LGG菌外壳的处理应彻底,且颗粒分散应均匀,从而使锚定蛋白与GEM高效结合。本研究从蛋白质残留、核酸残留和超微结构变化3个方面对制备的GEM颗粒进行了全方面鉴定,结果显示使用10%的TCA加热处理制备的GEM颗粒中蛋白质与核酸残留极少,并且颗粒的形态完整,大小均一,可以提示说明细菌的核酸、蛋白质等物质基本上已去除,与文献报道的结果基本一致[9],为后续研究奠定了基础。
本实验中2种融合蛋白PA3-EGFP和P60-EGFP的锚定结构区均能与GEM很好地结合,PA3为乳酸乳球菌主要自溶素AcmA的C端结构域,是研究较多且使用最广泛的蛋白锚定基序,因此本研究也选用了该蛋白作为一种候选的锚定基序。另外也有研究显示,单核细胞增多性李斯特菌的P60蛋白N末端28-245位的蛋白片段包含2个LysM基序和1个位于二者之间的SH3结构域,并且当2个LysM和该SH3结构域都同时存在时,P60蛋白具有锚定活性和结合细胞壁肽聚糖的能力[24]。更为重要的一点是,P60蛋白的这一部分片段具有活化宿主自然杀伤细胞 (NK cells) 的能力,而NK细胞活化后分泌的IFN-g在宿主对抗某些细菌和病毒感染过程中发挥着重要的作用[25-26]。可以提示,利用这一蛋白基序功能,锚定蛋白进行疫苗抗原的融合表达有可能提高相应疫苗的效果。因此,P60蛋白在疫苗应用中具有潜在优势。在本研究中,我们在锚定蛋白PA3的C端和P60(28-245) 的N端融合EGFP蛋白,从而对研究的锚定蛋白进行荧光标记,在不影响锚定蛋白正常锚定功能的情况下,有利于对锚定蛋白进行定位观察和定量检测。通过多角度的检测分析,我们进一步证实了PA3对于鼠李糖乳杆菌制备的GEM颗粒具有良好的锚定活性,同时发现P60(28-245) 蛋白也具有较好的锚定活性,并且与PA3的水平基本相当,因此我们认为P60(28-245) 也可作为GEM-PA系统的候选锚定蛋白进行深入研究。
本研究从鼠李糖乳杆菌出发,构建了基于该菌株的革兰氏阳性增强基质-蛋白锚钩表面展示系统,并且筛选了一种新的GEM颗粒锚定蛋白,初步探索了一种新的细菌颗粒样表面展示系统,为后续细菌颗粒样疫苗的研究奠定了 基础。
参考文献
| [1] | Hojsak I, Snovak N, Abdovic S, et al. Lactobacillus GG in the prevention of gastrointestinal and respiratory tract infections in children who attend day care centers: a randomized, double-blind, placebo-controlled trial.Clin Nutr, 2010, 29(3): 312–316.DOI: 10.1016/j.clnu.2009.09.008 |
| [2] | Landete JM. A review of food-grade vectors in lactic acid bacteria: from the laboratory to their application.Crit Rev Biotechnol, 2016, 26: 1–13. |
| [3] | Wyszyńska A, Kobierecka P, Bardowski J, et al. Lactic acid bacteria—20 years exploring their potential as live vectors for mucosal vaccination.Appl Microbiol Biotechnol, 2015, 99(7): 2967–2977.DOI: 10.1007/s00253-015-6498-0 |
| [4] | van Braeckel-Budimir N, Haijema BJ, Leenhouts K. Bacterium-like particles for efficient immune stimulation of existing vaccines and new subunit vaccines in mucosal applications.Front Immunol, 2013, 4: 282. |
| [5] | Qiao XW. GEM particle vaccines for Porcine circovirus type 2 [D]. Yangzhou: Yangzhou University, 2013 (in Chinese). 乔绪稳. 猪圆环病毒2型GEM颗粒疫苗的初步研究 [D]. 扬州: 扬州大学, 2013. |
| [6] | Tarahomjoo S. Exploring surface display technology for enhancement of delivering viable lactic acid bacteria to gastrointestinal tract.Rijeka: InTech Open Access Publisher, 2013: 427–454. |
| [7] | Zadravec P, ?trukelj B, Berlec A. Improvement of LysM-mediated surface display of designed ankyrin repeat proteins (DARPins) in recombinant and nonrecombinant strains of Lactococcus lactis and Lactobacillus species.Appl Environ Microbiol, 2015, 81(6): 2098–2106.DOI: 10.1128/AEM.03694-14 |
| [8] | Xu W, Huang M, Zhang Y, et al. Novel surface display system for heterogonous proteins on Lactobacillus plantarum.Lett Appl Microbiol, 2011, 53(6): 641–648.DOI: 10.1111/lam.2011.53.issue-6 |
| [9] | Bosma T, Kanninga R, Neef J, et al. Novel surface display system for proteins on non-genetically modified gram-positive bacteria.Appl Environ Microbiol, 2006, 72(1): 880–889.DOI: 10.1128/AEM.72.1.880-889.2006 |
| [10] | Zadravec P, ?trukelj B, Berlec A. Heterologous surface display on lactic acid bacteria: non-GMO alternative?.Bioengineered, 2015, 6(3): 179–183.DOI: 10.1080/21655979.2015.1040956 |
| [11] | Visweswaran GRR, Leenhouts K, van Roosmalen M, et al. Exploiting the peptidoglycan-binding motif, LysM, for medical and industrial applications.Appl Microbiol Biotechnol, 2014, 98(10): 4331–4345. |
| [12] | Gu H. Dissection of Listeria monocytogenes p60 protein structural domains [D]. Yangzhou: Yangzhou University, 2014 (in Chinese). 顾浩. 产单核细胞李斯特菌P60蛋白结构域的剖析 [D]. 扬州: 扬州大学, 2014. |
| [13] | Nganou-Makamdop K, van Roosmalen ML, Audouy SAL, et al. Bacterium-like particles as multi-epitope delivery platform for Plasmodium berghei circumsporozoite protein induce complete protection against malaria in mice.Malar J, 2012, 11: 50.DOI: 10.1186/1475-2875-11-50 |
| [14] | Rigter A, Widjaja I, Versantvoort H, et al. A protective and safe intranasal RSV vaccine based on a recombinant prefusion-like form of the F protein bound to bacterium-like particles.PLoS ONE, 2013, 8(8): e71072.DOI: 10.1371/journal.pone.0071072 |
| [15] | Audouy S A L, van Selm S, van Roosmalen M L, et al. Development of lactococcal GEM-based pneumococcal vaccines.Vaccine, 2007, 25(13): 2497–2506.DOI: 10.1016/j.vaccine.2006.09.026 |
| [16] | Berlec A, Ravnikar M, Strukelj B. Lactic acid bacteria as oral delivery systems for biomolecules.Pharmazie, 2012, 67(11): 891–898. |
| [17] | Ramirez K, Ditamo Y, Rodriguez L, et al. Neonatal mucosal immunization with a non-living, non-genetically modified Lactococcus lactis vaccine carrier induces systemic and local Th1-type immunity and protects against lethal bacterial infection.Mucosal Immunol, 2010, 3(2): 159–171.DOI: 10.1038/mi.2009.131 |
| [18] | Ma K. Functional study on BslA adhesion of Bacillus anthracis [D]. Hefei: Anhui University, 2012 (in Chinese). 马坤. 炭疽芽孢杆菌BslA蛋白粘附功能研 究 [D]. 合肥: 安徽大学, 2012. |
| [19] | Chen RC, Xu LM, Du SJ, et al. Lactobacillus rhamnosus GG supernatant promotes intestinal barrier function, balances Treg and TH17 cells and ameliorates hepatic injury in a mouse model of chronic-binge alcohol feeding.Toxicol Lett, 2016, 241: 103–110.DOI: 10.1016/j.toxlet.2015.11.019 |
| [20] | Hu SM, Kong J, Sun ZL, et al. Heterologous protein display on the cell surface of lactic acid bacteria mediated by the s-layer protein.Microb Cell Fact, 2011, 10: 86.DOI: 10.1186/1475-2859-10-86 |
| [21] | Kobierecka P, Wyszyńska A, Maruszewska M, et al. Lactic acid bacteria as a surface display platform for Campylobacter jejuni antigens.J Mol Microbiol Biotechnol, 2015, 25(1): 1–10.DOI: 10.1159/000368780 |
| [22] | Heine SJ, Franco-Mahecha OL, Chen XT, et al. Shigella IpaB and IpaD displayed on L. Lactis bacterium-like particles induce protective immunity in adult and infant mice.Immunol Cell Biol, 2015, 93(7): 641–652.DOI: 10.1038/icb.2015.24 |
| [23] | Steen A, Buist G, Leenhouts KJ, et al. Cell wall attachment of a widely distributed peptidoglycan binding domain is hindered by cell wall constituents.J Biol Chem, 2003, 278(26): 23874–23881.DOI: 10.1074/jbc.M211055200 |
| [24] | Yu MF, Zuo JR, Gu H, et al. Domain function dissection and catalytic properties of Listeria monocytogenes p60 protein with bacteriolytic activity.Appl Microbiol Biotechnol, 2015, 99(24): 10527–10537.DOI: 10.1007/s00253-015-6967-5 |
| [25] | Yebra MJ, Monedero V, Pérez-Martínez G, et al. Genetically engineered Lactobacilli for technological and functional food applications.Rigeka: InTech Open Access Publisher, 2012: 143–168. |
| [26] | Schmidt RL, Filak HC, Lemon JD, et al. A LysM and SH3-domain containing region of the Listeria monocytogenes p60 protein stimulates accessory cells to promote activation of host NK cells.PLoS Pathog, 2011, 7(11): e1002368.DOI: 10.1371/journal.ppat.1002368 |
