

南京农业大学 农业部动物生理生化重点开放实验室,江苏 南京 210095
摘要:本文旨在探究β-CM7对糖尿病大鼠心肌组织肾素-血管紧张素系统 (Renin angiotensin system, RAS) 的影响及其保护机制。32只雄性SD大鼠通过相应处理被分为正常对照组、模型对照组、胰岛素治疗组 (3.7×10-8 mol/d) 及β-CM7干预组 (7.5×10-8 mol/d)。连续饲养30 d后,处死大鼠取心肌。β-CM7在干预糖尿病模型后,组织中AngⅡ含量显著降低,Ang1-7含量极显著升高;AT1受体和Mas受体mRNA表达均显著升高;ACE和ACE2的mRNA表达均显著升高,且酶活均显著升高。综上可得,β-CM7可以通过激活RAS的负性调节通路“ACE2-Ang1-7-Mas轴” 显著抑制大鼠心肌ACE mRNA和蛋白的强表达,缓解AngⅡ对心肌组织的损伤,提示β-CM7抑制心肌损伤的作用可能与ACE/ACE2通路有关。
关键词: β-酪啡肽-7糖尿病大鼠心肌RAS系统
Protective effect and mechanism of β-CM7 on renin angiotensin system & diabetic cardiomyopathy
Kun Wang, Dongning Han, Yujuan Zhang, Chao Rong, Yuanshu Zhang


Key Laboratory of Animal Physiology & Biochemistry, Ministry of Agriculture, Nanjing Agricultural University, Nanjing 210095, Jiangsu, China
Received: March 27, 2015; Accepted: November 19, 2015
Supported by: National Natural Science Foundation of China (No. 30871838/A200850).
Corresponding authors: Yuanshu Zhang. Tel/Fax: +86-25-84396763; E-mail: zhangyuanshu@njau.edu.cn
Abstract: This article aimed at exploring the effects and protective mechanism of β-CM7 on renin angiotensin system (RAS) in diabetic rats myocardial tissue. We divided 32 male SD rats into 4 groups: control group, diabetic model control group, insulin (3.7×10-8 mol/d) treatment group and β-CM7 (7.5×10-8 mol/d) treatment group. After 30 days, all rats were decapitated and myocardical tissues were collected immediately. After injection, β-CM7 could decrease the content of AngⅡ, increase the content of Ang1-7. And β-CM7 could improve the mRNA of AT1 receptor and Mas receptor. β-CM7 also could improve the mRNA of ACE and ACE2, enhance the activity of ACE and ACE2. These data confirmed that β-CM7 could activate ACE2-Ang1-7-Mas axis, negative passage in RAS, to inhibit the expression ACE mRNA and protein in rat myocardium, alleviate the myocardial tissue damage induced by AngⅡ. The effect of β-CM7 on inhibiting myocardium damage might be related to ACE/ACE2 passageway.
Keywords: β-casomorphin7diabetic ratcardiac musclerenin angiotensin system (RAS)
糖尿病是一种由多病因引起的以慢性持续高血糖为特征的终身慢性疾病。主要表现为能量物质 (如糖、脂肪、蛋白质等)、电解质代谢紊乱,以及机体氧化-抗氧化系统平衡的破坏。糖尿病心肌病 (Diabetic cardiomyopathy,DCM)是糖尿病主要并发症之一,是一种独立于冠心病、高血压和其他种类的心脏病之外的特异的心脏病变,是导致糖尿病患者心衰的重要原因,也是导致糖尿病晚期心功能衰竭和死亡的主要原因之一。
在糖尿病常见的心血管并发症中,糖尿病心肌病变是一种重要的特异性心肌病变。糖尿病心肌病发病机制比较复杂,包括:1) 胰岛素分泌减少或致使胰岛素作用障碍,引起糖利用率下降或障碍、脂质氧化增强及蛋白合成下降[1, 2];2) 心肌细胞的能量代谢异常,钠、钙泵的功能下降,使心肌细胞兴奋-收缩及心肌复极-舒张脱偶联受到影响,导致心肌正常活动功能异常;3) 脂质过氧化反应的加强产生的大量中间产物和自由基,以及高血糖症候、脂质沉积可诱导心肌细胞凋亡及心肌间质纤维化[3, 4];4) 心肌局部肾素-血管紧张素系统异常激活。其中肾素-血管紧张素系统途径为近些年新的研究热点。
肾素-血管紧张素系统 (Renin-angiotensin system,RAS) 是机体主要的体液系统,在心血管疾病的发生发展以及疾病的预后和并发症的发生中都起着重要的作用。有研究发现,高血糖可激活心肌局部的RAS使肾素和血管紧张素转化酶 (ACE) 活性明显增高,血管紧张素Ⅰ (Angiotensin,AngⅠ) 和血管紧张素Ⅱ (AngⅡ)生成增加[5]。AngⅡ是RAS的主要效应分子,与其受体在大多数心脏病 (心肌梗死、高血压和心力衰竭) 及糖尿病中表达增加,对心血管有损害作用[6]。血管紧张素转换酶2 (Angiotensin converting enzyme 2,ACE2) 是近年来发现的ACE的同系物[7, 8]和ACE具有42%的同源序列,但与ACE不同的是ACE2仅有一个酶活性位点,它能够高效催化AngⅡ转化为Ang1-7,而Ang1-7具有拮抗AngⅡ的效应,是已被证明的重要的心血管功能调节剂,具有舒张血管、改善心功能等作用[8]。有研究发现使用ACE的抑制剂 (ACEI) 可促进大鼠ACE2的mRNA表达上升,减少氧化应激的形成及改善心血管的增殖和重塑[9]。可见,RAS系统中相关因子可能通过氧化应激途径对心脏造成一定伤害或改善损伤。这方面的研究目前刚刚开始。
β-酪啡肽-7 (β-Casomorphin7,β-CM7) 是经酪蛋白酶水解产生的一种重要的乳源生物活性肽成员之一。本研究室前期的研究证实β-CM7具有一定降低糖尿病大鼠空腹血糖和抵抗高血糖所致的氧化应激损伤的作用,可提高糖尿病心肌损伤大鼠心肌及血液的抗氧化应激能力,但其详细的机理尚不清楚[10, 11]。本实验拟通过对糖尿病心肌损伤大鼠心肌局部RAS系统两条通路各关键因子mRNA和蛋白表达水平的比较分析研究,明确RAS在心肌损伤中的作用,通过分析β-CM7干预对心肌组织中RAS各关键因子变化的影响,从RAS途径的角度探讨β-CM7保护糖尿病心肌损伤的可能机制。
1 材料与方法 1.1 材料及主要仪器 电动匀浆器 (Polytron-aggregate,瑞士);高速低温离心机 (MIKRO-22型,德国);Mx3000P Real-Time PCR仪 (Stratagene,美国);混匀器 (上海沪西分析仪器厂有限公司);RT-6000酶标分析仪 (深圳雷杜生命科学股份有限公司);FMJ-182放射免疫γ-计数仪 (上海原子核研究所日环仪器一厂);核酸浓度测定仪 (Eppndorf Biophotometer,德国) 等。
血管紧张素Ⅱ放射免疫分析试剂盒 (北京北方生物技术研究所)。灵敏度10 pg/mL;批内变异系数 (CV)<5%。
Real-time分析试剂:oligdt 18.0随机引物、dNTPs、5×RT缓冲液、RNA酶抑制剂、M-mlv反转录酶 (Promega Corporation,美国) 均购自南京生兴生物技术有限公司;TRIzol购自南京天为生物科技有限公司;荧光酶 (FS Universal SYBR Green Master) 购自南京博飞科技有限公司;氯仿、异丙醇、乙醇等均为分析纯。
1.2 实验动物 SD大鼠购自浙江省实验动物中心,许可证号SCXF (浙) 20080033;标准鼠粮、垫料 (青龙山动物繁殖场)。饲养于南京农业大学农业部动物生理生化重点实验室实验动物房。
1.3 大鼠模型的建立与分组42 只8周龄雄性SD大鼠 (体重150−180 g)适应喂养1周后,腹腔注射链服佐菌素 (STZ,60 mg/kg体重),选取24只STZ成模后大鼠随机分为3组,模型对照组、β-CM7干预组和胰岛素治疗组。另设正常对照组平行观察,每组8只。胰岛素治疗组每天皮下注射胰岛素6 U/只 (3.7×10-8 mol/只),β-CM7干预组每天腹腔注射β-CM7溶液7.5×10-8 mol/只,正常对照组和模型对照组每天腹腔注射等体积生理盐水。实验周期为30 d,期间标准鼠粮与饮水不受限制,记录每天的饮水与采食量;每5天称重并测空腹血糖1次。
实验末所有大鼠颈静脉采血后断颈处死,分离血清。迅速取出心脏,去除心包膜、血渍,称重,分别取约100 mg和200 mg心室肌组织装入无RNA酶冻存管和普通冻存管,立即放入液氮,然后转入-80 ℃冰箱保存备用。
1.4 指标测定 1.4.1 心肌组织中血管紧张素Ⅱ(AngⅡ)的测定 实验确定用浓度为0.02%心肌匀浆液上样。故吸取20 μL浓度为1%心肌组织匀浆液加入980 μL生理盐水,混匀。加入10 μL酶抑制剂混匀即成血管紧张素Ⅱ的检测液。实验采用竞争机制原理,按照放射免疫说明书操作。FMJ-182放射免疫γ-计数仪监测各沉淀管的放射性计数 (CPM)。从标准曲线上查知对应结合率的待测样品中的AngⅡ含量。结果以Ang pg/mg心肌组织表示。
1.4.2 心肌组织中AT1、Mas、ACE、AEC2 mRNA Real-time PCR分析 采用TRIzol一步抽提法提取心肌组织的总RNA。用Eppndorf Biophotometer核酸浓度测定仪测定各个样品的RNA浓度及纯度。核酸分析仪检测其浓度与纯度A260/A280的比值,所有样品所提取的RNA的OD280/260均在1.8−2.0之内,表明所提RNA纯度可靠。二步法进行反转录,获得cDNA,-20 ℃保存备用。
基因引物序列来自GenBank,PCR引物采用Primer 5.0软件设计,引物序列及参数见表1。引物由上海英骏生物技术有限公司合成。
表1 AT1,Mas,β-actin,ACE and ACE2引物序列 Table 1 Parameters of primer pairs for AT1,Mas,β-actin,ACE and ACE2 genes
| Gene | GenBank accession number | Primers sequence (5'−3') | Orientation | Product size (bp) |
| AT1R | NM030985 | CCCACTCAAGCCTGTCTACGAA | Forward | 120 |
| GTGTGCTTTGAACCTGTCACTCC | Reverse | |||
| MasR | NM012757 | TGACAGCCATCAGTGTGGAGA | Forward | 116 |
| GCATGAAAGTGCCCACAGGA | Reverse | |||
| β-actin | AF122902 | CCCTGTGCTGCTCACCGA | Forward | 198 |
| ACAGTGTGGGTGACCCCGTC | Reverse | |||
| ACE | NM012544 | ATGCCTCTGCGTGGGACTTC | Forward | 112 |
| TACTGCACGTGGCCCATCTC | Reverse | |||
| ACE2 | AY881244 | AATCGTAGGCTCTGGGCTTGG | Forward | 182 |
| TTCGATCAACTGGTTTCGGTTGTA | Reverse |
表选项
荧光PCR反应总体积为25 μL,其中cDNA 2.5 μL;ddH2O 7.5 μL;引物 (含量均为10 pmol/L):上游1.25 μL、下游1.25 μL;荧光酶 (SYBR Green) 12.5 μL。
AT1、Mas两个基因PCR反应条件:95 ℃ 1 min;95 ℃ 30 s、62 ℃ 30 s、72 ℃ 30 s,共40个循环。
ACE、ACE2两个基因PCR反应条件:95 ℃ 10 min;95 ℃ 20 s、60 ℃ 30 s、72 ℃ 30 s,增加熔解曲线,共45个循环。
本实验以β-actin管作为内标,以荧光PCR方法来监测4种基因mRNA的相对表达量。以方法计算mRNA的表达量。根据标准曲线所用cDNA的上样浓度为16倍稀释液。
1.4.3 酶联免疫分析法测定心肌组织中的Ang1-7的含量 取10%心肌组织匀浆液10 μL,按试剂盒说明书酶联免疫吸附法(Enzyme linked immunosorbent assay,ELISA) 测定,在RT-6000酶标分析仪96孔酶标板上以空白孔调零,450 nm波长下依序测量各孔的吸光度 (OD值)。
以标准品浓度作横坐标,对应OD值作纵坐标,绘制出标准品线性回归曲线,按曲线方程计算各样本浓度值。本次实验标准曲线方程为y=0.003 4x+0.014 4,R2=0.999 2。式中,y表示各样品所测OD值,x表示各样品心肌5倍稀释后Ang1-7含量 (μg/mL),R表示相关系数。
1.4.4 酶联免疫分析测定心肌组织中的ACE、ACE2的含量 按ELISA试剂盒说明书操作,在96孔酶标板上依次加入10%心肌组织匀浆液样品10 μL,在经过温育、酶联反应、洗涤、显色、终止反应等步骤后。在450 nm波长下以空白孔调零用RT-6000酶标分析仪测定各孔吸光度 (OD值)。
以标准品浓度作横坐标,对应OD值作纵坐标,绘制出标准品线性回归曲线,按曲线方程计算各样本浓度值,再乘以稀释倍数 (5),即为样品的实际浓度。ACE检测范围为1-40 U/g,ACE2检测范围0-24 U/g。
1.5 数据处理 采用SPSS16.0统计软件进行统计分析,差异显著性检验采用单因子方差分析 (One way ANOVA,LSD)。所有数值以平均值±标准误差 (x±s) 表示。
2 结果与分析 2.1 大鼠心肌组织中血管紧张素Ⅱ的含量 由图1看出,模型对照组大鼠心肌组织中AngⅡ含量相对于正常对照组有明显的升高 (P=0.015);而作为阳性对照组,胰岛素治疗组AngⅡ含量相对于模型对照组有明显的下降 (P=0.010);β-CM7干预AngⅡ含量相对于模型对照组也同样有明显下降 (P=0.025)。β-CM7干预组大鼠心肌组织中AngⅡ含量为 (4 377.7±263.93 pg/mg),介于正常对照组 (4 202.1±311.92 pg/mg) 与模型对照组 (5 401.3±301.72 pg/mg) 之间。
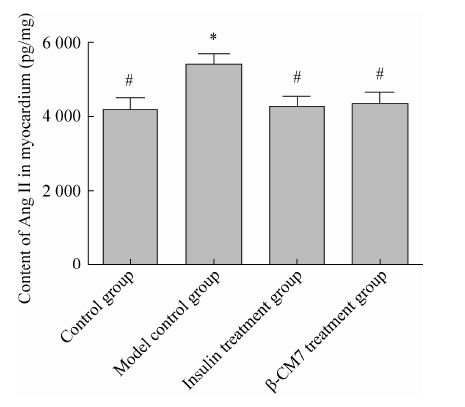 |
| 图1 心肌组织中AngⅡ的含量 Fig.1 Content of angiotensinⅡin rats myocardial tissues (n=8). * means significant difference compared with control group at 0.05 level; # means significant difference compared with model group at 0.05 level. |
| 图选项 |
2.2 大鼠心肌组织中血管紧张素1-7的变化 结果如图2所示,模型对照组大鼠心肌组织中Ang1-7的含量显著低于正常对照组 (P<0.01);而胰岛素治疗组和β-CMT干预组的Ang1-7的含量则显著高于模型对照组 (P<0.01);含量由低到高依次为模型对照组 (7.313±0.57 ng/L)<β-CM7干预组 (12.340±0.687 ng/L) <胰岛素治疗组 (13.420±0.986 ng/L) 和正常对照组 (14.199± 1.084 ng/L)。
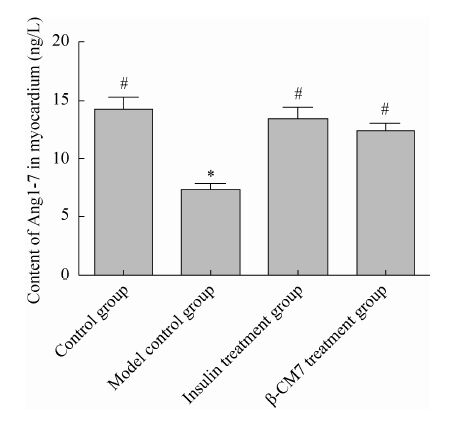 |
| 图2 心肌组织中Ang1-7的含量 Fig.2 Content of angiotensin (1−7) in myocardial tissues (n=8). * means significant difference compared with control group at 0.05 level; # means significant difference compared with model group at 0.05 level. |
| 图选项 |
2.3 心肌组织中AT1R、Mas、ACE和ACE2的mRNA表达变化 结果如图3所示,模型对照组与β-CM7干预组大鼠心肌组织中AT1R及Mas两个受体的mRNA表达显著高于正常对照组与胰岛素治疗组 (P<0.05);在ACE及ACE2的mRNA表达方面,β-CM7干预组大鼠均表现出高表达状态,模型对照组大鼠ACE2的mRNA表达则相对不足。
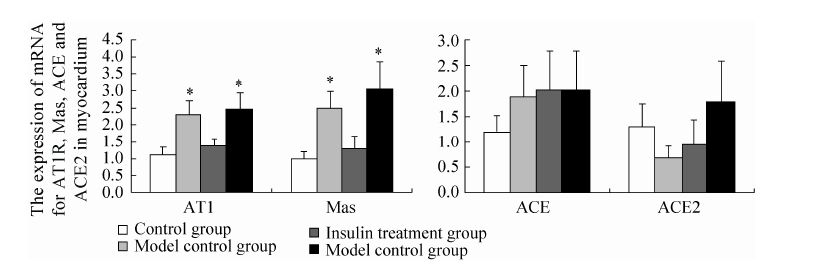 |
| 图3 AT1R、Mas、ACE、ACE2的RNA表达水平 Fig.3 The expression of mRNA for AT1R,Mas,ACE and ACE2 in myocardium (n=8). *means significant difference compared with control group at 0.05 level. |
| 图选项 |
2.4 心肌组织中ACE2 mRNA/ACE mRNA结果变化 由表2可知,在ACE2mRNA和ACEmRNA比值上,β-CM7干预组及正常对照组显著高于模型对照组 (P<0.05)。提示在糖尿病进程中,β-CM7干预组大鼠损伤与抗损伤两条通路均处于激活状态,以ACE2占优势,延缓了糖尿病并发症的发展;模型对照组大鼠则ACE占优势,即损伤通路占优势。
表2 心肌组织中ACE2/ACEmRNA的比值及ACE2/ACE的酶活力的比值 (n=8) Table 2 ACE2/ACE mRNA expression ratio and ACE2/ACE enzyme ratio in myocardium (n=8)
| Myocardium | Control group | Model group | Insulin treatment group | β-CM7 treatment group |
| ACE2/ACE mRNA | 1.02±0.13# | 0.43±0.10* | 0.74±0.15# | 0.83±0.09# |
| ACE2/ACE enzyme radio | 1.15±0.18# | 0.60±0.10* | 0.89±0.08# | 0.93±0.11# |
表选项
2.5 心肌组织中ACE和ACE2的酶活力变化及活力比值分析 由表3看出,模型对照组、β-CM7干预组、正常对照组和胰岛素治疗组ACE酶活力依次升高;模型对照组显著低于β-CM7干预组和正常对照组 (P<0.05)。
表3 心肌组织中ACE和ACE2的酶活力变化 (n=8) Table 3 The change of angiotensin converting enzyme 1 and 2 in myocardial tissue (n=8)
| Groups | ACE enzyme activity (U/g) | ACE2 enzyme activity (U/g) |
| Control group | 1.80±0.085# | 2.18±0.196# |
| Model group | 1.33±0.053* | 0.83±0.152* |
| Insulin treatment group | 1.82±0.080# | 1.24±0.167* |
| β-CM7 treatment group | 1.55±0.059*# | 1.61±0.203*# |
| * means significant difference compared with control group at 0.05 level; # means significant difference compared with model group at 0.05 level. | ||
表选项
由表2可以看出,在ACE2/ACE酶活力比值方面,β-CM7干预组和正常对照组均显著高于模型对照组 (P<0.05),结果与mRNA水平上的结果相符。提示模型对照组在抗损伤通路“AngⅠAng1-7—Mas”并不活跃;β-CM7干预组则在抗损伤通路表现较为活跃,可通过提高ACE2酶活力抗损伤,延缓了糖尿病及心肌病变的发展。
3 讨论 肾素-血管紧张素系统 (RAS) 是心血管和肾脏功能调节的中心环节,通过其经典通路ACE-AngⅡ-AT1R轴可引起血管收缩、水钠潴留、炎症反应、氧化应激及心血管重塑形成等;此通路中的核心是ACE。ACE是一个单链多肽酸性糖蛋白,相对分子质量为14×103-16×103,活性中心含有锌,属肽酰二肽水解酶,通过作用于无活性的AngⅠ的C末端,转化为具有血管收缩功效的AngⅡ。AngⅡ是RAS经典通路中的主要效应分子。目前AngⅡ是被公认的促心肌纤维化因素。Gray等研究证实[12],AngⅡ可直接作用于心肌成纤维细胞,与细胞表面的AT1受体结合刺激心肌成纤维细胞增生及胶原代谢的改变,引起心肌间质及血管周围纤维化导致心脏重构,心室顺应性下降,最终引起舒张和收缩功能障碍,促进心衰的发生。AngⅡ也可通过激活还原型烟酰胺腺嘌呤二核苷酸磷酸 (Nicotinamide adenine dinucleotide phosphate,NADPH) 氧化酶,使内皮细胞线粒体ATP敏感的钾离子通道开放,引起线粒体氧自由基 (ROS) 增加,一氧化氮 (NO) 水平降低,从而加重AngⅡ介导的心血管氧化损伤,心力衰竭和糖尿病等心血管疾病[13, 14, 15, 16]。本实验结果表明模型组大鼠心肌组织中AngⅡ含量明显高于其他各组,结果与他人的研究结果一致。即ACE-AngⅡ- AT1R通路处于强激活状态,参与了糖尿病心肌损伤的发生。
ACE2-Ang1-7-MasR通路是RAS中的另一路径。途径中的核心ACE2具有与ACE相反的作用。其可通过调节血管紧张素多肽的代谢,清除AngⅡ前体AngⅠ使其生成Ang1-9,致使AngⅡ的生成减少,从而减少心肌局部AngⅡ含量,对心肌起到一定的保护作用;另一方面ACE2可催化AngⅡ转化为Ang1-7,并且在ACE2作用下生成的Ang1-9会经过ACE催化最终转变为Ang1-7,这样可以生成较多的Ang1-7,而Ang1-7则可以直接对抗AngⅡ引发的强烈收缩血管、血管壁增厚及氧化应激作用增加等作用[15, 17];此外Ang1-7作为一种内源性血管紧张素转化酶抑制剂 (ACEI) 在抑制AngⅡ同时,还可增强缓激肽发挥效应,使其通过Mas受体实现抗AngⅡ的作用,减轻血管损伤、减弱氧化应激,起到对心肌的保护作用[10, 13, 17, 18]。另外,Gwathmey等[19]研究表明ACE2基因可通过Ang1-7-Mas信号实现其抗氧化效应。本实验中我们的研究发现模型对照组大鼠经典通路中AngⅡ比较活跃,而Ang1-7轴系对其的抑制作用并不明显;同时在本次实验中检测β-CM7干预组大鼠心肌组织中ACE2具有较高的酶活性,其mRNA及其受体Mas的mRNA也处于高水平表达状态,推测β-CM7可以通过提高ACE2的酶活从而使心肌组织中AngⅡ含量降低,增加Ang1-7在心肌中的储备,从而激活ACE2-Ang1-7-MasR通路,增强了机体的抗氧化应激能力,拮抗了糖尿病状态下ACE-AngⅡ-AT1R通路过度激活对心肌的损伤。
综上,本实验室以前的研究发现β-CM7可以降低高血糖[20],通过增加心肌组织中抗氧化酶活性,抑制由于氧化应激而引起的炎症级联反应增强,从而预防或延缓糖尿病心肌病变的发生[21, 22]。本研究结果认为β-CM7可通过对RAS系统的调节,起到对心肌的保护作用,其部分机制与激活ACE2-Ang1-7-MasR通路相关;而胰岛素与RAS系统相关性并不明确,提示β-CM7与胰岛素对心肌保护作用途径不尽相同。
参考文献
| [1] | Poornima IG, Parikh P, Shannon RP. Diabetic cardiomyopathy: the search for a unifying hypothesis. Circ Res, 2006, 98(5): 596-605. |
| [2] | An D, Rodrigues B. Role of changes in cardiac metabolism in development of diabetic cardiomyopathy. Am J Physiol Heart Circ Physiol, 2006, 291(4): 1489-1506. |
| [3] | Adeghate E. Molecular and cellular basis of the aetiology and management of diabetic cardiomyopathy: a short review. Mol Cell Biochem, 2004, 261(1): 187-191. |
| [4] | Crackower MA, Sarao R, Oudit GY, et al. Angiotensin-converting enzyme 2 is an essential regulator of heart function. Nature, 2002, 417(6891): 822-828. |
| [5] | Zhang B, Fan JQ, Zhang QJ, et al. Effect of angiotensin-converting enzyme 2 over expression on ventricular remodeling in rat model of mycardial infarction. Acad J Sec Milit Med Univ, 2013, 34(12): 1291-1298 (in Chinese). 张波, 范晋奇, 张全军, 等. 血管紧张素转化酶2过表达对大鼠心肌梗死后心室重构的影响. 第二军医大学学报, 2013, 34(12): 1291-1298. |
| [6] | Zhang CH, Zang WJ, Zang YM. The relationship between RAS system, Ca2+ transport and diabetes, cardiopathy. J Cardiop, 2002, 14(5): 439-442 (in Chinese). 张春虹, 臧伟进, 臧益民. RAS系统、Ca2+转运与糖尿病心肌病的关系. 心脏杂志, 2002, 14(5): 439-442. |
| [7] | Donoghue M, Hsieh F, Baronas E, et al. A novel angiotensin-converting enzyme-related carboxypeptidase (ACE2) converts angiotensin I to angiotensin 1-9. Circ Res, 2000, 87(5): e1-e9. |
| [8] | Tipnis SR, Hooper NM, Hyde R, et al. A human homolog of angiotensin-converting enzyme. Cloning and functional expression as a captopril-insensitive carboxypeptidase. J Biol Chem, 2000, 275(43): 33238-33243. |
| [9] | Pei ZH, Meng RS, Li GW, et al. Angiotensin-(1-7) ameliorates myocardial remodeling and interstitial fibrosis in spontaneous hypertension: role of MMPs/TIMPs. Toxicol Lett, 2010, 199(2): 173-181. |
| [10] | Han DN, Zhang DH, Wang LP, et al. Protective effect of β-Casomorphin-7 on cardiomyopathy of streptozotocin-induced diabetic rats via inhibition of hyperglycemia and oxidative stress. Peptide, 2013, 44: 120-126. |
| [11] | Zhang W, Miao JF, Wang SS, et al. The protective effects of beta-casomorphin-7 against glucose-induced renal oxidative stress in vivo and vitro. PLoS ONE, 2013, 8(5): e63472. |
| [12] | Gray MO, Long CS, Kalinyak JE, et al. Angiotensin II stimulates cardiac myocyte hypertrophy via paracrine release of TGF-β1 and endothelin-1 from fibroblast. Cardiovasc Res, 1998, 40(2): 352-363. |
| [13] | Briones AM, Touyz RM. Oxidative stress and hypertension: current concepts. Curr Hypertens Rep, 2010, 12(2): 135-142. |
| [14] | Zhong JC, Guo D, Chen CB, et al. Prevention of angiotensinⅡ-mediated renal oxidative stress, inflammation, and fibrosis by angiotensin-converting enzyme 2. Hypertension, 2011, 57(2): 314-322. |
| [15] | Zhong JC, Basu R, Guo D, et al. Angiotensin-converting enzyme 2 suppresses pathological hypertrophy, myocardial fibrosis, and cardiac dysfunction. Circulation, 2010, 122(7): 717-728. |
| [16] | Dworakowski R, Anilkumar N, Zhang M, et al. Redox signaling involving NADPH oxidase-derived reactive oxygen species. Biochem Soc Trans, 2006, 34(Pt5): 960-964. |
| [17] | Zhong JC, Zhu DL. Angiotensin-converting enzyme 2 and hypertension. J Hypert, 2005, 13(11): 682-686 (in Chinese).钟久昌, 朱鼎良. 血管紧张素转换酶2与高血压. 高血压杂志, 2005, 13(11): 682-686. |
| [18] | Zhong JC, Yu XY, Yu HM, et al. Effect of recombinant angiotensin-converting enzyme 2 gene on oxidative stress levels in human endothelial cells. J Zhonghua Hypert, 2008, 16(6): 499-502 (in Chinese). 钟久昌, 余细勇, 于汇民, 等. 血管紧张素转换酶2基因转染对人血管内皮细胞中氧化应激水平的影响. 中华高血压杂志, 2008, 16(6): 499-502. |
| [19] | Gwathmey TM, Pendergrass KD, Reid SD, et al. Angiotensin (1-7) angiotensin-converting enzyme 2 attenuates reactive oxygen species formation to angiotensin II with in the cell nucleus. Hypertension, 2010, 55(1): 166-171. |
| [20] | Song XD, Ren HH, Yin H, et al. Inhibition of β-casomorphin-7 on the absorption of glucose in rat’s small intestin in vitro. Acta Nutr Sin, 2010, 32(2): 117-120, 125 (in Chinese). 宋晓丹, 任欢欢, 印虹, 等. β-酪啡肽-7对大鼠离体小肠葡萄糖吸收的抑制效应. 营养学报, 2010, 32(2): 117-120, 125. |
| [21] | Yin H, Miao JF, Ma C, et al. Potential effects of β-casomorphin-7 in pancreas of type 1 diabetes rats. J Food Sci, 2012, 77(2): P278-P282. |
| [22] | Han DN, Wang YX, Xu CY, et al. Effect of β-casomorphin-7 on blood glucose level and its anti-lipid peroxidation effect in diabetic rats. Food Sci, 2012, 33(5): 243-247 (in Chinese). 韩东宁, 王艳霞, 徐晨阳, 等. β-酪啡肽-7对大鼠血糖及脂质过氧化的影响. 食品科学, 2012, 33(5): 243-247. |
