

福建师范大学 生命科学学院 福建省发育与神经生物学重点实验室,福建 福州 350108
基金项目:福建省教育厅重点项目 (No. JA12061) 资助
摘要: 牙本质涎磷蛋白(DSPP) 的表达是细胞向成牙本质细胞分化的标志。试图分析人DSPP启动子及构建人DSPP启动子驱动的LacZ基因表达的报告体系,从而方便快捷检测细胞是否向成牙本质细胞分化。为了建立能表达DSPP的细胞体系,分离了人牙胚间充质细胞,并用地塞米松诱导培养液进行诱导,结果显示,该诱导培养液能有效地诱导人牙胚间充质细胞DSPP基因的表达。利用双荧光素酶报告系统对4段人DSPP基因5′上游区域 (?4 000?+54、?2 500?+54、?1 447?+54和?1 027?+54) 进行分析,结果显示?2 500?+54区域的启动子活性最高。5′上游区从-2 500 bp延长到-4 000 bp时,启动子活性下降;5′上游区从?2 500 bp缩短至 ?1 447 bp时,启动子活性下降;再次将?1 447 bp缩短至?1 027 bp时,启动子活性进一步下降。结果暗示在?4 000 bp至?2 500 bp区域存在转录抑制元件,?2 500 bp至?1 027 bp区域存在转录激活元件。用?2 500?+54启动子区域和LacZ基因构建phDSPP-LacZ慢病毒报告载体,并分别在人牙胚间充质细胞和永生化人牙胚间充质细胞系ihEDMC4上检测phDSPP-LacZ报告载体的功能,通过X-Gal染色,结果显示在2种细胞牙向分化过程中均可检测到LacZ基因的表达。研究构建的phDSPP-LacZ慢病毒报告载体可为诱导人源细胞牙向分化、牙齿发育、牙齿再生工程等研究中DSPP的表达检测提供一种更加便捷的手段。
关键词: 牙本质涎磷蛋白 启动子 人牙胚间充质细胞 LacZ基因
Expression of the reporter LacZ driven by human dentin sialophosphoprotein promoter in human dental mesenchymal cells
Lin Meizhen, Jiang Meiqin, Li Shuiqin, Lin Yan, Huang Yide


Fujian Key Laboratory of Developmental and Neural Biology,College of Life Sciences,Fujian Normal University,Fuzhou 350108,Fujian,China
Received: November 18, 2015; Accepted: March 24, 2016
Supported by:Foundation of Fujian Educational Committee (No. JA12061)
Corresponding authors:Yide Huang. Tel/Fax: +86-591-22860592; E-mail: ydhuang@fjnu.edu.cn
Abstract: The expression of dentin sialophosphoprotein (DSPP) is the marker for cells differentiated into odontoblasts. This study attempted to analyze the DSPP promoter and build the reporter LacZ expression system driven by this promoter,which allows convenient and quick detection of odontoblast cells. First,we separated the human dental mesenchymal cells in which the expression of DSPP can be effectively induced by dexamethasone. Second,four 5′ flanking regions of human DSPP gene (? 4 000?+54,?2 500?+54,?1 447?+54 and ?1 027?+54) were analyzed,the results showed that the highest promoter activity lied in the ?2 500?+54 region. The promoter activity is reduced when the 5′ flanking region was extended from ?2 500 to ?4 000 bp upstream from the transcription start site; The promoter activity are also decreased when the 5′ flanking regions were shorted from ?2 500 to ?1 447 bp and from ?1 447 to ?1 027 bp,indicating that potential suppresser elements are lied in the region between ?4 000 and ?2 500 bp and potential activator elements are lied in the region between ?2 500 and ?1 027 bp. Then we constructed the lentiviral report vector phDSPP-LacZ containing the ?2 500?+ 54 promoter region in front of the LacZ gene. The expression of LacZ was detected using X-Gal staining in both human dental mesenchymal cells and immortalized human dental mesenchymal cells infected with phDSPP-LacZ. The phDSPP-LacZ lentiviral vector may provide a more convenient method to detect the expression of DSPPinhuman odontogenic differentiation,tooth development and tooth regeneration studies.
Key words: dentin sialophosphoprotein (DSPP) promoter human dental mesenchymal cells LacZ gene
牙本质中的大部分非胶原蛋白和胶原纤维是由成牙本质细胞分泌,在牙本质基质中,非胶原蛋白可占牙有机成分的90%,它们提供矿化模板,控制晶体形核和生长[1-2]。非胶原蛋白主要包括牙本质磷蛋白 (Dentin phosphoprotein DPP)、牙本质涎蛋白 (Dentin sialoprotien DSP)、牙本质基质蛋白1 (DMP1)、骨钙素 (OC)、骨桥素 (OPN) 等,其中DSP和DPP是牙本质胞外基质 (Extracellular matrix) 的主要成分蛋白,由牙本质涎磷蛋白 (Dentin sialophosphoprotein DSPP) 割裂加工产生[3-5]。DSPP起先认为只特异表达于成牙本质细胞,后来研究发现DSPP也表达于骨[6-7]、牙骨质[8-9]和某些非矿化的组织中[10]。
在细胞牙向分化的研究中,目前未找到只唯一表达在成牙本质细胞中的特异基因,因此,依然将DSPP基因表达作为细胞牙向分化的重要标志之一。目前所用检测DSPP表达的方法主要有RT-PCR或Real-time PCR、免疫组化和Western印迹,这些方法操作耗时费力。如能构建一个以人DSPP启动子驱动的LacZ报告体系,将可以快速方便地检测在人源细胞牙向分化研究中DSPP的表达情况。虽然在小鼠中找到了活性较强的DSPP启动子成分[3],但人类DSPP启动子的结构尚未见报道。为了构建人DSPP启动子驱动的LacZ报告体系,我们应用荧光素酶报告系统对不同长度的人DSPP基因上游序列进行分析,寻找启动子活性最高的序列。利用活性最高的DSPP -2 500-+54区的启动子序列构建LacZ表达载体,并在人牙胚间充质细胞和永生化人牙胚间充质细胞系ihEDMC4[11]体外诱导牙向分化过程中检测LacZ的表达。
1 材料与方法1.1 道德伦理申明本研究所使用的人源性样本取自福建省福州市东南女子医院患者自愿药物流产的胎儿并得到患者的知情同意。本研究得到福建师范大学动物伦理委员会的许可并且严格遵守其相关规定。
1.2 材料载体pEGFP-N1、pNL-IRES-EGFP、pAd/CMV/ V5-GW/LacZ及三质粒慢病毒系统中的质粒pVSVG、pHelper、293T细胞和人牙胚间充质永生化细胞系ihEDMC4[11]由本实验室保存;双荧光酶报告载体pGL3-Basic和CMV-Renilla购自Promega公司;克隆中所用到的限制性内切酶和修饰酶均购自大连TaKaRa公司;荧光酶检测试剂盒Dual-Luciferase? Reporter Assay System和转染试剂TransFast? Transfection Reagent购自Promega公司;地塞米松和β-甘油磷酸酯钠购自Sigma公司;L-抗坏血酸磷酸酯购自日本Wako公司;α-MEM和DMEM高糖培养基购自赛默飞世尔生物化学制品有限公司;胎牛血清购自Hyclone公司;引物由生工生物工程 (上海) 公司合成。
1.3 人牙胚间充质细胞分离培养及DSPP基因诱导表达人19周下磨牙牙胚用DispaseⅡ (2 U/mL)消化,使牙间充质与牙上皮互相分离。然后向牙间充质组织中加入适量的CD酶 (3 mg/mL Ⅰ型胶原酶和4 mg/mL DispaseⅡ),37 ℃、5% CO2细胞培养箱中进行消化30 min左右,期间每隔10 min左右吹打消化的组织。消化下来细胞在含10%胎牛血清 (FBS) 的α-MEM培养基中连续培养10 d,中间不换细胞培养液。10 d后换半液再继续培养4 d,之后换成新鲜培养液进行培养。待细胞的汇合度达90%左右时对细胞进行传代。传至第3代细胞用于实验。在诱导牙间充质细胞表达DSPP实验中,当牙间充质细胞传代24 h后,更换成地塞米松a-MEM (10% FBS) 诱导培养液 (100 nmol/L 地塞米松,10 mmol/L β-甘油磷酸酯钠,50 μg/mL L-抗坏血酸磷酸酯) 进行诱导培养,诱导培养14 d,期间每隔2 d换一次液。通过Real-time PCR检测DSPP表达情况,扩增上游引物:5¢-GCCATTC CAGTTCCTCAAAGC-3¢,下游引物:5¢-CATGC ACCAGGACACCACTT-3¢。
1.4 pGL3-DSPP-Luc载体的构建从人基因组DNA中克隆出4段DSPP启动子拟区域序列,序列位置分别为:-4 000-+54、-2 500- +54、-1 447-+54和-1 027-+54,扩增引物见表 1。-1 447-+54和-1 027-+54片段通过SalⅠ位点克隆到含有萤火虫荧光素酶基因的pGL3-Basic载体上,重组载体分别命名为pGL3-DSPP (-1 447-+54)-Luc和pGL3-DSPP (-1 027-+54)-Luc。-4 000-+54和-2 500-+54片段通过KpnⅠ和SacⅠ位点克隆到pGL3-Basic载体上,重组载体分别命名为pGL3- DSPP (-4 000-+54)-Luc和pGL3-DSPP (-2 500- +54)-Luc。
表 1 PCR扩增所用的引物Table 1 Primers for PCR amplification
| Primer name | Primer sequence (5¢-3¢) |
| pGL3- DSPP- Luc vector | |
| hDSPP (-4 000-+54) -F1 | GCGGTACCTACACCATGGAATACTATGCAG |
| hDSP P (-4 000-+54) -R1 | GCGAGCTCTCTTATCTTTCTCTTTGAAGACTGA |
| hDSPP (-2500-+54) -F2 | GCGGTACCACATATTATTGGGTTTGAT |
| hDSPP (-2 500-+54) -R2 | GCGAGCTCTCTTATCTTTCTCTTTGAAGACTGA |
| hDSPP (-1 447-+54) -F3 | GCGTCGACATTGAGATTCATTTTGGGGC |
| hDSPP (-1 447-+54) -R3 | GCGTCGACTCTTATCTTTCTCTTTGAAGACTGA |
| hDSPP (-1 027-+54) -F4 | AAGTCGACTTCCTTCCCATTCA |
| hDSPP (-1 027-+54) -R4 | GCGTCGACTCTTATCTTTCTCTTTGAAGACTGA |
| phDSPP-LacZ lentiviral vector | |
| LacZ-F5 | CCCCCGGGTCACCATGATAGATCCCG |
| LacZ-R5 | TTGCGGCCGCTTATTTTTGACACCAGAC |
| hDSPP (-2 500-+54) -F6 | GCGTCGACACATATTATTGGGTTTGAT |
| hDSPP (-2 500-+54) -R6 | GGGGTACCTCTTATCTTTCTCTTTGAAGACTGA |
| hDSPP (-2 500-+54) -LacZ-SV40 poly(A)-F7 | TGCTCTAGAACATATTATTGGGTTTGAT |
| hDSPP (-2 500-+54) -LacZ-SV40 poly(A)-R7 | TGCTCTAGATTGATGAGTTTGGACAAACC |
表选项
1.5 DSPP启动子活性检测采用双报告荧光素酶检测DSPP各区段的启动子活性。按Dual-Luciferase? Reporter Assay System (Promega公司) 试剂盒操作说明进行,简要如下:在15 mL离心管中用2 mL无血清α-MEM培养液分别将2.5 μg pGL3-hDSPP (-4 000-+54)- Luc、pGL3-hDSPP (-2 500-+54)-Luc、pGL3- hDSPP (-1 447-+54)-Luc和pGL3-hDSPP (-1 027- +54)-Luc重组质粒和2.5 μg CMV-Renilla质粒混匀。加入15 μL TransFast? Transfection Reagent (Promega公司),混匀后室温静置15 min。吸弃地塞米松诱导培养10 d后的人牙胚间充质细胞培养液,并加入上述质粒DNA/TransFast? Transfection Reagent混合液,37 ℃、5% CO2培养箱中孵育2 h。孵育结束后,向6 cm培养皿加入4 mL含10%FBS的α-MEM培养液,培养48 h后收集并裂解细胞。细胞裂解液用GloMax?-Multi JR检测仪 (Promega公司) 分别检测DSPP启动子活性。
1.6 phDSPP-LacZ慢病毒载体的构建为了构建phDSPP-LacZ慢病毒载体,首先以pAd/CMV/V5-GW/LacZ载体为模板,设计LacZ上下游引物 (表 1),通过PCR扩增得到LacZ基因,LacZ基因的5′和3′端通过引物引入SmaⅠ和NotⅠ酶切位点。用酶SmaⅠ和NotⅠ双酶切去除pEGFP-N1质粒上EGFP序列,回收pEGFP-N1骨架并与用酶SmaⅠ和NotⅠ双酶切LacZ片段连接,将LacZ基因克隆到pEGFP-N1质粒EGFP位置上。以pGL3-hDSPP (-2 500-+54)-Luc质粒为模板,扩增-2 500-+54的hDSPP启动子序列,并在5′和3′端分别引入SalⅠ和KpnⅠ酶切位点。用SalⅠ和KpnⅠ双酶切上述构建的含有LacZ基因的pEGFP-N1重组质粒,并与SalⅠ和KpnⅠ双酶切的hDSPP (-2 500-+54) 片段连接。通过设计hDSPP (-2 500-+54) 上游引物和SV40终止子下游引物 (表 1),PCR扩增含有hDSPP (-2 500-+54)、LacZ基因和SV40终止子序列片段,并在片段的上下游引入XbaⅠ酶切位点。用XbaⅠ分别酶切上述片段和慢病毒载体pNL-IRES-EGFP,并将它们连接构建phDSPP-LacZ重组载体。
1.7 phDSPP-LacZ慢病毒生产phDSPP-LacZ慢病毒的生产按文献[12]进行,方法简要如下:用含10% FBS高糖DMEM培养基培养293T细胞,待细胞丰度达到75%-85%时,采用磷酸钙法将15 μg phDSPP- LacZ、6 μg pVSVG和7 μg pHelper三个质粒共同转染到293T细胞中。12 h后终止转染,荧光显微镜下观察转染的细胞表达绿色荧光蛋白情况。终止转染24 h后,收集含有病毒的培养液,并更换新鲜培养液,此后每隔12-18 h收集1次病毒上清液,并添加新鲜培养液,直至293T细胞死亡。收集的病毒上清液用Amicon Ultra-15 Centrifugal Filter Units超滤管 (Millipore) 进行浓缩。病毒浓缩液进行滴度测定,分装,-80 ℃保存。
1.8 LacZ表达检测人牙胚间充质细胞和永生化人牙胚间充质细胞ihEDMC4分别转染phDSPP-LacZ和pNL-IRES-EGFP空载慢病毒,36 h后吸去培养液终止感染,并用地塞米松诱导培养液连续诱导培养7 d。用PBS对细胞洗涤2次。用0.5%戊二醛于室温中固定细胞10 min,细胞固定后用含1 mmol/L MgCl2的PBS缓冲液洗涤3次。用含X-Gal的染色液 (于PBS中配制1 mg/mL X-Gal,5 mmol/L K4Fe(CN)6·3H2O,5 mmol/L K3Fe(CN)6和2 mmol/L MgCl2)对细胞进行染色。
2 结果与分析2.1 人牙胚间充质细胞的分离培养用Dispase II酶对人牙胚组织进行消化分离牙间充质组织和牙上皮组织。人牙胚间充质组织用CD酶进行消化,消化后的单细胞进行培养。图 1是人牙胚间充质细胞培养不同时间的形态图,从图中可以看出,人牙胚间充质细胞形态呈长梭形。对分离的人牙胚间充质细胞进行连续传代,发现其可连续生长到P28代左右,表明人牙胚间充质细胞具有很强的增殖能力。
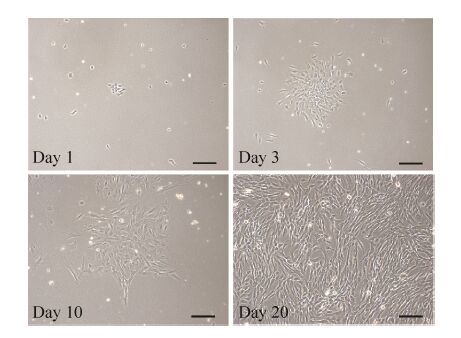 |
| 图 1 分离培养的人牙胚间充质细胞形态 Figure 1 Morphology of isolated human embryonic dental mesenchymal cells in culture. Primary cells were isolated from human molar and cultured in α-MEM medium with 10% FBS. The morphology of the cells at days 1,3,10 and 20 were presented. Scale bars represent 100 μm. |
| 图选项 |
2.2 体外诱导人牙胚间充质细胞DSPP表达 用地塞米松诱导培养液对P3代人牙胚间充质细胞进行诱导培养。诱导培养14 d后,用Real-time PCR检测细胞DSPP基因表达情况。结果显示地塞米松诱导培养液能有效地诱导人牙胚间充质细胞DSPP的表达,与未诱导组相比,诱导组DSPP表达量大约上升了63倍左右 (图 2)。
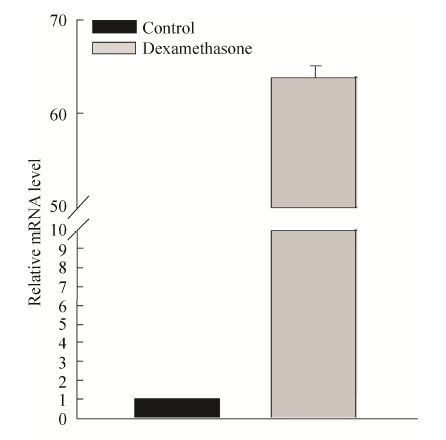 |
| 图 2 地塞米松诱导培养液诱导人牙胚间充质细胞DSPP表达 Figure 2 Induction of DSPP by dexamethasone in primary embryonic dental mesenchymal cells. Human embryonic dental mesenchymal cells at P3 were cultured in media with or without dexamethasone for 14 d before RNA extraction. The DSPP mRNA expression were detected using real-time PCR. |
| 图选项 |
2.3 人DSPP近端启动子分析对人DSPP转录起始位点上游2 553 bp碱基序列进行生物信息学分析,结果如图 3所示。人DSPP启动子没有CG岛。在近转录起始位点区域 (-89到-75 bp和-29到-15 bp) 有2个TBP (TATA框结合蛋白) 结合位点,其中-89到-75 bp处有1个TATA框。除靠近转录起始位点处有2个TBP结合位点和1个TATA框外,序列中还存在另外7个TBP结合位点和6个TATA框,并且6个TATA框都在TBP结合位点中。在分析的区域中存在1个CAAT框、1个GC框、4个Runx2位点、9个Msx1位点、4个TCF-1位点、2个NF-Y位点、7个GATA-1位点、3个C/EBP β位点和2个SP1位点 (图 3)。
 |
| 图 3 人DSPP近端启动子区域分析 Figure 3 Analysis of human DSPP proximal promoter region. The DNA sequence of the 2.5 kb 5′ flanking region and parts of downstream sequence of the human DSPP gene are shown. Nucleotides are numbered on the left. +1 corresponding to the transcription start of the promoter. The potential response element of Runx2,Msx1,TCF-1,NF-Y,GATA-1,C/EBP β and SP1 are underlined and labeled. TATA box,CAAT box and GC box sequences are shown with the box. |
| 图选项 |
2.4 DSPP启动子活性检测从人基因组中PCR扩增出4段DSPP拟启动子区域,区域包括DSPP基因转录起始位置上游序列和部分下游序列 (-4 000-+54、-2 500-+54、-1 447-+54和-1 027-+54)。将4段DSPP拟启动子区域分别插入pGL3-Basic质粒荧光素酶基因的上游,以驱动荧光素酶的表达(图 4A)。重组载体pGL3-hDSPP (-4 000-+54)-Luc、pGL3-hDSPP (-2 500-+54)-Luc、pGL3-hDSPP (-1 447-+54) -Luc和pGL3-hDSPP (-1 027-+54)-Luc以及载体pGL3-Basic分别转染经地塞米松诱导培养液诱导后的人牙胚间充质细胞。48 h后对细胞裂解液进行荧光素酶活性检测。结果显示,在4个检测的DSPP拟启动子区域中,-2 500- +54区域活性最强(图 4B)。
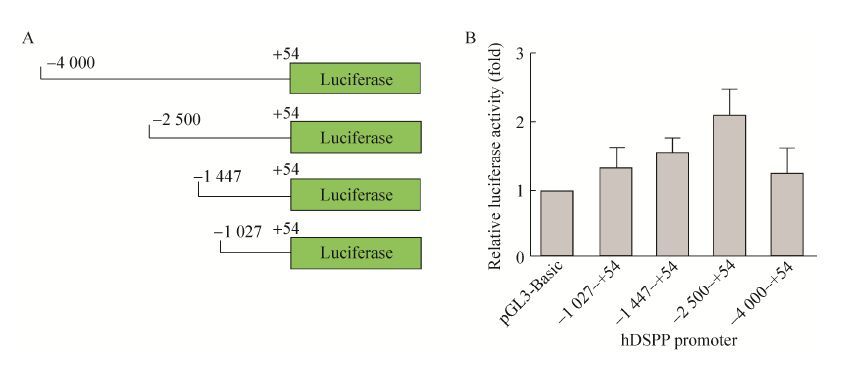 |
| 图 4 DSPP启动子活性检测 Figure 4 Analysis of hDSPP promoter activity. (A) Diagram of pGL3- hDSPP- Luc vectors containing four different regions of hDSPP promoter upstream of the luciferase gene. (B) The four reporter vectors and pGL3-Basic were respectively transfected into the induced human embryonic dental mesenchymal cells by dexamethasone. The expression of luciferase in each group was then examined using GloMax?-Multi JR 48 h post transfection. |
| 图选项 |
2.5 phDSPP-LacZ报告载体的构建及其功能为了方便分析细胞在牙向分化过程中DSPP的表达情况,我们利用hDSPP启动子活性最高的区域 (-2 500-+54) 来驱动LacZ基因的表达。-2 500-+54 hDSPP启动子和LacZ基因序列一起克隆到pNL-IRES-EGFP慢病毒载体上,构建成phDSPP-LacZ报告载体 (图 5A)。利用293T细胞成功生产出phDSPP-LacZ 病毒 (图 5B),超滤管浓缩后病毒滴度约为5.8×106 TU/mL。
 |
| 图 5 phDSPP-LacZ报告载体的示意图及包装慢病毒 Figure 5 Construction of phDSPP-LacZ vector for lentivirus production. (A) Diagram of phDSPP-LacZ vector. (B) HEK293T cells were co-transfected with phDSPP- LacZ,pVSVG and pHelper using calcium phosphate method and left to grow for 12 h before the culture media was replaced with fresh media. The expression of GFP protein were detected using fluorescent microscope 24 h post transfection. Scale bars represent 10 μm. |
| 图选项 |
phDSPP-LacZ报告载体是利用LacZ作为报告基因,一旦细胞表达DSPP,DSPP启动子即可启动LacZ基因转录产生β-半乳糖苷酶。β-半乳糖苷酶通过作用底物X-Gal,可生成不溶性蓝色产物并沉积在细胞周围。因此通过X-Gal染色就可方便地判断细胞或组织中DSPP表达情况。感染phDSPP-LacZ病毒的人牙胚间充质细胞和人牙胚间充质永生化细胞系ihEDMC4经地塞米松诱导培养液诱导培养后,X-Gal染色可以检测到LacZ基因的表达 (图 6)。
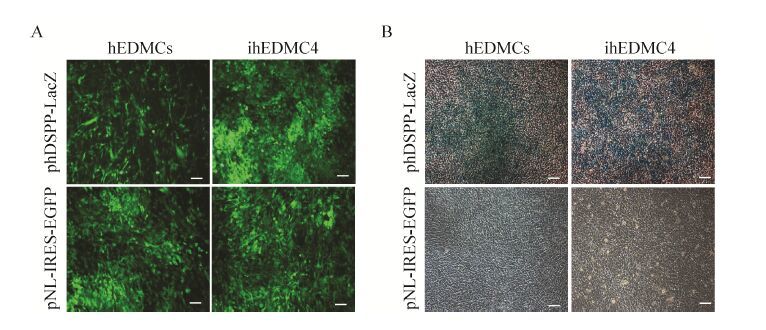 |
| 图 6 体外检测phDSPP-LacZ载体功能 Figure 6 Examination of phDSPP-LacZ reporter function in vitro. (A) Human embryonic dental mesenchymal cells (hEDMCs) at P3 and immortalized human embryonic dental mesenchymal cell line ihEDMC4 at P78 were both transduced with phDSPP-LacZ or pNL-IRES-EGFP and left to grow for 36 h before the culture media was replaced with fresh media containing dexamethasone. To observe transduction efficiency,the GFP expression was examined using inverted fluorescence microscope. (B) After 7 d induction by dexamethasone,the cells from (A) were fixed and stained with X-gal. Scale bars represent 10 μm. |
| 图选项 |
3 讨论在牙齿发育的过程中,靠近内釉上皮细胞的牙乳头细胞被诱导形成成牙本质细胞,成牙本质细胞表达分泌各种牙本质基质蛋白,矿化后形成牙本质[13-14]。在牙本质基质蛋白中,来源于DSPP的DSP和DPP蛋白是其主要成分蛋白。因此,DSPP被作为是细胞牙向分化的最重要标志蛋白之一。在许多研究中,如利用干细胞进行的牙再生研究、牙齿的发育研究等经常要检测DSPP基因的表达情况。而目前还没有一种方便快捷的方法用于检测对人类细胞牙向分化过程中DSPP的表达。
在大鼠DSPP表达研究中,Ritchie等将LacZ基因连接于大鼠DSPP启动子后,通过X-Gal染色,可以方便地做到在原位检测哪些细胞表达DSPP[15],相似的方法也可以用于人类细胞牙向分化过程中DSPP的检测。为了建立这种检测手段,首先必须对人类DSPP启动子进行分析。DSPP启动子并非组成型的启动子,不是在所有牙源性的细胞中都有表达,只有在细胞牙向分化过程中形成牙本质细胞才会得以表达。研究发现,牙源性的干细胞通过适当的诱导可以向成牙本质细胞分化[16-19]。研究人员用含有地塞米松、β-甘油磷酸和抗坏血酸按照一定比例添加到培养液中配成诱导培养液,可以促进人牙髓干细胞和永生化的牙乳头细胞向成牙本质样细胞分化,表达DSPP蛋白[20-22]。我们也采取这种方法对分离的人牙胚间充质细胞进行诱导,发现地塞米松诱导培养液也可以有效地诱导人牙胚间充质细胞DSPP基因的表达。
建立可表达DSPP细胞体系后,我们克隆了4段包括转录起始位点不同长度的上游和部分下游序列:-4 000-+54、-2 500-+54、-1 447-+54和-1 027-+54。利用双荧光素酶报告系统,分别检测这4段序列的启动子活性,发现克隆的4段DSPP启动子序列中-2 500-+54活性相对最高,其次是-1 447-+54,而-1 027-+54和 -4 000-+54相对比较低。将人DSPP基因5′上游区域从-2 500 bp延长至-4 000 bp时,启动子活性出现明显的下降,表明在-4 000 bp到 -2 500 bp区域存在转录抑制元件。启动子区域从-2 500 bp缩短至-1 447 bp时和从-1 447 bp缩短至-1 027 bp时,启动子活性都出现下降,表明这2个区域存在转录激活元件。对人DSPP近端的启动子分析表明在-2 500至-1 447间存在1个NF-Y位点、4个Mxs1位点以及1个CAAT框和1个GC框。在-1 447 bp至-1 027 bp间存在2个Runx2位点和4个Msx1位点。在-1027至转录起始位点区间也存在着2个Runx2位点。NF-Y,也称为CBF或CP1,是CCAAT结合因子,在许多真核生物的启动子上有结合位点,与启动子结合后可以激活基因的转录。在小鼠的DSPP表达研究中发现,CCAAT结合因子位点突变后,其启动子活性出现5倍的下降,表达CCAAT结合因子可以激活DSPP的表达[23]。Bmp2上调DSPP的表达也是通过诱导NF-Y在核中聚集,从而刺激DSPP表达[24]。Msx1是牙齿发育最重要的调节蛋白之一,Msx1敲除小鼠牙齿发育失败[25]。Runx2对于成骨细胞和成牙本质细胞分化很重要,在成牙本质细胞系MO6-G3研究中发现Runx2可抑制DSPP的表达[26]。人DSPP启动子从-1 447延伸到-2 500 bp时,启动子活性增加,可能与其在这个区间存在正调控因子NF-Y、Mxs1和调节序列CAAT框和GC框相关。而-1 447到+54,以及再从 -1 447 bp截短到-1 027 bp,启动子活性都出现不同程度的下调,可能Runx2参与了对DSPP表达的抑制。在人DSPP启动子上,这些因子具体结合到哪个位置并如何调控其表达还有待于进一步的研究。有趣的是,在对人DSPP启动子分析时发现,除转录起始位点附近处有TATA框和TBP结合位点外,在更上游的地方还分布着多个TATA框和TBP结合位点,人DSPP基因具体由哪一个TATA框起始转录或者是否存在多个转录起始位点目前还是未知。
LacZ基因是生物学研究中常用的报告基因之一[27-28]。LacZ基因编码的β-半乳糖苷酶通过分解无色的底物X-Gal产生不溶性蓝色产物,可以观察表达β-半乳糖苷酶的细胞,其作为报告蛋白最大的优点是易于在组织水平上观测原位表达,并且不受组织特别是钙化组织自发荧光的影响。为了使构建的报告体系除了可用于培养的细胞检测外,还可方便用于重组的组织块或是器官发育过程中DSPP的检测,我们选择LacZ基因作为研究的报告基因。研究中将活性最高的DSPP启动子区域(-2 500-+54)克隆到LacZ基因上游,构建phDSPP-LacZ慢病毒报告载体。将该载体感染人牙胚间充质细胞和永生化人牙胚间充质细胞系ihEDMC4,细胞经牙向分化诱导后,均能检测到LacZ基因表达。表明我们构建的phDSPP-LacZ慢病毒载体可为诱导人源细胞牙向分化、牙齿发育和牙齿再生工程等研究中DSPP的表达检测提供一种更加便捷的手段。
参考文献
| [1] | Thesleff I, Nieminen P. Tooth morphogenesis and cell differentiation.Curr Opin Cell Biol, 1996, 8(6): 844–850.DOI:10.1016/S0955-0674(96)80086-X(in Chinese). |
| [2] | Li Z, Yu M, Tian W. An inductive signalling network regulates mammalian tooth morphogenesis with implications for tooth regeneration. Cell Prolif, 2013, 46(5): 501–508(in Chinese). |
| [3] | Feng JQ, Luan XH, Wallace J, et al. Genomic organization,chromosomal mapping,and promoter analysis of the mouse dentin sialophosphoprotein (Dspp) gene,which codes for both dentin sialoprotein and dentin phosphoprotein.J Biol Chem, 1998, 273(16): 9457–9464.DOI:10.1074/jbc.273.16.9457(in Chinese). |
| [4] | Yamakoshi Y, Kinoshita S, Izuhara L, et al. DPP and DSP are necessary for maintaining TGF-β1 activity in dentin.J Dent Res, 2014, 93(7): 671–677.DOI:10.1177/0022034514534690(in Chinese). |
| [5] | MacDougall M. Refined mapping of the human dentin sialophosphoprotein (DSPP) gene within the critical dentinogenesis imperfecta type II and dentin dysplasia type II loci.Eur J Oral Sci, 1998, 106(S1): 227–233.DOI:10.1111/eos.1998.106.issue-S1(in Chinese). |
| [6] | Qin C, Brunn JC, Cadena E, et al. The expression of dentin sialophosphoprotein gene in bone.J Dent Res, 2002, 81(6): 392–394.DOI:10.1177/154405910208100607(in Chinese). |
| [7] | Choi YS, Lee JY, Suh JS, et al. The mineralization inducing peptide derived from dentin sialophosphoprotein for bone regeneration.J Biomed Mater Res A, 2013, 101A(2): 590–598.DOI:10.1002/jbm.a.v101a.2(in Chinese). |
| [8] | Baba O, Qin CL, Brunn JC, et al. Detection of dentin sialoprotein in rat periodontium.Eur J Oral Sci, 2004, 112(2): 163–170.DOI:10.1111/eos.2004.112.issue-2(in Chinese). |
| [9] | Gibson MP, Jani P, Liu Y, et al. Failure to process dentin sialophosphoprotein into fragments leads to periodontal defects in mice.Eur J Oral Sci, 2013, 121(6): 545–550.DOI:10.1111/eos.2013.121.issue-6(in Chinese). |
| [10] | Alvares K, Kanwar YS, Veis A. Expression and potential role of dentin phosphophoryn (DPP) in mouse embryonic tissues involved in epithelial-mesenchymal interactions and branching morphogenesis.Dev Dyn, 2006, 235(11): 2980–2990.DOI:10.1002/(ISSN)1097-0177(in Chinese). |
| [11] | Huang YD, Yang Y, Jiang MQ, et al. Immortalization and characterization of human dental mesenchymal cells.J Dent, 2015, 43(5): 576–582.DOI:10.1016/j.jdent.2015.02.008(in Chinese). |
| [12] | Huang YD, Zhen RN, Jiang MQ, et al. Development of all-in-one multicistronic Tet-On lentiviral vectors for inducible co-expression of two transgenes.Biotechnol Appl Biochem, 2015, 62(1): 48–54.DOI:10.1002/bab.1239(in Chinese). |
| [13] | Loughna P, Chitty L, Evans T, et al. Fetal size and dating: charts recommended for clinical obstetric practice.Ultrasound, 2009, 17(3): 160–166.DOI:10.1179/174313409X448543(in Chinese). |
| [14] | Thesleff I. Genetic basis of tooth development and dental defects.Acta Odontol Scand, 2000, 58(5): 191–194.DOI:10.1080/000163500750051728(in Chinese). |
| [15] | Godovikova V, Li XR, Saunders TL, et al. A rat 8 kb dentin sialoprotein-phosphophoryn (DSP-PP) promoter directs spatial and temporal LacZ activity in mouse tissues.Dev Biol, 2006, 289(2): 507–516.DOI:10.1016/j.ydbio.2005.10.002(in Chinese). |
| [16] | Iohara K, Nakashima M, Ito M, et al. Dentin regeneration by dental pulp stem cell therapy with recombinant human bone morphogenetic protein 2.J Dent Res, 2004, 83(8): 590–595.DOI:10.1177/154405910408300802(in Chinese). |
| [17] | He HX, Yu JH, Liu Y, et al. Effects of FGF2 and TGFβ1 on the differentiation of human dental pulp stem cells in vitro.Cell Biol Int, 2008, 32(7): 827–834.DOI:10.1016/j.cellbi.2008.03.013(in Chinese). |
| [18] | Yu JH, Deng ZH, Shi JN, et al. Differentiation of dental pulp stem cells into regular-shaped dentin-pulp complex induced by tooth germ cell conditioned medium.Tissue Eng, 2006, 12(11): 3097–3105.DOI:10.1089/ten.2006.12.3097(in Chinese). |
| [19] | Lee JH, Lee DS, Choung HW, et al. Odontogenic differentiation of human dental pulp stem cells induced by preameloblast-derived factors.Biomaterials, 2011, 32(36): 9696–9706.DOI:10.1016/j.biomaterials.2011.09.007(in Chinese). |
| [20] | Alliot-Licht B, Bluteau G, Magne D, et al. Dexamethasone stimulates differentiation of odontoblast-like cells in human dental pulp cultures.Cell Tissue Res, 2005, 321(3): 391–400.DOI:10.1007/s00441-005-1115-7(in Chinese). |
| [21] | Wang J, Liu XH, Jin XB, et al. The odontogenic differentiation of human dental pulp stem cells on nanofibrous poly (L-lactic acid) scaffolds in vitro and in vivo.Acta Biomater, 2010, 6(10): 3856–3863.DOI:10.1016/j.actbio.2010.04.009(in Chinese). |
| [22] | Yang GB, Li XY, Yuan GH, et al. Immortalization and characterization of human dental papilla cells with odontoblastic differentiation.Int Endod J, 2013, 46(6): 565–572.DOI:10.1111/iej.2013.46.issue-6(in Chinese). |
| [23] | Chen S, Unterbrink A, Kadapakkam S, et al. Regulation of the cell type-specific dentin sialophosphoprotein gene expression in mouse odontoblasts by a novel transcription repressor and an activator CCAAT-binding factor.J Biol Chem, 2004, 279(40): 42182–42191.DOI:10.1074/jbc.M402476200(in Chinese). |
| [24] | Chen S, Gluhak-Heinrich J, Martinez M, et al. Bone morphogenetic protein 2 mediates dentin sialophosphoprotein expression and odontoblast differentiation via NF-Y signaling.J Biol Chem, 2008, 283(28): 19359–19370.DOI:10.1074/jbc.M709492200(in Chinese). |
| [25] | Satokata I, Maas R. Msx1 deficient mice exhibit cleft palate and abnormalities of craniofacial and tooth development.Nat Genet, 1994, 6(4): 348–356.DOI:10.1038/ng0494-348(in Chinese). |
| [26] | Chen S, Rani S, Wu YM, et al. Differential regulation of dentin sialophosphoprotein expression by Runx2 during odontoblast cytodifferentiation.J Biol Chem, 2005, 280(33): 29717–29727.DOI:10.1074/jbc.M502929200(in Chinese). |
| [27] | West DB, Pasumarthi RK, Baridon B, et al. A lacZ reporter gene expression atlas for 313 adult KOMP mutant mouse lines.Genome Res, 2015, 25(4): 598–607.DOI:10.1101/gr.184184.114(in Chinese). |
| [28] | Yao WJ, Chu X, Sung LA. Cell type-restricted expression of erythrocyte tropomodulin Isoform41 in exon 1 knockout/LacZ knock-in heterozygous mice.Gene Expr Patterns, 2015, 17(1): 45–55(in Chinese). |
