

1 西南大学 家蚕基因组生物学国家重点实验室,重庆 400716
2 湖北文理学院 医学院,湖北 襄阳 441053
网络出版时间:2015-03-07
基金项目:国家重点基础研究发展计划 (973 计划) (No. 2012CB114602);国家自然科学基金 (Nos. 31071136, 31571334),重庆市基础与前沿研究计划 (No. cstc2014jcyjA00025) 资助
摘要: 异时性基因调控细胞增殖和个体发育阶段的转换。家蚕异时性基因在家蚕变态发育过程中也很可能具有重要的调控作用,但它们的表达模式、生物学功能以及与microRNA之间的关系却鲜有报道。本研究首先利用果蝇同源基因lin-41搜索家蚕基因组数据库中相似序列,设计引物扩增Bmlin-41的编码序列,克隆了家蚕Bmlin-41基因CDS,其长度为2 166 bp,编码721个氨基酸,含有B-box和NHL结构域;随后,利用RT-PCR、qPCR技术并结合已有的家蚕全基因组芯片数据研究了Bmlin-41在家蚕中的时空表达模式,发现Bmlin-41在从家蚕胚胎到成虫的发育过程中呈逐渐递增的表达趋势,在五龄3 d不同组织中,于卵巢里表达量最高,精巢和中肠次之,而其余组织中低量表达或不表达;最后,利用3′RACE克隆了Bmlin-41基因的3′UTR,全长 1 434 bp,用在线软件RNAhybrid预测发现Bmlin-41的3′UTR上存在bmo-let-7靶位点,构建了含Bmlin-41 3′UTR的双荧光素酶报告基因载体,在S2细胞上共转染Bmlin-41 3′UTR和bmo-let-7的模拟物 (Mimics) 和拮抗剂 (Antagomir),bmo-let-7 mimics显著下调Bmlin-41,bmo-let-7 antagomir显著上调Bmlin-41,证实了Bmlin-41是bmo-let-7的靶基因。以上研究结果为深入研究let-7 miRNA和Bmlin-41的功能,揭示Bmlin-41和bmo-let-7在家蚕变态发育过程中的调控关系提供了新的线索。
关键词: 家蚕 异时性基因 家蚕let-7 miRNA Bmlin-41 表达模式 靶基因
Cloning and expression profile of Bmlin-41 and its regulation by the silkworm microRNA let-7
Lanting Zhou1,2, Ting Zhou1, Junling Gao1, Wei Wang1, Xiaoyan Wu1, Yaxi Huang1, Qingyou Xia1, and Shiping Liu1


1 State Key Laboratory of Silkworm Genome Biology, Southwest University, Chongqing 400716, China;
2 Medical College, Hubei University of Arts and Science, Xiangyang 441053, Hubei, China
Received: October 15, 2015; Accepted: October 15, 2015
Supported by:National Basic Research Program of China (973 Program) (No. 2012CB114602); National Natural Science Foundation of China (Nos. 31071136, 31571334), Fundamental and Advanced Research Projects of Chongqing (No. cstc2014jcyjA00025)
Corresponding authors:Shiping Liu. Tel: +86-23-68251569; E-mail: lsp98668@163.com
Abstract: The heterochronic genes regulate cell proliferation and switch development stage transitions. Heterochronic genes might also play important roles in regulating the development of silkworm, but very few of their expression profiles, functions and their relationship with microRNAs are available so far. Firstly, in this work, the primers for cloning Bmlin-41 were designed based on the homologous sequence of known Drosophila melanogaster lin-41, which was used as the query to blast against SilkDB. The obtained full CDS (2 166 bp) of Bmlin-41 encodes 721 amino acids and contains B-box and NHL domains. Then, the spatiotemporal expression patterns of Bmlin-41 were characterized by RT-PCR, quantitative real time PCR as well as our lab’s previous silkworm genome microarray data. Bmlin-41 was increasingly expressed from embryonic to adult stage. In diverse tissues of day-3 fifth instar, Bmlin-41 showed the highest accumulation in ovary, secondly in testis and midgut, but very low expression was observed in other tissues. Finally, 3′UTR of Bmlin-41 1 434 bp was cloned by rapid-amplification of cDNA ends (3'RACE) and was predicted to bare two binding sites of bmo-let-7 by using online RNAhybrid. To verify the binding effect, 3′UTR was cloned into psi-CHECK-2 vector and submitted to dual luciferase assay in the S2 cells in vitro. The dual luciferase assay demonstrated that Bmlin-41 was down-regulated by bmo-let-7 mimics and upregulated by bmo-let-7 antagomir, thus confirming the Bmlin-41 is negatively regulated by bmo-let-7. Our work might help further study on the roles of Bmlin-41 and bmo-let-7 and their regulation relationship involved in controlling metamorphosis of silkworm.
Key words: silkworm (Bombyx mori) heterochronic gene bmo-let-7 miRNA Bmlin-41 expression profile target gene
生长和发育具有严格的时序性,时序性发育是由异时性基因 (Heterochronic gene) 调控的细胞有序增殖和分化的结果[1]。异时性基因lin-4、lin-14、lin-28、lin-42和lin-29共同调控线虫不同发育阶段特定细胞的分裂和分化,以控制线虫的正常发育[2-6]。异时性基因lin-41在线虫幼龄末期下调表达,受其负调控的成虫特异转录因子lin-29上调表达,促使幼虫向成虫转化[7]。当lin-41缺失突变时,幼虫期缩短,成虫表型提前出现,而当lin-41过表达时,幼虫期延长[7]。LIN-41蛋白属于TRIM-NHL家族,通常含有由RING 锌指结构、B-BOX 基序、卷曲螺旋结构 (Coiled-coil) 组成的TRIM基序和NHL结构域,RING 锌指结构具有泛素化连接酶的活性,B-BOX是一种锌指结构,具有结合DNA、RNA和蛋白质的能力,NHL形成β螺旋结构域,可与蛋白质和RNA相结合,不同结构域使lin-41的功能多样化[8-9]。lin-41在生物体内有多种生物学功能,如促进细胞增殖和抑制细胞分化,是细胞全能性和自我更新的调控因子[10,11,12,13,14]。
MicroRNA (MiRNA) 是一类长约22 nt的非编码RNA,以互补配对方式和靶基因的3′UTR结合诱导沉默复合体 (RNA-induced silencing complex,RISC),清除靶基因mRNA或抑制靶基因mRNA的翻译,参与调节新陈代谢、信号传导、细胞增殖、细胞凋亡和细胞分化等各项生命活动[15]。lin-4是第一个被发现的时序性小分子RNA (Small temporal RNA,stRNA) 和miRNA奠基成员[16],是异时性基因lin-14的负调控子[17],通过与lin-14 的3′UTR 上7个反向互补位点相结合来实现调控作用[18]。let-7是第二个小分子时序RNA和奠基性miRNA[19,20],通过与靶基因lin-14、lin-28、lin-41、lin-42和 daf-12的3′UTR反向互补结合来调控线虫晚期幼虫和成虫的发育[7,19,21]。let-7和lin-41在不同物种间具有高度保守性,它们之间的调控关系也存在于果蝇[10]和高等动物中[11-12,22-23]。let-7与细胞增殖、组织形成、器官分化以及细胞凋亡等有关[24,25,26],还抑制某些肿瘤细胞的生长[27-30]。
家蚕let-7在三龄前期低量表达或不表达,三龄晚期开始高量表达[31],调控家蚕从幼虫到成虫的发育[32]。然而,家蚕let-7是否调节Bmlin-41以及它们如何控制家蚕变态发育一直未见报道。本研究克隆了家蚕lin-41基因的编码区序列,通过3′RACE技术获得其全长3′UTR,利用共转染和双荧光素酶报告基因载体系统在果蝇细胞S2中证明了bmo-let-7负调控Bmlin-41,为深入研究家蚕变态发育的分子调控机理奠定了基础。
1 材料与方法1.1 材料家蚕品种为华系二化性大造品种,由家蚕基因组生物学国家重点实验室提供。家蚕幼虫是在25 ℃的人工气候箱中用桑叶饲养。
1.2 主要试剂pEASY-T1和pEASY-T5载体购于北京全式金生物技术 (TransGen Biotech) 有限公司。Trizol购于Invitrogen公司。限制性内切酶PstⅠ、XhoⅠ、NotⅠ和Taq DNA聚合酶以及3′-Full RACE Core Set Ver.2.0试剂盒和实时荧光定量相关试剂均购于TaKaRa公司。细胞转染试剂 (X-tremeGENE HP DNA Transfection Reagent) 购于Roche公司。超纯质粒提取试剂盒购于Qiagen公司。RNase抑制剂、M-MLV反转录试剂盒、双荧光素酶报告基因载体psi-CHECKTM- 2 Vector和双荧光素酶报告基因检测试剂盒 (Dual-Glo?Luciferase Assay System) 均购于Promega公司。bmo-let-7模拟物 (Mimic)、模拟物阴性对照 (Negative control mimic) 和bmo-let-7拮抗剂 (Antagomir) 购于Dharmacon公司。果蝇S2细胞和相关细胞培养基购自Life Technologies公司。优质胎牛血清 (Fetal Bocine Serum,FBS) 购自PAA公司。
1.3 引物设计与合成用软件primer premier 5.0设计引物。所有引物均由上海生工生物工程技术服务有限公司合成。
1.4 Bmlin-41基因的克隆和序列分析1.4.1 Bmlin-41基因的克隆从NCBI (http://www.ncbi.nlm.nih.gov) 下载果蝇LIN-41的蛋白质序列作为源序列,在家蚕基因组数据库SilkDB (http://silkworm. genomics.org.cn/) 进行Blast比对。在该基因编码区 (Coding sequence,CDS) 设计正向和反向引物,上下游引物分别位于起始密码子ATG后和终止密码子TAA附近。PCR反应按以下程序进行:94 ℃预变性3 min,然后94 ℃变性 30 s、54 ℃退火30 s、72 ℃延伸1 min,共35个循环,再72 ℃终延伸10 min。将得到的PCR产物连接到pEASY-T5载体,经PCR和双酶切 (PstⅠ与NotⅠ) 筛选阳性克隆,送上海生工生物工程技术服务有限公司测序验证。
1.4.2 总RNA提取和实时定量PCR检测分别取家蚕发育周期的个体材料 (包括胚胎6 d、四眠、五龄3 d、预蛹、刚化的蛹和刚的化蛾)、家蚕幼虫阶段13个时间点材料 (一龄初、一眠初、一眠末、二龄初、二眠初、二眠末、三龄初、三眠初、三眠末、四龄初、四眠初、四眠末、五龄3 d) 和五龄3 d的组织材料 (头、体壁、丝腺、中肠、脂肪体、精巢、卵巢、血液、马氏管)。使用Trizol试剂参照文献中的方法提取和纯化总RNA[33],用M-MLV合成cDNA。根据Bmlin-41基因的CDS序列设计实时定量PCR引物Q-Bmlin-41-F和Q-Bmlin-41-R (表 1),用家蚕真核翻译起始因子eIF-4A作为内参基因,其引物为Q-sw22934-F和Q-sw22934-R (表 1)。在ABI 7500 fast real-time PCR仪上采用两步法标准程序进行定量PCR检测,反应程序如下:95 ℃预变性30 s,然后95 ℃变性30 s,60 ℃退火30 s,40个循环,进入溶解曲线阶段。
表1 本研究所使用的引物Table1 Primers used in this study
| Primer name | Primer sequence (5′-3′) |
| Bmlin-41-ORF-F | ATGACAACACTGGCAAAA |
| Bmlin-41-ORF-R | TCAGTTCAGATGTGACACTAG |
| Bmlin-41-probe-F | TTTTATTGCGAGGCTTGTAT |
| Bmlin-41-probe-R | TTCTATTCCGTCAGAGTCCAT |
| Actin3-F | AACACCCCGTCCTGCTCACTG |
| Actin3-R | GGGCGAGACGTGTGATTTCCT |
| Q-sw22934-F | TTCGTACTGGCTCTTCTCGT |
| Q-sw22934-R | CAAAGTTGATAGCAATTCCCT |
| Q-Bmlin-41-F | TCACCAAATCTCGCCTATCG |
| Q-Bmlin-41-R | TAAAACCTGACCGGGTCTCC |
| Bmlin-41-3′UTR-F | CCGCTCGAGGGATTTTGTGGGCCGTGG |
| Bmlin-41-3′UTR-R | ATTTGCGGCCGCGGCATACCAACGCCTAGAAC |
| Bmlin-41-outer | CAGATATTCAATAGCCGTGGCG |
| Bmlin-41-inner | TAATGGTGGACCCGACCCTGACG |
| 3′RACE Outer Primer | TACCGTCGTTCCACTAGTGATTT |
| 3′RACE Inner Primer | CGCGGATCCTCCACTAGTGATTTCACTATAGG |
| The underlined are restriction endonuclease recognition sites. | |
表选项
1.4.3 Bmlin-41基因的序列分析和LIN-41蛋白系统进化树构建在ExPaSy (http://www.expasy.org/tools/) 网站进行Bmlin-41基因氨基酸序列的翻译。使用Sim4在线程序 (http://pbil.univ-lyon1.fr/sim4. php) 与家蚕基因组序列比对鉴定所克隆基因的内含子和外显子结构。使用SMART程序 (http://smart.embl-heidelberg.de/) 预测蛋白质结构域。通过NCBI的Blast程序进行搜索,下载LIN-41同源体序列,使用Clustalx1.83[34]软件进行比对,用MEGA 6.0[35]构建系统进化树。
1.5 Bmlin-41基因在家蚕中的时空表达模式下载家蚕全基因组的组织表达芯片数据[36],根据芯片中所检测的基因序列查找到Bmlin-41
的芯片数据,分析Bmlin-41 的组织表达谱。利用RT-PCR和实时定量PCR方法,研究Bmlin-41在家蚕不同发育阶段和五龄3 d不同组织中的表达模式。
1.6 Bmlin41基因3′UTR的克隆和bmo-let-7靶位点预测以3 μg 五龄3 d卵巢的RNA为模板,利用3′-Full RACE Core Set Ver.2.0试剂盒进行反转录合成cDNA。在CDS区域的终止密码子上游600 bp和164 bp处分别设计Bmlin-41-outer和Bmlin-41-inner引物,进行套式PCR扩增。outer反应程序:94 ℃预变性3 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸 1 min 30 s,20个循环;72 ℃终延伸10 min。取1 μL outer反应液为模板,利用引物Bmlin-41-inner和3′RACE Inner Primer进行inner反应:94 ℃预变性 3 min;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸1 min 30 s,30个循环;72 ℃,10 min。胶回收主带与pEASY-T1连接得到pEASY-T1 [Bmlin41-3′RACE]载体,转化、筛选阳性克隆,送生工生物公司测序验证。
从miRBase[37] (http://www.mirbase.org/) 下载bmo-let-7-5p的成熟体序列UGAGGUAGUA GGUUGUAUAGU,用在线软件RNAhybrid[38] (http://bibiserv.techfak.uni-bielefeld.de/rnahybrid/) 预测Bmlin-41 3′UTR上bmo-let-7的结合位点。
1.7 Bmlin-41基因3′UTR双荧光素酶报告基因载体构建和共转染实验在Bmlin-41基因3′UTR起始碱基设计上游引物 (加XhoⅠ酶切位点,见表 1下划线),在poly A前设计下游引物 (加NotⅠ酶切位点,见表 1下划线),以测序正确的pEASY-T1[Bmlin41- 3′RACE]载体质粒为模板,扩增3′UTR亚克隆片段,反应条件为:94 ℃预变性3 min;94 ℃变性30 s,68 ℃退火30 s,72 ℃延伸1 min 30 s,30个循环;72 ℃终延伸10 min。切胶回收后连接得到pEASY-T1[Bmlin41-3′UTR]载体。测序正确后,用XhoⅠ和NotⅠ分别酶切pEASY-T1 [Bmlin41-3′UTR]载体和psi-CHECK-2载体,胶回收后,顺次进行连接、转化、挑斑和测序验证,得到Bmlin-41基因3′UTR的双荧光素酶报告基因载体psi[Bmlin41-3′UTR]。
提取psi[Bmlin41-3′UTR]载体的超纯质粒,将果蝇S2细胞接种到24孔板,待细胞长至80%时,利用转染试剂X-tremeGENE,把1 μg Bmlin-41基因3′UTR报告基因载体psi-CHECK- 2[Bmlin41-3′UTR]质粒分别与bmo-let-7 模拟物 (Mimics)、拮抗剂 (Antagomir) 和对照进行共转染。设计4组实验,分别为psi[Bmlin41-3′UTR]组、psi[Bmlin41-3′UTR]+ negative control mimics (终浓度50 μmol/L) 组、psi[Bmlin41-3′UTR]+bmo-let-7 mimics (终浓度50 μmol/L) 组、psi[Bmlin41-3′UTR]+bmo-let-7 antagomir (终浓度250 μmol/L) 组,各设3个生物学重复。48 h后,收集细胞,加入适量PBS,按照Dual-Glo?Luciferase Assay System试剂盒说明书,加入荧光素酶试剂底物,10 min后,测定萤火虫荧光值,加入终止液,10 min后,测定海肾荧光值。
1.8 数据统计和分析双荧光素酶活性以海肾荧光值/萤火虫荧光值作比较,均一化后,应用GraphPad prism 5.0.软件进行统计分析,数据以平均值+标准误 (x±s) 表示,采用Unpaired t检验进行差异显著性分析,双尾检验 (Two-tailed) P<0.05表示显著性差异,P<0.01表示极显著性差异。
2 结果与分析2.1 Bmlin-41基因的克隆和序列分析在家蚕基因组数据库中,利用果蝇的LIN-41氨基酸序列 (GenBank登录号AAM68901.1) 进行Blast比对,检索到一条编号为BGIBMGA002757的同源基因,将之命名为Bmlin-41。以家蚕五龄3 d卵巢的cDNA为模板,用引物Bmlin-41-F和Bmlin-41-R进行PCR扩增,得到1条约2 000 bp的目的片段 (图 1A)。用PstⅠ和NotⅠ双酶切及质粒PCR鉴定阳性克隆,酶切片段与PCR扩增片段大小一致,初步说明该质粒是重组质粒 (图 1B)。测序验证后,发现该基因序列长2 166 bp,与BGIBMGA002757基因序列一致。
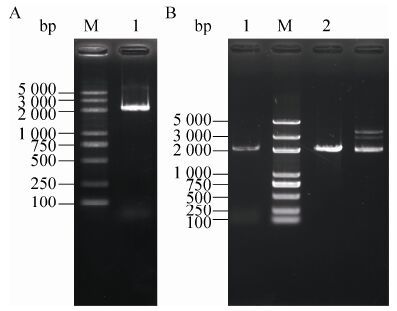 |
| 图1 Bmlin-41基因CDS的克隆 Figure1 Cloning of Bmlin-41 coding sequence. (A) PCR product of Bmlin-41 CDS. M: DNA marker; 1: PCR product. (B) PCR and restriction digestion of positive plasmid. M: DNA marker; 1: PCR of positive plasmid; 2: recovered fragments of Bmlin-41 CDS; 3: double restriction digestion of positive plasmid by PstⅠ and NotⅠ. |
| 图选项 |
Bmlin-41基因位于家蚕nscaf2564上,单外显子,预测其编码721个氨基酸,用在线SMART程序对家蚕Bombyx mori的LIN-41蛋白进行结构域分析,并与其他几个物种包括智人Homo sapiens、小家鼠Mus Musculus、斑马鱼Danio rerio、秀丽隐杆线虫Caenorhabditis elegans、黑腹果蝇 Drosophila melanogaster) 的LIN-41结构域进行比较 (图 2)。BmLIN-41蛋白结构具有TRIM-NHL家族的典型锌指结构域B-BOX、卷曲螺旋结构域 (B-Box C-terminal domain) BBC和能够形成β螺旋结构域的NHL。
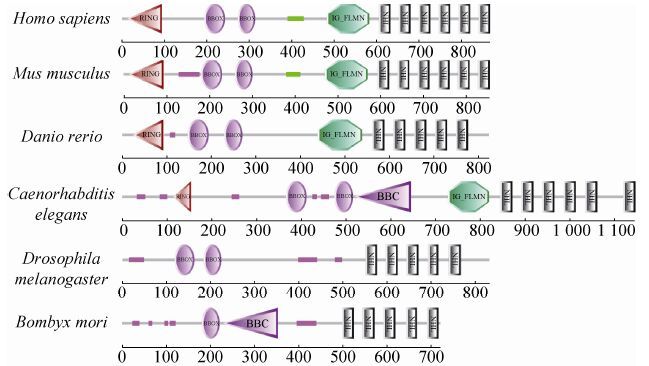 |
| 图2 LIN-41蛋白结构域预测 Figure2 Predicted domains of LIN-41. All domains were predicted by SMART online at http://smart.embl-heidelberg. de/smart[39]. RING: Ring finger; IG_FLMN: Filamin-type immunoglobulin domains; BBOX: B-box-type zinc finger domains; BBC: B-Box C-terminal domain; The NHL repeat: named after NCL-1,HT2A and Lin-41,is found largely in a large number of eukaryotic and prokaryotic proteins. |
| 图选项 |
用Bmlin-41的蛋白质氨基酸序列在NCBI上Blast搜索,发现家蚕Bmlin-41与鳞翅目Lepidoptera的小菜蛾Plutella xylostella和黑脉金斑蝶Danaus plexippus的很相似,分别有87%和84%的一致性,其次和双翅目Diptera的中华按蚊Anopheles sinensis和Drosophila致倦库蚊Culex quinquefasciatus的相似度分别为63%和45%,与线虫Caenorhabditis elegans、斑马鱼Danio rerio、和哺乳动物的相似性都低于40%。用MEGA 6.0构建系统发育树 (图 3)。由系统树可见,不同科和目的动物分别聚在一起。蚊科Culicidae的5种昆虫聚在一个进化枝上,果蝇科Drosophilidae的12种果蝇聚在一起,与家蝇科Muscidae中的家蝇Musca domestica L.明显分开,蚊科、果蝇科和家蝇科的昆虫又聚在上一级的双翅目上。家蚕和同为鳞翅目的黑脉金斑蝶与小菜蛾进化距离最近,它们聚在一个分类枝上,与双翅目的蚊子和果蝇分开。膜翅目中,蜜蜂科Apoidea的小蜜蜂Apis florea和大蜜蜂Apis dorsata聚在一个小分支上,熊蜂科Bombidae欧洲熊蜂Bombus terrestris和北美大黄蜂Bombus impatiens聚在另一个小分支上,蜜蜂科与熊蜂科聚在上一级的膜翅目中,膜翅目与脊椎动物之间的进化距离要比与系统树中其他目昆虫之间的进化距离近些。线虫纲Nematode中,蛔虫科Ascarididae的犬弓首蛔虫Toxocara canis和猪蛔虫Ascaris suum聚在一起,再与小杆科Rhabditidae的秀丽隐杆线虫Caenorhabditis elegans聚在高一级线虫动物门Nemathelminthes上,又与膜翅目昆虫和脊椎动物聚在更高一级进化支上。人科Hominidae、猩猩科Pongidae和猴科Cercopithecidae彼此分开又共同聚在上一级灵长目Primates上,与啮齿目 Rodentia的小家鼠Mus musculus聚在哺乳纲Mammalia上。鲤目Cyprinlformes鲤科 Cyprinidae中的斑马鱼Danio rerio、鸡形目Galliformes雉科Phasianidae中的原鸡Gallus gallus和哺乳动物Mammalia聚在脊椎动物门Vertebrata上。
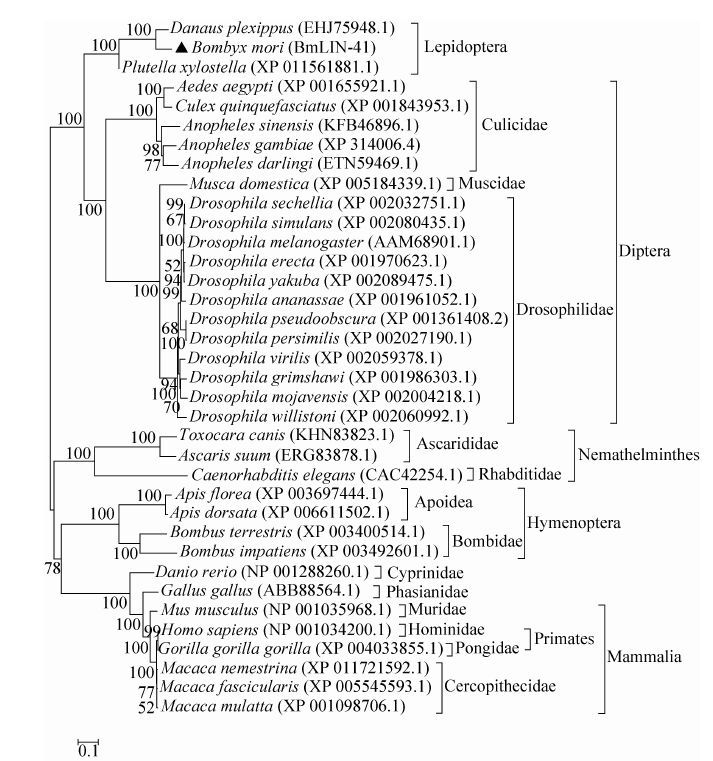 |
| 图3 LIN-41氨基酸序列系统进化树 Figure3 Phylogenetic tree of LIN-41 based on amino acid sequences. The phylogenetic tree was constructed with the MEGA 6.0 by the neighbor-joining (NJ) method with amino acid sequences of BmLIN-41and its homologues. The bootstrap method was used in this phylogeny test and poisson model was selected for the substitution model. |
| 图选项 |
2.2 家蚕Bmlin-41在家蚕中的时空表达模式RT-PCR结果显示Bmlin-41基因在家蚕一龄至五龄3 d都有表达,但不同时期之间的表达量差异很大,一龄和四龄分别比一眠和四眠表达量高,三眠初和四眠初分别比三眠末和四眠末表达量高,一眠初至二眠初都是低量表达,二眠末表达量明显升高 (图 4A)。定量PCR检测结果表明,Bmlin-41基因在家蚕胚胎、幼虫 (四龄和五龄3 d)、预蛹、蛹和成虫中呈上调表达,至蛾期时的表达量最高 (图 4B)。RT-PCR、芯片数据和定量PCR检测结果表明,Bmlin-41基因在家蚕五龄3 d的生殖腺中高量表达,丝腺中的表达量最低或无表达 (图 4C-E)。
 |
| 图4 家蚕Bmlin-41时空表达模式 Figure4 Spatiotemporal expression profiles of Bmlin-41. (A) Temporal expression patterns of Bmlin-41 by RT-PCR[40]. e-IL1: early 1st instar larva; e-ML1:early 1st molt larva; l-ML1: late 1st molt larva; e-IL2: early 2nd instar larva; e-ML2: early 2nd molt larva; l-ML2: late 2nd molt larva; e-IL3: early 3rd instar larva; e-ML3: early 3rd molt larva; l-ML3: late 3rd molt larva; e-IL4: early 4th instar larva; e-ML4: early 4th molt larva; l-ML4: late 4th molt larva. D3-IL5: 3rd day of fifth instar larva. (B) Temporal expression profile of Bmlin-41 by qPCR. D6-Em: 6th day of embryo; IL4: 4th instar larva; D3-IL5: 3rd day of fifth instar larva; Ppu: prepupa; Pu: pupa; Ad: adult moth. (C) Spatial expression profile of Bmlin-41 in day-3 fifth instar larvae by RT-PCR[40]. (D) Spatial expression profile of Bmlin-41 in fifth instar larvae based on microarray assay. The microarray data were downloaded from BmMDB(http://www.silkdb.org/microarray/)[36]. (E) Spatial expression profile of Bmlin-41 in day-3 fifth instar larvae by qPCR. HD: head; BW: body wall; SG: silk gland; A/MSG: anterior/middle silk gland; PSG: posterior silk gland; MG: midgut; FB: fat body; HC: hemocyte; MT: Malpighian tubule; OV: ovary; TE: testis. |
| 图选项 |
2.3 Bmlin-41基因3′UTR的克隆及bmo-let-7靶位点预测用五龄3 d卵巢的总RNA按3′RACE试剂盒操作进行反转录获得cDNA模板,使用引物Bmlin-41-outer和Bmlin-41-inner进行套式PCR扩增,inner反应得到一条将近1 700 bp的片段 (图 5A)。菌落PCR片段与套式PCR扩增片段大小一致 (图 5B),说明该菌落为阳性克隆。将此克隆进行测序验证后,去除引物和CDS序列,得到Bmlin-41的3′UTR,大小为1 434 bp。使用RNAhybrid在线预测,发现在Bmlin-41基因3′UTR上有两个bmo-let-7靶位点,分别位于3′UTR的780位 (T1) 和919位 (T2),靶位点的自由能mfe分别为-17.3 kcal/mol和-20.7 kcal/mol (图 6A)。这表明家蚕Bmlin-41基因可能是bmo-let-7的靶基因。
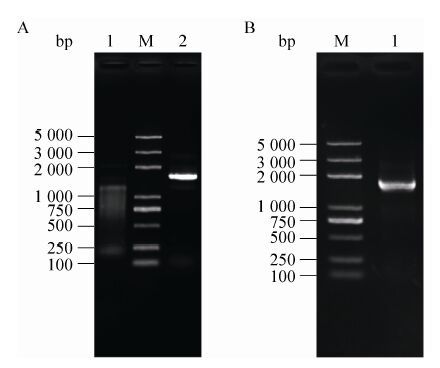 |
| 图5 家蚕Bmlin-41基因3′UTR克隆 Figure5 Cloning of Bmlin-41 3′UTR. (A) The 3’RACE of Bmlin-41 3′UTR. M: DNA marker; 1: cDNA by reverse transcription PCR; 2: product of inner PCR. (B) PCR validation of pEASY-T1 [Bmlin-41-3′UTR] plasmid. M: DNA marker; 1: PCR product of 3′UTR. |
| 图选项 |
2.4 Bmlin-41基因3′UTR的bmo-let-7靶位点的实验验证2.4.1 双荧光素酶报告基因载体构建为了在细胞水平验证Bmlin-41基因是否受bmo-let-7调控,在Bmlin-41基因的3′UTR两端设计引物 (加XhoⅠ/NotⅠ酶切位点) (表 1),将其亚克隆至双荧光素酶报告基因载体 (psi-CHECK-2) 的海肾荧光素酶基因 (Renilla luciferase gene) 后面,酶切验证阳性克隆 (图 6B),测序验证,得到psi-CHECK-2[Bmlin41- 3′UTR]载体。
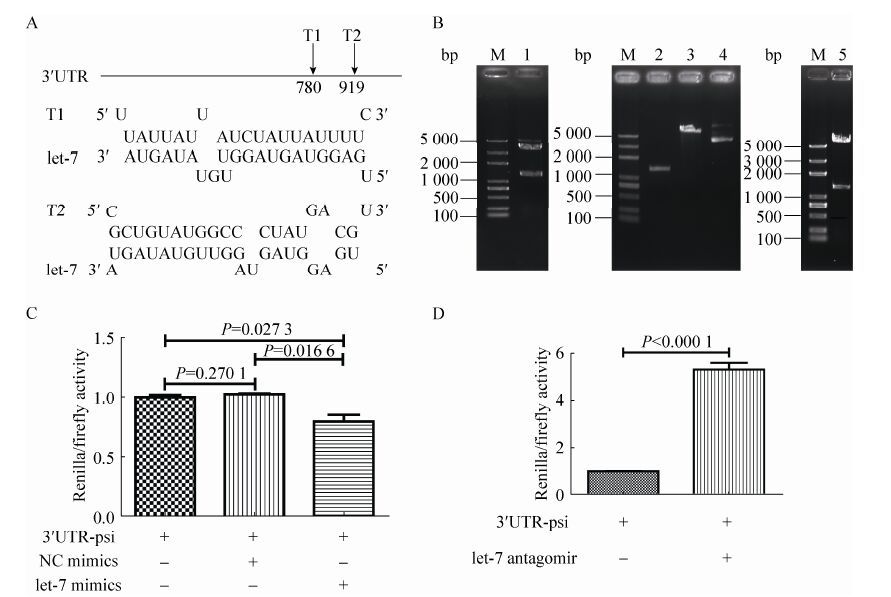 |
| 图6 家蚕Bmlin-41基因3′UTR上bmo-let-7靶位点的预测和细胞水平验证 Figure6 Target site prediction and experimental validation of bmo-let-7 within 3′UTR ofBmlin-41. (A) Target site prediction by online RNAhybrid. (B) Constructing dual luciferase reporter gene vector. M: DNA marker; 1: pEASY-T1[Bmlin-41-3′UTR] digested by PstⅠ and NotⅠ; 2: recovered fragments of 3′UTR; 3: the psi-CHECK-2 vector digested withPstⅠ and NotⅠ; 4: the empty psi-CHECK-2 vector; 5: digestion product of psi-CHECK-2[Bmlin-41-3′UTR] by PstⅠ and NotⅠ. (C) bmo-let-7 mimics down-regulates Bmlin-41. 3′UTR-psi: psi-CHECK-2[Bmlin-41-3′UTR] vector; NC mimics: negative control mimics; let-7 mimics: bmo-let-7-5p mimics. (D) Bmo-let-7 antagomir upregulates Bmlin-41. 3′UTR-psi: psi-CHECK-2[Bmlin-41-3′UTR] vector; let-7 antagomir: bmo-let-7-5p antagomir; error bars x±s . P<0.05 means significance,P<0.01 means extreme significance (student’s t test). |
| 图选项 |
2.4.2 双荧光素酶信号测定与分析共转染果蝇S2细胞系48 h后,测定各组荧光素酶活性并计算比值 (Renilla/Firefly)。与对照相比,当双荧光素酶报告基因载体和let-7 mimics共转染时,荧光素酶活性显著下降 (图 6C),说明let-7 mimic转染入S2细胞后与3′UTR结合,抑制了靶基因的转录,使海肾荧光素酶活性降低;当和bmo-let-7 antagomir共转染时,荧光素酶活性极显著上升 (图 6D),暗示let-7 antagomir转染S2细胞后,竞争性的抑制了内源性let-7,靶基因转录水平上升,海肾荧光素酶活性增加。这表明Bmlin-41基因是bmo-let-7的靶基因,受bmo-let-7负调控。
3 讨论Bmlin-41在家蚕幼虫阶段的不同龄期和眠期有不同的表达,在家蚕整个生命周期中呈上调趋势,成虫期的表达量最高 (图 4A,B),暗示它可能与家蚕的龄期转化和变态发育有关。芯片数据和定量PCR结果表明,Bmlin-41在卵巢和精巢中高量表达 (图 4D,E),推测其在生殖腺中具有重要功能,可能参与卵的形成与受精核的分裂和分化。芯片数据和定量PCR结果总体上看是基本一致的,但也存在不完全一致的情况。例如,在芯片数据中,Bmlin-41在中肠里低量表达,但定量PCR结果显示其在中肠里的表达量相对较高;两种实验结果都表明Bmlin-41在精巢和卵巢里高量表达,但在卵巢里的定量PCR结果重复性并不好。这些不一致可能与不同批次所取材料之间的细微差异有关,但也不能排除是由于实验中某些不确定因素所致,有待于以后进一步证实。
let-7是动物中最早发现的miRNA之一,在很多物种都含有let-7,具有高度的保守性[20]。let-7在幼虫晚期开始表达,成虫时表达量达高峰,控制线虫和果蝇晚期幼虫到成虫的变态转型[19,41]。bmo-let-7在家蚕胚胎阶段和一龄期间无表达,二龄幼虫期开始低量表达,三龄幼虫至成虫阶段表达量较高[31]。bmo-let-7和Bmlin-41在家蚕发育周期中总体上都呈上调趋势,但在某些发育阶段和组织中,let-7的表达变化与Bmlin-41明显相反。例如,let-7在四龄期的表达明显低于四眠[31],而Bmlin-41在四龄期间的表达却显著高于四眠 (图 4A),let-7在卵巢中的表达量低于精巢[31],但是Bmlin-41在卵巢中表达量却略高于精巢 (图 4C和4D),相反的表达关系暗示let-7可能在家蚕一些发育时期和特定组织中负调控Bmlin-41。然而,由于let-7与Bmlin-41在个体和器官水平的表达比较是基于不同批次的实验,它们之间的表达关系还有必要在后续的研究中进一步验证。
线虫lin-41基因的3′UTR上存在let-7的靶位点,把lin-41基因的3′UTR连接到Escherichia coli lacZ 报告基因后,lacZ 的活性被抑制,进一步证明了lin-41基因是let-7的靶基因[21]。在家蚕中,克隆Bmlin-41基因3′UTR序列,通过共转染和双荧光素酶报告基因系统,证明了Bmlin-41是bmo-let-7的靶基因 (图 5)。miRNA是通过识别与结合靶基因来实现其调控功能的,但截至目前,家蚕miRNA功能研究报道不多,一个重要原因是很少有靶基因被证实。我们前面用pGL3载体系统在家蚕胚胎细胞系BmE中证明了bmo-miR-7负调控靶基因Bmyan,为深入研究家蚕眼睛和脑的发育提供了一些依据[42]。在本研究中,我们用psi-CHECK-2载体系统在果蝇S2细胞系中证明了家蚕bmo-let-7 miRNA负调控靶基因Bmlin-41,将为深入研究家蚕发育变态的分子机理提供新的线索。然而,预测发现Bmlin-41的mRNA 3′UTR上有两个靶位点,它们是否都是bmo-let-7的有效结合位点?所以,为了深入研究bmo-let-7对其靶基因Bmlin-41的调控,还有必要通过靶位点突变实验对两个靶位点的结合效率进行比较。
4 结论本研究首次克隆和鉴定了家蚕Bmlin-41基因。它具有TRIM-NHL家族典型的B-Box、NHL结构域。Bmlin-41的时序表达模式具有明显的发育阶段特性,总体上是龄期高于眠期,眠初高于眠末,成虫期高于幼虫期;在五龄3 d的生殖腺中高量表达,其他组织中低量表达或不表达。通过3′RACE得到Bmlin-41基因3′UTR,预测Bmlin-41基因的3′UTR上存在bmo-let-7靶位点,用双荧光素酶报告基因系统,在细胞水平证明了Bmlin-41基因是bmo-let-7的靶基因,被bmo-let-7负调控。该研究为进一步研究家蚕let-7和Bmlin-41的功能以及家蚕变态发育的分子机理提供了一些参考。
参考文献
| [1] | Ambros V. A hierarchy of regulatory genes controls a larva-to-adult developmental switch in C.elegans. Cell, 1989, 57(1): 49–57(in Chinese). |
| [2] | Ambros V, Horvitz HR. Heterochronic mutants of the nematode Caenorhabditis elegans.Science, 1984, 226(4673): 409–416(in Chinese). |
| [3] | Ambros V, Horvitz HR. The lin-14 locus of Caenorhabditis elegans controls the time of expression of specific postembryonic developmental events.Genes Dev, 1987, 1(4): 398–414(in Chinese). |
| [4] | Ambros V, Moss EG. Heterochronic genes and the temporal control of C. elegans development.Trends Genet, 1994, 10(4): 123–127(in Chinese). |
| [5] | Slack F, Ruvkun G. Temporal pattern formation by heterochronic genes.Annu Rev Genet, 1997: 611–634(in Chinese). |
| [6] | Bettinger JC, Lee K, Rougvie AE. Stage-specific accumulation of the terminal differentiation factor LIN-29 during Caenorhabditis elegans development.Development, 1996, 122(8): 2517–2527(in Chinese). |
| [7] | Slack FJ, Basson M, Liu ZC, et al. The lin-41 RBCC gene acts in the C. elegans heterochronic pathway between the let-7 regulatory RNA and the LIN-29 transcription factor.Mol Cell, 2000, 54(4): 659–669(in Chinese). |
| [8] | Loedige I, Gaidatzis D, Sack R, et al. The mammalian TRIM-NHL protein TRIM71/LIN-41 is a repressor of mRNA function.Nucleic Acids Res, 2013, 41(1): 518–532(in Chinese). |
| [9] | Ecsedi M, Groβhans H. LIN-41/TRIM71: emancipation of a miRNA target.Genes Dev, 2013, 27(6): 581–589(in Chinese). |
| [10] | O'Farrell F, Esfahani SS, Engstrm Y, et al. Regulation of the Drosophila lin-41 homologue dappled by let-7 reveals conservation of a regulatory mechanism within the LIN-41 subclade.Dev Dyn, 2008, 237(1): 196–208(in Chinese). |
| [11] | Spike C. A. The TRIM-NHL protein LIN-41 and the OMA RNA-binding proteins antagonistically control the prophase-to-metaphase transition and growth of Caenorhabditis elegans oocytes.Genetics, 2014, 198(4): 1535–1558(in Chinese). |
| [12] | Rybak A, Fuchs H, Hadian K, et al. The let-7 target gene mouse lin-41 is a stem cell specific E3 ubiquitin ligase for the miRNA pathway protein Ago2.Nat Cell Biol, 2009, 11(12): 1411–1420(in Chinese). |
| [13] | Tocchini C, Keusch JJ, Miller SB, et al. The TRIM-NHL protein LIN-41 controls the onset of developmental plasticity in Caenorhabditis elegans.PLoS Genet, 2014, 10(8)(in Chinese). |
| [14] | Ecsedi M, Rausch M, Groβhans H. The let-7 microRNA directs vulval development through a single target.Dev Cell, 2015, 32(3): 335–344(in Chinese). |
| [15] | Bartel DP. MicroRNAs: genomics, biogenesis, mechanism, and function.Cell, 2004, 116(2): 281–297(in Chinese). |
| [16] | Lee RC, Feinbaum RL, Ambros V. The C. elegans heterochronic gene lin-4 encodes small RNAs with antisense complementarity to lin-14.Cell, 1993, 75(5): 843–854(in Chinese). |
| [17] | Arasu P, Wightman B, Ruvkun G. Temporal regulation of lin-14 by the antagonistic action of two other heterochronic genes, lin-4 and lin-28.Genes Dev, 1991, 5(10): 1825–1833(in Chinese). |
| [18] | Wightman B, Ha I, Ruvkun G. Posttranscriptional regulation of the heterochronic gene lin-14 by lin-4 mediates temporal pattern formation in C.elegans. Cell, 1993, 75(5): 855–862(in Chinese). |
| [19] | Reinhart BJ, Slack FJ, Basson M, et al. The 21-nucleotide let-7 RNA regulates developmental timing in Caenorhabditis elegans.Nature, 2000, 403(6772): 901–906(in Chinese). |
| [20] | Pasquinelli AE, Reinhart BJ, Slack F, et al. Conservation of the sequence and temporal expression of let-7 heterochronic regulatory RNA.Nature, 2000, 408(6808): 86–89(in Chinese). |
| [21] | Vella MC, Choi EY, Lin SY, et al. The C. elegans microRNA let-7 binds to imperfect let-7 complementary sites from the lin-41 3'UTR.Genes Dev, 2004, 18(2): 132–137(in Chinese). |
| [22] | Kloosterman WP, Wienholds E, Ketting RF, et al. Substrate requirements for let-7 function in the developing zebrafish embryo.Nucleic Acids Res, 2004, 32(21): 6284–6291(in Chinese). |
| [23] | Kanamoto T, Terada K, Yoshikawa H, et al. Cloning and regulation of the vertebrate homologue of lin-41 that functions as a heterochronic gene in Caenorhabditis elegans.Dev Dyn, 2006, 235(4): 1142–1149(in Chinese). |
| [24] | Abbott AL, Alvarez-Saavedra E, Miska EA, et al. The let-7 MicroRNA family members mir-48, mir-84, and mir-241 function together to regulate developmental timing in Caenorhabditis elegans.Dev Cell, 2005, 9(3): 403–414(in Chinese). |
| [25] | Esquela-Kerscher A, Johnson SM, Bai L, et al. Post-embryonic expression of C. elegans microRNAs belonging to the lin-4 and let-7 families in the hypodermis and the reproductive system.Dev Dyn, 2005, 234(4): 868–877(in Chinese). |
| [26] | Groβhans H, Johnson T, Reinert KL, et al. The temporal patterning microRNA let-7 regulates several transcription factors at the larval to adult transition in C. elegans.Dev Cell, 2005, 8(3): 321–330(in Chinese). |
| [27] | Alvarez-Garcia I, Miska EA. MicroRNA functions in animal development and human disease.Development, 2005, 132(21): 4653–4662(in Chinese). |
| [28] | Ambros V. The functions of animal microRNAs.Nature, 2004, 431(7006): 350–355(in Chinese). |
| [29] | Lujambio A, Ropero S, Ballestar E, et al. Genetic unmasking of an epigenetically silenced microRNA in human cancer cells.Cancer Res, 2007, 67(4): 1424–1429(in Chinese). |
| [30] | Brueckner B, Stresemann C, Kuner R, et al. The human let-7a-3 locus contains an epigenetically regulated microRNA gene with oncogenic function.Cancer Res, 2007, 67(4): 1419–1423(in Chinese). |
| [31] | Liu SP, Xia QY, Zhao P, et al. Characterization and expression patterns of let-7 microRNA in the silkworm (Bombyx mori).BMC Dev Biol, 2007, 7(1): 88(in Chinese). |
| [32] | Ling L, Ge X, Li ZQ, et al. MicroRNA Let-7 regulates molting and metamorphosis in the silkworm, Bombyx mori.Insect Biochem Mol Biol, 2014: 13–21(in Chinese). |
| [33] | Liu SP, Xia QY. Protocol of Northern blotting hybridization for microRNA detection of silkworm (Bombyx mori).Sci Sericul, 2014, 40(4): 724–729(in Chinese). 刘仕平, 夏庆友. Northern杂交检测家蚕microRNA 的技术流程.蚕业科学,2014,40(4):724–729. |
| [34] | Higgins DG, Thompson JD, Gibson TJ. Using CLUSTAL for multiple sequence alignments.Methods Enzymol, 1996: 383–402(in Chinese). |
| [35] | Tamura K, Stecher G, Peterson D, et al. MEGA 6.0: molecular evolutionary genetics analysis version 6.0.Mol Biol Evol, 2013, 30(12): 2725–2729(in Chinese). |
| [36] | Xia QY, Cheng DJ, Duan J, et al. Microarray-based gene expression profiles in multiple tissues of the domesticated silkworm, Bombyx mori.Genome Biol, 2007, 8(8): R162(in Chinese). |
| [37] | Kozomara A, Griffiths-Jones S. miRBase: annotating high confidence microRNAs using deep sequencing data.Nucleic Acids Res, 2014: D68–D73(in Chinese). |
| [38] | Rehmsmeier M, Steffen P, Hchsmann M, et al. Fast and effective prediction of microRNA/target duplexes.RNA, 2004, 10(10): 1507–1517(in Chinese). |
| [39] | Letunic I, Doerks T, Bork P. SMART: recent updates, new developments and status in 2015.Nucleic Acids Res, 2015: D257–D260(in Chinese). |
| [40] | Zhou T. Cloning of let-7 target genes and inducing of ecdysone on bmo-let-7 miRNA in silkworm cell lines[D]. Chongqing: Southwest University, 2009 (in Chinese). 周挺. 家蚕let-7 miRNA的靶基因克隆和激素诱导[D]. 重庆: 西南大学, 2009. |
| [41] | Sempere LF, Dubrovsky EB, Dubrovskaya VA, et al. The expression of the let-7 small regulatory RNA is controlled by ecdysone during metamorphosis in Drosophila melanogaster.Dev Biol, 2002, 244(1): 170–179(in Chinese). |
| [42] | Liu SP, Huang YX, Yin JY, et al. Cloning and expression profile of Bmyan in the silkworm (Bombyx mori) and experimental validation as one target of microRNA 7.Chin J Biotech, 2015, 31(11): 1612–1622(in Chinese). 刘仕平, 黄亚玺, 尹纪云, 等. 家蚕Bmyan基因的克隆表达和作为microRNA 7靶基因的验证.生物工程学报,2015,31(11):1612–1622. |
