

1 浙江海正药业股份有限公司,浙江 台州 318000
2 浙江工业大学 生物工程研究所,浙江 杭州 310032
网络出版时间:2015-12-29
摘要: 辛伐他汀是重要的降胆固醇处方药物。莫那可林J是辛伐他汀合成过程的关键中间体,也是洛伐他汀生物合成的中间产物。为获得莫那可林J并通过一步法发酵生成辛伐他汀,构建了洛伐他汀生物合成关键基因lovF基因的RNAi载体pMHJ137,通过农杆菌介导的方法转化土曲霉F001,筛选整合到染色体的阳性菌,并在阳性菌株MJ1-24的发酵过程中加入了DMB-S-MMP验证其直接合成辛伐他汀的效率。结果显示MJ1-24不再产生洛伐他汀,产物中仅有莫那可林J累积。如果在发酵过程中加入前体物质,可得到产物辛伐他汀。综上,RNAi技术能够有效实现土曲霉基因沉默。此项技术推进了一步法发酵生产辛伐他汀的工艺开发。
关键词: 辛伐他汀 洛伐他汀 莫那可林J RNAi lovF
One-step fermentation for producing simvastatin via RNAi silencing of lovF gene in Aspergillus terreus
Li Na1, Li Meihong1, Yu Zhen1, Zhou Jun1, Huang Jun1,2


1 Zhejiang Hisun Pharmaceutical Co. Ltd., Taizhou 318000, Zhejiang, China;
2 Institute of Bioengineering, Zhejiang University of Technology, Hangzhou 310032, Zhejiang, China
Received: July 27, 2015; Accepted: November 2, 2015
Corresponding authors:Huang Jun. Tel: +86-576-88820587; E-mail: Huangj@hisunpharm.com
Abstract: Simvastatin is one of the important prescription drugs for hypercholesterolemia. Monacolin J is a key intermediate during simvastatin synthesis, and also an intermediate of lovastatin biosynthesis. In this work, we construct a monacolin J producing strain via RNA interference to achieve one-step fermentation to obtain simvastatin. The lovF gene silencing plasmid pMHJ137 was constructed and transformed into Aspergillus terreus by Agrobacterium tumefaciens mediated transformation method. Precursor DMB-S-MMP was supplied during the fermentation to screen positive strains of transformants; which also further confirmed the simvastatin producing capability of MJ1-24 by one-step fermentation. Strain MJ1-24 produced monacolin J rather than lovastatin, and the feeding of DMB-S-MMP resulted in the generation of simvastatin. This study suggested that RNAi can efficiently silence the lovF gene of A. terreus and promote the simvastatin production by one-step fermentation.
Key words: simvastatin lovastatin monocolin J RNAi lovF
辛伐他汀 (Simvastatin,SV) 于1989年在美国上市,是目前美国市场上销量第二的降胆固醇药物。因为其年销售额达到100亿美元左右,也是制药行业的“重磅炸弹”[1-2]。辛伐他汀目前主要是以洛伐他汀 (Lovastatin,LV) 化学全合成得到。合成方法主要包括甲基化法、碱水解法和酶法等[3-4]。其中甲基化法因为反应条件苛刻、副反应多、产品分离难度大等缺点而很少被采用。而值得一提的是,后两者都以洛伐他汀的水解物——莫那可林J (Monacolin J,MJ) 为原料。
洛伐他汀由丝状真菌土曲霉Aspergillus terreus发酵产生,与辛伐他汀的区别仅在于C8位的侧链:前者是2-甲基丁酰,而后者是2,2-二甲基丁酰。洛伐他汀经水解脱掉C8位的侧链2-甲基丁酰后,得到莫那可林J,后者再与前体2,2-二甲基丁酰 (2,2-Dimethyl Butyryl) 的衍生物通过化学法或酶法得到辛伐他汀[5-7]。因此,莫那可林J是间接甲基化法和酶法合成辛伐他汀的关键前体物。
莫那可林J是洛伐他汀的生物合成途径的一个中间产物:土曲霉首先通过PKS途径合成莫那可林J,再与侧链基团2-甲基丁酰辅酶A (由lovF基因编号的二酮合成酶催化合成) 在转脂酶 (由lovD基因编码) 的催化作用下合成洛伐他汀[10-12]。因此,中断lovF和lovD基因均可积累莫那可林J,从而简化辛伐他汀的合成工艺。
丝状真菌常用的基因中断手段有基因敲除和RNA干扰技术 (RNAi) 等。但是土曲霉的同源重组效率低,利用基因敲除的方法有较大的难度[13-14]。本文利用RNAi对土曲霉的lovF进行中断,获得积累莫那可林J的基因工程菌,并在该基因工程菌的发酵过程中加入前体物质,发酵直接得到辛伐他汀。
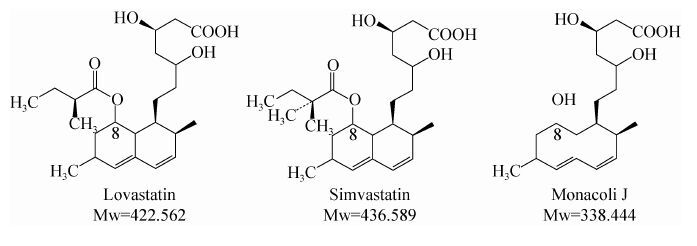 |
| 图1 洛伐他汀、辛伐他汀和莫那可林J的化学结构[8-9] Figure1 Chemical structures of lovastatin,simvastatin and monacolin J[8-9]. |
| 图选项 |
1 材料与方法1.1 材料1.1.1 质粒和菌株土曲霉Aspergillus terreus F001为本公司洛伐他汀产生菌、农杆菌Agrobacterium tumefaciens LBA4404由本实验室保藏。克隆载体pBluKS、双元载体pBGgHg及pCAMBIA1300由本实验室保藏;pMD19S购自宝生物工程 (大连) 有限公司 (TaKaRa)。
1.1.2 抗生素和培养基大肠杆菌培养基为LB,培养基中使用的卡那霉素 (Kanamycin,Km) 和羧苄青霉素 (Carbenicillin,Cb) 终浓度为100 μg/mL,利福平 (Rifampicin,Rif) 终浓度为50 μg/mL,链霉素 (Streptomycin,Sm) 终浓度为30 μg/mL,潮霉素 (Hygromycin B,Hm) 的终浓度为 200 μg/mL。土曲霉生长培养基为YPD培养基 (1%酵母提取物,2%蛋白胨,2%葡萄糖),农杆菌转化培养基为IMAS培养基[15]。
1.1.3 主要试剂核酸内切酶,DNA分子量标准DL2000,rTaq DNA聚合酶,LA Taq DNA聚合酶,DNA连接试剂盒,DNA平末端化试剂盒 (BKL kit) 等购自TaKaRa公司;DNA胶回收试剂盒和DNA片段回收试剂盒购自上海华舜生物公司;引物由南京金斯瑞生物技术有限公司合成。
1.2 转化方法大肠杆菌转化采用CaCl2法,农杆菌转化采用电转化法[15],土曲霉转化采用农杆菌介导的转化方法 (ATMT法)[15]。
1.3 土曲霉的发酵及产物检测土曲霉F001在YPD固体培养基上,28 ℃培养8 d。转接到30 mL种子培养基 (酵母抽提物0.12%,棉籽饼粉2.5%,葡萄糖3%,K2HPO4 1.5%,调节pH值为7.0),28 ℃、220 r/min培养40-48 h;以10%的接种量转接到发酵培养基 (乳糖20%,葡萄糖1.2%,棉籽饼粉4%,酵母抽提0.12%,调节pH值为7.2),28 ℃、220 r/min培养12 d。发酵液中产物检测方法见参考文献[16]。
1.4 菌株稳定性研究将阳性菌株MJ1-24在不含抗生素的YPD培养基上连续传代5次后,稀释涂布分离单菌落。随机挑取10株单菌落进行潮霉素抗性检测及发酵验证。
2 结果与分析2.1 载体pMHJ137的构建双元载体pMHJ1由pBGgHg经SacⅡ+ PvuⅡ切除带真核启动子的egfp和hph基因以及LB后,与退火后的包含LB序列 (下划线部分)的两条互补寡核苷酸链LBS和LBR (表 1) 连接得到。
表1 本研究所用引物序列Table1 Primers used in this study
| Primer name | Primer sequence (5′-3′) | restriction site |
| LBS | TGGCAGGATATATTGTGGTGTAAACATCTAGAGTTAA | |
| LBR | TTAACTCTAGATGTTTACACCACAATATATCCTGCCAGC | |
| EX6SF15 | tcagatatcAAGTCAGCCGACCAAGTAAGACTGGG | EcoR V |
| EX6SR16 | tccttcgaaCTGCAATGGTGACATGAGTGAGTGCT | BstBⅠ |
| EX6RR18 | tcattcgaaCTATAATGGACCAGGTTGACCCCATTTC | BstBⅠ |
| EX6RF17 | tcactcgagAAGTCAGCCGACCAAGTAAGACTGGG | XhoⅠ |
| PgpdF11 | ccaactagtTGAGGATCTAGAGCTGCTGTTC | SpeⅠ |
| PgpdR12 | ccagatatcTTCATATCGCAATCGATGGC | EcoR V |
| 35SF19 | ccactcgagTTTCTCCATAATAATGTGTGAGTAGTTCCC | XhoⅠ |
| 35SR20 | ccagtcgacGATTGAATTAATTCGGGGGATCTGGATTTTAGTAC | SalⅠ |
| fhphX | ccagtcgacGAATTAATTCGGGGGATCTGGATTTTAG | SalⅠ |
| fhphY | ccatctagaGCAAGTGGATTGATGTGATAACATGGTG | XbaⅠ |
| hphcF | CTATTTCTTTGCCCTCGGAC | |
| hphcR | AGGGTGTCACGTTGCAAGAC | |
| The underline parts are the restriction endonuclease sites. | ||
表选项
为了形成发夹结构的RNA,我们选择lovF基因的exon6作为反向重复序列,而在这个反向重复序列之间以lovF基因的intron6为连接序列。把这样的序列放在gpd启动子与35S-3'终止子之间 (如图)。构建过程如下:
首先从土曲霉基因组上扩增片段1和片段2:片段1为正向exon6和intron6,以引物EX6SF15和EX6SR16 (表 1) 扩增;片段2为反向exon6,以引物EX6RR18和EX6RF17 (表 1) 扩增。
再从双元载体pBGgHg扩增片段3和片段4:片段3为Pgpd,以引物PgpdF11和PgpdR12 (表 1) 扩增;片段4为35S-3'终止子,以引物35SF19和35SR20 (表 1) 扩增。
从pCAMBIA1300扩增片段5:含35S启动子和35S终止子的潮霉素抗性基因hph,以引物fhphX和fhphY (表 1) 扩增。
上述5个片段按3-1-2-4-5的顺序通过克隆载体连接,得到如图 2的片段。以SpeⅠ+ XbaⅠ切下此片段后,连接到pMHJ1的XbaⅠ位点,即为载体pMHJ137。
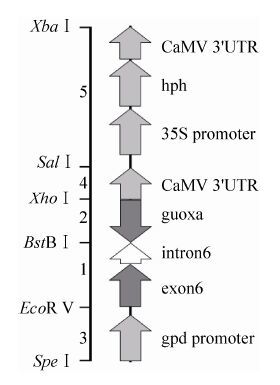 |
| 图2 载体pMHJ137中的发夹结构 Figure2 Hairpin structure in plasmid pMHJ137. |
| 图选项 |
2.2 农杆菌介导的土曲霉的转化取3 μL质粒pMHJ137,采用电转化法转化农杆菌LBA4404,涂布LB (含Rif,Km,Sm) 平板,28 ℃培养2 d。挑取含质粒pMHJ137的农杆菌LBA4404,转化土曲霉F001孢子,转化方法参照文献[15]。
2.3 转化子的PCR检测随机挑取10个转化子转接液体YPD,28 ℃振荡培养4 d,提取基因组DNA。以基因组 DNA为模板,以引物hphcF和hphcR (表 1) 进行PCR检验。结果如图 3所示,和对照质粒pMHJ137一样,以基因组DNA为模板可以扩增出hph基因内部740 bp的目的条带,表明潮霉素抗性基因与发夹结构已整合到F001的染色体上。
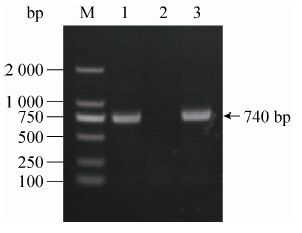 |
| 图3 转化子的PCR检验 Figure3 PCR analysis of transformants. M: DNA ladder; 1: plasmid pMHJ137; 2: parent strain F001; 3: positive strain. |
| 图选项 |
2.4 转化子的发酵验证对经PCR检测后有潮霉素抗性的转化子进行发酵验证,发酵产物进行HPLC分析。结果表明,与出发菌株 (图 4A) 相比,大部分转化子都产生了除洛伐他汀之外的新的物质 (图 4C),其出峰时间在4 min左右,与莫那可林J的出峰时间吻合。质谱分析 (图 5A) 其分子量为338,与莫那可林J相同;二级质谱分析 (图 6A) 其离子碎片峰与辛伐他汀标准品一致。根据本实验设计的原理,可以断定该新物质为莫那可林J。其中有3个转化子 (MJ1-8,MJ1-24,MJ2-30),发酵样品中只能检测出莫那可林J而没有原有的洛伐他汀 (图 4C)。
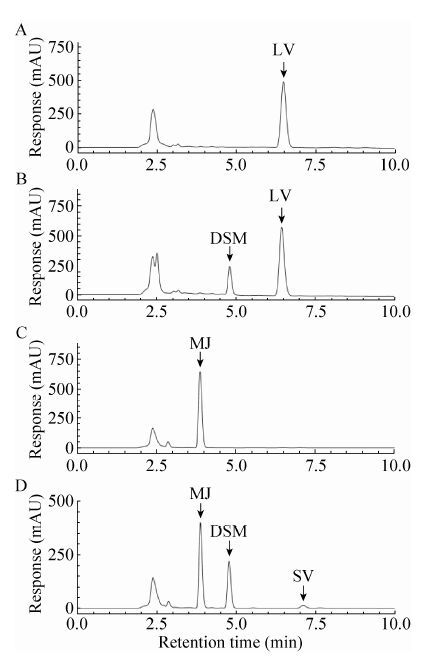 |
| 图4 转化子MJ1-24与初始菌株F001发酵液的HPLC图谱 Figure4 HPLC analysis of fermentation products from strain MJ1-24 and F001. (A) HPLC analysis of fermentation products from parent strain F001. (B) HPLC analysis of fermentation products from parent strain F001 in which the precursor DMB-S-MMP was added. (C) HPLC analysis of fermentation products from RNAi strain MJ1-24. (D) HPLC analysis of fermentation products from RNAi strain MJ1-24 in which the precursor DMB-S-MMP was added. LV: lovastatin; DSM: DMB-S-MMP; MJ: monacolin J; SV: simvastatin. |
| 图选项 |
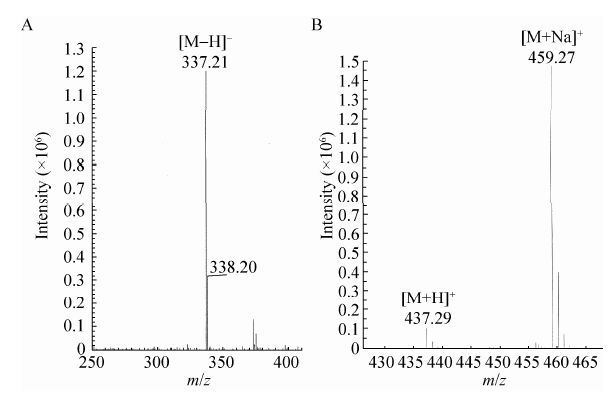 |
| 图5 莫那可林J (A) 和辛伐他汀 (B) 的质谱图 Figure5 A mass spectrometry analysis of monacolin J (A) and simvastatin (B). |
| 图选项 |
 |
| 图6 莫那可林J (A) 和辛伐他汀 (B) 的二级质谱图 Figure6 Secondary spectrometry analysis of monacolin J (A) and simvastatin (B). |
| 图选项 |
2.5 一步法发酵生产辛伐他汀由于由lovD基因编码的转脂酶没有被干扰,因此理论上在发酵体系中加入前体2,2-二甲基丁酰 (2,2-Dimethyl Butyryl) 的衍生物可以发酵产生辛伐他汀。我们在MJ1-24菌株的发酵过程中加入DMB-S-MMP,结果在发酵产物中检测到2个对照样品中没有的物质 (图 4D)。其中HPLC分析保留时间在7.5 min处的新峰经质谱分析其分子量为436 (图 5B),与辛伐他汀的分子量吻合,其HPLC出峰时间也与辛伐他汀标准品一致 (数据未显示);二级质谱分析 (图 6B) 其离子碎片峰与辛伐他汀标准品一致。根据本实验设计的原理,可以断定该新物质为辛伐他汀。而出峰时间在5.0 min的样品HPLC出峰时间与前体DMB-S-MMP相同,经质谱分析其分子量为218,因此可以判断此物质为前体DMB-S-MMP。同时,我们在出发菌株F001的发酵过程中加入DMB-S-MMP,结果在发酵产物中可以检测出洛伐他汀产物及前体DMB-S-MMP,并没有辛伐他汀的累积 (图 4B)。
2.6 菌株稳定性菌株MJ1-24传代5次后,分离得到的10株单菌落,在潮霉素抗性平板上均生长正常。以其基因组DNA为模板,进行PCR检验,可以扩增到潮霉素基因740 bp目的条带;而发酵结果也表明与初始菌株相同,样品中只能检测到莫那可林J的累积,而没有洛伐他汀产物。可见该菌株在不含潮霉素的培养条件下,菌株生长情况没有明显变化,菌株特性能够稳定遗传。
3 讨论通过抑制lovF和lovD基因的表达均可以实现产物莫那可林J的累积,但两种方法的原理有所不同:针对lovF基因的抑制策略是通过阻断侧链前体的合成来实现的,而针对lovD基因的抑制策略则是通过阻断侧链基因的加入完成的。生产莫那可林J的最终目的是合成辛伐他汀。在积累莫那可林J的同时保留转脂酶的活性从而实现一步法发酵生产辛伐他汀,被认为是较合理的方案。本研究选择lovF基因作为靶基因进行干扰。
全生物法生产辛伐他汀一直以来被认为是理想的合成方法,印度的Ranganathan[17]敲除了土曲霉的lovF基因,并将不同来源的PKS结构域组合在一起,重新构建可合成2,2-二甲基CoA的二酮合成酶基因,得到的基因工程菌可用于发酵直接生产辛伐他汀。但是通过组合生物合成技术得到的聚酮化合物产量都非常低,难以应用于工业化生产[18]。
本研究中的lovD基因的活性仍然保留,当加入前体物质DMB-S-MMP时,发酵液中可以检测到辛伐他汀。底物的改变导致lovD基因编码的转脂酶活性下降是发酵单位很低的原因之一。以往已经有大量研究曾对转脂酶进行了改造的尝试。例如,Gao等利用定向进化技术,使改造后的lovD以2,2-二甲基丁酰类似物为底物的活性提高11倍[19];Jiménez-Osés等将lovD基因经过改造后,其合成辛伐他汀的活性提高了 1 000倍[20]。如果将这些改造后的转脂酶基因重新导入到土曲霉中以替换原有的lovD基因,或许有助于进一步改进发酵法一步生产辛伐他汀的工艺。
RNAi技术已经广泛应用于丝状真菌的基因功能研究和工业菌株的基因改造[21-24]。龚桂花[25]等利用RNAi技术将头孢菌素C工业生产菌株中cefG基因的转录水平降低了80%以上,而头孢菌素C发酵水平降低了34.6%。李晓瑾等[26]通过RNAi技术特异性沉默烟曲霉色素形成相关基因arp1,产生与原始菌株不同的灰色菌株。Liu等[27]在新型隐球菌中应用RNAi技术降低了CAP59及ADE2基因的转录水平,使菌株产生了不同的表型。由此可见,RNAi是丝状真菌基因敲除的一种有效的尝试。目前关于土曲霉的基因中断方法的报道比较少,本文首次将RNAi技术应用于改造土曲霉工业菌株,通过沉默土曲霉中lovF基因,去除了洛伐他汀产物,成功地实现了莫那可林J的积累。这种尝试不但进一步改进了辛伐他汀的生产工艺,而且为实现清洁的工业化生产打下了良好的基础。
参考文献
| [1] | Barrios-González J, Miranda RU. Biotechnological production and applications of statins.Appl Microbiol Biotechnol, 2010, 85(4): 869–883(in Chinese). |
| [2] | Plosker GL, McTavish D. Simvastatin: a reappraisal of its pharmacology and therapeutic efficacy in hypercholesterolaemia.Drugs, 1995, 50(2): 334–363(in Chinese). |
| [3] | Yang ZY, Gan CH. Biosynthesis of simvastatin-a mini-review.Chin J Biotech, 2008, 24(3): 349–354(in Chinese). 杨仲毅, 甘春晖. 辛伐他汀的生物合成.生物工程学报,2008,24(3):349–354. |
| [4] | Hoffman WF, Alberts AW, Anderson PS, et al. 3-Hydroxy-3-methylglutaryl-coenzyme a reductase inhibitors. 4. Sidechain ester derivatives of mevinolin.J Med Chem, 1996, 29(5): 849–852(in Chinese). |
| [5] | Hendrickson L, Davis CR, Roach C, et al. Lovastatin biosynthesis in Aspergillus terreus: characterization of blocked mutants, enzyme activities and a multifunctional polyketide synthase gene.Chem Biol, 1999, 6(7): 429–439(in Chinese). |
| [6] | Kenndy J, Auclair K, Kendrew SG, et al. Modulation of polyketide synthase activity by accessory proteins during lovastatin biosynthesis.Science, 1999, 284(5418): 1368–1372(in Chinese). |
| [7] | Manzoni M, Rollini M. Biosynthesis and biotechnological production of statins by filamentous fungi and application of these cholesterol-lowering drugs.Appl Microbiol Biotechnol, 2002, 58(5): 555–564(in Chinese). |
| [8] | Xie XK, Tang Y. Efficient synthesis of simvastatin by use of whole-cell biocatalysis.Appl Environ Microbiol, 2007, 73(7): 2054–2060(in Chinese). |
| [9] | Alberts AW, Chen J, Kuron G, et al. Mevinolin: a highly potent competitive inhibitor of hydroxymethylglutaryl-coenzyme A reductase and a cholesterol-lowering agent.Proc Natl Acad Sci USA, 1980, 77(7): 3957–3961(in Chinese). |
| [10] | Gao L, Li HM. Advances in the studies of lovastatin biosynthesis and its related genes.Pharmaceut Biotechnol, 2005, 12(3): 201–206(in Chinese). 高蓝, 李浩明. 洛伐他汀生物合成及其相关基因研究进展.药物生物技术,2005,12(3):201–206. |
| [11] | Xie XK, Watanabe K, Wojcicki WA, et al. Biosynthesis of lovastatin analogs with a broadly specific acyltransferase.Chem Biol, 2006, 13(11): 1161–1169(in Chinese). |
| [12] | Sutherland A, Auclair K, Vederas JC. Recent advances in the biosynthetic studies of lovastatin.Curr Opin Drug Discov Devel, 2001, 4(2): 229–236(in Chinese). |
| [13] | Lin XB, Li HM. Studies on protoplast formation, inactivation and fusion in lovastatin-producing fungus.J GuangDong Coll Pharm, 2007, 23(1): 63–66(in Chinese). 林晓波, 李浩明. 洛伐他汀产生菌的原生质体制备、灭活及融合条件研究.广东药学院学报,2007,23(1):63–66. |
| [14] | Cai JJ, Li JL. Protoplast formation and regeneration in lovastatin-producing fungus Aspergillus terreus.J China Agric Univ, 2000, 5(5): 1–5(in Chinese). 蔡晶晶, 李季伦. 洛伐他汀产生菌土曲霉原生质体的制备与再生.中国农业大学学报,2000,5(5):1–5. |
| [15] | Wang DY, He D, Li GQ, et al. An efficient tool for random insertional mutagenesis: Agrobacterium tumefaciens-mediated transformation of the filamentous fungus Aspergillus terreus.J Microbiol Methods, 2014: 114–118(in Chinese). |
| [16] | Bao RS, Sun P, Yang ZY, et al. HPLC analysis of monacolin J in biosynthesis.Chin Pharm J, 2012, 47(7): 543–546(in Chinese). 包如胜, 孙鹏, 杨仲毅, 等. 生物合成过程中莫那克林J的高效液相色谱法测定方法.中国药学杂志,2012,47(7):543–546. |
| [17] | Ranganathan A. Process for the preparation of simvastatin: WIPO, PCT/IN2002/000157. 2003-02-06. |
| [18] | Wong FT, Khosla C. Combinatorial biosynthesis of polyketides-a perspective.Curr Opin Chem Biol, 2012, 16(1/2): 117–123(in Chinese). |
| [19] | Gao X, Xie XK, Pashkov L, et al. Directed evolution and structural characterization of a simvastatin synthase.Chem Biol, 2009, 16(10): 1064–1074(in Chinese). |
| [20] | Jiménez-Osés G, Osuna S, Gao X, et al. The role of distant mutations and allosteric regulation on LovDactive site dynamics.Nat Chem Biol, 2014, 10(6): 431–436(in Chinese). |
| [21] | Degefu Y, Hanif M. Agrobacterium- tumefaciens-mediated transformation of Helminthosporium turcicum, the maize leaf-blight fungus.Arch Microbiol, 2003, 180(4): 279–284(in Chinese). |
| [22] | Ji Y, Li M, Jiang XL. Application of gene targeting and RNAi in fungus functional genomics.Biotechnol Bull, 2011, (5): 64–70(in Chinese). 冀颖, 李梅, 蒋细良. 基因打靶与RNA干扰技术在丝状真菌基因功能组学研究中的应用.生物技术通报,2011,(5):64–70. |
| [23] | Wang SW, Liu G, Xing M, et al. Advances in filamentous fungal RNA interference and its application technology.Biotechnol Bull, 2011, (10): 77–83(in Chinese). 王绍文, 刘刚, 邢苗, 等. 丝状真菌中的RNA干扰及其应用技术.生物技术通报,2011,(10):77–83. |
| [24] | McDonald T, Brown D, Keller NP, et al. RNA silencing of mycotoxin production in Aspergillus and Fusarium species.Mol Plant Microbe Interact, 2005, 18(6): 539–545(in Chinese). |
| [25] | Gong GH, Liu Y, Hu YJ, et al. Down-regulation of cefG gene transcription in an industrial strain of Acremonium chrysogenum by RNA interference.Biotechnol Bull, 2010, (10): 194–197(in Chinese). 龚桂花, 刘艳, 胡又佳, 等. RNAi技术降低头孢菌素C工业生产菌株中cefG基因的转录.生物技术通报,2010,(10):194–197. |
| [26] | Li XJ, Liu JY, Su MQ, et al. Silencing arp1 gene in Aspergillus fumigatus by dsRNA mediated RNA interference.Lett Biotechnol, 2006, 17(5): 696–699(in Chinese). 李晓瑾, 刘家云, 苏明权, 等. dsRNA介导的RNA干扰沉默烟曲霉色素形成相关基因arp1的研究.生物技术通讯,2006,17(5):696–699. |
| [27] | Liu H, Cottrell TR, Pierini LM, et al. RNA interference in the pathogenic fungus Cryptococcus neoformans.Genetics, 2002, 160(2): 463–470(in Chinese). |
