

1 华东理工大学 生物反应器工程国家重点实验室,上海 200237
2 上海生物制造技术协同创新中心,上海 200237
3 上海纽迈电子科技有限公司,上海 200237
网络出版时间:2016-01-26
基金项目:国家重点基础研究发展计划 (973 计划) (No. 2011CB200900) 资助
摘要: 为了建立一个高效的高产油微藻诱变育种流程,微藻中油脂含量快速和准确的测定在其中具有重要作用。在本研究中,首先利用低场核磁共振技术,建立了直接检测干藻粉和培养液中小球藻油脂含量的方法,其信号强度与细胞中油脂含量存在特异的线性关系,干藻粉和藻液中油脂含量与信号值拟合的R2均高于0.99,说明该方法用于小球藻油脂含量的检测是准确和可行的。同时该方法与传统油脂测量方法相比,具有快速、简便和准确等优点。但其通量不及尼罗红染色法,因此,我们开发了将尼罗红染色法用于初筛,低场核磁共振技术用于复筛的新型高通量藻种复合筛选方法,并将此筛选方法应用于一种异养高产油原壳小球藻的诱变育种过程中。首先从3 098株诱变藻种中初筛得到108株具有较高油脂含量的藻株,然后利用低场核磁共振技术复筛得到9株高产油性能的藻株,其中一株甘油三酯含量超过20%,比原始藻株提高1倍,培养168 h后培养液油脂浓度达到5 g/L,证明此诱变育种流程不仅提高了筛选的效率还可靠且可行。
关键词: 低场核磁共振 诱变育种流程 微藻 油脂检测
Low field nuclear magnetic resonance for rapid quantitation of microalgae lipid and its application in high throughput screening
Tingting Liu1, Tao Wang1, Yi Yang3, Zejian Wang1, Yingping Zhuang1,2, Ju Chu1,2, and Meijin Guo1,2


1 State Key Laboratory of Bioreactor Engineering, East China University of Science and Technology, Shanghai 200237, China;
2 Shanghai Collaborative Innovation Center for Biomanufacturing, Shanghai 200237, China;
3 Shanghai Niumag Corporation, Shanghai 200237, China
Received: November 18, 2015; Accepted: January 6, 2016
Supported by:National Basic Research and Development Program of China (973 Program) (No. 2011CB200900)
Corresponding authors:Meijin Guo. Tel/Fax: +86-21-64251131; E-mail: guo_mj@ecust.edu.cn
Abstract: A rapid and accurate determination method of lipids in microalgae plays a significant role in an efficient breeding process for high-lipid production of microalgae. Using low field nuclear magnetic resonance (LF-NMR),we developed a direct quantitative method for cellular lipids in Chlorella protothecoides cells. The LF-NMR signal had a linear relationship with the lipid content in the microalgae cells for both dry cell samples and algal broth samples (R2>0.99). These results indicated that we could use this method for accurate determination of microalgal lipids. Although LF-NMR is a rapid and easy lipid determination method in comparison to conventional methods,low efficiency would limit its application in high throughput screening. Therefore,we developed a novel combined high throughput screening method for high-lipid content mutants of C. protothecoides. Namely,we initially applied Nile red staining method for semi-quantification of lipid in the pre-screening process,and following with LF-NMR method for accurate lipid determination in re-screening process. Finally,we adopted this novel screening method in the breeding process of high-lipid content heterotrophic cells of C. protothecoides. From 3 098 mutated strains 108 high-lipid content strains were selected through pre-screening process,and then 9 mutants with high-lipid production were obtained in the re-screening process. In a consequence,with heterotrophical cultivation of 168 h,the lipid concentration could reach 5 g/L,and the highest lipid content exceeded 20% (W/W),which was almost two-fold to that of the wild strain. All these results demonstrated that the novel breeding process was reliable and feasible for improving the screening efficiency.
Key words: low field nuclear magnetic resonance mutated breeding process microalgae lipid determination
当今主要利用的石油资源是不可再生的,且会对环境造成污染,产生温室效应[1]。生物柴油 (Biodiesel) 是比较理想的可再生能源,其利用生物的光合作用进行合成,是一种新型碳中性的能源。利用微藻进行生物柴油原材料的开发和利用近年来受到全球广泛的关注,相较于传统农作物而言,微藻具有明显优势,如单位细胞油脂含量高、不仅能固定二氧化碳,同时还能吸收废水中的氮和磷等。因此,利用微藻生产生物柴油在未来是非常具有潜力的对象[2-3]。
但是,目前微藻作为生物柴油的原料成本仍然较高,是阻碍生物柴油工业化生产的最大因素之一。为了降低成本,采用微生物育种以期待获得具有更高油脂含量以及更好生长性能的小球藻藻种是比较可靠的方法之一[4]。由于通过基因改造改良藻种受到单细胞转化技术发展缓慢,高效的诱变育种方法成为小球藻育种的最佳选择[5],Ota和马玉滨等用重离子诱变技术选育到高产油脂拟微球藻与小球藻[6-7]。
在优良藻种获得中,高通量筛选技术的出现是传统筛选技术基础上发展起来的快速和高效的筛选方法,但油脂 (Lipid)的快速检测是影响藻种进行高通量筛选的重要限制因素,因此寻找一种简单、快速、准确的油脂测定方法,不仅能够提高筛选的效率,同时能够对优良藻种的培养研究过程中油脂含量的变化进行实时监控,从而用于对藻种生产性能的评估和培养过程的优化。
微藻总脂含量的测定方法有传统的有机溶剂提取法、索氏提取法、荧光染料测定法、傅里叶变换红外光谱法、磷酸香草醛法、铜试剂法、苏丹黑染色法和核磁共振法等[8]。近来,基于低场核磁共振原理的油脂检测技术受到广泛的关注,低场核磁共振虽然分辨率不及高场核磁共振,不能得到精细的分子结构信息,但能得到分子之间的相互作用引起的信号变化[9],凭借成本低廉、快速、简便等优势,在石油[10]、矿石[11]、食品加工和分析[12]、废物原料的分析[13]和制药工业等许多领域得到广泛的应用,但在微藻油脂检测中的应用还甚少。
低场核磁共振测量油脂是基于氢质子在不同物质中弛豫时间的差异而实现的[14],蛋白和碳水化合物中氢核的弛豫时间很短,能够与油脂明显区分开。而自由水和油脂中的弛豫时间接近,但通过添加一些顺磁性离子 (例如锰离子) 能够大大加快自由水中氢核的弛豫,因此可以去除水对油脂信号的干扰[15-16]。
以上这些油脂检测方法各有优缺点,不论在藻种的筛选还是过程培养中,不能依赖单一的方法来满足油脂检测的需求[17]。因此,本文提出了1种基于尼罗红染色初筛和低场核磁共振复筛的新型诱变育种方法,并建立了高效的藻种育种流程,获得高产油的藻株。
1 材料与方法1.1 藻种和培养方法 原壳小球藻Chlorella protothecoides IOCAS038F 由中国科学院青岛海洋所刘建国教授赠送。
所用的培养基为经过优化后的异养培养基,成分如表 1所示,配好后调pH至8.0。在初筛和复筛中,依次在孔板、摇瓶和5 L发酵罐中进行。平板筛选所用的培养基是在上述培养基中添加2%的琼脂,待其冷却凝固后涂布藻细胞,置于30 ℃培养。孔板培养先在无菌的48孔板中每个孔中添加2.4 mL灭菌培养基,接种之后于30 ℃、200 r/min的摇床上培养。摇瓶培养在500 mL的摇瓶中进行,其装液量为 200 mL,接入10% (V/V) 的种子,于30 ℃、200 r/min的摇床上培养。反应器培养在实验室5 L发酵罐中进行 (上海国强生化工程技术有限公司,上海),反应器的装液量为3 L,并加入0.1%的消泡剂,灭菌后接入10%的摇瓶种子,通气量 1.8 L/min,在30 ℃下进行培养,初始转速为200 r/min,培养过程中通过逐步提高转速使得溶氧水平 (DO) 维持在20%饱和浓度以上,全程用2 mol/L HCl溶液将pH自动调控为7.0。
表1 培养基成分Table1 Medium component
| Constituents | Concentration (mg/L) | Constituents | Concentration (mg/L) |
| Glucose | 50 000 | Na2CO3 | 20.000 |
| NaNO3 | 5 000 | Na2MoO4·2H2O | 0.390 |
| K2HPO4·3H2O | 1 000 | H3BO3 | 2.860 |
| MgSO4·7H2O | 300 | MnCl2·4H2O | 1.810 |
| CaCl2·2H2O | 40 | ZnSO4·7H2O | 0.222 |
| Citric acid | 6 | CuSO4·5H2O | 0.079 |
| Ferric ammonium citrate | 6 | Co(NO3)2·6H2O | 0.492 |
| EDTA | 1 |
表选项
1.2 原壳小球藻诱变方法 紫外 (UV) 诱变:取处于对数生长期的原壳小球藻培养液10 mL于培养皿中,在15 W的紫外灯下距离40 cm分别照射一定时间,稀释后均匀涂布于平板上培养7 d。LiCl诱变:取一定量LiCl母液加入处于对数生长期的原壳小球藻培养液中混匀,30 min后稀释以终止诱变,再稀释适当倍数涂布于平板上培养7 d。UV-LiCl联合诱变:根据原壳小球藻UV诱变和LiCl诱变的致死曲线得到各自的最佳处理条件进行处理,稀释后均匀涂布于平板上培养7 d。LV (LiCl-UV) 诱变:将原壳小球藻按照适当的条件先进行LiCl诱变,再进行UV诱变,涂平板得到单藻落;VL (UV-LiCl) 诱变:将原壳小球藻进行UV诱变再用适当浓度的LiCl处理,涂平板得到单藻落;LVL (LiCl-UV-LiCl) 诱变:将原壳小球藻依次进行LiCl诱变、UV诱变和LiCl诱变,涂平板得到单藻落。常压室温等离子体 (Atmospheric and room temperature plasma,ARTP) 诱变:取处于对数生长期的原壳小球藻藻液于装有无菌玻璃珠的瓶中振荡数次,然后取10 μL于载片上,载片置于ARTP诱变仪 (ARTP-II,无锡思清源生物科技有限公司) 诱变一定时间后,用1 mL无菌水洗下载片上的藻液,均匀涂布于平板上培养7 d。
为了增加诱变后平板上长出的单藻落的正突变率,选用了奥利司他作为诱变后的筛选压力,以便提高筛选效率。即待平板培养的培养基灭菌后冷却至50-70 ℃后,添加一定量奥利司他,再按照平板培养的方法培养。将诱变后的小球藻平板培养至长出单藻落后,挑单藻落至48孔板进行孔板培养,培养3 d后初筛,然后复筛,最后将筛选出的藻株进行遗传稳定性验证。藻株摇瓶培养5 d为第一代,以10%接种量接种后摇瓶培养5 d即为第二代,以此类推,一共传6代即可。取10 mL每1代藻株培养8 d的藻液用低场核磁共振仪检测,油脂含量相同或者相近即为遗传稳定性较好。
1.3 检测方法 小球藻生物量用细胞干重 (Dry cell weight,DCW) 进行表示,取40 mL对应发酵液,6 000 r/min离心5 min,弃上清后洗涤2次,离心,80 ℃烘干后称其干重,计算得到DCW。
油脂检测分别采用尼罗红染色、索氏提取和GC-MS,以及低场核磁共振方法。尼罗红染色是先取100 μL培养好的原壳小球藻于黑色酶标板中,加100 μL 30 mg/L的尼罗红二甲基亚砜溶液,混匀1 min,染色20 min,用荧光酶标仪 (BioTek SYNERGY H1) 测定激发波长为485 nm,发射波长为535 nm的荧光强度[18]。索氏提取法检测含油量步骤是先将样品于80 ℃烘干至恒重,然后用研钵研磨成细粉,再准确称取一定质量的藻粉,将其置于脱脂滤筒中放于索氏提取仪器中,连接好仪器后由冷凝管上方加入1∶2的氯仿和甲醇混合液,于55 ℃水浴加热12 h后取下烧瓶旋转蒸发,然后置于烘箱烘干,记录其重量并计算含油率[19]。GC-MS检测含油量的步骤是先将原壳小球藻藻液离心洗涤后烘干,再将干燥的藻体研磨成均一的细粉。精确称取0.02-0.1 g研磨后的藻粉,在称量好的藻粉中加1 mL 0.4 mol/L KOH-CH3OH溶液后置于70 ℃中水浴30 min,冷却后加入1 mL 0.3 mol/L H2SO4-CH3OH溶液和0.5 mL 14%的BF3-CH3OH溶液 (Sigma-Aldrich, USA),再次置于70 ℃中水浴30 min,冷却后加入2 mL正己烷反复振荡多次,静置10 min,然后加水至10 mL,3 000 r/min离心5 min。最后将正己烷层用0.2 μm油性过滤头过滤后与400 mg/L 十九烷酸甲酯按照1∶1 (V/V) 的比例混匀,将混匀的样品用GC-MS仪器 (安捷伦 7 890C GC 系统和5 975C inert MSD,美国) 检测,在分析软件上计算得到各脂肪酸组分的浓度和各组分的百分比。
低场核磁共振 (Low field nuclear magnetic resonance,LF-NMR) 技术检测方法为将一定体积或一定质量的原壳小球藻抽提藻油或三油酸甘油酯 (Sigma-Aldrich,美国) 标准液置于玻璃小瓶中,用PQ001型LF-NMR核磁共振分析仪 (PQ001-010,上海纽迈电子科技有限公司) 检测其响应值。在直接测定含游离水的油脂样品中 (小球藻培养液或含水样),则添加15% MnCl2以排除水信号对油脂信号的干扰。
1.4 数据统计分析 致死率计算是先按照稀释涂布法统计各个样本的藻落数,然后根据处理后藻落数与总藻落数计算致死率。
致死率= (未处理藻落数-相应条件处理后藻落数)/未处理藻落数×100%。正突变率计算中尼罗红染色法测得的荧光强度高于原始藻株的荧光强度20%的藻株为正突变藻株。
正突变率=正突变藻株数/所检测的藻株数×100%。所有实验数据为3次重复实验结果的平均值。
2 结果与讨论2.1 低场核磁共振技术快速检测小球藻油脂方法的建立2.1.1 三油酸甘油酯标液 (TAG) 和干藻粉中油脂量 (GC-MS测得) 与LF-NMR响应值的关系 为了考察低场核磁共振技术在检测原壳小球藻油脂中的可行性和适用性,首先考察了标准品三油酸甘油酯及2种形式细胞中油脂量 (用GC-MS测得) 与低场核磁信号响应值之间的关系,结果见图 1。从图 1中可看出,不管是三油酸甘油酯、抽提藻油和存在于干藻粉中的油脂与低场核磁信号之间都呈良好的线性关系,特别是TAG标液与响应值线性拟合R2大于0.999 9,表明低场核磁共振技术对TAG的定量具有非常高的准确性。同时,比较分析图 1中A、B和C可发现,三者线性拟合的斜率是不同的,这是因为不同样品中的油脂含量差异造成的,抽提藻油由于含有蛋白、色素等杂质油脂含量低于标品,而藻粉油脂含量仅为13.47%,所以其信号响应强度均小于标品三油酸甘油酯。因此,结果表明低场核磁信号与原壳小球藻中的油脂量是专一性的正比关系,能够用于原壳小球藻油脂量的测量。
 |
| 图1 不同类型油脂与低场核磁信号之间的关系 Figure1 The linear relationship between LF-NMR signal intensities and the lipids quantity or lipid contents. (A) Glycerol trioleate. (B) Extracted algal lipids by Soxhlet method from C. protothecoides. (C) Dry microalgae cells. (D) The calibration curve of LF-NMR signal intensity with algal lipid content (GC-MS determination) in dry cells. |
| 图选项 |
另外,从图 1D中可看出,不同含油率干藻粉质量相同的情况下,低场核磁信号值与GC-MS所测得的含油量也呈很好的线性关系,经过线性拟合,得到公式(1):
| $y=0.005x+3.0711,{{R}^{2}}=0.9974$ | (1) |
这也验证了低场核磁共振技术用于直接测定藻粉中油脂含量的可行性,用于微藻中油脂含量快速和直接的测定。
2.1.2 培养液中小球藻用GC-MS测得含油量与LF-NMR响应值之间的关系 快速检测无论在藻种筛选和过程控制中都具有重要的作用。为了实现低场核磁共振技术能够直接检测藻培养液中的油脂含量,考察了不同原壳小球藻培养液 (体积均为10 mL) 用GC-MS测得的油脂浓度与用低场核磁共振技术测得的响应值的关系,结果表明不同原壳小球藻培养液的含油量与响应值呈线性关系 (图 2)。经过线性拟合,得到公式(2):
| $y=0.0024x-0.1398,{{R}^{2}}=0.9983$ | (2) |
 |
| 图2 不同原壳小球藻培养液细胞油脂利用低场核磁直接测定结果 (油脂含量都是用GC-MC 法测得) Figure2 The calibration curve of LF-NMR signal intensity with lipid concentration in algal broth. All the lipid contents were quantified by GC-MS method. |
| 图选项 |
由此可知,利用低场核磁共振技术不仅可直接检测干藻粉中的油脂含量,还可以直接测定培养液中的油脂浓度,在获得细胞浓度后还可计算得到细胞含油率。
2.1.3 低场核磁共振技术与现有小球藻含油量定量方法比较 目前,小球藻油脂含量分析的方法主要包括称重法、染色法、核磁共振法和气相色谱质谱联用等。为了从现有的小球藻含油量检测方法中选出适合于小球藻诱变后筛选的方法,对GC-MS、索氏提取、尼罗红染色常用微藻油脂定量方法与低场核磁定量方法进行比较。对比的数据来自于相关参考文献[8, 10, 18]以及本文的实验结果,对比结果见表 2。从表 2中可以看出低场核磁共振技术操作最简单、耗时最短且准确性高,可以用于小球藻诱变筛选流程中的复筛和遗传稳定性验证,尼罗红染色可以快速检测多个样品,适用于高通量筛选,可以用于初筛。因此,小球藻诱变流程中的初筛选择尼罗红染色法,复筛和遗传稳定性验证则采用低场核磁共振技术。
表2 低场核磁和传统油脂测定方法的比较Table2 Comparison of lipid determination between conventional determination methods and LF-NMR method
| Measuring methods | Dry cells | Extraction or staining | Duration | Accuracy | Application |
| LF-NMR | Needn’t | No | 3-5 min | High (R2≥0.99) | Direct determination for lipid content |
| GC-MS | Need | Extraction | 24-48 h | High (R2≥0.99) | Direct detection for lipid constituents |
| Soxhlet extraction | Need | Extraction | 24-48 h | Low (with impurity) | Extracted lipid |
| Stained by Nile red | Needn’t | Staining | 30-40 min | Medium (R2≥0.98) | High throughput screening |
表选项
2.2 低场核磁共振快速检测技术在小球藻诱变育种过程中的应用2.2.1 不同诱变方法的致死曲线 为了确定各诱变方法适当的诱变剂量,绘制了原壳小球藻UV诱变、LiCl诱变和ARTP诱变的致死曲线,结果见图 3。由于出发藻种是野生藻种,没有经过诱变处理,适合选择致死率较高的条件进行诱变[20]。在UV诱变致死曲线中,原壳小球藻致死率随处理时间增加而增加,在处理6 min后致死率达到了95%以上,因此,原壳小球藻UV诱变的剂量为UV照射6 min。在LiCl致死曲线中,原壳小球藻致死率随LiCl浓度的增加而增加,当LiCl浓度达到9 g/L后致死率基本不再变化,达到70%左右,因此,选择LiCl诱变的剂量为9 g/L。在ARTP致死曲线与UV致死曲线类似,在25 s以后原壳小球藻的致死率达到了95%,因此,ARTP诱变中选择25 s为处理时间。
 |
| 图3 不同诱变方法的致死曲线 Figure3 Lethal percentages of C. protothecoides cells treated by different mutation methods. (A) UV radiation. (B) LiCl. (C) ARTP. |
| 图选项 |
2.2.2 原壳小球藻的诱变育种及初筛 由于单独诱变效果不能满足筛选要求,特别是所选的诱变方法中LiCl本身并无直接诱变作用,但是与其他诱变剂联用能产生很好的协同作用[21],因此对不同的复合诱变策略进行考察。同时,奥利司他是一种脂肪酸合成酶抑制剂,可以抑制脂肪酸的合成[22],将其作为选择压力,提高筛选的正突变率。首先对奥利司他的筛选效果进行考察 (图 4A),显然,奥利司他在筛选过程中发挥了作用,提高了筛选的正突变率。此后将小球藻细胞用5种不同诱变方法处理后在添加20 μg/mL奥利司他的平板培养,然后从平板中共挑取3 098个单藻落至48孔板培养后用尼罗红染色法对其进行初筛,计算得到各自的正突变率 (图 4B),从图中可以看出ARTP、LVL和UV的正突变率在30%以上,明显高于LV和VL。相较于LVL和UV而言,ARTP不仅正突稍高,而且操作更加简单、快捷,所以选取ARTP作为藻种诱变筛选流程中的诱变方法。
 |
| 图4 原壳小球藻不同诱变处理方法的正突变率 Figure4 Positive mutation rates of C. protothecoides cells treated by different mutation methods. (A) Treated by ARTP with or without orlistat. (B) Treated by five different mutation methods with orlistat. |
| 图选项 |
2.2.3 基于低场核磁的高产油藻株复筛 正如2.1中结果,低场核磁能够快速和准确地定量分析微藻中的油脂含量,因此将其利用到高油脂藻细胞的筛选中。由于其筛选通量不及尼罗红染色高,所以应用到以上诱变藻种的复筛中,直接检测微藻培养液,快速和准确地获得油脂浓度,共复筛108株藻株 (图 5)。图 5中所有的突变藻株的含油量都比原始藻株大,验证了此筛选流程的可靠性。图 5中除了大部分藻株油脂含量在1.5 g/L到2.3 g/L之间,还有9株藻株含油量较高,选取此9株藻株进行传代培养,传6代后结果见表 3。表 3中大部分藻株第6代的藻株油脂含量与复筛时即第一代的油脂含量相近,说明其遗传稳定性良好。选取其中遗传稳定性好且油脂含量也较高的G1H3、4E4、D4G5这3株藻株在5 L搅拌式反应器中进行发酵验证,结果见图 6。图 6A中D4G5、G1H3的生长曲线和出发藻株WT相似,在48 h时微藻细胞量达到最大,微藻生长进入稳定期,而4E4在48 h还处于生长期。G1H3、D4G5的最终生物量比WT高,而4E4和WT相近,表明高油脂含量突变株的生长情况良好,并未受到突变的影响。在图 6B中,所有藻株培养24 h的油脂含量都有所下降,可能是由于藻株处于对数生长期细胞调动大部分能量生长细胞引起,当48 h细胞达到稳定期后,细胞中的油脂含量开始快速累积,培养结束时突变株的油脂含量均高于野生株,分别为21.8%、17.7%和16.9%,而野生株仅为10.2%,尤其是D4G5最终含油脂率为WT的2倍左右,这都说明获得的突变株不仅油脂含量高,而且生长良好,产油脂的性能比原始藻株好,图 6C中油脂浓度的变化也能验证这一点,同时这些都证明了此藻细胞育种流程的可靠性。
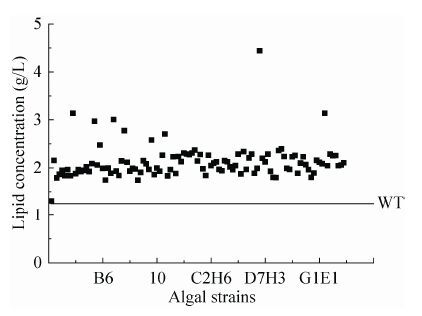 |
| 图5 复筛结果 Figure5 The lipid concentration of rescreened C. protothecoides strains. |
| 图选项 |
 |
| 图6 高油脂含量原壳小球藻突变株,G1H3、4E4、D4G5 及野生株在5 L 搅拌式反应器中生长和油脂含量变化曲线 Figure6 Time courses of cell growth and lipid content of G1H3, 4E4, D4G5 and wild strains cultured in a 5-liter stirred bioreactor. (A) Cell growth. (B) Lipid content. (C) Lipid concentration. |
| 图选项 |
表3 高产油藻株的摇瓶发酵验证Table3 Verification of high lipid content strains grown in shaking flask
| Strains | The sixth generation | The first generation | |||
| Lipid concentration measured by LF-NMR (g/L) | DCW (g/L) | Lipid content measured by LF-NMR (%) | Lipid content measured by GC-MS (%) | Lipid concentration measured by LF-NMR (g/L) | |
| WT | 1.32 | 14.4 | 9.18 | 9.32 | 1.29 |
| B2 | 2.22 | 15.3 | 14.51 | 14.49 | 2.26 |
| B5 | 2.64 | 17.6 | 15.00 | 15.06 | 2.68 |
| B7 | 2.72 | 16.7 | 16.29 | 16.21 | 2.71 |
| 1 | 2.18 | 16.1 | 13.54 | 13.61 | 2.51 |
| 7 | 2.16 | 14.6 | 14.78 | 14.81 | 2.45 |
| 16 | 2.36 | 14.8 | 15.96 | 15.87 | 2.35 |
| G1H3 | 2.80 | 17.1 | 16.35 | 16.41 | 2.82 |
| 4E4 | 2.82 | 15.9 | 17.76 | 17.71 | 2.82 |
| D4G5 | 4.19 | 19.3 | 21.69 | 21.61 | 4.24 |
表选项
3 结论 低场核磁共振技术检测小球藻油脂含量是一个可靠的方法,可以用于小球藻油脂含量快速检测,因此将低场核磁共振技术用于藻种筛选流程中可以使筛选更加简单快捷。
图 7所示为基于尼罗红染色初筛和低场核磁共振复筛的一个简单、高效、易操作的高产油微藻诱变育种流程。藻种诱变筛选工艺流程:微藻细胞先经ARTP诱变后在添加20 μg/mL奥利司他的平板中培养,挑单藻落至48孔板中培养3 d,尼罗红染色后用荧光酶标仪检测其荧光强度,将荧光强度大的藻种接种至摇瓶培养,8 d后用LF-NMR检测,油脂含量较大的藻种再传代检验其遗传稳定性,遗传稳定性合格的藻种就是油脂含量较高的新藻种。
 |
| 图7 高产油脂微藻育种流程 Figure7 Breeding procedure for high lipid producing strains of microalgae. |
| 图选项 |
此流程不仅优化了诱变方式,还选择了适合的筛选方法,其中的低场核磁共振技术相较于索氏提取以及GC-MS等方法,不需要将藻液离心干燥,更不需要索氏提取的复杂工艺和GC-MS复杂的前处理。在时间和操作步骤的简易程度上,低场核磁共振技术都优胜于索氏提取和GC-MS。将低场核磁共振技术用于诱变流程的复筛中简化了筛选的步骤,缩短了筛选的周期,使筛选流程方便、快速和高效。
参考文献
| [1] | Zeng M, Ouyang SJ, Shi H, et al. Overall review of distributed energy development in China: status quo, barriers and solutions.Renew Sust Energ Rev, 2015: 1226–1238(in Chinese). |
| [2] | Ahmad AL, Yasin NHM, Derek CJC, et al. Microalgae as a sustainable energy source for biodiesel production: a review.Renew Sust Energ Rev, 2011, 15(1): 584–593(in Chinese). |
| [3] | Chen H, Qiu T, Rong JF, et al. Microalgal biofuel revisited: an informatics-based analysis of developments to date and future prospects.Appl Energ, 2015: 585–598(in Chinese). |
| [4] | Bennamoun L, Afzal MT, Léonard A. Drying of alga as a source of bioenergy feedstock and food supplement-a review.Renew Sust Energ Rev, 2015: 1203–1212(in Chinese). |
| [5] | Larkum AWD, Ross IL, Kruse O, et al. Selection,breeding and engineering of microalgae for bioenergy and biofuel production.Trends Biotechnol, 2012, 30(4): 198–205(in Chinese). |
| [6] | Ma YB, Wang ZY, Zhu M, et al. Increased lipid productivity and TAG content in Nannochloropsis by heavy-ion irradiation mutagenesis.Bioresour Technol, 2013: 360–367(in Chinese). |
| [7] | Ota S, Matsuda T, Takeshita T, et al. Phenotypic spectrum of Parachlorella kessleri (Chlorophyta) mutants produced by heavy-ion irradiation.Bioresour Technol, 2013: 432–438(in Chinese). |
| [8] | Liang Y, Shi WJ, Tian CY. A review of the methods for determining total lipid content in microalgae.Per Ocean Univ China, 2012, 42(5): 35–40(in Chinese). 梁英, 石伟杰, 田传远. 微藻总脂含量测定方法概述.中国海洋大学学报,2012,42(5):35–40. |
| [9] | Horn PJ, Neogi P, Tombokan X, et al. Simultaneous quantification of oil and protein in cottonseed by low-field time-domain nuclear magnetic resonance.J Am Oil Chem Soc, 2011, 88(10): 1521–1529(in Chinese). |
| [10] | Niu Y, Kantzas A, Bryan J. Determining bitumen,water and solids in oil sands ore by using low-field NMR.J Can Petrol Technol, 2008: 40(in Chinese). |
| [11] | Bryan JL, Mai AT, Hum FM, et al. Oil and water content measurements in bitumen ore and froth samples using low field NMR.SPE Reserv Eval Eng, 2006, 9(6): 654–663(in Chinese). |
| [12] | Shao XL, Li YF. Classification and prediction by LF NMR.Food Bioproc Technol, 2012, 5(5): 1817–1823(in Chinese). |
| [13] | Willson RM, Wiesman Z, Brenner A. Analyzing alternative bio-waste feedstocks for potential biodiesel production using time domain (TD)-NMR.Waste Manage, 2010, 30(10): 1881–1888(in Chinese). |
| [14] | Gao CF, Xiong W, Zhang YL, et al. Rapid quantitation of lipid in microalgae by time-domain nuclear magnetic resonance.J Microbiol Meth, 2008, 75(3): 437–440(in Chinese). |
| [15] | Jin YQ, Zheng XY, Chi Y, et al. Rapid,accurate measurement of the oil and water contents of oil sludge using low-field NMR.Ind Eng Chem Res, 2013, 52(6): 2228–2233(in Chinese). |
| [16] | Silva RC, Carneiro GF, Barbosa LL, et al. Studies on crude oil-water biphasic mixtures by low-field NMR.Magn Reson Chem, 2012, 50(2): 85–88(in Chinese). |
| [17] | Han YC, Wen QX, Chen ZQ, et al. Review of methods used for microalgal lipid-content analysis.Energy Procedia, 2011: 944–950(in Chinese). |
| [18] | Liang WY, Zhang YC, Cao JC, et al. Quantification of lipid content in microalgae using Nile red as fluorescent probe.Environ Chem, 2013, 32(8): 1491–1495(in Chinese). 梁文艳, 张元春, 曹敬灿, 等. 采用尼罗红荧光探针对微藻中油脂的定量测定.环境化学,2013,32(8):1491–1495. |
| [19] | Wei FS, Li CH, Dai M, et al. Improvement of soxhlet extraction used for determination of crude lipids content of marine microalgae.J Shanghai Ocean Univ, 2011, 20(4): 619–623(in Chinese). 韦芳三, 李纯厚, 戴明, 等. 索氏提取法测定海洋微藻粗脂肪含量及其优化方法的研究.上海海洋大学学报,2011,20(4):619–623. |
| [20] | Shi QQ, Wu SG. Industrial Microbe Breeding.4th ed.Beijing: Science Press, 2013: 97-103(in Chinese). 施巧琴, 吴松刚. 工业微生物育种学.4版.北京: 科学出版社, 2013: 97-103. |
| [21] | Cheng M, Cui CB, Li CW, et al. Chemical mutation technique applied in microorganism breeding.J Int Pharm Res, 2009, 36(6): 412–417(in Chinese). 程明, 崔承彬, 李长伟, 等. 化学诱变技术在微生物育种研究中的应用.国际药学研究杂志,2009,36(6):412–417. |
| [22] | Agostini M, Almeida LY, Bastos DC, et al. The fatty acid synthase inhibitor orlistat reduces the growth and metastasis of orthotopic tongue oral squamous cell carcinomas.Mol Cancer Ther, 2014, 13(3): 585–595(in Chinese). |
