
 , 杨东风1, 2
, 杨东风1, 2 

1. 浙江理工大学 生命科学学院,浙江 杭州 310018
2. 浙江省植物次生代谢调控重点实验室,浙江 杭州 310018
摘要:为探讨一氧化氮 (Nitric oxide,NO) 信号在脱落酸 (Abscisic acid,ABA) 诱导丹参酚酸类成分积累 中的作用,采用不同浓度一氧化氮外源供体硝普钠 (Sodium nitroprusside,SNP) 处理丹参毛状根,6 d 后采收, 测定酚酸类成分含量;ABA 联合一氧化氮清除剂 (2-(4-carboxy-2-phenyl)-4,4,5,5-tetramethylimidazoline-1-oxyl- 3-oxide,c-PTIO) 或一氧化氮合酶抑制剂 (NG-nitro-L-arginine methyl ester,L-NAME) 对丹参毛状根进行处理, 测定酚酸类成分含量和关键基因表达量。结果表明,100 μmol/L SNP 对丹参毛状根中迷迭香酸与丹酚酸B 积 累的诱导效果最显著,迷迭香酸和丹酚酸B 含量分别增加了3 倍和4 倍。ABA 处理能显著促进PAL (Phenylalanine ammonia lyase)、TAT (Tyrosine aminotransferase) 和RAS (Rosmarinic acid synthase) 基因的表达, 促进丹参毛状根中酚酸类成分的积累,而联合c-PTIO 或L-NAME 共同处理后,3 种关键基因表达下调,并显 著抑制了酚酸类成分的积累。研究证明NO 和ABA 均能够促进丹酚酸类成分的积累,NO 信号可能介导了ABA 对丹酚酸生物合成的诱导作用。
关键词: 丹参一氧化氮脱落酸酚酸
Role of NO signal in ABA-induced phenolic acids accumulation in Salvia miltiorrhiza hairy roots
Lihong Shen1, Jiahui Ren1, Wenfang Jin1, Ruijie Wang1, Chunhong Ni1, Mengjiao Tong1, Zongsuo Liang1, 2

 , Dongfeng Yang1, 2
, Dongfeng Yang1, 2

1. School of Life Sciences, Zhejiang Sci-Tech University, Hangzhou 310018, Zhejiang, China
2. Key Laboratory of Plant Secondary Metabolism and Regulation of Zhejiang Province, Hangzhou 310018, Zhejiang, China
Received: June 12, 2015; Accepted: September 22, 2015
Supported by: Natural Science Foundation of Zhejiang Province (No. LQ13C020003), National Natural Science Foundation of China (Nos. 81373908, 81403033).
Corresponding authors: Zongsuo Liang. Tel/ Fax: +86-571-86843301; E-mail: liangzs@ms.iswc.ac.cnDongfeng Yang. Tel/Fax: +86-571-86843301; E-mail: ydf807@sina.com
Abstract: To investigate roles of nitric oxide (NO) signal in accumulations of phenolic acids in abscisic acid (ABA)-induced Salvia miltiorrhiza hairy roots, S. miltiorrhiza hairy roots were treated with different concentrations of sodium nitroprusside (SNP)-an exogenous NO donor, for 6 days, and contents of phenolic acids in the hairy roots are determined. Then with treatment of ABA and NO scavenger (2-(4-carboxy-2-phenyl)-4,4,5,5-tetramethylimidazoline-1- oxyl-3-oxide, c-PTIO) or NO synthase inhibitor (NG-nitro-L-arginine methyl ester, L-NAME), contents of phenolic acids and expression levels of three key genes involved in phenolic acids biosynthesis were detected. Phenolic acids production in S. miltiorrhiza hairy roots was most significantly improved by 100 μmoL/L SNP. Contents of RA and salvianolic acid B increased by 3 and 4 folds. ABA significantly improved transcript levels of PAL (phenylalanine ammonia lyase), TAT (tyrosine aminotransferase) and RAS (rosmarinic acid synthase), and increased phenolic acids accumulations. However, with treatments of ABA+c-PTIO or ABA+L-NAME, accumulations of phenolic acids and expression levels of the three key genes were significantly inhibited. Both NO and ABA can increase accumulations of phenolic acids in S. miltiorrhiza hairy roots. NO signal probably mediates the ABA-induced phenolic acids production.
Keywords: Salvia miltiorrhizanitric oxideabscisic acidphenolic acids
丹参为唇形科鼠尾草属植物丹参Salvia miltiorrhiza Bunge 的干燥根及根茎,因其色红且形状似参而得名“丹参”,是一种主治心血管系统疾病的常用中药。丹参有效成分主要包括两大类:水溶性化合物 (咖啡酸、迷迭香酸和丹酚酸B 等) 和脂溶性化合物 (丹参酮Ⅰ、丹参酮ⅡA、隐丹参酮等)[1]。丹酚酸B和迷迭香酸是丹参的主要水溶性活性成分,丹酚酸B有抗肝纤维化、抑制血小板聚集、抗血栓形成等活 性[3],迷迭香酸具有抗炎、抗菌、抗氧化等生理活性[4]。
植物体内丹酚酸的生物合成主要来源于酪氨酸途径和苯丙氨酸途径:苯丙氨酸途径以苯丙氨酸为底物,在苯丙氨酸解氨酶 (PAL) 作用下脱氨基生成反式肉桂酸,苯丙氨酸解氨酶是该途径的限速酶;酪氨酸途径以酪氨酸为起始,经酪氨酸氨基转氨酶 (TAT) 的氧化脱氨和羟基苯丙酮酸还原酶 (HPPR) 的还原作用下生成4-羟基苯乳酸。4-香豆酰辅酶A与4-羟基苯乳酸在迷迭香酸合成酶 (RAS) 和细胞色素P450蛋白作用下生成迷迭香酸[5]。PAL、TAT、RAS的表达与迷迭香酸、丹酚酸B的积累呈正相关。近年来,丹参毛状根已经广泛应用于丹参次生代谢的研究[6],许多诱导子都能够促进丹参次生代谢产物的积累。我们前期研究发现外源脱落酸 (Abscisic acid,ABA) 和一氧化氮 (Nitric oxide,NO) 均能够促进丹参毛状根中丹参酮的积累[7],NO信号则介导了ABA对丹参酮的诱导作用。ABA也能够显著促进丹参毛状根中酚酸类成分的积累[8],然而,NO对丹酚酸积累的调控作用及其在ABA诱导丹酚酸积累中的作用尚未有研究报道。硝普钠 (Sodium nitroprusside,SNP) 是一种NO供体,c-PTIO (2-(4-carboxy-2-phenyl)-4,4,5,5-tetramethylimidazoline-1-oxyl-3 -oxide) 为NO清除剂[9],L-NAME (NG-nitro-L- arginine methyl ester) 为NO合成抑制剂[11]。本研究将以丹参毛状根为材料,首先研究SNP对丹酚酸积累的影响,进而采用c-PTIO清除内源NO,L-NAME抑制NO积累,分析NO信号在ABA诱导丹酚酸积累中的作用。研究结果对于揭示环境促进丹参有效成分积累的形成机制具有重要意义。
1 材料与方法 1.1 诱导子与抑制剂的制备 脱落酸 (ABA) (Wolsen,中国)、硝普钠 (SNP)、L-NAME (Sigma,美国) 和c-PTIO (Amresco,美国) 分别溶于蒸馏水中,过0.22 μm 滤膜,制成母液备用。硝普钠需避光保存。
1.2 毛状根培养及处理 以本实验室丹参毛状根为材料 (由发根农杆菌ATCC15834 诱导所得),基本培养基为含有30 g/L蔗糖的6,7-V培养基。取0.2 g新鲜的丹参毛状根接种于含有50 mL液体培养基的三角瓶中,置于摇床中,110 r/min,25 ℃黑暗培养。
硝普钠浓度分别为0、25、50、100和 200 μmol/L加入培养18 d后的毛状根培养基中,c-PTIO (100 μmol/L) 和L-NAME (200 μmol/L) 分别与ABA (50 μmol/L) 同时加入培养18 d后的毛状根培养基中,以研究它们对酚酸类有效成分积累的影响。处理后第6 天采收丹参毛状根,滤纸吸干,50 ℃干燥至恒重。
1.3 酚酸类有效成分的提取与HPLC定量分析 丹参毛状根中酚酸类有效成分的提取:干燥毛状根研钵中磨碎,过0.45 mm筛,精密称取0.10 g,加入2 mL甲醇提取液,超声提取 45 min,提取液10 000 r/min离心15 min,取上清液过0.45 μm滤膜,备用。
丹酚酸B和迷迭香酸标准品购自中国食品药品鉴定所,精密称取标准品适量,以甲醇溶解,备用。分别精密吸取不同体积的丹酚酸B和迷迭香酸对照品储备液,用甲醇稀释配成系列对照品溶液,分别进样10 μL,测定峰面积积分值,以对照品溶液浓度为横坐标,峰面积为纵坐标进行回归,得到丹酚酸B和迷迭香酸线性回归方程分别为:
丹酚酸B:Y=1.3E+7X+3.0E+5,R2=0.9997;
迷迭香酸:Y=3.3E+7X-2.4E+5,R2=0.9860。
含量测定采用Waters 1525二元高效液相色谱仪,Waters 2996二极管阵列检测器进行检测,色谱柱为Waters SunFire C18 (250 mm×4.6 mm,5 μm),数据采集软件为Empower 2。色谱条件为:流速1.0 mL/min,柱温30 ℃,上样体积20 μL。检测波长270 nm,流动相乙腈和水,梯度洗脱。梯度程序:t = 0 min,40%乙腈;t = 5 min,60%乙腈;t = 20 min,60%乙腈;t = 23 min,80%乙腈;t = 25 min,100%乙腈。
1.4 RNA分离、cDNA合成及荧光实时定量分析 丹参毛状根处理24 d后采收,在液氮中研磨成粉末,总RNA采用Trizol法提取。采用PrimeScript® RT reagent Kit (TaKaRa,Tokyo,日本) 反转录合成第一链cDNA。荧光RT-PCR分析采用Brilliant Ⅱ SYBR® Green QPCR Master Mix试剂盒 (Agilent,Santa Clara,美国)。反应体积为10 μL,包括5.2 μL Brilliant Ⅱ SYBR® Green QPCR Master Mix,0.4 μL 10 μmol/L 上游引物,0.4 μL 10 μmol/L 下游引物,1.0 μL cDNA 模板和 3.0 μL无菌超纯水。反应程序为:95 ℃ 30 s;95 ℃ 15 s,58 ℃ 30 min,40个循环。实验3个重复,测定18S、PAL、TAT及RAS的基因表达量。以18S作为内参基因,进行综合分析,采用比较Ct法计算不同处理后的目的基因表达水平。计算公式为目的基因的量=,△△Ct=(Ct,目的基因-Ct,内参基因) 实验组-(Ct,目的基因-Ct,内参基因) 对照组。显著性差异分析采用DPS软件,在5%显著水平进行统计分析,不同字母 (a、b、c等) 表示差异显著,相同字母表示差异不显著。
2 结果与分析 2.1 硝普钠对丹参毛状根生长的影响 首先采用不同浓度的硝普钠处理丹参毛状根,研究毛状根生长的变化。结果如图1所示,50 μmol/L和100 μmol/L的硝普钠对丹参毛状根的生长影响不显著,而高浓度 (200 μmol/L) 以及低浓度 (25 μmol/L),对丹参毛状根生长略有抑制,干重分别降低了14%和16%,但抑制作用不显著。ABA处理对丹参毛状根的生长略有促进,干重达到0.333 g,较对照组增加了14%。ABA与c-PTIO或L-NAME联合诱导,均使毛状根的干重略有增加,分别为0.324 g和0.354 g,较对照组提高了11%和21%。c-PTIO或L-NAME单独诱导对丹参毛状根生长的影响不显著。
 |
| 图1 SNP、ABA、c-PTIO和L-NAME对丹参毛状根生长状况的影响 Fig.1 Effects of SNP and ABA,c-PTIO,L-NAME on the growth of S. miltiorrhiza hairy roots. Different letters (such as a,b,c) indicate significant difference at P ≤ 0.05 using Duncan’s multiple-range test. |
| 图选项 |
2.2 硝普钠对丹酚酸类成分积累的影响 采用不同浓度硝普钠处理丹参毛状根后,其迷迭香酸与丹酚酸B的含量如图2所示。 50 μmol/L和200 μmol/L硝普钠处理对迷迭香酸积累没有影响。而对于丹酚酸B,4种浓度硝普钠均能使其含量有不同程度的增加。其中以 100 μmol/L硝普钠处理对迷迭香酸与丹酚酸B积累的诱导效果最为显著,迷迭香酸含量达到3.181 mg/g,较对照提高了3倍,丹酚酸B的含量达到11.171 mg/g,较对照提高了4倍。研究结果表明,NO供体硝普钠能够促进丹参酚酸类成分的积累,但具有浓度依赖性。
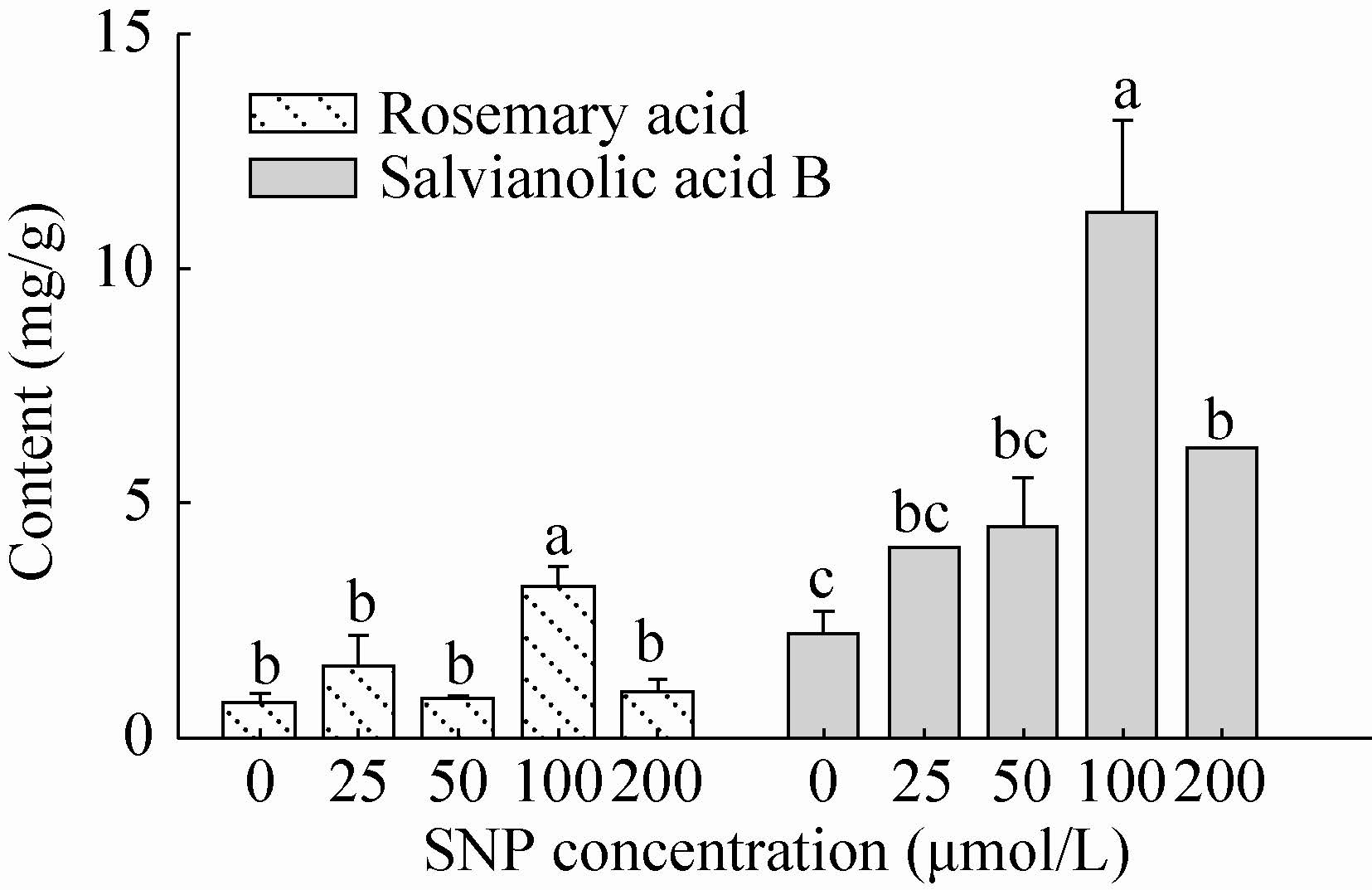 |
| 图2 SNP对丹参毛状根中酚酸类成分积累的影响 Fig.2 Effects of SNP on the accumulation of phenolic acids in S. miltiorrhiza hairy roots. Different letters (such as a,b,c) indicate significant difference at P ≤ 0.05 using Duncan’s multiple-range test. |
| 图选项 |
2.3 c-PTIO和L-NAME对ABA诱导丹酚酸类成分积累的影响 如图3所示,ABA处理能够显著促进丹参毛状根中迷迭香酸和丹酚酸B的积累,含量分别达到7.5 mg/g和20.5 mg/g,分别较对照组增加45%和40%,这与我们以前的研究结果一致。c-PTIO和L-NAME单独诱导对酚酸类成分积累影响不大,但当与ABA联合处理时则能够显著抑制ABA对丹酚酸的诱导作用。其中ABA+c-PTIO处理,迷迭香酸和丹酚酸B的含量降为5.3 mg/g和16.6 mg/g,较ABA单独诱导分别降低了31%和27%;ABA+L-NAME处理时,两者含量为4.6 mg/g和14.2 mg/g,较ABA单独诱导分别降低40%和38%。结果表明c-PTIO和L-NAME处理能够显著抑制ABA诱导丹酚酸类成分的积累,这说明NO信号很可能参与了ABA诱导酚酸类成分的积累。
 |
| 图3 ABA及c-PTIO、L-NAME对丹参毛状根中酚酸积累的影响 Fig.3 Effects of ABA,c-PTIO and L-NAME on the accumulation of phenolic acids in S. miltiorrhiza hairy roots. Different letters (such as a,b,c) indicate significant difference at P ≤ 0.05 using Duncan’s multiple-range test. |
| 图选项 |
2.4 c-PTIO和L-NAME对丹酚酸合成关键基因表达的影响 苯丙氨酸氨裂解酶 (PAL)、酪氨酸氨基转移酶 (TAT) 和迷迭香酸合酶 (RAS) 是丹参中酚酸类成分生物合成的3种关键酶。为揭示ABA对丹酚酸类成分生物合成的诱导机制,我们研究了ABA对丹参毛状根中PAL、TAT和RAS基因表达的影响。如图4所示,ABA处理后,PAL、TAT和RAS 3种基因表达显著提高,分别较对照组提升了6倍、4倍和4倍。单独使用c-PTIO或L-NAME处理后的丹参毛状根中3种关键基因表达与对照组相差不大。但当ABA与c-PTIO联合诱导时,较单独使用ABA诱导,PAL、TAT和RAS基因表达分别降低了97%、48%和79%;ABA与L-NAME联合诱导时,分别降低了72%、78%和63%。这说明,NO清除剂c-PTIO和NO合成抑制剂L-NAME均能够显著抑制ABA对丹酚酸类成分合成关键基因表达的上调作用,这进一步证明,NO信号很可能介导了ABA诱导的丹参酮的积累。
 |
| 图4 c-PTIO和L-NAME对丹参毛状根中丹酚酸合成关键基因表达量的影响 Fig.4 Effects of c-PTIO and L-NAME on the key gene expressions in S. miltiorrhiza hairy roots. Different letters (such as a,b,c) indicate significant difference at P ≤ 0.05 using Duncan’s multiple-range test. |
| 图选项 |
3 讨论 植物次生代谢产物是植物与环境相互作用的产物[12],在植物与环境的相互作用中起着非常重要的作用[13]。很多环境胁迫都能诱导次生代谢产物的积累[14],揭示环境诱导次生代谢产物积累的作用机制,有利于提高次生代谢产物含量。一氧化氮 (Nitric oxide,NO) 和脱落酸 (Abscisic acid,ABA) 是重要的逆境响应信号分子,NO在各种生物胁迫和非生物胁迫中的信号转导作用已被广泛证实,如干旱和热胁迫等[15],外源 NO 能明显缓解盐胁迫对苜蓿幼苗生长及光合作用的抑制[16]。已有研究表明,NO能够诱导植物次生代谢产物的积累,NO供体硝普钠能够显著诱导银杏愈伤组织中次生代谢产物的积累[17],促进长春花和金丝桃等植物的悬浮培养细胞中次生代谢产物的积累,调节姜黄生长,并促进其次生代谢产物的积累[18]。在红豆杉细胞培养物中,NO信号也介导了超声和脑苷脂类所诱导的紫杉醇的积累[19]。ABA由于在水分胁迫下能够快速积累而被认为是胁迫性植物激素,它在调节植物生长、发育和耐受性中起着重要作用[20]。已有研究表明ABA能够诱导植物萜类和花青素等次生代谢产物的积累[23]。我们前期研究表明ABA能够促进丹参毛状根中丹酚酸和丹参酮的积累[24],NO供体硝普钠也能促进丹参酮的积累[7]。本研究采用ABA和外源NO供体硝普钠处理丹参毛状根,进一步证实ABA能够显著促进丹酚酸的积累,同时发现SNP也能够促进丹酚酸的合成,其中以100 μmol/L SNP处理效果最为显著。
有关NO与ABA相互作用的研究也越来越多作为两种重要的信号分子,ABA和NO相互作用的研究已经成为当前研究热点之一。越来越多的证据表明,NO和ABA信号有关。在保卫细胞中,NO信号也与ABA诱导的气孔关闭有关[25]。也有证据表明,ABA能够增强保卫细胞中NO的合成,相反NO也能够促进ABA的积累[27]。在长春花细胞中,ABA和NO均参与长春碱的合成[28]。我们前期研究表明ABA能够诱导丹参毛状根中丹参酮类成分和内源NO的积累,NO清除剂 (c-PTIO) 和NO合酶抑制剂 (L-NAME) 显著抑制了ABA的诱导作用,证明NO信号在ABA诱导丹参酮的积累中起着重要作用[29]。本研究发现ABA能够显著促进丹参毛状根中迷迭香酸和丹酚酸B的积累,同时对丹酚酸合成关键酶苯丙氨酸解氨酶 (PAL)、酪氨酸氨基转氨酶 (TAT) 和迷迭香酸合成酶 (RAS) 的基因表达具有显著上调作用。为了进一步揭示NO在ABA诱导丹酚酸积累中的作用,我们分别采用c-PTIO和L-NAME与ABA联合处理丹参毛状根,发现c-PTIO和L-NAME均能够显著抑制ABA对丹酚酸以及PAL、TAT和RAS基因表达的诱导作用。而我们前期研究发现ABA能够促进内源NO的积累,c-PTIO和L-NAME也能够抑制ABA对内源NO积累的诱导作用[29]。这进一步表明,NO信号在ABA诱导丹酚酸积累中起着重要作用,ABA很可能通过NO信号通路诱导了丹酚酸类成分的生物合成。本研究结果对于揭示环境促进丹参有效成分积累的形成机制具有重要意义。
参考文献
| [1] | Yang YX, Li Y, Zhou TS. Impacts of drying methods on the main chemical ingredients and antioxidant activities in cultured hairy roots of Salvia miltiorrhiza. Anhui Med Pharm J, 2014, 18(12): 2233-2236 (in Chinese). 杨翼信, 李焱, 周铜水. 不同干燥方法对丹参毛状根有效成分含量及其抗氧化活性的影响. 安徽医药, 2014, 18(12): 2233-2236. |
| [2] | Yuan Y, Wu Q, Shi JS, et al. Advance in studies on hepatoprotective effect of Salvia miltiorrhiza and its main components. China J Chin Mat Med, 2015, 40(4): 588-593 (in Chinese). 袁媛, 吴芹, 石京山, 等. 丹参及其主要成分保肝作用的研究进展. 中国中药杂志, 2015, 40(4): 588-593. |
| [3] | Lin C, Liu ZG, Qian X, et al. Research progress of salvianolic acid B in cardiovascular diseases. Chin Pharmacol Bull, 2015, 31(4): 449-452 (in Chinese). 林超, 刘兆国, 钱星, 等. 丹酚酸B在心血管疾病中药理作用研究进展. 中国药理学通报, 2015, 31(4): 449-452. |
| [4] | Huang YX, Huang RG, Zheng XZ. Progress in the research on the pharmacological actions of rosmarinic acid. Strait Pharmaceut J, 2010, 22(5): 17-20 (in Chinese). 黄幼霞, 黄荣桂, 郑兴中. 迷迭香酸药理作用的研究进展. 海峡药学, 2010, 22(5): 17-20. |
| [5] | Di P. Exploring the biosynthetic pathway of phenolic acids and functional study of the involved genes in Salvia miltiorrhiza bunge[D]. Shanghai: Department of Pharmacy of the Long March Hospital Affiliated to Second Military Medical University, 2012: 12-15 (in Chinese). 邸鹏. 丹参酚酸类成分生源途径的探索及相关基因的克隆与功能研究[D]. 上海: 第二军医大学附属长征医院药学部, 2012: 12-15. |
| [6] | Feng K. The study on establishment of Salvia miltiorrhiza bunge hairy root culture system and elicitor’s effect[D]. Yangling: Northwest A&F University, 2010: 1-8 (in Chinese). 冯珂. 丹参毛状根培养体系建立及诱导子的作用研究[D]. 杨凌: 西北农林科技大学, 2010: 1-8. |
| [7] | Liang ZS, Yang DF, Liang X, et al. Roles of reactive oxygen species in methyl jasmonate and nitric oxide-induced tanshinone production in Salvia miltiorrhiza hairy roots. Plant Cell Rep, 2012, 31(5): 873-883. |
| [8] | Cui BM, Liang ZS, Liu Y, et al. Effects of ABA and its biosynthetic inhibitor fluridone on accumulation of penolic acids and activity of PAL and TAT in hairy root of Salvia miltiorrhiza. China J Chin Mat Med, 2012, 37(6): 754-759 (in Chinese). 崔北米, 梁宗锁, 刘岩, 等. ABA及其生物合成抑制剂对丹参毛状根酚酸类成分和关键酶的影响. 中国中药杂志, 2012, 37(6): 754-759. |
| [9] | Wang SH, Zhang Q, Li ZP, et al. Effect of nitric oxide on the production of extracellular polysaccharide and intracellular polysaccharide of Ganoderma lucidum. J Anhui Sci Technol Univ, 2013, 27(3): 25-28 (in Chinese). 王松华, 张强, 李正鹏, 等. 一氧化氮对灵芝多糖产量的影响. 安徽科技学院学报, 2013, 27(3): 25-28. |
| [10] | Zhang AY, Zhang J, Zhang JH, et al. Nitric oxide mediates brassinosteroid-induced ABA biosynthesis involved in oxidative stress tolerance in maize leaves. Plant Cell Physiol, 2011, 52(1): 181-192. |
| [11] | Omar NM, Marshall JM. Age-related changes in carotid vascular responses to adenosine and nitric oxide in the rat: in vitro and in vivo studies. J Appl Physiol, 2010, 109(2): 305-313. |
| [12] | Chao MX, Ye BP. Influence of environmental abiotic factors on plant secondary metabolite biosynthesis. Pharmaceut Biotechnol, 2013, 20(4): 365-368 (in Chinese). 巢牡香, 叶波平. 环境非生物因子对植物次生代谢产物合成的影响. 药物生物技术, 2013, 20(4): 365-368. |
| [13] | Guo YL, Zhang PY, Guo MR, et al. Secondary metabolites and plant defence against pathogenic disease. Plant Physiol J, 2012, 48(5): 429-434 (in Chinese). 郭艳玲, 张鹏英, 郭默然, 等. 次生代谢产物与植物抗病防御反应. 植物生理学报, 2012, 48(5): 429-434. |
| [14] | Wang YM, Li J, Zhang LY, et al. Research overview on accumulation of medicinal plant secondary metabolites. Central South Pharm, 2012, 10(2): 136-138 (in Chinese). 王玉明, 李锦, 张丽媛, 等. 药用植物次生代谢产物积累规律的研究概况. 中南药学, 2012, 10(2): 136-138. |
| [15] | Oz MT, Eyidogan F, Yucel M, et al. Functional role of nitric oxide under abiotic stress conditions//Khan MN, Mobin M, Mohammad F, et al. Eds. Nitric Oxide Action in Abiotic Stress Responses in Plants. Berlin Heidelberg: Springer, 2015: 21-41. |
| [16] | Zhou WH, Shi SL, Kou JT. Effects of exogenous nitric oxide on the growth and nitrogen metabolism of alfalfa seedlings under salt stress. Chin J Appl Ecol, 2012, 23(11): 3003-3008 (in Chinese). 周万海, 师尚礼, 寇江涛. 盐胁迫下外源NO对苜蓿幼苗生长及氮代谢的影响. 应用生态学报, 2012, 23(11): 3003-3008. |
| [17] | El-Beltagi HS, Ahmed OK, Hegazy AE. Molecular role of nitric oxide in secondary products production in Ginkgo biloba cell suspension culture. Not Bot Horti Agrobo, 2015, 43(1): 12-18. |
| [18] | Liu JF, Wang MY, Tang YJ, et al. Effects of salicylic acid and nitric oxide on the growth and accumulation of secondary metabolites in Curcuma longa. Acta Horticult Sin, 2015, 42(4): 741-750 (in Chinese). 刘建福, 王明元, 唐源江, 等. 水杨酸和一氧化氮对姜黄生长及次生代谢产物的影响. 园艺学报, 2015, 42(4): 741-750. |
| [19] | Wang JW, Zheng LP, Tan RX. Involvement of nitric oxide in cerebroside-induced defense responses and taxol production in Taxus yunnanensis suspension cells. Appl Microbiol Biotechnol, 2007, 75(5): 1183-1190. |
| [20] | Yoshida T, Mogami J, Yamaguchi-Shinozaki K. ABA-dependent and ABA-independent signaling in response to osmotic stress in plants. Curr Opin Plant Biol, 2014, 21: 133-139. |
| [21] | Gagné S, Cluzet S, Mérillon JM, et al. ABA initiates anthocyanin production in grape cell cultures. J Plant Growth Regul, 2011, 30(1): 1-10. |
| [22] | Chang K, Chen M, Zeng L, et al. Abscisic acid enhanced ajmalicine biosynthesis in hairy roots of Rauvolfia verticillata by upregulating expression of the MEP pathway genes. Russian J Plant Physiol, 2014, 61(1): 136-140. |
| [23] | Kai GY, Teng XJ, Cui LJ, et al. Effect of three plant hormone elicitors on the camptothecin accumulation and gene transcript profiling in Camptotheca acuminata seedlings. Int J Sci, 2014, 3: 86-95. |
| [24] | Yang DF, Ma PD, Liang X, et al. PEG and ABA trigger methyl jasmonate accumulation to induce the MEP pathway and increase tanshinone production in Salvia miltiorrhiza hairy roots. Physiol Plant, 2012, 146(2): 173-183. |
| [25] | Song XG, Yan MH, Zhu YP, et al. Effects of nitric oxide in ABA- and darkness-induced stomatal closure of V. faba. J Anhui Agri Sci, 2011, 39(2): 669-672 (in Chinese). 宋喜贵, 闫茂华, 朱艳萍, 等. 一氧化氮在脱落酸和黑暗诱导蚕豆气孔关闭中的作用. 安徽农业科学, 2011, 39(2): 669-672. |
| [26] | León J, Castillo MC, Coego A, et al. Diverse functional interactions between nitric oxide and abscisic acid in plant development and responses to stress. J Exp Bot, 2014, 65(4): 907-921. |
| [27] | Wang PC, Du YY, Hou YJ, et al. Nitric oxide negatively regulates abscisic acid signaling in guard cells by S-nitrosylation of OST1. Proc Natl Acad Sci USA, 2015, 112(2): 613-618. |
| [28] | Chen Q, Chen ZW, Lu L, et al. Interaction between abscisic acid and nitric oxide in PB90-induced catharanthine biosynthesis of catharanthus roseus cell suspension cultures. Biotechnol Progr, 2013, 29(4): 994-1001. |
| [29] | Du XH, Zhang CL, Guo WL, et al. Nitric oxide plays a central role in water stress-induced tanshinone production in Salvia miltiorrhiza hairy roots. Molecules, 2015, 20(5): 7574-7585. |
