

西北农林科技大学 生命科学学院,陕西 杨凌 712100
网络出版时间:2016-11-11
基金项目:国家自然科学基金 (No. 31270299),陕西省自然科学基金 (No. K3320215182),高校基本科研业务费基金项目 (No. Z1090201430) 资助
摘要: 转录调控是植物生长发育、逆境反应、信号转导、抗病性等一系列基因表达的最主要调控形式,转录因子是参与基因转录水平调控过程的重要反式因子。单锌指 (DNA binding with one finger,DOF) 转录因子是植物特有的一类转录因子,包含一个C2-C2 锌指结构,其N-末端保守的DOF 结构域是能与DNA 和蛋白相互作用的双重功能域,在植物生长发育过程中参与多种生物学过程。尽管已有研究报道DOF 家族基因参与植物抗逆响应,但其在禾谷类重要粮食作物中的作用机制还极不明确。本文通过对禾本科植物DOF 家族基因系统进化分析及组织表达和诱导表达分析,综述了DOF 家族基因参与植物胁迫应答方面的相关研究进展,为进一步深入了解禾本科植物抗逆机制提供重要参考。
关键词: 转录因子 抗逆性 单锌指家族基因 禾本科植物
Advances in stress response of DNA binding with one finger transcription factor family genes in graminaceous plants
Liu Wenting, Ma Tiantian, Zhou Chunju, Zang Xiao, Li Langjin, Zhang Baojun, Du Wei, Zhang Weili, Chen Kunming


College of Life Sciences, Northwest A<F University, Yangling 712100, Shaanxi, China
Received: July 31, 2015; Accepted: October 15, 2016
Supported by:National Natural Science Fund of China (No. 31270299), Natural Science Fund of Shaanxi Province (No. K3320215182), Fundamental Research Funds for the Central Universities (No. Z1090201430)
Corresponding authors:Kunming Chen. Tel: +86-29-87092262; E-mail: kunmingchen@nwsuaf.edu.cn
Abstract: Transcription factor is a key trans-acting factor to mediate stress response by regulating gene expression. Plants have developed a series of mechanisms to modulate development, stress response, signaling and disease resistance at transcription level. DNA binding with one finger (DOF), containing one C2-C2 zinc finger domain, is a special plant transcription factor. Specifically, the conserved domain at N-terminus of DOF has multiple functions, including interacting with DNA and protein, which could be involved in plant development and stress response. Although many DOF family genes are characterized in plant stress response, it is not clear if DOF genes have functions in cereal plants. In the present paper, the role of DOF family genes on cereal plants were discussed based on a comprehensive phylogenetic relationship analysis, expression profiles in different tissues and various environmental conditions. The results obtained here will provide an important reference for further understanding the mechanism of gramineous crops in stress resistance.
Key words: transcription factor stress resistance DOF family genes graminaceous plants
转录因子又称反式作用因子 (Trans-acting factor),是指能够与目的基因启动子区域的顺式作用元件 (Cis-acting element) 特异性结合并对转录有激活或抑制作用的DNA结合蛋白。典型的转录因子一般含有4个功能结构域:即DNA结合区、转录调控区 (包括激活和抑制域)、寡聚化位点及核定位信号区[1]。转录因子通过这些功能区域,在特定的时间进入细胞核内与启动子顺式作用元件或与其他转录因子的功能区域相互作用,进而调控基因的转录表达。转录因子根据其结构特性可以分为不同的基因家族,这些基因家族又可依据保守域的数目、间隔以及保守域外的功能域分为不同的亚家族[1-2]。
植物在生长发育过程中会经历各种生物及非生物胁迫,这些环境胁迫往往严重影响植物生长发育。植物响应环境胁迫的机制也极其复杂,涉及一系列在基因组、细胞和整体生理水平上的适应性改变[3]。在植物抵御各种胁迫反应中,转录因子所介导的基因表达调控网络起着重要作用,被认为是植物响应和适应逆境的关键途径之一[4-6]。在逆境条件下,植物中的许多基因被诱导或阻遏[4-5, 7-8]。许多转录因子家族,包括AM/ATAF1/CUC2 (NAC)、WRKY、MYB、锌指蛋白Cys2 (C2) His2 (H2) type zinc finger protein (ZFP)、螺旋环螺旋basic helix-loop-helix (bHLH) 和碱性亮氨酸拉链basic leucine zipper (bZIP) families等,参与对激素和逆境胁迫的响应[4-5, 7-8]。这些转录因子与特定的顺式作用元件结合,组成调控网络,特异地调控植物胁迫反应中众多抗性相关基因的表达,从而提高植物对环境胁迫的适应能力。
DOF (DNA binding with one finger) 转录因子是植物特有的一类转录因子,因其具有一个单锌指结构,因此被称为DOF。在植物生长发育过程中参与多种生物学过程,如碳氮代谢[9-10]、光响应[11-12]、花和花粉发育[13-14-15]、种子发育和萌发[16-18]、次生代谢[19-20]、保卫细胞特异基因的调控[21]、维管发育和叶片极性等[22]。最近有研究表明,DOF转录因子也参与植物逆境响应过程[23-26]。DOF家族成员众多,例如禾本科植物水稻、小麦、高粱和甘蔗中,分别具有31、31、28和26个DOF转录因子[23, 27-29]。四种禾本科植物中的116个Dof基因,依据其进化关系可分为10个不同的亚族[29],表明DOF转录因子在禾本科植物生长发育及胁迫响应中可能具有重要作用。然而,现阶段DOF家族基因参与植物尤其是禾谷类粮食作物发育调控与胁迫响应的机制还极不明确,亟待深入研究。
1 禾本科植物DOF家族基因的系统发育分析DOF蛋白在植物生长发育过程中发挥着重要的作用,目前,对Dof基因的研究越来越多。DOF转录因子系统分类对其结构和功能多样性的认识具有十分重要的意义。禾本科植物是种子植物中最有经济价值的大科,其中水稻、小麦、玉米是世界三大粮食作物,甘蔗、高粱是重要的糖料和能源C4作物,它们作为人类粮食和牲畜饲料的主要来源以及工业生产的原材料在中国被广泛种植[30]。因此,对整个禾本科作物DOF家族基因进行准确鉴定与系统发育分析,具有重要的理论与现实意义。人们首次对整个DOF家族成员进行系统分类,主要是根据拟南芥的全基因组序列预测的Dof基因及来自玉米、大麦、小麦、烟草和水稻等的部分Dof成员进行的[31]。通过分析,人们对禾本科Dof基因家族的类型、分布以及结构特点有了较全面的认识和理解。
二穗短柄草Brachypodium distachyon是第一个被测序的禾本科植物,已成为小麦、大麦等温带禾谷类研究的模式作物[32]。有人从二穗短柄草 (http://blast.brachypodium.org/) 数据库中搜集到了27个Dof转录因子家族基因,分布在不同的5条染色体上,根据系统进化分析将BdDof基因归为A、B、C和D四个亚家族,其中A和C亚家族包括22个成员,B和D亚家族分别包括3和2个成员[32]。
2003年,Lijavetzky等首次对水稻DOF家族成员进行系统分类:收集到了30个水稻Dof基因序列,它们分布于水稻11条染色体中 (11号染色体除外),其中,1号和3号染色体包含的数目最多,各含有6个Dof基因;水稻Dof基因所编码的蛋白质长度为175-551个氨基酸,DOF结构域位于其N端的20-171氨基酸之间。将水稻DOF基因家族可分为A、B、C、D四个亚家族[27]。
江海洋等[33]收集到18个玉米Dof基因,其编码的蛋白长度变化较大,从211-618氨基酸都有分布,说明玉米Dof基因的起源和进化模式复杂,功能多样,可能参与多种代谢途径的调控。另外,对玉米的Dof基因的结构域和系统进化树分析表明:玉米Dof进化树具有3个明显的分支,不同成员基因结构相似性较高,家族基因成员相对水稻和拟南芥较少。水稻和拟南芥的进化树各有4个明显的分支,家族基因成员较多,说明Dof基因在不同植物中进化模式有所不同,功能上也可能存在差异。
小麦基因组中至少存在31个Dof基因,分为4个亚家族[23]。TaDof1/TaDof10、TaDof8、TaDof9和TaDof14、TaDof30 属于Ⅰ亚家族;TaDof2、TaDof3和TaDof6、TaDof12、TaDof15属于Ⅱ亚家族;TaDof5、TaDof16、TaDof17、TaDof18、TaDof19、TaDof20、TaDof29、TaDof26和TaDof31属于Ⅲ亚家族;TaDof4、TaDof7、TaDof21、TaDof22、TaDof24、TaDof25、TaDof27和 TaDof28属于Ⅳ亚家族[23]。目前,已经克隆了2个与玉米ZmDof1同源的相关小麦Dof (WPBF和TaDof1) 基因,分析了它们在普通小麦不同组织中的表达及其在低氮条件下,植株对N的耐受性[34]。但相对而言,由于小麦测序尚未完全完成,人们对其Dof家族基因结构和功能尚缺乏较系统研究。
近年来,我们实验室在植物抗逆性及其信号调控机制研究方面进行了较为深入的研究,发现并鉴定了一批与水稻和小麦ROS代谢调控密切相关的基因和基因家族,包括DOF家族。其中水稻OsDof1 (LOC_Os02g15350.1) 的表达受干旱胁迫诱导上调表达 (图 1),表明其可能参与植物干旱逆境响应过程。
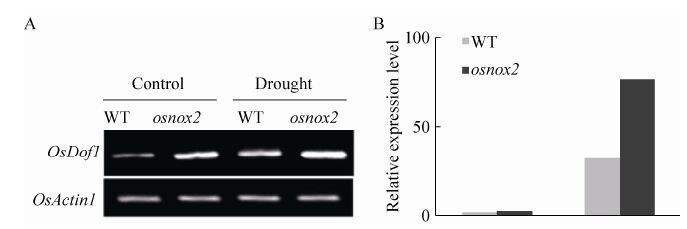 |
| 图1 水稻OsDof1基因在干旱和osnox2突变体中的上调表达 Figure1 The up-regulation expression of OsDof1 gene in wildtype rice and osnox2 mutant under drought. (A) Expression of OsDof1 gene by Semi-quantitative RT-PCR. (B) Expression of OsDof1 gene by qRT-PCR. |
| 图选项 |
为了进一步明确DOF家族基因在水稻和小麦等禾谷类作物中的功能及其逆境胁迫响应机制,我们利用公共的基因组数据库资源,收集了水稻、小麦和拟南芥3种植物DOF家族的99个氨基酸序列,系统发育分析和蛋白结构域分析结果表明,3种植物的DOF家族成员聚为5个保守的亚家族即Subs. Ⅰ-Ⅴ (图 2),其中OsDof1属于亚家族Ⅰ。与水稻OsDof1同源的两个小麦Dof基因TaDof1和TaDof2,也属于亚家族Ⅰ (图 2)。进一步利用Genevestigator数据库中小麦基因芯片数据分析表明,TaDof1和TaDof2 基因在小麦不同发育时期均有表达 (图 3A),且表现出一定的组织表达特异性,TaDof1在颖片和旗叶中高量表达而TaDof2在根中高量表达 (图 3B)。
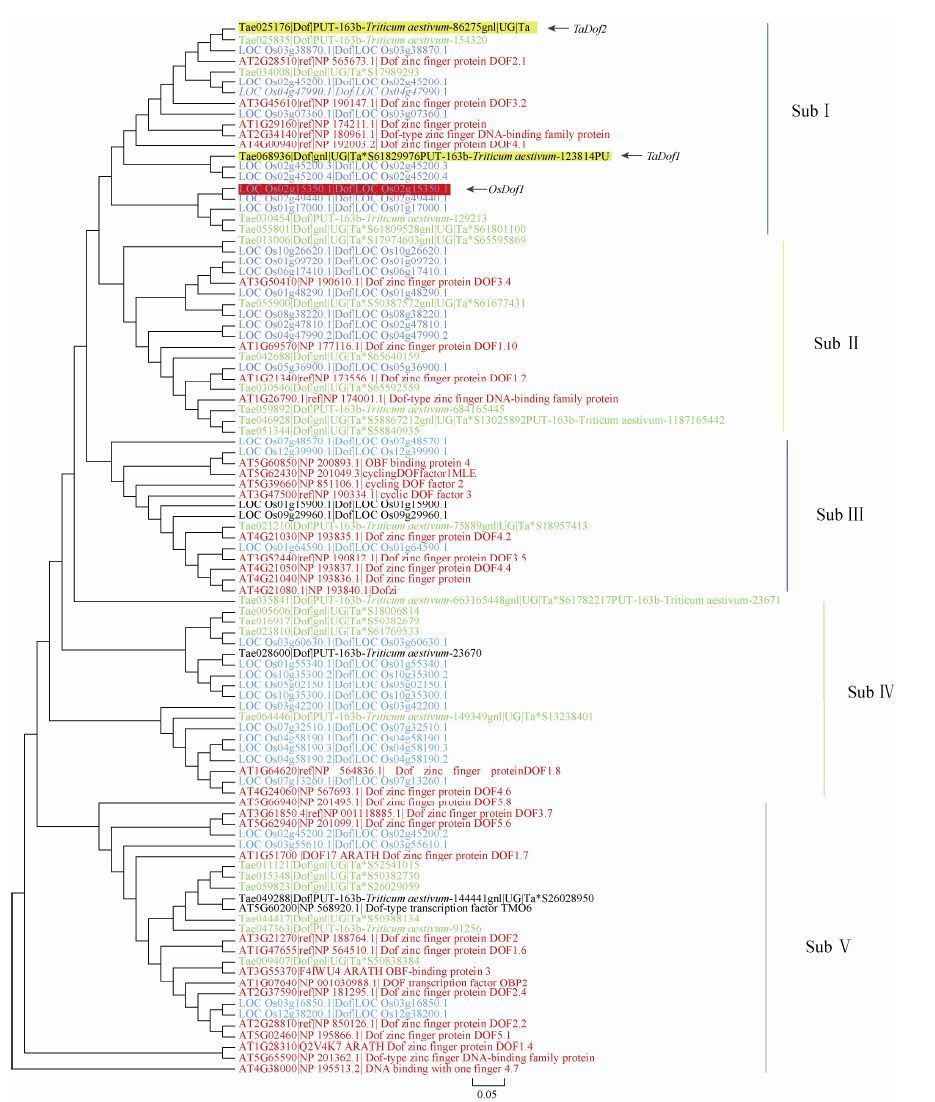 |
| 图2 植物DOF家族基因系统发育分析 Figure2 The phylogenetic tree constructed from a complete alignment of OsDof,AtDof and TaDof 99 proeins by NJ method. |
| 图选项 |
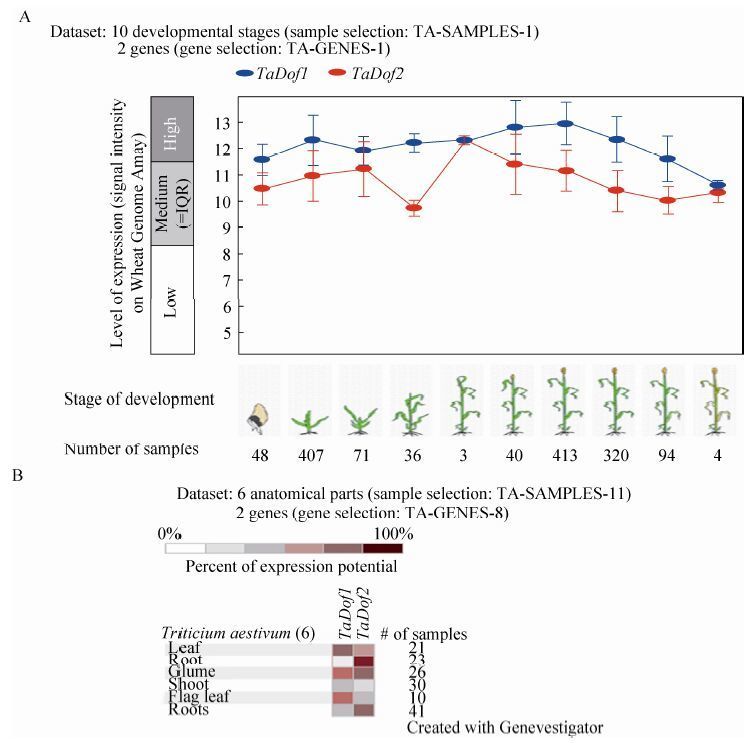 |
| 图3 利用芯片数据库Genevestigator分析TaDof1/2基因在不同发育时期和组织中的差异表达 Figure3 Differential expression profiles of TaDof1/2 genes in different development stage and tisssues with Genevestigator. (A) Expression of TaDof1/2 genes in different development stage. Note: Blue color represents Tadof1; Red color represents TaDof2. (B) Exprssion profiles of TaDof1/2 genes in different tissues. Note: color scale represents log2 expression values,white represents low level and red indicates high level of transcript abundances. |
| 图选项 |
另外,TaDof1和TaDof2基因的表达还受PEG脱水、干旱和盐胁迫的影响 (图 4)。在PEG脱水处理下,TaDof1/2在小麦根和叶子中均明显下调表达,而在盐胁迫下,其在地上部分强烈上调表达;但在干旱胁迫下,两基因的表达表现出一定的品种差异 (图 4)。这些结果初步说明TaDof1/2基因是干旱、盐等胁迫的应答基因,但其如何参与植物逆境胁迫响应,是否与植物的抗逆性相关,其表达调控机制如何等问题,有待进一步深入研究。
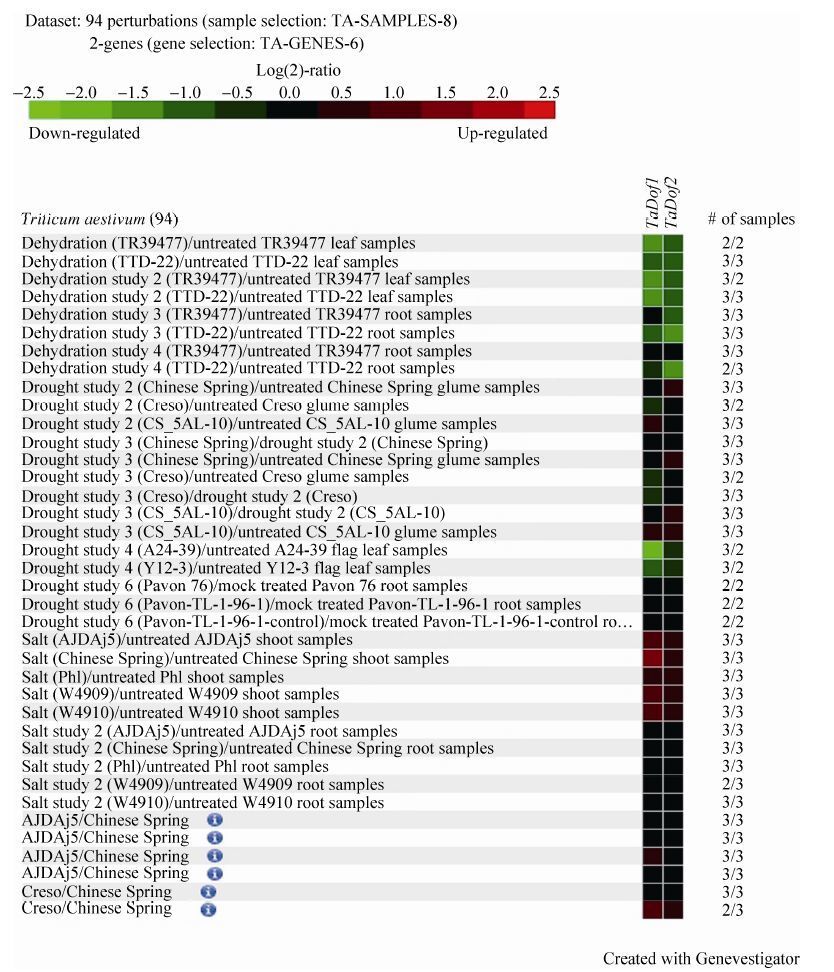 |
| 图4 利用芯片数据库Genevestigator分析小麦TaDof1/2基因在不同非生物逆境条件下的差异表达 Figure4 Differential expression profile of TaDof1/2 genes in different abiotic stress with Genevestigator. Note: color scale represents log2 expression values,green represents low level and red indicates high level of transcript abundances. |
| 图选项 |
2 禾本科植物DOF家族基因的组织表达分析基因的组织表达谱通常可以暗示该基因在相应表达部位的生物学功能[35]。EST数据及定量RT-PCR结果均表明:在禾本科植物水稻、玉米和小麦中,大部分Dof基因在各个组织或器官中都有不同程度的表达,表明这些基因可能在植物生长的各个发育时期都发挥功能。其中,部分基因特异器官和优势表达特征,可能在植物生长发育的某一个或某几个发育阶段发挥特殊功能。
周淑芬等[36]利用RT-PCR技术分析了DOF家族基因在粳稻日本晴Oryza sativa L. Japonica植株幼苗、根、茎、叶、种子等组织中的表达情况发现,在30个水稻Dof基因中,除了OsDof9在所检测的组织中没有表达外,其他Dof基因均能在1个或多个组织中差异表达,其中22个基因在3个及以上的组织中表达。依据表达水平的高低,将水稻Dof基因家族成员分为低、中、高丰度表达3大类:低丰度表达基因的相对表达量为0-5,包括OsDof1、OsDof4、OsDof6、OsDof13、OsDof14、OsDof15、OsDof21、OsDof19、OsDof20、OsDof25和OsDof29共11个成员;中丰度表达基因的相对表达量为5-50,也有11个成员,包括OsDof3、OsDof5、OsDof8、OsDof12、OsDof16、OsDof17、OsDof18、OsDof22、OsDof23、OsDof26和OsDof30;高丰度表达基因7个成员,包括OsDof2、OsDof7、OsDof10、OsDof11、OsDof24、OsDof27和OsDof28。另外他们还发现,在这些表达的Dof基因中,OsDof 9基因具有器官特异或优势表达特征,OsDof6和OsDof15在根中特异表达,OsDof7在种子特异表达,OsDof8在种子中优势表达,OsDof2在苗中优势表达,而OsDof11、OsDof24、OsDof27和OsDof30在叶中优势强表达,显示这些基因在水稻特定器官的发育与调节中发挥重要功能。然而,目前仅有两个水稻特异或优势表达DOF基因的生物学功能得到较深入的研究,分别为种子特异表达基因OsDof7 (RPBF) 和叶中优势表达基因OsDof11。OsDof7可能通过赤霉素信号途径在水稻种子萌发过程中发挥重要调控作用[37],而OsDof11在长日照条件下通过调控长日控制因子如Hd3a和OsMADS14的表达水平而促进水稻开花[38]。
ZmDof1是首个从玉米中分离的DOF蛋白,定位于细胞核,可与磷酸烯醇式丙酮酸酶PEPC (Phosphoenolpyruvate carboxylase) 基因的启动子区域结合,提高植物的C4光合效率;而另一个DOF转录因子ZmDof2,可阻遏PEPC基因的表达,降低C4光合效率[39]。ZmDof1和ZmDof2在玉米营养器官包括根、茎、叶中都有表达[40],且ZmDof1能够促进碳同化和促进植物在低氮环境条件下的生长[41]。最近的研究发现,ZmDof1基因不仅在营养器官中表达,而且也能在花和花粉器官中表达,调控花粉特异基因的表达,在光合作用和花粉发育中有双重作用[15]。
如上所述,小麦的31个DOF家族基因可归为4个亚家族。总体而言,属于Ⅰ亚家族的TaDof1/TaDof10、TaDof8、TaDof9和TaDof14,除了TaDof9在胚乳中高表达外,其他基因均在根和叶中高量表达。而属于Ⅱ亚家族的TaDof2、TaDof3和TaDof6均在胚乳中表达量高,类似于TaDof9在胚乳中的表达。TaDof2、TaDof3和TaDof6与WPBF同源[35],WPBF是一类胚乳特异表达基因的正调控因子,其表达受到赤霉素 (GA) 的诱导[42]。TaDof5、TaDof6、TaDof18、TaDof19和TaDof26属于Ⅲ亚家族,这一亚家族的基因主要在营养器官中高表达,但是TaDof26在胚乳中表达量高。而属于Ⅳ亚家族TaDof4、TaDof7、TaDof21、TaDof22、TaDof24、TaDof25和TaDof27均在根和茎中高量表达。此外,TaDof1/2在根中表达量高,而TaDof15在穗中表达量高。然而,小麦Dof基因的具体生物学功能,尚缺乏深入研究。
3 禾本科植物DOF家族基因的诱导表达分析自然界中的植物在整个生育期内不可避免受到多种不良环境变化的影响,有时甚至遭受严酷的环境胁迫。逆境胁迫主要包括生物胁迫和非生物胁迫两大类。在农业生产中生物胁迫主要包括病害、虫害、杂草等,而非生物胁迫主要包括干旱、水涝、低温、高温、盐碱等。这些逆境胁迫是影响和限制植物正常生长发育、并造成作物严重减产的主要因素之一。许多转录因子在植物响应干旱、激素、高盐、病原等胁迫反应中起重要作用。现有研究表明,DOF蛋白作为转录激活子或抑制子可参与调节植物的光、激素及防御反应等[43],表明其在植物逆境胁迫响应中具有重要功能。对禾本科植物Dof基因的逆境响应表达谱进行分析,可为进一步了解并明确Dof基因的功能及其对逆境胁迫响应机制提供有价值的线索,为阐明Dof基因与作物抗逆性之间的关系及其分子调控机制提供参考。
研究表明,31个小麦Dof基因中,17个基因能够响应干旱胁迫。这些干旱响应基因,除了TaDof14和TaDof15基因在干旱条件下的表达明显上调外,其余15个下调[23],表明多数Dof基因可能负向调控植物的干旱适应性。另外,基因芯片分析数据表明,在热胁迫时,TaDof5、TaDof17和TaDof19随着胁迫时间的推移,其表达均明显下调;而在盐胁迫处理下,只有TaDof1在茎中有明显的上调表达,其余的Dof基因的表达变化很小或者不表达,表明TaDof1基因可能与抗盐适应性密切相关[23]。此外研究还发现,TaDof1参与氮同化过程,能诱导氮同化相关基因如GS和GOGAT的表达[44]。
周淑芬等[36]在水稻中的研究表明,7个Dof基因,包括OsDof2、OsDof5、OsDof12、OsDof22、OsDof24和OsDof27,受ABA诱导上调表达,而9个基因,包括OsDof1、OsDof3、OsDof8、OsDof11、OsDof13、OsDof17、OsDof18、OsDof20和OsDof26,受ABA诱导下调表达,其中OsDof2、OsDof3、OsDof11、OsDof12、OsDof27和OsDof24基因受ABA影响强烈。在NaCl逆境下,8个基因的表达受到诱导,10个基因表达受到抑制,其中OsDof27、OsDof11、OsDof2、OsDof24、OsDof5诱导表达丰度及上调倍数较高。在PEG处理中,30个基因中仅有OsDof11、OsDof2和OsDof10三个基因的表达受到显著抑制,而多达20个基因的表达被明显上调,其中4个基因 (OsDof2、OsDof27、OsDof11和OsDof10) 上调倍数较高。另外,定量RT-PCR分析结果表明,水稻Dof基因在幼苗期正常生长、暗处理、ABA、NaCl和PEG等胁迫条件下,除了2个基因 (OsDof9和OsDof25) 的表达不受任何胁迫的影响和1个基因 (OsDof10) 只受PEG调节外,其他27个基因的表达水平在2种及以上胁迫条件下均发生了不同程度的上调或下调,暗示水稻Dof基因广泛参与各种胁迫的应答反应及其逆境信号传递与调控,但其具体的作用机制尚不明确,需进一步的深入研究。
4 展望转录因子不但参与植物对生物与非生物胁迫的应答,同时还作为信号分子直接调控植物的生长发育。转录因子往往通过影响下游一系列基因的表达来调控发育过程或响应环境胁迫,因此往往是发育调控的“开关分子”,相对于其他单基因的操纵,人为控制某些关键转录因子的表达更能影响植物在胁迫下的生长和产量。随着转录因子功能研究技术与方法的日益成熟,众多具有重要生物学功能的转录因子将得到深入研究,这为通过操纵转录因子提高农作物产量和胁迫抗性提供了可能。尤其是在气候灾害频繁威胁农作物生产和产量的今天,通过转录因子对农作物进行改良,具有极其重要的现实意义。通过基因工程手段导入某些转录因子,有望通过触发一系列信号传递过程,激发相关转录因子与相应的顺式作用元件的结合,从而启动特定基因的表达以对内、外界信号作出适应性反应。
自从1993年首次从玉米中鉴定报道第一个植物DOF转录因子以来[45],许多的植物Dof基因被克隆鉴定或从基因组数据库中预测出来。从单细胞藻类到高等植物,都有Dof基因被鉴定的报道。在苔藓植物小立碗藓中预测有19个Dof基因,绿藻植物莱因衣藻中预测有1个Dof基因[46],蕨类植物中预测有8个Dof基因。在高等植物中,裸子植物火炬松中被预测有8个Dof基因[47];拟南芥基因组中存在37个 (其中AtDofl.9 随后被证明是一个假基因) [24, 31]、水稻中30个[27]、白杨中41个[48]、大麦中28个[47]、大豆中31个[16]、面包小麦中18个[23]、玉米中18个[33]和高粱中28[28];另外,在穇子[49]、海岸松[50]、甘薯[51]、马铃薯[52]、豌豆[53]和烟草[54]等植物中也鉴定到了多个Dof基因。
尽管已有研究表明DOF广泛参与植物生长发育调控过程,且部分Dof基因被克隆。比如,在烟草Nicotian tabacum cv. Xanthi中,有研究报道,BBF1 (属于烟草中的Dof基因) 涉及到许多防御相关基因的转录调控,BBF1超表达能够促进了活性氧的产生和防御相关基因的表达[55]。在白菜Brassica rapa L. ssp. Pekinensis 中,已鉴定到了76个Dof家族成员,其中9个BraDof基因进行冷、热、盐和干旱非生物逆境胁迫处理,大部分基因在4种胁迫处理下均上调表达,显示BraDof转录因子通过复杂的作用机制在植物对非生物胁迫抗性中发挥重要作用[25]。在西红柿中,与拟南芥Cycling DOF Factors (CDFs) 同源的西红柿SlCDF1和SlCDF3主要参与光周期开花响应和非生物逆境抗性响应,与野生型植物相比,转基因SlCDF1和SlCDF3植株抗盐和抗旱性提高[26]。在转基因水稻中,超表达OsDof12促进早期开花[56];OsDof3基因参与赤霉素调控的目的基因的表达[37]。在大麦中,HvDof24、HvDof23和HvDof17 3个HvDof基因参与调控赤霉素和细胞分裂素之间的平衡[57, 58, 59]。这些研究证明,植物的DOF家族基因参与植物非生物逆境胁迫应答过程,在植物抗逆中具有重要作用。随着基因组学和生物信息学的发展及对DOF蛋白的深入研究,越来越多的DOF蛋白将会被发现、鉴定与克隆,这对阐释DOF蛋白参与作物逆境胁迫响应及在抗逆性中的作用和地位具有重要意义。
如前所述,目前人们对禾本科植物DOF蛋白参与植物生物与非生物逆境响应的机制还极不清楚,相关研究大多仍局限在表达部位、亚细胞定位和胁迫诱导检测等方面,对其参与逆境应答的方式、作用机制及分子调控途径等仍未阐明,人们对其功能的认识依然十分有限。因此,禾本科粮食作物DOF家族基因的逆境应答机制的阐明,将是未来研究的重要方向之一,具有重要科学与现实意义。
参考文献
| [1] | Liu LS, White MJ, MacRae TH. Transcription factors and their genes in higher plants: functional domains, evolution and regulation.Eur J Biochem, 1999, 262(2): 247(in Chinese). |
| [2] | Cai XF, Zhang YY, Zhang JH, et al. Advances in research on function of the Dof gene family in plant.Plant Physiol J, 2013, 49(1): 1–12(in Chinese). 蔡晓锋, 张余洋, 张俊红, 等. 植物Dof 基因家族功能研究进展.植物生理学报,2013,49(1):1–12. |
| [3] | Arkinson NJ, Urwin PE. The interaction of plant biotic and abiotic stresses, from genes to the field.J Exp Bot, 2012, 63(10): 3523(in Chinese). |
| [4] | Yamaguchi-Shinozaki K, Shinozaki K. Transcriptional regulatory networks in cellular responses and tolerance to dehydration and cold stresses.Annual Rev Plant Biol, 2006: 781–803(in Chinese). |
| [5] | Nakashima K, Ito Y, Yamaguchi-Shinozaki K. Transcriptional regulatory networks in response to abiotic stresses in Arabidopsis and grasses.Plant Physiol, 2009: 88–95(in Chinese). |
| [6] | Kodaira KS, Qin F, Phan Tran LS, et al. Arabidopsis Cys2/His2 zinc-fingerproteins AZF1 and AZF2 negatively regulate abscisic acidrepressive and auxin-inducible genes under abiotic stress conditions.Plant Physiol, 2011, 157(2): 742–756(in Chinese). |
| [7] | Golldack D, Lüking I, Yang O. Plant tolerance to drought and salinity: stress regulating transcription factors and their functional significance in the cellular transcriptional network.Plant Cell Rep, 2011, 30(8): 1383–1391(in Chinese). |
| [8] | Lindemose S, O’Shea C, Jensen MK, et al. Structure, function and networks of transcription factors involved in abiotic stress responses.Int J Mol Sci, 2013, 14(3): 5842–5878(in Chinese). |
| [9] | de Dios Barajas-López J, Tezycka J, Travaglia CN, et al. Expression of the chloroplast thioredoxins f and m is linked to short-term changes in the sugar and thiol status in leaves of Pisum sativum.J Exp Bot, 2012, 63(13): 4887–4900(in Chinese). |
| [10] | Yanagisawa S, Akiyama A, Kisaka H, et al. Metabolic engineering with Dof1 transcription factor in plants: improved nitrogen assimilation and growth under low-nitrogen conditions.Proc Natl Acad Sci USA, 2004, 101(20): 7833–7838(in Chinese). |
| [11] | Imaizumi T, Schultz TF, Harmon FG, et al. FKF1 F-box protein mediates cyclic degradation of a repressor of CONSTANS in Arabidopsis.Science, 2005, 309(5732): 293–297(in Chinese). |
| [12] | Sawa M, Nusinow DA, Kay SA, et al. FKF1 and GIGANTEA complex formation is required for day-length measurement in Arabidopsis.Science, 2007, 318(5848): 261–265(in Chinese). |
| [13] | Iwamoto M, Higo K, Takano M. Circadian clockand phytochrome-regulated Dof-like gene, Rdd1, is associated with grain size in rice.Plant Cell Environ, 2009, 32(5): 592–603(in Chinese). |
| [14] | Li CL, Lü J, Zhao X, et al. TaCHP, a wheat zinc finger protein gene down-regulated by abscisic acid and salinity stress plays a positive role in stress tolerance.Plant Physiol, 2010, 154(1): 211–221(in Chinese). |
| [15] | Chen XY, Wang DX, Liu C, et al. Maize transcription factor Zmdof1 involves in the regulation of Zm401 gene.Plant Growth Regul, 2012, 6(3): 271–284(in Chinese). |
| [16] | Wang HW, Zhang B, Hao YJ, et al. The soybean Dof-type transcription factor genes, GmDof4 and GmDof11, enhance lipid content in the seeds of transgenic Arabidopsis plants.Plant J, 2007, 52(4): 716–729(in Chinese). |
| [17] | Mena M, Vicente-Carbajosa J, Schmidt RJ, et al. An endosperm-specific DOF protein from barley, highly conserved in wheat, binds to and activates transcription from the prolaminbox of a native B-hordein promoter in barley endosperm.Plant J, 1998, 16(1): 53–62(in Chinese). |
| [18] | Dong GQ, Ni ZF, Yao YY, et al. Wheat Dof transcription factor WPBF interacts with TaQM and activates transcription of an alpha-gliadin gene during wheat seed development.Plant Mol Biol, 2007, 63(1): 73–84(in Chinese). |
| [19] | Skirycz A, Jozefczuk S, Stobiecki M, et al. Transcription factor AtDOF4; 2 affects phenylpropanoid metabolism in Arabidopsis thaliana.New Phytol, 2007, 175(3): 425–438(in Chinese). |
| [20] | Skirycz A, Reichelt M, Burow M, et al. DOF transcription factor AtDof1.Plant J, 2006, 47(1): 10–24(in Chinese). |
| [21] | Cominelli E, Galbiati M, Albertini A, et al. DOF-binding sites additively contribute to guard cell-specificity of AtMYB60 promoter.BMC Plant Biol, 2011: 162(in Chinese). |
| [22] | Kim HS, Kim SJ, Abbasi N, et al. The DOF transcription factor Dof5.Plant J, 2010, 64(3): 524–535(in Chinese). |
| [23] | Shaw LM, McIntyre CL, Gresshoff P M. Members of the Dof transcription factor family in Triticum aestivum are associated with light-mediated gene regulation.Funct Integr Genomics, 2009, 9(4): 485–498(in Chinese). |
| [24] | Malviya N, Gupta S, Singh VK, et al. Genome wide in silico characterization of Dof gene families of pigeonpea (Cajanus cajan (L) Millsp.Mol Biol Rep, 2015, 42(2): 535–552(in Chinese). |
| [25] | Ma J, Li MY, Wang F, et al. Genome-wide analysis of Dof family transcription factors and their responses to abiotic stresses in Chinese cabbage.BMC Genomics, 2015: 33(in Chinese). |
| [26] | Corrales AR, Nebauer SG, Carrillo L, et al. Characterization of tomato Cycling Dof Factors reveals conserved and new functions in the control of flowering time and abiotic stress responses.J Exp Bot, 2014, 65(4): 995–1012(in Chinese). |
| [27] | Lijavetzky D, Carbonero P, Vicente-Carbajosa J. Genome-wide comparative phylogenetic analysis of the rice and Arabidopsis DOF gene families.BMC Evolutionary Biology, 2003: 17(in Chinese). |
| [28] | Kushwaha H, Gupta S, Singh VK, et al. Genome wide identification of Dof transcription factor gene family in Sorghum and its comparative phylogenetic analysis with rice and Arabidopsis.Mol Biol Rep, 2011, 38(8): 5037–5053(in Chinese). |
| [29] | Gupta S, Kushwaha H, Singh VK, et al. Genome wide in silico characterization of Dof transcription factor gene family of sugarcane and its comparative phylogenetic analysis with Arabidopsis, rice and sorghum.Sugar Tech, 2014, 16(4): 372–384(in Chinese). |
| [30] | Aragón C, Carvalho LC, González J, et al. Sugarcane (Saccharum sp.Tropic Plant Biol, 2009, 2(1): 38–50(in Chinese). |
| [31] | Yanagisawa S. The Dof family of plant transcription factors.Trends Plant Sci, 2002, 7(12): 555–560(in Chinese). |
| [32] | The International Brachypodium Initiative: Genome sequencing and analysis of the model grass Brachypodium distachyon. Nature, 2010, 463(11): 763–768.Brachypodium distachyon. Nature, 2010, 463(11): 763–768(in Chinese). |
| [33] | Jiang HY, Luo C, Jiang T, et al. Genome-wide analysis of Dof transcription factor family genes in maize.China J Bioinform, 2010, 8(3): 198–201(in Chinese). 江海洋, 骆晨, 江腾, 等. 玉米Dof 转录因子家族基因的全基因组分析.生物信息学,2010,8(3):198–201. |
| [34] | Dong GQ. Study on function of transcription factor WPBF and TaDof1 in wheat[D]. Beijing: China Agricultural University, 2006 (in Chinese). 董国清. 普通小麦转录因子WPBF 和TaDof1 功能研究[D]. 北京: 中国农业大学, 2006. |
| [35] | Ravel C, Praud S, Murigneux A. Single-nucleotide polymorphism frequency in a set of selected lines of bread wheat ( Triticum aestivum L.Genome, 2006, 49(9): 1131–1139(in Chinese). |
| [36] | Zhou SF, Yan JW, Liu HQ, et al. Transcriptional profiling analysis of OsDof gene family in various rice tissues and their expression characteristics under different stresses.Mol Plant Breed, 2012, 10(6): 635–643(in Chinese). 周淑芬, 颜静宛, 刘华清, 等. 水稻DOF 基因家族的组织表达谱及胁迫诱导表达特征分析.分子植物育种,2012,10(6):635–643. |
| [37] | Washio K. Identification of Dof proteins with implication in the gibberellin-regulated expression of a peptidase gene following the germination of rice grains.Biochim Biophys Acta (BBA): Gene Struct Exp, 2001, 1520(1): 54–62(in Chinese). |
| [38] | Li DJ, Yang CH, Li XB, et al. Functional characterization of rice OsDof12.Planta, 2009, 229(6): 1159–1169(in Chinese). |
| [39] | Noguero M, Atif RM, Ochatt S, et al. The role of the DNA-binding One Zinc Finger (DOF) transcription factor family in plants.Plant Sci, 2013: 32–45(in Chinese). |
| [40] | Yanagisawa S. Dof1 and Dof2 transcription factors are associated with expression of multiple genes involved in carbon metabolism in maize.Plant J, 2000, 21(3): 281–288(in Chinese). |
| [41] | Yanagisawa S. Dof domain proteins: plant-specific transcription factors associated with diverse phenomena unique to plants.Plant Cell Physiol, 2004, 45(4): 386–391(in Chinese). |
| [42] | Vicent-Carbajosa J, Moose SP, Parsons RL, et al. A maize zinc-finger protein binds the prolamin box in zein gene promoters and interacts with the basic leucine zipper transcriptional activator Opaque2.Proc Natl Acad Aci USA, 1997: 7685–7690(in Chinese). |
| [43] | Shinozaki K, Yamaguchi-Shinozaki K, Seki M. Regulatory network of gene expression in the drought and cold stress responses.Curr Opin Plant Biol, 2003, 6(5): 410–417(in Chinese). |
| [44] | Kumar R, Taware R, Gaur VS, et al. Influence of nitrogen on the expression of TaDof1 transcription factor in wheat and its relationship with photosynthetic and ammonium assimilating efficiency.Mol Biol Rep, 2009: 2209–2220(in Chinese). |
| [45] | Yanagisawa S, Izui K. Molecular cloning of two DNAbinding proteins of maize that are structurally different but interact with the same sequence motif.J Biol Chem, 1993: 16028–16036(in Chinese). |
| [46] | Shigyo M, Tabei N, Yoneyama T, et al. Evolutionary processes during the formation the plant-specific Dof transcription factor family.Plant Cell Physiol, 2007, 48(1): 179–185(in Chinese). |
| [47] | Moreno-Risueno MA, Martinez M, Vicente-Carbajosa J, et al. The family of DOF transcription factors: from green unicellular algae to vascular plants.Mol Genet Genomics, 2007: 379–390(in Chinese). |
| [48] | Yang X, Tuskan GA, Cheng ZM. Divergence of the Dof gene families in poplar, Arabidopsis, and rice suggests multiple modes of gene evolution after duplication.Plant Physiol, 2006: 820–830(in Chinese). |
| [49] | Gupta N, Gupta AK, Kumar A. Spatial distribution pattern analysis of Dofl transcription factor in different tissues of three Eleusine coracana genotypes differing in their grain colour, yield and photosynthetic efficiency.Mol Biol Rep, 2012, 39(3): 2089–2095(in Chinese). |
| [50] | Rueda-Lopez M, Crespillo R, Canovas FM, et al. Differential regulation of two glutamine synthetase genes by a single Dof transcription factor.Plant J, 2008, 56(1): 73–85(in Chinese). |
| [51] | Tanaka M, TakahataY, Nakayama H, et al. Altered carbohydrate metabolism in the storage roots of sweet potato plants overexpressing the zinc finger transcription factor.Planta, 2009, 230(4): 737–746(in Chinese). |
| [52] | Plesch G, Ehrhardt T, Mueller-Roeber B. Involvement of TAAAG elements suggests a role for Dof transcription factors in guard cell-specific gene expression.Plant J, 2001, 28(4): 455–464(in Chinese). |
| [53] | Seki H, Nakamura N, Marutani M, et al. Molecular cloning of cDNA for a novel pea Dof protein, PsDofl, and its DNA-binding activity to the promoter of PsDofl gene.Plant Biotechnol, 2002, 19(4): 251–260(in Chinese). |
| [54] | De Paolis A, Sabatini S, De Pascalis L, et al. A ro1B regulatory factor belongs to a new class of single zinc finger plant proteins.Plant J, 1996, 10(2): 215–223(in Chinese). |
| [55] | Mayumi T, Md. A H, Shota O, Keiko N,et al. Overexpression of a tobacco Dof transcription factor BF1stimulates the transcription of the tobacco mosaic virus resistance gene N and defense-related responses including ROS production. Plant Biotechnol, 2013, 30, 37-46. |
| [56] | Washio K. Functional dissections between GAMYB and Dof transcription factors suggest a role for protein-protein associations in the gibberellin-mediated expression of the RAmy1A gene in the rice aleurone.Plant Physiol, 2003, 133(2): 850–863(in Chinese). |
| [57] | Diaz I, Vicente-Carbajosa J, Abraham Z, et al. The GAMYB protein from barley interacts with the DOF transcription factor BPBF and activates endosperm-specific genes during seed development.Plant J: Cell Mol Biol, 2002, 29(4): 453–464(in Chinese). |
| [58] | Diaz I, Martinez M, Isabel-LaMoneda I, et al. The DOF protein, SAD, interacts with GAMYB in plant nuclei and activates transcription of endospermspecific genes during barley seed development.Plant J: Cell Mol Biol, 2005, 42(5): 652–662(in Chinese). |
| [59] | Moreno-Risueno MA, Diaz I, Carrillo L, et al. The HvDOF19 transcription factor mediates the abscisic acid-dependent repression of hydrolase genes in germinating barley aleurone.Plant J: Cell Mol Biol, 2007, 51(3): 352–365(in Chinese). |
