

1 辽宁医学院 生物化学与分子生物学教研室,辽宁 锦州 121000
2 辽宁医学院 发育生物学教研室,辽宁 锦州 121000
3 东北师范大学 昆虫脑神经生物学实验室,吉林 长春 130024
基金项目:国家自然科学基金 (No. 31071912),辽宁省大学生创新训练计划项目 (No. 201210160015) 资助
摘要: 苯丙氨酸羟化酶 (PAH) 是芳香族氨基酸羟化酶家族 (AAAHs) 的一员,催化苯丙氨酸 (Phe) 转化为酪氨酸 (Tyr)。运用Western blotting技术检测沙蚕PAH免疫原性。制作沙蚕头部石蜡切片,运用免疫组织化学技术,检测PAH蛋白表达定位情况。解剖剥离沙蚕脑组织,提取总RNA,运用RT-PCR技术克隆pah基因片段,构建质粒并转化入大肠杆菌中扩增,挑单一均匀菌落培养,双酶切鉴定后测序并比对同源性。Western blotting结果表明pah表达的蛋白存在于沙蚕脑内,免疫组化标记技术结果表明苯丙氨酸羟化酶主要分布在日本刺沙蚕前脑中腹侧、中脑背侧和两侧。RT-PCR结果表明沙蚕脑内存在苯丙氨酸羟化酶基因,且与多种动物pah具有同源性。在蛋白质和核酸水平鉴定了低等环节动物日本刺沙蚕脑组织内苯丙氨酸羟化酶的存在,为进一步研究无脊椎动物中枢神经系统内芳香族氨基酸羟化酶的基因分化奠定基础。
关键词: 日本刺沙蚕 苯丙氨酸羟化酶 免疫组织化学 RT-PCR
The expression of phenylalanine hydroxylase in the brain of ragworm Neanthes japonica (Polychaeta, Annelida)
Ren Guimin1, Dong Zhe1, Liu Chao2, Liu Yimeng2, Luan Zhidong2, Liu Qi3, Bao Xuexiang3, Wang Shun1


1 Department of Biochemistry and Molecular Biology, School of Basic Medical Sciences, Liaoning Medical University, Jinzhou 121000, Liaoning, China;
2 Department of Developmental Biology, School of Basic Medical Sciences, Liaoning Medical University, Jinzhou 121000, Liaoning, China;
3 Laboratory of Insect Brain Biology, Northeast Normal University, Changchun 130024, Jilin, China
Received: December 24, 2015; Accepted: March 3, 2016
Supported by:National Natural Science Foundation of China (No. 31071912), College Students' Innovative Training Program Foundation of Liaoning Province (No. 201210160015)
Corresponding authors:Shun Wang. Tel: +86-416-4673253; E-mail: 284476696@qq.com
Abstract: Phenylalanine hydroxylase (PAH) is a member of aromatic amino acid hydroxylase (AAAHs) family, and catalyze phenylalanine (Phe) into tyrosine (Tyr). Using immunological and RT-PCR methods to prove the existence of phenylalanine hydroxylase (PAH) gene in the brain of Neanthes japonica in protein and nucleic acid level. Using Western blotting to detect the pah immunogenicity of Neanthes japonica. Making paraffin sections and using immunohistochemical technique to identify the presence and distribution of the phenylalanine hydroxylase gene in the brain of Neanthes japonica. Clone pah gene from the brain of Neanthes japonica by RT-PCR, constructing plasmid and transferring into E. coli to amplification, picking a single homogeneous colony, double digesting then making sequence and comparing homology. Western blotting results showed that the expression of the protein is present in Neanthes japonica brain, immunohistochemistry technique results showed that phenylalanine hydroxylase mainly expressed in abdominal of forebrain, dorsal and sides of midbrain. RT-PCR technique results showed that the phenylalanine hydroxylase exist in the brain of Neanthes japonica and has a high homology with others animals. PAH is present in the lower organisms Neanthes japonica, in protein and nucleic acid level. Which provide the foundation for further study the evolution of aromatic amino acid hydroxylase genes in invertebrate.
Key words: Neanthes japonica phenylalanine hydroxylase immunohistochemistry RT-PCR
含有芳香环的酪氨酸 (Tyrosine,Tyr)、苯丙氨酸 (Phenylalanine,Phe) 和色氨酸 (Tryptophan,Trp) 统称作芳香族氨基酸[1],对芳香族氨基酸具有羟化活力的酶通称作芳香族氨基酸羟化酶[2]。依据羟化作用底物的不同将芳香族氨基酸羟化酶分为3种,即苯丙氨酸羟化酶 (Phenylalanine hydroxylase,PAH)、色氨酸羟化酶 (Tryptophan hydroxylase,TPH) 和酪氨酸羟化酶 (Tyrosine hydroxylase,TH),这3种酶组成芳香族氨基酸羟化酶家族[3-5] (Aromatic amino acid hydroxylases,AAAHs)。苯丙氨酸羟化酶作为芳香族氨基酸羟化酶家族的一员,主要催化苯丙氨酸转化为酪氨酸[6],是苯丙氨酸代谢过程中的关键酶和限速酶。人类 (Human) PAH基因与重要代谢疾病苯丙酮尿症 (Phenylketonuria,PKU) 等疾病密切相关[7-10],线虫Nematode的PAH基因与表皮的黑色素合成有关[11],果蝇Nematode PAH基因与表皮硬化、眼色素合成以及神经活动有关[12-13],埃及伊蚊Aedes aegypti PAH基因与防御免疫黑化有关[14]。研究结果表明苯丙氨酸羟化酶在人体及动物中具有重要作用。
在对无脊椎动物芳香族氨基酸羟化酶基因进化的研究中,目前认为酪氨酸羟化酶首先从芳香族氨基酸羟化酶基因家族中分化出来[15],而后苯丙氨酸羟化酶才与色氨酸羟化酶分化开,形成3种具有独立功能的酶[16]。目前研究表明PAH和TPH在节肢动物门已经分化成各自独立的酶[17],但两者是否在更低等生物中分化成独立的酶,还没有明确的证据。本课题采用Western blotting技术、免疫组化标记技术和RT-PCR技术,对在进化上比节肢动物更低等的环节动物的典型代表动物日本刺沙蚕Neathes japonicai脑内PAH的存在、表达定位和克隆进行分析,以期在蛋白质和核酸水平上证明在环节动物中存在独立的PAH基因,为芳香族氨基酸羟化酶基因的分化研究提供依据。
1 材料与方法1.1 材料兔抗PAH多克隆抗体、β-actin兔抗多克隆抗体、HRP标记的山羊抗兔IgG二抗购自南京恩晶生物公司,免疫组化试剂盒、DAB显色试剂盒购自福建迈新生物公司,树脂石蜡 (Colophony-Paraffin,CP) 包埋剂为东北师范大学暴学祥教授提供,3′ RACE PCR试剂盒、大肠杆菌Escherichia coli Competent Cell DH5α、LA Tap酶、pHSG396载体、T4 DNA连接酶、限制性内切酶XbaⅠ和XhoⅠ均购自TaKaRa公司。胶回收试剂盒、小剂量质粒提取试剂盒购自Axygen公司。Trizol试剂购自Invitrogen公司。引物由北京鼎国生物公司合成。基因序列由上海杰李生物公司测序完成。
1.2 方法1.2.1 Western blotting检测沙蚕脑内苯丙氨酸羟化酶的表达剥离日本刺沙蚕脑组织置于EP管中剪碎,加入裂解液超声振碎制成匀浆,冰上静置30 min,4 ℃、13 000 r/min离心20 min,使用BCA法蛋白定量,制得标准曲线后,经计算得样品蛋白浓度,最后将蛋白样品制成约2 μg/μL,沸水煮5 min使蛋白变性。
制胶后电泳槽加足量SDS-PAGE电泳液,将上述制备好的蛋白样品缓慢加入上样孔,先80 V电泳20 min,样品通过浓缩胶后,再120 V电泳100 min。电泳后轻轻撬下凝胶,放入装有转膜液的平皿中,按阳极、滤纸、PVDF膜、胶、滤纸、阴极的顺序放在转膜仪20 V转膜20 min,转好的PVDF膜放入5%脱脂奶粉的封闭液中,室温封闭2 h,TBST缓冲液洗膜3次,每次10 min。一抗 (TBST稀释1∶200) 孵育4 ℃过夜,洗膜3次后二抗室温孵育2 h,用新配置的发光液浸没室温孵育1 min,去除多余发光液后显影照相。同样的方法用β-actin兔抗多克隆抗体代替一抗同步进行上述实验过程,作为阳性对照。
1.2.2 免疫组化检测沙蚕脑内苯丙氨酸羟化酶的表达定位将日本刺沙蚕的头和躯干分离后,快速将头放入4%多聚甲醛中室温固定4 h,然后用0.1 mol/L PBS (pH 7.4) 洗3次,15 min/次,之后用梯度酒精脱水 (70%、80%、90%、95%、100%,每次1 h),用二甲苯透明3次,每次1 h,CP包埋剂整体定向包埋,旋转切片机上制作连续额状切片,片厚6 μm,裱于涂有多聚赖氨酸的载玻片上,晾干备用。
切片经二甲苯脱蜡,梯度酒精复水,0.1 mol/L PBS (pH 7.4) 冲洗,用内源性过氧化物酶室温孵育10 min,再用0.1 mol/L PBS冲洗3次,兔抗PAH多克隆抗体 (0.1 mol/L PBS稀释1∶100) 室温孵育3 h,继而用生物素标记的二抗孵育 10 min,PBS冲洗,最后用DAB显色10 min。连接数字显示的显微镜观察拍照。用0.1 mol/L PBS和兔抗β-actin多克隆抗体代替兔抗PAH多克隆抗体同步进行上述免疫组织化学染色过程,作为阴性对照和阳性对照。
1.2.3 RT-PCR核酸水平检测沙蚕脑内苯丙氨酸羟化酶用Trizol试剂提取沙蚕脑总RNA,再反转录成cDNA并以此为模板,β-actin引物为内参进行RT-PCR检测PAH,引物见表 1。按照试剂盒的操作方法进行两轮巢式PCR。反应体系中包括cDNA模板1 μL、引物各2 μL、LA Tap酶0.5 μL、缓冲液5 μL等 (50 μL体系),混匀离心后进行PCR扩增,首轮PCR产物稀释100倍后取1 μL作为第二轮PCR的模板。反应程序如下:94 ℃预变性5 min;94 ℃变性45 s,54 ℃退火50 s,72 ℃延伸2 min,32个循环;4 ℃保存。以β-actin作为内对照。
表1 RT-PCR引物序列Table1 RT-PCR primer sequences
| Primer name | Primer sequence (5'-3') | Size (bp) |
| Gene specific outer primer | TACCGTCGTTCCACTAGTGATTT | 23 |
| 3'RACE outter primer | CTGGAYKCDGAYCAYCCWGGHTT | 23 |
| Gene specific inner primer | CGCGGATCCTCCACTAGTGATTTCACTATAGG | 32 |
| 3' RACE inner primer | CTNGGNGCHCCTGATGA | 17 |
表选项
巢式PCR产物在1%的琼脂糖上电泳鉴定并拍照。按照胶回收试剂盒操作流程进行胶回收。T4 DNA连接酶1 μL、载体1 μL、胶回收产物16 μL、T4 DNA连接酶缓冲液2 μL (20 μL体系) 16 ℃连接过夜。连接产物转化到感受态大肠杆菌DH5α,37 ℃孵育60 min,菌液涂于涂有IPTG和X-gal的氨苄青霉素抗性的LB平皿上,37 ℃培养过夜。挑取大小均匀的白斑菌落培养,参照小剂量质粒提取试剂盒提取质粒,限制性内切酶XbaⅠ和XhoⅠ双酶切鉴定,阳性克隆质粒送交测序后进行Blast对比。
2 结果与分析2.1 Western blotting检测苯丙氨酸羟化酶在沙蚕脑内的表达Western blotting结果表明,应用兔抗PAH多克隆抗体能够在日本刺沙蚕头提取液中标记出一条明显的分子量大约为52 kDa的条带 (图 1),其结果与抗体使用说明书所表述的52 kDa标准分子量大小相一致。β-actin为阳性对照标记出一条44 kDa的条带 (图 1)。结果表明苯丙氨酸羟化酶基因在日本刺沙蚕脑内有相应的蛋白表达产物存在,为进一步应用免疫组化切片标记技术进行PAH的表达分布研究提供了依据和可能。
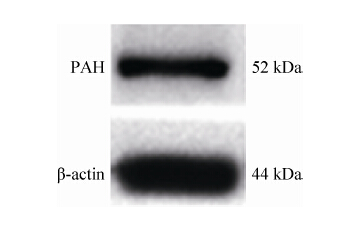 |
| 图1 苯丙氨酸羟化酶在沙蚕头的蛋白表达 Figure1 Western blotting analysis of the immunogenicity ofphenylalanine hydroxylase and β-actin in the brain ofragworm Neathes japonica. |
| 图选项 |
2.2 免疫组化检测苯丙氨酸羟化酶在沙蚕脑区的表达分布低倍镜下可以看出,在视野范围内日本刺沙蚕的脑区确实有被染色的褐色颗粒的存在,呈现出明显、稳定的PAH免疫组织化学阳性反应,说明苯丙氨酸羟化酶在日本刺沙蚕脑内有表达 (图 2A-2F)。阴性对照实验无阳性染色胞体 (图 2G和图 2H),阳性对照实验显示出明显的阳性反应结果 (图 2I和图 2J)。
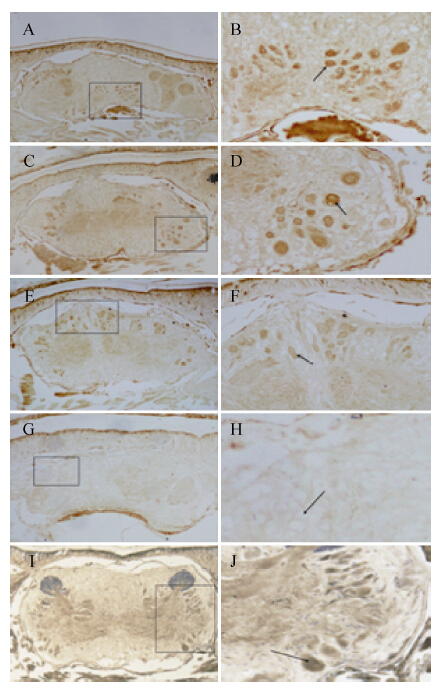 |
| 图2 沙蚕脑区免疫组化染色图 (A、C、E、G、I为20×,B、D、F、H、J为40×,A、B为前脑,C、D、E、F、G、H、I、J为中脑) Figure2 Immunolocalization of phenylalanine hydroxylase in the brain of ragworm Neanthes japonica. A,C,E,G,I is 20 times under a microscope; B,D,F,H,J is 40 times under a microscope,A,B is the forebrain,C,D,E,F,G,H,I,J is the midbrain. The arrow pointing in the direction of positive cells. A,B,C,D,E,F is the experimental group. G,H is the negative control group. I,J is the positive control group. |
| 图选项 |
切片免疫组化染色实验结果显示这些PAH阳性神经元在前脑和中脑均有表达,只是在前脑分布较集中,胞体小,分布较少;在中脑分布相对分散,胞体大,表达量较大;这些胞体均染色显著,呈深褐色,在局部聚集成群。根据胞体在脑中的分布位置的不同,可以大体区分为3群。第一群主要集中在前脑区域,染色细胞主要分布在中腹侧,胞体相对较小,大约包含40个神经元胞体 (图 2A、2B)。第二群主要集中在一对后眼之间的中脑区域,染色细胞主要分布在两侧部,右侧胞体较集中,大约包含15个神经元胞体 (图 2B、2C)。第三群主要集中在中后脑区域,染色细胞在背方和两侧边部均有分布,两侧分布相对较少,背方分布较多,但较分散,相对集中区域大约包含20个神经元胞体 (图 2E、2F)。苯丙氨酸羟化酶主要存在于神经元的细胞质中,且这些神经元细胞无突触,没有远端的投射 (图 2B、2D、2F)。在整个脑区未见静脉曲张状纤维投射的存在。
2.3 RT-PCR检测苯丙氨酸羟化酶在沙蚕脑中的存在巢式PCR的第一轮产物可以增加目的模板的浓度,第二轮PCR产物的特异性更高,两轮PCR之后的扩增产物经1%琼脂糖凝胶电泳,由于是简并性引物,电泳条带会有多条,如图 3A所示,在750 bp和320 bp左右有两条明亮的条带,上面的条带与预期的更相近,将大的条带切下回收,T4 DNA连接酶连接,连接产物转化入大肠杆菌DH5α,挑取4个大小均匀的白斑菌落,提取质粒双酶切鉴定后电泳如图 3B所示,1号、3号和4号为阳性克隆,将1号、3号和4号送交测序。经测序3号片段得到一段长度为757 bp带有PolyA尾巴的一段cDNA序列,NCBI网站上Blast之后结果如表 2所示,发现此基因序列与栉孔扇贝Azumaecten farreri PAH (GenBank登录号AEE60803.1)具有71%的同源性,与白腹丛蚊Armigeres subalbatus PAH (GenBank登录号AAT78350.1) 具有70%的同源性,与囊舌虫Saccoqlossus kowalevskii PAH (GenBank登录号NP_001161629.1) 具有70%的同源性,与家蚕Bombyx mori PAH (GenBank登录号NP_001274766.1) 具有69%的同源性,与拟黑多刺蚁Polyrhachis vicina PAH (GenBank登录号AFL02790.1) 具有65%的同源性,与大红斑蝶Danaus plexippus PAH (GenBank登录号EHJ64587.1) 具有66%的同源性。
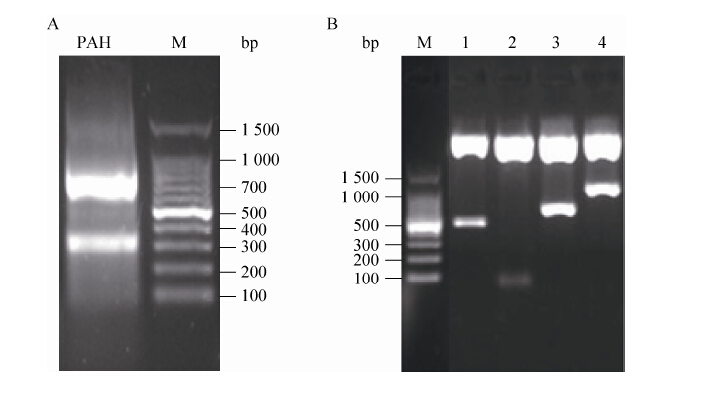 |
| 图3 沙蚕神经索PAH的克隆 Figure3 Clone of phenylalanine hydroxylase in the nerve cord of ragworm Neanthes japonica. (A) Electrophoresis images of PAH. (B) Identification of pHSG-PAH plasmid using restriction endonuclease digestion,1,3,and 4 were positive clone; 2 was negative clone; M: DL100 DNA ladder. |
| 图选项 |
表2 测序片段Blast结果Table2 Blast result of segment sequence
| Species | Max score | Total score | Query cover (%) | Ident (%) | Accession No. |
| Azumapecten farreri (PAH) | 189 | 189 | 55 | 71 | AEE60803.1 |
| Armigeres subalbatus (PAH) | 183 | 183 | 55 | 70 | AAT78350.1 |
| Saccoqlossus kowalevskii (PAH) | 181 | 181 | 55 | 70 | NP_001161629.1 |
| Bombyx mori (PAH) | 179 | 179 | 55 | 69 | NP_001274766.1 |
| Polyrhachis vicina (PAH) | 175 | 175 | 56 | 65 | AFL02790.1 |
| Danaus plexippus (PAH) | 174 | 174 | 55 | 66 | EHJ64587.1 |
表选项
3 讨论历经漫长的选择进化,PAH基因在脊椎动物乃至人类仍被保留。1983年Woo等[18]从人肝脏中成功克隆出了苯丙氨酸羟化酶基因,PAH在肝脏合成,定位于第12号染色体12q24.1,大约由1.5 Mb碱基组成,包含13个外显子和12个内含子,转录时剪切掉内含子形成了仅包含1 353 bp外显子的单链,即包含451个密码子的可译框,mRNA翻译成451个氨基酸的酶单体,单体再聚合成有功能的PAH酶[19-20]。
目前对于芳香族氨基酸羟化酶的研究大多集中于高等生物,人类苯丙氨酸羟化酶基因的突变致人患苯丙酮酸尿症[21],动物体内的苯丙氨酸羟化酶基因突变也导致了一系列的疾病,而目前对于低等生物苯丙氨酸羟化酶的研究则相对较少。在基因进化研究方面,低等生物中芳香族氨基酸羟化酶是否像哺乳动物一样进行了功能基因的分化还是未知,尤其是苯丙氨酸羟化酶和色氨酸羟化酶基因是否也进行了相应地分化,是在哪一进化中的低等生物物种中进行了分化,即分化的节点到底在哪儿,一直没有定论。
实验中对日本刺沙蚕体内的PAH蛋白进行了免疫学标记,对pah基因进行了克隆。Western blotting实验结果表明,在日本刺沙蚕体内有明确的pah基因表达的蛋白存在。免疫组化实验结果明确了其在蛋白水平的组织分布情况,在日本刺沙蚕脑内PAH神经元细胞内,PAH充满细胞液,细胞无投射,说明被合成的苯丙氨酸羟化酶在细胞液中使苯丙氨酸转变为酪氨酸,而不需要分泌到胞外到远端去发挥作用。分布的这种差别,应该与苯丙氨酸羟化酶所具有的相应的功能有关,研究表明,苯丙氨酸羟化酶是生物体内苯丙氨酸转化为酪氨酸的关键限速酶[22-24],一旦此酶缺乏,苯丙氨酸就会在体内堆积,酪氨酸量就会减少,进而影响酪氨酸转化为多巴胺或酪胺的量[25-26],引起一系列的连环反应,即影响多巴胺、去甲肾上腺素、肾上腺素这些儿茶酚胺[27]类神经递质的功能,或影响酪胺和章鱼胺的功能,这些单胺类神经递质都是以苯丙氨酸和酪氨酸为前体物质合成的,若以苯丙氨酸为前体物质,则PAH的存在显得尤为重要。从分布来看,有PAH神经元细胞分布的脑区域可能与儿茶酚胺、酪胺和章鱼胺类神经递质的合成相关,具体在沙蚕体内会引起什么样的变化还有待下一步通过对酪氨酸羟化酶及相应单胺类神经递质在沙蚕脑内的存在及分布模式的研究去进行深入地讨论。
应用分子克隆技术克隆出了PAH的一段757 bp带有PolyA尾巴的cDNA序列,NCBI网站上Blast结果与多个物种PAH高度的同源性,从核酸水平上证明了在日本刺沙蚕脑中确有独立的PAH的存在。
综上所述,低等的环节动物日本刺沙蚕脑内存在独立的苯丙氨酸羟化酶,在蛋白质水平和核酸水平上为芳香族氨基酸羟化酶中苯丙氨酸羟化酶和色氨酸羟化酶的基因分化提供了证据,为两种羟化酶基因的分化节点在已有的节肢动物门基础上向前推进到环节动物门提供了依据。
参考文献
| [1] | Cao J, Shi F, Liu XG, et al. Phylogenetic analysis and evolution of aromatic amino acid hydroxylases.FEBS Lett, 2010, 584(23): 4775–4782(in Chinese). |
| [2] | Tu GW, Zou X. Structure and catalytic characters of aromatic amino acid hydroxylase.Chin J Biochem Mol Biol, 2014, 30(1): 14–22(in Chinese). 涂光伟, 邹祥. 芳香族氨基酸羟化酶家族结构与催化功能.中国生物化学与分子生物学报,2014,30(1):14–22. |
| [3] | Fitzpatrick PF. Mechanism of aromatic amino acid hydroxylation.Biochemistry, 2003, 42(48): 14083–14091(in Chinese). |
| [4] | Fitzpatrick PF. The aromatic amino acid hydroxylases.Adv Enzymol Relat Areas Mol Biol, 2000: 235–294(in Chinese). |
| [5] | Grenett HE, Ledley FD, Reed LL, et al. Full-length cDNA for rabbit tryptophan hydroxylase: functional domains and evolution of aromatic amino acid hydroxylases.Proc Natl Acad Sci USA, 1987, 84(16): 5530–5534(in Chinese). |
| [6] | Daubner SC, Le T, Wang SZ. Tyrosine hydroxylase and regulation of dopamine synthesis.Arch Biochem Biophys, 2011, 508(1): 1–12(in Chinese). |
| [7] | Kaufman S. 16-Hepatic phenylalanine hydroxylase and PKU.Brain Mech Mental Retard, 2013: 445–458(in Chinese). |
| [8] | Ho G, Reichardt J, Christodoulou J. In vitro read-through of phenylalanine hydroxylase (PAH) nonsense mutations using amino glycosides: a potential therapy for phenylketonuria.J Inherit Metab Dis, 2013, 36(6): 955–959(in Chinese). |
| [9] | Bratland E, Magitta NF, Wolff ASB, et al. Autoantibodies against aromatic amino acid hydroxylases in patients with autoimmune polyendocrine syndrome type 1 target multiple antigenic determinants and reveal regulatory regions crucial for enzymatic activity.Immunobiology, 2013, 218(6): 899–909(in Chinese). |
| [10] | Nakashima A, Ota A, Kaneko YS, et al. A possible pathophysiological role of tyrosine hydroxylase in Parkinson's disease suggested by postmortem brain biochemistry: a contribution for the special 70th birthday symposium in honor of Prof.J Neural Transm, 2013, 120(1): 49–54(in Chinese). |
| [11] | Loer CM, Davidson B, McKerrow J. A phenylalanine hydroxylase gene from the nematode C.J Neurogenet, 1999, 13(3): 157–180(in Chinese). |
| [12] | Kutch IC, Sevgili H, Wittman T, et al. Thermoregulatory strategy may shape immune investment in Drosophila melanogaster.J Exp Biol, 2014, 217(Pt 20): 3664–3669(in Chinese). |
| [13] | Alcaiz S, Silva FJ. Phenylalanine hydroxylase participation in the synthesis of serotonin and pteridines in Drosophila melanogaster.Comp Biochem Physiol Part C, 1997, 116(3): 205–212(in Chinese). |
| [14] | Johnson JK, Rocheleau TA, Hillyer JF, et al. A potential role for phenylalanine hydroxylase in mosquito immune responses.Insect Biochem Mol Biol, 2003, 33(3): 345–354(in Chinese). |
| [15] | Zhang SN, Huang T, Ilangovan U, et al. The solution structure of the regulatory domain of tyrosine hydroxylase.J Mol Biol, 2014, 426(7): 1483–1497(in Chinese). |
| [16] | Chen GL, Miller GM. Tryptophan hydroxylase.Biochem Pharmacol, 2013, 85(9): 1227–1233(in Chinese). |
| [17] | Ledley FD, Grenett HE, Bartos DP, et al. Assignment of human tryptophan hydroxylase locus to chromosome 11: gene duplication and translocation in evolution of aromatic amino acid hydroxylases.Somat Cell Mol Genet, 1987, 13(5): 575–580(in Chinese). |
| [18] | Woo SLC, Lidsky AS, Güttler F, et al. Cloned human phenylalanine hydroxylase gene allows prenatal diagnosis and carrier detection of classical phenylketonuria.Nature, 1983, 306(5939): 151–155(in Chinese). |
| [19] | Zhang Z, Huang ZQ, Shen Q, et al. Cloning of human phenylalanine hydroxylase gene and construction of prokaryotic expression plasmid.J Sun Yat-Sen Univ: Med Sci, 2007, 28(3): 288–291(in Chinese). 张志, 黄宗青, 沈琪, 等. 人苯丙氨酸羟化酶基因克隆及其原核表达质粒的构建.山东大学学报: 医学科学版,2007,28(3):288–291. |
| [20] | Flydal MI, Martinez A. Phenylalanine hydroxylase: function, structure, and regulation.IUBMB Life, 2013, 65(4): 341–349(in Chinese). |
| [21] | He J, Wang HZ, Xu FL, et al. Mutation analysis of the PAH gene in children with phenylketonuria from the Qinghai area of China.Chin J Contemp Pediatr, 2015, 17(11): 1221–1227(in Chinese). 何江, 王惠珍, 徐发亮, 等. 青海地区苯丙酮尿症患者苯丙氨酸羟化酶基因突变分析.中国当代儿科杂志,2015,17(11):1221–1227. |
| [22] | Zhang SN, Hinck AP, Fitzpatrick PF. The amino acid specificity for activation of phenylalanine hydroxylase matches the specificity for stabilization of regulatory domain dimers.Biochemistry, 2015, 54(33): 5167–5174(in Chinese). |
| [23] | Geisler S, Gostner JM, Becker K, et al. Immune activation and inflammation increase the plasma phenylalanine-to-tyrosine ratio.Pteridines, 2013, 24(1): 27–31(in Chinese). |
| [24] | Teraishi T, Sasayama D, Hori H, et al. Possible association between common variants of the phenylalanine hydroxylase (PAH) gene and memory performance in healthy adults.Behav Brain Funct, 2013, 9(1): 125–133(in Chinese). |
| [25] | Dilmukhametova LK, Pronina TS, Volina EV, et al. The regulation of compensatory dopamine synthesis in the arcuate nucleus of rats.Neurochem J, 2014, 8(3): 168–177(in Chinese). |
| [26] | Harding CO, Winn SR, Gibson KM, et al. Pharmacologic inhibition of L-tyrosine degradation ameliorates cerebral dopamine deficiency in murine phenylketonuria (PKU).J Inherit Metab Dis, 2014, 37(5): 735–743(in Chinese). |
| [27] | Daigo H, Setsuko K, Hirofumi T, et al. The role of tetrahydrobiopterin and catecholamines in the developmental regulation of tyrosine hydroxylase level in the brain.J Neurochem, 2013, 126(1): 70–81(in Chinese). |
