

中国科学院天津工业生物技术研究所,天津 300308
Construction of recombinant strains co-expressing PPK and GMAS for the synthesis of L-theanine
Yuan Li, Shan Liu, Jun Zhu


Tianjin Institute of Industrial Biotechnology, Chinese Academy of Sciences, Tianjin 300308, China
Received: June 2, 2016; Accepted: August 8, 2016
Supported by:Science and Technology Projects of Tianjin (No. 14ZCZDSY00064)
Corresponding authors:Jun Zhu. Tel/Fax: +86-22-24828771; E-mail: zhu_j@tib.cas.cn
Abstract: Recombinant strains expressing enzymes for ATP regeneration and L-theanine production were constructed and used for the synthesis of L-theanine. The ppk gene encoding polyphosphate kinase (PPK) from Rhodobacter sphaeroides andgmas gene encoding γ-glutamylmethylamide synthetase (GMAS) from Methylovorus mays were synthesized, and two recombinant plasmids, pETDuet-ppk+gmas and pET21a-ppk+gmas were constructed for co-expression of PPK and GMAS in Escherichia coli BL21(DE3). SDS-PAGE analysis showed that PPK and GMAS were overexpressed in soluble form in both recombinant strains. GMAS-PPK obtained from the recombinant strain containing pET21a-ppk+gmas was more efficient to synthesize L-theanine. After 24 h at 37 ℃ and pH at 7.0, 86.0% yield of L-theanine was achieved with catalytic amount of ATP. This study extends the application of enzymatic ATP regeneration system. In addition, it provides an efficient method for the biosynthesis of L-theanine.
Key words: ATP regeneration γ-glutamylmethylamide synthetase polyphosphate kinase L-theanine co-expression dual-enzyme coupled reaction
腺嘌呤核苷三磷酸(ATP)是一种高能磷酸化合物,是生物体内最直接的能量来源。在工业中,ATP常常用于生物合成酶催化生产高附加值化学品的反应中。由于ATP价格昂贵,直接在反应过程中添加ATP从经济角度考虑是不允许的。因此,ATP再生系统[1]是提高生物合成酶反应经济性的一个有效措施。文献已报道多种酶可以用于ATP再生,例如,丙酮酸激酶、乙酸激酶和多聚磷酸盐激酶(PPK)等[2]。其中,PPK由于其底物多聚磷酸盐(polyP)廉价易得[3],广泛应用于ATP再生。基于PPK的ATP再生系统已用于多种高附加值化学品的合成,如D-氨基酸二肽[4]、甘油三磷酸[5]和D-木酮糖-5-磷酸[6]等。
L-茶氨酸是一种茶叶中的游离氨基酸,决定茶叶的风味和品质。其具有放松减压、提高学习能力和抗肿瘤等多种重要的生理功能[7],因此广泛应用于食品、保健品及医药行业。γ-谷氨酰甲胺合成酶(GMAS)由于其对乙胺的高活性,可用于L-茶氨酸的合成[8-9]。然而,该反应需要ATP的参与。因此,本研究构建了共表达PPK和GMAS的重组菌株,并将其应用于L-茶氨酸的合成,路线如图 1所示。通过共表达PPK和GMAS,有效实现了基于PPK的ATP再生系统在合成L-茶氨酸中的应用,也为L-茶氨酸的生物合成提供了新的有效途径。
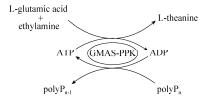 |
| 图 1 偶联ATP再生酶法合成L-茶氨酸 Figure 1 Enzymatic synthesis of L-theanine coupled with ATP regeneration. |
| 图选项 |
1 材料与方法1.1 材料1.1.1 质粒与菌株大肠杆菌(Escherichia coli) Top10、BL21 (DE3)与表达载体pETDuet-1、pET-21a (+)为本实验室保存。
1.1.2 试剂限制性内切酶购于Thermo公司;Taq DNA聚合酶、Primer STARTMDNA聚合酶和T4 DNA连接酶购于宝生物工程(大连)有限公司;质粒小量提取试剂盒、DNA凝胶回收试剂盒购于天根生化科技(北京)有限公司;L-茶氨酸和γ-谷氨酰羟肟酸标准品购于Sigma-Aldrich公司;ATP和ADP购于北京索莱宝科技有限公司;其他试剂均为国产分析纯试剂。
1.2 方法1.2.1 共表达重组载体的构建编码PPK的基因ppk (来源于类球红细菌Rhodobacter sphaeroides,GenBank登录号:GZ485151)委托华大基因合成,并进行密码子优化以适合在E. coli中外源表达。基因的两端分别添加NcoⅠ和SalⅠ酶切位点。用NcoⅠ/SalⅠ双酶切,将胶回收后的基因片段与同样酶切的pETDuet-1连接,构建重组质粒pETDuet-ppk。编码GMAS的基因gmas (来源于噬甲基菌Methylovorus mays,GenBank登录号:AB333782)同样由华大基因合成并进行密码子优化,基因两端分别添加NdeⅠ和XhoⅠ酶切位点。用NdeⅠ/XhoⅠ双酶切后克隆入pETDuet-ppk中,构建共表达质粒pETDuet-ppk+gmas。
以pETDuet-ppk为模板,使用引物PPK-F和PPK-R (表 1)扩增ppk基因,PCR反应条件为:95 ℃预变性5 min;95 ℃ 45 s,58 ℃ 30 s,72 ℃ 1 min,30个循环;72 ℃延伸10 min。PCR产物经纯化并用NdeⅠ/SalⅠ双酶切后克隆入pET-21a (+)中以构建重组质粒pET21a-ppk。使用引物GMAS-F和GMAS-R (表 1),从pETDuet-ppk+gmas扩增gmas基因,PCR反应条件为:95 ℃预变性5 min;95 ℃ 45 s,58 ℃ 30 s,72 ℃ 1.5 min,30个循环;72 ℃延伸10 min。用Hind Ⅲ消化后,将gmas基因片段插入pET21a-ppk中ppk基因的下游,构建共表达质粒pET21a-ppk+gmas。
表 1 PCR引物序列Table 1 PCR primer sequence
| Primer name | Primer sequence (5'-3') |
| PPK-F | GGAATTCCATATGGCCGAAGATCGTGCTATGC (the underline indicates NdeⅠ) |
| PPK-R | ACGCGTCGACTCAACCTTGACGCGGTTTAC (the underline indicates SalⅠ) |
| GMAS-F | CCCAAGCTTAAGGAGATATAATGAAGAGCCTGGAAGAAGCAC (the underline indicates Hind III) |
| GMAS-R | CCCAAGCTTTCAGTAGAATTGAACATAGCGGTTG (the underline indicates Hind III) |
表选项
1.2.2 重组蛋白的诱导及酶活测定将构建成功的共表达质粒转入E. coli BL21 (DE3)中,挑取转化子接种到含有100 mg/L氨苄青霉素的LB液体培养基中,37 ℃、200 r/min培养过夜。过夜培养物以1%的接种量转接入另一摇瓶中培养至OD600=0.6-0.8,加入IPTG诱导过夜,SDS-PAGE凝胶电泳检测蛋白表达情况。
诱导完成后8 000 r/min离心收集菌体,用无菌水洗涤一次,按10 mL/g湿菌体的比例加入20 mmol/L磷酸钠缓冲液(pH 8.0)重悬,超声破碎,4 ℃、12 000 r/min离心10 min。将上清液冻干,获得重组蛋白的粗酶粉并进行酶活测定,GMAS和PPK的酶活测定方法分别参照文献[8]和[4]。
1.2.3 双酶共表达合成L-茶氨酸标准反应体系:200 mmol/L谷氨酸钠、200 mmol/L乙胺盐酸盐、5 mmol/L ATP、150 mmol/L MgCl2·6H2O、75 mmol/L六偏磷酸钠和10 mL咪唑缓冲液(75 mmol/L,pH 8.0)。用5 mol/L NaOH调节反应pH至7.0,加入5 g/L GMAS-PPK粗酶粉,于30 ℃反应。
1.2.4 HPLC测定L-茶氨酸含量反应产物L-茶氨酸使用HPLC检测。HPLC检测条件:色谱柱为Astec chirobiotic? TAG (250 mm× 4.6 mm×5 μm),柱温30 ℃,以醋酸铵缓冲液(5 mmol/L,pH 6.0)与甲醇(25:75,V:V)为流动相,流速为0.8 mL/min,等梯度洗脱,紫外检测器,检测波长为215 nm,进样量10 μL。
2 结果与分析2.1 共表达质粒pETDuet-ppk+gmas的构建将合成的ppk基因插入pETDuet-1载体的第一个多克隆位点,得到重组质粒pETDuet-ppk。NcoⅠ/ SalⅠ双酶切鉴定,结果如图 2A所示,酶切产生分子量与ppk基因大小一致的条带。合成的gmas基因插入pETDuet-ppk中的第2个多克隆位点,获得PPK与GMAS的共表达质粒pETDuet-ppk+gmas,其中每个基因处于独立的T7启动子控制下。用NcoⅠ/ SalⅠ/XhoⅠ三酶切鉴定重组质粒,酶切结果见图 2B。酶切产生三条带,分子量最小的为ppk片段,分子量约1 500 bp的为含有T7启动子的gmas片段。经酶切鉴定的重组质粒由华大基因进行测序,测序结果与合成序列一致,表明构建成功。
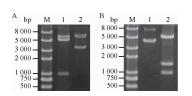 |
| 图 2 重组质粒pETDuet-ppk (A)和pETDuet-ppk+gmas (B)的酶切鉴定 Figure 2 Identification of recombinant plasmids. (A) Identification of pETDuet-ppk. M: DNA marker; 1: digestion of plasmid pETDuet-ppk by NcoⅠ/SalⅠ; 2: recombinant plasmid pETDuet-ppk. (B) Identification of pETDuet-ppk+gmas. M: DNA marker; 1: recombinant plasmid pETDuet-ppk+gmas; 2: digestion of plasmid pETDuet-ppk+gmas by NcoⅠ/ SalⅠ/XhoⅠ. |
| 图选项 |
2.2 共表达质粒pET21a-ppk+gmas的构建用末端分别含有NdeⅠ和SalⅠ酶切位点的引物扩增ppk基因,并插入pET-21a (+)中,得到重组质粒pET21a-ppk,NdeⅠ/SalⅠ双酶切鉴定,结果如图 3A所示,其中分子量较小的条带为ppk基因。PCR扩增gmas基因,其中在5′引物的上游序列中添加核糖体结合位点序列。将得到的gmas片段插入ppk的下游,获得另一共表达质粒pET21a-ppk+gmas,其中ppk与gmas基因处于同一启动子控制下。用NdeⅠ/Hind Ⅲ双酶切鉴定重组质粒,酶切结果见图 3B。除载体条带外,酶切产生另外两条较小的带,其分子量分别与gmas和ppk基因大小相符。经酶切鉴定的重组质粒同样进行测序验证,经比对无突变,表明构建成功。
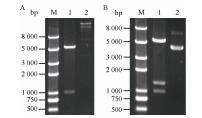 |
| 图 3 重组质粒pET21a-ppk (A)和pET21a-ppk+gmas (B)的酶切鉴定 Figure 3 Identification of recombinant plasmids. (A) Identification of pET21a-ppk. M: DNA marker; 1: digestion of plasmid pET21a-ppk by NdeⅠ/SalⅠ; 2: recombinant plasmid pET21a-ppk. (B) Identification of pET21a-ppk+gmas. M: DNA marker; 1: digestion of plasmid pET21a-ppk+gmas by NdeⅠ/Hind Ⅲ; 2: recombinant plasmid pET21a-ppk+gmas. |
| 图选项 |
2.3 重组蛋白的表达及酶活测定将两种共表达重组质粒pETDuet-ppk+gmas和pET21a-ppk+gmas分别转入BL21 (DE3)中,得到重组菌株TPG和APG。将TPG和APG分别用终浓度0.05、0.1、0.2、0.5和1.0 mmol/L的IPTG于20 ℃诱导过夜,电泳检测蛋白表达。结果表明诱导后GMAS和PPK在两个重组菌株中均成功过表达,并且大部分目的蛋白存在于上清液中;对于各个IPTG诱导浓度,蛋白的表达水平无明显差异。其中,在TPG的表达产物中,存在大量GMAS,但仅微量的PPK;与TPG相比,APG中GMAS的表达量明显降低,而PPK的量增加。同时,在0.1 mmol/L IPTG下考察了不同诱导温度(20 ℃、25 ℃、30 ℃和37 ℃)对目的蛋白表达的影响。结果表明20 ℃时重组蛋白的可溶性表达最好。0.1 mmol/L IPTG于20 ℃诱导过夜后蛋白表达的SDS-PAGE检测结果见图 4。
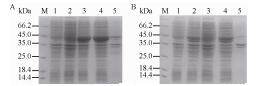 |
| 图 4 TPG和APG裂解物的SDS-PAGE分析(A:TPG表达产物;B:APG表达产物) Figure 4 SDS-PAGE analysis of the TPG and APG lysate. (A) TPG expression products. M: protein marker; 1: control of E. coli BL21(DE3) (pETDuet-1) after induction; 2: control of TPG which is not induced; 3: TPG after induction; 4: supernate of TPG after induction; 5: precipitate of TPG after induction. (B) APG expression products. M: protein marker; 1: control of E. coli BL21(DE3) (pET-21a (+)) after induction; 2: APG after induction; 3: control of APG which is not induced; 4: supernate of APG after induction; 5: precipitate of APG after induction. |
| 图选项 |
用终浓度0.1 mmol/L的IPTG于20 ℃诱导过夜后,离心收集TPG和APG菌体,重悬后超声破碎。4 ℃离心细胞裂解液,将上清冻干,得到GMAS-PPK粗酶粉。对两种粗酶粉进行酶活测定,从TPG和APG制备的GMAS-PPK粗酶粉的GMAS酶活分别为1.25 U/mg和0.51 U/mg,PPK酶活分别为0.14 U/mg和0.34 U/mg。
2.4 共表达GMAS-PPK催化活性比较使用相同量的来自TPG和APG的GMAS-PPK粗酶粉合成L-茶氨酸,结果如图 5所示,6.5 h后L-茶氨酸的产率分别达到34.1%和47.9%。与APG相比,来自TPG的GMAS-PPK所催化反应的初始速率明显降低。因此,选用来自APG的GMAS-PPK进行L-茶氨酸合成反应研究。
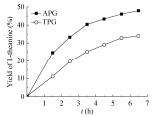 |
| 图 5 来自TPG和APG的GMAS-PPK催化活性比较 Figure 5 Comparison of catalytic activity of GMAS-PPK from TPG and APG. The reaction was carried out with the standard reaction using GMAS-PPK from TPG or APG. The concentration of L-theanine was determined by HPLC at different time. |
| 图选项 |
2.5 共表达GMAS-PPK用于合成L-茶氨酸使用来自APG的GMAS-PPK在不同温度下或不同pH下合成L-茶氨酸,结果如图 6所示。结果表明最适反应温度为37 ℃,最适反应pH为7.0-7.5。
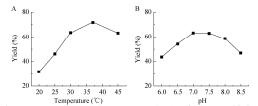 |
| 图 6 温度和pH对GMAS-PPK催化合成L-茶氨酸的影响(A:温度的影响;B:pH的影响) Figure 6 Effect of temperature and pH on the production of L-theanine catalyzed by GMAS-PPK. The reaction was carried out with the standard reaction at various temperatures (A) and pHs (B). The concentration of L-theanine was determined by HPLC after 24 h. |
| 图选项 |
在上述最优反应温度和pH下,于200 mL反应体系中合成L-茶氨酸。以200 mmol/L L-谷氨酸钠和200 mmol/L乙胺盐酸盐为底物,偶联以六偏磷酸钠为磷酸供体的ATP再生体系,使用共表达的GMAS-PPK作催化剂,反应过程中使用2 mol/L NaOH将反应pH维持到7.0,反应进程如图 7所示。在最初6 h内,反应速度较快,随后反应速度变缓。在24 h后,L-茶氨酸的摩尔产率可达86.0%,含量为26.8 g/L。
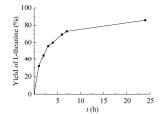 |
| 图 7 双酶偶联合成L-茶氨酸反应进程 Figure 7 Time course of the dual-enzyme coupled synthesis of L-theanine. |
| 图选项 |
3 讨论在ATP作为能量供体的酶催化反应中,如何高效且低成本地提供ATP循环再生是需要解决的主要问题[10]。本研究构建了共表达PPK和GMAS的重组菌株,并使用从其制备的GMAS-PPK粗酶粉催化反应,建立了一个双酶偶联的催化系统,可在催化量ATP的存在下实现L-茶氨酸的高效合成。
在本研究中将gmas和ppk基因分别同时插入pETDuet-1和pET-21a (+)中,获得两个共表达菌株TPG和APG。在两个重组菌株中GMAS和PPK均成功地以可溶性形式表达。然而,在TPG的表达产物中GMAS的量远大于PPK。在之前的研究中,当分别在E. coli中重组表达时,GMAS的表达水平明显高于PPK,说明GMAS可能更适应在E. coli中外源表达。因此,当gmas和ppk在各自独立的启动子控制下在E. coli中共表达时,宿主会优先合成GMAS。而将gmas基因插入pET21a-ppk中与ppk共用一个启动子时,由于远离启动子,GMAS的表达量大大降低,同时PPK的表达水平明显上升。相应地,TPG中GMAS的活性比APG中高约1倍,而PPK活性比APG低60%。由于GMAS与PPK活性的失调,当将来自TPG的GMAS-PPK用作催化剂时,ATP再生成为限速步骤,导致其催化合成L-茶氨酸的能力降低。这说明当共表达PPK和GMAS用于L-茶氨酸合成时,重组菌株APG要优于TPG。
当将来自APG的GMAS-PPK用于L-茶氨酸合成时,最适反应温度为37 ℃,最适pH为7.0-7.5,反应条件温和。在最适反应条件下,底物L-谷氨酸钠浓度为200 mmol/L时,反应混合物中加入约为底物初始量四十分之一的ATP即可使L-茶氨酸的转化率达到85%以上;反应中ATP循环了约35次。因此,通过酶法ATP再生,反应体系中ATP的量大大降低。
除PPK之外,文献[2]中还报道了基于丙酮酸激酶或乙酸激酶的ATP再生系统。然而,丙酮酸激酶所用磷酸供体为磷酸烯醇式丙酮酸,其价格昂贵,不易保存;此外,产物丙酮酸累积后会对丙酮酸激酶产生抑制作用。乙酸激酶催化乙酰磷酸和ADP生成乙酸和ATP,乙酰磷酸不易市售获得,因而限制了其在工业化生产中的使用。与之相比,本研究中使用稳定性好且价格便宜的六偏磷酸钠作为磷酸供体有效实现了ATP的再生,更有利于工业化生产应用。
在文献报道的利用L-谷氨酰胺酶(GLS)[11-12]和γ-谷氨酰转肽酶(GGT)[13-16]催化合成L-茶氨酸的反应体系中,需要以价格较昂贵的L-谷氨酰胺(70-100元/kg)为底物,还需要添加大大过量的乙胺(多达10倍)防止L-谷氨酰胺水解。另外,此类反应体系一般是在碱性条件下进行,在工业生产中会增加设备维护的成本。相比之下,虽然本研究中需要添加少量ATP (5 mmol/L),但是该反应以廉价的L-谷氨酸钠(15-30元/kg)为原料,无需考虑L-谷氨酰胺水解带来的副产物问题。另外,反应中只需要等当量的乙胺盐酸盐,大大降低了其用量。此外,该反应在中性条件下进行,为工业化生产提供了便利条件。有关L-茶氨酸酶法合成途径的具体参数见表 2。
表 2 酶法合成L-茶氨酸方法的比较Table 2 Comparison of production conditions and yields with enzymes used in L-theanine production.
| Enzyme | Strain for enzyme source | Enzyme dosage (U/mL) | Substrates | Conditions | t (h) | Yield (%) | Reference | |
| γ-Glutamyl donor used (mol/L) | Ethylamine (mol/L) | |||||||
| GLS | P. nitroreducens | 0.5 | L-Glutamine, 0.7 | 1.5 | pH 11.0, 30 ℃ | 7 | 39 | [11] |
| P. nitroreducens | 0.3 | L-Glutamine, 0.3 | 1.5 | pH 10.0, 37 ℃ | 5 | 40 | [12] | |
| GGT | E. coli | 0.4 | L-Glutamine, 0.2 | 1.5 | pH 10.0, 37 ℃ | 2 | 60 | [13] |
| E. coli | 1.5 | L-Glutamine, 0.267 | 2.0 | pH 10.5, 37 ℃ | 24 | 80 | [14] | |
| B. subtillis | 2.0 | L-Glutamine, 0.2 | 2.2 | pH 10.0, 37 ℃ | 5 | 78 | [15] | |
| B. licheniformis | 1.0 | L-Glutamine, 0.08 | 0.6 | pH 9.0, 37 ℃ | 4 | 84 | [16] | |
| GMAS | M. mays | 2.5 | L-Glutamic acid, 0.2 | 0.2 | pH 7.0, 37 ℃ | 24 | 86 | This work |
表选项
为了提高该双酶偶联系统的催化效率,需要进一步改造GMAS和PPK,以期提高两种酶在同一菌株中的表达量和酶活,并进一步增加合成L-茶氨酸的底物浓度和产率。
参考文献
| [1] | Langer RS, Hamilton BK, Gardner CR, et al. Enzymatic regeneration of ATP. I. alternative routes.AIChE J, 1976, 22(6): 1079–1090.DOI: 10.1002/(ISSN)1547-5905 |
| [2] | Andexer JN, Richter M. Emerging enzymes for ATP regeneration in biocatalytic processes.ChemBioChem, 2015, 16(3): 380–386.DOI: 10.1002/cbic.v16.3 |
| [3] | Shiba T, Tsutsumi K, Ishige K, et al. Inorganic polyphosphate and polyphosphate kinase: their novel biological functions and applications.Biochemistry, 2000, 65(3): 315–323. |
| [4] | Sato M, Masuda Y, Kirimura K, et al. Thermostable ATP regeneration system using polyphosphate kinase from Thermosynechococcus elongatus BP-1 for D-amino acid dipeptide synthesis.J Biosci Bioeng, 2007, 103(2): 179–184.DOI: 10.1263/jbb.103.179 |
| [5] | Restiawaty E, Iwasa Y, Maya S, et al. Feasibility of thermophilic adenosine triphosphate-regeneration system using Thermus thermophilus polyphosphate kinase.Process Biochem, 2011, 46(9): 1747–1752.DOI: 10.1016/j.procbio.2011.05.021 |
| [6] | Kim JE, Zhang YHP. Biosynthesis of D-xylulose 5-phosphate from D-xylose and polyphosphate through a minimized two-enzyme cascade.Biotechnol Bioeng, 2016, 113(2): 275–282.DOI: 10.1002/bit.25718 |
| [7] | Mu WM, Zhang T, Jiang B. An overview of biological production of L-theanine.Biotechnol Adv, 2015, 33(3/4): 335–342. |
| [8] | Yamamoto S, Wakayama M, Tachiki T. Characterization of theanine-forming enzyme from Methylovorus mays No. 9 in respect to utilization of theanine production.Biosci Biotechnol Biochem, 2007, 71(2): 545–552.DOI: 10.1271/bbb.60590 |
| [9] | Yamamoto S, Morihara Y, Wakayama M, et al. Theanine production by coupled fermentation with energy transfer using γ-glutamylmethylamide synthetase of Methylovorus mays No. 9.Biosci Biotechnol Biochem, 2008, 72(5): 1206–1211.DOI: 10.1271/bbb.70663 |
| [10] | Zhao HM, van der Donk WA. Regeneration of cofactors for use in biocatalysis.Curr Opin Biotechnol, 2003, 14(6): 583–589.DOI: 10.1016/j.copbio.2003.09.007 |
| [11] | Tachiki T, Yamada T, Mizuno K, et al. γ-glutamyl transfer reactions by glutaminase from Pseudomonas nitroreducens IFO12694 and their application for the syntheses of theanine and γ-glutamylmethylamide.Biosci Biotechnol Biochem, 1998, 62(7): 1279–1283.DOI: 10.1271/bbb.62.1279 |
| [12] | Pu HF, Wang Q, Zhu FF, et al. Cloning, expression of glutaminase from Pseudomonas nitroreducens and application to theanine synthesis.Biocatal Biotransformat, 2013, 31(1): 1–7.DOI: 10.3109/10242422.2012.749462 |
| [13] | Suzuki H, Izuka S, Miyakawa N, et al. Enzymatic production of theanine, an "umami" component of tea, from glutamine and ethylamine with bacterial γ-glutamyltranspeptidase.Enzyme Microb Technol, 2002, 31(6): 884–889.DOI: 10.1016/S0141-0229(02)00213-2 |
| [14] | Wang Q, Min C, Zhu FF, et al. Production of bioactive γ-glutamyl transpeptidase in Escherichia coli Using SUMO fusion partner and application of the recombinant enzyme to L-theanine synthesis.Curr Microbiol, 2011, 62(5): 1535–1541.DOI: 10.1007/s00284-011-9891-7 |
| [15] | Chen XY, Su LQ, Wu D, et al. Application of recombinant Bacillus subtilis γ-glutamyltranspeptidase to the production of L-theanine.Process Biochem, 2014, 49(9): 1429–1439.DOI: 10.1016/j.procbio.2014.05.019 |
| [16] | Bindal S, Gupta R. L-Theanine synthesis using γ-glutamyl transpeptidase from Bacillus licheniformis ER-15.J Agric Food Chem, 2014, 62(37): 9151–9159.DOI: 10.1021/jf5022913 |
