

西南大学 家蚕基因组生物学国家重点实验室,重庆 400716
基金项目:国家重点基础研究发展计划 (973计划) (No. 2012CB114603),国家自然科学基金 (No. 81201551),中央高校基本科研业务费专项资金 (No. XDJK2013B020),中央高校基本科研业务费专项资金学科团队项目 (No. 2362015XK09),重庆市研究生科研创新项目 (No. CYB2015067),西南大学基本科研业务费专项资金 (No. XDJK2015D021) 资助
摘要: B类清道夫受体在动脉粥样硬化及其他心血管疾病的形成或抑制,机体免疫防御,凋亡细胞清除等生理过程中起着重要的作用。克隆了家蚕B型清道夫受体家族的一个成员BmSCRB8基因,通过RACE技术获得BmSCRB8的cDNA全长为2 668 bp,其ORF为1 704 bp,编码567个氨基酸,通过在线预测其蛋白分子量为63.87 kDa,等电点为6.06。采用RT-PCR方法得到了BmSCRB8的时空表达谱,结果表明BmSCRB8在家蚕各组织以及血液各时期均有表达,且在脂肪体中表达量最高,变态发育时期表达量较高。原核表达获得BmSCRB8重组蛋白,并经由蛋白纯化、免疫小鼠后制备得到家蚕BmSCRB8多克隆抗体。同时构建了BmSCRB8真核表达载体并转染家蚕胚胎细胞系。免疫荧光及过表达结果显示BmSCRB8主要定位于细胞膜上,Western blotting结果显示免疫小鼠后所得到的抗血清可特异性识别BmSCRB8蛋白。
关键词: 家蚕 BmSCRB8 表达谱 多克隆抗体 亚细胞定位
Cloning and expression of scavenger receptor class B BmSCRB8 in silkworm Bombyx mori
Zhao Yuzu, Zhang Kui, Tang Mei, Xu Man, Li Chongyang, Pan Guangzhao, Shen Li, Cui Hongjuan, Yang Liqun


State Key Laboratory of Silkworm Genome Biology, Southwest University, Chongqing 400716, China
Received: January 12, 2016; Accepted: June 15, 2016
Supported by:National Basic Research Program of China (973 Program) (No. 2012CB114603), National Natural Science Foundation of China (No. 81201551), the Fundamental Research Funds for the Central Universities (No. XDJK2013B020), Disciplinary Team Program of the Fundamental Research Funds for the Central Universities (No. 2362015XK09), Postgraduate Technology Innovation Program of Chongqing (No. CYB2015067), Basic Research Specialized Funds of Southwest University (No. XDJK2015D021)
Corresponding authors:Liqun Yang. Tel: +86-23-68251712; E-mail: cysylq@swu.edu.cn
Abstract: Scavenger receptor class B is involved in various indispensable physiological processes, like the formation and inhibition of atherosclerosis or other cardiovascular diseases, innate immune defense and the removal of apoptotic cells. Here, we cloned BmSCRB8, a member of scavenger receptor class B in silkworm. We obtained the full-length cDNA sequence of BmSCRB8 by rapid amplification of cDNA ends (RACE), including 2 668 bp. The ORF of BmSCRB8 is 1 704 bp, encoding 567 amino acids. Online software prediction indicated that the molecular weight of BmSCRB8 is 63.87 kDa and the isoelectric point (pI) is 6.06. The space-time expression profile of BmSCRB8 was detected by reverse transcription PCR (RT-PCR), which implicated that BmSCRB8 is extensively expressed in each tissue and at each stage of blood. In addition, BmSCRB8 is highest expressed in fat body of silkworm, and is highly expressed in metamorphosis periods. Anti-BmSCRB8 polyclonal antibody was generated through prokaryotic expression, protein purification and mice immunization. Simultaneously, weconstructed BmSCRB8 eukaryotic vector and then transfected embryonic cell line of silkworm. Immunofluorescence and overexpression showed that BmSCRB8 expressed specifically in membrane. Western blotting demonstrated that BmSCRB8 protein can be specifically recognized by anti-serum generated after mice immunization.
Key words: bombyx mori BmSCRB8 expression profile polyclonal antibody subcellular localization
清道夫受体 (SR) 是一类细胞膜糖蛋白,能够识别并结合诸如氧化低密度脂蛋白、细菌、凋亡细胞等多聚阴离子配体[1-5]。根据美国国立卫生研究院15位清道夫受体领域专家的讨论研究,清道夫受体包括10种不同的亚类 (A-J)[5]。其中B类清道夫受体 (SR-B) 包括CD36、SR-BⅠ及其剪切变体SR-B Ⅱ和LIMP Ⅱ (Lysosomal integral membrane protein Ⅱ) 4个成员[1, 5-7]。SR-B主要参与到动脉粥样硬化、炎症反应、宿主防御、血管生成、凋亡细胞清除等生理过程[7-12]。本研究中的BmSCRB8即为家蚕中CD36基因的同源基因之一。1976年,Okumura等[13-14]发现一种血小板膜表面糖蛋白并将其命名为糖蛋白Ⅳ (G Ⅳ),即CD36。在昆虫中,关于CD36研究主要集中在果蝇里。目前,果蝇中了解到的CD36同源基因主要有3个。Croquemort (Catcher of death) 基因,主要介导吞噬并且在凋亡细胞的清除中发挥作用[15];ninaD基因,在果蝇中参与类胡萝卜素的转运过程[16];SNMP (Sensory neuron membrane protein),表达于触角的嗅觉感觉神经 (OSNs),在果蝇中参与信息素的探测[17-18]。在家蚕中,B类清道夫受体 (SR-B) 家族基因均具有CD36结构域。目前,有关家蚕SR-B家族的研究较少,2008年Tanaka等在对家蚕全基因组中免疫相关基因进行鉴定时,分析获得了13个家蚕SR-B基因[19]。2010年,Sakudoh等证实了家蚕的黄茧基因C (Yellow cocoon) 编码Cameo2蛋白——B类清道夫受体家族 (SR-B) 的一个成员[20]。随后,该课题组又鉴定得到了另一个与β-胡萝卜素转运相关的蛋白SCRB15,该蛋白由Fresh (F) 基因编码,与Cameo2蛋白的氨基酸相似性为26%[21]。Dong等[22-23]克隆得到了家蚕B类清道夫家族的两个成员:SCRBQ1和SCRBQ4,在对其功能的初步探索中,推测这两个基因均能结合大肠杆菌和金黄色葡萄球菌。家蚕作为中国最主要的经济昆虫之一,同时也是鳞翅目昆虫的典型代表。对家蚕BmSCRB8基因的研究,一方面,可将家蚕作为模式生物进一步丰富对SR-B家族基因的功能研究;另一方面,也可以弄清BmSCRB8在家蚕中发挥的具体作用以及该基因参与的相关的生理活动,丰富对家蚕功能基因的研究。本文通过RACE技术克隆得到了家蚕B类清道夫受体家族的一个成员BmSCRB8,并对其基因结构特征、时空表达谱和亚细胞定位进行了分析研究。
1 材料与方法1.1 材料与试剂大造 (P50),取自西南大学家蚕基因资源库。幼虫在27 ℃,相对湿度80%的条件下常规桑叶饲育。RNA提取试剂盒购自Omega公司。HiFi酶、限制性内切酶、载体PMD19-T、DNA marker、Solution Ⅰ连接酶为TaKaRa公司产品。质粒提取试剂盒购自Qiagen公司。胶回收试剂盒购自Axygen公司。RACE试剂盒、转染试剂均购自Invitrogen公司。引物由华大基因合成。多聚甲醛购自生工生物工程 (上海) 股份有限公司。抗荧光猝灭剂和DAPI为碧云天公司产品。
1.2 方法1.2.1 总RNA提取及cDNA合成各组织材料通过解剖5龄3 d家蚕得到,包括头、表皮、中肠、丝腺、脂肪体、马氏管、精卵巢和血液。同时取4龄3 d起各时期家蚕血液,将Trizol直接加入血细胞中进行裂解,其他组织先在液氮中研磨为粉末后再加入Trizol,利用反转录试剂盒反转得到cDNA模板。
1.2.2 RACE法扩增BmSCRB8的全长序列从SilkDB (http://www.silkdb.org/silkdb/) 下载预测的BmSCRB8的mRNA序列,根据预测的mRNA序列设计扩增BmSCRB8基因的特异引物 (表 1)。以家蚕5龄3 d脂肪体cDNA为模板扩增BmSCRB8基因的部分序列,克隆及测序验证后,根据该序列设计特异引物 (表 1) GSP1、GSP2、NGSP1和NGSP2。根据GeneRacerTM RACE Ready cDNA Kit说明书 (Invitrogen) 扩增3′和5′端。经1%琼脂糖凝胶电泳检测回收扩增产物,进行T克隆,测序后拼接得到BmSCRB8的cDNA序列。
1.2.3 BmSCRB8蛋白序列分析在通过RACE法获得BmSCRB8基因全长cDNA序列后,通过在线软件ORF Finder (http://www.ncbi.nlm.nih.gov/gorf/gorf.html) 对BmSCRB8的ORF序列进行预测并得到其所翻译的氨基酸序列。运用在线软件TMHMM Server v. 2.0 (http://www.cbs.dtu.dk/services/TMHMM/)、SMART (http://smart.embl-heidelberg.de/)、Protein isoelectric point calculator (http://isoelectric. ovh.org/)、SignalP 4.1 Server (http://www.cbs. dtu.dk/services/SignalP/)、ExPasy (http://www. expasy.org/tools/) 预测蛋白的分子量、等电点、结构域等信息,并对其内含子外显子情况进行分析。
1.2.4 BmSCRB8蛋白进化分析根据RACE得到的BmSCRB8基因的ORF,得到其编码的氨基酸全长,在NCBI中进行比对后下载了16个物种的同源序列,通过Clustalx软件比对其序列,导入MEGA 6软件以NJ法构建进化树。
1.2.5 BmSCRB8表达谱分析以家蚕5龄3 d各组织和4龄3 d到熟蚕各时期血液cDNA为模板对BmSCRB8进行RT-PCR检测,内参为肌动蛋白3 (BmActin3),引物序列列于表 1。PCR体系:模板0.1 μg,20 μmol/μL上下游引物各0.5 μL,10×HiFi 缓冲液 2.5 μL,2.0 mmol/L,dNTPs 2 μL,HiFi酶0.2 μL,双蒸水补齐至25 μL。PCR反应条件:94 ℃预变性5 min,95 ℃变性30 s、55 ℃退火30 s、72 ℃延伸1 min 40 s,共25个循环,最后72 ℃延伸10 min,12 ℃保存。各取5 μL PCR产物进行琼脂糖凝胶电泳,分析得到表达谱。
表 1 引物序列Table 1 Primer sequences
| Primer names | Primer sequences (5'-3') |
| BmSCRB8-F | ACCGTGCCAGGCTGTACTA |
| BmSCRB8-R | ATTTCTGCGGGCGTTTT |
| GSP1 | GTCGTCATATCCCCACAGAAACCTGT |
| NGSP1 | GCCATCCCTCACTTGCTCCCAGTTA |
| GSP2 | TGGAAGAGACCATTTGACTTATTG |
| NGSP2 | CGCTACAAGATGCCGGTGAATGTT |
| BmSCRB8-YH-F (BamH Ⅰ) | CGGGATCCAATACAATCAACGATGCTATCTTAT |
| BmSCRB8-YH-R (Xho Ⅰ) | CCCTCGAGtGGTCGAGAAAGTTCCGTGG |
| BmSCRB8-CDS-F (Hind Ⅲ) | CCCAAGCTTATGGAAAATCTCAACGGC |
| BmSCRB8-CDS-R (Xho Ⅰ) | CCGCTCGAGAGAGCTATCTTGGTTCTTTGTT |
表选项
1.2.6 BmSCRB8原核表达根据BmSCRB8全长序列及生物信息学分析选取特异性片段,设计带有BamH Ⅰ、Xho Ⅰ酶切位点的特异引物序列,引物序列见表 1。进行PCR扩增,并将扩增得到片段构建到原核表达载体pET-28(a) 中,即为pET-28(a)-BmSCRB8。转化后经卡那霉素抗性筛选后挑取阳性克隆,摇菌提取质粒,转化Rosseta感受态,接种单菌落于含卡那霉素的LB培养基中培养12 h后,分别转接100 μL于4份卡那霉素抗性的10 mL LB培养基中,37 ℃、220 r/min摇菌至OD600值为0.8-1.0时,其中3份加入终浓度为 1 mmol/L的IPTG,1份不加IPTG作为对照,分别在16 ℃、25 ℃、37 ℃,220 r/min的条件下进行培养。其中16 ℃培养24 h,25 ℃培养16 h,37 ℃培养8 h。离心弃上清收集菌体,并用PBS清洗菌体数次,以PBS重悬菌体后置于冰上进行超声破碎直至菌液透亮为止。离心分别收集上清和沉淀,取20 μL蛋白加入5 μL SDS-PAGE上样缓冲液 (5×) 沸水浴30 min变性,采用5%浓度浓缩胶与10%浓度分离胶进行SDS-PAGE电泳。考马斯亮蓝染色分析。分别接100 μL于4份卡那霉素抗性的10 mL LB培养基中,37 ℃、220 r/min摇菌至OD600值为0.8-1.0时,其中3份分别加入终浓度为0.05 mmol/L、0.1 mmol/L、0.2 mmol/L的IPTG,1份不加IPTG作为对照,在16 ℃、220 r/min条件下进行培养。收集菌体后依次进行超声破碎,收集上清、沉淀,SDS-PAGE电泳、考染检测。最终发现优化条件后,蛋白始终诱导在沉淀中。比较条件后最终选择16 ℃、24 h、220 r/min、IPTG终浓度为1 mmol/L的条件进行大规模诱导。
1.2.7 BmSCRB8蛋白纯化接菌培养至OD600值介于0.8到1.0之间时,在16 ℃、220 r/min的条件下用1 mmol/L IPTG诱导表达24 h。收集菌体,50 mmol/L Tris-HCl重悬后,高压破碎收集沉淀。尿素溶解后用 0.45 m滤膜抽滤进行Ni离子亲和柱纯化,使用不同浓度咪唑进行梯度洗脱,收集洗脱液后用SDS-PAGE分析蛋白纯化情况。考马斯亮蓝染色后选择条带单一梯度进行透析、浓缩后加入30%甘油于-80 ℃保存蛋白。用纯化好的重组蛋白免疫昆明鼠,腹腔注射。共5次,蛋白量依次为50、70、100、120、140 μg,其中前3次间隔为10 d,第4次15 d,第5次21 d。在第5次免疫小鼠3 d后摘取小鼠眼球取血,通过梯度离心最终得到抗血清,加入30%甘油后分装保存于-80 ℃。
1.2.8 BmSCRB8过表达载体构建及细胞转染根据BmSCRB8全长设计特异性过表达引物,引物序列见表 1。扩增得到BmSCRB8全长ORF序列片段,将该片段连接至PIZ-OpIE2-EGFP载体,转化后挑取阳性克隆测序验证。该过表达质粒命名为PIZ-OpIE2-BmSCRB8-EGFP。在24孔板内放入24孔细胞培养板盖玻片,细胞铺板后用无抗Grace培养基培养家蚕胚胎细胞系,待细胞生长达到对数期时,进行质粒转染。将 0.5 μg质粒加入100 μL无抗无血清的Grace培养基中,混匀,加入1.5 μL脂质体,轻柔混匀,室温孵育30 min。将质粒-脂质体混合液加入 24孔板中,培养6 h后换正常培养基。转染3 d后用4%多聚甲醛固定15 min,Hochest染核 10 min,封片,共聚焦观察。
1.2.9 免疫荧光检测BmSCRB8亚细胞定位4龄眠时期家蚕解剖取脂肪体,PBS洗后以4%多聚甲醛固定30 min,0.3%TritonX-100打孔30 min,用含有10%山羊血清的1%BSA在37 ℃条件下进行封闭,4 ℃孵育一抗 (即BmSCRB8抗血清1∶500稀释) 过夜。PBS洗一抗后室温避光孵育二抗 (1∶2 000稀释) 2 h。PBS洗二抗后用Hochest染核,室温避光2 h。挑取组织到滴加了抗荧光淬灭剂的载玻片上,盖上盖玻片,于4 ℃避光压片过夜。封片,Olympus FV1000共聚焦荧光显微镜观察BmSCRB8的细胞定位情况。
1.2.10 Western blotting检测BmSCRB8抗血清特异性以原核表达并纯化得到的重组蛋白作为样品,通过Western blotting实验检测抗血清的特异性。通过SDS-PAGE凝胶电泳分离蛋白,转移蛋白至PVDF膜上后用5% BSA室温封闭2 h,4 ℃孵育一抗 (即BmSCRB8抗血清) 过夜,一抗1∶5 000稀释。TBST洗一抗后孵育二抗,1∶10 000稀释,室温2 h。TBST洗二抗后曝光。
2 结果与分析2.1 家蚕BmSCRB8基因全长克隆与分析根据数据库预测结果,以家蚕5龄3 d脂肪体的cDNA作为模板进行PCR扩增,克隆得到长度为1 612 bp的中间序列。根据克隆得到的序列,通过RACE技术扩增得到5′末端序列和3′末端序列,分别为541 bp和1 441 bp,拼接得到长为2 668 bp的BmSCRB8全长序列 (图 1A)。序列提交GenBank,登录号为KU866108。其中含有一个长度为1 704 bp的开放阅读框 (ORF),编码567个氨基酸,通过在线软件预测得到其蛋白分子量为63.87 kDa,等电点 (PI) 为6.06;同时还包括121 bp长的5'非编码片段 (5'-UTR) 和843 bp长的3'非编码片段 (3'UTR) (图 1B)。在线数据库分析结果显示,BmSCRB8基因位于23号染色体 (图 1D),为多外显子基因,基因全长34 364 bp,其中包括12个外显子和11个内含子 (图 1C)。
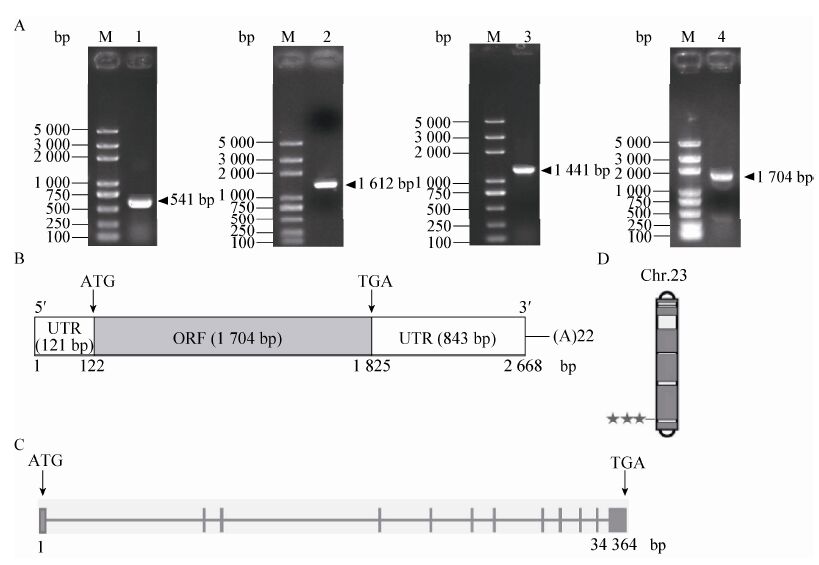 |
| 图 1 家蚕B型清道夫受体BmSCRB8的克隆及分析 Figure 1 Cloning and analysis ofBmSCRB8. (A) 1% agar gel analysis of BmSCRB8 PCR product. M: DNA marker; 1: 5′RACE product; 2: PCR product of intermediate sequence; 3: 3′RACE product; 4: PCR product of coding sequence. (B) The diagram of theBmSCRB8complete cDNAsequence. ATG: initiator codon; TGA: termination codon; UTR: untranslated regions; ORF: open reading frame. (C) The analysis of the BmSCRB8 complete genomic sequence; the length of horizontal lines represent the length of exon; the width of vertical lines represent the length of intron; ATG: initiator codon; TGA: termination codon. (D) Chromosomal localization of BmSCRB8. |
| 图选项 |
2.2 家蚕B类清道夫受体BmSCRB8蛋白结构分析通过在线网站TMHMM Server v.2.0 (http://www.cbs.dtu.dk/services/TMHMM/),SMART (http://smart.embl-heidelberg.de/),分析发现BmSCRB8在76-98、522-544存在两个典型的跨膜结构域,两个胞内区域1-75、545-567 (图 2A) 和一个胞外区域99-521 (CD36结构域) (图 2B)。利用NetNGlyc 1.0 server (http://www.cbs.dtu.dk/services/ NetNGlyc/) 和NetPhos 2.0 server (http://www. cbs.dtu.dk/services/NetPhos/) 进行预测,发现该蛋白有4个N-糖基化位点以及27个磷酸化位点,其中包括11个Ser、9个Thr和7个Tyr (图 2C)。
 |
| 图 2 家蚕BmSCRB8蛋白结构分析 Figure 2 Analysis of theBmSCRB8 protein. (A) Structure prediction of the BmSCRB8 protein. (B) CD36 domain of BmSCRB8. (C) Phosphorylation sites and N-Glycosylation sites of BmSCRB8; enlarged black font represent phosphorylation sites. |
| 图选项 |
2.3 同源与进化分析对16种与BmSCRB8具有同源序列的物种进行聚类分析,结果如图 3所示。从进化树来看,家蚕BmSCRB8与同为鳞翅目的小菜蛾的B类清道夫受体最为接近。
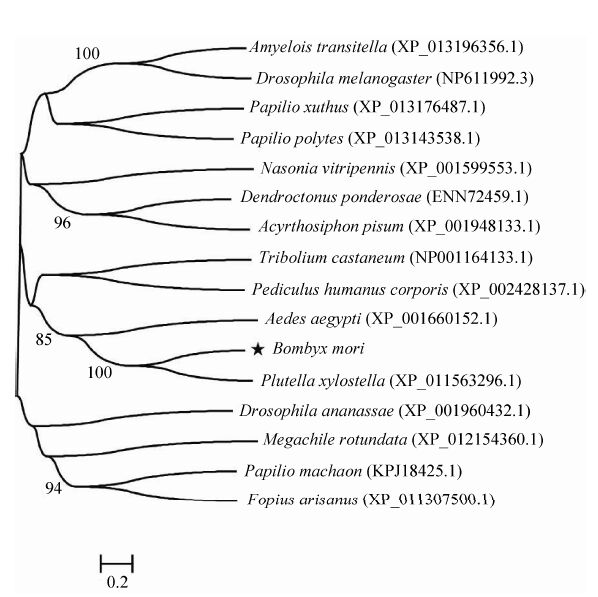 |
| 图 3 家蚕BmSCRB8进化分析 Figure 3 The phylogenetic tree of BmSCRB8. |
| 图选项 |
2.4 家蚕BmSCRB8的时空表达分析利用RT-PCR技术,以5龄3 d家蚕各组织,包括头、表皮、中肠、丝腺、脂肪体、马氏管、精巢、卵巢和血液的cDNA作为模板分析BmSCRB8在各组织中的表达情况。结果显示BmSCRB8在以上组织中均有表达,且在脂肪体中表达量最高,精卵巢次之 (图 4A)。为进一步分析BmSCRB8基因在家蚕幼虫各时期的表达情况,我们获取从4龄3 d到熟蚕时期的脂肪体cDNA作为模板,RT-PCR结果显示BmSCRB8从4龄3 d到熟蚕时期持续性表达,且在变态发育时期,即4龄眠和上蔟时期高表达 (图 4B)。
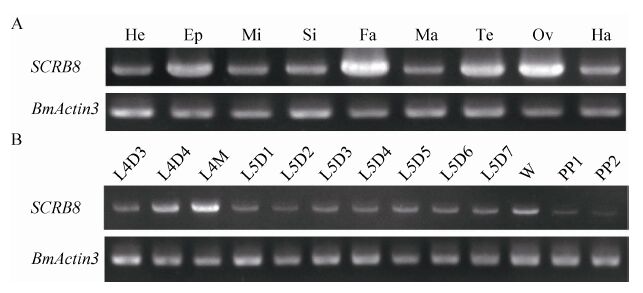 |
| 图 4 家蚕BmSCRB8在家蚕幼虫各组织及脂肪体各时期的时空表达谱 Figure 4 The space-time expression profile of BmSCRB8 in different tissues and at different stages. (A) The expression profile of BmSCRB8 in different tissues from the 3rd of 5th larval. He: Head; Ep: Epidermis; Mi: Midgut; Si: Silk gland; Fa: Fat body; Ma: Malpighian tubules; Te: Testis; Ov: Ovary; Ha: Haemocyte. (B) The expression profile of BmSCRB8 in different stages of fat body from the 3rd day of the 4th larval to the 2nd day of spinning. L4D3: 3rd day of 4th larval; L4D4: the 4th day of the 4th larval; L4M: molting period of the 4th larval; L5D1: the 1st day of 5th larval; L5D2: 2nd day of the 5th larval; L5D3: the 3rd day of the 5th larval; L5D4: the 4th day of the 5th larval; L5D5: the 5th day of the 5th larval; L5D6: 6th day of the 5th larval; L5D7: the 7th day of the 5th larval; W: wondering stage; PP1: the 1st day of prepupa; PP2: the 2nd day of prepupa. |
| 图选项 |
2.5 BmSCRB8的原核表达选择家蚕BmSCRB8蛋白99-521 aa段序列,设计特异性引物进行PCR扩增,引物序列见 表 1。经BamH Ⅰ和Xho Ⅰ双酶切后将该片段连接到PMD19-T载体上进行测序,得到正确的BmSCRB8序列。将该片段克隆到pET-28a (+) 载体上,经BamH Ⅰ和Xho Ⅰ双酶切,出现935 bp的特异性片段 (图 5A),成功获得重组表达质粒pET-28a(+)-BmSCRB8。转化Rosseta表达菌株,加入终浓度为1 mmol/L 的IPTG,16 ℃诱导24 h,得到原核表达产物。SDS-PAGE电泳结果显示,获得41 kDa大小的pET-28a(+)- BmSCRB8重组蛋白,其中BmSCRB8片段为 36.1 kDa,该蛋白存在于两个跨膜区域中间,且以包涵体形式存在 (图 5B)。并且优化表达条件后,BmSCRB8蛋白始终存在于包涵体中 (图 5C)。
 |
| 图 5 家蚕BmSCRB8原核表达、蛋白纯化及抗体制备 Figure 5 The prokaryotic expression and protein purification of BmSCRB8 and the preparation of anti-BmSCRB8. (A) The construction of the pET-28a(+)-BmSCRB8 plasmid. M: marker; 1: PCR product of BmSCRB8; 2: PMD 19-T- BmSCRB8 plasmid; 3: pET-28a(+) empty vector; 4: restriction enzyme digestion of PMD 19-T-BmSCRB8 plasmid; 5: restriction enzyme digestion of pET-28a(+) plasmid; 6: pET-28a(+)-BmSCRB8 plasmid; 7: restriction enzyme digestion of pET-28a(+)-BmSCRB8 plasmid; (B) The temperature gradient induction of BmSCRB8 recombinant protein (The concentration of IPTG is 1 mmol/L). M: marker; 1: non-induced supernatant (IPTG free); 2: non-induced sediment (IPTG free); 3: the soluble fraction induced at 16 ℃; 4: the inclusion body induced at 16 ℃; 5: the soluble fraction induced at 25 ℃; 6: the inclusion body induced at 25 ℃; 7,8: the soluble fraction induced at 37 ℃; 9: the inclusion body induced at 37 ℃; (C) The concentration of IPTG induction of BmSCRB8 recombinant protein (16 ℃,24 h). M: marker; 1: non-induced supernatant (IPTG free); 2: non-induced sediment (IPTG free); 3: the soluble fraction induced by 0.05 mmol/L IPTG; 4: the inclusion body induced by 0.05 mmol/L IPTG; 5: the soluble fraction induced by 0.1 mmol/L IPTG; 6: the inclusion body induced by 0.1 mmol/L IPTG; 7: the soluble fraction induced by 0.2 mmol/L IPTG; 8: the inclusion body induced by 0.2 mmol/L IPTG; (D) The purification of BmSCRB8 recombinant protein and the preparation of theBmSCRB8 anti-serum. M: marker; 1: the inclusion body induced by 1 mmol/L IPTG at 16 ℃ for 24 h; 2: the soluble fraction induced by 1 mmol/L IPTG at 16 ℃ for 24 h; 3: the purified inclusion body; 4: the detection of purified protein by the BmSCRB8 anti-serum. |
| 图选项 |
2.6 BmSCRB8的蛋白纯化及抗体制备大规模诱导产生包涵体蛋白后,通过Ni+亲和层析法纯化蛋白,得到纯度>99%的BmSCRB8重组蛋白。用纯化的家蚕BmSCRB8重组蛋白免疫昆明鼠,获得鼠源抗血清。将纯化得到的重组蛋白进行SDS-PAGE电泳后,以免疫得到的抗血清作为一抗进行孵育后在41 kDa附近得到单一条带 (图 5D),表明我们得到较为特异性的BmSCRB8抗血清。
2.7 BmSCRB8蛋白的亚细胞定位通过PCR扩增得到BmSCRB8的全长ORF片段,克隆到PIZ-OpIE2-EGFP载体上,将该质粒命名为PIZ-OpIE2-BmSCRB8-EGFP (图 6A)。分别用PIZ-OpIE2-EGFP和PIZ-OpIE2-BmSCRB8- EGFP转染家蚕胚胎细胞系72 h后,固定细胞,Hochest染核,通过共聚焦显微镜进行观察,结果显示对照质粒转染细胞后整个细胞均匀分布着EGFP阳性信号,而在重组质粒转染的细胞中,EGFP信号则特异性地表达于细胞膜上,反映出BmSCRB8蛋白定位于细胞膜上 (图 6B)。
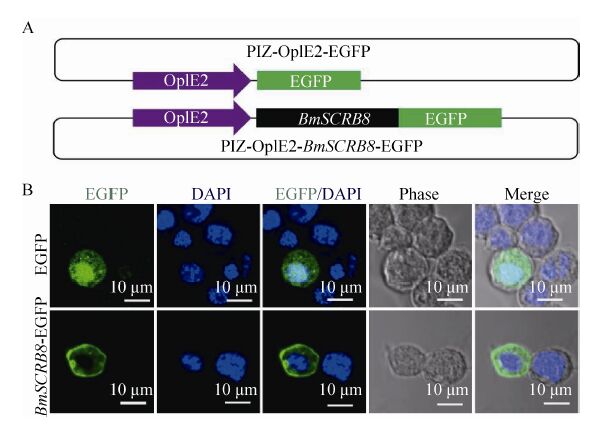 |
| 图 6 家蚕胚胎细胞系中BmSCRB8蛋白的亚细胞定位 Figure 6 The subcellular localization of BmSCRB8 in embryonic cell line. (A) PIZ-OpIE2-EGFP vector; PIZ-OpIE2- BmSCRB8-EGFP vector. (B) The cells transfected with PIZ-OpIE2-EGFP and PIZ-OpIE2-BmSCRB8-EGFP respectively. |
| 图选项 |
2.8 BmSCRB8抗血清检测以纯化得到的重组蛋白作为抗原,通过ELISA技术测定BmSCRB8抗血清效价,见表 2。
表 2 BmSCRB8抗血清效价Table 2 Titer of BmSCRB8 anti-serum
| The diluted multiples of antibody | OD450 (Absorbance value at 450 nm) | ||
| 1 | 2 | 3 | |
| 1:500 | 1.632 | 1.598 | 1.614 |
| 1:1 000 | 1.561 | 1.573 | 1.568 |
| 1:2 000 | 1.543 | 1.552 | 1.539 |
| 1:4 000 | 1.531 | 1.523 | 1.528 |
| 1:8 000 | 1.508 | 1.519 | 1.496 |
| 1:16 000 | 1.492 | 1.503 | 1.487 |
| 1:32 000 | 1.458 | 1.471 | 1.476 |
| 1:64 000 | 1.406 | 1.425 | 1.412 |
| 1:128 000 | 1.308 | 1.297 | 1.316 |
| 1:256 000 | 0.167 | 0.153 | 0.149 |
| Negative serum | 0.178 | 0.142 | 0.160 |
表选项
取家蚕5龄3 d到5龄6 d脂肪体,提取蛋白后进行Western blotting分析,结果显示在 63.87 kDa附近有单一条带,表明我们自制的抗血清能够特异性识别BmSCRB8蛋白 (图 7A)。随后,取家蚕4龄眠时期的脂肪体进行免疫荧光,结果显示BmSCRB8蛋白特异性表达于细胞膜上 (图 7B),与过表达结果相一致,进一步证明了BmSCRB8抗血清的特异性。
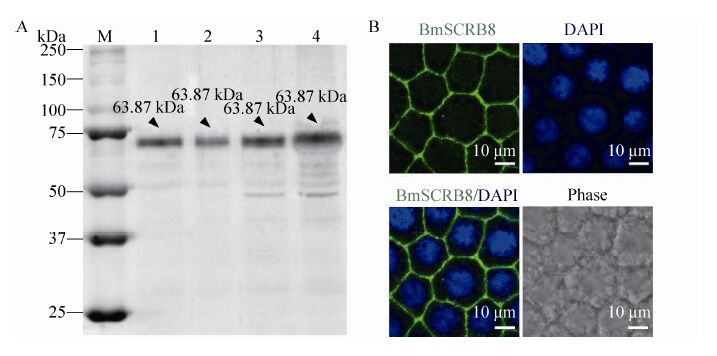 |
| 图 7 BmSCRB8抗血清检测 Figure 7 The detection of the BmSCRB8 anti-serum. (A) Detection of BmSCRB8 anti-serum by western blotting. M: marker; 1: the fat body in 3rd day of 5th larval; 2: the fat body in 4th day of 5th larval; 3: the fat body in 5th day of 5th larval; 4: the fat body in 6th day of 5th larval. (B) Detection of BmSCRB8 anti-serum by immunofluorescence. |
| 图选项 |
3 讨论B类清道夫受体 (SR-B) 是一类跨膜的细胞表面糖蛋白,其主要表达于巨噬细胞、血管上皮细胞、脂肪细胞等,参与到诸如动脉粥样硬化、炎症反应、宿主防御、血管生成、凋亡细胞清除等生理过程中[24]。目前而言,SR-B的研究主要集中于哺乳动物中,此外。昆虫中对于果蝇SR-B的研究相对较多,多集中于对SR-B在类胡萝卜素转运、信息素探测等生理过程中的功能[16-25]。在家蚕中,关于SR-B的功能鲜有报导。现有的研究提到SR-B在宿主防御方面的功能,也有部分研究针对于家蚕黄茧的形成,即类胡萝卜素的转运[19, 21, 23]。开展对家蚕BmSCRB8基因的研究,一方面可将家蚕作为模式生物,更为方便地进行体内基因编辑,对SR-B进行深入研究,为哺乳动物的研究提供参考借鉴;另一方面也能进一步丰富对家蚕功能基因的研究,为害虫防治提供理论依据。本文通过PCR和RACE技术克隆得到家蚕BmSCRB8基因的全长对其编码的蛋白序列进行分析后发现,BmSCRB8为具有CD36结构域的两次跨膜糖蛋白,为典型的SR-B家族成员。同时也对BmSCRB8蛋白重要的功能位点 (磷酸化、糖基化) 进行了预测,该蛋白有4个N-糖基化位点和27个磷酸化位点,包括11个Ser、9个Thr和7个Tyr。这些位点能够指导后续的功能研究。
在昆虫中,脂肪体相当于哺乳动物中的肝脏并且在昆虫的生长发育和变态过程中发挥极其重要的作用[26]。有研究表明,昆虫中脂肪体能在宿主免疫防御过程中快速产生抗菌肽进而参与到免疫应答中[27],此外,昆虫脂肪体还能参与到代谢中,合成血淋巴相关蛋白[28-29],也能间接参与到免疫防御活动中[30-31]。对家蚕5龄3 d各组织的表达谱进行分析发现,BmSCRB8基因在各组织中均有明显表达,且在脂肪体中表达量最高。而从家蚕4龄3 d到熟蚕时期的表达谱显示,BmSCRB8在各时期持续性表达,且在变态发育时期 (即眠期和上蔟时期) 表达量较高。推测BmSCRB8可能参与到家蚕免疫反应中。
本研究构建了PIZ-OpIE2-BmSCRB8-EGFP过表达质粒并转染家蚕胚胎细胞系共聚焦显微镜观察,转染了PIZ-OpIE2-BmSCRB8-EGFP的细胞有荧光蛋白信号表达于细胞膜上。我们进一步构建了原核表达载体pET-28(a)-BmSCRB8,并诱导其在大肠杆菌中高量表达,经纯化获得BmSCRB8原核表达蛋白,免疫昆明鼠后获得抗BmSCRB8血清,通过免疫荧光进一步表明BmSCRB8蛋白定位于脂肪体细胞膜,与过表达结果相互验证。暗示家蚕BmSCRB8蛋白可能有与哺乳动物相似的功能,作为一个跨膜糖蛋白参与到细胞膜内外的物质、能量、信号的运输与传递。促进细胞对修饰过的脂质分子的摄取,以及在与胞外配体结合后激活相关信号转导,进而参与到噬菌、炎症反应等生理过程。Western blotting结果证明我们得到了较为特异的BmSCRB8,为进一步对家蚕BmSCRB8基因的研究提供了重要的检测依据。
参考文献
| [1] | Murphy JE, Tedbury PR, Homer-Vanniasinkam S, et al. Biochemistry and cell biology of mammalian scavenger receptors.Atherosclerosis,2005, 182(1): 1–15.DOI: 10.1016/j.atherosclerosis.2005.03.036 |
| [2] | González-Lázaro M, Dinglasan RR, de la Cruz Hernández-Hernández F, et al. Anopheles gambiae Croquemort SCRBQ2, expression profile in the mosquito and its potential interaction with the malaria parasite Plasmodium berghei.Insect Biochem Mol Biol,2009, 39(5/6): 395–402. |
| [3] | Jones RS, Minogue AM, Connor TJ, et al. Amyloid-β-induced astrocytic phagocytosis is mediated by CD36, CD47 and RAGE.J Neuroimmune Pharmacol,2013, 8(1): 301–311.DOI: 10.1007/s11481-012-9427-3 |
| [4] | Plüddemann A, Mukhopadhyay S, Gordon S. The interaction of macrophage receptors with bacterial ligands.Expert Rev Mol Med,2006, 8(28): 1–25. |
| [5] | PrabhuDas M, Bowdish D, Drickamer K, et al. Standardizing scavenger receptor nomenclature.J Immunol,2014, 192(5): 1997–2006.DOI: 10.4049/jimmunol.1490003 |
| [6] | Neculai D, Schwake M, Ravichandran M, et al. Structure of LIMP-2 provides functional insights with implications for SR-BI and CD36.Nature,2013, 504(7478): 172–176.DOI: 10.1038/nature12684 |
| [7] | Baranova IN, Vishnyakova TG, Bocharov AV, et al. Class B scavenger receptor types I and II and CD36 mediate bacterial recognition and proinflammatory signaling induced by Escherichia coli, lipopolysaccharide, and cytosolic chaperonin 60.J Immunol,2012, 188(3): 1371–1380.DOI: 10.4049/jimmunol.1100350 |
| [8] | Erdman LK, Cosio G, Helmers AJ, et al. CD36 and TLR interactions in inflammation and phagocytosis: implications for malaria.J Immunol,2009, 183(10): 6452–6459.DOI: 10.4049/jimmunol.0901374 |
| [9] | Kim E, Tolhurst AT, Qin LY, et al. CD36/fatty acid translocase, an inflammatory mediator, is involved in hyperlipidemia-induced exacerbation in ischemic brain injury.J Neurosci,2008, 28(18): 4661–4670.DOI: 10.1523/JNEUROSCI.0982-08.2008 |
| [10] | Seizer P, Schiemann S, Merz T, et al. CD36 and macrophage scavenger receptor a modulate foam cell formation via inhibition of lipid-laden platelet phagocytosis.Semin Thromb Hemost,2010, 36(2): 157–162.DOI: 10.1055/s-0030-1251499 |
| [11] | Stewart CR, Stuart LM, Wilkinson K, et al. CD36 ligands promote sterile inflammation through assembly of a toll-like receptor 4 and 6 heterodimer.Nat Immunol,2010, 11(2): 155–161.DOI: 10.1038/ni.1836 |
| [12] | Cai L, Ji AL, de Beer FC, et al. SR-BI protects against endotoxemia in mice through its roles in glucocorticoid production and hepatic clearance.J Clin Invest,2008, 118(1): 364–375.DOI: 10.1172/JCI31539 |
| [13] | Okumura T, Jamieson GA. Platelet glycocalicin. I. Orientation of glycoproteins of the human platelet surface.J Biol Chem,1976, 251(19): 5944–5949. |
| [14] | Okumura I, Lombart C, Jamieson GA. Platelet glycocalicin. II. Purification and characterization.J Biol Chem,1976, 251(19): 5950–5955. |
| [15] | Franc NC, Dimarcq JL, Lagueux M, et al. Croquemort, a novel drosophila hemocyte/ macrophage receptor that recognizes apoptotic cells.Immunity,1996, 4(5): 431–443.DOI: 10.1016/S1074-7613(00)80410-0 |
| [16] | Voolstra O, Kiefer C, Hoehne M, et al. The Drosophila class B scavenger receptor NinaD-I is a cell surface receptor mediating carotenoid transport for visual chromophore synthesis.Biochemistry,2006, 45(45): 13429–13437.DOI: 10.1021/bi060701u |
| [17] | Nichols Z, Vogt RG. The SNMP/CD36 gene family in Diptera, Hymenoptera and Coleoptera: Drosophila melanogaster, D. pseudoobscura, Anopheles gambiae, Aedes aegypti, Apis mellifera, and Tribolium castaneum.Ins Bio Mol Biol,2008`, 38(4): 398–415.DOI: 10.1016/j.ibmb.2007.11.003 |
| [18] | Benton R, Vannice KS, Vosshall LB. An essential role for a CD36-related receptor in pheromone detection in Drosophila.Nature,2007, 450(7167): 289–293.DOI: 10.1038/nature06328 |
| [19] | Tanaka H, Ishibashi J, Fujita K, et al. A genome-wide analysis of genes and gene families involved in innate immunity of Bombyx mori.Insect Biochem Mol Biol,2008, 38(12): 1087–1110.DOI: 10.1016/j.ibmb.2008.09.001 |
| [20] | Sakudoh T, Iizuka T, Narukawa J, et al. A CD36-related transmembrane protein is coordinated with an intracellular lipid-binding protein in selective carotenoid transport for cocoon coloration.J Biol Chem,2010, 285(10): 7739–7751.DOI: 10.1074/jbc.M109.074435 |
| [21] | Sakudoh T, Kuwazaki S, Iizuka T, et al. CD36 homolog divergence is responsible for the selectivity of carotenoid species migration to the silk gland of the silkworm Bombyx mori.J Lipid Res,2013, 54(2): 482–495.DOI: 10.1194/jlr.M032771 |
| [22] | Dong ZP. Clone, Identification and study on the function of class B scavenger receptor genes in silkworm, Bombyx mori [D]. Chongqing: Southwest University, 2011 (in Chinese). 董占鹏. 家蚕B型清道夫受体 (class B scavenger receptor) 基因的克隆鉴定及功能研究 [D]. 重庆: 西南大学, 2011.http://cdmd.cnki.com.cn/article/cdmd-10635-1011111563.htm |
| [23] | Dong ZP, Chai CL, Dai FY, et al. Expression pattern and tissue localization of the class B scavenger receptor BmSCRBQ4 in Bombyx mori.Insect Sci,2015, 22(6): 739–747.DOI: 10.1111/1744-7917.12158 |
| [24] | Benard EL, Roobol SJ, Spaink HP, et al. Phagocytosis of mycobacteria by zebrafish macrophages is dependent on the scavenger receptor Marco, a key control factor of pro-inflammatory signalling.Dev Comp Immunol,2014, 47(2): 223–233.DOI: 10.1016/j.dci.2014.07.022 |
| [25] | Kiefer C, Sumser E, Wernet MF, et al. A class B scavenger receptor mediates the cellular uptake of carotenoids in Drosophila.Proc Natl Acad Sci USA,2002, 99(16): 10581–10586.DOI: 10.1073/pnas.162182899 |
| [26] | Price GM. Protein and nucleic acid metabolism in insect fat body.Biol Rev,1973, 48(3): 333–372.DOI: 10.1111/brv.1973.48.issue-3 |
| [27] | Aggrawal K, Silverman N. Peptidoglycan recognition in Drosophila.Biochem Soc Trans,2007, 35(Pt6): 1496–1500. |
| [28] | Zhang WB, Zhou QM, Zhang K, et al. Integrin-mediated signaling pathway and its research advances in insects.Sci Sericult,2015, 41(1): 159–165.(in Chinese). 张维博, 周其明, 张奎, 等. 整合素介导的信号通路及在昆虫领域的研究进展.蚕业科学, 2015, 41(1): 159-165. |
| [29] | Su JJ, Chen SY, Zhang K, et al. Identification and expression analysis of cathepsin O gene in silkworm (Bombyx mori).Sci Agr Sin,2015, 48(22): 4564–4573.(in Chinese). 苏晶晶, 陈思源, 张奎, 等. 家蚕组织蛋白酶O (BmCatO) 基因鉴定及表达分析.中国农业科学, 2015, 48(22): 4564-4573. |
| [30] | Arrese EL, Soulages JL. Insect fat body: energy, metabolism, and regulation.Annu Rev Entomol,2010, 55: 207–225.DOI: 10.1146/annurev-ento-112408-085356 |
| [31] | Tan J, Zhang K, Xu M, et al. Identification and subcellular localization of Bmintegrin αPS3 from silkworm (Bombyx mori).Sci Agr Sin,2013, 46(22): 4808–4815.(in Chinese). 谈娟, 张奎, 徐曼, 等. 家蚕整合素基因Bmintegrin αPS3的鉴定及亚细胞定位.中国农业科学, 2013, 46(22): 4808-4815. |
