
 , 李元广1
, 李元广1

1 华东理工大学生物反应器工程国家重点实验室,上海 200237
2 上海泽元海洋生物技术有限公司,上海 200237
网络出版时间:2016-09-26
基金项目:国家科技支撑计划(No. 2011BAE06B04-16)资助
通讯作者:Daojing Zhang. Tel/Fax: +86-21-64252104; E-mail: djz@ecust.edu.cn
Yuanguang Li. Tel/Fax: +86-21-64250964; E-mail: ygli@ecust.edu.cn
摘要: 本次研究旨在建立经济可行的海洋芽孢杆菌源脂肽类化合物的中试规模纯化工艺。对包括酸化沉淀、甲醇浸提、溶剂沉淀、盐析、萃取、硅胶柱层析和HZ806大孔树脂吸附工艺在内的可放大的成熟单元工艺进行反复试验,考察脂肽类化合物表面活性对单元工艺的影响。严格遵循以高收率为前提循序渐进逐步减少杂质的原则,组合上述单元工艺对目标产物进行提取和纯化,并最终获得高纯度脂肽样品。新工艺可从1 t海洋芽孢杆菌Bacillus marinus B-9987的发酵液中,以百克量级的规模制备87.51%-100%纯度的脂肽类化合物样品,收率>81.73%。本研究首次实现了高纯度的海洋芽孢杆菌源脂肽类化合物的百克量级制备;允许发酵生产阶段使用天然培养基,缓解了脂肽中游发酵生产和下游大规模纯化之间的矛盾;且各单元工艺规避了脂肽类化合物水溶液的乳化起泡和不经济的大体积水溶液蒸发浓缩。新工艺实用可行,经济合理。
关键词: 海洋芽孢杆菌 脂肽 中试规模纯化 百克量级 放大
Pilot-scale purification of lipopeptide from marine-derived Bacillus marinus
Kangbo Gu1, Cheng Guan1, Jiahui Xu1, Shulan Li2, Yuanchan Luo1, Guomin Shen1, Daojing Zhang1

 , Yuanguang Li1
, Yuanguang Li1

1 State Key Laboratory of Bioreactor Engineering, East China University of Science and Technology, Shanghai 200237, China;
2 Shanghai Zeyuan Marine Biotechnology Co. Ltd., Shanghai 200237, China
Received: March 29, 2016; Accepted: September 12, 2016
Supported by:Key Technologies Research and Development Program of China (No. 2011BAE06B04-16)
Abstract: This research was aimed at establishing the pilot-scale purification technology of lipopeptide from marine-derived Bacillus marinus. We studied lipopeptide surfactivity interferences on scale-up unit technologies including acid precipitation, methanol extraction, solvent precipitation, salting out, extraction, silica gel column chromatography and HZ806 macroporous absorption resin column chromatography. Then, the unit technologies were combined in a certain order, to remove the impurities gradually, and to gain purified lipopeptide finally, with high recovery rate throughout the whole process. The novel pilot-scale purification technology could effectively isolate and purify lipopeptide with 87.51% to 100% purity in hectograms from 1 ton of Bacillus marinus B-9987 fermentation broth with more than 81.73% recovery rate. The first practical hectogram production of highly purified lipopeptide derived from Bacillus marinus was achieved. With this new purification method, using complex media became possible in fermentation process to reduce the fermentation cost and scale-up the purification for lipopeptide production. For practicability and economy, foaming problem resulting from massive water evaporation was avoided in this technology.
Key words: Bacillus marinus lipopeptide pilot-scale purification hectogram scale-up
自Arima等[1]从枯草芽孢杆菌的次级代谢产物中发现脂肽类化合物表面活性素(Surfactin)以来,在过去的半个世纪中已有十多种不同类型的脂肽被陆续发现[2]。脂肽类化合物的分子结构同时含有亲水基团和亲油基团,因此具有显著的表面活性和生物活性[3]:由于表面活性可降低表面张力提高烃类化合物的溶解性,脂肽类化合物及其产生菌被用于清理石油和烃类化合物所导致的环境污染[4-5];脂肽类化合物的表面活性和抗细菌活性等特点在化妆品行业具有潜在的应用前景[6];在生物医药领域,脂肽类化合物被证实具有抗真菌[7-9]、抗细菌[8, 10-11]、抗癌[8, 12-13]等生物活性,其中放线菌源的脂肽类抗生素达托霉素作为万古霉素的替代品已于2003年在美国批准上市[14];在农业领域,由于脂肽类化合物具有环境友好和可降解等优点[3, 15],具有开发成农用杀菌剂[8, 16-17]、免疫诱导剂[18]以及杀虫剂[19]等绿色农药的潜力,也是目前可持续农业的研究热点之一[15]。
目前脂肽类化合物的研究领域,主要对脂肽产生菌的代谢产物进行初步的提取和预处理,再通过薄层色谱法(TLC)[7-8, 20]、凝胶排阻层析[9, 21-22]或者高效液相色谱(HPLC)[7, 9, 21]等手段,对目标脂肽类化合物进行分离纯化,所获得的纯化样品往往极少,只能进行离体试验[7-8, 22],或者对离体的叶片和作物等进行规模较小的生测试验[9, 20],制备规模难以满足诸如田间药效试验和毒理学试验对纯品的大量需求。脂肽产业的进一步开发,亟待高纯度脂肽类化合物的规模制备工艺的建立。
然而,由于脂肽类化合物的表面活性显著,混合物中的脂肽所表现出的溶解性、极性和胶束状态(影响凝胶排阻层析和超滤的截留分子量的选择),会随着样品浓度、杂质种类和杂质数量的变化而变化,对下游分离纯化工艺的建立构成严重的干扰。目前,脂肽类化合物仅放线菌源的达托霉素的开发较为成功,主要得益于该脂肽分子的电离特性,可采用离子交换法实现其分离纯化[23-24]。而芽孢杆菌源脂肽类化合物,比如常见的表面活性素、芬荠素(Fengycin)和伊枯草菌素(Iturin)[25],均难以复制这个成功的先例。为了克服脂肽类化合物表面活性对分离纯化工艺的干扰,往往需要从源头减少杂质数量,降低下游分离纯化的难度。合成培养基组分明确而稳定,不易引入过多的杂质,适合于脂肽类化合物的分离纯化研究[25-27]。得益于合成培养基这一优点,Dhanarajan等[25]研究了大孔树脂吸附工艺,可毫克量级制备68.3%纯度伊枯草菌素、77.6%纯度芬荠素和91.6%纯度表面活性素;Zhang等[26]建立了絮凝-过滤工艺,可克量级制备79.5%纯度表面活性素;Chen等[27]研究了超滤法制备工艺,可克量级制备83%纯度表面活性素。然而,合成培养基营养单一,成本较高,多用于代谢研究以及疫苗生产,并不适用于大规模发酵生产[28]。因此上述纯化工艺的规模不过克量级和毫克量级,尚不能满足脂肽类化合物开发对纯化样品较大的需求量。
本次研究,以海洋芽孢杆菌Bacillus marinus B-9987所产新结构脂肽类化合物为研究对象,建立经济可行的高纯度脂肽类化合物的中试规模制备工艺。该工艺不但不限制中游大规模发酵对天然培养基的需求,还能从发酵产品中高效地提取和纯化目标脂肽类化合物,而且其中的单元工艺也需尽量规避脂肽水溶液的乳化起泡和不经济的大体积水溶液蒸发浓缩,保证该工艺经济实用,易于向其他芽孢杆菌源脂肽类化合物的开发领域推广。
1 材料与方法1.1 发酵生产菌、目标脂肽类化合物及发酵生产本次研究对象为海洋芽孢杆菌B. marinus B-9987所产的marihysin A、maribasin A和maribasin B新结构脂肽类化合物[16-17, 29],统称为BM脂肽类化合物。B. marinus B-9987产BM脂肽类化合物的发酵液,由上海泽元海洋生物技术有限公司生产提供。BM脂肽类化合物的发酵生产采用营养丰富的天然培养基[30],取代文献[25-27]中所报道的有利于脂肽分离纯化而不利于发酵生产的合成培养基。本次发酵规模达到2.5 t发酵液/批次(装液系数:0.5),BM发酵水平达到120 mg/L。
1.2 BM脂肽类化合物定量检测方法采用HPLC检测样品中BM脂肽类化合物的含量。液相系统:Waters 1525高压液相色谱系统和Waters 2487紫外检测器。液相条件:分析柱为Cosmoil 5C18-MS-Ⅱ (粒径5 μm,规格4.6 mm×250 mm);柱温25 ℃;进液量20 μL;以70%甲醇为流动相,流速1.0 mL/min;检测波长210 nm。根据HPLC图谱中BM目标化合物的峰面积之和,代入线性回归方程Y=23 140X-17 741 (R2=0.999 7)计算HPLC检测样品中BM物质的含量。其中,Y为BM图谱中BM目标化合物的峰面积之和,单位μV·s;X为检测样品的BM含量,单位μg/mL;该回归方程在15.62-1 000 μg/mL范围内线性关系良好。
基于精确的HPLC检测方法,结合检测样品的浓缩/稀释比例,计算出原待测样品溶液中BM物质的浓度和总量;结合干重数据,确定BM物质的纯度;同理,可以测定单元工艺前后BM物质总量的变化,计算该单元工艺的收率(得率)。
1.3 中试规模纯化工艺的研究1.3.1 中试规模纯化工艺所需仪器、材料、填料及试剂仪器为管式离心机(上海章泉离心机技术有限公司)、旋转蒸发仪(上海青浦沪西仪器厂)、循环水式真空泵(上海亚荣生化仪器厂)、电热恒温鼓风干燥箱(上海齐欣科学仪器有限公司)、层析用玻璃柱(聚四氟乙烯活塞)、布氏漏斗;耗材及填料分别为定性滤纸(杭州特种纸业有限公司)、硅胶(200-300目,上海天莲化工科技有限公司)、HZ806、HZ807、HZ816、HZ818大孔树脂(上海华震科技有限公司)、XAD 7HP大孔树脂(美国罗门哈斯公司,Rohm & Haas);工艺所需的试剂为浓盐酸(AR)、甲醇(工业级和AR)、乙醚(AR)、乙酸乙酯(AR)、氯仿(AR)、苯(AR)、二氯甲烷(AR)、正丁醇(AR)、无水硫酸镁(AR)、NaOH (AR)、硫酸铵(CP)、工业乙醇(工业级,含量95%)。
1.3.2 单元工艺研究及中试规模纯化工艺的建立本次工艺研究,分别对酸化沉淀[9, 25]、溶剂浸提[9, 31]、溶剂沉淀[32]、盐析[13, 22]、萃取[20-21]、硅胶柱层析[31, 33]和大孔树脂吸附[25]等可放大的常用单元工艺进行比较,对不同纯化阶段的脂肽类样品进行反复试验,根据各个单元工艺的特点加以整合,建立中试规模纯化工艺。
2 结果与分析2.1 单元工艺的纯化效果研究BM脂肽类化合物为胞外产物,B. marinus B-9987发酵液经管式离心机(16 000 r/min)菌液分离后,弃菌体取发酵上清液。此时,BM脂肽类化合物在发酵上清液中的含量 < 0.011%,去除水分后其在溶质中的含量也仅为0.15%,需要后续的下游工艺进行提取和纯化。
2.1.1 酸化沉淀工艺使用12 mol/L浓盐酸将B. marinus B-9987发酵上清液(BM脂肽纯度为0.15%)的pH值降至2.5-3.5之间,BM脂肽类化合物均被完全沉淀,未发现类似蛋白质沉淀的等电点。然而,当BM脂肽样品的纯度为40.01%、75.53%和87.51%时(BM脂肽水溶液的浓度同发酵上清液的120 mg/L),酸化沉淀的收率出现明显的下降,其中87.51%纯度BM脂肽样品,超过94%的BM物质酸化后未被沉淀,这个结果与发酵上清液中的实验结果完全不同,详见表 1。
表 1 酸化沉淀工艺效果Table 1 Recovery rate of acid precipitation
| Final pH | Recovery rates1 of precipitating BM samples with different purities (%) | |||
| 0.15%2 | 40.01%3 | 75.53%4 | 87.51%5 | |
| pH 2.5 | 100.00±0.00 d | 40.65±1.53 c | 20.65±1.93 b | 5.06±0.18 a |
| pH 3.0 | 100.00±0.00 d | 39.25±1.71 c | 19.97±0.27 b | 3.99±0.13 a |
| pH 3.5 | 100.00±0.00 d | 41.15±4.17 c | 22.31±0.43 b | 3.88±0.48 a |
| 1 SPSS (ver. 17.0) statistical analysis using Duncan's multiple range test at P=0.05 were expressed with the lowercase letters following data. When the lowercase letters behind data were different, it meant the statistically significant difference between the data. 2 Free cell broth. And the BM purity of the distillate was only 0.15%. 3 Acid precipitate derived from free cell broth treated with MeOH extraction, solvent precipitation, silica gel column chromatography, and HZ806 macroporous absorption resin column chromatography. 4 Sample with a purity of 40.01% treated with silica gel column chromatography. 5 Sample with a purity of 75.53% treated with HZ806 macroporous absorption resin column chromatography. | ||||
表选项
酸化沉淀的试验结果表明,脂肽分子中虽然有肽环,但其分子量远远小于蛋白质,不足以像蛋白质一样发生等电点沉淀;再者,酸化沉淀的过程,可能是酸化条件下多糖和胞外蛋白等物质形成沉淀,并将BM脂肽类化合物从上清液中完全转移至沉淀中;然而,随着脂肽类化合物样品纯度的不断提升,可以被酸化沉淀的杂质也越来越少,因此酸化沉淀的效果开始明显下降。这也从一个方面体现了混合物中脂肽类化合物理化性质的多变。
根据上述试验结果,酸化沉淀可用于发酵液中BM脂肽类化合物的提取。将1 t发酵液的pH值降至2.80-3.20,仅需8 L 12 mol/L浓盐酸,形成28 kg沉淀物(干重),前后体积浓缩了60-70倍,而且发酵上清液中的BM脂肽被完全转移至沉淀中,收率为100%,纯度也从0.011%提升至0.43%,明显高于直接蒸发浓缩发酵液所获得的0.15%含量的BM样品,有利于后续的进一步纯化工作。但是,较高纯度BM脂肽样品的水溶液的酸化沉淀效果不佳,酸化沉淀工艺不能用于规避纯化阶段中后期的脂肽类样品水溶液的蒸发浓缩和起泡问题。
2.1.2 甲醇浸提工艺甲醇溶解性较好、易于浓缩、可回收再利用,且蒸发过程中不存在乳化起泡等问题,作为提取BM脂肽的溶剂较为合适。为了提升浸提的收率,进行了8批次的甲醇浸提,每批次采用110-120 L甲醇浸提25-28 kg的沉淀物。浸提过程中甲醇浸提的平均分配系数仅为0.11 L/kg。除加热外,机械搅拌和超声波促进溶解均不能提升分配系数,可见BM脂肽和酸化沉淀中的甲醇不溶物有较好的亲和性,不受传质等动力学因素影响,这和发酵液酸化沉淀中表现的高收率相符合。且酸化沉淀的甲醇浸提过程先难后易,BM浸膏样品的纯度也在不断提升,从第1、2批次的2.22%纯度和16.67%收率,上升至第3-5批次的6.45%纯度和65.30%收率,及至最高的第6-8批次的9.10%纯度和13.33%收率。这一现象对脂肽类化合物进一步的纯化较为有利。
甲醇浸提工艺的总收率为95.30%,浸膏平均纯度为4.99%。经酸化沉淀、甲醇浸提、合并与浓缩,1 t发酵液中的BM脂肽被完全转移至10-20 L易于浓缩不易起泡的甲醇溶液中,体积浓缩了50-100倍,便于后续单元工艺的操作。随后的研究采用纯度最低(纯化难度最高)的第1、2批次甲醇浸提的2.22%纯度样品进行试验,以保证新工艺适用于不同批次的浸提样品。
2.1.3 溶剂沉淀工艺根据介电常数衡量混合溶液的极性,以5 g/L纯度2.22%的BM脂肽类化合物的甲醇溶液为试验对象,按照极性由低到高的顺序与不同的低极性的有机溶剂快速混合,藉由溶剂极性和溶解性的显著变化析出目标化合物,收集沉淀并进行比较。混合溶剂介电常数按照立方根相加律进行计算[34],试验结果详见表 2。
表 2 溶剂沉淀法试验结果Table 2 Result of solvent precipitation test
| Solvents1 | Permittivities1 | Effects and conclusions |
| MeOH | 32.7 | BM sample was completely dissolved. |
| n-BuOH | 17.5 | n-BuOH could extract BM, so its permittivity was regarded as an upper limit for reference. |
| PhH, (Et)2O, TCM, EtOAc, MF or DCM extracting precipitate directly | 2.3-9.1 | Efficiency of solid-liquid mass transfer was extremely low to further raise the sample’s purity. |
| MeOH/PhH (1:6, V/V) | 4.0 | BM was dissolved and no precipitate formed. |
| MeOH/EtOAc/PE (2:5:5, V/V) | 6.0 | BM was dissolved and no precipitate formed. |
| MeOH/TCM (1:6, V/V) | 7.0 | BM was dissolved and no precipitate formed. |
| MeOH/(Et)2O (1:6, V/V) | 6.4 | Purity was raised from 2.22% to 6.90% with 100% recovery rate2. |
| MeOH/EtOAc (1:6, V/V) | 8.6 | Purity was raised from 6.90% to 9.08% with 99.80% recovery rate after MeOH/(Et)2O precipitation2. |
| MeOH/MF (1:6, V/V) | 10.7 | Purity was raised from 9.08% to 11.06% with 100% recovery rate after MeOH/EtOAc precipitation2. |
| MeOH/DCM (1:6, V/V) | 11.3 | BM was dissolved and no precipitate formed. |
| 1 Abbreviations and permittivities (dielectric constants) of organic solvents were: PE (petroleum ether, 1.8), PhH (benzene, 2.3), (Et)2O (diethyl ether, 4.4), TCM (trichloromethane, 4.9), EtOAc (ethyl acetate, 6.4), MF (methyl formate, 8.5), DCM (dichloromethane, 9.1), n-BuOH (n-butanol, 17.5), and MeOH (methanol, 32.7), respectively. 2 The effect of the MeOH/EtOAc mixture was poor when the process was performed as the first step after acid precipitation and MeOH extraction. However, better result would be obtained when this process was performed as the second step following the MeOH/(Et)2O precipitation. A similar phenomenon occurred in the MeOH/MF mixture. | ||
表选项
根据表 2所示结果,直接采用液固提取法效率低下。液液混合沉淀因传质速度快,较为合理。再者,除了介电常数,溶剂种类对沉淀效果有明显的影响。甲醇/乙醚以体积比1:6混合时,其介电常数为6.4,取其沉淀进行检测,BM脂肽样品的纯度从2.22%提升至6.90%。而同样体积比的甲醇/苯混合后,介电常数更低,仅为4.0,但却没有BM物质被沉淀,毫无提升效果。氯仿和二氯甲烷也有类似现象。此外,采用甲醇/乙酸乙酯直接沉淀BM脂肽甲醇浸提溶液也毫无效果,但是用于沉淀甲醇/乙醚沉淀样品的甲醇溶液却有明显效果,纯度从6.90%升至9.08%。甲醇/甲酸甲酯沉淀时也有类似现象。
由此得出结论:沉淀溶剂的选择不仅要考虑极性,还要考虑溶剂的种类;在确定溶剂种类的情况下,以逐步提升极性渐进除杂的方式进行,才能获得稳定可靠的结果。
溶剂沉淀法可应用于酸化沉淀和甲醇浸提之后,先浓缩甲醇溶液至相对较小的体积以减少沉淀溶剂用量。BM脂肽甲醇溶液的浓度在5-20 g/L之间均有效,但要避免过度浓缩导致甲醇溶液过于黏稠,不利于分散、传质和沉淀。然后将6倍体积的乙醚溶剂快速倾倒和冲散甲醇溶液,并形成沉淀;之后抽滤收集沉淀、甲醇溶解、浓缩、6倍体积乙酸乙酯沉淀、抽滤收集沉淀。样品纯度从2.22%提升至9.08%,收率为99.80%。甲酸甲酯因其较高的成本和较大的毒性不予采用。溶剂沉淀法作为酸化沉淀和甲醇浸提之后,精制步骤之前提升样品纯度和质量的预处理工艺,简单、快速、有效,期间所用溶剂均可回收再利用。
2.1.4 盐析工艺选择工业应用中常用的硫酸铵进行盐析试验[35]。配制120 mg/L纯度分别为0.15%、40.01%、75.53%和87.51%的BM脂肽的水溶液(试验对象同2.1.1),按照243、390和561 g/L的添加量,使硫酸铵的饱和度分别达到40%、60%和80% (室温,25 ℃)。不同于酸化沉淀,硫酸铵盐析工艺不受样品纯度的影响,可以在饱和度40%-80%之间将BM脂肽类化合物完全从水溶液中析出并沉淀。结果详见表 3。
表 3 盐析试验结果Table 3 Recovery rate of salting out
| Saturation Degree1 | Recovery rates2 of salting out BM samples with different purities (%) | |||
| 0.15%3 | 40.01%3 | 75.53%3 | 87.51%3 | |
| 40% | 99.77±0.25a | 99.96±0.07a | 99.63±0.25a | 99.57±0.25a |
| 60% | 99.57±0.50a | 99.75±0.23a | 99.67±0.15a | 99.50±0.13a |
| 80% | 99.70±0.10a | 99.82±0.07a | 99.50±0.36a | 99.74±0.18a |
| 1Under room temperature (about 25 ℃), the addition amount of (NH4)2SO4 for saturation degrees of 40%, 60%, and 80% were 243 g/L, 390 g/L, and 561 g/L, respectively. 2 Statistical analysis using Duncan’s multiple range test at P=0.05 were expressed with the lowercase letters following data. And no significant difference was detected. 3 Same samples mentioned in Table 1. | ||||
表选项
但是经由盐析法获得的BM脂肽类化合物的沉淀物,会被难挥发的硫酸铵严重污染,结合脂肽类化合物的表面活性,很难采用有机溶剂浸提的方法使脂肽与硫酸铵简单分开,需要后续步骤进行分离和处理(2.1.6硅胶柱层析及2.1.7大孔树脂吸附工艺)。此外,虽然工业级硫酸铵价格低廉,但要使1 t发酵液的饱和度提升至40%仍需使用243 kg硫酸铵,而且发酵液的体积有所上升,增加了后续处理的难度,经济性远不及酸化沉淀。
根据上述试验结果,盐析法可在BM脂肽类化合物纯度 > 40%的纯化过程中间阶段,从水溶液中高效提取BM脂肽类化合物。此时酸化沉淀法无法有效地将BM脂肽类化合物从水溶液中分离和提取,而水溶液的处理量远小于发酵液体积,于是硫酸铵盐析法较为经济可行,并规避了易于起泡且耗时耗能的水溶液蒸发浓缩。但盐析法需要后续步骤除去硫酸铵污染物,因此在BM脂肽纯化阶段后期,慎用盐析法。
2.1.5 萃取工艺萃取工艺试验中,极性较低的溶剂,如乙酸乙酯和二氯甲烷,均不能萃取BM脂肽,而正丁醇萃取BM脂肽的分配系数仅为1.20,同体积正丁醇需要萃取3次才能保证收率 > 90%。而当BM脂肽的水溶液浓度大于1.0 g/L时,正丁醇和水呈现互溶的情况而无法分层和萃取。如直接稀释BM脂肽的水溶液(BM浓度 < 300 mg/L)进行正丁醇萃取,减压蒸发正丁醇的工作量较大。因此使用正丁醇直接萃取BM脂肽类化合物,并不可行。
在实际生产中,萃取法多与盐析法相结合,从水溶液中完全提取BM脂肽。在处理含有有机溶剂的BM脂肽的水溶液时,如2.1.7中含有BM脂肽的50%乙醇洗脱液,其中的乙醇经减压蒸发回收之后仍难以完全除尽,此时使用盐析法,会在液面析出较薄的“乙醇油层”,BM脂肽沉淀析出后完全溶解于该油层之中,无法通过离心和过滤获得,且该油层体积小而粘度大,直接使用分液漏斗收集油层,操作过程中的物料损失难以避免。此时添加正丁醇使油层变厚、粘度变低,操作大为简便,再经分液漏斗收集及多次正丁醇萃取与洗涤器皿,获得盐析沉淀物的正丁醇溶液,如此盐析法经由萃取工艺变得可行,BM脂肽的收率可达100%,且此时正丁醇用量较少,其不易起泡的特性便于蒸发和浓缩。但由于脂肽的表面活性,正丁醇萃取剂中会含有大量水分和硫酸铵,因此依靠萃取法分离脂肽和硫酸铵污染物(详见2.1.4)并不可行。
2.1.6 硅胶柱层析工艺硅胶柱层析是常用的精制工艺。受到表面活性的干扰,脂肽类化合物、填料、试剂和杂质之间相互的选择性和分子间作用力较为复杂,难以明确。因此,硅胶填料和流动相溶剂的选择,需从具有代表性的候选材料中进行筛选。硅胶柱填料选择分离纯化效果较好的200-300目硅胶。溶剂选择方面,Snyder[36]根据质子受体参数、质子给予参数和强偶极参数的比例,将常用的80多种溶剂分成9个大类:Ⅰ-Ⅴ、Ⅵa、Ⅵb、Ⅶ和Ⅷ。洗脱剂选择常用的甲醇(Ⅱ),排除成本较高毒性过大的乙腈(Ⅲ)和四氢呋喃(Ⅵb)。而稀释洗脱剂所用的底剂,则选择5种不同类别的代表性溶剂进行试验和筛选:氯仿(Ⅷ)、二氯甲烷(Ⅴ)、乙酸乙酯(Ⅵa)、乙醚(Ⅰ)和苯(Ⅶ)。并且,比较不同纯化阶段的BM脂肽样品对硅胶柱层析和流动相选择的影响,建立可行的硅胶柱层析单元工艺。
硅胶柱层析试验的结果表明:硅胶柱无论使用何种流动相均不能使2.22%纯度的甲醇浸提样品的纯度有所提升,试验中的硅胶填料无法吸附脂肽样品致使BM脂肽被过早洗脱,因此从脂肽样品中除去部分低极性杂质的溶剂沉淀法的预处理步骤是必要的;但当样品纯度有所提升,如经过溶剂沉淀处理的9.08%纯度的样品,甲醇/乙酸乙酯(Ⅱ/Ⅵa)和甲醇/乙醚(Ⅱ/Ⅰ)流动相可有效提升BM脂肽样品的纯度至20.86%和20.92%,而氯仿(Ⅷ)、二氯甲烷(Ⅴ)和苯(Ⅶ)仍不能有效提升样品纯度,该结果和2.1.3溶剂沉淀法的试验结果类似;当原料的纯度提升至40%之后,各类底剂均可有效提升脂肽类化合物的纯度至70%,如之前无效的氯仿(Ⅷ)、二氯甲烷(Ⅴ)和苯(Ⅶ),在50%-70%梯度之间可完全洗脱BM脂肽类化合物,并将样品纯度分别提升至75.53%、75.49%和70.43%,且纯化效果优于或相当于乙酸乙酯(Ⅵa)的69.68%,但逊色于乙醚(Ⅰ)的78.36%。硅胶柱层析工艺的试验结果详见表 4。
表 4 硅胶柱层析效果Table 4 Purification effect of silica gel column chromatography
| Mobile qphase | Purification effects1 on BM samples with different purities (%) | Classification | ||
| 2.22%2 | 9.08%3 | 40.01%4 | ||
| MeOH/TCM | 2.22±0.01 e No effect. | 11.02±0.98 d No effect. | 75.53±1.99 a More effective. | Ⅱ/Ⅷ |
| MeOH/DCM | 2.22±0.01 e No effect. | 10.97±0.91 d No effect. | 75.49±1.49 a More effective. | Ⅱ/Ⅴ |
| MeOH/EtOAc | 2.22±0.01 e No effect. | 20.86±4.02 c Effective. | 69.68±0.89 b More effective. | Ⅱ/Ⅵa |
| MeOH/(Et)2O | 2.22±0.01 e No effect. | 20.92±1.21 c Effective. | 78.36±1.64 a Most effective. | Ⅱ/Ⅰ |
| MeOH/PhH | 2.22±0.01 e No effect. | 10.55±0.97 d No effect. | 70.43±3.45 b More effective. | Ⅱ/Ⅶ |
| 1Bold characters signify that the samples were purified after corresponding treatments. And statistical analysis using Duncan's multiple range test at P=0.05 were expressed with the lowercase letters following data. 2 MeOH extraction derived from acid precipitate. 3 MeOH extraction derived from acid precipitate treated with solvent precipitation. 4 Sample with 9.08% purity treated with silica gel column chromatography and HZ806 macroporous absorption resin column chromatography. | ||||
表选项
结合2.1.3溶剂沉淀工艺中沉淀剂的筛选结果和2.1.6硅胶柱层析工艺中底剂的筛选结果,可得出初步结论:使用有机溶剂处理BM脂肽样品,在甲醇(Ⅱ)作为BM脂肽主要溶解试剂和洗脱剂的前提下,Ⅰ类和Ⅵa类试剂适合于提升粗提物的纯度;而Ⅰ类、Ⅴ类和Ⅷ类试剂适合于纯化阶段中后期进一步提升脂肽类化合物的纯度。Ⅶ类试剂效果不佳,而Ⅲ类、Ⅳ类和Ⅵb类中的大多数常用试剂极性较大,不适合作为底剂,而作为溶解试剂和洗脱剂,经济性和实用性均不及甲醇(Ⅱ)。
乙醚(Ⅰ)是所用试验溶剂中纯化效果最好的底剂,但因沸点过低、易于挥发和爆炸性等问题而不能实际应用;二氯甲烷(Ⅴ)因其过低的沸点以及过于易挥发的缺点,实际应用和溶剂回收较为困难;苯(Ⅶ)的效果不佳,而且考虑到毒性不予应用。
综合上述结果和因素,硅胶柱层析工艺可用于BM脂肽类化合物预处理之后的精制工作,处理9.08%纯度的有机溶剂沉淀样品时,按2.4 g BM/kg硅胶填料的处理能力装柱,甲醇/乙酸乙酯为流动相,在35%-80%梯度之间洗脱全部BM脂肽,提升BM脂肽的纯度至20.86%,收率96.30%;纯化40.01%纯度的大孔树脂处理样品时,使用甲醇/氯仿流动相,按7.2 g BM/kg硅胶填料的处理能力装柱,在50%-70%梯度之间洗脱全部BM脂肽,BM脂肽的纯度提升至75.53%,收率95.50%。
2.1.7 大孔树脂吸附工艺近年来大孔树脂在工业应用领域有较快的发展,有多种不同骨架种类的大孔树脂填料可供选择[35]。本次研究选择极性相对较低而且较为常用的聚苯乙烯-二乙烯苯骨架大孔树脂和聚甲基丙烯酸酯骨架大孔树脂作为研究对象,使用BM脂肽的硅胶柱纯化样品(纯度20.86%),对包括XAD 7HP、HZ806、HZ807、HZ816和HZ818在内的5种大孔树脂的吸附能力、解吸能力和稳定性进行比较,流动相为乙醇/水。聚甲基丙烯酸酯骨架的XAD 7HP、HZ806和HZ807具有良好的吸附能力、解吸能力以及稳定性,优于聚苯乙烯-二乙烯苯骨架的HZ816和HZ818 (图 1)。结合成本因素,本次工艺选择的填料为HZ806大孔树脂。
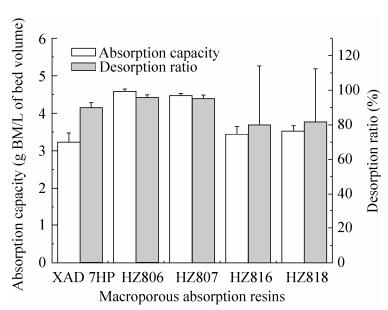 |
| 图 1 大孔树脂吸附能力、解吸能力和稳定性比较 Figure 1 Absorption capacities, desorption ratios and reproducibilities of macroporous absorption resins. |
| 图选项 |
脂肽的水溶液在浓缩时存在乳化和起泡问题,因此要尽量减小大孔树脂吸附处理之后水溶液的体积。HZ806大孔树脂处理不同纯化阶段的BM脂肽样品的工艺均表现一致:纯水上样、25%乙醇除杂,及50%乙醇洗脱BM脂肽。50%乙醇完全洗脱BM脂肽需要4.0 BV (床层体积)的流动相,而开始的0.9 BV的“死体积”流动相中未检测出BM脂肽类化合物,其后的3.1 BV的50%乙醇流动相洗脱全部的BM脂肽,因此有1.55 BV的水分需要后续处理。由此可知,大孔树脂单位床层体积的吸附量越大,同样1.55 BV水分中所含的BM脂肽就越多,则单位数量的BM脂肽所产生的水分就越少,后续处理就越容易。
HZ806大孔树脂处理不同纯度BM脂肽样品的结果详见图 2。当BM脂肽样品纯度仅为2.22%时(酸化沉淀的甲醇浸膏),虽然大孔树脂将样品的纯度提升至17.50%,但吸附能力仅为0.33 g BM/L床层体积,后续需要处理的水分高达4.70 L/g BM,不利于生产;而当BM脂肽样品纯度上升至20.86%时(硅胶柱处理样品),大孔树脂处理效果有了显著改善,纯度上升至40.01%,吸附能力上升至4.58 g BM/L床层体积,所需处理的水分减少至0.34 L/g BM,减压蒸发回收大部分乙醇之后,将2.1.4盐析法和2.1.5萃取法相结合,规避脂肽水溶液的蒸发浓缩和起泡问题的同时提取BM脂肽,收率96.02% (污染样品的硫酸铵由后续硅胶柱层析和大孔树脂吸附法去除);而当样品纯度上升至75.53%时(第二次硅胶柱处理的样品),大孔树脂吸附法可将样品纯度提升至87.51%,吸附能力高达12.1 g BM/L床层体积,所需处理的水分仅为0.13 L/g BM,收率97.31%。
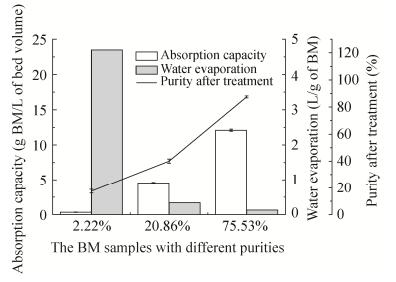 |
| 图 2 HZ806大孔树脂吸附工艺的吸附能力、待处理水溶液体积和纯化效果 Figure 2 Absorption capacities, water evaporation volumes, and purification effects of different BM samples treated with HZ806 macroporous absorption resin. |
| 图选项 |
最后0.13 L/g BM的水溶液,可使用HZ806大孔树脂再次吸附样品,使用水溶液上样,再用95%工业乙醇洗脱BM脂肽,乙醇洗脱阶段弃去先流出的0.9 BV的水溶液,再收集2.0 BV乙醇即可,对乙醇的减压浓缩过程可回避BM脂肽水溶液的起泡问题;如水溶液体积较小,也可以与正丁醇混合,正丁醇能抑制起泡,且与水共沸方便减压浓缩;如连续生产过程中,也可以保证BM脂肽不被降解的前提下,使用电热恒温鼓风干燥箱60 ℃缓慢烘干,也无乳化起泡问题。通过上述方法,在获得最终纯化样品的同时,完全规避脂肽水溶液的蒸发浓缩过程中严重的乳化起泡等问题。
2.2 单元工艺的组合及中试规模纯化工艺的建立以保持目标脂肽类化合物高收率为前提,严格履行循序渐进减少杂质的原则方针,选择成熟的可放大单元工艺进行研究和组合(详见2.1),并最终建立一套经济、实用,可放大的海洋芽孢杆菌源脂肽类化合物的中试规模纯化工艺。工艺流程详见图 3。
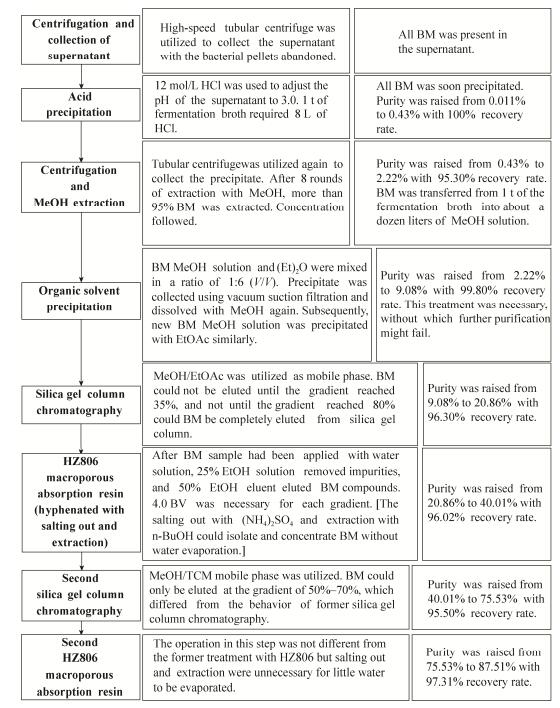 |
| 图 3 BM脂肽类化合物中试规模纯化工艺 Figure 3 Production process for pilot-scale purification of BM series lipopeptides. |
| 图选项 |
图 3所示的BM脂肽类化合物中试规模纯化工艺流程,其中的数据为处理原料纯度最低的第1、2批次甲醇浸提的2.22%纯度样品的过程数据,最终获得纯度87.51%的脂肽样品(样品的HPLC检测图谱详见图 4),总收率81.73%;如采用第3-5批次的甲醇浸提样品,其纯度优于之前第1、2批次的样品,该批次样品经中试规模纯化工艺处理后的纯度达到100% (样品的HPLC检测图谱详见图 5);至第6-8批次,虽然浸提量仅占总数的13.33%,但在硅胶柱第二次处理阶段即已形成纯品,且由于步骤减少,总收率也有一定的提升,为83.99%。
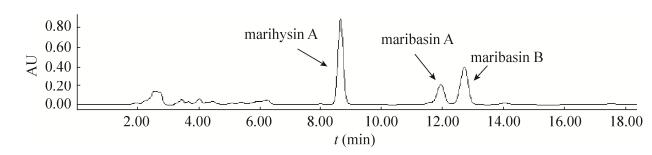 |
| 图 4 87.51%纯度的BM脂肽样品的HPLC检测图谱 Figure 4 HPLC spectrum of BM series lipopeptides with 87.51% purity. |
| 图选项 |
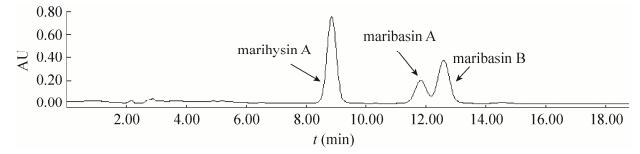 |
| 图 5 100%纯度的BM脂肽样品的HPLC检测图谱 Figure 5 HPLC spectrum of BM series lipopeptides with 100% purity. |
| 图选项 |
新工艺可从1 t海洋芽孢杆菌B. marinus B-9987的发酵液(BM发酵水平120 mg/L)中提取并制备87.51%-100%纯度的脂肽类化合物样品(平均纯度97.57%),收率 > 81.73% (平均82.04%),产量为百克量级(纯化样品干重100.90 g,BM净含量98.45 g)。
3 讨论本次研究,首次实现了高纯度海洋芽孢杆菌源脂肽类化合物的百克量级的中试规模制备,可满足样品纯度和数量要求较高的研究项目,如农药登记毒理学试验[37]。无论是百克量级制备规模还是97.57%的平均样品纯度,均高于目前文献所报道的最高水平:絮凝-过滤工艺的克量级制备79.5%纯度表面活性素[26],超滤法的克量级制备83%纯度表面活性素[27],以及大孔树脂吸附法的毫克量级制备68.3%纯度伊枯草菌素、77.6%纯度芬荠素和91.6%纯度表面活性素[25]。
新工艺采取循序渐进去除杂质的稳健路线,对原料要求较低,允许天然培养基应用于中游大规模发酵生产,且不影响后续中游发酵的优化等研究,解决了芽孢杆菌源脂肽类化合物中游发酵生产和下游大规模纯化之间的矛盾,具有实际应用和生产价值。而且工艺过程中规避不经济的大体积水溶液蒸发浓缩,解决了脂肽类化合物水溶液浓缩过程中的乳化起泡的难题,具有更好的实用性,易于向其他芽孢杆菌源脂肽类化合物的开发领域推广。
杂质的多寡对脂肽类化合物下游纯化的难易有很大的影响。选择发酵培养基时,排除诸如玉米浆、花生饼粉、菜籽饼粉等农副产品原料,选择基于农副产品为原材料精制加工后的天然培养基,如蛋白胨和酵母提取物,并与组分明确的合成培养基组成复合培养基。这类培养基营养较寡营养的合成培养基更为丰富,而且杂质的种类和数量都明显少于粗糙的农副产品原料。此外,可对有益于脂肽合成的微量金属离子进行筛选[38-39],提高脂肽产量同时对杂质数量的影响相对较小,更有利于下游工艺的纯化效果。
再者,2.2中同一批次培养基的发酵产品的不同批次甲醇浸提样品,由于杂质数量和种类的不同,最终的纯化效果也会有较大的差异。2.1.6中未经有机溶剂沉淀法去除油性杂质(较低极性的杂质)的2.22%纯度的第1、2批次甲醇浸提样品,不能被硅胶填料所吸附,是BM脂肽与油性杂质亲和性较好的体现。因而油性杂质的分离较为困难,是BM脂肽分离纯化最大的难点,经过多个单元工艺的分离纯化仍然难以完全除尽。2.1.2中甲醇浸提时的平均分配系数仅为0.11 L/kg,是脂肽与酸化沉淀中的甲醇不溶物具有亲和性的表现。然而,油性杂质和酸化沉淀中的甲醇不溶物之间并无亲和性。这就意味着需要大量甲醇浸提多次才能从酸化沉淀中的甲醇不溶物中浸提出全部BM,而只要少量甲醇浸提1-2次即可将酸化沉淀中的油性杂质溶解去除。利用BM脂肽和这两类杂质彼此亲和性不同的特点,通过第1、2批次甲醇浸提,以16.67%的BM脂肽被浸提的代价,将酸化沉淀中的油性杂质浸提、溶解并除去,此时浸提样品的馏分呈现油膏状。之后甲醇浸提酸化沉淀中其余83.33%的BM脂肽时,不利于脂肽分离纯化的油性杂质明显减少,因此第3批次之后的甲醇浸提浓缩后的馏分为“干燥”的固体物,且第1、2批次甲醇浸提也溶解并去除了大量的其他杂质,因此第3-8批次甲醇浸提物的纯度也明显高于第1、2批次甲醇浸提物。这是同样纯化工艺,第1、2批次甲醇浸提的原料可获得87.51%纯度样品,而第3-8批次甲醇浸提的原料能够最终制成100%纯度样品的重要原因。酸化沉淀中的甲醇不溶物与BM脂肽的亲和性,对于甲醇浸提较为不利,但是对BM脂肽的纯化却非常有利。
如未来连续发酵技术突破瓶颈,在大规模发酵生产中获得广泛应用,并且适用于脂肽类化合物的发酵生产,则高成本寡营养但外源杂质较少的合成培养基将变得相对经济可行,为可放大的絮凝-过滤工艺、超滤法和大孔树脂吸附工艺[25-27]提供足够的脂肽原料,规模制备脂肽类化合物纯化样品的工艺将变得更为简单而高效。
参考文献
| [1] | Arima K, Kakinuma A, Tamura G. Surfactin, a crystalline peptidelipid surfactant produced by Bacillus subtilis:isolation, characterization and its inhibition of fibrin clot formation.Biochem Biophys Res Commun,1968, 31(3): 488–494.DOI: 10.1016/0006-291X(68)90503-2 |
| [2] | Lü YN, Yang SZ, Mu BZ. Progress of lipopeptide biosurfactants.Biotechnol Bull,2004(6): 11–16.(in Chinese). 吕应年, 杨世忠, 牟伯中. 脂肽类生物表面活性剂的研究进展.生物技术通报, 2004(6): 11-16. |
| [3] | Deleu M, Paquot M. From renewable vegetables resources to microorganisms:new trends in surfactants.C R Chim,2004, 7(6/7): 641–646. |
| [4] | Lai CC, Huang YC, Wei YH, et al. Biosurfactant-enhanced removal of total petroleum hydrocarbons from contaminated soil.J Hazard Mater,2009, 167(1/3): 609–614. |
| [5] | Scheibenbogen K, Zytner RG, Lee H, et al. Enhanced removal of selected hydrocarbons from soil by Pseudomonas aeruginosa UG2 biosurfactants and some chemical surfactants.J Chem Technol Biotechnol,1994, 59(1): 53–59.DOI: 10.1002/(ISSN)1097-4660 |
| [6] | Brown MJ. Biosurfactants for cosmetic applications.Int J Cosmet Sci,1991, 13(2): 61–64.DOI: 10.1111/ics.1991.13.issue-2 |
| [7] | Gandhimathi R, Seghal Kiran G, Hema TA, et al. Production and characterization of lipopeptide biosurfactant by a sponge-associated marine actinomycetes Nocardiopsis alba MSA10.Bioprocess Biosyst Eng,2009, 32(6): 825–835.DOI: 10.1007/s00449-009-0309-x |
| [8] | Donio MBS, Ronica SFA, Thanga Viji V, et al. Isolation and characterization of halophilic Bacillus sp.BS3 able to produce pharmacologically important biosurfactants.Asian Pac J Trop Med,2013, 6(11): 876–883.DOI: 10.1016/S1995-7645(13)60156-X |
| [9] | Gong QW, Zhang C, Lu FX, et al. Identification of bacillomycin D from Bacillus subtilis fmbJ and its inhibition effects against Aspergillus flavus.Food Control,2014, 36(1): 8–14.DOI: 10.1016/j.foodcont.2013.07.034 |
| [10] | Saravanakumari P, Mani K. Structural characterization of a novel xylolipid biosurfactant from Lactococcus lactis and analysis of antibacterial activity against multi-drug resistant pathogens.Bioresour Technol,2010, 101(22): 8851–8854.DOI: 10.1016/j.biortech.2010.06.104 |
| [11] | Pabel CT, Vater J, Wilde C, et al. Antimicrobial activities and matrix-assisted laser desorption/ionization mass spectrometry of Bacillus isolates from the marine sponge Aplysina aerophoba.Mar Biotechnol,2003, 5(5): 424–434.DOI: 10.1007/s10126-002-0088-8 |
| [12] | Shaala LA, Youssef DTA, McPhail KL, et al. Malyngamide 4, a new lipopeptide from the Red Sea marine cyanobacterium Moorea producens(formerly Lyngbya majuscula).Phytochem Lett,2013, 6(2): 183–188.DOI: 10.1016/j.phytol.2013.01.002 |
| [13] | Hajare SN, Subramanian M, Gautam S, et al. Induction of apoptosis in human cancer cells by a Bacillus lipopeptide bacillomycin D.Biochimie,2013, 95(9): 1722–1731.DOI: 10.1016/j.biochi.2013.05.015 |
| [14] | Baltz RH, Miao V, Wrigley SK. Natural products to drugs:daptomycin and related lipopeptide antibiotics.Nat Prod Rep,2005, 22(6): 717–741.DOI: 10.1039/b416648p |
| [15] | Ongena M, Jacques P. Bacillus lipopeptides:versatile weapons for plant disease biocontrol.Trends Microbiol,2008, 16(3): 115–125.DOI: 10.1016/j.tim.2007.12.009 |
| [16] | Liu RF, Zhang DJ, Li YG, et al. A new antifungal cyclic lipopeptide from Bacillus marinus B-9987.Helv Chim Acta,2010, 93(12): 2419–2425.DOI: 10.1002/hlca.v93.12 |
| [17] | Zhang DJ, Liu RF, Li YG, et al. Two new antifungal cyclic lipopeptides from Bacillus marinus B-9987.Chem Pharm Bull,2010, 58(12): 1630–1634.DOI: 10.1248/cpb.58.1630 |
| [18] | Ongena M, Jourdan E, Adam A, et al. Surfactin and fengycin lipopeptides of Bacillus subtilis as elicitors of induced systemic resistance in plants.Environ Microbiol,2007, 9(4): 1084–1090.DOI: 10.1111/emi.2007.9.issue-4 |
| [19] | Mnif I, Elleuch M, Chaabouni SE, et al. Bacillus subtilis SPB1 biosurfactant:production optimization and insecticidal activity against the carob moth Ectomyelois ceratoniae.Crop Protect,2013, 50: 66–72.DOI: 10.1016/j.cropro.2013.03.005 |
| [20] | Yánez-Mendizábal V, Zeriouh H, Vi?as I, et al. Biological control of peach brown rot (Monilinia spp.) by Bacillus subtilis CPA-8 is based on production of fengycin-like lipopeptides.Eur J Plant Pathol,2012, 132(4): 609–619.DOI: 10.1007/s10658-011-9905-0 |
| [21] | Zhao ZZ, Wang QS, Wang KM, et al. Study of the antifungal activity of Bacillus vallismortis ZZ185in vitro and identification of its antifungal components.Bioresour Technol,2010, 101(1): 292–297.DOI: 10.1016/j.biortech.2009.07.071 |
| [22] | Moyne AL, Shelby R, Cleveland TE, et al. Bacillomycin D:an iturin with antifungal activity against Aspergillus flavus.J Appl Microbiol,2001, 90(4): 622–629.DOI: 10.1046/j.1365-2672.2001.01290.x |
| [23] | Kelleher TJ, Lai JJ, Decourcey JP, et al.Process for the purification of daptomycin:EP, 1586580.2009-11-25. |
| [24] | Wang ZG, Wang WY, Wu M, et al. Purification of daptomycin from fermentation broth of Streptomyces roseosporus by anion-exchange resin.Pharm Clin Res,2011, 19(4): 318–321.(in Chinese). 王泽根, 王文轶, 吴旻, 等. 阴离子交换树脂对Streptomyces roseosporus发酵液中达托霉素的分离纯化研究.药学与临床研究, 2011, 19(4): 318-321. |
| [25] | Dhanarajan G, Rangarajan V, Sen R. Dual gradient macroporous resin column chromatography for concurrent separation and purification of three families of marine bacterial lipopeptides from cell free broth.Sep Purif Technol,2015, 143: 72–79.DOI: 10.1016/j.seppur.2015.01.025 |
| [26] | Zhang DL, Wang YF, Lu YJ, et al. An efficient method for separation of surfactin from Bacillus amyloliquefaciens fmb50 broth by flocculation.Process Biochem,2014, 49(7): 1182–1188.DOI: 10.1016/j.procbio.2014.03.021 |
| [27] | Chen HL, Chen YS, Juang RS. Separation of surfactin from fermentation broths by acid precipitation and two-stage dead-end ultrafiltration processes.J Membr Sci,2007, 299(1/2): 114–121. |
| [28] | Yu JT, Tang XX, Wu XY, et al. New Biotechnology (Vol.1).Beijing: Chemical Industry Press, 2003: 99-100(in Chinese). 俞俊棠, 唐孝宣, 邬行彦, 等. 新编生物工艺学(上册).北京: 化学工业出版社, 2003: 99-100. |
| [29] | Gao W, Tian L, Zhou JY, et al. Antifungal mechanism of Bacillus marinus B-9987.Acta Microbiol Sin,2009, 49(11): 1494–1501.(in Chinese). 高伟, 田黎, 周俊英, 等. 海洋芽胞杆菌(Bacillus marinus) B-9987菌株抑制病原真菌机理.微生物学报, 2009, 49(11): 1494-1501. |
| [30] | Chen J, Wei HG, Luo YC, et al. Medium optimization for the production of new antifungl cyclic lipopeptide marinhysin A by Bacillus marinus B-9987.China Biotechnol,2013, 33(1): 84–89.(in Chinese). 陈杰, 魏鸿刚, 罗远婵, 等. 海洋芽胞杆菌B-9987产新型抗菌环脂肽Marinhysin A的培养基优化.中国生物工程杂志, 2013, 33(1): 84-89. |
| [31] | Bezza FA, Chirwa EMN. Production and applications of lipopeptide biosurfactant for bioremediation and oil recovery by Bacillus subtilis CN2.Biochem Eng J,2015, 101: 168–178.DOI: 10.1016/j.bej.2015.05.007 |
| [32] | de Sousa T, Bhosle S. Isolation and characterization of a lipopeptide bioemulsifier produced by Pseudomonas nitroreducens TSB.MJ10 isolated from a mangrove ecosystem.Bioresour Technol,2012, 123: 256–262.DOI: 10.1016/j.biortech.2012.07.056 |
| [33] | Ibrahim ML, Ijah UJJ, Manga SB, et al. Production and partial characterization of biosurfactant produced by crude oil degrading bacteria.Int Biodeterior Biodegrad,2013, 81: 28–34.DOI: 10.1016/j.ibiod.2012.11.012 |
| [34] | Zhang XW, Yin QX, Cui PL, et al. Correlation of solubilities of hydrophilic pharmaceuticals versus dielectric constants of binary solvents.Ind Eng Chem Res,2012, 51(19): 6933–6938.DOI: 10.1021/ie202624d |
| [35] | Yu JT, Tang XX, Wu XY, et al.New Biotechnology (Vol.2).Beijing:Chemical Industry Press, 2003:37-42, 145-153(in Chinese). 俞俊棠, 唐孝宣, 邬行彦, 等.新编生物工艺学(下册).北京:化学工业出版社, 2003:37-42, 145-153. |
| [36] | Snyder LR. Classification off the solvent properties of common liquids.J Chromatogr Sci,1978, 16(6): 223–234.DOI: 10.1093/chromsci/16.6.223 |
| [37] | Zhang ZM, Wang SJ, Yu SY, et al. GB 15670-1995 Toxicological Test Methods of Pesticides for Registration.Beijing: China Standards Press, 1996: 207-241(in Chinese). 张子明, 王淑洁, 于守洋, 等. GB 15670-1995农药登记毒理学试验方法.北京: 中国标准出版社, 1996: 207-241. |
| [38] | Abdel-Mawgoud AM, Aboulwafa MM, Hassouna NAH. Optimization of surfactin production by Bacillus subtilis isolate BS5.Appl Biochem Biotechnol,2008, 150(3): 305–325.DOI: 10.1007/s12010-008-8155-x |
| [39] | Wei YH, Wang LF, Chang JS. Optimizing iron supplement strategies for enhanced surfactin production with Bacillus subtilis.Biotechnol Prog,2004, 20(3): 979–983.DOI: 10.1021/bp030051a |
