张雪, 陈婷, 牛艳慧, 李杨, 胡文革


石河子大学生命科学学院, 新疆 石河子 832000
收稿日期:2021-02-18;修回日期:2021-04-22;网络出版日期:2021-05-09
基金项目:国家自然科学基金(31160026,31560040)
*通信作者:胡文革, E-mail: hwg-t@163.com.
摘要:[目的] 通过研究新疆艾比湖湿地不同盐生植物根际土壤真菌的多样性和群落结构,为艾比湖湿地退化恢复工作和真菌深入研究提供理论支持。[方法] 利用高通量测序技术对真菌扩增子ITS1区进行测定,从而分析艾比湖湿地6种盐生植物根际土壤真菌群落多样性,并结合相关土壤理化因子分析环境与真菌群落多样性和丰富度的关联。[结果] 艾比湖湿地6种盐生植物根际土壤真菌群落多样性及丰富度存在差异,碱蓬根际土壤真菌多样性最高,芦苇根际土壤真菌群落丰富度最高。真菌群落组成分析表明,土壤样品中真菌菌落主要隶属于子囊菌门(Ascomycota)和担子菌门(Basidiomycota),其中子囊菌门为主要优势菌门;链格孢霉属(Alternaria)是6种植物共有的优势菌属,但是其在不同植物之间的丰度存在差异,在戟叶鹅绒藤中的丰度最高,在准噶尔大戟中的丰度最低。pH与真菌多样性呈显著负相关,全磷(TP)与真菌群落丰富度呈显著正相关,pH、电导率(EC)和有机质(OM)对优势菌属的影响最大。[结论] 艾比湖湿地6种盐生植物根际土壤真菌群落组成及多样性具有显著差异,碱蓬和芦苇根际土壤真菌的多样性和丰度高于其他植物,子囊菌门和链格孢霉属是艾比湖湿地的主要土壤真菌门属。研究结果可为艾比湖湿地的生态修复提供理论指导。
关键词:艾比湖湿地根际土壤真菌土壤环境因子多样性及丰富度
Research on diversity of fungi community in rhizosphere soil of six halophytes in Ebinur Lake Wetland
Xue Zhang, Ting Chen, Yanhui Niu, Yang Li, Wenge Hu


College of Life Sciences, Shihezi University, Shihezi 832000, Xinjiang Uygur Autonomous Region, China
Received: 18 February 2021; Revised: 22 April 2021; Published online: 9 May 2021
*Corresponding author: Wenge Hu, E-mail: hwg-t@163.com.
Foundation item: Supported by the National Natural Science Foundation of China (31160026, 31560040)
Abstract: [Objective] By studying the diversity and community structure of fungi in the rhizosphere soil of different halophytes in the Ebinur Lake wetland in Xinjiang, we provide theoretical support for the degradation and restoration of the Ebinur Lake wetland and the in-depth study of fungi. [Methods] We used high-throughput sequencing technology to determine the fungal amplicon ITS1 region to analyze the fungal community diversity in the rhizosphere soil of six halophytes in the Ebinur Lake Wetland, and combined with the relevant soil physical and chemical factors to analyze the relationship between the environment and the diversity and richness of fungal communities. [Results] The diversity and richness of fungal communities in the rhizosphere soil of the six halophytes in Ebinur Lake wetland were different. The fungi in the rhizosphere of Suaeda glauca had the highest diversity and the fungi in the rhizosphere of Phragmites australis had the highest richness. The analysis of fungal community composition showed that the fungal communities in the soil samples mainly belonged to Ascomycota and Basidiomycota, and Ascomycota was the dominant phylum. Alternaria was the dominant genus shared by all the six plants, but its abundance varies among different plants, with the highest abundance in Cynanchum sibiricum and the lowest in Euphorbia soongarica. There was a significant negative correlation between pH and fungal diversity, and a significant positive correlation between total phosphorus and fungal richness. The influence of pH, electrical conductivity and organic matter on dominant fungi was the most significant. [Conclusion] The rhizosphere soil fungal community composition and diversity of the six halophytes were significantly different in Ebinur Lake Wetland. The diversity and abundance of fungi in the rhizosphere soil of Suaeda glauca and Phragmites australis were higher than those of other plants, and Ascomycetes and Alternaria were the main soil fungal genera in Ebinur Lake Wetland. The research results could provide theoretical guidance for the ecological restoration of Ebi Lake wetland.
Keywords: Ebinur Lake Wetlandrhizosphere soilfungisoil environmental factorsdiversity and richness
艾比湖湿地是新疆现有最大的高盐湿地,对维护区域动植物栖息、生物多样性和区域生态平衡有着重要意义[1],而盐碱化导致的湿地退化是艾比湖湿地目前面临的较为严峻的问题,其在一定程度上会使湿地土壤理化性质和生物多样性发生改变。虽然艾比湖湿地土壤盐碱化严重,但是依然分布着较为丰富的盐生植物,例如盐角草,能够通过离子区隔化和泌盐作用使得周围土壤含盐量在2年内降低1%以下[2];芦苇可以去除盐碱湿地中的Na+,也能降低Ca2+、Cl–和CO32–等盐分离子的含量,且其腐殖质还能降低盐碱土的盐分,提高有机质的含量[3];碱蓬是盐碱地的先锋植物,可以显著降低土壤盐分,改良土壤结构[4];准噶尔大戟、花花柴和戟叶鹅绒藤也具有很强的耐盐碱能力,它们都是艾比湖湿地的优势盐生植物,对维护艾比湖湿地生态平衡具有重要作用。根际土壤真菌是土壤-植物生态系统的重要组成部分[5],真菌群落结构的组成和多样性密切影响着植物的生长发育[6]。虽然土壤pH能够通过影响土壤基质的组成、化学性质和利用效率使得土壤真菌群落组成和多样性受到干扰,土壤养分[7]和含水量[8]也对土壤真菌群落结构具有显著影响,但土壤本身的特性和植被根系分泌物对真菌群落结构和多样性的影响更大。真菌的多样性在维护生态平衡方面具有重要意义,而真菌多样性与气候、植被类型和土壤养分等密切相关[9],通过研究不同植物根际土壤真菌的多样性,可以使我们进一步了解真菌群落结构,也有利于了解环境的变化,为艾比湖湿地退化恢复工作提供理论支持。
近年来,高通量测序技术以高测序通量和高准确率的优势被广泛应用于真菌多样性和群落结构组成研究中。王诗慧等[10]以天山不同植被类型的根际和非根际土壤为研究对象,利用高通量测序技术探究真菌群落组成差异;阳祥等[11]以5种稻田土壤为研究对象,对比分析发现,土壤真菌群落组成及多样性受土壤类型影响显著。目前,关于艾比湖湿地真菌群落多样性研究较少,仅见于王艳萍[12]和Hu等[13]对艾比湖湿地不同季节的真核微生物多样性进行分析,而利用高通量测序技术分析艾比湖湿地同一季节不同植物根际土壤真菌群落的多样性及丰富度的研究还未见报道。
本文以艾比湖湿地6种优势建群植物盐角草、芦苇、准噶尔大戟、花花柴、碱蓬和戟叶鹅绒藤的根际土壤为研究对象,研究不同植物根际土壤真菌多样性及群落结构组成,分析环境因子与其相关性,探究艾比湖湿地中不同植被根际土壤真菌群落对植物生长的潜在影响机制,为湿地退化恢复提供理论指导。
1 材料和方法 1.1 研究区概况 艾比湖湿地(82°36′–83°50′E,44°37′–45°15′N)位于新疆准噶尔盆地西南缘,处于阿拉山口主风道区,是准噶尔盆地的最低点,属典型的高盐湿地[14],该地形成了盐湖、沼泽、盐漠等多种地类,生长有旱生、盐生、水生等多种植被群落。盐角草(Salicornia europaea)、芦苇(Phragmites australis)、准噶尔大戟(Euphorbia soongarica)、花花柴(Karelinia caspia)、碱蓬(Suaeda glauca)和戟叶鹅绒藤(Cynanchum sibiricum)是艾比湖湿地典型的盐生植被代表。
1.2 样品采集 本研究通过五点采样法于2018年7月对艾比湖湿地6种建群植物盐角草、芦苇、准噶尔大戟、花花柴、碱蓬和戟叶鹅绒藤的根际土壤进行定点采样,具体采样信息见表 1。每种植物随机选取5个植物群落区,每个群落区分别选取3株植物的根际土壤,每种植物共采集了15个土壤样本,将15个土壤样本混匀后作为一种植物的根际土壤样品,装入无菌自封袋后贴上标签。运回实验室后将土壤样本分成两份:一份进行自然风干、研磨、100目筛过筛后用于土壤理化性质的测定;一份于–80 ℃冰箱保存,用于高通量测序。
表 1. 艾比湖湿地采样信息 Table 1. Sampling information of the Ebinur Lake Wetland
| Sample names | Vegetation species | Longitude | Latitude | Season |
| YJC | Salicornia europaea | 83°09′39″E | 45°26′27″N | Summer |
| LW | Phragmites australis | 83°09′20″E | 45°26′37″N | Summer |
| DJ | Euphorbia soongarica | 83°09′17″E | 45°26′36″N | Summer |
| HHC | Karelinia caspia | 83°17′40″E | 45°25′22″N | Summer |
| JP | Suaeda glauca | 83°23′07″E | 45°18′59″N | Summer |
| ERT | Cynanchum sibiricum | 83°08′13″E | 45°26′54″N | Summer |
| The different capital letter abbreviations represent different vegetation species. YJC: Salicornia europaea; LW: Phragmites australis; DJ: Euphorbia soongarica; HHC: Karelinia caspia; JP: Suaeda glauca; ERT: Cynanchum sibiricum. The same as below. | ||||
表选项
1.3 土壤理化性质 测量样本的pH、电导率(EC)、土壤含水率(SM)、全氮(TN)、全磷(TP)、全钾(TK)、碱解氮(AN)、速效磷(AP)、速效钾(AK)、有机质(OM)共10个指标,均采用土壤常规分析方法[15]。
1.4 土壤总DNA的提取 使用PowerSoil DNA Isolation Kit (USA,MoBio公司)试剂盒提取土壤样本总DNA,每个样本设置5个重复,用1%的琼脂糖凝胶电泳检测提取的效果。以稀释后的样本总DNA为模板,使用针对ITS1的标准特异引物ITS5-1737F (GGAAGTAAAAGTCGTAACAAGG)与ITS1-2043R (GCTGCGTTCTTCATCGATGC)进行扩增。PCR反应体系(25 μL):2×PCR mix 10 μL,上、下游引物各1 μL,模板3 μL,补足ddH2O至25 μL。PCR反应条件:94 ℃ 5 min;94 ℃ 45 s,55 ℃ 30 s,72 ℃ 1 min,35个循环;72 ℃ 10 min。用0.7%的琼脂糖凝胶电泳检测后,将属于同一个样本的5个PCR产物混合均匀为1个后送至北京诺禾致源生物信息科技有限公司进行高通量测序。
1.5 生物信息学分析 去除barcode和引物后,利用FLASH、QIIME、MOTHUR等软件获得有效数据,用Uparse软件以97%的相似度划分OTU并选取代表序列,同时对OTUs代表序列进行物种注释。不同样本以rDNA ITS序列97%一致性为阈值统计Alpha多样性指数,利用SPSS 26.0对土壤优势菌属与环境因子间进行相关性分析。利用Excel 2010和SPSS 26.0进行数据统计分析,利用Origin Pro 2020进行数据绘图。
2 结果和分析 2.1 艾比湖湿地6种植物根际土壤的理化性质 使用SPSS 26.0对6种植物根际土壤的理化指标进行单因素方差分析(One-way ANOVA)。由表 2可知,6种植物的根际土壤均为碱性土壤,盐角草的pH最高,为8.92,碱蓬最低,为7.91;不同植物间土壤电导率存在显著差异(P<0.05),花花柴最高,为12.41 mS/cm,芦苇最低,为1.13 mS/cm;6种植物根际土壤的含水率和全氮含量均较低;准噶尔大戟根际土壤有机质含量最高,为57.33 g/kg,花花柴最低,为5.03 g/kg;不同植物间有效钾、全钾和全磷均存在显著差异(P<0.05),分别在戟叶鹅绒藤(226.99 mg/kg)、准噶尔大戟(1.09 g/kg)、碱蓬(26.43 g/kg)取得最大值,在花花柴(45.72 mg/kg)、盐角草(0.50 g/kg)、盐角草(13.82 g/kg)取得最小值。
表 2. 6种植物根际土壤理化因子的差异分析 Table 2. Measurement results of the physical and chemical properties of the rhizosphere soil of six plants
| Characteristics | YJC | LW | DJ | HHC | JP | ERT |
| pH | 8.92±0.01a | 8.02±0.05d | 8.03±0.04d | 8.56±0.01b | 7.91±0.02e | 8.19±0.09c |
| EC/(mS/cm) | 9.56±0.11c | 1.13±0.05f | 4.34±0.10d | 12.41±0.21a | 3.08±0.13e | 10.57±0.22b |
| SM/% | 3.37±0.33d | 3.96±0.23c | 5.41±0.56b | 7.18±0.18a | 1.17±0.14e | 1.17±0.11e |
| AN/(mg/kg) | 9.67±0.29c | 37.3±0.58a | 26.8±0.57b | 11.6±0.58c | 11.2±0.75c | 37.3±0.29a |
| OM/(g/kg) | 31.64±0.85b | 23.85±0.64b | 57.33±0.57a | 5.03±0.56c | 7.27±0.44c | 32.56±0.95b |
| TN/(g/kg) | 0.25±0.01b | 0.45±0.17bc | 0.35±0.02bc | 0.79±0.58a | 0.07±0.01b | 0.34±0.01bc |
| AP/(mg/kg) | 13.55±0.45c | 16.67±1.90bc | 9.00±0.51c | 26.99±1.91b | 11.28±1.62c | 57.34±3.30a |
| AK/(mg/kg) | 63.58±1.49e | 243.98±3.33a | 119.63±3.43c | 45.72±1.14f | 80.97±0.73d | 226.99±1.48b |
| TP/(g/kg) | 0.50±0.01e | 1.02±0.02b | 1.09±0.01a | 0.58±0.01d | 0.71±0.08c | 0.97±0.02b |
| TK/(g/kg) | 13.82±0.18e | 20.30±0.53bc | 17.47±0.60d | 19.83±0.36cd | 26.43±0.24a | 22.61±0.22b |
| The value is “mean±standard deviation”, and different lowercase letters in the same line indicate significant differences between plants (P < 0.05). | ||||||
表选项
2.2 高通量测序结果分析 稀释曲线可直接反映测序数据量的合理性,并间接反映样本中物种的丰富程度,当曲线趋向于平坦时,说明测序数据量渐近合理。本研究中,所有样品的序列数量到60000后都基本趋于平缓,说明测序数据可以反映样品中真菌群落的实际情况(图 1)。
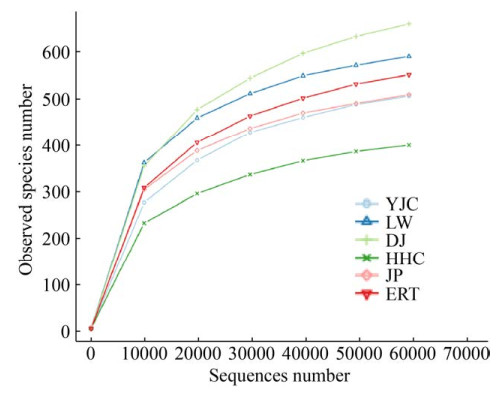 |
| 图 1 艾比湖湿地6种建群植物根际土壤样品的稀释曲线 Figure 1 Rarefaction curves of rhizosphere soil samples of six constructive plants in the Ebinur Lake wetland. |
| 图选项 |
各样本的文库覆盖度都达到了99.8%,表明注释结果能反映样品的实际情况,所得的真菌群落信息能够代表真实环境中真菌的多样性。总测序结果的α多样性分析见表 3。Shannon指数越大,则群落多样性越高,真菌多样性从高到低依次为JP>LW>DJ>HHC>ERT>YJC,碱蓬最高,盐角草最低;Chao1指数和ACE指数越大,群落丰富度越高,真菌群落丰富度从高到低依次为LW>DJ>ERT>YJC>JP>HHC,芦苇最高,花花柴最低。
表 3. 6种建群植物根际土壤真菌多样性指数 Table 3. Rhizosphere soil fungi diversity index of six constructive plants
| Sample names | Observed species | Goods coverage | Shannon | Simpson | Chao1 | ACE |
| YJC | 502 | 0.998 | 2.422 | 0.500 | 591.034 | 567.905 |
| LW | 652 | 0.997 | 5.012 | 0.923 | 804.023 | 810.218 |
| DJ | 648 | 0.998 | 4.380 | 0.855 | 722.693 | 740.837 |
| HHC | 410 | 0.998 | 4.205 | 0.861 | 499.679 | 490.479 |
| JP | 507 | 0.999 | 5.175 | 0.937 | 549.632 | 558.903 |
| ERT | 548 | 0.998 | 3.622 | 0.726 | 610.346 | 611.898 |
表选项
花瓣图(图 2)可以直观地展示各样本间特有的和共有的OTU数目。由图 2可以看出,6种植物共有的OTU数量为147,分属于37个属,每种植物特有的OTU数目均较低。芦苇特有的OTU数目最多,分属于26个属,占样本总OTU数量的24.27%;花花柴特有的OTU数目最少,分属于20个属,占样本总OTU数量的6.70%;盐角草特有的OTU数量占样本总OTU数量的13.51%,分属于26个属;准噶尔大戟特有的OTU数量占总OTU数量的17.04%,分属于43个属;戟叶鹅绒藤特有的OTU数量占总OTU数量的9.28%,分属于24个属;碱蓬特有的OTU数量占总OTU数量的11.75%,分属于20个属。
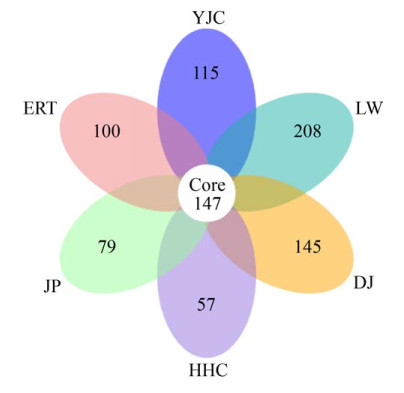 |
| 图 2 6种建群植物根际土壤样本基于OTU的花瓣图 Figure 2 Sample petal map based on OTU. |
| 图选项 |
2.3 真菌群落结构组成 样本的种群组成可以反映其在不同分类水平上的群落结构,有利于分析样本之间的差异,从而分析其群落结构特征。根据物种注释结果,所有样品中鉴定到的真菌分为14门37纲79目153科241属。对门水平下的物种进行分析发现,YJC、LW、DJ、HHC、JP、ERT中Others所占比例分别为76.93%、59.03%、16.88%、16.88%、27.26%、21.64%。选取门水平上除Others外丰富度排名前8的物种生成柱状堆积图,结果如图 3所示。艾比湖湿地6种建群植物根际土壤的优势真菌门隶属于子囊菌门(Ascomycota)、担子菌门(Basidiomycota)、被孢霉门(Mortierellomycota)、毛霉菌门(Mucoromycota)、隐真菌门(Rozellomycota)、壶菌门(Chytridiomycota)和球囊菌门(Glomeromycota)、芽枝霉门(Blastocladiomycota)、Aphelidiomycota。其中子囊菌门(Ascomycota)的占比最高,其在YJC、LW、DJ、HHC、JP、ERT中的相对丰富度占比分别为95.74%、74.50%、96.52%、90.93%、78.09%、98.76%;其次为担子菌门,其在各样本之间占比分别为3.25%、23.52%、0.79%、5.87%、21.19%、1.04%。
 |
| 图 3 6种植物根际土壤真菌在门分类水平上的群落结构 Figure 3 Community structure of six plant rhizosphere soil fungi at phylum level. |
| 图选项 |
根据物种注释结果,对属水平下的物种进行分析发现,YJC、LW、DJ、HHC、JP、ERT中Others所占比例分别为91.11%、76.86%、66.96%、35.17%、53.58%、40.85%。分析各样本在属水平上除Others外丰富度前十的物种群落结构,结果如图 4所示。排名前十的分别为链格孢霉属(Alternaria)、枝顶孢属(Acremonium)、曲霉属(Aspergillus)、镰刀菌属(Fusarium)、拟叉壳属(Microsphaeropsis)、盘菌属(Peziza)、赤霉属(Gibberella)、Udeniomyces、Plicaturopsis、节担菌属(Wallemia)。TOP10在各样本之间分布差异明显,YJC样本中的链格孢霉属和镰刀菌属的相对丰度较高;LW样本中的链格孢霉属、镰刀菌属、盘菌属和Plicaturopsis的相对丰度较高;DJ样本中的链格孢霉属、赤霉属、镰刀菌属和曲霉属的相对丰度较高;HHC样本中的镰刀菌属和拟叉壳属的相对丰度较高;JP样本中的链格孢霉属和节担菌属的相对丰度较高;ERT样本中的链格孢霉属和拟叉壳属的相对丰度较高。6种植物根际土壤中共有的且所占比例较高的菌属为链格孢霉属,其在YJC、LW、DJ、HHC、JP、ERT中的占比分别为65.89%、22.54%、22.28%、35.27%、52.80%、89.27%,其次是镰刀菌属和拟叉壳属。
 |
| 图 4 6种植物根际土壤真菌在属分类水平上的群落结构 Figure 4 Community structure of six plant rhizosphere soil fungi at genus level. |
| 图选项 |
2.4 真菌多样性与环境因子的相关性分析 相关性分析可以用来反映菌群与环境因子之间的关系。由表 4中Spearman相关系数可知,pH与节担菌属呈极显著负相关,与Udeniomyces呈极显著正相关;EC与Plicaturopsis呈显著负相关,与Udeniomyces呈显著正相关;OM与曲霉属呈极显著正相关,其余理化因子与优势菌都具有一定的相关性但是并未达到显著水平。
表 4. 6种植物根际土壤优势真菌与土壤环境因子的相关性分析 Table 4. Correlation between the dominant fungi and environmental factors in rhizosphere soil of six constructive plant
| Dominant fungi | pH | EC | AN | OM | TN | AP | TP | TK | SM | AK |
| Alternaria | 0.371 | 0.429 | –0.203 | –0.029 | –0.543 | 0.543 | –0.600 | 0.257 | –0.771 | –0.143 |
| Microsphaeropsis | –0.086 | 0.486 | 0.319 | –0.543 | 0.371 | 0.657 | –0.086 | 0.600 | 0.029 | –0.600 |
| Gibberella | –0.029 | –0.486 | –0.290 | 0.429 | –0.086 | –0.829 | 0.257 | –0.657 | 0.371 | 0.600 |
| Wallemia | –0.943** | –0.714 | 0.174 | –0.314 | –0.029 | –0.429 | 0.486 | 0.600 | 0.086 | 0.200 |
| Fusarium | 0.029 | –0.600 | –0.232 | 0.371 | –0.314 | –0.486 | 0.029 | –0.486 | –0.086 | 0.371 |
| Peziza | –0.143 | –0.714 | –0.116 | 0.086 | 0.029 | –0.486 | 0.143 | –0.429 | 0.257 | 0.143 |
| Plicaturopsis | –0.314 | –0.829* | –0.087 | 0.086 | –0.314 | –0.371 | 0.086 | –0.086 | –0.200 | 0.200 |
| Aspergillus | 0.029 | –0.029 | 0.116 | 0.943** | –0.429 | –0.371 | 0.429 | –0.200 | –0.371 | 0.771 |
| Udeniomyces | 0.943** | 0.886* | –0.203 | –0.086 | 0.429 | 0.486 | –0.543 | –0.600 | 0.371 | –0.486 |
| Acremonium | –0.429 | –0.029 | 0.029 | –0.771 | 0.429 | 0.029 | 0.029 | 0.429 | 0.486 | –0.371 |
| * means significant correlation (P < 0.05), ** means extremely significant correlation (P < 0.01), Same as below. | ||||||||||
表选项
通过相关性分析,得到6种植物根际土壤真菌群落多样性与环境因子的关系,结果如表 5所示。艾比湖湿地6种植物根际土壤的大部分环境因子与多样性指数的相关性未达到显著性水平,只有pH与Shannon指数呈极显著负相关,与Simpson指数呈显著负相关,TP与Chao1指数、ACE指数和OTU的数量显著正相关。
表 5. 6种植物根际土壤真菌群落多样性与土壤环境因子的相关性 Table 5. Correlation between soil fungal community diversity and soil environmental factors in six plant rhizosphere soils
| Indexes | Shannon | Simpson | Chao1 | ACE | OTUs amount |
| pH | –0.943** | –0.829* | –0.314 | –0.314 | –0.600 |
| EC | –0.714 | –0.543 | –0.600 | –0.600 | –0.714 |
| AN | 0.174 | 0.116 | 0.667 | 0.667 | 0.725 |
| TN | –0.029 | 0.086 | 0.143 | 0.143 | 0.086 |
| OM | –0.314 | –0.600 | 0.657 | 0.657 | 0.543 |
| AP | –0.429 | –0.200 | –0.143 | –0.143 | –0.200 |
| TP | 0.486 | 0.257 | 0.831* | 0.831* | 0.886* |
| TK | 0.600 | 0.657 | –0.086 | –0.086 | 0.200 |
| SM | 0.086 | 0.143 | –0.086 | –0.086 | –0.143 |
| AK | 0.200 | –0.086 | 0.200 | 0.200 | 0.257 |
表选项
3 讨论 3.1 艾比湖湿地不同建群植物根际土壤真菌群落多样性和丰富度特征 本研究通过Illumina HiSeq测序平台对艾比湖湿地盐角草、芦苇、准噶尔大戟、花花柴、碱蓬和戟叶鹅绒藤的根际土壤真菌ITS1区进行了测序。结果发现,碱蓬根际土壤真菌多样性显著高于其他5种植物根际土壤,这可能是因为碱蓬可以促进盐分溶淋和氮磷钾的释放,从而提高了土壤肥力,对土壤真菌多样性起到了保护作用[16]。土壤pH是影响真菌群落结构的重要环境因子,对真菌的生长和繁殖具有显著影响[8],本研究中,pH与土壤真菌多样性指数呈显著负相关,盐角草根际土壤pH最高,但真菌多样性最低,这可能是因为真菌偏好在弱酸性土壤中生存[17–18]。邵璐等[19]对盐场碱蓬根际土壤真菌进行研究发现链格孢霉属作为优势属出现,而本研究中链格孢霉属在6种植物根际土壤中的相对丰度均较高,这说明链格孢霉属在强碱环境中生存能力较强。芦苇根际土壤真菌的多样性和群落丰富度都较高,这是因为芦苇根系发达,能够充分地吸收土壤中的水分和养分,从而适应盐渍环境,有利于维持根际微生物群落的稳定[20]。土壤真菌大部分都是好氧型真菌,含水量过高会抑制真菌的生长和繁殖[21],适宜的含水量才适合土壤真菌的生长[22],花花柴根际土壤真菌群落丰富度较低,这可能与其较高的土壤含水量有关。土壤有机质含量超过其所能承受的阈值时,真菌多样性就会降低[23]。本研究中,准噶尔大戟和戟叶鹅绒藤的根际土壤真菌群落的Shannon指数较低,而Chao1指数和ACE指数较高,且两种植物根际土壤的有机质含量都较高,这与de Vries等[24]发现在局域小尺度上土壤真菌的多样性随着土壤有机质含量的增加而降低的研究结果相似。准噶尔大戟和戟叶鹅绒藤根际土壤的速效养分含量较高,可被土壤直接吸收,从而提高土壤肥力,改善土壤质地,提高土壤中真菌群落丰度,对土壤真菌起到保护作用[16]。
3.2 艾比湖湿地不同建群植物根际土壤真菌群落多样性及丰度与环境因子的关系 真菌对季节变化、土壤理化性质、植被类型等的响应各有不同,而土壤环境因子是影响土壤真菌多样性的主要因素[25],通过分析真菌多样性与土壤环境因子的关系,可以间接反映土壤是否健康,并在土壤真菌群落动态演替和湿地的恢复方面具有重要的指导意义,也能为湿地生态恢复提供坚实的理论基础。
本研究结果表明,pH与真菌群落多样性呈显著负相关,这与Zhang等[26]发现土壤pH过高会限制真菌的存活、李森森等[22]发现酸性条件更适合土壤真菌生长的研究结果相同。本研究发现全磷与真菌群落丰富度呈显著正相关,这与已有的研究结果相似[27]。本研究发现土壤盐分对真菌优势属影响较大,这与Vanegas等[28]发现土壤含盐量对红树林根际真菌群落组成有重要影响的结果相似。高玉峰等[29]研究发现真菌数量随碱解氮含量升高而下降,这与本研究结果不一致,可能与研究样地土壤氮素水平不同有关。
优势菌是决定微生物群落平衡的重要因素,能够影响微生物群落的组成和结构[30]。子囊菌门大多为腐生菌[31],能够分解木质素和角质素等难以降解的物质[32],从而促进土壤养分循环,提高土壤质量,而湿地的环境极易于其生长。在门水平上,6种植物根际土壤真菌都以子囊菌门为主,其次是担子菌门,这说明优势菌群受到环境因素显著影响,这与杨立宾等[33]、高微微等[34]的研究结果一致。链格孢霉属是6种植物根际土壤共有的优势菌,它分布广泛,具有较好的抑菌活性[35–36],在一定程度上可使植被避免被植物病原菌伤害,使植株生长更旺盛,这也说明链格孢霉属的耐盐性较强。本研究表明,pH与节担菌属呈极显著负相关,与Udeniomyces呈极显著正相关,含盐量与Plicaturopsis呈显著负相关,与Udeniomyces呈显著正相关;有机质含量与曲霉属呈极显著正相关,这说明真菌属对环境的适应能力不同,对环境因子的改变比较敏感,从而导致真菌群落结构发生变化。
Akhter等[37]对种植盐草(Kallar grass)的盐碱地(pH=10.4,EC=18.9 dS·m–1)进行了5年连续监测,发现与无盐草盐碱地相比,种植盐草的土壤盐分显著降低,pH也以每年0.229的速度降低,土壤环境改善,土壤肥力有所恢复,这表明种植盐生植物是盐碱地生物改良的合理方法[38]。真菌扮演着分解者的角色,参与有机质的降解、土壤养分转化和循环等过程,能增加土壤肥力[39]。本研究通过对6种湿地盐生植物根际土壤进行真菌ITS1区测序,探明其根区真菌优势菌门为子囊菌门和链格孢霉菌,可用于后续耐盐微生物菌剂的研发,以提高盐生植物的生存阈值,这为艾比湖湿地退化恢复工作提供了一个新思路。
References
| [1] | Zhu HQ, Li YH, Li FD. Seasonal variations of soil enzyme activities in typical plant communities in the Ebinur Lake wetland, China. Chinese Journal of Applied Ecology, 2017, 28(4): 1145-1154. (in Chinese) 朱海强, 李艳红, 李发东. 艾比湖湿地典型植物群落土壤酶活性季节变化特征. 应用生态学报, 2017, 28(4): 1145-1154. |
| [2] | Wang YQ, He JZ, Zhao XL, Zhang HY, Deng F, Jia XY, Liu C. Comparison of salt-tolerance and drought-tolerance of two desert plants (Karelinia caspica and Suaeda turkestanica litw.) in Tarim. Genomics and Applied Biology,, 2009, 28(6): 1128-1134. (in Chinese) 王彦芹, 贺江舟, 赵小亮, 张海燕, 邓芳, 贾晓宇, 刘陈. 塔里木盆地荒漠植物花花柴和碱蓬耐盐、耐旱性比较. 基因组学与应用生物学, 2009, 28(6): 1128-1134. |
| [3] | Sun B, Xie JC, Wang N, Li SQ, Li CJ. Effect of reeds on salt enrichment and improvement of saline-alkali land. Journal of Soil and Water Conservation, 2012, 26(3): 92-96, 101. (in Chinese) 孙博, 解建仓, 汪妮, 李双庆, 李春娇. 芦苇对盐碱地盐分富集及改良效应的影响. 水土保持学报, 2012, 26(3): 92-96, 101. |
| [4] | Wang LY, Pan J, Xiao H, Cheng WJ, Yang Y. Effect of soluble salt on planting salt-tolerant plants of coastal saline soil. Acta Agriculturae Boreali-Sinica, 2014, 29(5): 226-231. (in Chinese) 王立艳, 潘洁, 肖辉, 程文娟, 杨勇. 种植耐盐植物对滨海盐碱地土壤盐分的影响. 华北农学报, 2014, 29(5): 226-231. |
| [5] | Fu YJ, Zhang JL, Hou XQ. Comparative analysis of fungi diversity in rizospheric and non-rhizospheric soil from cypripedium macranthum estimated via high-throughput sequencing. Acta Agriculturae Boreali-Occidentalis Sinica, 2019, 28(2): 253-259. (in Chinese) 付亚娟, 张江丽, 侯晓强. 大花杓兰根际与非根际土壤真菌多样性的高通量测序分析. 西北农业学报, 2019, 28(2): 253-259. |
| [6] | Coats VC, Rumpho ME. The rhizosphere microbiota of plant invaders: an overview of recent advances in the microbiomics of invasive plants. Frontiers in Microbiology, 2014, 5: 368. |
| [7] | Yu TH, Zhang NL, Yu S, Qu LY. The characteristics of soil fungal community and effect factors under common tree species in urban parks of Beijing. Acta Ecologica Sinica, 2021, 41(5): 1835-1845. (in Chinese) 于天赫, 张乃莉, 于爽, 曲来叶. 北京城市公园常见乔木土壤真菌群落特征及影响因素. 生态学报, 2021, 41(5): 1835-1845. |
| [8] | Han SZ, Gao R, Li AP, Ma HL, Yin YF, Si YT, Chen SD, Zheng QR. Soil microbial community structure of two types of forests in the mid-subtropics of China. Chinese Journal of Applied Ecology, 2015, 26(7): 2151-2158. (in Chinese) 韩世忠, 高人, 李爱萍, 马红亮, 尹云锋, 司友涛, 陈仕东, 郑群瑞. 中亚热带地区两种森林植被类型土壤微生物群落结构. 应用生态学报, 2015, 26(7): 2151-2158. |
| [9] | 王佳悦. 若尔盖湿地土壤真菌多样性及生态位研究. 四川农业大学学位论文, 2016. |
| [10] | Wang SH, Chang SL, Li X, Zhang YT. Soil fungal diversity and its community structure in Tianshan Forest. Acta Ecologica Sinica, 2021, 41(1): 124-134. (in Chinese) 王诗慧, 常顺利, 李鑫, 张毓涛. 天山林区土壤真菌多样性及其群落结构. 生态学报, 2021, 41(1): 124-134. |
| [11] | Yang X, Huang XT, Wang C, Wang XT, Yin XL, Lin SY, Wang WQ. Comparison of fungal community structure and diversity in typical paddy fields. China Environmental Science, 2020, 40(10): 4549-4556. (in Chinese) 阳祥, 黄晓婷, 王纯, 王晓彤, 尹晓雷, 林少颖, 王维奇. 典型稻田土壤真菌群落结构及多样性对比. 中国环境科学, 2020, 40(10): 4549-4556. DOI:10.3969/j.issn.1000-6923.2020.10.042 |
| [12] | 王艳萍. 艾比湖湿地真核微生物群落动态演替和优势菌群组成变化对环境响应的研究. 石河子大学学位论文, 2014. |
| [13] | Hu WG, Jin XT, Wang YP, He SB. Diversity of eukaryotic micro-organisms and changes in the dominant fungal taxa composition in relationship with soil environment in the Ebinur Lake wetland. Biotechnology & Biotechnological Equipment, 2018, 32(2): 408-419. |
| [14] | Xie ZY, Li WH, Xie ZJ, Li XQ. Evaluation of the ecological service of Ebinur Lake Wetland Nature Reserve. Arid Land Geography, 2011, 34(3): 532-540. (in Chinese) 谢正宇, 李文华, 谢正君, 李新琪. 艾比湖湿地自然保护区生态系统服务功能价值评估. 干旱区地理, 2011, 34(3): 532-540. |
| [15] | 鲁如坤. 土壤农业化学分析方法. 北京: 中国农业科技出版社, 2000. |
| [16] | Ji ZJ, Tang YP, Zhang ZY, Fu CP, Li JH, Li J, Chen SX. Primary exploration of reformating and renovation on coastal saline-alkali soil under different substrate treatment. Journal of Nanjing Agricultural University, 2006, 29(1): 138-141. (in Chinese) 吉志军, 唐运平, 张志扬, 付春平, 李江华, 李健, 陈双星. 不同基底处理下碱蓬种植对滨海盐渍土的改良与修复效应初探. 南京农业大学学报, 2006, 29(1): 138-141. |
| [17] | Ju TZ, Chen Y, Chang CH, An LZ. The diversity of soil fungi and its relations with fertility factors in Taxus chinensis (Pilg.) Rehd community of Xiaolongshan of Tianshui city. Research of Environmental Sciences, 2008, 21(1): 128-132. (in Chinese) 巨天珍, 陈源, 常成虎, 安黎哲. 天水小陇山红豆杉(Taxus chinensis (Pilg.) Rehd)林土壤真菌多样性及其与生态因子的相关性. 环境科学研究, 2008, 21(1): 128-132. |
| [18] | Sun Q, Wu HL, Chen F, Kang JH. Fungal community diversity and structure in rhizosphere soil of different crops in the arid zone of central Ningxia. Microbiology China, 2019, 46(11): 2963-2972. (in Chinese) 孙倩, 吴宏亮, 陈阜, 康建宏. 宁夏中部干旱带不同作物根际土壤真菌群落多样性及群落结构. 微生物学通报, 2019, 46(11): 2963-2972. |
| [19] | Shao L, Jiang H. Effect of season and variation in salinity on the rhizosphere fungal diversity of Suaeda liaotungensis. Acta Ecologica Sinica, 2016, 36(4): 1050-1057. (in Chinese) 邵璐, 姜华. 辽宁碱蓬根际土壤真菌多样性的季节变化及其耐盐性. 生态学报, 2016, 36(4): 1050-1057. |
| [20] | Wang JW, Zhao CZ, Zhao LC, Wang XP, Li Q. Response of root morphology and biomass of Phragmites australis to soil salinity in inland salt marsh. Acta Ecologica Sinica, 2018, 38(13): 4843-4851. (in Chinese) 王继伟, 赵成章, 赵连春, 王小鹏, 李群. 内陆盐沼芦苇根系形态及生物量分配对土壤盐分因子的响应. 生态学报, 2018, 38(13): 4843-4851. |
| [21] | Yin XL, Chen GX, Wang C, Wang XT, Yang X, Wang WQ. Effects of Spartina alterniflora invasion on soil fungi community structure and diversity in estuarine wetland. Acta Scientiae Circumstantiae, 2020, 40(6): 2186-2194. (in Chinese) 尹晓雷, 陈桂香, 王纯, 王晓彤, 阳祥, 王维奇. 互花米草入侵对河口湿地土壤真菌群落结构及多样性影响. 环境科学学报, 2020, 40(6): 2186-2194. |
| [22] | Li SS, Ma DL, Zang SY, Wang LL, Sun HZ. Structural and functional characteristics of soil microbial community in the Songjiang wetland under different interferences. Acta Ecologica Sinica, 2018, 38(22): 7979-7989. (in Chinese) 李森森, 马大龙, 臧淑英, 王璐璐, 孙弘哲. 不同干扰方式下松江湿地土壤微生物群落结构和功能特征. 生态学报, 2018, 38(22): 7979-7989. |
| [23] | Liu RJ, Jiao H, Li Y, Li M, Zhu XC. Research advances in species diversity of arbuscular mycorrhizal fungi. Chinese Journal of Applied Ecology, 2009, 20(9): 2301-2307. (in Chinese) 刘润进, 焦惠, 李岩, 李敏, 朱新产. 丛枝菌根真菌物种多样性研究进展. 应用生态学报, 2009, 20(9): 2301-2307. |
| [24] | de Vries FT, Hoffland E, van Eekeren N, Brussaard L, Bloem J. Fungal/bacterial ratios in grasslands with contrasting nitrogen management. Soil Biology and Biochemistry, 2006, 38(8): 2092-2103. DOI:10.1016/j.soilbio.2006.01.008 |
| [25] | Bridge PD, Newsham KK. Soil fungal community composition at Mars Oasis, a southern maritime Antarctic site, assessed by PCR amplification and cloning. Fungal Ecology, 2009, 2(2): 66-74. DOI:10.1016/j.funeco.2008.10.008 |
| [26] | Zhang D, Meng KX, Hao YH, Fan HY, Cui N, Wang SS, Song TF. Comparative proteomic analysis of cucumber roots infected by Fusarium oxysporum f. sp. cucumerium Owen. Physiological and Molecular Plant Pathology, 2016, 96: 77-84. DOI:10.1016/j.pmpp.2016.09.002 |
| [27] | Yang T, Adams JM, Shi Y, He JS, Jing X, Chen LT, Tedersoo L, Chu HY. Soil fungal diversity in natural grasslands of the Tibetan Plateau: associations with plant diversity and productivity. New Phytologist, 2017, 215(2): 756-765. DOI:10.1111/nph.14606 |
| [28] | Vanegas J, Mu?oz-García A, Pérez-Parra KA, Figueroa-Galvis I, Mestanza O, Polanía J. Effect of salinity on fungal diversity in the rhizosphere of the halophyte Avicennia germinans from a semi-arid mangrove. Fungal Ecology, 2019, 42: 100855. DOI:10.1016/j.funeco.2019.07.009 |
| [29] | Gao YF, He ZD. Study on soils effect factors to fungi diversity in Hebei Province. Chinese Agricultural Science Bulletin, 2010, 26(10): 177-181. (in Chinese) 高玉峰, 贺字典. 影响土壤真菌多样性的土壤因素. 中国农学通报, 2010, 26(10): 177-181. |
| [30] | Luo X, Zhang HY, Liu MY, Shao B. Study review on microbial community diversity in paddy soils. Journal of Anhui Agricultural Sciences, 2018, 46(21): 42-43, 47. (in Chinese) 罗鑫, 张海燕, 刘明元, 邵彪. 稻田土壤微生物群落多样性研究进展. 安徽农业科学, 2018, 46(21): 42-43, 47. DOI:10.3969/j.issn.0517-6611.2018.21.012 |
| [31] | Yelle DJ, Ralph J, Lu FC, Hammel KE. Evidence for cleavage of lignin by a brown rot basidiomycete. Environmental Microbiology, 2008, 10(7): 1844-1849. DOI:10.1111/j.1462-2920.2008.01605.x |
| [32] | Deng JJ, Zhou YB, Yin Y, Bai XJ, Gao HL, Zhu WX. Characteristics of soil fungal community structure at two coniferous plantations in mountainous region of eastern Liaoning Province, northeastern China. Journal of Beijing Forestry University, 2019, 41(9): 130-138. (in Chinese) 邓娇娇, 周永斌, 殷有, 白雪娇, 高慧淋, 朱文旭. 辽东山区两种针叶人工林土壤真菌群落结构特征. 北京林业大学学报, 2019, 41(9): 130-138. |
| [33] | Yang LB, Sui X, Wei D, Cui FX, Zhu DG, Ni HW. Fungal diversity in the brown coniferous forest soils of Daxing'anling Mountains, Northeast China. Chinese Journal of Applied Ecology, 2019, 30(10): 3411-3418. (in Chinese) 杨立宾, 隋心, 魏丹, 崔福星, 朱道光, 倪红伟. 大兴安岭棕色针叶林土壤的真菌多样性. 应用生态学报, 2019, 30(10): 3411-3418. |
| [34] | Gao WW, Kang Y, Lu H, Wang QY. Basic soli physicochemical properties and soil fungal diversity under different forest types of urban forest. Journal of Northeast Forestry University, 2016, 44(3): 89-94, 100. (in Chinese) 高微微, 康颖, 卢宏, 王秋玉. 城市森林不同林型下土壤基本理化特性及土壤真菌多样性. 东北林业大学学报, 2016, 44(3): 89-94, 100. DOI:10.3969/j.issn.1000-5382.2016.03.019 |
| [35] | Wang HK, Zhang TY, Zhang M. Advances on taxonomic studies of the genus Alternaria. Journal of Shandong Agricultural University, 2001, 32(3): 406-410. (in Chinese) 王洪凯, 张天宇, 张猛. 链格孢属真菌分类研究进展. 山东农业大学学报: 自然科学版, 2001, 32(3): 406-410. DOI:10.3969/j.issn.1000-2324.2001.03.033 |
| [36] | 卢丹丹. 北桑寄生内生真菌的分离鉴定及Alternaria alternata次级代谢产物研究. 山西医科大学学位论文, 2020. |
| [37] | Akhter J, Mahmood K, Malik KA, Ahmed S, Murray R. Amelioration of a saline sodic soil through cultivation of a salt-tolerant grass Leptochloa fusca. Environmental Conservation, 2003, 30(2): 168-174. DOI:10.1017/S0376892903000158 |
| [38] | Jia YF. The use of salt plants to repair the salt alkali application and resource utilization. Agricultural Development & Equipments, 2020(1): 41-42. (in Chinese) 贾燕芳. 盐生植物修复盐碱地应用及资源化利用途径. 农业开发与装备, 2020(1): 41-42. DOI:10.3969/j.issn.1673-9205.2020.01.030 |
| [39] | An SS, Li GH, Chen LD. Soil microbial functional diversity between rhizosphere and non-rhizosphere of typical plants in the hilly area of southern Nixia. Acta Ecologica Sinica, 2011, 31(18): 5225-5234. (in Chinese) 安韶山, 李国辉, 陈利顶. 宁南山区典型植物根际与非根际土壤微生物功能多样性. 生态学报, 2011, 31(18): 5225-5234. |
