王珊珊#, 刘佳萌#, 孙晶, 贾宁, 金诺, 刘佳妮, 范蓓

 , 王凤忠
, 王凤忠

农业农村部农产品质量安全收贮运管控重点实验室, 中国农业科学院农产品加工研究所, 北京 100193
收稿日期:2021-03-01;修回日期:2021-05-19;网络出版日期:2021-09-16
基金项目:中国农业科学院农产品加工研究所创新工程(125161015000150013);国家自然科学基金(31800005);中央级公益性科研院所基本科研业务费专项(Y2020XK24)
*通信作者:范蓓, E-mail: caasBFan@163.com;
王凤忠, E-mail: caasFZWang@163.com.
#并列第一作者。
摘要:[目的] 分析树干仿生栽培和大棚种植的铁皮石斛根、茎中内生细菌的组成与分布,并挖掘潜在的微生物资源及功能。[方法] 利用Illumina MiSeq高通量测序技术,对不同栽培方式铁皮石斛根、茎中免培养内生细菌丰富度及多样性进行比较分析;通过传统的内生菌分离法以及16S rRNA基因测序技术对可培养内生细菌进行分离鉴定;采用滤纸片法筛选拮抗石斛病原菌的内生菌株。[结果] 高通量测序分析中内生细菌以Pseudomonas(30.52%)为主,其次是Mycobacterium(10.22%)以及Brachybacterium(8.32%),树干仿生栽培石斛内生细菌组成丰富度及多样性高于大棚种植,石斛根中内生细菌组成丰富度及多样性高于石斛茎。可培养内生细菌中Bacillus(18.37%)所占比例最高,其次是Curtobacterium(8.16%),同时筛选得到8株具有抑制石斛病原菌活性的菌株。[结论] 铁皮石斛中蕴含着丰富的内生细菌资源,菌群组成和分布受其不同栽培方式和组织部位的影响。此外,筛选得到8株具有抑制病原菌活性的菌株,表明铁皮石斛内生细菌代谢产物具有抗菌活性。本试验对铁皮石斛内生细菌多样性及其抑菌活性的分析研究,为石斛内生微生物资源的后续深度挖掘以及利用提供了内生细菌资源。
关键词:铁皮石斛内生细菌多样性抑菌活性
Diversity and antibacterial activity of endophytic bacteria in roots and stems of Dendrobium officinale with different cultivation patterns
Shanshan Wang#, Jiameng Liu#, Jing Sun, Ning Jia, Nuo Jin, Jiani Liu, Bei Fan

 , Fengzhong Wang
, Fengzhong Wang

Key Laboratory of Agro-products Quality and Safety Control in Storage and Transport Process, Ministry of Agriculture and Rural Affairs/Institute of Food Science and Technology, Chinese Academy of Agricultural Sciences, Beijing 100193, China
Received: 1 March 2021; Revised: 19 May 2021; Published online: 16 September 2021
*Corresponding author: Bei Fan, E-mail: caasBFan@163.com;
Fengzhong Wang, E-mail: caasFZWang@163.com.
Foundation item: Supported by the Knowledge Innovation Program Funding of Institute of Food Science and Technology, Chinese Academy of Agricultural Sciences (125161015000150013), by the National Natural Science Foundation of China (31800005) and by the Central Public-Interest Scientific Institution Basal Research Fund (Y2020XK24)
#These authors contributed equally to this work.
Abstract: [Objective] To explore the potential microbial resources and functions, this study analyzed the diversity of endophytic bacteria in the roots and stems of Dendrobium officinale cultivated on trunks and in greenhouses. [Methods] The composition and distribution of the endophytic bacterial community were analyzed by Illumina MiSeq High-throughput sequencing. Meanwhile, the endophytic bacteria were isolated using the traditional culture method and identified by 16S rRNA gene sequence analysis. The Kirby-Bauer test was used for detecting antimicrobial activity. [Results] The results showed that the culture-independent bacteria mainly belonged to Pseudomonas (30.52%), followed by Mycobacterium (10.22%) and Brachybacterium (8.32%). The abundance and diversity of endophytic bacteria of Dendrobium officinale cultivated on trunks were higher than that cultivated in greenhouse. The endophytic bacteria of Dendrobium officinale in root showed more abundance and diversity than in the stems. Bacillus (18.37%) accounted for the highest proportion of the culturable endophytic bacteria, followed by Curtobacterium (8.16%). Meanwhile, 8 strains showed antimicrobial activity against at least one pathogen in this study. [Conclusion] The result demonstrated that there was a huge resource of endophytic bacteria in the Dendrobium officinale. The distribution of the endophytic bacterial community was influenced by the difference of cultivation patterns and tissues. In addition, the strains with antimicrobial activity could be used as biological control of pathogenic bacteria. This study provides a diverse endophytic microbial resource of Dendrobium for further exploring and utilizing.
Keywords: Dendrobium officinaleendophytic bacteriadiversityantimicrobial activity
石斛属(Dendrobium)植物在全球约有1500种,在中国被认定为有药用价值的石斛属植物已超过50种[1–2]。《神农本草经》等古医学典籍以及《中国药典》对石斛均有记载,其主要在归胃、肾经方面的作用较为突出。大量现代医学研究表明,石斛中的多糖、生物碱、酚类、菲类和联苄类等活性成分具有增强免疫力、降血糖、抗氧化、抗肿瘤、抗衰老、抗炎症等药用功效,且能对神经系统和糖脂代谢具有保护调控作用[3–6]。2018年国家卫生健康委员会将铁皮石斛(Dendrobium officinale)列入食药物质(http://www.nhc.gov.cn/),2019年铁皮石斛国际标准ISO 21370: 2019的发布为其走向世界奠定了基础(https://www.iso.org/standard/70792.html),铁皮石斛作为石斛市场主流产品,具有较高的药用研究价值。
目前市场上的铁皮石斛主要可分为野生和人工种植两大类。我国石斛资源虽然丰富,但由于近些年野生石斛的过度开发破坏,其资源几乎枯竭。20世纪90年代以来,为保护野生石斛资源,我国科技工作者在石斛人工育苗、种植等方面取得了重大突破。2006年,我国初步实现了石斛从濒危物种到人工种植产业化的初级态势;2012年出台的《中国药用铁皮石斛标准》使石斛产业更为关注种源、品质和安全性[7]。石斛人工种植栽培方式主要可分为仿生栽培和大棚集约化设施栽培:仿生栽培即人为创造与野生石斛生境相同或相似的种植条件,使人工种植石斛仿照野生石斛生长条件进行生长发育的一种栽培方式;大棚集约化设施栽培即依据石斛生长发育规律,人为地创造设施条件进行石斛规模集中种植的方式[8]。虽然人工种植能较大限度地提高石斛产量,操作简便,不易产生管理失误,适于不同品种栽培,但易发生细菌性和真菌性病害,对其产量和质量均造成严重影响,如白绢病(Southern blight)寄主范围广、发病快、难防治,成为石斛毁灭性病害[9]。并且,肥料、化学农药等高产保质措施的施用会导致石斛的药效品质以及内生环境组成与野生石斛相比产生较大的差异。
植物内生细菌作为植物组织内部的微生物资源,其与宿主复杂密切的协同进化关系越来越受到研究人员的重视。研究表明,部分内生细菌可产生与宿主植物相同或相似的活性功能,或者对宿主植物的一些致病菌具有较好的抑制效果[10]。因此,本试验选取树干仿生栽培和大棚种植石斛的根和茎,结合Illumina MiSeq高通量测序技术与传统的内生细菌分离法对其内生细菌组成和分布进行全面的分析研究,探究不同栽培方式下石斛内生菌群的组成与分布,以便于进一步挖掘内生菌群与其药用活性成分之间的相互关系。以导致石斛白绢病(Southern blight)的罗尔阿太菌(Athelia rolfsii,CBS 719.83)、石斛漆斑病(Tar spot disease)的露湿漆斑菌(Myrothecium roridum,CBS 357.89)以及石斛软腐病(Soft rot)的胡萝卜软腐果胶杆菌猕猴桃亚种(Pectobacterium carotovorum subsp. actinidiae,BCCM/LMG 26003)为指示病原菌,利用滤纸片扩散法(Kirby-Bauer test)对菌株进行抑菌活性筛查,筛选石斛病原菌拮抗菌株,以期为石斛病害的生物防控以及合理利用宝贵石斛资源提供研究基础。
1 材料和方法 1.1 材料与试剂 本试验所用铁皮石斛于2018年12月采自福建省三明市农业科学研究院,按照栽培模式不同,将其分为树干仿生栽培和大棚种植石斛,并分别采集无明显病害的石斛根和茎,24 h内运回实验室,于4 ℃储藏,并在两天之内尽快开展表面消毒以及内生细菌的分离鉴定工作。
Chelex-100树脂,美国Bio-Rad公司;细菌DNA扩增引物27F和1492R,生工生物工程(上海)股份有限公司;GelStain核酸染料、2×EasyTaq Super Mix、1500 bp DNA Marker,北京全式金生物技术有限公司;罗尔阿太菌(Athelia rolfsii)、露湿漆斑菌(Myrothecium roridum)以及胡萝卜软腐果胶杆菌猕猴桃亚种(Pectobacterium carotovorum subsp. actinidiae),由福建省三明市农业科学研究院提供。
洁净工作台,北京东联哈尔仪器制造有限公司;生化培养箱,上海一恒科学仪器有限公司;旋转蒸发仪RE-52AA,上海亚荣生化仪器厂;PCR仪,Applied Biosystems(ABI);DYY-6C型电泳仪,北京六一生物科技有限公司;Illumina Miseq PE300平台,上海美吉生物医药科技有限公司。
1.2 培养基 本试验共采用11种分离培养基:腐殖酸培养基(HV)、10%浓度YIM38培养基(10%YIM38)、自来水酵母培养基(TW)、葡萄糖淀粉培养基(BL)、丙酸钠培养基(SP)、海藻糖-脯氨酸培养基(TP)、纤维素培养基(CM)、M-WA培养基(GP)、10%浓度营养琼脂(NA)、棉籽糖组氨酸培养基(RH)、R2A合成培养基(R2A),对表面消毒的石斛样本进行内生细菌的分离,以获得更多的可培养内生菌株[11]。为了给石斛内生细菌提供自然的生长条件,在分离培养基中添加1%的石斛浸汁,制备方法为:将用超纯水洗涤干净的石斛鲜茎以10% (W/V)添加至超纯水中,粉碎机粉碎,并用4到6层纱布过滤,取10 mL石斛浸汁加入至1 L培养基中,pH 7.2,121 ℃灭菌15 min。
菌株YIM38纯化培养基以及发酵培养基:葡萄糖4 g,酵母浸粉4 g,麦芽浸粉5 g,维生素B 1 g,氯化钠1 g,琼脂粉20.0 g,超纯水1 L,pH 7.2;LB培养基:胰蛋白胨10 g,酵母浸粉5 g,氯化钠10 g,琼脂粉20.0 g,超纯水1 L,pH 7.2;马铃薯葡萄糖肉汤(potato dextrose broth,PDB)培养基、马铃薯葡萄糖琼脂(potato dextrose agar,PDA)培养基、各培养基原料采购自北京奥博星生物技术有限公司以及国药集团化学试剂有限公司。
1.3 石斛样本表面消毒 分别对石斛植株的根和茎进行表面消毒,具体流程如下:超纯水超声处理15 min;1% Tween-20浸泡1 min;3%次氯酸钠浸泡7 min;2.5%硫代硫酸钠浸泡9 min;75%乙醇浸泡3 min;蒸馏水洗涤3次,取200 μL第3次洗涤水涂布于11种分离培养基上,28 ℃培养2周,若培养基上无细菌生长,则证明样本表面消毒干净;最后,用10%碳酸氢钠浸泡10 min。消毒之后的样本一部分利用传统的内生菌分离法进行可培养内生细菌的体外分离鉴定;另一部分送至上海美吉生物医药科技有限公司(www. majorbio.com)通过Illumina MiSeq高通量测序技术,对其内生细菌进行免培养多样性分析[12]。
1.4 可培养内生细菌的分离鉴定 将消毒后的石斛样本用无菌手术剪剪成0.5–1.0 cm小段,置于分离培养基上,于28 ℃、有氧条件下进行培养,直至样品内部出现单个菌落。观察并挑取外观形态特征不同的单菌落在YIM38纯化培养基上划线分离,经过2–3次点接纯化、转接后,得到单一菌株,对分离出的单菌落进行菌体形态观察,并对形态特征有明显差异的菌株进行16S rRNA基因序列分析。菌株总DNA模板的提取采用Chelex-100法[13],16S rRNA基因PCR扩增中所使用的引物由生工生物工程(上海)股份有限公司合成,其序列为:27F:5′-AGAGTTTGATCCTG GCTCAG-3′和1492R:5′-TACGGCTACCTTGTTA CGACTT-3′。PCR反应体系共50 μL,包括2 μL DNA模板,25 μL的1×EasyTaq PCR SuperMix酶,27F和1492R引物各1.5 μL以及20 μL无菌水,利用Wang等试验方法进行PCR扩增[12]。PCR产物经1.2%的琼脂糖凝胶电泳检测后,送由生工生物工程(上海)股份有限公司进行序列测定。将测得的基因序列登录EZBioCloud数据库(https://www.ezbiocloud.net/identify)进行16S rRNA基因序列比对,得到序列相似性比对结果,并将菌株16S rRNA基因序列提交至NCBI GenBank。利用MEGA 7.0中的Neighbor-joining法对其进行系统进化树的构建,自举值为1000,初步确定菌株的生物学分类地位
1.5 抑菌活性菌株的筛选 挑选单菌落接种至150 mL的YIM38液体发酵培养基中,在200 r/min、28 ℃条件下振荡培养48 h。将培养液在4 ℃、9500 r/min条件下离心20 min后分别收集发酵上清液和菌体。发酵上清液用等体积的乙酸乙酯进行萃取,菌体用等体积的丙酮进行萃取,接着在38 ℃条件下对萃取液进行旋转蒸发浓缩,1 mL甲醇复溶,分别得到菌株发酵上清乙酸乙酯萃取液以及菌体丙酮萃取液,–20 ℃保存备用。
采用滤纸片扩散法(Kirby-Bauer test)对菌株进行抑菌活性筛查。石斛病原真菌罗尔阿太菌(Athelia rolfsii)和露湿漆斑菌(Myrotheciuum roridum)、病原细菌胡萝卜软腐果胶杆菌猕猴桃亚种(Pectobacterium carotovorum subsp. actinidiae)分别在28 ℃、200 r/min条件下,在PDB (前两者)和LB液体培养基中培养12 h,以10% (V/V)添加至PDA (前两者)和LB固体培养基中,混合均匀,倒入培养皿中用作测试板。分别用20 μL菌株的发酵上清乙酸乙酯萃取液以及菌体丙酮萃取液浸湿无菌滤纸片(直径6 mm)。将滤纸片晾干后放置在测试平板上,在28 ℃、有氧条件下培养16 h,通过测量抑菌圈的直径(电子数显卡尺,0–150 mm)来测试菌株抑菌效果。
1.6 数据分析 免培养内生细菌多样性数据利用SILVA 16S rRNA数据库(Release132, http://www.arb-silva.de)、UPARSE (version 7.1, http://drive5.com/uparse/)以及Mothur (version v.1.30.1, http://www.mothur.org/)等软件进行分析。
2 结果和分析 2.1 Illumina MiSeq高通量测序分析
2.1.1 测序数据的质量控制与评估分析: 对样本中内生细菌的V5-V7可变区序列进行扩增测序,优化之后的有效序列数目为721757,有效碱基数目为285386495 bp。按照97%相似性对非重复序列(不含单序列)进行操作分类单元(operational taxonomic units,OTU)聚类分析,在聚类过程中去除嵌合体,得到OTU的代表序列数目为1295。从稀释曲线来看,基于OTU水平的Shannon多样性指数曲线趋向平坦,说明测序数据量足够大,可以反映样本中绝大多数微生物的多样性信息(图 1-A)。
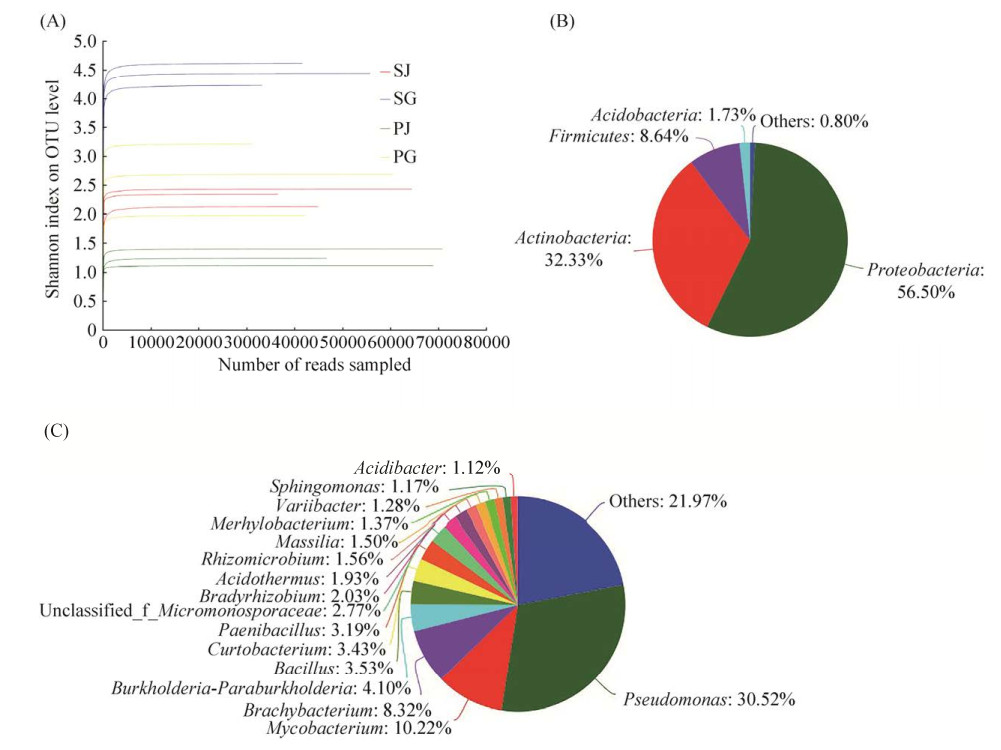 |
| 图 1 不同样本在OTU水平(97%相似性)的Shannon多样性指数曲线(A)以及免培养内生细菌在门水平上(B)和属水平上(C)的群落饼图(Pie图)分布 Figure 1 Rarefaction curves of the OTU number at 97% similarity for different samples (A) and community analysis pieplot on phylum level (B) and genus level (C) of the culture-independent endophytic bacteria on the whole. PG: the roots of Dendrobium officinale cultivated in greenhouses; PJ: the stems of Dendrobium officinale cultivated in greenhouses; SG: the roots of Dendrobium officinale cultivated on trunks; SJ: the stems of Dendrobium officinale cultivated on trunks. |
| 图选项 |
采用RDP classifier贝叶斯算法对OTU代表序列进行分类学分析,样本整体可被分类为26个门、46个纲、115个目、251个科、481个属和746个种。其中,主要以变形菌门Protebacteria (56.50%)为主,其次是放线菌门Actinobacteria (32.33%)以及厚壁菌门Firmicutes (8.64%)(图 1-B)。从属水平来看,假单胞菌属Pseudomonas (30.52%)所占比例最高,其次是分支杆菌属Mycobacterium (10.22%)以及短状杆菌属Brachybacterium (8.32%) (图 1-C)。
2.1.2 样本中内生细菌组成及分布: 利用偏最小二乘法判别分析PLS-DA (partial least squares discriminant analysis)对各组石斛样本内生细菌组成进行组间相似性分析,检验组间差异的显著性。结果显示,各组样本均能很好地聚类到一起,表明不同栽培方式和组织的石斛内生细菌菌群组成和分布不同(图 2)。
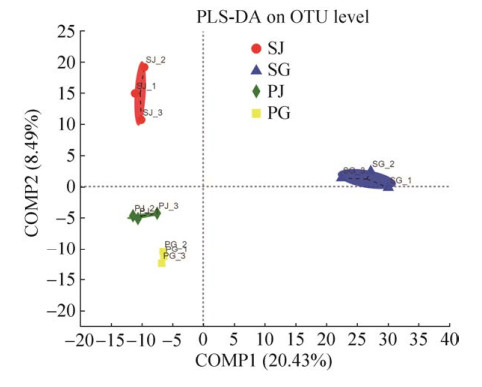 |
| 图 2 不同石斛样本基于OTU水平的偏最小二乘法判别分析PLS-DA Figure 2 Partial Least Squares Discriminant Analysis for different samples on OTU level. PG: the roots of Dendrobium officinale cultivated in greenhouses; PJ: the stems of Dendrobium officinale cultivated in greenhouses; SG: the roots of Dendrobium officinale cultivated on trunks; SJ: the stems of Dendrobium officinale cultivated on trunks. |
| 图选项 |
从反映群落丰富度的指数Ace、Chao、Sobs来看,PG和SG的指数均高于PJ和SJ,表明石斛样本根组织中的内生细菌群落丰富度高于石斛茎组织;而SG和SJ的指数均分别高于PG和PJ,表明树干仿生栽培石斛样本的内生细菌丰富度高于大棚种植石斛。从反映群落多样性的指数Shannon和Simpson来看,Shannon值越大,说明群落多样性越高,Simpson指数值越大,说明群落多样性越低,结果表明石斛根中的内生细菌群落多样性高于石斛茎,树干仿生栽培石斛样本的内生细菌多样性高于大棚种植石斛(表 1)。
表 1. 各石斛样本中Alpha多样性指数 Table 1. Alpha-diversity analyses of endophytes in different Dendrobium samples
| Groups | Samples | Reads | Alpha diversity | |||||
| Ace | Chao | Sobs | Shannon | Simpson | Coverage/% | |||
| PG | PG_1 | 30951 | 329.9749 | 322.4286 | 263 | 3.2042 | 0.0797 | 99.79 |
| PG_2 | 42146 | 270.5409 | 260.6000 | 223 | 1.9700 | 0.2958 | 99.89 | |
| PG_3 | 60561 | 326.0934 | 333.7576 | 301 | 2.6782 | 0.1179 | 99.92 | |
| PJ | PJ_1 | 46733 | 184.5712 | 195.6000 | 180 | 1.2303 | 0.6193 | 99.97 |
| PJ_2 | 70912 | 177.2620 | 177.5000 | 175 | 1.3926 | 0.4919 | 99.99 | |
| PJ_3 | 68702 | 175.7065 | 185.7895 | 158 | 1.1036 | 0.5289 | 99.95 | |
| SG | SG_1 | 41419 | 603.1498 | 612.8654 | 549 | 4.6106 | 0.0205 | 99.80 |
| SG_2 | 55636 | 575.6237 | 568.3182 | 518 | 4.4332 | 0.0219 | 99.85 | |
| SG_3 | 33075 | 552.0026 | 564.4043 | 492 | 4.2178 | 0.0477 | 99.75 | |
| SJ | SJ_1 | 64238 | 227.7085 | 228.4615 | 225 | 2.4219 | 0.1717 | 99.98 |
| SJ_2 | 44803 | 451.3398 | 466.0286 | 412 | 2.1214 | 0.4402 | 99.86 | |
| SJ_3 | 36443 | 257.8596 | 258.6250 | 233 | 2.3351 | 0.1816 | 99.89 | |
| PG: the roots of Dendrobium officinale cultivated in greenhouses; PJ: the stems of Dendrobium officinale cultivated in greenhouses; SG: the roots of Dendrobium officinale cultivated on trunks; SJ: the stems of Dendrobium officinale cultivated on trunks. | ||||||||
表选项
对各组石斛样本内生细菌群落组成丰富度进行属水平上的Heatmap图分析(图 3-A)。从丰富度值前50的细菌菌属来看,PG和SG的内生细菌菌属组成丰富度均分别高于PJ和SJ,表明石斛样本根组织中的内生细菌群落丰富度高于石斛茎;而SG和SJ的丰富度均分别高于PG和PJ,表明仿生栽培石斛茎的内生细菌丰富度高于大棚种植石斛。同时,石斛样本中丰富度值前50的多数细菌菌属在SG中具有较高的丰富度,如Variibacter、Acidibacter、Bradyrhizobium以及Rhizomicrobium在SG中具有较高的丰富度值,而在PJ、SJ和PG中丰富度值较低。为了较为直观地展现各组石斛样本的内生细菌组成相似性及重叠情况,选用相似水平为97%的OTU进行Venn图分析(图 3-B)。结果显示,4组石斛样本共有的OTU数目为119,占总OTU数目的9.19%。SJ、SG、PJ和PG分别特有的OTU数目为176、400、96和50。SG中含有的OTU数目最多,为862,内生细菌组成最为多样,其次是SJ。从整体来看,SG和SJ中OTU数目明显高于PG和PJ,表明仿生栽培石斛茎中的内生细菌组成多样性高于大棚种植;而SG和PG中OTU数目均分别高于SJ和PJ,表明石斛根组织中的内生细菌组成多样性高于石斛茎。
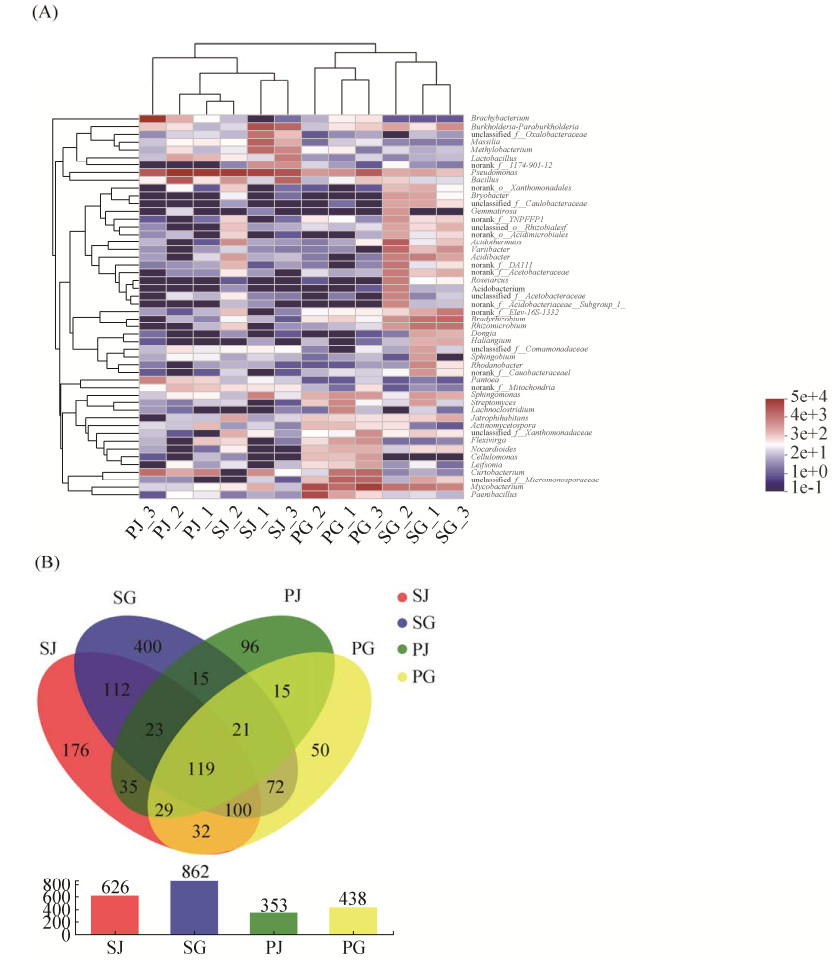 |
| 图 3 不同石斛样本中检测到的细菌群落丰富度值前50的菌属Heatmap图分析(A)以及各组石斛样本基于OTU水平的Venn图(B) Figure 3 Heatmap of the top 50 most abundant genera in bacterial communities detected in the different groups (A) and Venn diagrams showing the number of OTU shared and unique among different samples (B). PG: the roots of Dendrobium officinale cultivated in greenhouses; PJ: the stems of Dendrobium officinale cultivated in greenhouses; SG: the roots of Dendrobium officinale cultivated on trunks; SJ: the stems of Dendrobium officinale cultivated on trunks. |
| 图选项 |
对不同组石斛样本中优势菌属进行比较分析(表 2)。结果显示,不同组石斛样本中的优势菌属不同。SG中优势菌属为Bradyrhizobium (8.91%),其次是Mycobacterium (7.83%);SJ中优势菌属为Pseudomonas (46.14%),其次是Burkholderia- Paraburkholderia (14.70%);PG中优势菌属为Mycobacterium (37.34%),其次是Paenibacillus (14.04%);PJ中优势菌属为Pseudomonas (54.48%),其次是Brachybacterium (26.46%)。Acidobacterium (1.92%)、Rhizomicrobium (6.93%)、Roseiarcus (2.20%)以及Variibacter (5.82%)仅在SG中检测到;Cellulomonas (1.18%)和Lachnoclostridium (1.50%)仅在PG中检测到;Bradyrhizobium仅在石斛根组织SG (8.91%)和PG (0.28%)中检测到;Lactobacillus、Massilia和Methylobacterium仅在石斛茎组织SJ和PJ中检测到;Acidothermus仅在树干仿生栽培石斛SG和SJ中检测到;Brachybacterium、Flexivirga和Streptomyces仅在大棚种植石斛PG和PJ中检测到。Pseudomonas在SJ (46.14%)和PJ (54.48%)中所占比例较高。SG中丰富度占比小于0.01%的菌属有28.74%,表明SG中内生菌属多样性最高。
表 2. 不同组石斛样本中优势菌属比较 Table 2. Comparison of percentage (%) of the dominant bacterial genera for the different groups
| Genus | SG | SJ | PG | PJ |
| Acidibacter | 4.35 | 0.66 | – | 0.02 |
| Acidothermus | 7.56 | 1.06 | – | – |
| Acidobacterium | 1.92 | – | – | – |
| Bacillus | 0.22 | 5.72 | 0.27 | 6.47 |
| Brachybacterium | – | – | 0.17 | 26.46 |
| Bradyrhizobium | 8.91 | – | 0.28 | – |
| Burkholderia-Paraburkholderia | 1.75 | 14.70 | 0.27 | 0.22 |
| Cellulomonas | – | – | 1.18 | – |
| Curtobacterium | 0.02 | 1.14 | 8.00 | 4.32 |
| Flexivirga | – | – | 1.71 | 0.15 |
| Lactobacillus | – | 2.12 | – | 0.61 |
| Lachnoclostridium | – | – | 1.50 | – |
| Massilia | – | 5.93 | – | 0.11 |
| Methylobacterium | – | 5.33 | – | 0.09 |
| Mycobacterium | 7.83 | 0.45 | 37.34 | 0.08 |
| Paenibacillus | 0.06 | – | 14.04 | 0.07 |
| Pantoea | – | – | – | 1.32 |
| Pseudomonas | 1.27 | 46.14 | 8.58 | 54.48 |
| Rhizomicrobium | 6.93 | – | – | – |
| Roseiarcus | 2.20 | – | – | – |
| Streptomyces | – | – | 1.55 | 0.02 |
| Sphingomonas | – | 1.61 | 2.10 | 0.11 |
| Variibacter | 5.82 | – | – | – |
| Unclassified_f_Oxalobacteraceae | – | 3.22 | – | 0.04 |
| Norank_f_DA111 | 2.87 | 0.30 | – | – |
| Norank_f_1174–901-12 | – | 1.85 | – | – |
| Unclassified_f_Xanthomonadaceae | – | 0.42 | 1.24 | – |
| Unclassified_o_Rhizobiales | – | 0.22 | – | – |
| Unclassifiied_f_Micromonosporaceae | 0.74 | – | 11.57 | – |
| Norank_f_Elev-16S-1332 | 2.97 | – | 0.19 | – |
| Norank_f_Acetobacteraceae | 2.77 | – | – | – |
| Unclassified_f_Acetobacteraceae | 1.68 | – | – | 0.03 |
| Norank_f_YNPFFP1 | – | – | 0.13 | – |
| Others | 28.74 | 8.04 | 9.28 | 5.30 |
| Genera making up less than 1% of total composition in each sample were classified as “other”. PG: the roots of Dendrobium officinale cultivated in greenhouses; PJ: the stems of Dendrobium officinale cultivated in greenhouses; SG: the roots of Dendrobium officinale cultivated on trunks; SJ: the stems of Dendrobium officinale cultivated on trunks. | ||||
表选项
对不同组织部位的石斛样本中内生细菌群落组成进行属水平的Wilcox秩和检验(Wilcoxon rank-sum test),置信区间为0.95。结果显示,石斛根中Mycobacterium、unclassified_f_Micromonosporaceae、Bradyrhizobium和Streptomyces平均相对丰富度极显著高于茎(**P < 0.01),而根中Pseudomona的平均相对丰富度极显著低于茎(**P < 0.01);根中Rhizomicrobium和norank_f_Elev-16S-1332的平均相对丰富度显著高于茎(*P < 0.05),而根中Massilia和Lactobacillus的平均相对丰富度显著低于茎(*P < 0.05)(图 4-A)。对不同栽培方式的石斛样本进行分析,大棚种植石斛中Brachybacterium的平均相对丰富度极显著高于树干仿生栽培石斛(**P < 0.01),Curtobacterium的平均相对丰富度显著高于仿生栽培石斛(*P < 0.05),而Acidibacter和norank_f__DA111的平均相对丰富度显著低于仿生栽培石斛(*P < 0.05)(图 4-B)。
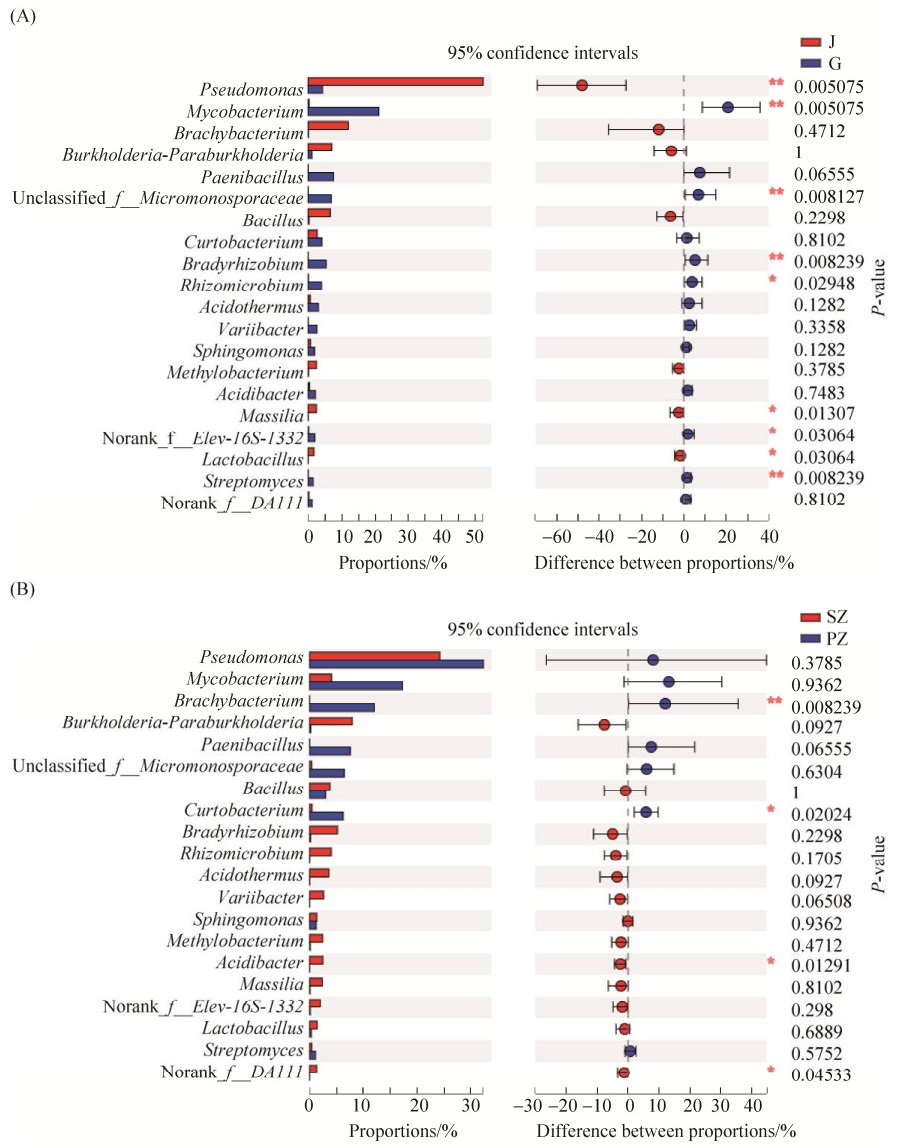 |
| 图 4 不同石斛样本中内生细菌在属水平上的Wilcox秩和检验 Figure 4 Wilcox rank-sum test of endophytic bacteria at genus level in different Dendrobium samples. A: Wilcoxon rank-sum test of endophytic bacteria in roots and stems of Dendrobium at genus level; B: Wilcoxon rank-sum test of endophytic bacteria of Dendrobium under different cultivation patterns at genus level. J: the stems of Dendrobium officinale cultivated on trunks and in greenhouses; G: the roots of Dendrobium officinale cultivated on trunks and in greenhouses; SZ: the roots and stems of Dendrobium officinale cultivated on trunks; PZ: the roots and stems of Dendrobium officinale cultivated in greenhouses. |
| 图选项 |
2.2 可培养内生细菌的分离鉴定 从表面消毒的石斛茎、根组织中共分离出174株可培养内生细菌。所有分离菌株均通过16S rRNA基因序列分析鉴定,并通过EzBioCloud数据库(https://www.ezbiocloud.net/identify)进行比对。所有内生细菌可被分为4个不同的细菌门、24个菌属、49个菌种。厚壁菌门Firmicutes (38.78%)所占比例最高,其次是变形菌门Proteobacteria (30.61%)和放线菌门Actinobacteria (28.57%)(图 5-A),而只分离出一株拟杆菌门Bacteroidetes菌株:TP-PG-7 (Sphingobacterium mucilaginosum,相似率:99.64%)。在属水平上,芽孢杆菌属Bacillus (18.37%)所占比例最高,其次是短小杆菌属Curtobacterium (8.16%) (图 5-B)。初步排重后,将49株菌株的16S rRNA基因序列提交至NCBI GenBank,其登录号为MW406839–MW406887。并分别基于厚壁菌门、变形菌门以及放线菌门构建了菌株的系统发育树,自举值为1000,展示它们的系统进化发育关系(图 6)。
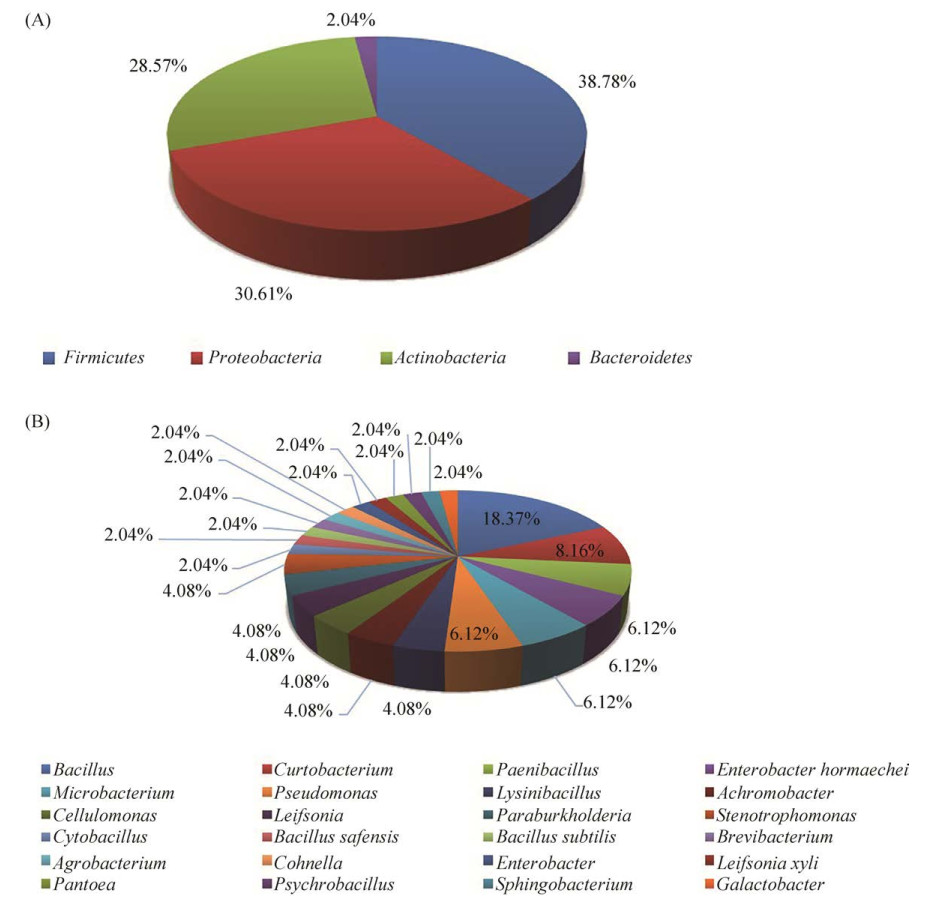 |
| 图 5 石斛可培养内生细菌组成 Figure 5 Composition of culturable endophytic bacteria of Dendrobium. A: Composition of cultivable endophytes on phylum level; B: Composition of cultivable endophytes on genus level. |
| 图选项 |
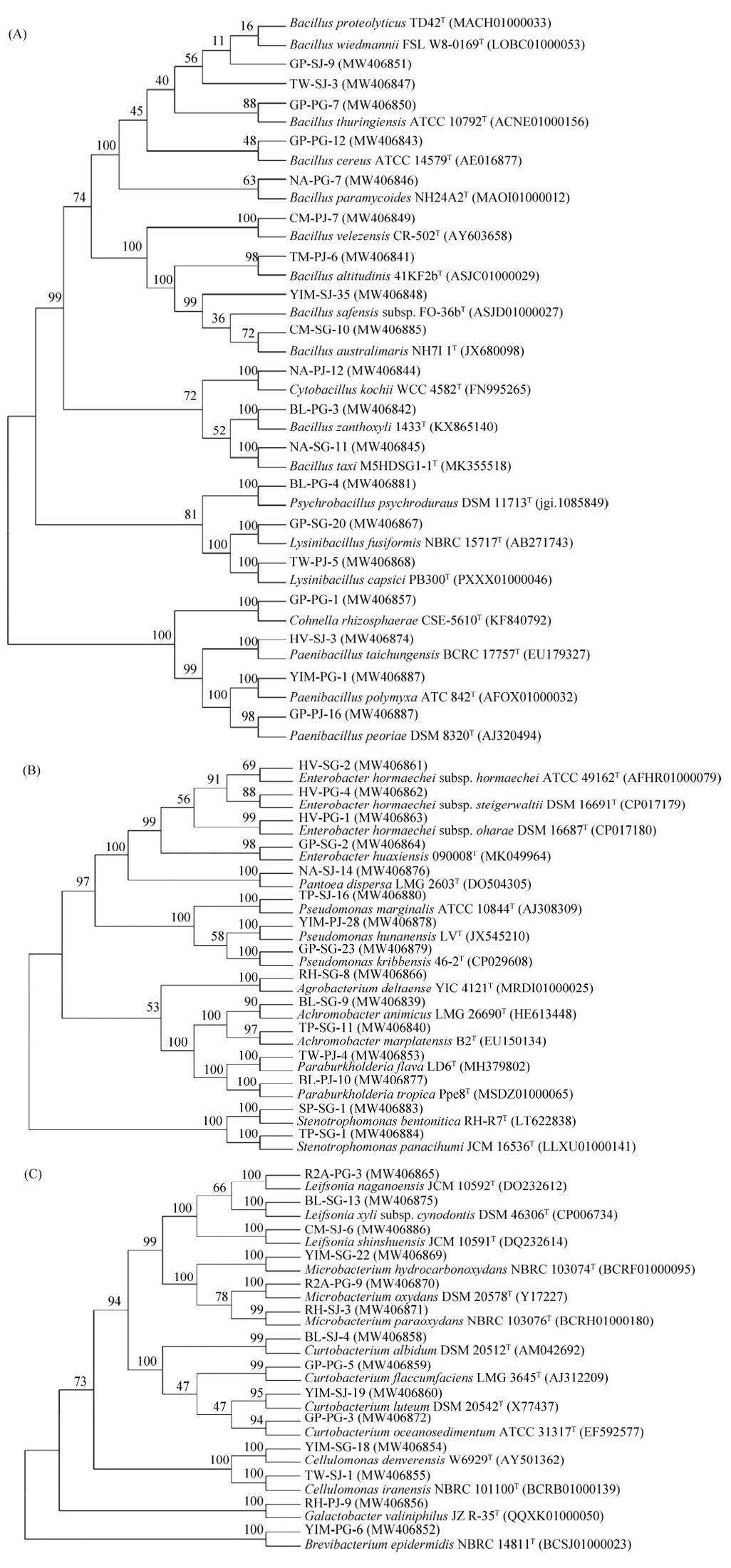 |
| 图 6 基于菌株的16S rRNA基因序列构建的系统发育进化树 Figure 6 Phylogenetic tree based on 16S rRNA gene sequence of strain. A: Phylogenetic tree of isolates in the phylum Firmicutes and related species based on 16S rRNA gene sequences; B: Phylogenetic tree of isolates in the phylum Proteobacteria and related species based on 16S rRNA gene sequences; C: Phylogenetic tree of isolates in the phylum Actinobacteria and related species based on 16S rRNA gene sequences. The number in parentheses represents the accession number; the number at nodes of tree indicates bootstrap confidence. The length of branches represents the evolutionary distance. |
| 图选项 |
对各组样本中分离鉴定到的可培养内生细菌菌株进行比较分析(图 7-A)。结果显示,从SG中分离出的菌株数目最多,占总菌株数目的44.25%,其次是PG (21.84%)。且从SG和PG中分离出的内生菌株数目均高于SJ (18.97%)和PJ (14.94%),这与免培养分析结果相一致,表明石斛根组织中的免培养以及可培养内生细菌丰富度及多样性均高于石斛茎组织。从不同栽培方式来看,SG中分离出的内生菌株的数目明显高于PG,而SJ高于PJ,表明树干仿生栽培石斛中可培养内生细菌丰富度及多样性高于大棚种植石斛。
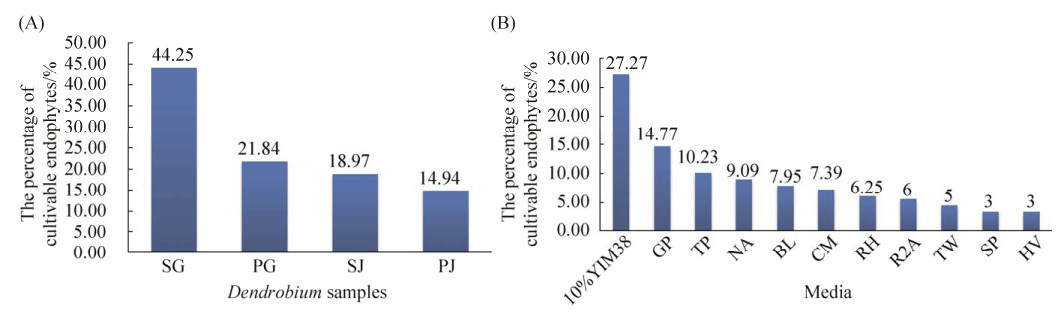 |
| 图 7 不同组石斛样本中分离出的可培养内生细菌占总菌株的比例(A)以及11种分离培养基分离出的可培养内生细菌菌株数目所占总菌株比例(B) Figure 7 Proportion of cultivable endophytic bacteria isolated from different groups of Dendrobium samples (A) and proportion of cultivable endophytic bacterial isolated from 11 kinds of isolation media in the total bacterial strains (B). PG: the roots of Dendrobium officinale cultivated in greenhouses; PJ: the stems of Dendrobium officinale cultivated in greenhouses; SG: the roots of Dendrobium officinale cultivated on trunks; SJ: the stems of Dendrobium officinale cultivated on trunks. |
| 图选项 |
不同培养基成分也会影响微生物的生长和繁殖。本实验为了获得更多的可培养内生细菌菌株,采用了11种分离培养基对石斛样本中的内生菌株进行分离(图 7-B)。结果显示,10% YIM38培养基中分离得到的内生菌株数目最多,占总菌株数目的27.27%,其次是GP培养基(14.77%),而SP (3%)和HV (3%)培养基中分离出的内生细菌数目最少,表明10% YIM38培养基的成分组成最有利于石斛中大多数内生细菌菌株的生长,故本实验后期采用YIM38培养基对内生菌株进行纯化和发酵。
2.3 内生细菌对植物病原菌的体外抑菌活性筛查 本试验以3种石斛病原菌为指示菌,共筛选得到8株具有抑菌活性的菌株(表 3)。其中,YIM-PG-1 (Paenibacillus polymyxa ATCC 842T,99.86%)对3株指示病原菌均具有较好的抑制效果,其余7株仅对石斛病原真菌具有抑制效果,而对病原细菌胡萝卜软腐果胶杆菌猕猴桃亚种不具有抑制活性。此外,菌株上清乙酸乙酯萃取液对石斛病原菌的抑制效果优于菌体丙酮萃取液,表明内生细菌菌株中具有抑菌活性的成分主要分泌至胞外,这为下一步研究活性成分以及植物活体试验奠定了基础(图 8)。
表 3. 对3种病原菌中至少一种具有抑制活性的内生细菌菌株 Table 3. Endophytic strains which showed antimicrobial activity against at least one of the three phytopathogens
| Strain Number | GenBank accession number | Closest species in 16S rRNA gene sequences database | Samilarity/% | Active part | Pathogenic fungi | P. carotovorum subsp. Actinidiae/mm | |
| A. rolfsii/ mm | M. roidum/ mm | ||||||
| YIM-PG-1 | MW406873 | P. polymyxa ATCC 842T | 99.86 | Supernatant | 13.85 | 12.86 | 12.36 |
| Sediment | 9.46 | – | – | ||||
| GP-PJ-16 | MW406887 | P. peoriae DSM 8320 | 99.27 | Supernatant | 9.38 | 9.01 | – |
| Sediment | 7.37 | 7.22 | – | ||||
| GP-SG-2 | MW406864 | E. huaxiensis 090008 | 98.74 | Supernatant | 11.26 | 10.39 | – |
| Sediment | 7.85 | – | – | ||||
| CM-PJ-7 | MW406849 | B. velezensis CR-502 | 98.86 | Supernatant | 13.62 | 12.86 | – |
| Sediment | 7.27 | – | – | ||||
| HV-PG-4 | MW406862 | E. hormaechei subsp. steigerwaltii DSM 16691 | 99.64 | Supernatant | 7.31 | 7.17 | – |
| Sediment | 7.19 | – | – | ||||
| BL-SJ-4 | MW406858 | C. albidum DSM 20512 | 99.08 | Supernatant | 8.59 | 7.79 | – |
| Sediment | – | – | – | ||||
| HV-PG-1 | MW406863 | E. hormaechei subsp. oharae DSM 16687 | 99.57 | Supernatant | 7.88 | – | – |
| Sediment | – | – | – | ||||
| CM-SJ-6 | MW406886 | L. shinshuensis JCM 10591 | 98.96 | Supernatant | 7.29 | – | – |
| Sediment | – | – | – | ||||
表选项
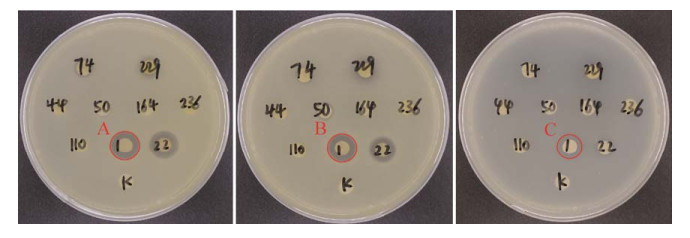 |
| 图 8 YIM-PG-1菌株上清乙酸乙酯萃取液对3株指示病原菌抑制效果图 Figure 8 Antimicrobial activity of the ethyl acetate extracts of the supernatant of YIM-PG-1 against phytopathogens. A: Antimicrobial activity of YIM-PG-1 against Athelia rolfsii; B: Antimicrobial activity of YIM-PG-1 against Myrothecium roidum; C: Antimicrobial activity of YIM-PG-1 against Pectobacterium carotovorum subsp. actinidiae. |
| 图选项 |
3 讨论 目前自然环境中能被分离鉴定到的微生物大约只占1%,仍有大量未知的微生物由于低丰富度、缺乏信号和化学因子的刺激以及不适宜的温度、pH、氧利用率、营养来源等因素而不能通过传统的内生菌分离法被分离鉴定到[14]。因此本试验基于Illumina MiSeq高通量测序平台,对石斛样本内生细菌16S rRNA基因序列的V5–V7区进行高通量测序,并结合传统的内生细菌组织分离法,全面、深入地探究铁皮石斛样本中的内生细菌群落组成、分布以及生物学活性等信息。
首先,基于Illumina MiSeq高通量测序技术对铁皮石斛内生细菌群落组成丰富度及多样性的分析结果表明,石斛内生细菌菌群组成和分布受其不同栽培方式和组织的影响,树干仿生栽培石斛内生细菌组成丰富度及多样性高于大棚种植,石斛根组织中的内生细菌组成丰富度及多样性高于茎组织。研究表明,内生菌在宿主植物中的定殖是一个连续的过程,一般从植物根际(细菌对植物根分泌物的反应)开始,然后是根表面和根内部定殖,一旦进入到根内部,有能力的内生菌可以移动到植物的地上部分(茎和叶)[15–18],故石斛根部的内生菌群丰富度及多样性高于石斛茎部。已有研究表明,铁皮石斛根部内生细菌的属、种数量明显比茎多,这与本试验结果相一致[19]。但传统医药学以及中国药典中均以石斛茎入药,这或许是因为石斛中的主要药效成分多糖和生物碱在石斛茎中的含量高于根[4, 20–21]。内生菌在与药用植物互相依存的过程中,会对药用植物的化学成分以及药理活性产生一定的影响。例如,接种了菌根真菌MF23 (Mycena sp.)的金钗石斛Dendrobiu nobile,其总生物碱含量显著增加了18.3%[22]。本试验中,Bradyrhizobium仅在石斛根组织SG (8.91%)和PG (0.28%)中检测到;Lactobacillus、Massilia和Methylobacterium仅在石斛茎组织SJ和PJ中检测到;且Pseudomonas在SJ (46.14%)和PJ (54.48%)中所占比例较高,推测Pseudomonas可产生对宿主石斛有益或相似的代谢物,较快适应了与宿主共生的特殊环境,进而迅速从根部迁移至茎部。高阳等研究发现,金钗石斛中内生细菌多样性与其石斛碱含量具有一定的相互作用关系,且Pseudomonas与石斛碱含量呈正相关[23]。因此本试验中检测到的石斛茎和根中特有及优势菌属是否与其独特的药效成分具有一定的相互作用关系,仍需进一步的探究。本试验结果表明,不同栽培方式的石斛中内生细菌组成和分布也具有显著差异。对不同栽培方式的石斛样本中优势菌属进行比较分析,Acidothermus、Rhizomicrobium、Roseiarcus和Variibacter仅在树干仿生栽培石斛SG或SJ中检测到;Brachybacterium、Cellulomonas、Flexivirga、Lachnoclostridium、Pantoea和Streptomyces仅在大棚种植石斛PG或PJ中检测到。在所有石斛样本中丰富度占比小于1%的菌属在SG中占有28.74%,SJ中占比为8.04%,分别高于PG (9.28%)和PJ (5.30%),表明树干仿生栽培石斛内生细菌多样性高于大棚种植。推测树干仿生栽培石斛所处生境接近于野生栽培石斛,其栽培基质中内生菌群组成较为多样,而大棚种植石斛生存环境较为单一、固定,故树干仿生栽培石斛内生菌群多样性高于大棚种植。因大棚种植石斛内生细菌群落多样性较低,不能通过菌群平衡来很好地维持植物-内生菌动态平衡状态,进而需要一些特殊的菌属在植物发育及植物对病原体和非生物胁迫的反应中起关键作用,故在大棚种植石斛PG和PJ中检测到的丰富度占比大于1%的菌属比树干仿生栽培石斛的多。同时,不同栽培方式铁皮石斛的药效成分含量也具有明显的差异,大棚种植的铁皮石斛在醇溶性浸出物、多酚、黄酮和生物碱等含量上低于仿野生铁皮石斛[23–25]。目前,仍未有关于不同栽培方式的石斛中内生细菌与药效成分相互作用关系的研究。因此,下一步可结合不同栽培方式石斛中药效成分的差异进行相关研究。
在本实验中,基于MiSeq高通量测序分析,共得到26个细菌门、481个菌属以及746个菌种,远远高于利用传统的内生细菌分离法得到的4个细菌门、24个菌属以及49个菌种。其中,高通量测序分析中内生细菌主要以Pseudomonas (30.52%)为主,其次是Mycobacterium (10.22%)以及Brachybacterium (8.32%);分离鉴定到的可培养内生细菌中Bacillus (18.37%)所占比例最高,其次是Curtobacterium (8.16%),而Pseudomonas所占比例为6.12%,Mycobacterium、Brachybacterium均未被分离鉴定到。推测可能是因为内生细菌的体外分离鉴定受到多方面的影响,如培养基营养水平、培养温度、pH条件以及共培养细菌或共生环境所产生的信号和化学因子的刺激等,故利用传统的微生物培养法分离鉴定出的内生菌株具有偏向性和局限性。Bacillus在自然界无处不在,较为活跃,且适应性强,易被分离鉴定到,具有较强的促进植物生长、防治植物病虫害和增强植物抗逆性等作用,并能在不利的环境条件下生存很长时间,具有很大的发展潜力[26]。但Bacillus在植物体内多以孢子形式存在、细胞壁较厚,在进行植物基因组DNA提取时,无法使其裂解,导致未能有效地获取到该类群细菌的基因组DNA。而Pseudomonas为革兰氏阴性菌,细胞壁相比于Bacillus而言较薄,能较完整地提取到该类细菌的基因组DNA。虽然本实验在内生细菌的体外分离鉴定中,采用添加了1%石斛浸汁的11种分离培养基,以满足不同内生细菌的生长和繁殖条件,但推测采集的石斛样本中的Pseudomonas没有Bacillus适应性强,无法较好地适应体外培养条件,故未能分离鉴定出更多的该菌属菌株。由此可见,为了较全面地分析植物体内生菌群的组成和分布,应适当地结合高通量测序技术和传统的内生菌分离方法[27–29]。
虽然基于MiSeq高通量测序技术能鉴定到更多稀有的菌属,更好地表征内生菌群地组成与分布,但只有将单菌株分离纯化出来,才能更进一步地研究阐述其生长、代谢以及生理生化功能。因此,如何扩大培养范围、分离纯化得到更多的可培养微生物仍是优先考虑且必需的思路[30]。任何微生物的生长都需要适当的营养、pH、温度、氧气浓度和物理化学成分等,且不同微生物所需不同。K?pke等研究发现在不同的培养基基质和培养条件下,微生物生长会出现明显差异[31]。任杰等通过优化发酵培养条件,显著提高了菌株A02和A08固氮酶的活力[32]。本试验采用11种不同组成成分的分离培养基,并添加1%的石斛浸汁以满足不同内生细菌的生长和繁殖条件,更广泛地分离出石斛内生菌株。结果表明,从以葡萄糖为主要碳源、以酵母浸提物为有机氮源并添加了麦芽浸粉的10% YIM38培养基分离出的内生菌株最多,表明其可满足更多的不同种属内生细菌生长的营养因子需求,而对3株石斛病原菌均具有较好抑制效果的YIM-PG-1菌株也是从10% YIM38中分离得到。分离出的唯一1株拟杆菌门Bacteroidetes中鞘氨醇杆菌属Sphingobacterium的菌株TP-PG-7是从添加了海藻糖和脯氨酸的TP培养基中分离得到的。由此可见,一些稀有菌属需要给予特殊的营养物质或化学因子才能利用传统的细菌分离法将其培养纯化出来。因此,未来还需结合高通量测序技术,对微生物生理环境进行分析研究,解析影响稀有微生物不能被培养的关键营养因子,改进分离培养、纯化传代培养以及保存技术,以获得并利用更大比例的内生微生物资源,进而推动来源于稀有微生物的新基因以及新天然活性产物等资源的挖掘利用。
研究表明,一些从药用植物中分离出的内生菌可对其致病菌具有较好的抑制效果[10, 33]。本试验中,从大棚种植的石斛根组织中分离得到的多粘类芽孢杆菌(Paenibacillus polymyxa,99.86%) YIM-PG-1对3种指示病原菌均具有较好的抑制效果。徐桑尔研究发现,多粘类芽孢杆菌CF05可有效防治由萎蔫短小杆菌(Curtobacterium flaccumfaciens)引起的铁皮石斛细菌性叶斑病,并具有显著的促生效果[34]。许多类芽孢杆菌属不仅可以通过生物固氮、磷酸盐溶解、产生植物激素吲哚-3-乙酸(IAA)等直接促进宿主植物生长,还可以生产各种抗菌剂和杀虫剂,并通过触发植物的过敏防御反应来实现对宿主植物的生物防控作用。例如,多粘类芽孢杆菌P. polymyxa菌株WR可产生超过30种对尖孢镰刀菌Fusarium oxysporum f. sp. niveum具有一定抗真菌活性的挥发性有机化合物,包括苯、醛、酮和醇,尽管有些产量很低,其中,苯并噻唑、苯甲醛、十一烷醛、十二烷醛、十六烷醛、2-十三烷酮和苯酚是主要的抗真菌化合物[35–36]。同时,从结果来看,筛选到的8株具有抑菌活性的菌株,有5株是分离自大棚种植石斛(YIM-PG-1,GP-PJ-16,CM-PJ-7,HV-PG-4,HV-PG-1),而只有3株是分离自树干仿生栽培石斛。推测其可能是由于树干仿生栽培石斛内生菌群的组成丰富度及多样性高于大棚种植石斛,可以通过菌群平衡来抵御病原菌的入侵,但大棚种植石斛内生菌群丰富度及多样性较低,需要一些特定的内生菌来产生抗逆物质,进而抵御病原菌的入侵。由于条件所限,本试验只进行了内生菌株对病原菌的离体抑制活性检测,进行植物活体检验以及抑菌活性成分的分离、纯化和结构鉴定有待进一步的研究。
4 总结 本试验结合Illumina MiSeq高通量技术与传统的内生菌分离法对不同栽培方式的铁皮石斛根、茎中内生细菌组成和分布进行研究。结果显示,铁皮石斛中蕴含着巨大的内生细菌资源,具有非常可观的应用前景。整体来看,高通量测序分析中内生细菌主要以Pseudomonas (30.52%)为主,其次是Mycobacterium (10.22%)以及Brachybacterium (8.32%);可培养内生细菌中Bacillus (18.37%)所占比例最高,其次是Curtobacterium (8.16%)。石斛内生细菌菌群组成和分布受其不同栽培方式和组织部位的影响,树干仿生栽培石斛内生细菌组成丰富度及多样性高于大棚种植,石斛根中的内生细菌组成丰富度及多样性高于石斛茎。本试验对铁皮石斛内生细菌菌群的分析研究,提供了丰富的内生细菌资源,为其后续次级活性代谢产物以及生物合成奠定研究基础。同时筛选得到8株具有抑制病原菌活性的菌株,表明铁皮石斛内生细菌代谢产物具有抗菌活性,以此为基础,可进一步有针对性地分离有效活性物质,开发具有抑菌防腐作用的微生物菌剂。
References
| [1] | Zeng SJ. Species introduction of Dendrobium officinale in China. Flowers, 2015(4): 19-26. (in Chinese) 曾宋君. 中国药用石斛种类介绍. 花卉, 2015(4): 19-26. DOI:10.3969/j.issn.1673-890X.2015.04.006 |
| [2] | Zhou CH, Xie ZS, Lei ZX, Huang YC, Wei G. Simultaneous identification and determination of flavonoids in Dendrobium officinale. Chemistry Central Journal, 2018, 12(1): 40. DOI:10.1186/s13065-018-0403-8 |
| [3] | (清)顾观光辑杨鹏举校注. 神农本草经. 第2版. 北京: 学苑出版社, 2002: 51. |
| [4] | 中国药典. 一部. 中国医药科技出版社, 2015. |
| [5] | Tang HX, Zhao TW, Sheng YJ, Zheng T, Fu LZ, Zhang YS. Dendrobium officinale kimura et migo: a review on its ethnopharmacology, phytochemistry, pharmacology, and industrialization. Evidence-Based Complementary and Alternative Medicine, 2017, 2017: 7436259. |
| [6] | Li ZJ, Wang YC, Han B, Yang YB, Wang Z, Sun ZY. Research progress on constituents of alkaloids in plants from Dendrobium Sw. Chinese Traditional and Herbal Drugs, 2019, 50(13): 3246-3254. (in Chinese) 李振坚, 王元成, 韩彬, 杨业波, 王振, 孙振元. 石斛属植物生物碱成分研究进展. 中草药, 2019, 50(13): 3246-3254. DOI:10.7501/j.issn.0253-2670.2019.13.034 |
| [7] | 中国药用铁皮石斛标准. 2014. |
| [8] | Zhang DD. Difference between wild Dendrobium and cultivated Dendrobium. Guangming Journal of Chinese Medicine, 2020, 35(2): 277-279. (in Chinese) 张丹丹. 浅谈野生石斛和种植石斛的区别. 光明中医, 2020, 35(2): 277-279. DOI:10.3969/j.issn.1003-8914.2020.02.052 |
| [9] | Chen QY, Chen DH, Shi Y, Si WS, Wu LS, Si JP. Occurrence regularity of Dendrobium catenatum southern blight disease. China Journal of Chinese Materia Medica, 2019, 44(9): 1789-1792. (in Chinese) 陈秋燕, 陈东红, 石艳, 斯王肃, 吴令上, 斯金平. 铁皮石斛白绢病发生规律研究. 中国中药杂志, 2019, 44(9): 1789-1792. |
| [10] | K?berl M, Schmidt R, Ramadan EM, Bauer R, Berg G. The microbiome of medicinal plants: diversity and importance for plant growth, quality and health. Frontiers in Microbiology, 2013, 4: 400. |
| [11] | 郑旭. 马铃薯内生菌的分离鉴定及抑龙葵碱功能研究. 中国农业科学院硕士学位论文, 2019. |
| [12] | Wang SS, Liu JM, Sun J, Sun YF, Liu JN, Jia N, Fan B, Dai XF. Diversity of culture-independent bacteria and antimicrobial activity of culturable endophytic bacteria isolated from different Dendrobium stems. Scientific Reports, 2019, 9: 10389. DOI:10.1038/s41598-019-46863-9 |
| [13] | Zhou SQ, Huang XL, Huang DY, Hu XW, Chen JL. A rapid method for extracting DNA from actinomycetes by chelex-100. Biotechnology Bulletin, 2010(2): 123-125. (in Chinese) 周双清, 黄小龙, 黄东益, 胡新文, 陈吉良. Chelex-100快速提取放线菌DNA作为PCR扩增模板. 生物技术通报, 2010(2): 123-125. |
| [14] | Vartoukian SR, Palmer RM, Wade WG. Strategies for culture of 'unculturable' bacteria. FEMS Microbiology Letters, 2010, 309(1): 1-7. |
| [15] | Compant S, Clément C, Sessitsch A. Plant growth-promoting bacteria in the rhizo- and endosphere of plants: Their role, colonization, mechanisms involved and prospects for utilization. Soil Biology and Biochemistry, 2010, 42(5): 669-678. DOI:10.1016/j.soilbio.2009.11.024 |
| [16] | Santoyo G, Moreno-Hagelsieb G, del Carmen Orozco-Mosqueda M, Glick BR. Plant growth-promoting bacterial endophytes. Microbiological Research, 2016, 183: 92-99. DOI:10.1016/j.micres.2015.11.008 |
| [17] | Afzal I, Shinwari ZK, Sikandar S, Shahzad S. Plant beneficial endophytic bacteria: Mechanisms, diversity, host range and genetic determinants. Microbiological Research, 2019, 221: 36-49. DOI:10.1016/j.micres.2019.02.001 |
| [18] | Pavlova AS, Leontieva MR, Smirnova TA, Kolomeitseva GL, Netrusov AI, Tsavkelova EA. Colonization strategy of the endophytic plant growth-promoting strains of Pseudomonas fluorescens and Klebsiella oxytoca on the seeds, seedlings and roots of the epiphytic orchid, Dendrobium nobile Lindl. Journal of Applied Microbiology, 2017, 123(1): 217-232. DOI:10.1111/jam.13481 |
| [19] | Wang MY, Tao X, Li KY, Wang YL, Yang TD, Xiong Z. Analysis of community structure of endophytic bacteria from Dendrobium officinale. Journal of West China Forestry Science, 2014, 43(5): 106-111. (in Chinese) 王明月, 陶茜, 李克艳, 王艳玲, 阳廷丹, 熊智. 铁皮石斛内生细菌群落结构分析. 西部林业科学, 2014, 43(5): 106-111. |
| [20] | Chen J, Chen ND, Zheng Q. Comparative study on the main constituents and scavenging DPPH free radicals of root, stem and leaf of four Dendrobium plants. Northern Horticulture, 2020(10): 128-133. (in Chinese) 陈静, 陈乃东, 郑诠. 四种石斛的根、茎、叶主要成分及其DPPH自由基清除能力对比. 北方园艺, 2020(10): 128-133. |
| [21] | Li HY, Huang QL, Dai Y, Sun Q. Comparison of contents of dendrobinein in Dendrobium nobile of Luzhou and Chishui. Journal of Chinese Medicinal Materials, 2016, 39(11): 2474-2478. (in Chinese) 李华云, 黄群莲, 代勇, 孙琴. 泸州、赤水两地金钗石斛中石斛碱含量比较. 中药材, 2016, 39(11): 2474-2478. |
| [22] | Li Q, Ding G, Li B, Guo SX. Transcriptome analysis of genes involved in dendrobine biosynthesis in Dendrobium nobile lindl. infected with mycorrhizal fungus MF23 (Mycena sp.). Scientific Reports, 2017, 7: 316. DOI:10.1038/s41598-017-00445-9 |
| [23] | 高阳. 金钗石斛内生菌多样性与石斛碱含量的相关性研究. 贵州师范大学硕士学位论文, 2017. |
| [24] | Xu LH, Zhou X, Zheng WR, Li TT, He ZF, Zhan FY, Bai LP, Wang JH. Comparison on polysaccharides, d-mannose and crude fiber content of Dendrobium officinale in different imitation wild cultivation. Journal of Zhejiang Agricultural Sciences, 2018, 59(7): 1253-1257. (in Chinese) 徐丽红, 周鑫, 郑蔚然, 黎天天, 何中方, 詹福云, 白丽萍, 王君虹. 不同仿野生栽培铁皮石斛多品质指标的比较. 浙江农业科学, 2018, 59(7): 1253-1257. |
| [25] | Yang Y, Luo ZQ, Huang AX, Wu SY, Ran JC. Gas chromatography test different ways of planting tin pattern Dendrobium candidum welcome alkali content and the analysis of volatile components. Molecular Plant Breeding, 2016, 14(7): 1835-1840. (in Chinese) 杨洋, 罗在柒, 黄安香, 吴仕艳, 冉景丞. 气相色谱检测不同种植方式铁皮石斛中石斛碱含量及挥发性成分分析. 分子植物育种, 2016, 14(7): 1835-1840. |
| [26] | Radhakrishnan R, Hashem A, Abd Allah EF. Bacillus: a biological tool for crop improvement through bio-molecular changes in adverse environments. Frontiers in Physiology, 2017, 8: 667. DOI:10.3389/fphys.2017.00667 |
| [27] | Lee SA, Park J, Chu B, Kim JM, Joa JH, Sang MK, Song J, Weon HY. Comparative analysis of bacterial diversity in the rhizosphere of tomato by culture-dependent and independent approaches. Journal of Microbiology, 2016, 54(12): 823-831. DOI:10.1007/s12275-016-6410-3 |
| [28] | Xing L, Zhao SG, Zheng N, Li SL, Wang JQ. Advance in isolation and culture techniques of uncultured microbes: a review. Microbiology China, 2017, 44(12): 3053-3066. (in Chinese) 邢磊, 赵圣国, 郑楠, 李松励, 王加启. 未培养微生物分离培养技术研究进展. 微生物学通报, 2017, 44(12): 3053-3066. |
| [29] | Liu Y, Han M, Wang WL, Ma CY, Zhang P. Application progress of high-throughput technology in microbial culture and comparative analysis of molecular sequencing. Journal of Anhui Agricultural Sciences, 2020, 48(15): 16-19. (in Chinese) 刘莹, 韩锰, 王文磊, 马成玉, 张沛. 高通量技术在微生物培养中的应用进展及分子测序对比分析. 安徽农业科学, 2020, 48(15): 16-19. DOI:10.3969/j.issn.0517-6611.2020.15.005 |
| [30] | Overmann J, Abt B, Sikorski J. Present and future of culturing bacteria. Annual Review of Microbiology, 2017, 71: 711-730. DOI:10.1146/annurev-micro-090816-093449 |
| [31] | Ko?pke B, Wilms R, Engelen B, Cypionka H, Sass H. Microbial diversity in coastal subsurface sediments: a cultivation approach using various electron acceptors and substrate gradients. Applied and Environmental Microbiology, 2005, 71(12): 7819-7830. DOI:10.1128/AEM.71.12.7819-7830.2005 |
| [32] | Ren J, Zhang X, Liang QY, Dong MM, Li L, Xiao W, He B. Effects of culture conditions on nitrogenase activity of endophytes A02, A08 from cassava and optimization of culture conditions. Southwest China Journal of Agricultural Sciences, 2019, 32(11): 2571-2578. (in Chinese) 任杰, 张晓, 梁琼月, 董蒙蒙, 李立, 肖未, 何冰. 不同培养条件对内生菌A02、A08固氮酶活力的影响及培养条件优化. 西南农业学报, 2019, 32(11): 2571-2578. |
| [33] | Wang SS, Liu JM, Sun J, Jia N, Fan B, Dai XF. Research progress on endophytes of medicinal Dendrobium. Food and Nutrition in China, 2020, 26(7): 35-40, 25. (in Chinese) 王珊珊, 刘佳萌, 孙晶, 贾宁, 范蓓, 戴小枫. 药用石斛内生菌的研究进展. 中国食物与营养, 2020, 26(7): 35-40, 25. DOI:10.3969/j.issn.1006-9577.2020.07.010 |
| [34] | Xu SE, Lu P, Jin LP, Wang YJ. Effects of Bacillus polymyxa on the control of bacterial leaf spot of Dendrobium officinale and its growth promotion. Journal of Zhejiang Agricultural Sciences, 2016, 57(12): 2033-2034. (in Chinese) 徐桑尔, 卢鹏, 金莉萍, 王勇军. 多粘类芽孢杆菌防治铁皮石斛细菌性叶斑病及促生效果. 浙江农业科学, 2016, 57(12): 2033-2034. |
| [35] | Raza W, Yuan J, Ling N, Huang QW, Shen QR. Production of volatile organic compounds by an antagonistic strain Paenibacillus polymyxa WR-2 in the presence of root exudates and organic fertilizer and their antifungal activity against Fusarium oxysporum f. sp. niveum. Biological Control, 2015, 80: 89-95. DOI:10.1016/j.biocontrol.2014.09.004 |
| [36] | Grady EN, MacDonald J, Liu LD, Richman A, Yuan ZC. Current knowledge and perspectives of Paenibacillus: a review. Microbial Cell Factories, 2016, 15: 203. DOI:10.1186/s12934-016-0603-7 |
