杨建社1, 王帅涛1, 牛艳婷1, 林金水1,2


1. 延安大学生命科学学院, 陕西 延安 716000;
2. 陕西省红枣重点实验室(延安大学), 陕西 延安 716000
收稿日期:2020-11-14;修回日期:2021-01-04;网络出版日期:2021-01-19
基金项目:国家自然科学基金(32070103,31860012,31700031);陕西省教育厅重点实验室科研计划(17JS138);陕西省自然科学基础研究计划(2021JM-415);陕西省“特支计划”区域发展人才项目;陕西省普通高等学校青年杰出人才支持计划
*通信作者:林金水, Tel: +86-911-2332030;E-mail: linjinshui@yau.edu.cn.
摘要:作为一种对抗真核细胞和原核细胞的强有力细菌武器,Ⅵ型分泌系统(type Ⅵ secretion system,T6SS)广泛存在于革兰氏阴性菌中。铜绿假单胞菌是一种对多种抗生素具有耐药性并能够在人体引发急性和慢性感染的条件致病菌,它编码3套独立的T6SS,分别为H1-、H2-和H3-T6SS。T6SS通过介导细菌间竞争、生物被膜的形成、金属离子的摄取以及与真核宿主细胞之间的相互作用,对铜绿假单胞菌在毒力和适应环境方面发挥重要作用。本文主要对铜绿假单胞菌T6SS的组装、效应蛋白的分泌、功能及调控机制展开综述,旨在为T6SS的研究提供一定的参考,并为铜绿假单胞菌感染的预防和治疗提供一定的指导。
关键词:铜绿假单胞菌T6SS组装分泌功能调控
Assembly, secretion, function, and regulation of T6SS in Pseudomonas aeruginosa
Jianshe Yang1, Shuaitao Wang1, Yanting Niu1, Jinshui Lin1,2


1. College of Life Sciences, Yan'an University, Yan'an 716000, Shaanxi Province, China;
2. Shaanxi Key Laboratory of Chinese Jujube(Yan'an University), Yan'an 716000, Shaanxi Province, China
Received: 14 November 2020; Revised: 4 January 2021; Published online: 19 January 2021
*Corresponding author: Lin Jinshui, Tel: +86-911-2332030;E-mail: linjinshui@yau.edu.cn.
Foundation item: Supported by the National Natural Science Foundation of China (32070103, 31860012, 31700031), by the Scientific Research Program Funded by the Shaanxi Provincial Education Department (17JS138), by the Natural Science Basic Research Plan in Shaanxi Province of China (2021JM-415), by the Regional Development Talent Project of "Special Support Plan" of Shaanxi Province and by the Outstanding Young Talent Support Plan of the Higher Education Institutions of Shaanxi Province
Abstract: The type Ⅵ secretion system (T6SS) is a versatile bacterial weapon, which is widespread in Gram-negative bacteria and used to act against both eukaryotic and prokaryotic cells. Pseudomonas aeruginosa is an opportunistic pathogen that is resistant to a variety of antibiotics and can cause acute and chronic infections in humans. P. aeruginosa encodes three separate T6SSs, namely H1-, H2-, and H3-T6SS, which play key roles in virulence and environmental adaptation by mediating inter-bacterial competition, biofilm formation, metal uptake, and interaction with eukaryotic host cells. This article reviews the latest progress in assembly, secretion, function, and regulation mechanisms of T6SS in P. aeruginosa, aiming to provide reference for the study of T6SS and provide guidance for the prevention and treatment of P. aeruginosa infection.
Keywords: Pseudomonas aeruginosaT6SSassemblysecretionfunctionregulation
铜绿假单胞菌(Pseudomonas aeruginosa)又名绿脓杆菌,属于非发酵革兰氏阴性细菌,因其具有极强的环境适应能力而广泛分布于各种环境中,如空气、水、土壤、植物、哺乳动物的皮肤、粘膜道等[1–3]。铜绿假单胞菌作为一种常见的条件致病菌,常引起泌尿系统感染、囊性纤维化病、肺炎、烧伤感染和烫伤感染等疾病[2, 4]。临床中,铜绿假单胞菌可造成急性和慢性感染,其中慢性感染与生物被膜的形成、运动性降低以及Ⅵ型分泌系统(type Ⅵ secretion system,T6SS)的表达紧密联系[5]。T6SS是铜绿假单胞菌重要的分子武器,因其参与铜绿假单胞菌的多种生命活动而引起广泛关注。
铜绿假单胞菌中的T6SS最初由Mougous等在PAO1菌株中发现,同时该研究初次提出了铜绿假单胞菌T6SS的结构模型[6]。之后的十几年,铜绿假单胞菌成为国内外研究T6SS的重要模式生物之一。铜绿假单胞菌编码3套独立的T6SS,分别为H1-、H2-和H3-T6SS,它们可以将效应蛋白直接注入靶细胞,从而行使其特定的生物学功能[6–8]。铜绿假单胞菌T6SS既可作用于原核细胞,也可作用于真核细胞。作用于原核细胞时,铜绿假单胞菌T6SS主要通过破坏靶细胞的细胞结构、水解核酸和影响代谢过程等途径抑制或者杀死靶细胞,使铜绿假单胞菌在细菌间的竞争中处于有利地位[9–12];作用于真核细胞时,由T6SS分泌的效应蛋白可促进铜绿假单胞菌在靶细胞中的内化、干扰靶细胞内质网的功能等[10, 13–15]。此外,一些由T6SS分泌的效应蛋白可帮助铜绿假单胞菌从环境中摄取一些重要的金属离子,如铁离子、铜离子等,如图 1所示[16–18]。T6SS是铜绿假单胞菌重要的分子武器,因其参与铜绿假单胞菌的多种生命活动而引起广泛关注。本文对铜绿假单胞菌T6SS的组装、分泌、功能及调控机制等进行综述,以期对T6SS的研究提供一定的参考并为铜绿假单胞菌感染的预防和治疗提供一定的指导。
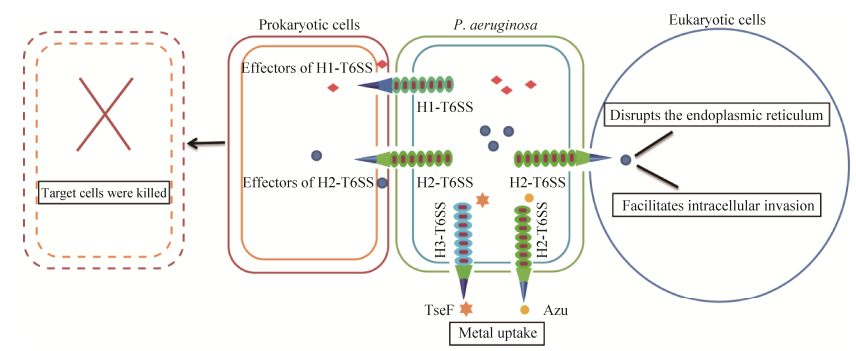 |
| 图 1 铜绿假单胞菌T6SS具有多种功能 Figure 1 Multifunctionality of T6SS in P. aeruginosa. |
| 图选项 |
1 铜绿假单胞菌T6SS的组装 作为一种直接接触式的细菌武器,T6SS广泛存在于如铜绿假单胞菌、溶藻弧菌、霍乱弧菌和不动杆菌等革兰氏阴性菌中[19–21]。铜绿假单胞菌T6SS的结构包括:横跨细胞内膜(inner membrane,IM)和外膜(outer membrane,OM)的跨膜复合体(membrane complex TssLMJ,MC)、与细胞内膜结合的基座复合体(baseplate TssEFGK,BP)、由Hcp内管和TssBC (又名VipAB)鞘组成的管状结构、位于管状结构顶端的VgrG-PAAR尖峰复合体(VgrG-PAAR spike complex)等几部分[22–28]。如图 2所示,T6SS未被激活时,TagA通过与MC-BP结合来抑制T6SS的组装起始[29]。而T6SS一旦被激活时,TssA (TagA的拮抗蛋白)通过与TagA的结合从而消除TagA对T6SS组装的抑制作用,T6SS开始组装[29]。Hcp蛋白与TssB、TssC鞘被招募到基座复合体上,形成管状结构并开始延伸,当延伸的管状结构遇到位于另一侧内膜的TagA蛋白时,其延伸则被终止[29]。随后,TssBC通过一种未知的机制收缩,将Hcp管以及携带效应蛋白的VgrG-PAAR尖峰复合体推向靶细胞内,从而行使T6SS的分泌功能[30]。完成效应蛋白的分泌后,ClpV依赖TagJ结合到收缩的TssBC鞘上,并通过水解ATP的方式将TssBC收缩鞘分解成TssB、TssC单体,以便被用于另一个T6SS的组装[28]。其他用于T6SS组装的蛋白如Hcp、TagJ以及ClpV等被水解,而基座复合体、跨膜复合体以及TagA继续保留,以便下次组装[25, 29, 31]。
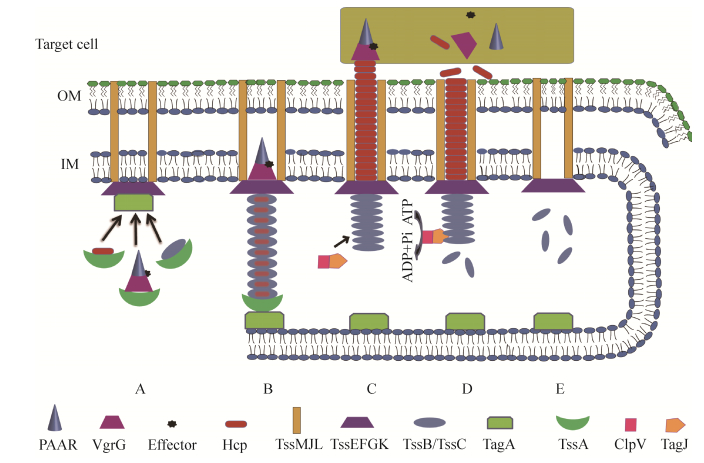 |
| 图 2 铜绿假单胞菌T6SS的组装及分泌示意图 Figure 2 Schematic representation of assembly and secretion of T6SS in P. aeruginosa. A: TagA inhibits initiation of T6SS by binding to the baseplate TssEFGK; B: TssA facilitates polymerization of T6SS and its role is antagonized by its interacting partner TagA; C: T6SS assembles completely, TssBC sheath contracts and propels the inner tube towards the target cell; D: ClpV mediates TssBC contraction sheath depolymerization by hydrolyzing ATP; E: the secretion of T6SS completely. OM: outer membrane; IM: inner membrane. |
| 图选项 |
2 铜绿假单胞菌T6SS的分泌机制 铜绿假单胞菌T6SS的生物学功能主要是由其分泌的蛋白功能决定的,其分泌蛋白主要由发挥生物学活性的效应蛋白以及分泌性结构蛋白(如PAAR、VgrG、Hcp)组成[28]。其中效应蛋白根据其结构可分为两大类。第一类为带有延伸功能域的分泌性结构蛋白[28]。这些分泌性结构蛋白既作为铜绿假单胞菌T6SS的重要组成部分,又与延伸功能域融合表达,一同分泌到靶细胞而发挥特异的生物学效应[28]。例如,VgrG2b是铜绿假单胞菌H2-T6SS的分泌性结构蛋白,在C端有一个能抑制靶细胞正常分裂的延伸功能域,它使VgrG2b具有抑制靶细胞正常生长的能力[32]。Tse7是由铜绿假单胞菌编码的一种核酸酶,其细胞毒性结构域位于C端,而N端是PAAR结构域,这种毒性结构域与PAAR结构域的融合表达使Tse7与VgrG1b结合,从而通过H1-T6SS分泌[12]。具有C端延伸功能域的Hcp蛋白已被报道广泛存在于肠杆菌科细菌中,然而在铜绿假单胞菌中尚未发现此类效应蛋白[33–34]。
第二类是非结构性分泌蛋白,又被称为专属效应蛋白(dedicated effector)[28]。专属效应蛋白主要以非共价的方式锚定在Hcp、VgrG和PAAR等分泌性结构蛋白上而随之一起分泌[13, 35],或通过接头蛋白介导而锚定在分泌性结构蛋白上并随之一起分泌[36–38]。(1) 与Hcp蛋白非共价结合:2010年,铜绿假单胞菌T6SS首次被提出具有抗菌功能,该研究也发现了3个H1-T6SS效应蛋白(Tse1、Tse2和Tse3)[39]。后续研究表明,这3个效应蛋白都依赖于与Hcp1蛋白的非共价结合而随Hcp1一起分泌[28, 40]。与Hcp非共价结合而分泌的效应蛋白往往位于Hcp六聚体管的管腔内,而Hcp管的内径为40 nm,因此,依赖Hcp蛋白分泌的效应蛋白的分子量通常在20 kDa以下[33]。(2) 与VgrG或PAAR蛋白非共价结合:与Hcp不同,依赖VgrG或PAAR蛋白分泌的效应蛋白常与VgrG或PAAR蛋白的外侧以非共价的方式结合[33]。铜绿假单胞菌T6SS共编码10个VgrG蛋白,虽然它们的蛋白结构各有不同,但它们都有一个独特的TTR样结构域,该结构域能特异地与其运载的效应蛋白结合[13, 28, 32, 41]。例如,AmpDH3与VgrG2b的TTR样结构域以非共价的方式结合而随VgrG2b分泌[41];PldA和PldB分别与VgrG4b和VgrG5特异性结合并随之分泌[13]。(3) 通过接头蛋白介导与分泌性结构蛋白结合:有些专属效应蛋白并不能与PAAR、Hcp、VgrG等分泌性结构蛋白非共价结合,因为它们的分泌需要特定的接头蛋白介导[42]。目前在铜绿假单胞菌T6SS中发现了3个接头蛋白,分别为TecT (含DUF4123结构域)[43]、Tla3 (含DUF2875结构域)[38]和EagT6 (含DUF1795结构域)[44],如表 1所示。其中,TecT是最早被发现的,研究表明,T6SS效应蛋白TseT的分泌依赖于PAAR4以及接头蛋白TecT,而TecT在分泌过程中主要起到稳定TseT的作用[43]。与TecT不同的是,含有DUF2875结构域的伴侣Tla3则起接头蛋白的作用,通过同时与效应蛋白Tle3和分泌性结构蛋白VgrG2b的互作,帮助Tle3间接地锚定到VgrG2b上,从而使Tle3随VgrG2b一起分泌[44]。此外,铜绿假单胞菌中DUF1795超家族蛋白EagT6可以帮助H1-T6SS效应蛋白Tse6的稳定及分泌。这是由于EagT6同源二聚体含有非极性残基形成的疏水腔,该疏水腔将Tse6的疏水跨膜结构域(TMD)与细胞质的亲水环境隔绝,以防止Tse6的聚集和降解而起分子伴侣的作用。同时,由于EagT6还与VgrG1互作,EagT6与TMD的结合将Tse6招募到VgrG1上,从而使Tse6随VgrG1一起分泌[38]。
表 1. 铜绿假单胞菌PAO1 T6SS效应因子的接头蛋白 Table 1. Adaptor proteins of T6SS effectors in P. aeruginos PAO1
| Domain of unknown function (DUF) | Adaptor protein (PA number) | Effector (PA number) | Activity | References |
| DUF4123 | TecT (PA3905) | TseT (PA3907) | Nuclease | [43] |
| DUF1795 | EagT6 (PA0094) | Tse6 (PA0093) | NAD(P)+ glycohydrolase | [11, 38] |
| DUF2875 | Tla3 (PA0259) | Tle3 (PA0260) | Phospholipase | [44] |
表选项
综上所述,铜绿假单胞菌T6SS通过多种途径对其效应蛋白进行识别和分泌。其中,接头蛋白的发现为专属效应蛋白的分泌提供了一种新途径。但值得注意的是,目前发现的接头蛋白并不随其效应蛋白一起分泌到胞外,那么在分泌的过程中,接头蛋白是通过何种机制与效应蛋白分开的仍然是一个有待解决的问题。
3 铜绿假单胞菌T6SS的功能 铜绿假单胞菌T6SS因其功能的多样性,近年引起广泛关注。其功能主要有:(1) 与生物被膜的形成以及耐药性相关[45];(2) 抗原核细胞作用[11–12];(3) 抗真核细胞作用[14];(4) 介导金属离子的摄取[16–17]。铜绿假单胞菌T6SS功能主要由其分泌的特定效应蛋白所介导,因此,鉴定效应蛋白的功能是解析铜绿假单胞菌T6SS生物学功能的关键。
3.1 生物被膜的形成与耐药性 自然界中细菌通常以两种不同形式存在,即浮游生长和形成生物被膜[45]。生物被膜是由生物被膜基质和包裹于其中的细菌构成的微生态系统,它是细菌的一种群体生活状态[45]。在临床上,能形成生物被膜的铜绿假单胞菌“隐藏”在生物被膜中而逃过抗生素和免疫系统的杀灭作用。因此,生物被膜形成是铜绿假单胞菌对抗生素产生耐药性,导致慢性感染的主要原因之一,囊性纤维化患者肺部感染、慢性支气管炎和支气管扩张等均为常见的生物被膜相关性疾病[45]。研究表明,铜绿假单胞菌T6SS的表达和活性与生物被膜的形成存在一定联系[45–46]。
我们课题组研究发现,相比野生菌,icmF3 (铜绿假单胞菌H3-T6SS的结构基因)缺失突变株形成生物被膜的能力显著增强,推测IcmF3可能对铜绿假单胞菌生物被膜形成的信号通路有调节作用;此外,我们还发现icmF3缺失突变增强了铜绿假单胞菌对妥布霉素和庆大霉素等氨基糖苷类抗生素的抗性,而这可能与其生物被膜的形成能力增强有关[18]。然而,铜绿假单胞菌H3-T6SS的另一个结构基因clpV3缺失突变后却显示出与icmF3缺失突变株相反的生物被膜表型,clpV3缺失突变使铜绿假单胞菌生物被膜的形成能力明显减弱[47]。tssC1是铜绿假单胞菌H1-T6SS的结构基因,有研究发现tssC1基因在生物被膜细菌中的表达量是在浮游细菌中的18倍,且妥布霉素、庆大霉素和环丙沙星对铜绿假单胞菌PA14的最低杀菌浓度比tssC1缺失突变株的最低杀菌浓度高2–4倍,表明TssC1能增强铜绿假单胞菌生物被膜对抗生素的耐受性[48]。Hcp蛋白通常被认为是T6SS激活的标志,生物被膜中铜绿假单胞菌的hcp1、hcp2和hcp3的表达量均显著高于浮游生长的细胞[45]。这些结果表明T6SS与铜绿假单胞菌生物被膜的形成相关联。同时,不同的T6SS结构基因对铜绿假单胞菌生物被膜的形成似乎具有不同的调控作用。
3.2 抗原核细胞作用 铜绿假单胞菌与其他细菌生存在同一环境中时,往往能够取得生长竞争优势,主要原因是铜绿假单胞菌通过T6SS分泌一些能够抑制竞争菌生长甚至将其杀死的毒性蛋白[8, 41, 49]。而编码这些毒性蛋白的基因附近往往存在编码同源免疫蛋白的基因,它们共表达形成同源免疫对,以防止铜绿假单胞菌自身受到毒性蛋白的伤害[50–51]。铜绿假单胞菌T6SS分泌的可作用于原核细胞的毒性蛋白,根据作用部位及功能可分为细胞壁靶向酶[52]、细胞膜靶向酶[53]、抑制靶细胞蛋白质合成[54]、核酸酶[12]、影响细胞代谢过程以及作用机制未知的毒性蛋白[11, 55],如表 2所示。
表 2. 铜绿假单胞菌T6SS效应蛋白 Table 2. Effectors of T6SS in P. aeruginosa
| Effector proteins (PA number) | Activity/Functions | Immunity proteins (PA number) | T6SS-dependent | References | ||
| Anti-prokaryotic effectors | Tse1 (PA1844) | Amidase | Tsi1 (PA1845) | H1-T6SS | [58] | |
| Tse3 (PA3484) | Muramidase | Tsi3 (PA3485) | H1-T6SS | [58] | ||
| AmpDh3 (PA0807) | Amidase | PA0808 | H2-T6SS | [41] | ||
| VgrG2bC-ter (PA0262) | Metallopeptidase | PA0261 | H2-T6SS | [32] | ||
| Tle1 (PA3290) | Phospholipase | Tli1 (PA3291) | H2-T6SS | [60] | ||
| Tle3 (PA0260) | Phospholipase | Tli3 (PA0259) | H2-T6SS | [44] | ||
| Tle4 (PA1510) | Phospholipase | Tli4 (PA1509) | H2-T6SS | [75] | ||
| Tle5a/PldA (PA3487) | Phospholipase | Tli5a (PA3488) | H2-T6SS | [53] | ||
| Tle5b/PldB (PA5089) | Phospholipase | Tli5b1-Tli5b3 (PA5086-PA5088) | H2-T6SS | [13, 51] | ||
| Tse4 (PA2774) | Disrupts the proton motive force | Tsi4 (PA2775) | H1-T6SS | [62, 66] | ||
| Tse8 (PA4163) | Limiting the ability to synthesize proteins | Tsi4 (PA4164) | H1-T6SS | [54] | ||
| Tse7 (PA0099) | Nuclease | Tsi7 (PA0100) | H1-T6SS | [12] | ||
| TseT (PA3907) | Nuclease | TsiT (PA3908) | H2-T6SS | [43] | ||
| Tse6 (PA0093) | NAD(P)+ Glycohydrolase | Tsi6 (PA0092) | H1-T6SS | [11] | ||
| Tas1 (PA14_01140) | (p)ppApp synthetase | Tis1 (PA14_01130) | H1-T6SS | [55] | ||
| Tse2 (PA2702) | ADP-ribosyltransferase | Tsi2 (PA2703) | H1-T6SS | [9, 64] | ||
| Tse5 (PA2684) | ND | Tsi5 (PA2684.1) | H1-T6SS | [66–67] | ||
| Anti- eukaryotic effectors | VgrG2b (PA0262) | Interacts with γ-tubulin | – | H2-T6SS | [15] | |
| Tle5a/PldA (PA3487) | Phospholipase | – | H2-T6SS | [69–70] | ||
| Tle5b/PldB (PA5089) | Phospholipase | – | H2-T6SS | [14, 69] | ||
| Tle4/TplE (PA1510) | Disrupts the endoplasmic reticulum | – | H2-T6SS | [10] | ||
| Metal uptake | TseF (PA2374) | PQS-Fe3+-binding protein | – | H3-T6SS | [16] | |
| Azu (PA4922) | Cu2+-binding protein | – | H2-T6SS | [17] | ||
| ND: not determined; –: not applicable. | ||||||
表选项
3.2.1 细胞壁靶向酶: 细菌细胞壁有维持细菌细胞形态、抵御外源裂解酶侵害以及抵抗细菌内部渗透压等功能[56]。因此,细菌细胞壁一旦受到破坏,细菌将不能正常生长甚至死亡。当铜绿假单胞菌与其他细菌处于竞争关系时,它可分泌3个靶向细胞壁的毒性蛋白,分别为Tse1、Tse3和AmpDh3,它们分别作用于细胞壁肽聚糖的不同位点而对靶细胞的细胞壁造成破坏[41, 57–58]。肽聚糖是大多数细菌细胞壁的重要结构成分,它主要由通过β(1-4)糖苷键连接的N-乙酰葡糖胺和N-乙酰胞壁酸的重复二糖单元形成的糖链组成[59]。在大多数革兰氏阴性菌中,该二糖单元与一个氨基酸顺序为l-Ala-d-Glu-m-Dap-d-Ala-d-Ala的短肽连接,聚合并交联形成包裹细胞的网状结构[56, 59]。尽管Tse1、Tse3和AmpDh3都作用于靶细胞的细胞壁,但其作用位点却有所不同[56]。其中,由铜绿假单胞菌H1-T6SS分泌的毒性蛋白Tse1和Tse3分别具有肽聚糖酰胺酶和肽聚糖水解酶活性,且Tse1作用于肽聚糖上短肽第2位d-Glu和第3位m-Dap之间的酰胺键,而Tse3作用于肽聚糖多糖链上的β(1-4)糖苷键,从而破坏细胞壁的多糖骨架[41, 56]。AmpDh3是最近发现的由铜绿假单胞菌H2-T6SS分泌的细胞壁酰胺酶,它作用于二糖单元与短肽之间的酰胺键而水解靶细胞的细胞壁肽聚糖,使靶细胞的细胞壁破坏,从而达到杀菌目的[41]。
3.2.2 细胞膜靶向酶: 铜绿假单胞菌T6SS编码的毒性蛋白中,作用于靶细胞细胞膜的主要是磷脂酶家族的一些蛋白,如Tle家族蛋白。研究表明,由H2-T6SS分泌的Tle1、Tle3、Tle4 (又名TplE)、Tle5a (又名PldA)和Tle5b (又名PldB)等,均通过破坏靶细胞的细胞膜发挥其生物学功能[13, 44, 53, 58, 60]。值得一提的是,Tle5a和Tle5b既可靶向真核细胞,也可靶向原核细胞[13, 53]。除了上述5种磷脂酶外,铜绿假单胞菌T6SS还可分泌两个作用于靶细胞细胞膜的效应蛋白,即VgrG2b的C端延伸结构域(VgrG2bC-ter)和Tse4。VgrG2b是H2-T6SS的重要结构组分,根据功能的不同,将VgrG2b分为N-端区域和C-端区域,其中N-端区域由DUF2345、gp27样结构域和gp5样结构域组成;而其C-端区域被鉴定为锌金属肽酶家族的一员,VgrG2bC-ter通过改变靶细胞细胞膜的形态来影响靶细胞的正常分裂,从而达到抑菌目的[32]。而Tse4是铜绿假单胞菌的内膜蛋白,它含有由高含量的亮氨酸组成的亮氨酸拉链结构,该结构常出现在一些诱导细胞膜形成孔的蛋白中[61]。研究发现,tse4缺失突变株的细胞膜外钾离子(K+)浓度明显高于野生铜绿假单胞菌,此外该突变株的电位差也显著低于野生铜绿假单胞菌,这些结果表明Tse4使靶细胞的细胞膜穿孔,导致K+外排,使细胞膜两侧电位差降低,从而发挥毒性作用[62]。
3.2.3 抑制靶细胞蛋白质合成: Tse8是在铜绿假单胞菌T6SS中发现的第一个通过抑制靶细胞蛋白质的合成来发挥毒性作用的效应蛋白[54]。它经H1-T6SS分泌至靶细胞并与靶细胞的GatCAB转胺复合体相互作用,GatCAB转胺复合体是缺乏天冬酰胺和/或谷氨酰胺tRNA合成酶的细菌合成蛋白质所必需的复合体[54]。研究表明,Tse8与GatB和GatC相互作用,但不与GatA相互作用,且Tse8与GatA的蛋白结构高度相似。因此,Tse8可能取代了GatA在GatCAB转胺复合体中的位置,与GatCB形成异源三聚体,从而使靶细胞蛋白质的合成受到抑制[54]。
3.2.4 核酸酶: 目前在铜绿假单胞菌T6SS中共发现2个核酸酶Tse7和TseT。Tse7是一种含Tox-GHH2结构域的核酸酶,其细胞毒性结构域位于C端,而N端为PAAR结构域[12]。Tse7与VgrG1b相互作用而形成PAAR-Tse7-VgrG1b复合物,从而使Tse7依赖H1-T6SS被运送到靶细胞,Tse7在靶细胞可诱导SOS反应和导致靶细胞DNA降解,最终使其生长停滞[12]。而TseT是含有TOX-REase-5结构域的限制性核酸内切酶超家族蛋白,它经H2-T6SS分泌至靶细胞,通过水解靶细胞DNA而对其发挥毒性作用[43, 63]。
3.2.5 影响细胞代谢: 目前,在铜绿假单胞菌T6SS中发现的影响靶细胞代谢的毒性蛋白有3个,分别为Tse2、Tse6和Tas1。其中,由铜绿假单胞菌H1-T6SS分泌的效应蛋白Tse2在细胞质中发生作用,可有效抑制靶细胞的增殖[9]。通过DALI结构相似性搜索,将Tse2的蛋白结构与数据库中的蛋白结构进行比对发现,与Tse2结构最为相似的蛋白是ADP-核糖基转移酶,ADP-核糖基转移酶将NAD+的ADP核糖部分转移到靶蛋白上,导致靶蛋白活性丧失,从而使靶细胞的生理代谢紊乱,导致生长停滞。因此,Tse2可能通过发挥ADP-核糖基转移酶的活性来行使其生物学功能[64–65]。NAD+和NADP+是细胞代谢过程中极为重要的两种辅酶,它们在三羧酸循环、糖酵解和呼吸链等代谢过程中发挥着不可替代的作用。最近有研究发现由铜绿假单胞菌H1-T6SS分泌的一个毒性蛋白可以水解靶细胞内的NAD+和NADP+,导致靶细胞胞内代谢紊乱。经鉴定,该蛋白属于NAD(P)+糖苷酶,并将其命名为Tse6[11, 38]。Tas1是铜绿假单胞菌中第一个生理作用被阐明的(p)ppApp合成酶,它由铜绿假单胞菌PA14编码,经H1-T6SS被分泌到靶细胞并介导靶细胞的ATP水解,生成(p)ppApp和AMP,引起胞内(p)ppApp快速积累以及重要代谢途径的失调,从而实现杀菌目的[55]。
3.2.6 作用机制未知的毒性蛋白: Tse5 (又名RhsP1)是由铜绿假单胞菌H1-T6SS分泌的毒性蛋白,但其毒性机制尚不清楚[8, 66]。Tse5是Rhs家族蛋白,含有RHS/YD重复序列[67]。毒性分析显示Tse5在大肠杆菌的周质空间表达时,使大肠杆菌不能正常生长,而在细胞质表达时,并无此表型,这表明Tse5在靶细胞的周质空间发挥毒性作用[66]。Rhs家族蛋白在革兰氏阴性菌中广泛分布,如致病性气单胞菌的T6SS效应蛋白TseI,该蛋白上有两个自剪切位点[68],使TseI表达时能够自剪切为3个片段:与VgrG相互作用的Rhs N末端片段(VgrG-interacting Rhs N terminus,VIRN)、Rhs核心片段以及与VgrG相互作用的Rhs C末端片段(VgrG-interacting Rhs C-ter-minus,VIRC)[68]。其中,VIRC编码一种能降解DNA的核酸内切酶,是TseI的毒性结构域,而VIRN和Rhs核心片段则是促进VIRC功能的分泌型分子伴侣,它们通过与VgrG1结合的方式分泌而行使其生物学功能[68]。作为TseI的同源蛋白,铜绿假单胞菌Tse5的毒性结构域也位于C端,与TseI类似,Tse5表达时其C端也会被自剪切下来[67-68]。因此,Tse5的分泌方式与作用机制可能与TseI类似。虽然现已明确Tse5是依赖于铜绿假单胞菌H1-T6SS的毒性效应蛋白,但其毒性作用机制还有待进一步研究[67–68]。
综上所述,铜绿假单胞菌T6SS通过分泌功能多样的毒性蛋白杀死或抑制其他细菌的正常生长,使铜绿假单胞菌在菌间竞争中获得优势。
3.3 抗真核细胞作用 细菌内化入宿主细胞是细菌自身求生的一种生物学行为,该行为使细菌成功逃避宿主的免疫攻击。铜绿假单胞菌可内化入宿主的非吞噬细胞,如上皮细胞和内皮细胞等,从而引发一系列如败血症、肺炎、伤口和皮肤感染等疾病[15]。研究表明,铜绿假单胞菌T6SS编码的一些效应蛋白,既可作为毒性蛋白参与铜绿假单胞菌与其他细菌的生长竞争,又可作用于真核细胞,促进铜绿假单胞菌的内化[14]。这种既有抗原核细胞作用,又有抗真核细胞作用的效应蛋白被称为跨界效应蛋白[69]。目前在铜绿假单胞菌T6SS中发现的跨界效应蛋白(transkingdom effector)共有4个,分别为Tle5a、Tle5b、VgrG2b和Tle4[10, 14–15]。
Tle5a和Tle5b是由铜绿假单胞菌H2-T6SS编码的两种磷脂酶,它们作用于原核细胞时,通过破坏靶细胞的细胞膜发挥作用[13, 53];而作用于真核细胞时,Tle5a和Tle5b可以激活PI3K/Akt信号通路,导致肌动蛋白重排和细胞膜突起形成,从而促进铜绿假单胞菌内化入宿主上皮细胞[70]。Sana等研究表明,由铜绿假单胞菌PAO1编码的VgrG2b依赖H2-T6SS被转位至上皮细胞并与γ微管蛋白复合物(γ-tubulin ring complex,γTuRC)相互作用,这种相互作用促进了铜绿假单胞菌微管依赖性的宿主细胞内化作用[15]。内质网是真核细胞中重要的细胞器,它在蛋白质的合成、折叠以及分泌等过程中发挥重要作用,而内质网内环境的稳定是其行使生物学功能的基本条件,如果内质网的稳态遭到干扰并在短期内得不到恢复,则会引起自噬反应,最终导致细胞死亡[10]。Tle4是铜绿假单胞菌编码的磷脂酶家族蛋白,它依赖H2-T6SS被转位至上皮细胞,使内质网接头蛋白Bip和CHOP的表达增加,从而激活了未折叠蛋白响应(unfolded protein response,UPR),使宿主上皮细胞内质网的内环境紊乱,最终导致上皮细胞的自噬[10]。综上所述,由T6SS分泌的效应蛋白是介导铜绿假单胞菌对宿主侵染和在宿主定殖的关键因素。
3.4 金属离子的摄取 铁离子、铜离子等过渡金属离子通常被称为生命金属,在生物体内参与调节细胞渗透压,作为辅因子调节蛋白酶活性等,是生物体正常生长所必需的[16, 71]。铜绿假单胞菌利用多种铁摄取的方式以适应铁匮乏的环境,比如ABC亚铁离子转运装置(又名Feo运输装置);此外,在限铁环境中,铜绿假单胞菌产生两种铁载体,分别为脓青素(pyoverdine)和螯铁蛋白(pyochelin),它们螯合细胞外的Fe3+并与细胞的外膜受体特异结合,然后经过内膜转运系统将携带Fe3+的铁载体运输至细胞质内[72]。我们课题组最近研究发现T6SS参与了铜绿假单胞菌的Fe3+摄取过程,并揭示了铜绿假单胞菌这一新的Fe3+摄取途径的机制:铜绿假单胞菌H3-T6SS分泌的效应蛋白TseF可以结合自身分泌的铁螯合剂2-庚基-3-羟基-4(1H)-喹诺酮(Pseudomonas quinolone signal,PQS),并通过与PQS-Fe3+结合而随同PQS-Fe3+一起定位在外膜囊泡(outer membrane vesicles,OMVs)上,然后通过外膜囊泡将TseF-PQS-Fe3+复合物运输到铜绿假单胞菌表面,进一步通过外膜受体FptA或OprF进入胞内,从而完成细胞对胞外Fe3+的摄取[16]。
icmF3是H3-T6SS的重要结构基因,icmF3的缺失明显促进了铜绿假单胞菌在限铁培养条件下的生长,这暗示icmF3突变可能增强了铜绿假单胞菌铁载体的合成。令人意外的是,在限铁生长条件下icmF3基因突变反而显著降低了铜绿假单胞菌pyoverdine的合成,而对pyochelin的产生却没有明显的影响,这些结果表明缺失icmF3基因增强铜绿假单胞菌在限铁条件下的生长表型与铁载体pyoverdine和pyochelin的合成无关[18]。我们进一步分析显示当icmF3缺失突变株培养在补铁的LB培养基中细胞内会积累更多的铁而使菌落变成深褐色,这暗示icmF3缺失突变导致细胞储存更多的铁[18]。另有研究显示当铜绿假单胞菌在富铁培养基中培养时细胞膜呈现粉红色,这是由于储存在细胞膜上的PQS螯合Fe3+形成的[71, 73–74]。而我们进一步的研究结果显示在富铁培养条件下,H3-T6SS抑制铜绿假单胞菌PQS的合成(数据未发表)。因此,icmF3突变株在富铁培养条件下积累的铁可能就是PQS-Fe3+。当外界铁供运受限的时候,icmF3缺失突变株内储存的这些铁将是细胞生长重要的铁源,从而导致其在限铁条件下的生长明显增强[18]。Cu2+是铜绿假单胞菌体内的另一重要的金属离子。最近研究显示,由H2-T6SS分泌的Cu2+结合蛋白Azu是铜绿假单胞菌摄取外界Cu2+所必需的蛋白之一[17]。当铜绿假单胞菌处于低Cu2+浓度的环境时,由H2-T6SS将Azu分泌到胞外螯合Cu2+形成Azu-Cu2+复合体,该复合体与细胞外膜蛋白OprC直接相互作用而将Cu2+传递至胞内;相反,当铜绿假单胞菌处于高Cu2+浓度的环境时,Azu的分泌受到抑制,从而抑制乃至阻断铜绿假单胞菌对外界Cu2+的摄取[17]。综上所述,T6SS在铜绿假单胞菌金属离子摄取的过程中发挥重要作用。
4 铜绿假单胞菌T6SS的调控 铜绿假单胞菌T6SS的表达在转录、翻译和翻译后水平上都受到严格调控,主要包括RsmA与AmrZ的调控[76]、RetS/Gac系统的调控[77]、PpkA和PppA[78]的调控、RpoN的调控[79]、群体感应的调控以及金属离子摄取相关调节蛋白(CueR和Fur)的调控[17, 80],如图 3所示。
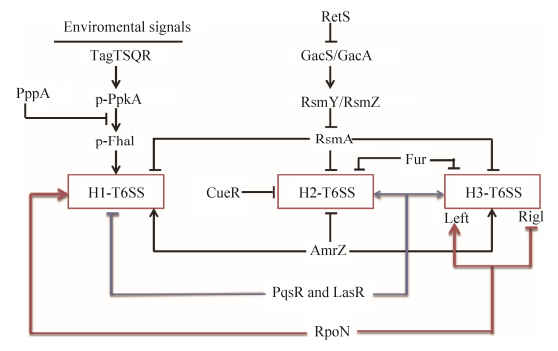 |
图 3 铜绿假单胞菌T6SS的调控示意图 Figure 3 Schematic representation of regulation of T6SS in P. aeruginosa.   |
| 图选项 |
4.1 Rsm系统的调控 铜绿假单胞菌的Rsm系统由2个RNA结合蛋白(RsmA和RsmF)和至少4个非编码小分子RNA (RsmV、RsmW、RsmY和RsmZ)组成[5]。其中,RsmA和RsmF通过特异性地识别并结合位于靶标mRNA 5′前导序列中保守的GGA序列,从而阻断其核糖体结合位点(ribosome binding site,RBS)与30S核糖体亚基的相互作用,进而阻止了靶标mRNA的翻译起始,最终抑制靶蛋白的合成[5, 81]。而RsmV、RsmW、RsmY和RsmZ等小分子RNA含有多个GGA序列,可直接与RsmA结合。因此,这4种小分子RNA可通过与靶标mRNA竞争RsmA和RsmF的结合来抑制RsmA和RsmF的活性[5, 76]。
在铜绿假单胞菌基因组的5570个开放阅读框中,大约有10%的基因表达受到Rsm系统的调控,一些与T6SS相关的基因也包含其中[5, 82]。比如,将铜绿假单胞菌PA14的rsmA基因缺失后,hcp1、hcp2、hcp3的表达量显著上升,这表明RsmA对铜绿假单胞菌的3套T6SS都有负调控作用[81]。此外,RsmV可通过抑制RsmA和RsmF蛋白的活性来激活tssA1 (铜绿假单胞菌H1-T6SS结构基因)的翻译[5]。有趣的是,与野生PAO1相比,clpV3突变虽然使H2-和H3-T6SS的表达显著降低,但H1-T6SS的表达却有所增加,同时其rsmA的表达量也显著降低[47]。虽然RsmA活性主要受RsmY和RsmZ等小分子RNA的调控,但rsmA转录水平的改变也可能影响该调节因子的活性,因此,H1-T6SS表达量的增加可能与rsmA的表达降低相关[47]。因此,Rsm系统主要通过控制2个RNA结合蛋白(RsmA和RsmF)表达水平或活性而对铜绿假单胞菌T6SS进行调控。
4.2 RetS/Gac系统的调控 RetS/Gac系统通过控制两个小分子RNA rsmY和rsmZ的转录,从而间接地对RsmA的活性进行调节,最终实现对下游基因的表达调控[77, 83]。GacS是一种传感器激酶,它通过转移磷酸基团来激活其同源反应调节因子GacA,RetS则与GacS形成异源二聚体,并阻断GacS自身的磷酸化,从而阻止GacA磷酸化,磷酸化的GacA是激活rsmY和rsmZ转录所必需的,而rsmY和rsmZ对RsmA的活性具有抑制作用[76, 83]。研究表明,将铜绿假单胞菌中的retS敲除后,GacS/GacA双组分系统被激活而进一步激活rsmY和rsmZ转录,导致RsmA的活性受RsmY和RsmZ的抑制,从而解除RsmA对T6SS的翻译抑制,最终使Hcp1、Hcp2、VgrG2b、PldA等蛋白的表达和分泌量增加,表明RetS/ Gac系统负调控铜绿假单胞菌的H1-和H2- T6SS[17, 43, 83–84]。因此,RetS/Gac系统通过影响RsmA的功能间接调控铜绿假单胞菌T6SS的表达。
4.3 AmrZ的调控 藻酸盐和运动调节因子Z (alginate and motility regulator Z,AmrZ)是DNA结合蛋白Ribbon- Helix-Helix家族中的一员,它可直接与铜绿假单胞菌T6SS的启动子结合而对其进行调控[81, 85–86]。研究表明,AmrZ可抑制铜绿假单胞菌H2-T6SS的表达,上调H1-T6SS和H3-T6SS的表达,但AmrZ对铜绿假单胞菌T6SS的具体调控机制还有待进一步研究[81]。
4.4 PpkA和PppA的调控 铜绿假单胞菌T6SS的翻译后调控包括苏氨酸磷酸化(threonine phosphorylation pathway,TPP)依赖性途径和TPP非依赖性途径[87]。丝氨酸-苏氨酸激酶PpkA和丝氨酸-苏氨酸磷酸酶PppA分别通过作用于含有FHA结构域的蛋白Fha1实现对铜绿假单胞菌H1-T6SS的调控[88]。当铜绿假单胞菌受到环境信号的刺激时,PpkA被激活并自动磷酸化,磷酸化的PpkA进一步结合Fha1并使之磷酸化,进而激活了H1-T6SS的表达与组装[88]。后续研究表明,TagTSQ可以检测和感应环境信号,并通过调节TagR (可激活PpkA)的位置或构象将环境信号传递给PpkA并使其激活,从而激活了H1-T6SS的表达和组装[78, 89]。目前发现的TagTSQ能够检测和感应的环境信号包括多粘菌素B、胞外DNA (extracellular DNA,eDNA)和乙二胺四乙酸(ethylene diamine tetraacetic Acid,EDTA) 等[90–91]。PppA是PpkA的拮抗剂,一旦环境信号的刺激消失,PppA能够有效地使磷酸化的Fha1(p-Fha1)去磷酸化,实现这一过程的逆转[88],如图 3所示。此外,其他细菌通过Ⅳ型分泌系统(type Ⅳ secretion system,T4SS)或T6SS介导与铜绿假单胞菌的直接接触,会引起铜绿假单胞菌的膜扰动,这一膜扰动信号会使铜绿假单胞菌H1-T6SS得到激活,这种激活过程也是通过TPP依赖性调控途径实现的[90]。总之,TagTSQ-TagR通过感应和传递环境信号给PpkA/PppA,PpkA和PppA则通过与Fha1蛋白结合并使之磷酸化或去磷酸化,从而对铜绿假单胞菌H1-T6SS进行调控。
4.5 RpoN的调控 RpoN最先是在肺炎克雷伯氏菌中发现的[92],起初被认为与氮代谢相关,后来发现可以调控鞭毛合成、生物被膜形成、毒力因子和抗生素耐药性等相关基因的转录与表达[93–95]。现在研究发现,RpoN在铜绿假单胞菌T6SS相关基因的表达调控方面也发挥重要作用[92–93]。研究表明,在rpoN缺失突变株中,H1-T6SS相关基因hcp1、clpV1和vgrG1的表达显著降低,表明铜绿假单胞菌H1-T6SS受RpoN的正调控[93]。此外,RpoN对铜绿假单胞菌H2-和H3-T6SS也有调控作用。其中,左侧H3-T6SS操纵子(由lip3启动子驱动)受RpoN正调控,而右侧H3-T6SS操纵子(由hsiB3启动子驱动)和H2-T6SS受RpoN负调控[20, 79]。Sfa是RpoN的激活蛋白,RpoN对H2-T6SS的调控是以Sfa2依赖的方式间接实现的,而对H3-T6SS的调控则不依赖于Sfa3,它可能是通过RpoN/GacA/RsmA通路实现对H3-T6SS的间接性调控[20, 79]。综上所述,RpoN通过多种方式对铜绿假单胞菌的3套T6SS进行差异化调控。
4.6 QS调控 群体感应(quorum sensing,QS)是一种基于细胞密度来调节基因表达的基因调控系统,它可调节毒力基因和生物膜形成相关基因的表达[96]。目前在铜绿假单胞菌中发现至少4种群体感应系统:las、rhl、pqs和iqs[96]。在每个群体感应系统中,通过作为转录调节因子的受体蛋白与其同源的QS信号分子结合而激活与毒力因子、次级代谢和生物被膜发育有关的多种基因的转录[97–98]。这些信号系统在铜绿假单胞菌体内交织成一个复杂的多层次调控网络,可调节铜绿假单胞菌基因组中大约12%的基因[96, 98–100],其中铜绿假单胞菌T6SS的表达也受QS的差异调控[16, 101]。
las和rhl系统包括2个酰基高丝氨酸内酯合成酶LasI和RhlI,它们分别负责合成QS信号分子OdDHL [N-(3-氧十二烷酰基)-L-高丝氨酸内酯]和BHL (N-丁酰-L高丝氨酸内酯)[98]。随着细菌密度的增加,这些信号分子被释放并在环境中积累,当它们的浓度积累到阈值时,它们则与其同源受体LasR和RhlR结合形成复合体而激活它们的调控功能,从而调节相应靶标基因的表达[98]。研究表明,受QS调控的基因启动子区域通常含有一个las-rhl结合位点,它是一个20 bp的重复序列,位于转录起始的40–60 bp[80]。在铜绿假单胞菌H2-T6SS操纵子的上游区域也鉴定出该las-rhl结合位点,进一步研究发现H2-T6SS的表达直接受到las和rhl系统的正调控[80, 101]。此外,铜绿假单胞菌H1-和H3-T6SS也受las系统的差异调控,研究表明,las系统负调控铜绿假单胞菌H1-T6SS,而正调控H3-T6SS[101]。铜绿假单胞菌pqs系统的信号分子主要为2-庚基-3-羟基-4(1H)-喹诺酮(PQS)和2-庚基-4-羟基喹啉(HHQ),它们共用同一个受体蛋白PqsR (又名MvfR)[102]。研究显示PqsR负调控H1-T6SS的表达,而正调控H2-和H3-T6SS的表达[101],可是这种调控可能不依赖于信号分子PQS或HHQ,因为信号分子PQS/HHQ合成基因簇pqsABCDE的启动子区是PqsR-PQS (或PqsR-HHQ)复合体的唯一作用靶点[96]。有趣的是PqsR可以不依赖于PQS或HHQ独自发挥功能,目前已知PqsR可以与铜绿假单胞菌基因组的37个基因位点结合,其中就包括H2-T6SS的启动子区[16],这暗示PqsR独自直接调控H2-T6SS的表达,而对H1-T6SS和H3-T6SS的调控可能是间接的。H3-T6SS基因簇存在2个启动子区,包括控制主基因簇转录的lip3和hsi B3间隔区形成的双向转录启动子(PH3-T6SS-right和PH3-T6SS-left)以及控制vgrG3-tseF操纵子转录的clpV3和vgrG3间隔区形成的启动子(PvgrG3)。为了确定PqsR正调控H3-T6SS表达的表型是否与信号分子PQS有关,我们分析了PQS对H3-T6SS表达的影响。研究结果显示,PQS差异调控H3-T6SS的2个启动子区的表达。我们通过启动子的lacZ转录融合分析显示,PQS激活PH3-T6SS-right的表达而抑制PvgrG3的表达,但不影响PH3-T6SS-left的表达(数据未发表)。这些结果表明PqsR对H3-T6SS的调控可能通过PQS介导。综上所述,QS系统可对铜绿假单胞菌的3套T6SS进行差异化调控。
4.7 CueR调控 铜是大多数生物体(包括细菌)生长发育所必需的微量元素[103]。生物体内的铜稳态一旦被打破,则会严重影响生物体的正常生长,因此,生物体严格控制铜离子的摄取和外排,以确保体内铜离子的动态平衡[103–104]。铜绿假单胞菌的铜稳态主要由铜稳态调节蛋白CueR控制[17]。然而CueR除了控制铜绿假单胞菌细胞内铜稳态外,还可对H2-T6SS的活性及其组装进行调控[17]。研究发现,与野生型PAO1相比,cueR的缺失使hcp2和tssA2 (H2-T6SS的2个结构蛋白编码基因)的表达显著增高,但hcp1和hcp3的表达水平并无显著差异[17]。凝胶阻滞分析发现,CueR与tssA2起始密码子的上游区域–173到–140或相对于hcp2起始密码子的上游区域–208到–159的位点结合[17]。因此,CueR对铜绿假单胞菌H2-T6SS具有直接负调控作用。
4.8 Fur调控 Fur是铜绿假单胞菌中铁依赖基因表达的关键调控因子,它通过与靶标基因启动子上的Fur盒结合来抑制下游基因的转录过程[105]。Sana等在铜绿假单胞菌H2-T6SS操纵子的上游区域发现了Fur结合位点[80],这提示Fur对铜绿假单胞菌H2-T6SS的表达可能具有一定的调控作用,进一步研究发现,铜绿假单胞菌H2-T6SS受Fur的负调控[80]。此外,我们的研究结果显示,Fur对H3-T6SS也有调控作用。为了研究Fur对H3-T6SS的调控,我们检测了PH3-T6SS-right、PH3-T6SS-left和PvgrG3启动子的lacZ转录融合在铜绿假单胞菌fur缺失突变株中的表达情况,结果显示,相比野生型菌株,fur缺失突变显著诱导了PH3-T6SS-right、PH3-T6SS-left和PvgrG3启动子的表达;用质粒pME6032-fur互补fur缺失突变株后,这些启动子的表达又恢复到野生型水平,表明Fur负调控H3-T6SS的表达[16]。我们进一步通过凝胶迁移阻滞实验证明了Fur蛋白不能与H3-T6SS的启动子结合,表明Fur对H3-T6SS的调控是间接的(数据未发表)。综上所述,Fur对铜绿假单胞菌的H2-和H3-T6SS具有负调控作用,但对H2-T6SS的调控是直接的,而对H3-T6SS的调控是间接的。
4.9 其他调控方式 铜绿假单胞菌T6SS的表达除了受到上述调控因子的调控外,还受到其他环境因素的影响,比如温度[81, 106]。当培养温度从37 ℃降低到25 ℃时,铜绿假单胞菌T6SS相关基因hcpB、vgrG2b和hsiB1的表达都显著降低[106],这些表型可能与温度感受器AlgU (又名AlgT)的调控相关联[107]。此外,温度还会影响RsmA对铜绿假单胞菌T6SS的调控[81]。在铜绿假单胞菌PA14中,敲除rsmA后,H1-和H2-T6SS均可在37 ℃表达,但H3-T6SS在该条件下依然不能表达;然而,在25 ℃培养条件下,rsmA突变株中这3套T6SS均能表达,并且在野生型PA14菌株中还能检测到H1-和H2-T6SS的表达。这些结果表明在25 ℃培养条件下,铜绿假单胞菌PA14中H1-和H2-T6SS的表达不再依赖于rsmA的缺失,同时RsmA对H3-T6SS的负调控作用依赖于温度[81]。因此,温度也是影响铜绿假单胞菌T6SS表达的一个重要因素。
5 展望 铜绿假单胞菌T6SS通过接触依赖的方式将效应蛋白分泌到靶细胞,在感染宿主、生物被膜的形成以及细菌之间的竞争中发挥着不可替代的作用[16, 46, 65]。在铜绿假单胞菌中已发现的依赖T6SS分泌的效应蛋白共有19个,如表 2所示。其中,H1-T6SS是铜绿假单胞菌对其他细菌产生毒性的“主力军”,它可分泌9个毒性蛋白,即Tse1至Tse8和Tas1。H2-T6SS除了分泌介导细菌毒性的效应蛋白外,还可分泌4个跨界效应蛋白(VgrG2b、Tle4、Tle5a和Tle5b)。H3-T6SS分泌的效应蛋白目前只报道了TseF,它主要介导铜绿假单胞菌对Fe3+的摄取。值得一提的是,在铜绿假单胞菌众多的分泌系统中,只有T6SS能够分泌跨界效应蛋白,因此,T6SS的发现为铜绿假单胞菌与其他细菌间、铜绿假单胞菌与宿主细胞间相互作用以及铜绿假单胞菌致病性的研究提供了一个新方向。
除了在基础研究方面得到广泛关注外,铜绿假单胞菌T6SS在生物技术领域也有重要的应用价值。目前铜绿假单胞菌T6SS的应用研究方面主要有以下2个案例:(1) 近年来,细菌耐药性问题已成为全球公共健康领域的重大挑战。世界卫生组织在2017年公布了急需新型抗生素的重点病原体清单,该清单包含12种耐药性细菌。其中,鲍曼不动杆菌、铜绿假单胞菌和肠杆菌类被列为急需开发新型抗菌药物的人类病原体[108]。因此,针对铜绿假单胞菌严重的耐药性问题,科学家通过合成一种类似于T6SS毒性蛋白的短肽,使之与毒性蛋白的同源免疫蛋白结合而钝化同源免疫蛋白的作用,从而使铜绿假单胞菌被自身的毒性蛋白杀死[50]。(2) T6SS的效应蛋白主要通过与VgrG、Hcp和PAAR等结构蛋白结合而随它们一起分泌出去。最近研究显示,当一个与T6SS无关的β-内酰胺酶BlaTEM-1分别与铜绿假单胞菌PAK的VgrG1a以及铜绿假单胞菌PAO1的VgrG4b融合表达时,BlaTEM-1也可随这2个VgrG一起分泌到胞外[109]。因此,将异源蛋白与VgrG、Hcp和PAAR等结构蛋白融合表达并随它们一起分泌,可能为异源蛋白的分泌和向靶细胞的转位提供了一种新的选择。这些研究案例为铜绿假单胞菌T6SS在生物技术领域的应用打开了一扇窗。相信随着我们对铜绿假单胞菌T6SS生物学功能及其作用机制更加深入的了解,有关铜绿假单胞菌T6SS在生物技术领域的应用研究也将得到迅猛发展。
最近几年,人们对铜绿假单胞菌T6SS的组成、调控、生物学功能、作用机制以及应用等方面的研究取得了很大的进展,但是仍然存在一些问题有待阐明。比如:环境因素影响铜绿假单胞菌T6SS表达的细胞信号传导机制如何?铜绿假单胞菌是怎么识别遇到的是真核细胞还是原核细胞,从而启动不同的T6SS?铜绿假单胞菌T6SS不同效应蛋白的分泌是否存在一定的选择性机制?铜绿假单胞菌T6SS显示出多功能性,那么它是否还具有其他新型的生物学功能?如果有,其相对应的效应蛋白是什么?作用机制又如何?先前的研究表明,H2-和H3-T6SS与铜绿假单胞菌金属离子的摄取有关,铜绿假单胞菌的3套T6SS在结构和功能上具有相似性,因此,H1-T6SS对铜绿假单胞菌摄取金属离子的过程是否产生影响也是一个有待解决的问题。此外,虽然已有研究将异源蛋白通过与VgrG融合表达而从铜绿假单胞菌中分泌出去,但该融合蛋白并未成功从铜绿假单胞菌中转位至HeLa细胞[109]。这可能是该融合蛋白未能穿透HeLa细胞的细胞膜,或者融合蛋白在参与穿透细胞膜之前就从T6SS上脱落[109]。虽然目前还未能实现将异源蛋白通过VgrG嵌合体的形式运送至靶细胞,但是这种利用T6SS投递异源蛋白至靶细胞的方案在理论上是可行的。因此,要实现这一方案,还需更深入的研究。铜绿假单胞菌作为研究T6SS的最重要模式生物之一,针对这些问题的研究将对该领域的发展有巨大的推动作用。
References
| [1] | Wade DS, Calfee MW, Rocha ER, Ling EA, Engstrom E, Coleman JP, Pesci EC. Regulation of Pseudomonas quinolone signal synthesis in Pseudomonas aeruginosa. Journal of Bacteriology, 2005, 187(13): 4372-4380. DOI:10.1128/JB.187.13.4372-4380.2005 |
| [2] | Mielko KA, Jab?oński SJ, Milczewska J, Sands D, ?ukaszewicz M, M?ynarz P. Metabolomic studies of Pseudomonas aeruginosa. World Journal of Microbiology and Biotechnology, 2019, 35(11): 1-11. DOI:10.1007/s11274-019-2739-1 |
| [3] | Niu YT, Wang ST, Cheng JL, Lin JS. Zinc uptake systems in Pseudomonas aeruginosa-a review. Acta Microbiologica Sinica, 2021, 61(7): 1856-1872. (in Chinese) 牛艳婷, 王帅涛, 成娟丽, 林金水. 铜绿假单胞菌锌离子摄取系统的研究进展. 微生物学报, 2021, 61(7): 1856-1872. |
| [4] | Hoggarth A, Weaver A, Pu QQ, Huang T, Schettler J, Chen F, Yuan XF, Wu M. Mechanistic research holds promise for bacterial vaccines and phage therapies for Pseudomonas aeruginosa. Drug Design, Development and Therapy, 2019, 13: 909-924. DOI:10.2147/DDDT.S189847 |
| [5] | Janssen KH, Diaz MR, Gode CJ, Wolfgang MC, Yahr TL. RsmV a small non-coding regulatory RNA in Pseudomonas aeruginosa that sequesters RsmA and RsmF from target mRNAs. Journal of Bacteriology, 2018, 200(16): e00277-18. |
| [6] | Mougous JD, Cuff ME, Raunser S, Shen A, Zhou M, Gifford CA, Goodman AL, Joachimiak G, Ordonez CL, Lory S, Walz T, Joachimiak A, Mekalanos JJ. A virulence locus of Pseudomonas aeruginosa encodes a protein secretion apparatus. Science, 2006, 312(5779): 1526-1530. DOI:10.1126/science.1128393 |
| [7] | Cianfanelli FR, Monlezun L, Coulthurst SJ. Aim, load, fire: the type Ⅵ secretion system, a bacterial nanoweapon. Trends in Microbiology, 2016, 24(1): 51-62. DOI:10.1016/j.tim.2015.10.005 |
| [8] | Sana TG, Berni B, Bleves S. The T6SSs of Pseudomonas aeruginosa strain PAO1 and their effectors: beyond bacterial-cell targeting. Frontiers in Cellular and Infection Microbiology, 2016, 6: 61. |
| [9] | Li M, Le Trong I, Carl MA, Larson ET, Chou S, de Leon JA, Dove SL, Stenkamp RE, Mougous JD. Structural basis for type Ⅵ secretion effector recognition by a cognate immunity protein. PLoS Pathogens, 2012, 8(4): e1002613. DOI:10.1371/journal.ppat.1002613 |
| [10] | Jiang F, Wang X, Wang B, Chen LH, Zhao ZD, Waterfield NR, Yang GW, Jin Q. The Pseudomonas aeruginosa type Ⅵ secretion PGAP1-like effector induces host autophagy by activating endoplasmic Reticulum stress. Cell Reports, 2016, 16(6): 1502-1509. DOI:10.1016/j.celrep.2016.07.012 |
| [11] | Whitney JC, Quentin D, Sawai S, LeRoux M, Harding BN, Ledvina HE, Tran BQ, Robinson H, Goo YA, Goodlett DR, Raunser S, Mougous JD. An interbacterial NAD(P)(+) glycohydrolase toxin requires elongation factor Tu for delivery to target cells. Cell, 2015, 163(3): 607-619. DOI:10.1016/j.cell.2015.09.027 |
| [12] | Pissaridou P, Allsopp LP, Wettstadt S, Howard SA, Mavridou DAI, Filloux A. The Pseudomonas aeruginosa T6SS-VgrG1b spike is topped by a PAAR protein eliciting DNA damage to bacterial competitors. PNAS, 2018, 115(49): 12519-12524. DOI:10.1073/pnas.1814181115 |
| [13] | Wettstadt S, Wood TE, Fecht S, Filloux A. Delivery of the Pseudomonas aeruginosa phospholipase effectors PldA and PldB in a VgrG- and H2-T6SS-dependent manner. Frontiers in Microbiology, 2019, 10: 1718. DOI:10.3389/fmicb.2019.01718 |
| [14] | Yang XY, Li ZQ, Gao ZQ, Wang WJ, Geng Z, Xu JH, She Z, Dong YH. Structural and SAXS analysis of Tle5-Tli5 complex reveals a novel inhibition mechanism of H2-T6SS in Pseudomonas aeruginosa. Protein Science, 2017, 26(10): 2083-2091. DOI:10.1002/pro.3246 |
| [15] | Sana TG, Baumann C, Merdes A, Soscia C, Rattei T, Hachani A, Jones C, Bennett KL, Filloux A, Superti-Furga G, Voulhoux R, Bleves S. Pseudomonas aeruginosa strain PAO1 into epithelial cells is promoted by interaction of a T6SS effector with the microtubule network.. mBio, 2015, 6(3): e00712. |
| [16] | Lin JS, Zhang WP, Cheng JL, Yang X, Zhu KX, Wang Y, Wei GH, Qian PY, Luo ZQ, Shen XH. A Pseudomonas T6SS effector recruits PQS-containing outer membrane vesicles for iron acquisition. Nature Communications, 2017, 8: 14888. DOI:10.1038/ncomms14888 |
| [17] | Han YY, Wang TT, Chen GK, Pu QQ, Liu Q, Zhang YN, Xu LH, Wu M, Liang HH. A Pseudomonas aeruginosa type Ⅵ secretion system regulated by CueR facilitates copper acquisition. PLoS Pathogens, 2019, 15(12): e1008198. DOI:10.1371/journal.ppat.1008198 |
| [18] | Lin JS, Cheng JL, Chen KQ, Guo CH, Zhang WP, Yang X, Ding W, Ma L, Wang Y, Shen XH. The icmF3 locus is involved in multiple adaptation-and virulence-related characteristics in Pseudomonas aeruginosa PAO1. Frontiers in Cellular and Infection Microbiology, 2015, 5: 70. |
| [19] | Sheng LL, Lv Y, Liu Q, Wang QY, Zhang YX. Connecting type Ⅵ secretion, quorum sensing, and c-di-GMP production in fish pathogen Vibrio alginolyticus through phosphatase PppA. Veterinary Microbiology, 2013, 162(2/3/4): 652-662. |
| [20] | Chen LH, Zou YR, She PF, Wu Y. Composition, function, and regulation of T6SS in Pseudomonas aeruginosa.. Microbiological Research, 2015, 172: 19-25. DOI:10.1016/j.micres.2015.01.004 |
| [21] | Zheng J, Leung KY. Dissection of a type Ⅵ secretion system in Edwardsiella tarda.. Molecular Microbiology, 2007, 66(5): 1192-1206. DOI:10.1111/j.1365-2958.2007.05993.x |
| [22] | Basler M, Pilhofer M, Henderson GP, Jensen GJ, Mekalanos JJ. Type Ⅵ secretion requires a dynamic contractile phage tail-like structure. Nature, 2012, 483(7388): 182-186. DOI:10.1038/nature10846 |
| [23] | Chang YW, Rettberg LA, Jensen GJ. In vivo structures of an intact type Ⅵ secretion system revealed by electron cryotomography. EMBO Reports, 2017, 18(5): e201744072. |
| [24] | Corbitt J, Yeo JS, Davis CI, LeRoux M, Wiggins PA. Type Ⅵ secretion system dynamics reveals a novel secretion mechanism in Pseudomonas aeruginosa.. Journal of Bacteriology, 2018, 200(11): e00744-e00717. |
| [25] | Ho BT, Dong TG, Mekalanos JJ. A view to a kill: the bacterial type Ⅵ secretion system. Cell Host & Microbe, 2014, 15(1): 9-21. |
| [26] | Zoued A, Durand E, Brunet YR, Spinelli S, Douzi B, Guzzo M, Flaugnatti N, Legrand P, Journet L, Fronzes R, Mignot T, Cambillau C, Cascales E. Priming and polymerization of a bacterial contractile tail structure. Nature, 2016, 531(7592): 59-63. DOI:10.1038/nature17182 |
| [27] | Santin YG, Doan T, Lebrun R, Espinosa L, Journet L, Cascales E. In vivo TssA proximity labelling during type Ⅵ secretion biogenesis reveals TagA as a protein that stops and holds the sheath. Nature Microbiology, 2018, 3(11): 1304-1313. DOI:10.1038/s41564-018-0234-3 |
| [28] | Liang XY, Xu P, Dong T. Effector recognition and translocation by type Ⅵ protein secretion system in Gram-negative bacteria. Microbiology China, 2019, 46(2): 339-344. (in Chinese) 梁小夜, 许平, 董涛. 从效应蛋白视角看革兰氏阴性细菌Ⅵ型蛋白分泌系统底物转运机理. 微生物学通报, 2019, 46(2): 339-344. |
| [29] | Stietz MS, Liang XY, Li H, Zhang XR, Dong TG. TssA-TssM-TagA interaction modulates type Ⅵ secretion system sheath-tube assembly in Vibrio cholerae.. Nature Communications, 2020, 11: 5065. DOI:10.1038/s41467-020-18807-9 |
| [30] | Ruhe ZC, Low DA, Hayes CS. Polymorphic toxins and their immunity proteins: diversity, evolution, and mechanisms of delivery. Annual Review of Microbiology, 2020, 74(1): 497-520. DOI:10.1146/annurev-micro-020518-115638 |
| [31] | Fang XY, Hu LH, Hang YP, Yu F, Chen YH, Zhong QS. Research progress of type Ⅵ secretion system in Pseudomonas aeruginosa.. China Biotechnology, 2018, 38(9): 88-93. (in Chinese) 方雪瑶, 胡龙华, 杭亚平, 俞凤, 陈艳慧, 钟桥石. 铜绿假单胞菌Ⅵ型分泌系统的研究进展. 中国生物工程杂志, 2018, 38(9): 88-93. |
| [32] | Wood TE, Howard SA, F?rster A, Nolan LM, Manoli E, Bullen NP, Yau HCL, Hachani A, Hayward RD, Whitney JC, Vollmer W, Freemont PS, Filloux A. The Pseudomonas aeruginosa T6SS delivers a periplasmic toxin that disrupts bacterial cell morphology. Cell Reports, 2019, 29(1): 187-201.e7. DOI:10.1016/j.celrep.2019.08.094 |
| [33] | Hernandez RE, Gallegos-Monterrosa R, Coulthurst SJ. Type Ⅵ secretion system effector proteins: effective weapons for bacterial competitiveness. Cellular Microbiology, 2020, 22(9): e13241. |
| [34] | Ma JL, Pan ZH, Huang JH, Sun M, Lu CP, Yao HC. The Hcp proteins fused with diverse extended-toxin domains represent a novel pattern of antibacterial effectors in type Ⅵ secretion systems. Virulence, 2017, 8(7): 1189-1202. DOI:10.1080/21505594.2017.1279374 |
| [35] | Wood TE, Howard SA, Wettstadt S, Filloux A. PAAR proteins act as the 'sorting hat' of the type Ⅵ secretion system. Microbiology: Reading, England, 2019, 165(11): 1203-1218. DOI:10.1099/mic.0.000842 |
| [36] | Unterweger D, Kostiuk B, ?tjengerdes R, Wilton A, Diaz-Satizabal L, Pukatzki S. Chimeric adaptor proteins translocate diverse type Ⅵ secretion system effectors in Vibrio cholerae.. The EMBO Journal, 2015, 34(16): 2198-2210. DOI:10.15252/embj.201591163 |
| [37] | Alcoforado Diniz J, Coulthurst SJ. Intraspecies competition in Serratia marcescens is mediated by type Ⅵ-secreted rhs effectors and a conserved effector-associated accessory protein. Journal of Bacteriology, 2015, 197(14): 2350-2360. DOI:10.1128/JB.00199-15 |
| [38] | Quentin D, Ahmad S, Shanthamoorthy P, Mougous JD, Whitney JC, Raunser S. Mechanism of loading and translocation of type Ⅵ secretion system effector Tse6. Nature Microbiology, 2018, 3(10): 1142-1152. DOI:10.1038/s41564-018-0238-z |
| [39] | Hood RD, Singh P, Hsu F, Güvener T, Carl MA, Trinidad RRS, Silverman JM, Ohlson BB, Hicks KG, Plemel RL, Li M, Schwarz S, Wang WY, Merz AJ, Goodlett DR, Mougous JD. A type Ⅵ secretion system of Pseudomonas aeruginosa targets a toxin to bacteria. Cell Host & Microbe, 2010, 7(1): 25-37. |
| [40] | Silverman JM, Agnello DM, Zheng HJ, Andrews BT, Li M, Catalano CE, Gonen T, Mougous JD. Haemolysin coregulated protein is an exported receptor and chaperone of type Ⅵ secretion substrates. Molecular Cell, 2013, 51(5): 584-593. DOI:10.1016/j.molcel.2013.07.025 |
| [41] | Wang TT, Hu ZY, Du X, Shi Y, Dang J, Lee M, Hesek D, Mobashery S, Wu M, Liang HH. A type Ⅵ secretion system delivers a cell wall amidase to target bacterial competitors. Molecular Microbiology, 2020, 114(2): 308-321. DOI:10.1111/mmi.14513 |
| [42] | Unterweger D, Kostiuk B, Pukatzki S. Adaptor proteins of type Ⅵ secretion system effectors. Trends in Microbiology, 2017, 25(1): 8-10. DOI:10.1016/j.tim.2016.10.003 |
| [43] | Burkinshaw BJ, Liang XY, Wong M, Le ANH, Lam L, Dong TG. A type Ⅵ secretion system effector delivery mechanism dependent on PAAR and a chaperone-co-chaperone complex. Nature Microbiology, 2018, 3(5): 632-640. DOI:10.1038/s41564-018-0144-4 |
| [44] | Berni B, Soscia C, Djermoun S, Ize B, Bleves S. A type Ⅵ secretion system trans-kingdom effector is required for the delivery of a novel antibacterial toxin in Pseudomonas aeruginosa.. Frontiers in Microbiology, 2019, 10: 1218. DOI:10.3389/fmicb.2019.01218 |
| [45] | Chen LH, Zou YR, Kronfl AA, Wu Y. Type Ⅵ secretion system of Pseudomonas aeruginosa is associated with biofilm formation but not environmental adaptation. MicrobiologyOpen, 2020, 9(3): e991. |
| [46] | Cheng YY, Yam JKH, Cai Z, Ding YC, Zhang LH, Deng YY, Yang L. Population dynamics and transcriptomic responses of Pseudomonas aeruginosa in a complex laboratory microbial community. NPJ Biofilms and Microbiomes, 2019, 5(1): 1-11. DOI:10.1038/s41522-018-0076-z |
| [47] | Li YQ, Chen L, Zhang PS, Bhagirath AY, Duan KM. ClpV3 of the H3-type Ⅵ secretion system (H3-T6SS) affects multiple virulence factors in Pseudomonas aeruginosa.. Frontiers in Microbiology, 2020, 11: 1096. DOI:10.3389/fmicb.2020.01096 |
| [48] | Zhang L, Hinz AJ, Nadeau JP, Mah TF. Pseudomonas aeruginosa tssC1 links type Ⅵ secretion and biofilm-specific antibiotic resistance. Journal of Bacteriology, 2011, 193(19): 5510-5513. DOI:10.1128/JB.00268-11 |
| [49] | Hofer U. T6SS: shoot and scrub. Nature Reviews Microbiology, 2020, 18(8): 412-413. |
| [50] | Gao XP, Mu ZX, Qin B, Sun YC, Cui S. Structure-based prototype peptides targeting the Pseudomonas aeruginosa type Ⅵ secretion system effector as a novel antibacterial strategy. Frontiers in Cellular and Infection Microbiology, 2017, 7: 411. DOI:10.3389/fcimb.2017.00411 |
| [51] | Wen HY, Geng Z, Gao ZQ, She Z, Dong YH. Characterization of the Pseudomonas aeruginosa T6SS PldB immunity proteins PA5086, PA5087 and PA5088 explains a novel stockpiling mechanism. Acta Crystallographica Section F, Structural Biology Communications, 2020, 76(Pt 5): 222-227. |
| [52] | Ma LS, Hachani A, Lin JS, Filloux A, Lai EM. Agrobacterium tumefaciens deploys a superfamily of type Ⅵ secretion DNase effectors as weapons for interbacterial competition in planta. Cell Host & Microbe, 2014, 16(1): 94-104. |
| [53] | Russell AB, LeRoux M, Hathazi K, Agnello DM, Ishikawa T, Wiggins PA, Wai SN, Mougous JD. Diverse type Ⅵ secretion phospholipases are functionally plastic antibacterial effectors. Nature, 2013, 496(7446): 508-512. DOI:10.1038/nature12074 |
| [54] | Nolan LM, Cain AK, Manoli E, Sainz-Polo MA, Dougan G, Mavridou DAI, Albesa-Jové D, Parkhill J, Filloux A. Discovery of a Pseudomonas aeruginosa Type Ⅵ secretion system toxin targeting bacterial protein synthesis using a global genomics approach. bioRxiv, 2019. DOI:10.1101/733030 |
| [55] | Ahmad S, Wang BY, Walker MD, Tran HKR, Stogios PJ, Savchenko A, Grant RA, McArthur AG, Laub MT, Whitney JC. An interbacterial toxin inhibits target cell growth by synthesizing (p)ppApp. Nature, 2019, 575(7784): 674-678. DOI:10.1038/s41586-019-1735-9 |
| [56] | Wang ZH, Dong T. Bacterial cell wall degradation by type Ⅵ secretion system effector proteins in Vibrio cholerae.. Microbiology China, 2021, 48(1): 135-144. (in Chinese) 王增航, 董涛. 霍乱弧菌Ⅵ型分泌系统的效应蛋白对细菌细胞壁的降解机制. 微生物学通报, 2021, 48(1): 135-144. |
| [57] | Ding JJ, Wang W, Feng H, Zhang Y, Wang DC. Structural insights into the Pseudomonas aeruginosa type Ⅵ virulence effector Tse1 bacteriolysis and self-protection mechanisms. Journal of Biological Chemistry, 2012, 287(32): 26911-26920. DOI:10.1074/jbc.M112.368043 |
| [58] | Russell AB, Hood RD, Bui NK, LeRoux M, Vollmer W, Mougous JD. Type Ⅵ secretion delivers bacteriolytic effectors to target cells. Nature, 2011, 475(7356): 343-347. DOI:10.1038/nature10244 |
| [59] | Tong G, Pan Y, Dong H, Pryor R, Wilson GE, Schaefer J. Structure and dynamics of pentaglycyl bridges in the cell walls of Staphylococcus aureus by 13C-15N REDOR NMR. Biochemistry, 1997, 36(32): 9859-9866. DOI:10.1021/bi970495d |
| [60] | Hu HD, Zhang H, Gao ZQ, Wang DQ, Liu GF, Xu JH, Lan K, Dong YH. Structure of the type Ⅵ secretion phospholipase effector Tle1 provides insight into its hydrolysis and membrane targeting. Acta Crystallographica Section D, 2014, 70(8): 2175-2185. DOI:10.1107/S1399004714012899 |
| [61] | Kim S, Jeon TJ, Oberai A, Yang D, Schmidt JJ, Bowie JU. Transmembrane glycine zippers: physiological and pathological roles in membrane proteins. PNAS, 2005, 102(40): 14278-14283. DOI:10.1073/pnas.0501234102 |
| [62] | LaCourse KD, Peterson SB, Kulasekara HD, Radey MC, Kim J, Mougous JD. Conditional toxicity and synergy drive diversity among antibacterial effectors. Nature Microbiology, 2018, 3(4): 440-446. DOI:10.1038/s41564-018-0113-y |
| [63] | Zhang DP, de Souza RF, Anantharaman V, Iyer LM, Aravind L. Polymorphic toxin systems: comprehensive characterization of trafficking modes, processing, mechanisms of action, immunity and ecology using comparative genomics. Biology Direct, 2012, 7(1): 18. DOI:10.1186/1745-6150-7-18 |
| [64] | Robb CS, Robb M, Nano FE, Boraston AB. The structure of the toxin and type six secretion system substrate Tse2 in complex with its immunity protein. Structure, 2016, 24(2): 277-284. DOI:10.1016/j.str.2015.11.012 |
| [65] | Simon NC, Aktories K, Barbieri JT. Novel bacterial ADP-ribosylating toxins: structure and function. Nature Reviews Microbiology, 2014, 12(9): 599-611. DOI:10.1038/nrmicro3310 |
| [66] | Whitney JC, Beck CM, Goo YA, Russell AB, Harding BN, de Leon JA, Cunningham DA, Tran BQ, Low DA, Goodlett DR, Hayes CS, Mougous JD. Genetically distinct pathways guide effector export through the type Ⅵ secretion system. Molecular Microbiology, 2014, 92(3): 529-542. DOI:10.1111/mmi.12571 |
| [67] | Hachani A, Allsopp LP, de Oduko Y, Filloux A. The VgrG proteins are "à la carte" delivery systems for bacterial type Ⅵ effectors. Journal of Biological Chemistry, 2014, 289(25): 17872-17884. DOI:10.1074/jbc.M114.563429 |
| [68] | Pei TT, Li H, Liang XY, Wang ZH, Liu GF, Wu LL, Kim H, Xie ZP, Yu M, Lin SJ, Xu P, Dong TG. Intramolecular chaperone-mediated secretion of an Rhs effector toxin by a type Ⅵ secretion system. Nature Communications, 2020, 11(1): 1865. DOI:10.1038/s41467-020-15774-z |
| [69] | Nunes-Alves C. Bacterial secretion: a trans-kingdom effector. Nature Reviews Microbiology, 2014, 12(7): 460-461. |
| [70] | Jiang F, Waterfield NR, Yang J, Yang GW, Jin Q. A Pseudomonas aeruginosa type Ⅵ secretion phospholipase D effector targets both prokaryotic and eukaryotic cells. Cell Host & Microbe, 2014, 15(5): 600-610. |
| [71] | Royt PW, Honeychuck RV, Ravich V, Ponnaluri P, Pannell LK, Buyer JS, Chandhoke V, Stalick WM, DeSesso LC, Donohue S, Ghei R, Relyea JD, Ruiz R. 4-hydroxy-2-nonylquinoline: a novel iron chelator isolated from a bacterial cell membrane. Bioorganic Chemistry, 2001, 29(6): 387-397. DOI:10.1006/bioo.2001.1225 |
| [72] | Cornelis P. Iron uptake and metabolism in Pseudomonas.. Applied Microbiology and Biotechnology, 2010, 86(6): 1637-1645. DOI:10.1007/s00253-010-2550-2 |
| [73] | Diggle SP, Matthijs S, Wright VJ, Fletcher MP, Chhabra SR, Lamont IL, Kong XL, Hider RC, Cornelis P, Cámara M, Williams P. The Pseudomonas aeruginosa 4-quinolone signal molecules HHQ and PQS play multifunctional roles in quorum sensing and iron entrapment. Chemistry & Biology, 2007, 14(1): 87-96. |
| [74] | Royt PW, Honeychuck RV, Pant RR, Rogers ML, Asher LV, Lloyd JR, Carlos WE, Belkin HE, Patwardhan S. Iron-and 4-hydroxy-2-alkylquinoline-containing periplasmic inclusion bodies of Pseudomonas aeruginosa: a chemical analysis. Bioorganic Chemistry, 2007, 35(2): 175-188. DOI:10.1016/j.bioorg.2006.10.004 |
| [75] | Lu DF, Zheng YS, Liao NS, Wei L, Xu B, Liu XL, Liu JF. The structural basis of the Tle4-Tli4 complex reveals the self-protection mechanism of H2-T6SS in Pseudomonas aeruginosa.. Acta Crystallographica Section D, 2014, 70(12): 3233-3243. DOI:10.1107/S1399004714023967 |
| [76] | Brencic A, Lory S. Determination of the regulon and identification of novel mRNA targets of Pseudomonas aeruginosa RsmA. Molecular Microbiology, 2009, 72(3): 612-632. DOI:10.1111/j.1365-2958.2009.06670.x |
| [77] | Records AR, Gross DC. Sensor kinases RetS and LadS regulate Pseudomonas syringae type Ⅵ secretion and virulence factors. Journal of Bacteriology, 2010, 192(14): 3584-3596. DOI:10.1128/JB.00114-10 |
| [78] | Casabona MG, Silverman JM, Sall KM, Boyer F, Couté Y, Poirel J, Grunwald D, Mougous JD, Elsen S, Attree I. An ABC transporter and an outer membrane lipoprotein participate in posttranslational activation of type Ⅵ secretion in Pseudomonas aeruginosa.. Environmental Microbiology, 2013, 15(2): 471-486. DOI:10.1111/j.1462-2920.2012.02816.x |
| [79] | Sana TG, Soscia C, Tonglet CM, Garvis S, Bleves S. Divergent control of two type Ⅵ secretion systems by RpoN in Pseudomonas aeruginosa.. PLoS ONE, 2013, 8(10): e76030. DOI:10.1371/journal.pone.0076030 |
| [80] | Sana TG, Hachani A, Bucior I, Soscia C, Garvis S, Termine E, Engel J, Filloux A, Bleves S. The second type Ⅵ secretion system of Pseudomonas aeruginosa strain PAO1 is regulated by quorum sensing and fur and modulates internalization in epithelial cells. Journal of Biological Chemistry, 2012, 287(32): 27095-27105. DOI:10.1074/jbc.M112.376368 |
| [81] | Allsopp LP, Wood TE, Howard SA, Maggiorelli F, Nolan LM, Wettstadt S, Filloux A. RsmA and AmrZ orchestrate the assembly of all three type Ⅵ secretion systems in Pseudomonas aeruginosa.. Proceedings of the National Academy of Sciences of the United States of America, 2017, 114(29): 7707-7712. DOI:10.1073/pnas.1700286114 |
| [82] | Morris ER, Hall G, Li C, Heeb S, Kulkarni RV, Lovelock L, Silistre H, Messina M, Cámara M, Emsley J, Williams P, Searle MS. Structural rearrangement in an RsmA/CsrA ortholog of Pseudomonas aeruginosa creates a dimeric RNA-binding protein, RsmN. Structure, 2013, 21(9): 1659-1671. DOI:10.1016/j.str.2013.07.007 |
| [83] | Brencic A, McFarland KA, McManus HR, Castang S, Mogno I, Dove SL, Lory S. The GacS/GacA signal transduction system of Pseudomonas aeruginosa acts exclusively through its control over the transcription of the RsmY and RsmZ regulatory small RNAs. Molecular Microbiology, 2009, 73(3): 434-445. DOI:10.1111/j.1365-2958.2009.06782.x |
| [84] | Moscoso JA, Mikkelsen H, Heeb S, Williams P, Filloux A. The Pseudomonas aeruginosa sensor RetS switches type Ⅲ and type Ⅵ secretion via c-di-GMP signalling. Environmental Microbiology, 2011, 13(12): 3128-3138. DOI:10.1111/j.1462-2920.2011.02595.x |
| [85] | Pryor EE, Waligora EA, Xu BJ, Dellos-Nolan S, Wozniak DJ, Hollis T. The transcription factor AmrZ utilizes multiple DNA binding modes to recognize activator and repressor sequences of Pseudomonas aeruginosa virulence genes. PLoS Pathogens, 2012, 8(4): e1002648. DOI:10.1371/journal.ppat.1002648 |
| [86] | Jones CJ, Newsom D, Kelly B, Irie Y, Jennings LK, Xu BJ, Limoli DH, Harrison JJ, Parsek MR, White P, Wozniak DJ. ChIP-Seq and RNA-Seq reveal an AmrZ-mediated mechanism for cyclic di-GMP synthesis and biofilm development by Pseudomonas aeruginosa.. PLoS Pathogens, 2014, 10(3): e1003984. DOI:10.1371/journal.ppat.1003984 |
| [87] | Lin JS, Pissaridou P, Wu HH, Tsai MD, Filloux A, Lai EM. TagF-mediated repression of bacterial type Ⅵ secretion systems involves a direct interaction with the cytoplasmic protein Fha. Journal of Biological Chemistry, 2018, 293(23): 8829-8842. DOI:10.1074/jbc.RA117.001618 |
| [88] | Mougous JD, Gifford CA, Ramsdell TL, Mekalanos JJ. Threonine phosphorylation post-translationally regulates protein secretion in Pseudomonas aeruginosa.. Nature Cell Biology, 2007, 9(7): 797-803. DOI:10.1038/ncb1605 |
| [89] | Hsu F, Schwarz S, Mougous JD. TagR promotes PpkA-catalysed type Ⅵ secretion activation in Pseudomonas aeruginosa.. Molecular Microbiology, 2009, 72(5): 1111-1125. DOI:10.1111/j.1365-2958.2009.06701.x |
| [90] | Wilton M, Wong MJQ, Tang L, Liang XY, Moore R, Parkins MD, Lewenza S, Dong TG. Chelation of membrane-bound cations by extracellular DNA activates the type Ⅵ secretion system in Pseudomonas aeruginosa.. Infection and Immunity, 2016, 84(8): 2355-2361. DOI:10.1128/IAI.00233-16 |
| [91] | LeRoux M, Kirkpatrick RL, Montauti EI, Tran BQ, Peterson SB, Harding BN, Whitney JC, Russell AB, Traxler B, Goo YA, Goodlett DR, Wiggins PA, Mougous JD. Kin cell lysis is a danger signal that activates antibacterial pathways of Pseudomonas aeruginosa.. Elife, 2015, 4: e05701. DOI:10.7554/eLife.05701 |
| [92] | Merrick MJ. In a class of its own-the RNA polymerase sigma factor σ54(σN). Molecular Microbiology, 1993, 10(5): 903-909. DOI:10.1111/j.1365-2958.1993.tb00961.x |
| [93] | Shao X, Zhang X, Zhang Y, Zhu M, Yang P, Yuan J, Xie Y, Zhou T, Wang W, Chen S, Liang H, Deng X. RpoN-dependent direct regulation of quorum sensing and the type Ⅵ secretion system in Pseudomonas aeruginosa PAO1. Journal of Bacteriology, 2018, 200(16): e00205-18. |
| [94] | Viducic D, Murakami K, Amoh T, Ono T, Miyake Y. RpoN promotes Pseudomonas aeruginosa survival in the presence of tobramycin. Frontiers in Microbiology, 2017, 8: 839. DOI:10.3389/fmicb.2017.00839 |
| [95] | Viducic D, Ono T, Murakami K, Katakami M, Susilowati H, Miyake Y. rpoN gene of Pseudomonas aeruginosa alters its susceptibility to quinolones and carbapenems. Antimicrobial Agents and Chemotherapy, 2007, 51(4): 1455-1462. DOI:10.1128/AAC.00348-06 |
| [96] | Lin JS, Cheng JL. Quorum sensing in Pseudomonas aeruginosa and its relationship to biofilm development//Rathinam NK, Sani RKIntroduction to biofilm engineering.. Washington: American Chemical Society, 2019: 1-16. |
| [97] | Lee J, Zhang LH. The hierarchy quorum sensing network in Pseudomonas aeruginosa.. Protein & Cell, 2015, 6(1): 26-41. |
| [98] | Lin JS, Cheng JL, Wang Y, Shen XH. The Pseudomonas quinolone signal (PQS): not just for quorum sensing anymore. Frontiers in Cellular and Infection Microbiology, 2018, 8: 230. DOI:10.3389/fcimb.2018.00230 |
| [99] | Hoffman LR, Kulasekara HD, Emerson J, Houston LS, Burns JL, Ramsey BW, Miller SI. Pseudomonas aeruginosa lasR mutants are associated with cystic fibrosis lung disease progression. Journal of Cystic Fibrosis, 2009, 8(1): 66-70. DOI:10.1016/j.jcf.2008.09.006 |
| [100] | D'Argenio DA, Wu MH, Hoffman LR, Kulasekara HD, Déziel E, Smith EE, Nguyen H, Ernst RK, Larson Freeman TJ, Spencer DH, Brittnacher M, Hayden HS, Selgrade S, Klausen M, Goodlett DR, Burns JL, Ramsey BW, Miller SI. Growth phenotypes of Pseudomonas aeruginosa lasR mutants adapted to the airways of cystic fibrosis patients. Molecular Microbiology, 2007, 64(2): 512-533. DOI:10.1111/j.1365-2958.2007.05678.x |
| [101] | Lesic B, Starkey M, He J, Hazan R, Rahme LG. Quorum sensing differentially regulates Pseudomonas aeruginosa type Ⅵ secretion locus I and homologous loci Ⅱ and Ⅲ, which are required for pathogenesis. Microbiology: Reading, England, 2009, 155(Pt 9): 2845-2855. |
| [102] | Wang ST, Gao QQ, Cheng JL, Lin JS. Regulation of Pseudomonas aeruginosa biofilms by quorum sensing systems and c-di-GMP. Acta Microbiologica Sinica, 2021, 61(5): 1106-1122. (in Chinese) 王帅涛, 高倩倩, 成娟丽, 林金水. 铜绿假单胞菌生物被膜组成及其受群体感应系统和c-di-GMP调控的研究进展. 微生物学报, 2021, 61(5): 1106-1122. |
| [103] | Shi X, Darwin KH. Copper homeostasis in Mycobacterium tuberculosis.. Metallomics, 2015, 7(6): 929-934. DOI:10.1039/C4MT00305E |
| [104] | Argüello JM, Raimunda D, Padilla-Benavides T. Mechanisms of copper homeostasis in bacteria. Frontiers in Cellular and Infection Microbiology, 2013, 3: 73. |
| [105] | Silverman JM, Brunet YR, Cascales E, Mougous JD. Structure and regulation of the type Ⅵ secretion system. Annual Review of Microbiolog, 2012, 66: 453-472. DOI:10.1146/annurev-micro-121809-151619 |
| [106] | Termine E, Michel GP. Transcriptome and secretome analyses of the adaptive response of Pseudomonas aeruginosa to suboptimal growth temperature. International Microbiology, 2009, 12(1): 7-12. |
| [107] | Schurr MJ, Yu H, Boucher JC, Hibler NS, Deretic V. Multiple promoters and induction by heat shock of the gene encoding the alternative sigma factor AlgU (Sigma E) which controls mucoidy in cystic fibrosis isolates of Pseudomonas aeruginosa.. Journal of Bacteriology, 1995, 177(19): 5670-5679. DOI:10.1128/jb.177.19.5670-5679.1995 |
| [108] | Shrivastava SR, Shrivastava PS, Ramasamy J. World health organization releases global priority list of antibiotic-resistant bacteria to guide research, discovery, and development of new antibiotics. Journal of Medical Society, 2018, 32(1): 76. DOI:10.4103/jms.jms_25_17 |
| [109] | Wettstadt S, Filloux A. Manipulating the type Ⅵ secretion system spike to shuttle passenger proteins. PLoS ONE, 2020, 15(2): e0228941. DOI:10.1371/journal.pone.0228941 |
