李张强1, 李娜1,2, 李悦1, 汪美贞1,2


1. 浙江工商大学环境科学与工程学院, 浙江 杭州 310012;
2. 浙江省固体废物处理与资源化重点实验室, 浙江 杭州 310012
收稿日期:2020-04-26;修回日期:2020-06-09;网络出版日期:2020-07-16
基金项目:国家重点研发计划(政府间国际科技创新合作)(2018YFE0110500);国家自然科学基金(21906145)
*通信作者:汪美贞. E-mail:wmzyy@163.com.
摘要:贵金属纳米材料(Noble metal-based nanomaterials,NMNs)具有广谱抗菌性。NMNs可通过纳米穿孔、破坏膜稳定性、诱导活性氧、与DNA等生物大分子结合等方式杀灭细菌。同时,在NMNs选择压力下,细菌进化出了抵抗NMNs损害的能力。细菌对NMNs的耐性可通过膜电位排斥、分泌吸附蛋白、激活抗氧化损伤相关酶、外排有毒颗粒以及群体效应等途径得以表现。本文一方面总结了NMNs对细菌的抑制机制,另一方面探讨了细菌对NMNs产生耐性的方式、原因及目前研究的不足,以期为合理开发并应用抑菌贵金属纳米材料提供科学依据。
关键词:贵金属纳米材料抑菌机制细菌耐性膜电位排斥吸附蛋白群体感应
Antimicrobial noble metal-based nanomaterials
Zhangqiang Li1, Na Li1,2, Yue Li1, Meizhen Wang1,2


1. School of Environmental Science and Engineering, Zhejiang Gongshang University, Hangzhou 310012, Zhejiang Province, China;
2. Zhejiang Provincial Key Laboratory of Solid Waste Treatment and Recycling, Hangzhou 310012, Zhejiang Province, China
Received: 26 April 2020; Revised: 9 June 2020; Published online: 16 July 2020
*Corresponding author: Meizhen Wang. E-mail:wmzyy@163.com.
Foundation item: Supported by the National Key R & D Program of China (2018YFE0110500) and by the National Natural Science Foundation of China (21906145)
Abstract: Noble metal-based nanomaterials (NMNs) have a broad spectrum of antibacterial properties. NMNs can inhibit bacteria by means of nano-perforation, disrupting membrane stability, stimulating the generation of reactive oxygen species, binding to biological molecules such as DNA, and releasing toxic ions. Under the selective pressure of NMNs, bacteria evolve the resistance to NMNs inhibition. The resistance of bacteria to NMNs can be exhibited through electrostatic repulsion, secreting adsorption protein, activation of antioxidant enzymes, efflux of toxic particles, and quorum sensing. Here we summarize the antibacterial properties of NMNs, discuss bacterial resistance to NMNs, and indicate the shortage of current researches on bacterial resistance to NMNs, to assist rational development and application of antimicrobial NMNs.
Keywords: noble metal-based nanomaterialsantimicrobial mechanismbacterial resistancemembrane electrostatic repulsionadsorption proteinquorum sensing
纳米尺度引起的元素物理化学性质改变,开辟了一个新兴的领域——纳米科学[1]。尺寸在1– 100 nm范围内的金属粒子被称为金属纳米颗粒,其中以金、银、铂、钯等贵金属为中心的纳米颗粒称为贵金属纳米材料(Noble metal-based nanomaterials,NMNs)。由于其独特的物理化学性质以及优异的生物相容性,NMNs被广泛应用于电子与医药等各个领域[2]。抗生素替代是纳米材料在医学领域的重要应用方向之一。抗生素在治疗感染性疾病方面发挥着重要作用,但是其过量使用甚至滥用导致了抗生素抗性基因丰度剧增和多药耐药细菌蔓延[3]。由于NMNs不仅对普通细菌具有良好的抑菌作用,而且对多药耐药菌也表现出了较强的抑菌能力[4],抗菌纳米材料开发已然成为研究热潮。值得注意的是,如同抗生素一样,在纳米抗菌剂长期作用下,陆续出现了一些NMNs“杀不死”的顽固细菌[5]。这些抗纳米材料细菌的出现,是否会让人类再次面临抗生素耐药一样的窘境,目前不得而知。抗菌材料的安全性陆续引起了人们的重视[6]。因此,本文就近年来NMNs抑菌的分子机制以及细菌产生NMNs耐性的机理作一综述,以期为NMNs等抗菌材料的研究提供参考和借鉴。
1 贵金属纳米材料抑菌的分子机制 相比已有的抗生素,NMNs的抑菌范围更广。抗生素一般通过抑制蛋白质、DNA、叶酸等生物分子的合成,阻碍细菌繁殖,从而起到抑菌作用。一种类型的抗生素往往只能通过一种机制抑制某一类细菌。不同于抗生素,NMNs往往直接引起暴露细菌的死亡,包括由于尺寸效应导致纳米穿孔、插入细胞壁/细胞膜引起胞内物质外泄、诱导活性氧(Reactive oxygen species,ROS)产生、紊乱正常的生理功能(如DNA复制、蛋白质翻译)等,且往往是自外到内产生连续损伤(表 1)。
表 1. 贵金属纳米材料抑菌的分子机制 Table 1. Molecular mechanisms of noble metal nanomaterials to bacteria
| NMNs type | Antibacterial mechanism | Size/nm | Target bacteria | References |
| Gold | Nanoperforation | < 22 | Escherichia coli, Pseudomonas aeruginosa, Salmonella typhi | [1, 4, 7] |
| Destroy membrane stability | < 20 | P. aeruginosa, Plesiomonas shigelloides, Shigella flexneri B, Staphylococcus aureus | [8–11] | |
| Oxidative damage | 25 | E. coli, P. aeruginosa | [8, 12] | |
| Biomolecule binding | 10 | E. coli | [13] | |
| Silver | Nanoperforation | < 10 | E. coli, Staph. aureus | [14] |
| Destroy membrane stability | 20 | E. coli, nitrifying bacteria | [15–16] | |
| Ionic toxicity | – | E. coli, P. aeruginosa, Staph. aureus | [17–18] | |
| Oxidative damage | < 70 | E. coli, P. aeruginosa, Staph. aureus | [17–19] | |
| Biomolecule binding | < 40 | E. coli, Staph. aureus | [18, 20] | |
| (And many more) | ||||
| Platinum | Destroy membrane stability | < 10 | Staph. aureus, Streptococcus, Klebsiella | [21] |
| Ionic toxicity | – | E. coli, Staph. aureus, B. subtilis, B. cereus | [22] | |
| Oxidative damage | < 20 | E. coli, P. aeruginosa, B. subtilis, Staph. aureus | [23–25] | |
| Biomolecule binding | < 30 | Staph. aureus, S. enteritidis, Listeria monocytogenes | [26–27] | |
| Palladium | Nanoperforation | < 10 | E. coli, Staph. aureus, Fusarium graminearum | [28–29] |
| Destroy membrane stability | < 10 | E. coli, P. aeruginosa, Staph. aureus, Streptococcus, Klebsiella | [21, 30] | |
| Ionic toxicity | – | E. coli, Staph. aureus, B. subtilis, B. cereus | [22] | |
| Oxidative damage | 10 | E. coli, P. aeruginosa, Staph. aureus, F. graminearum | [28–30] |
表选项
1.1 抑菌的胞外机制 1.1.1 纳米穿孔: NMNs可以通过破坏细胞壁及/或细胞膜完整性,导致胞内组分外流,进而引起细菌死亡。在受到NMNs胁迫时,作为细菌屏障组分的细胞壁/细胞膜首当其冲,10 μg/mL的纳米银便使大肠杆菌的细胞膜囊泡溶解,在膜表面形成凹坑甚至孔洞,导致细菌的生理功能受到破坏[31]。纳米颗粒对细胞壁及细胞膜造成的膜穿孔,类似于医学治疗中的纳米刀技术,然而抑菌领域的“纳米刀”特征及机制尚未得到广泛研究[32]。纳米穿孔的抑菌效果与纳米颗粒的尺寸和形貌相关,NMNs的穿孔能力在粒径小于20 nm时表现得更为突出[1]。有研究显示,小尺寸的纳米颗粒由于Hall-Petch效应使得晶内位错阻力极高,因而在界面力学特性上表现出很高的韧度与硬度。当小尺寸NMNs吸附在膜面时,高硬度的颗粒对吸附点位产生持续剪切力,最终对“柔弱”的膜造成损伤[33-34]。
1.1.2 破坏膜稳定性: 细菌的细胞壁与内膜含有肽聚糖、脂多糖(Lipopolysaccharide,LPS)和蛋白质。NMNs在侵入内膜的同时会导致脂多糖和膜蛋白外泄,膜通透性的改变导致胞内物质外渗失控,最终引起细胞死亡。例如,纳米银与含巯基的LPS结合,削弱了LPS基团的相互作用,导致细胞膜通透性增加。小分子修饰的纳米金则可以通过螯合Mg2+,形成外膜小泡破坏细胞膜结构[1]。这一机制与庆大霉素作用机制相似,庆大霉素取代Mg2+产生外膜小泡,破坏细菌细胞膜,最终导致细菌的死亡[35]。在大肠杆菌、铜绿假单胞菌、金黄色葡萄球菌以及克雷伯氏菌中,都发现NMNs暴露后膜通透性改变引起的细菌死亡。NMNs不仅能够螯合Mg2+,还能螯合Ca2+和K+等与膜运输功能相关的离子[15-16]。
此外,由于NMNs金属的正电性,可以与带负电基团的膜发生静电吸附,通过影响膜电位进而改变细菌的生理功能。大肠杆菌暴露于纳米金时,膜电位受到影响,膜上的ATP合成酶活性显著下降,细菌的代谢水平受到明显抑制[13]。改变纳米银的带电性,负电性纳米银则完全丧失了抑菌能力[36],进一步佐证了静电吸附是NMNs抑菌机制之一。研究还指出,纳米颗粒的电性会受限于量子点的运输特性。例如,碳基纳米材料中的碳量子点可以促进电子传递并加快电性转变,这种量子特性也可以导致ROS的产生,从而起到抑制及杀灭细菌的效果[37]。纳米材料引起的表面电荷的改变,不仅会诱导ROS产生,还可能影响细菌的其他生理功能。这些膜电位引发的机制是否会产生协同抑菌效果,目前仍未明晰,值得深入。
1.2 抑菌的胞内机制: 1.2.1 氧化损伤 纳米颗粒本身能够引起严重的氧化损伤达到抑菌的目的。多数研究显示,NMNs具有类氧化酶活性[30]。基于d带理论,NMNs容易与氧结合(如Au-O键,Pt-O键),促进O2的解离,从而催化产生ROS。纳米材料的尺寸效应和表面效应使这种能力得以放大,较之金属离子具有更优异的抑菌性能[38]。不同贵金属纳米材料催化产生ROS的能力各异,这与颗粒的粒径、配合物的结构、纳米颗粒的形貌等多因素相关。一般而言,粒径越小,其诱导产生ROS的能力越强。较之大粒径的纳米银(43 nm),小粒径纳米银(9 nm)对大肠杆菌的抑菌作用要强7倍[18]。Cui等研究显示,当纳米金的粒径较大时(4–6 nm),纳米金的杀菌能力更多地通过影响膜电位及破坏核糖体功能得以表现,并未检测到ROS的改变[13]。但将纳米金的粒径调整到2 nm时,纳米金会诱导ROS的产生,导致胞内代谢失衡,进而表现出广谱抗菌性[8]。有关形貌对NMNs催化ROS产生的报道相对较少,有研究显示立方体纳米钯比八面体纳米钯的类氧化酶性质更强[30],微摩尔浓度的铂钯复合纳米材料即可对链球菌、葡萄球菌、大肠杆菌表现出抑菌效果[21]。
1.2.2 与生物大分子结合 侵入到胞内的NMNs,既可以缓慢氧化溶解出金属离子与生物大分子结合[18],亦可以直接与含磷(P)、硫(S)、巯基生物大分子结合[20],影响正常的细胞分裂及功能表达,导致细菌死亡。较之惰性金属金、铂、钯,纳米银、铜、锌容易溶解出Ag+、Zn2+、Cu2+,通过影响膜电位及络合蛋白质表现出杀菌性能。当NMNs侵入胞内后,NMNs会与胞内负电性的NADH脱氢酶、磷酸酪氨酸多肽、甘露醇、细菌群体感应信号分子等化学分子发生静电吸附;与此同时,NMNs会与DNA分子中的磷结合,磷酸二酯键断裂形成嘧啶二聚体,DNA丧失复制能力;或者与蛋白质中的硫、磷、氨基、羧基、巯基等结合,改变蛋白质三维结构,使其发生不可逆变性[19]。例如,纳米银与胞内的DNA和蛋白质交联,导致自由态DNA分子的凝聚[20]以及氧化损伤修复相关基因与蛋白的缺失[18]。类似的,纳米金可以降低编码核糖体蛋白S10的rpsJ表达,通过影响蛋白质的正常翻译破坏细菌的基本生理功能[13]。铂和钯通过与DNA中的磷形成交叉链接损伤DNA链,进而表现出对金黄色葡萄球菌等革兰氏阳性菌的抑菌作用[22]。值得一提的是,谷胱甘肽是重要的活性氧清除物质,纳米银可以和还原型谷胱甘肽结合,损伤清除ROS的能力,导致ROS累积,增强杀菌效果[39]。
特别需要说明的是,大环内酯类与喹诺酮类抗生素主要通过抑制DNA复制和蛋白质翻译过程抑菌,其作用靶点为DNA螺旋酶的A亚基等。不同于抗生素,NMNs则容易与所有含有磷、硫、氨基、巯基等基团的生物大分子结合[40]。这也从一定程度上解释了NMNs具有广谱抗菌性的原因。
综上,如图 1所示,NMNs通过穿孔损伤破坏细菌的膜结构,同时伴随着一些金属离子的释放;这些释放的金属离子和NMNs在破坏膜电位的同时侵入胞内,催化大量ROS产生;侵入胞内的NMNs还可以与细菌的DNA和蛋白质等结合,由外至内的连续作用最终造成了细菌的死亡。粒径小于20 nm的NMNs更容易发生纳米穿孔和破坏膜稳定性,粒径小于100 nm的NMNs都能够通过氧化损伤和结合生物大分子抑菌[18-20]。值得一提的是,由于革兰氏阳性菌外具有致密的肽聚糖层,NMNs通过纳米穿孔对革兰氏阳性菌造成的损伤较之革兰氏阴性菌要弱[4]。NMNs通过氧化损伤和结合生物大分子抑菌的能力具有广谱抑菌效果。虽然NMNs的形貌对氧化损伤和结合生物大分子的能力影响不大,但是不同形貌的NMNs对菌株的吸附能力和透膜能力存在区别[30],因此,形貌可能也是影响纳米材料抑菌的重要因素之一,但是目前报道较少,值得深入。
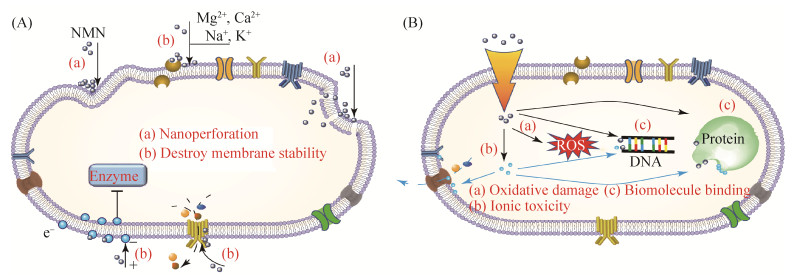 |
| 图 1 NMNs抑菌的分子机制 Figure 1 Antibacterial molecular mechanisms of NMNs. A: extracellular process; B: intracellular process. |
| 图选项 |
2 细菌产生耐性的机制 虽然通常认为,由于NMNs抑菌的无选择性,细菌往往难以对NMNs产生耐性;但是由于微生物本身具备进化完善的胁迫应对机制,例如完善的外排系统[41]、抗氧化系统[18]、特异性吸附蛋白、生物膜[42]等,细菌也可能对NMNs产生耐性(表 2)。有研究显示,大肠杆菌在纳米银的长期暴露下,最小抑菌浓度从3.38 mg/L上升到108 mg/L,提升了近35倍[5]。细菌对抗生素及重金属的抗性已经对人类社会造成了巨大的影响。以此类推,微生物对NMNs的耐受性必将影响其在医药卫生领域的应用。因此,为了系统且全面掌握NMNs应用的可行性,有关NMNs耐性的总结是不可或缺的。
表 2. 细菌产生纳米材料耐性的分子机制 Table 2. Molecular mechanism of bacterial resistance to nanomaterials
| Target bacteria | Nanomaterials | Size/nm | Resistance mechanism | References |
| Pseudomonas aeruginosa | Cd, Zn, Se | 10 | Efflux pump Antioxidant enzymes | [41] |
| CuO | < 50 | Efflux pump | [43] | |
| Ag, GO Ag | < 30, 1–5 layers < 30 | Quorum sensing Biofilm | [44-46] [44] | |
| Escherichia coli | ZnO, Ag, SiO2, ZnO | < 20 | Electrostatic repulsion | [47-49] |
| Ag | 30 | Adsorption protein | [5, 50] | |
| Ag TiO2, Ag Ag | 10 < 60 < 15 | Electrostatic repulsion Antioxidant enzymes Biofilm | [36] [51] [52] | |
| Staphylococcus aureus | Ag | 15 | Electrostatic repulsion | [53] |
| Ag+ | – | Efflux pump | [54] | |
| Salmonella typhimurium | Si, Ag | < 30 | Electrostatic repulsion | [55-56] |
| Enterococcus faecalis | Ag | 10 | Electrostatic repulsion | [57] |
表选项
2.1 膜电位排斥 细菌能够调节膜电位导致膜电性改变,然后通过静电排斥使带正电性的NMNs无法附着在细菌上,从而达到抵抗NMNs的作用。NMNs刺激膜电位的可能原因包括NMNs改变离子通量导致膜电位被动改变,以及结合膜组分物质,如带正电荷的脂类物质,主动应激导致膜电位改变[58]。研究显示,细菌通过膜应激反应机制将D-丙氨酸掺入革兰氏阳性细菌的细胞壁,减少它们的负电荷,从而保护细菌不与带正电的纳米颗粒接触[59]。在革兰氏阴性菌中,膜应激反应参与调节脂蛋白A,进而增加膜组分LPS正电荷[60]。
值得关注的是,细胞膜作为细菌抵御选择压力的天然屏障,不只是在抵抗NMNs上起作用,在对重金属、抗生素的耐性等方面亦发挥重要作用。重金属耐受的细菌可以通过共选择获得对抗生素的耐受,共选择是否同样适用于NMNs则需要未来进行深入探索。
2.2 吸附蛋白 不仅膜电位改变可以影响微生物抗NMNs能力,细菌还进化出了胞外吸附蛋白及胞内蛋白等多种途径抵抗NMNs损伤。在胞外,细菌可以产生鞭毛蛋白及胞外聚合物等,与NMNs吸附引起纳米颗粒团聚,使NMNs不能进入胞内,从而获得NMNs耐性[50]。在纳米银处理下,大肠杆菌和铜绿假单胞菌可以产生粘性鞭毛蛋白吸附纳米颗粒,使其团聚从而无法进入胞内,最终使细菌产生NMNs耐性[5]。在胞内,细菌可以产生吸附蛋白,与金属离子耦合,形成胞内隔离状态。诸如sil操纵子中的silG基因可以调控胞内隔离蛋白形成,使细菌形成金属耐性[61]。Siguero等[62]发现,保加利亚乳杆菌能够利用硫氧蛋白还原酶和谷胱甘肽氧化酶,将硒纳米颗粒(CS-SeNPs)转化为SeCys2和SeMet等有机硒化合物。
2.3 外排泵系统 毒性颗粒的外排也是细菌获得NMNs耐性的重要途径。外排泵系统的核心是针对特定物质调节膜通透性。外排泵是细菌造成多药耐药和泛耐药的主要原因之一。最近研究发现,一些金属和金属离子的外排泵能够共选择NMNs耐性。外排泵的基本组成包括3部分,即内膜转运蛋白、外膜通道蛋白和融合蛋白。内膜转运蛋白决定了底物的特异性。在NMNs外排过程中,内膜转运蛋白会识别出纳米颗粒和毒性离子,然后通过通道蛋白和融合蛋白将NMNs从胞内向胞外转移[43]。
目前金属外排泵系统主要涉及RND家族、MFS超家族和ABC家族。例如,沙门氏菌中的银耐性基因,则分属于调控银结合蛋白(SilRS与SILE家族)与RND家族和ABC家族的外排泵系统[56]。金黄色葡萄球菌可以通过P型外排泵(CopA、CopZ和NorB)获得银离子耐性[54]。值得一提的是,重金属耐性与抗生素抗性之间存在共选择作用,那么NMNs与重金属及抗生素之间是否也存在共选择,目前尚未见系统研究,值得深入。
2.4 激活抗氧化酶 当细菌长期暴露在NMNs中,细菌为了抵抗ROS损伤会调节氧化应激酶的表达从而获得NMNs耐性。Gou等[51]发现在纳米银暴露下,细菌上调了超氧化物歧化酶相关基因(如soxR、oxyR、sodA、sodB和sodC),使细胞免受氧化损伤。此外,长期的NMNs暴露可以引起DNA结构的损伤,从而激活DNA损伤修复机制。在纳米银抑菌的相关报道中,cueR、cusS、katE和recA等基因突变造成了细菌敏感性变化,cueR和cusS编码银离子外排泵相关蛋白,katE和recA则分别负责编码过氧化氢酶和修复DNA氧化损伤[18]。
2.5 群体效应 除了细胞个体对NMNs的抵抗,细菌还能够通过群体活动获得NMNs耐性。群体感应指的是细菌通过分泌、接受、响应信号完成胞外蛋白合成、生物膜形成及基因水平转移等群体行为[63]。研究表明,铜绿假单胞菌可以通过吩嗪等色素抵抗银和抗生素等抑菌剂,这些色素由群体感应调控,通过群体合作,使得群体获得抵抗NMNs毒害作用的能力[64]。同时,群体感应调控脓青素合成,脓青素可以将银离子还原为生物利用度较低的零价银,保护细菌免受银介导的抑菌性。值得关注的是,Zhang等[46]报道了铜绿单胞菌群体感应具有自适应进化的功能,短期内纳米材料可以干扰群体感应分泌信号分子及合成胞外蛋白,在长期低浓度胁迫中可以提升信号分泌与蛋白合成能力,消除吸附性纳米材料引起的短期毒害作用。但是对于非物理性损伤,微生物是否依旧可以发生自适应进化,有待进一步深入研究。
生物膜作为微生物典型的群体空间呈现形式,已经被证明对纳米颗粒的长期暴露具有抵抗力[41]。例如,Choi等[52]报道了纳米银对生物膜的最低杀菌浓度(38 mg/L)高于浮游细菌的最低杀菌浓度(10 mg/L)。同时,Jing等[65]研究表明,氧化铈纳米颗粒被捕获在荧光假单胞菌和污垢分枝杆菌生物膜的表面,而生物膜最深处的细菌细胞不受影响。
综上所述,细菌在暴露于NMNs时能够产生NMNs耐性,抵抗其抑菌性。如图 2所示,这一过程主要包含3个途径:第一是阻止NMNs的吸附和入侵,例如产生鞭毛蛋白以及改变膜的电性等;第二是消除NMNs的胞内毒性,这一过程涉及激活抗氧化酶以及毒性离子/纳米颗粒的外排等;第三是细菌通过群体感应及生物膜等群体效应吸附和还原NMNs,降低NMNs的抑菌能力进而获得NMNs耐性。值得关注的是,耐性的产生不与NMNs的抑菌机制相对应,小粒径的NMNs更容易破坏膜稳定性,但细菌的耐性不论NMNs粒径在1 nm还是30 nm都可以通过膜功能改变产生。相比于抑菌机制,有关NMNs耐性机制的研究更少,对于耐性机制的分析需要研究者们更积极的探索。
 |
| 图 2 细菌对NMNs产生耐性的分子机制 Figure 2 Molecular mechanism of bacterial resistance to NMNs. A: cellular resistance; B: group resistance. |
| 图选项 |
3 展望 随着NMNs研究和开发的深入,大量使用NMNs在不久将来已成必然。抑菌和耐性一直是人类与微生物对弈的战场,NMNs作为抑菌领域的新型武器,在以下几个方向仍值得进一步深入:(1) NMNs耐性与细菌其他耐受性的交叉作用。共选择抗性与交叉抗性机制是产生抗生素抗性菌株的重要原因,NMNs耐性对共选择机制的影响以及对交叉抗性的贡献是在NMNs泛用背景下值得重视的问题。(2) NMNs耐性的可遗传性与可传播性。细菌对NMNs的耐性如何稳定遗传,如何在不同种群间传播是评估NMNs生态环境风险所必须解决的难题。(3)环境微生物NMNs暴露下的表现。与实验室研究相比,极少有研究讨论环境细菌在NMNs暴露下的响应机制,分析现有实验室研究是否同样适用于环境模式,是更好地开发及应用NMNs的前提。
References
| [1] | Zhao YY, Tian Y, Cui Y, Liu WW, Ma WS, Jiang XY. Small molecule-capped gold nanoparticles as potent antibacterial agents that target gram-negative bacteria. Journal of the American Chemical Society, 2010, 132(35): 12349-12356. DOI:10.1021/ja1028843 |
| [2] | Wang ZM, Chen LN, Huang CS, Huang YK, Jia NQ. Albumin-mediated platinum nanocrystals for in vivo enhanced computed tomography imaging. Journal of Materials Chemistry B, 2017, 5(19): 3498-3510. DOI:10.1039/C7TB00561J |
| [3] | Martínez JL, Coque TM, Baquero F. What is a resistance gene? Ranking risk in resistomes. Nature Reviews Microbiology, 2015, 13(2): 116-123. DOI:10.1038/nrmicro3399 |
| [4] | Lima E, Guerra R, Lara V, Guzman A. Gold nanoparticles as efficient antimicrobial agents for Escherichia coli and Salmonella typhi. Chemistry Central Journal, 2013, 7(1): 11. DOI:10.1186/1752-153X-7-11 |
| [5] | Paná?ek A, Kvítek L, Smékalová M, Ve?e?ová R, Kolá? M, R?derová M, Dy?ka F, ?ebela M, Prucek R, Tomanec O, Zbo?il R. Bacterial resistance to silver nanoparticles and how to overcome it. Nature Nanotechnology, 2018, 13(1): 65-71. DOI:10.1038/s41565-017-0013-y |
| [6] | Sharifi S, Behzadi S, Laurent S, Forrest ML, Stroeve P, Mahmoudi M. Toxicity of nanomaterials. Chemical Society Reviews, 2012, 41(6): 2323-2343. DOI:10.1039/C1CS15188F |
| [7] | Zhou Y, Kong Y, Kundu S, Cirillo JD, Liang H. Antibacterial activities of gold and silver nanoparticles against Escherichia coli and bacillus calmette-guérin. Journal of Nanobiotechnology, 2012, 10: 19. DOI:10.1186/1477-3155-10-19 |
| [8] | Zheng KY, Setyawati MI, Leong DT, Xie JP. Antimicrobial gold nanoclusters. ACS Nano, 2017, 11(7): 6904-6910. DOI:10.1021/acsnano.7b02035 |
| [9] | Rattanata N, Klaynongsruang S, Leelayuwat C, Limpaiboon T, Lulitanond A, Boonsiri P, Chio-Srichan S, Soontaranon S, Rugmai S, Daduang J. Gallic acid conjugated with gold nanoparticles:antibacterial activity and mechanism of action on foodborne pathogens. International Journal of Nanomedicine, 2016, 11: 3347-3356. DOI:10.2147/IJN.S109795 |
| [10] | Hur YE, Park Y. Vancomycin-functionalized gold and silver nanoparticles as an antibacterial nanoplatform against methicillin-resistant Staphylococcus aureus. Journal of Nanoscience and Nanotechnology, 2016, 16(6): 6393-6399. DOI:10.1166/jnn.2016.12393 |
| [11] | Li XN, Robinson SM, Gupta A, Saha K, Jiang ZW, Moyano DF, Sahar A, Riley MA, Rotello VM. Functional gold nanoparticles as potent antimicrobial agents against multi-drug-resistant bacteria. ACS Nano, 2014, 8(10): 10682-10686. DOI:10.1021/nn5042625 |
| [12] | Khan FU, Chen YM, Khan NU, Ahmad A, Tahir K, Khan ZU, Khan AU, Khan SU, Raza M, Wan PY. Visible light inactivation of E. coli, cytotoxicity and ROS determination of biochemically capped gold nanoparticles. Microbial Pathogenesis, 2017, 107: 419-424. DOI:10.1016/j.micpath.2017.04.024 |
| [13] | Cui Y, Zhao YY, Tian Y, Zhang W, Lü XY, Jiang XY. The molecular mechanism of action of bactericidal gold nanoparticles on Escherichia coli. Biomaterials, 2012, 33(7): 2327-2333. DOI:10.1016/j.biomaterials.2011.11.057 |
| [14] | Martínez-Casta?ón GA, Ni?o-Martínez N, Martínez-Gutierrez F, Martínez-Mendoza JR, Ruiz F. Synthesis and antibacterial activity of silver nanoparticles with different sizes. Journal of Nanoparticle Research, 2008, 10(8): 1343-1348. DOI:10.1007/s11051-008-9428-6 |
| [15] | Chernousova S, Epple M. Silver as antibacterial agent:ion, nanoparticle, and metal. Angewandte Chemie International Edition, 2013, 52(6): 1636-1653. DOI:10.1002/anie.201205923 |
| [16] | Choi O, Deng KK, Kim NJ, Ross L Jr, Surampalli RY, Hu ZQ. The inhibitory effects of silver nanoparticles, silver ions, and silver chloride colloids on microbial growth. Water Research, 2008, 42(12): 3066-3074. DOI:10.1016/j.watres.2008.02.021 |
| [17] | Greulich C, Braun D, Peetsch A, Diendorf J, Siebers B, Epple M, K?ller M. The toxic effect of silver ions and silver nanoparticles towards bacteria and human cells occurs in the same concentration range. RSC Advances, 2012, 2(17): 6981-6987. DOI:10.1039/c2ra20684f |
| [18] | Ivask A, ElBadawy A, Kaweeteerawat C, Boren D, Fischer H, Ji ZX, Chang CH, Liu R, Tolaymat T, Telesca D, Zink JI, Cohen Y, Holden PA, Godwin HA. Toxicity mechanisms in Escherichia coli vary for silver nanoparticles and differ from ionic silver. ACS Nano, 2014, 8(1): 374-386. DOI:10.1021/nn4044047 |
| [19] | Sharma VK, Yngard RA, Lin Y. Silver nanoparticles:green synthesis and their antimicrobial activities. Advances in Colloid and Interface Science, 2009, 145(1/2): 83-96. |
| [20] | Feng QL, Wu J, Chen GQ, Cui FZ, Kim TN, Kim JO. A mechanistic study of the antibacterial effect of silver ions on Escherichia coli and Staphylococcus aureus. Journal of Biomedical Materials Research, 2000, 52(4): 662-668. DOI:10.1002/1097-4636(20001215)52:4<662::AID-JBM10>3.0.CO;2-3 |
| [21] | Boomi P, Prabu HG, Mathiyarasu J. Synthesis, characterization and antibacterial activity of polyaniline/Pt-Pd nanocomposite. European Journal of Medicinal Chemistry, 2014, 72: 18-25. DOI:10.1016/j.ejmech.2013.09.049 |
| [22] | Kovala-Demertzi D, Demertzis MA, Filiou E, Pantazaki AA, Yadav PN, Miller JR, Zheng YF, Kyriakidis DA. Platinum(II) and palladium(II) complexes with 2-acetyl pyridine 4N-ethyl thiosemicarbazone able to overcome the cis-platin resistance. Structure, antibacterial activity and DNA strand breakage. Biometals, 2003, 16(3): 411-418. DOI:10.1023/A:1022543718598 |
| [23] | Cai SF, Jia XH, Han QS, Yan XY, Yang R, Wang C. Porous Pt/Ag nanoparticles with excellent multifunctional enzyme mimic activities and antibacterial effects. Nano Research, 2017, 10(6): 2056-2069. DOI:10.1007/s12274-016-1395-0 |
| [24] | Tahir K, Nazir S, Ahmad A, Li BS, Khan AU, Khan ZUH, Khan FU, Khan QU, Khan A, Rahman AU. Facile and green synthesis of phytochemicals capped platinum nanoparticles and in vitro their superior antibacterial activity. Journal of Photochemistry and Photobiology B:Biology, 2017, 166: 246-251. DOI:10.1016/j.jphotobiol.2016.12.016 |
| [25] | K?ller M, Bellova P, Javid SM, Motemani Y, Khare C, Sengstock C, Tschulik K, Schildhauer TA, Ludwig A. Antibacterial activity of microstructured sacrificial anode thin films by combination of silver with platinum group elements (platinum, palladium, iridium). Materials Science and Engineering:C, 2017, 74: 536-541. DOI:10.1016/j.msec.2016.12.075 |
| [26] | Nejdl L, Kudr J, Moulick A, Hegerova D, Ruttkay-Nedecky B, Gumulec J, Cihalova K, Smerkova K, Dostalova S, Krizkova S, Novotna M, Kopel P, Adam V. Platinum nanoparticles induce damage to DNA and inhibit DNA replication. PLoS One, 2017, 12(7): e0180798. DOI:10.1371/journal.pone.0180798 |
| [27] | Sawosz E, Chwalibog A, Szeliga J, Sawosz F, Grodzik M, Rupiewicz M, Niemiec T, Kacprzyk K. Visualization of gold and platinum nanoparticles interacting with Salmonella enteritidis and Listeria monocytogenes. International Journal of Nanomedicine, 2010, 5: 631-637. |
| [28] | Adams CP, Walker KA, Obare SO, Docherty KM. Size-dependent antimicrobial effects of novel palladium nanoparticles. PLoS One, 2014, 9(1): e85981. DOI:10.1371/journal.pone.0085981 |
| [29] | Zhang JT, Liu Y, Li Q, Zhang XP, Shang JK. Antifungal activity and mechanism of palladium-modified nitrogen-doped titanium oxide photocatalyst on agricultural pathogenic fungi Fusarium graminearum. ACS Applied Materials & Interfaces, 2013, 5(21): 10953-10959. |
| [30] | Fang G, Li WF, Shen XM, Perez-Aguilar JM, Chong Y, Gao XF, Chai ZF, Chen CY, Ge CC, Zhou RH. Differential Pd-nanocrystal facets demonstrate distinct antibacterial activity against gram-positive and gram-negative bacteria. Nature Communications, 2018, 9(1): 129. DOI:10.1038/s41467-017-02502-3 |
| [31] | Sondi I, Salopek-Sondi B. Silver nanoparticles as antimicrobial agent:a case study on E. coli as a model for gram-negative bacteria. Journal of Colloid and Interface Science, 2004, 275(1): 177-182. DOI:10.1016/j.jcis.2004.02.012 |
| [32] | Morones JR, Elechiguerra JL, Camacho A, Holt K, Kouri JB, Ramirez JT, Yacaman MJ. The bactericidal effect of silver nanoparticles. Nanotechnology, 2005, 16(10): 2346-2353. DOI:10.1088/0957-4484/16/10/059 |
| [33] | Korin N, Kanapathipillai M, Matthews BD, Crescente M, Brill A, Mammoto T, Ghosh K, Jurek S, Bencherif SA, Bhatta D, Coskun AU, Feldman CL, Wagner DD, Ingber DE. Shear-activated nanotherapeutics for drug targeting to obstructed blood vessels. Science, 2012, 337(6095): 738-742. DOI:10.1126/science.1217815 |
| [34] | Zhu T, Li J. Ultra-strength materials. Progress in Materials Science, 2010, 55(7): 710-757. DOI:10.1016/j.pmatsci.2010.04.001 |
| [35] | Cox G, Stogios PJ, Savchenko A, Wright GD. Structural and molecular basis for resistance to aminoglycoside antibiotics by the adenylyltransferase ANT(2")-Ia. mBio, 2015, 6(1): e02180-14. |
| [36] | Abbaszadegan A, Ghahramani Y, Gholami A, Hemmateenejad B, Dorostkar S, Nabavizadeh M, Sharghi H. The effect of charge at the surface of silver nanoparticles on antimicrobial activity against gram-positive and gram-negative bacteria:a preliminary study. Journal of Nanomaterials, 2015, 2015: 720654. |
| [37] | Courtney CM, Goodman SM, Nagy TA, Levy M, Bhusal P, Madinger NE, Detweiler CS, Nagpal P, Chatterjee A. Potentiating antibiotics in drug-resistant clinical isolates via stimuli-activated superoxide generation. Science Advances, 2017, 3(10): e1701776. DOI:10.1126/sciadv.1701776 |
| [38] | Stone D, Ben-Shahar Y, Waiskopf N, Banin U. The metal type governs photocatalytic reactive oxygen species formation by semiconductor-metal hybrid nanoparticles. Chemcatchem, 2018, 10(22): 5119-5123. DOI:10.1002/cctc.201801306 |
| [39] | Tang SH, Zheng J. Antibacterial activity of silver nanoparticles:structural effects. Advanced Healthcare Materials, 2018, 7(13): 1701503. DOI:10.1002/adhm.201701503 |
| [40] | Gliga AR, Skoglund S, Wallinder IO, Fadeel B, Karlsson HL. Size-dependent cytotoxicity of silver nanoparticles in human lung cells:the role of cellular uptake, agglomeration and Ag release. Particle and Fibre Toxicology, 2014, 11(1): 11. DOI:10.1186/1743-8977-11-11 |
| [41] | Yang Y, Mathieu JM, Chattopadhyay S, Miller JT, Wu TP, Shibata T, Guo WH, Alvarez PJJ. Defense mechanisms of Pseudomonas aeruginosa PAO1 against quantum dots and their released heavy metals. ACS Nano, 2012, 6(7): 6091-6098. DOI:10.1021/nn3011619 |
| [42] | Shang ZY, van Nostrand JD, Zhou JZ, Liu Y. The effects of silver nanoparticles on intact wastewater biofilms. Frontiers in Microbiology, 2015, 6: 680. |
| [43] | Guo JH, Gao SH, Lu J, Bond PL, Verstraete W, Yuan ZG. Copper oxide nanoparticles induce lysogenic bacteriophage and metal-resistance genes in Pseudomonas aeruginosa PAO1. ACS Applied Materials & Interfaces, 2017, 9(27): 22298-22307. |
| [44] | Ellis DH, Maurer-Gardner EI, Sulentic CEW, Hussain SM. Silver nanoparticle antibacterial efficacy and resistance development in key bacterial species. Biomedical Physics & Engineering Express, 2018, 5(1): 015013. DOI:10.1088/2057-1976/aad5a7 |
| [45] | Muller M, Merrett ND. Pyocyanin production by Pseudomonas aeruginosa confers resistance to ionic silver. Antimicrobial Agents and Chemotherapy, 2014, 58(9): 5492-5499. DOI:10.1128/AAC.03069-14 |
| [46] | Zhang YY, Li N, Wang MZ, Feng HJ, Xu C, Xu F. Interference of non-lethal levels of graphene oxide in biofilm formation and adaptive response of quorum sensing in bacteria. Environmental Science:Nano, 2018, 5(12): 2809-2818. DOI:10.1039/C8EN00680F |
| [47] | Zhang RY, Carlsson F, Edman M, Hummelg?rd M, Jonsson BG, Bylund D, Olin H. Escherichia coli bacteria develop adaptive resistance to antibacterial ZnO nanoparticles. Advanced Biosystems, 2018, 2(5): 1800019. DOI:10.1002/adbi.201800019 |
| [48] | Butler KS, Peeler DJ, Casey BJ, Dair BJ, Elespuru RK. Silver nanoparticles:correlating nanoparticle size and cellular uptake with genotoxicity. Mutagenesis, 2015, 30(4): 577-591. DOI:10.1093/mutage/gev020 |
| [49] | Wang Q, Kang FX, Gao YZ, Mao XW, Hu XJ. Sequestration of nanoparticles by an EPS matrix reduces the particle-specific bactericidal activity. Scientific Reports, 2016, 6: 21379. DOI:10.1038/srep21379 |
| [50] | Faghihzadeh F, Anaya NM, Astudillo-Castro C, Oyanedel-Craver V. Kinetic, metabolic and macromolecular response of bacteria to chronic nanoparticle exposure in continuous culture. Environmental Science:Nano, 2018, 5(6): 1386-1396. DOI:10.1039/C8EN00325D |
| [51] | Gou N, Onnis-Hayden A, Gu AZ. Mechanistic toxicity assessment of nanomaterials by whole-cell-array stress genes expression analysis. Environmental Science & Technology, 2010, 44(15): 5964-5970. |
| [52] | Choi O, Yu CP, Fernández GE, Hu ZQ. Interactions of nanosilver with Escherichia coli cells in planktonic and biofilm cultures. Water Research, 2010, 44(20): 6095-6103. DOI:10.1016/j.watres.2010.06.069 |
| [53] | Wang SG, Lawson R, Ray PC, Yu HT. Toxic effects of gold nanoparticles on Salmonella typhimurium bacteria. Toxicology and Industrial Health, 2011, 27(6): 547-554. DOI:10.1177/0748233710393395 |
| [54] | George S, Tay I, Phue WH, Gardner H, Sukumaran B. Enhancing the bioavailability of silver through nanotechnology approaches could overcome efflux pump mediated silver resistance in methicillin resistant Staphylococcus aureus. Journal of Biomedical Nanotechnology, 2019, 15(11): 2216-2228. DOI:10.1166/jbn.2019.2858 |
| [55] | Siemer S, Westmeier D, Barz M, Eckrich J, Wünsch D, Seckert C, Thyssen C, Schilling O, Hasenberg M, Pang CF, Docter D, Knauer SK, Stauber RH, Strieth S. Biomolecule-corona formation confers resistance of bacteria to nanoparticle-induced killing:implications for the design of improved nanoantibiotics. Biomaterials, 2019, 192: 551-559. DOI:10.1016/j.biomaterials.2018.11.028 |
| [56] | Silver S. Bacterial silver resistance:molecular biology and uses and misuses of silver compounds. FEMS Microbiology Reviews, 2003, 27(2/3): 341-353. |
| [57] | Nabavizadeh M, Abbaszadegan A, Gholami A, Kadkhoda Z, Mirhadi H, Ghasemi Y, Safari A, Hemmateenejad B, Dorostkar S, Sharghi H. Antibiofilm efficacy of positively charged imidazolium-based silver nanoparticles in Enterococcus faecalis using quantitative real-time PCR. Jundishapur Journal of Microbiology, 2017, 10(10): e55616. |
| [58] | Lee DYD, Galera-Laporta L, Bialecka-Fornal M, Moon EC, Shen ZX, Briggs SP, Garcia-Ojalvo J, Süel GM. Magnesium flux modulates ribosomes to increase bacterial survival. Cell, 2019, 177(2): 352-360. DOI:10.1016/j.cell.2019.01.042 |
| [59] | Jordan S, Hutchings MI, Mascher T. Cell envelope stress response in gram-positive bacteria. FEMS Microbiology Reviews, 2008, 32(1): 107-146. DOI:10.1111/j.1574-6976.2007.00091.x |
| [60] | Tzeng YL, Ambrose KD, Zughaier S, Zhou XL, Miller YK, Shafer WM, Stephens DS. Cationic antimicrobial peptide resistance in Neisseria meningitidis. Journal of Bacteriology, 2005, 187(15): 5387-5396. DOI:10.1128/JB.187.15.5387-5396.2005 |
| [61] | Randall CP, Gupta A, Jackson N, Busse D, O'Neill AJ. Silver resistance in gram-negative bacteria:a dissection of endogenous and exogenous mechanisms. Journal of Antimicrobial Chemotherapy, 2015, 70(4): 1037-1046. |
| [62] | Palomo-Siguero M, Gutierrez AM, Pérez-Conde C, Madrid Y. Effect of selenite and selenium nanoparticles on lactic bacteria:a multi-analytical study. Microchemical Journal, 2016, 126: 488-495. DOI:10.1016/j.microc.2016.01.010 |
| [63] | Dieltjens L, Appermans K, Lissens M, Lories B, Kim W, van der Eycken EV, Foster KR, Steenackers HP. Inhibiting bacterial cooperation is an evolutionarily robust anti-biofilm strategy. Nature Communications, 2020, 11(1): 107. DOI:10.1038/s41467-019-13660-x |
| [64] | H?iby N, Bjarnsholt T, Givskov M, Molin S, Ciofu O. Antibiotic resistance of bacterial biofilms. International Journal of Antimicrobial Agents, 2010, 35(4): 322-332. DOI:10.1016/j.ijantimicag.2009.12.011 |
| [65] | Jing HY, Mezgebe B, Hassan AA, Sahle-Demessie E, Sorial GA, Bennett-Stamper C. Experimental and modeling studies of sorption of ceria nanoparticle on microbial biofilms. Bioresource Technology, 2014, 161: 109-117. DOI:10.1016/j.biortech.2014.03.015 |
