马振报1,2, 潘晔君1,2, 许钦怡1,2, 黄炜铭1,2, 林思茹1,2, 郭慧中1,2, 曾东平1,2, 熊文广1,2, 曾振灵1,2


1. 华南农业大学, 广东省兽药研制与安全评价重点实验室, 广东 广州 510642;
2. 国家兽医微生物耐药性风险评估实验室, 广东 广州 510642
收稿日期:2020-03-25;修回日期:2020-06-13;网络出版日期:2020-07-16
基金项目:十三五国家重点研发计划(2018YFD0500300);华南农业大学大学生创新训练项目(201910564457)
*通信作者:曾振灵, E-mail:zlzeng@scau.edu.cn.
摘要:[目的] 调查市售畜禽肉类中大肠杆菌的耐药状况和blaCTX-M基因的流行病学特征。[方法] 采集广州市不同区域零售市场和超市畜禽肉类样品进行大肠杆菌的分离,通过基因phoA扩增和测序进行大肠杆菌鉴定,采用琼脂扩散法和微量肉汤稀释法测定药物敏感性,通过PCR扩增检测blaCTX-M基因,对blaCTX-M阳性大肠杆菌进行全基因组测序。[结果] 从323份市售畜禽肉样品中分离获得大肠杆菌241株;药物敏感性结果表明大肠杆菌对氨苄西林(63.07%)、多西环素(47.72%)和复方新诺明(43.15%)耐药率较高;blaCTX-M基因检出率为3.32%(n=8),其中4株携带blaCTX-M-14,3株携带blaCTX-M-65,1株携带blaCTX-M-55;8株产CTX-M大肠杆菌可分为4种不同的ST型,且携带多种耐药基因和毒力基因。[结论] 市售畜禽肉中大肠杆菌污染严重。产CTX-M酶大肠杆菌均为多重耐药菌株,且blaCTX-M基因主要以水平传播方式在大肠杆菌中传播,需要加强监测。
关键词:CTX-M酶大肠杆菌流行病学畜禽肉
Epidemiological investigation of CTX-M-producing Escherichia coli from retail livestock and chicken meat
Zhenbao Ma1,2, Yejun Pan1,2, Qinyi Xu1,2, Weiming Huang1,2, Siru Lin1,2, Huizhong Guo1,2, Dongping Zeng1,2, Wenguang Xiong1,2, Zhenling Zeng1,2


1. Guangdong Provincial Key Laboratory of Veterinary Pharmaceutics Development and Safety Evaluation, South China Agriculture University, Guangzhou 510642, Guangdong Province, China;
2. National Risk Assessment Laboratory for Antimicrobial Resistance of Animal Original Bacteria, Guangzhou 510642, Guangdong Province, China
Received: 25 March 2020; Revised: 13 June 2020; Published online: 16 July 2020
*Corresponding author: Zhenling Zeng, E-mail:zlzeng@scau.edu.cn.
Foundation item: Supported by the National Key R&D Program of China (2018YFD0500300) and by the Training Program of Innovation for College Student of South China Agricultural University (201910564457)
Abstract: [Objective] To investigate antibiotic resistance and epidemiological characteristics of blaCTX-M gene of Escherichia coli from retail livestock and chicken meat in Guangzhou. [Methods] E. coli was isolated from retail livestock and chicken meat samples in different regional retail markets and fresh supermarket in Guangzhou. Those isolates were identified by the gene phoA and sequencing. Drug susceptibility was determined by agar diffusion and broth microdilution method. The blaCTX-M gene was detected using PCR amplification. Whole genome sequencing was performed in all blaCTX-M-positive E. coli. [Results] A total of 241 strains were isolated from 323 meat samples. The drug susceptibility test shows that those strains were highly resistant to ampicillin (63.07%), doxycycline (47.72%) and sulfamethoxazole/trimethoprim (43.15%). The prevalence of blaCTX-M gene was 3.32% (n=8), which contained 4 blaCTX-M-14-positive strains, 3 blaCTX-M-65-positive strains and 1 blaCTX-M-55-positive strain. Eight CTX-M-producing E. coli were divided into four distinct ST types, which carried multiple resistance genes and virulence genes. [Conclusion] The contamination of E. coli was serious in retail meat. All CTX-M-producing E. coli were multi-resistant strains, and the dissemination of blaCTX gene was mainly due to horizontal transfer, which needs further surveillance.
Keywords: CTX-M enzymeEscherichia coliepidemiologylivestock and chicken meat
产超广谱β-内酰胺酶(ESBLs)能够水解青霉素和第三代头孢菌素的β-内酰胺环,从而介导大肠杆菌等革兰氏阴性菌对β-内酰胺类抗生素耐药。自blaCTX-M基因在德国首次发现以来,CTX-M酶已成为ESBLs中流行最广的酶,且CTX-M已呈现全球性流行传播,对临床治疗造成不容忽视的影响[1-3]。CTX-M亚型种类丰富,迄今为止,NCBI数据库中已多达214种CTX-M亚型(www.ncbi.nlm.nih.gov/pathogens/)。根据氨基酸序列差异可将CTX-M分为5个群,即CTX-1G、CTX-2G、CTX-8G、CTX-9G和CTX-25G,其中CTX-1G和CTX-9G是当前世界最流行的CTX-M群,其中CTX-M-14和CTX-M-15亚型已成为当前全球最主要的基因型[3-4]。
动物源食品作为食物链中重要的组成部分,增加了人与动物的接触机会,加大了ESBLs通过食物链传播至人的风险。相对于人源和动物源CTX-M的研究,我国有关动物性食品源产CTX-M大肠杆菌的报道目前还比较少。Ye等[5]对广州市零售生肉、蔬菜等食品源肠杆菌中ESBLs基因调查结果表明,肠杆菌blaCTX-M基因(68.1%)已成为仅次于blaTEM基因(81.9%)的ESBLs基因。Xie等[6]对深圳市零售肉类中产CTX-M大肠杆菌研究表明,55株耐头孢噻肟大肠杆菌中37株检测到blaCTX-M基因,其中blaCTX-M-55基因为主要可转移的基因型。但目前有关市售畜禽肉源大肠杆菌中的blaCTX-M基因的流行病学研究还比较少。因此,本文针对广州市市售肉类中大肠杆菌的耐药状况和blaCTX-M基因在大肠杆菌中的流行与分布特征进行研究,为肉类食品耐药性风险评估和科学防控提供依据。
1 材料和方法 1.1 材料 1.1.1 样品来源: 2018年9月至2019年5月,对广州市天河区、海珠区和越秀区等5个农贸市场和1个生鲜超市共采集323份动物肌肉样品,包括165份猪肉、96份鸡肉、57份牛肉和5份羊肉,仅在海珠区的一个摊位采集到羊肉样品,具体采样信息见表 1。
表 1. 广州市零售市场采样信息表 Table 1. Information of samples collected from retail meat in Guangzhou
| Date | Location | Type | Pork | Beef | Chicken | Mutton | Total |
| 2018.09.28 | Tianhe district | Retail market | 30 | 13 | 17 | 0 | 60 |
| 2018.10.19 | Haizhu district | Retail market | 25 | 10 | 13 | 5 | 53 |
| 2018.11.14 | Yuexiu district | Retail market | 20 | 14 | 16 | 0 | 50 |
| 2019.04.21 | Liwan district | Retail market | 30 | 0 | 30 | 0 | 60 |
| 2019.05.01 | Baiyun district | Retail market | 30 | 10 | 10 | 0 | 50 |
| 2019.05.01 | Huangpu district | Supermarket | 30 | 10 | 10 | 0 | 50 |
| Total | - | - | 165 | 57 | 96 | 5 | 323 |
表选项
1.1.2 常用药品: 氨苄西林、阿莫西林、头孢噻呋、头孢噻肟、美罗培南、新霉素、安普霉素、黏菌素、环丙沙星、甲氧苄啶、磺胺甲噁唑购自大连美伦生物技术有限公司;头孢他啶、氟苯尼考、庆大霉素、阿米卡星、恩诺沙星、多西环素及替加环素购自生工生物工程(上海)股份有限公司。
1.1.3 培养基: 伊红美蓝琼脂培养基(Eosin- methylene Blue Medium),LB肉汤(luria-bertani broth)和LB琼脂培养基(luria-bertani agar)均购于山东海博生物有限公司;麦康凯琼脂培养基、水解酪蛋白琼脂培养基(mueller-hinton agar)、水解酪蛋白肉汤(MH broth)均购自广东环凯微生物科技有限公司。
1.1.4 常用试剂: TaKaRa rTaq、dNTPs Mixture及2000 DL marker均购自宝生物工程(大连)有限公司;乙二胺四乙酸、Tris碱、氯化钠、氢氧化钠、冰醋酸、丙三醇和无水乙醇等购自广州化学试剂厂。细菌全基因组提取试剂盒购于广州碧尧德生物科技有限公司。
1.2 采样及细菌分离 根据采样地点的具体情况进行采样,零售市场和生鲜超市每个摊位采集3-5份畜禽肉,分别放入无菌密封袋中,样品采集后将其置于低温盒中运送至实验室。采用无菌操作的方法取2 g肉接种到10 mL无菌EP管中,加入5 mL灭菌LB肉汤,置于37 ℃恒温摇床培养14 h,将培养后菌液划线接麦康凯琼脂平板,培养12-14 h后挑取红色单菌落,划线接种于伊红美蓝琼脂平板,培养14-16 h后,挑取纯化后的单菌落接种于LB琼脂平板上以便进行菌种鉴定、菌株保存及模板提取等后续实验。大肠杆菌工程菌J53和标准菌ATCC 25922由本实验室保存。
1.3 大肠杆菌blaCTX-M基因的检测 1.3.1 细菌DNA模板制备: 加热煮沸法提取DNA,将大肠杆菌在LB平板上培养12 h,取少量细菌加入含0.5 mL 1×TE的1.5 mL EP管中混匀并置于恒温金属浴中103 ℃加热10 min,随后冰浴5 min,12000 r/min离心3 min,取上清为模板,于-20 ℃保存备用。
1.3.2 引物的合成: 根据相关文献,选择合适的大肠杆菌鉴定引物phoA、blaCTX-M-1G和blaCTX-M-9G,引物序列见表 2,引物合成由北京擎科生物科技有限公司完成。
表 2. phoA和blaCTX-M基因引物序列 Table 2. Primer sequence of phoA and blaCTX-M gene
| Primer | Primer sequence (5′→3′) | Target length/bp | References |
| blaCTX-M-1G | F:CTTCCAGAATAAGGAATCCC | 946 | [7] |
| R:CGTCTAAGGCGATAAACAAA | |||
| blaCTX-M-9G | F:ATGATGACTCAGAGCATTCG | 902 | [7] |
| R:TGATGCCGTATTGGGAGTTTG | |||
| phoA | F:CGATTCTGGAAATGGCAAAAG | 720 | [8] |
| R:CGTGATCAGCGGTGACTATGAC | |||
| F: forward primer; R: reverse primer. | |||
表选项
1.3.3 PCR扩增: PCR反应25 μL体系:10× rTaq buffer 2.5 μL,dNTPs mixture 2.0 μL,上、下游引物各0.5 μL,rTaq酶0.125 μL,模板1 μL,加超纯水至25 μL。PCR反应程序见表 3,取5 μL的PCR扩增产物经1.2%琼脂糖凝胶电泳用凝胶成像系统拍照分析,对具有阳性条带的PCR产物进行测序,并将测序结果提呈NCBI进行序列比对确认。
表 3. PCR扩增程序 Table 3. Amplification procedure of PCR
| Primer | Amplification procedure |
| blaCTX-M-1G | 94 ℃×5 min+(94 ℃×45 s+52 ℃×45 s+72 ℃×45 s)×30+72 ℃×10 min |
| blaCTX-M-9G | 94 ℃×5 min+(94 ℃×45 s+60 ℃×45 s+72 ℃×45 s)×30+72 ℃×10 min |
| phoA | 94 ℃×5 min+(94 ℃×45 s+58 ℃×45 s+72 ℃×45 s)×30+72 ℃×10 min |
表选项
1.4 药物敏感性测定 大肠杆菌药物敏感性测定按照美国临床和实验室标准化委员会(CLSI)标准推荐的方法进行。受试药物中除黏菌素采样微量肉汤稀释法测定最小抑菌浓度,其余药物均采样琼脂扩散法测定。最小抑菌浓度值按CLSI-2018和CLSI-VET01所规定的耐药(resistant,R)折点值范围判断结果。
1.5 全基因组测序及分析 按照全基因组提取试剂盒说明书进行提取,将菌液收集至EP管,加入P1溶液300 μL,混匀后加入300 μL P2溶液,上下颠倒5-10次,加入300 μL P3溶液300 μL,上下颠倒5-10次后室温反应5 min,加入300 μL无水乙醇,涡旋混匀,取上清液过吸附柱,10000×g离心2 min,弃去离心液,洗涤液700 μL洗2次,10000×g离心2 min,弃去洗涤液,10000×g离心2 min后加入100 μL灭菌超纯水,转移至新的1.5 mL EP管中,做好标签,-80 ℃保存。将样品送至北京诺禾致源生物有限公司进行二代测序。将组装好的全基因组数据放入CGE数据库(https://cge.cbs.dtu.dk/)进行多位点序列分型(MLST)、耐药基因和毒力基因分析。
1.6 接合转移实验 接合转移实验采用肉汤接合法进行,将携带blaCTX-M阳性基因的大肠杆菌作供体菌,工程菌E. coli J53作受体菌,分别接种在2 mL LB肉汤试管中,在37 ℃、180 r/min摇床培养4 h至生长对数期,然后将供体菌与受体菌进行1︰1混合,37 ℃静置培养12 h,收集菌液涂布于200 μg/mL叠氮钠+2 μg/mL头孢噻肟双药板,16-20 h后挑取单菌落在双药板验证接合子,并PCR确证blaCTX-M基因。
2 结果和分析 2.1 大肠杆菌分离及blaCTX-M基因检测 本实验共从广州市6个不同区采集的323份畜禽肉样中分离鉴定大肠杆菌241株(分离率为75.23%),其中猪肉样分离120株(分离率为72.73%),鸡肉样分离70株(分离率为72.92%),牛肉样分离47株(分离率为82.46%)和羊肉样4株(分离率为80.00%)。PCR检测结果表明,8株大肠杆菌中检测到blaCTX-M,检出率为3.32%,其中4株为blaCTX-M-14,3株为blaCTX-M-65,1株为blaCTX-M-55。
2.2 药物敏感性测定 药物敏感性结果表明,241株大肠杆菌对17种受试药物表现出的耐药状况差异较大。其中氨苄西林耐药率最高,达到63.07%,其次是多西环素和复方新诺明的耐药率分别为47.72%和43.15%,其他药物的耐药率处于较低水平。值得注意的是,8株(3.32%)大肠杆菌具有头孢噻肟耐药表型,而美罗培南、阿米卡星和替加环素未出现耐药株(图 1)。
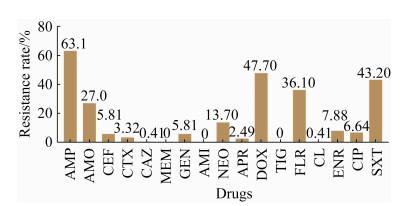 |
| 图 1 241株市售畜禽肉源大肠杆菌药物敏感性结果 Figure 1 Drug susceptibility test of 241 E. coli from retail livestock and chicken meat. AMP: ampcillin; AMO: amoxicillin; CEF: ceftiofur; CTX: cefotaxime; CAZ: ceftazidime; MEM: meropenem; GEN: gentamycin; AMI: amikacin; NEO: neomycin; APR: apramycin; DOX: doxycycline; TIG: tigecycline; FLR: florfenicol; CL: colistin; ENR: enrofloxacin; CIP: ciprofloxacin; SXT: sulfamethoxazole/trimethoprim. |
| 图选项 |
2.3 blaCTX-M阳性大肠杆菌特征 针对blaCTX-M阳性大肠杆菌特征研究(表 4)表明,8株blaCTX-M阳性大肠杆菌中7株来自鸡肉样品,1株来自猪肉样品,且仅在海珠区和荔湾区市场样品中分离得到。MLST分型结果表明,7株大肠杆菌获得ST分型,其中4株为ST1737型,2株为ST1838型,1株为ST616型;1株为新ST型,与ST101亲缘关系最近,仅在fumC基因上有一个碱基的差异。值得注意的是,ST1737仅出现在海珠区市场不同摊位的鸡肉中,ST1838也出现在荔湾区市场不同摊位的鸡肉样品中。8株blaCTX-M阳性大肠杆菌为多重耐药菌株,均对氨苄西林、阿莫西林、头孢噻呋、头孢噻肟和复方新诺明耐药。8株blaCTX-M阳性大肠杆菌携带的耐药基因丰富多样,包括介导人医临床和兽医重要的抗菌药耐药基因,如β-内酰胺类耐药基因(blaTEM、blaOXA)、磷霉素耐药基因fosA3、利福平耐药基因arr-3和氟苯尼考耐药基因floR。不同ST型大肠杆菌耐药基因和毒力基因携带的数量和种类差异较大,其中ST1838携带的耐药基因数目最多,有15种耐药基因,其中氨基糖苷类耐药基因7个(aadA1、aadA2b、aac(3)-IV、aph(3'')-Ib、aph(3')-Ia、aph(4)-Ia和aph(6)-Id)。ST1737携带的耐药基因数目最少,有7种耐药基因。值得注意的是,ST1838携带有更多的毒力基因,包括编码大肠杆菌补体基因iss、编码铁载体受体蛋白基因iroN、编码温度敏感血凝素基因tsh和ABC转运体蛋白基因mchBCF等毒力基因,且iss、iroN和tsh位于同一个ColV质粒相似片段上。而ST1737和ST616仅携带编码长极菌毛蛋白的lpfA基因(表 4)。接合转移试验结果表明,8株大肠杆菌blaCTX-M基因均可成功转移至工程菌E.coli J53。
表 4. blaCTX-M阳性大肠杆菌特征 Table 4. Characterization of blaCTX-M-positive E. coli
| Strains | Source | Location | ST type | Antibiotic phenotype | Resistance genes | Virulence genes |
| F18101 | Chicken | Haizhu district | 1737 | AMP/AMO/CEF/CTX/DOX/SXT | aadA5 blaCTX-M-14 fosA3 mdf(A) tet(A) dfrA17 sul2 | lpfA |
| F18105 | Chicken | Haizhu district | 1737 | AMP/AMO/CEF/CTX/DOX/SXT | aadA5 blaCTX-M-14 fosA3 mdf(A) tet(A) dfrA17 sul2 | lpfA |
| F18106 | Chicken | Haizhu district | 1737 | AMP/AMO/CEF/CTX/DOX/SXT | aadA5 blaCTX-M-14 fosA3 mdf(A) tet(A) dfrA17 sul2 | lpfA |
| F18107 | Chicken | Haizhu district | 1737 | AMP/AMO/CEF/CTX/DOX/SXT | aadA5 blaCTX-M-14 fosA3 mdf(A) tet(A) dfrA17 sul2 | lpfA |
| F19015 | Pork | Liwan district | NEW | AMP/AMO/CEF/CTX/DOX/FLR/SXT | aadA1 aadA2 blaCTX-M-55 cmlA1 floR mdf(A) tet(B) tet(M) sul2 dfrA12 | - |
| F19042 | Chicken | Liwan district | 1838 | AMP/AMO/CEF/CTX/GEN/NEO/APR/DOX/FLR/SXT | aadA1 aadA2b aac(3)-Ⅳ aph(3'')-Ib aph(3')-Ia aph(4)-Ia aph(6)-Id blaOXA-10 blaCTX-M-65 cmlA1 floR qnrS1 mdf(A) tet(A) sul3 | gad iroN iss mchB mchC mchF mcmA tsh |
| F19046 | Chicken | Liwan district | 1838 | AMP/AMO/CEF/CTX/GEN/NEO/APR/DOX/FLR/SXT | aadA1 aadA2b aac(3)-Ⅳ aph(3'')-Ib aph(3')-Ia aph(4)-Ia aph(6)-Id blaOXA-10 blaCTX-M-65 cmlA1 floR qnrS1 mdf(A) tet(A) sul3 | gad iroN iss mchB mchC mchF mcmA tsh |
| F19050 | Chicken | Liwan district | 616 | AMP/AMO/CEF/CTX/DOX/FLR/SXT | aadA1 aac(6')-Ib-cr blaTEM-1B blaOXA-1 blaCTX-M-65 qnrS2 arr-3 catB3 floR mdf(A) mph(A) tet(A) sul1 dfrA1 | lpfA |
| AMP: ampcillin; AMO: amoxicillin; CEF: ceftiofur; CTX: cefotaxime; GEN: gentamycin; NEO: neomycin; APR: apramycin; DOX: doxycycline; FLR: florfenicol; SXT: sulfamethoxazole/trimethoprim. | ||||||
表选项
3 讨论 大肠杆菌、克雷伯菌等肠杆菌作为自然界最广泛存在机会致病菌,大肠杆菌被作为研究CTX-M成功的模型[3]。市售肉常被大肠杆菌、沙门氏菌等病原菌污染,其污染的来源可能来自于以下几个方面:(1)畜禽在屠宰前已被病原菌感染;(2)在屠宰、储存、运输和销售过程与污染物接触造成的污染;(3)暴露在空气中的肉由于空气中微生物沉降粘附于肉类表面。本文中由于无法确定农贸市场畜禽肉具体来源及运输和销售等过程是否有污染,因此无法追踪到耐药基因的源头。本文市售畜禽肉中大肠杆菌的分离率为75.73%,表明市售畜禽肉中大肠杆菌的污染已经比较严重,需要引起人们的注意。同时该实验结果与前人对市售肉大肠杆菌的分离率结果相似[9-11]。大肠杆菌药物敏感性结果表明对氨苄西林、氟苯尼考、多西环素和复方新诺明耐药率超过40%,对阿米卡星、安普霉素、黏菌素等药物的耐药率较低,这与阿米卡星禁用于食品动物、黏菌素禁用于抗菌促生长添加剂有关。该结果与周雪艳等[9]分离的大肠杆菌耐药性水平相似,但低于先前广州市市售肉分离的大肠杆菌耐药性水平[12-13]。
CTX-M-1和CTX-M-9群是目前国内最主要的流行CTX-M酶,因此本研究主要检查这两种CTX-M基因群,本文共检测到8株阳性菌株,检出率为3.32%,其中4株CTX-M-14为3株CTX-M-65和1株CTX-M-55。与曾丽[14]对食品源等不同来源CTX-M基因亚型分布结果一致,但检出率低于姚旭对2015-2016年广州市零售肉中CTX-M基因的检出率[12]。同时,该实验结果与我国动物源大肠杆菌CTX-M酶主要流行亚型分布相一致[15]。这暗示市售畜禽肉大肠杆菌CTX-M基因与动物源大肠杆菌有密切关系。进一步研究结果发现,8株产CTX-M酶大肠杆菌均为多重耐药菌,其中7株从鸡肉样品中分离,这表明鸡肉中产CTX-M酶大肠杆菌更为常见。此外,8株菌种存在4种不同的ST型,即ST1737 (n=4)、ST1838 (n=2)、ST616 (n=1)和新ST型(n=1),且4株ST1737来源于海珠区交易市场2个不同摊位鸡肉样品分离,该结果表明水平传播是主要介导blaCTX-M基因在交易市场的畜禽肉类食品中的传播方式,但部分农贸市场仍以克隆传播,但不同摊位之间是否存在相互传播需要进一步研究。前人研究表明blaCTX-M基因大肠杆菌常与fosA3、oqxAB等介导人医临床重要抗菌药物耐药的基因共存,给临床治疗带来巨大挑战[6, 13]。本研究中8株产CTX-M大肠杆菌也携带临床重要耐药基因,如ST1737携带有fosA3基因,ST616携带arr-3基因,ST1838携带blaOXA-10。不同ST型大肠杆菌中的耐药基因和毒力因子种类和数目差异较大,其中ST1838携带的耐药基因和毒力基因数目最多,对药物的耐药谱更广。携带有lpfA基因可增加大肠杆菌的粘附能力,在ST1838中gad、iroN和iss基因共定位在ColV质粒片段上,增加了大肠杆菌的致病力和在宿主体内的生存力,这可能是大肠杆菌生存环境的选择作用造成的。8株大肠杆菌均可将blaCTX-M基因成功转移至受体工程菌,表明可接合型质粒在blaCTX-M基因的传播和扩散方面起重要作用,该结果与blaCTX-M基因食品动物和动物性食品中的研究结果一致[6, 16]。
4 结论 广州市零售畜禽肉中大肠杆菌污染严重,对氨苄西林耐药率超过70%,但对大部分药物耐药率仍处在较低水平,且blaCTX-M基因的检出率为3.32%。值得注意的是,产CTX-M酶大肠杆菌均为多重耐药菌株,且blaCTX-M基因均可接合转移,且菌株之间存在水平传播和克隆传播。
References
| [1] | Liu BG, Li YC, Wang BY, Bai M, Miao MS, Xu EP. Research progress of CTX-M type extended-spectrum β-lactamases. Journal of Henan Agricultural Sciences, 2019, 48(12): 1-7. (in Chinese) 刘保光, 栗俞程, 汪保英, 白明, 苗明三, 许二平. CTX-M型超广谱β-内酰胺酶研究进展. 河南农业科学, 2019, 48(12): 1-7. |
| [2] | Nordmann P, Naas T, Poirel L. Global spread of carbapenemase-producing Enterobacteriaceae. Emerging Infectious Diseases, 2011, 17(10): 1791-1798. DOI:10.3201/eid1710.110655 |
| [3] | Bevan DR, Jones AM, Hawkey PM. Global epidemiology of CTX-M β-lactamases:temporal and geographical shifts in genotype. Journal of Antimicrobial Chemotherapy, 2017, 72(8): 2145-2155. DOI:10.1093/jac/dkx146 |
| [4] | Cantón R, González-Alba JM, Galán JC. CTX-M enzymes:Origin and diffusion. Frontiers in Microbiology, 2012, 3: 110. |
| [5] | Ye QH, Wu QP, Zhang SH, Zhang JM, Yang GZ, Wang J, Xue L, Chen MT. Characterization of extended-spectrum β-lactamase-producing Enterobacteriaceae from retail food in China. Frontiers in Microbiology, 2018, 9: 1709. DOI:10.3389/fmicb.2018.01709 |
| [6] | Xie MM, Lin DC, Chen KC, Chan EWC, Yao W, Chen S. Molecular characterization of Escherichia coli strains isolated from retail meat that harbor blaCTX-M and fosA3 genes. Antimicrobial Agents and Chemotherapy, 2016, 60(4): 2450-2455. DOI:10.1128/AAC.03101-15 |
| [7] | Liu JH, Wei SY, Ma JY, Zeng ZL, Lü DH, Yang GX, Chen ZL. Detection and characterisation of CTX-M and CMY-2β-actamases among Escherichia coli isolates from farm animals in Guangdong Province of China. International Journal of Antimicrobial Agents, 2007, 29(5): 576-581. DOI:10.1016/j.ijantimicag.2006.12.015 |
| [8] | Hu QH, Tu J, Han XG, Zhu YY, Ding C, Yu SQ. Development of multiplex PCR assay for rapid detection of Riemerella anatipestifer, Escherichia coli, and Salmonella enterica simultaneously from ducks. Journal of Microbiological Methods, 2011, 81(1): 64-69. |
| [9] | Zhou XY, Liu YZ, Lu JX, Liu JL, Li Z. Identification and antimicrobial susceptibility of Escherichia coli from fresh pork. Chinese Journal of Health Laboratory Technology, 2014, 24(14): 2116-2119. (in Chinese) 周雪雁, 刘翊中, 卢建雄, 刘俊林, 李倬. 市售鲜猪肉中大肠杆菌的分离鉴定及耐药性分析. 中国卫生检验杂志, 2014, 24(14): 2116-2119. |
| [10] | He XM, Guo LJ, Wu GY, Cheng L, Li B, Luo Y, Zhou LK, Qing LS. Antibiotic and disinfectant resistance of Escherichia coli isolated from pork in Sichuan Province. Food Science, 2014, 35(7): 132-137. (in Chinese) 何雪梅, 郭莉娟, 吴国艳, 程琳, 李蓓, 罗燕, 邹立扣, 卿玲杉. 猪肉源大肠杆菌对抗生素及消毒剂的耐药性. 食品科学, 2014, 35(7): 132-137. |
| [11] | 于庆华. 不同动物源食品中大肠杆菌分离鉴定与耐药性分析. 饲料研究, 2019, 42(2): 50-52. |
| [12] | 姚旭.市售肉菜产ESBLs和碳青霉烯酶肠杆菌的分子流行病学研究.华南农业大学硕士学位论文, 2016. |
| [13] | Wang J, Zhi CP, Chen XJ, Guo ZW, Liu WL, Luo J, Huang XY, Zeng L, Huang JW, Xia YB, Yi MY, Huang T, Zeng ZL, Liu JH. Characterization of oqxAB in Escherichia coli isolates from animals, retail meat, and human patients in Guangzhou, China. Frontiers in Microbiology, 2017, 8: 1982. DOI:10.3389/fmicb.2017.01982 |
| [14] | 曾丽.不同来源大肠杆菌ESBLs基因分子流行病学研究.华南农业大学硕士学位论文, 2016. |
| [15] | Zhang DD, Wang HN. Prevalence and variation of CTX-M extended spectrum β-lactamase in animal origin in China. Sichuan Animal & Veterinary Sciences, 2018, 45(2): 40-41, 43. (in Chinese) 张冬冬, 王红宁. 我国动物源CTX-M型超广谱β内酰胺酶的流行及变异. 四川畜牧兽医, 2018, 45(2): 40-41, 43. |
| [16] | Liu BT, Li L, Fang LX, Sun J, Liao XP, Yang QE, Huang T, Liu YH. Characterization of plasmids carrying oqxAB in bla (CTX-M)-negative Escherichia coli isolates from food-producing animals. Microbial Drug Resistance, 2014, 20(6): 641-650. DOI:10.1089/mdr.2014.0022 |
