王志林1, 董震1,2,3, 武珊珊1, 敬文宪1, 陈启伟1, 尚佑军1, 王琬凝1, 刘永生1

 , 兰喜1
, 兰喜1

1. 中国农业科学院兰州兽医研究所, 家畜疫病病原生物学国家重点实验室, 甘肃 兰州 730046;
2. 华南农业大学动物医学院, 广东省重大临床动物疾病预防控制重点实验室, 广东 广州 510642;
3. 甘肃省定西市安定区畜牧兽医局, 甘肃 定西 743000
收稿日期:2019-11-07;修回日期:2020-01-16;网络出版日期:2020-03-09
基金项目:国家重点研发计划(2016YFD0500703,2018YFD0502006)
*通信作者:刘永生, Tel:+86-9318343721, E-mail:liuyongsheng@caas.cn;
兰喜, Tel:+86-9318342685, E-mail:lanxi@caas.cn.
摘要:[目的] 本研究旨在利用基因敲除技术构建的鼠伤寒沙门氏菌hcp及vgrg基因缺失株体外接种真核上皮细胞和巨噬细胞,并以其亲本株作为对照,以研究Hcp及VgrG在该菌粘附、侵入上皮细胞及抗吞噬过程中所发挥的作用。[方法] 通过优化Red同源重组系统操作过程中各个条件,建立一套快速敲除鼠伤寒沙门氏菌Ⅵ型分泌系统相关基因的操作系统,成功构建鼠伤寒沙门氏菌CVCC541的hcp及vgrg单基因缺失株、双基因缺失株及三基因缺失株,并用Hela细胞接种试验和菌落计数试验,评估不同菌株的粘附和侵袭能力;用小鼠巨噬细胞RAW 264.7接种试验,评估不同菌株的抗吞噬能力。[结果] 与亲本株CVCC541粘附侵袭Hela细胞相比,基因缺失株CVCC541Δvgrg、CVCC541Δhcp2Δvgrg和CVCC541Δhcp1Δhcp2Δhcp3的粘附率分别为17.17%±2.1%、14.73%±2.5%和82%±3.7%;CVCC541Δvgrg、CVCC541Δhcp2Δvgrg和CVCC541Δhcp1Δhcp2Δhcp3的侵袭率分别为7.05%±1.05%、6.21%±1.35%和87%±3.25%;与亲本株CVCC541在小鼠巨噬细胞RAW 264.7中的存活相比,基因缺失株CVCC541Δvgrg、CVCC541Δhcp2Δvgrg和CVCC541Δhcp1Δhcp2Δhcp3的存活率分别为15.67%±2.9%、14.47%±1.87%和56.12%±3.48%。[结论] 鼠伤寒沙门氏菌Ⅵ型分泌系统VgrG和Hcp对该菌入侵细胞和抗吞噬方面具有重要作用,该研究为鼠伤寒沙门氏菌通过六型分泌系统与宿主细胞相互作用的机制研究奠定了基础。
关键词:鼠伤寒沙门氏菌Ⅵ型分泌系统(T6SS)溶血素共调节蛋白(Hcp)缬氨酸甘氨酸重复蛋白G(VgrG)Red同源重组系统
Knockout and functional characteristics of CVCC541 VI secretion system related genes in Salmonella typhimurium
Zhilin Wang1, Zhen Dong1,2,3, Shanshan Wu1, Wenxian Jing1, Qiwei Chen1, Youjun Shang1, Wanning Wang1, Yongsheng Liu1

 , Xi Lan1
, Xi Lan1

1. State Key Laboratory of Veterinary Etiological Biology, Lanzhou Veterinary Research Institute, Chinese Academy of Agricultural Sciences, Lanzhou 730046, Gansu Province, China;
2. College of Veterinary Medicine, Guangdong Provincial Key Laboratory of Prevention and Control for Severe Clinical Animal Diseases, South China Agricultural University, Guangzhou 510642, Guangdong Province, China;
3. Animal Husbandry and Veterinary Bureau, Dingxi 743000, Gansu Province, China
Received: 7 November 2019; Revised: 16 January 2020; Published online: 9 March 2020
*Corresponding author: Yongsheng Liu, Tel:+86-9318343721, E-mail:liuyongsheng@caas.cn;
Xi Lan, Tel:+86-9318342685, E-mail:lanxi@caas.cn.
Foundation item: Supported by the National Key Research and Development Program (2016YFD0500703, 2018YFD0502006)
Abstract: [Objective] The aim of this study was to inoculate eukaryotic epithelial cells and macrophages in vitro using the hcp and vgrg gene deletion strains constructed by gene knockout technology, and to use their parental strains as a control group, to study the role of Hcp and VgrG genes in the process of adhesioning and invading epithelial cell and anti-phagocytosis. [Methods] We optimized the conditions in the operation of Red homologous recombination system, and established an operating system that rapidly knockout genes related to the type VI secretion system of Salmonella typhimurium, and successfully constructed CVCC541 single deletion strain, double deletion strain, and triple deletion strain, and Hela cell inoculation test and colony count test were used to evaluate the adhesion and invasion ability of different strains; the macrophage RAW 264.7 inoculation test was used to evaluate the anti-phagocytic ability of different strains. [Results] Compared with the CVCC541 strain, the adhesion rates of CVCC541Δvgrg, CVCC541Δhcp2Δvgrg, and CVCC541Δhcp1Δhcp2Δhc3 were 16.17%±2.1%, 14.73%±2.5% and 82%±3.7%, respectively; the invasive rates of CVCC541Δvgrg, CVCC541Δhcp2Δvgrg, and CVCC541Δhcp1Δhcp2Δhcp3 were 7.05%±1.05%, 6.21%±1.35% and 87%±3.25%, respectively. The survival rates of CVCC541Δvgrg, CVCC541Δhcp2Δvgrg and CVCC541Δhcp1Δhcp2Δhcp3 were 15.67%±2.9%, 14.47%±1.87% and 56.12%±3.48%, respectively. [Conclusion] Salmonella typhimurium type VI secretion system VgrG and Hcp played an important role in the process invasioning host cells and anti-phagocytosis. This work created the conditions for the research mechanism of interaction between Salmonella typhimurium and host cells through type VI secretion system secretory system.
Keywords: Salmonella typhimuriumtype VI secretion systemhemolysin co-regulatory protein (Hcp)valine glycine repeat protein G(VgrG)Red homologous recombination system
鼠伤寒沙门氏菌是肠杆菌科、沙门氏菌属的一种重要肠道致病菌,其宿主广泛,能通过污染的水和食物等传播媒介感染包括人在内的多种动物,从而引起包括腹泻、伤寒等一系列的临床症状[1]。革兰氏阴性细菌中存在几种不同类型的蛋白质分泌系统,包括T1SS、T2SS、T3SS、T4SS、T5SS、T6SS[2-3],其功能是将蛋白质转移到其胞外环境,或转移到相邻的原核或真核细胞中[4]。生物信息学研究表明高保守性细菌Ⅵ型分泌系统(Type Ⅵ secretion system,T6SS)在大约25%已测序的革兰氏阴性菌中广泛分布[5],是一种结构和机制类似于细胞内膜附着、收缩的噬菌体尾部的细胞器装置[6],并通过该装置促进细菌之间以及细菌和宿主细胞之间的相互作用,发挥多种生物学效应[4-5, 7-8]。类似于T4噬菌体尾管蛋白gp19/gp5的溶血素共调节蛋白(Hcp),可形成堆叠环状的六聚体结构蛋白,效应蛋白可以通过该管环状结构转运出去[9-10];缬氨酸甘氨酸重复蛋白G (VgrG)蛋白的N端结构域与噬菌体T4尾部刺突蛋白gp5/gp27高度同源[4, 11],可以聚集成一个三聚体位于Hcp管道末端并与其相连,Hcp-VgrG组成噬菌体“注射器”样基本结构[9, 12]。此外,圆锥形的针头蛋白脯氨酸-丙氨酸-丙氨酸-精氨酸重复蛋白(PAAR)位于Hcp-VgrG结构的末端,发挥稳定“注射器”结构装置的功能,更利于效应蛋白从细菌表面延伸到真核宿主细胞膜表面,并从“注射器“管道直接释放到宿主细胞质内,从而入侵宿主细胞内并逃避免疫监视[13]。研究发现鼠伤寒沙门氏菌具有存在于毒力岛6 (SPI-6)上的T6SS,由至少13个保守核心蛋白组成,鼠伤寒沙门氏菌存在有3种Hcp样蛋白和一个VgrG样蛋白[14-16],分别由位于毒力岛6 (Salmonella pathogenicity island,SPI-6)上的STM14_0324 (Hcp1)、STM14_0327 (Hcp2)和STM14_0338的VgrG (VgrS)以及位于毒力岛6之外的STM14_3785 (Hcp3)编码,这些蛋白既是分泌蛋白也是结构蛋白[14, 17-18]。
Red同源重组系统[19]是利用λ噬菌体的3个重组相关的基因exo、bet和gam,分别编码Exo (λ核酸外切酶)、Beta和Gam蛋白的一种外源性DNA片段和细菌染色体或质粒基因同源重组的基因改造技术[20]。由于不同菌株生理特征差异较大,该技术在不同革兰氏阴性菌的基因敲除应用中存在差别。在此项研究中,我们成功优化red同源重组系统操作过程中各个条件,成功构建了鼠伤寒沙门氏菌CVCC541 Ⅵ型分泌系统的hcp及vgrg基因的多个组合缺失株,并进行了CVCC541Δvgrg、CVCC541Δhcp2Δvgrg、CVCC541Δhcp1Δhcp2Δhcp3菌株体外粘附侵袭Hela细胞能力和抗小鼠巨噬细胞RAW 264.7吞噬能力的实验研究。
1 材料和方法 1.1 材料
1.1.1 主要试剂及器材: Fetal bovine serum (FBS)、培养液DMEM、0.25% Trypsin-EDTA (胰酶)购于美国Gibco公司;胶回收试剂盒、PCR产物纯化试剂盒、高保真酶PrimeSTAR? Max DNA Polymerase和DL 5000 DNA Marker购于大连TaKaRa公司;L-(+)-阿拉伯糖购于上海生工公司;Dpn1酶购于美国Promega公司;counting kit-8 cck-8细胞增殖试剂盒、青霉素-链霉素混合液(双抗)、氨苄西林(Ampicillin,Amp)、庆大霉素(Gentamicin,Gent)、卡那霉素(Kanamycin, Kna)购自北京索莱宝科技有限公司;Corning 24孔细胞培养板、Corning 96细胞培养孔板购自Corning公司;PBS,LB液体和固体培养基均为实验室配制;台式高速离心机购于Beckman公司;凝胶电泳仪、PCR仪、凝胶成像仪、酶标仪、MicroPulser电击仪及电击杯均购于美国Bio-Rad公司;电热恒温水浴槽购于上海一恒科技有限公司;二氧化碳温箱购于美国Thermo Scientific公司;紫外分光光度计购于美国Backman公司;Countstar自动细胞计数仪购于美国Countstar公司。
1.1.2 菌株、质粒及细胞: 菌株鼠伤寒沙门氏菌CVCC541购于中国兽药监察所(北京)。实验中Red同源重组系统质粒pKD46、pKD4和pCP20,以及Hela细胞和小鼠巨噬细胞RAW 264.7均为本实验室保存,本研究构建的单基因缺失菌株为CVCC541Δhcp1、CVCC541Δhcp2、CVCC541Δhcp3、CVCC541Δvgrg;双基因缺失株CVCC541Δhcp1Δhcp2、CVCC541Δhcp1Δhcp3、CVCC541Δhcp2Δhcp3、CVCC541Δhcp1Δvgrg、CVCC541Δhcp2Δvgrg、CVCC541Δhcp3Δvgrg以及三基因缺失株CVCC541Δhcp1Δhcp2Δhcp3。
1.1.3 引物设计: 本研究以NCBI公布的鼠伤寒沙门氏菌14028s的全基因组序列(GenBank序列号:CP001363.1)为参考序列,设计了目的基因打靶片段引物和鉴定引物。选取hcp2基因序列前后各56 bp和vgrg基因序列前后各45 bp分别作为同源打靶片段,并分别在同源打靶片段的3′端加上了从pKD4质粒上扩增卡那霉素抗性基因的上下游引物序列作为打靶片段引物,本研究参考了文献[18]中Hcp1和Hcp3的引物序列,另外,还设计了GC含量适宜的碱基序列作为目的基因的鉴定引物,所有引物序列如表 1所示(qc为目的基因敲除引物,jd为目的基因的鉴定引物)。所有引物送到西安擎科泽西生物科技有限责任公司合成。
表 1. 本研究中设计的引物 Table 1. Primers designed in this study
| Primers | Sequences (5′→3′) |
| Hcp2-qcF | ACCTAATAAAGCAGATAAATCAGGGCTTAATTTAGGTAGTTAAAAGGATAGTAGATGTGTAGGCTGGAGCTGCTTC |
| Hcp2-qcR | TTTAAAATCAAAATAATAAATCCGGCCAGATATAAATCTGGCCGGAAAAACAGCCGCATATGAATATCCTCCTTAG |
| Vgrg-qcF | CGGTGAGTCTATTTATTTTAATCCGGTATTAAAGGAGTCACTACCGTGTAGGCTGGAGCTGCTTC |
| Vgrg-qcR | ACCTTTACCAATCAGTTGCATGACATCGCTGGTATGTAACATCAGCATATGAATATCCTCCTTAG |
| Hcp2-jdF | AGGCGTGTCGAGAAGTAAA |
| Hcp2-jdR | TGTGATTCGAGGTCAGGTAA |
| Vgrg-jdF | AACCGGATGAAATTATCGTGTCT |
| Vgrg-jdR | TTTATCATCAAAAGGACGGGGACT |
| Kan-F | CGGTGCCCTGAATGAACTGC |
| Kan-R | CGGCCACAGTCGATGAATCC |
| pKD46-F | TAGTCCTTTTCCTTTGAGTTGTGG |
| pKD46-R | GGTGCCTGATGGTCGGAGA |
表选项
1.2 鼠伤寒沙门氏菌Ⅵ型分泌系统hcp及vgrg基因缺失株构建
1.2.1 Red同源重组系统操作步骤: (1) 质粒pKD46经电转进入鼠伤寒沙门氏菌CVCC541;(2)各个线性打靶片段的构建(以pKD4为模板,扩增的PCR产物为携带FRT位点的卡那霉素抗性基因序列及目的基因3′端或5′端外56 bp或45 bp的同源片段;(3)将线性打靶片段经电转转入能表达Red重组酶的鼠伤寒沙门氏菌CVCC541菌中;(4)筛选卡那霉素抗性的阳性体(一般单基因敲除阳性率极高,达到百分之八十以上,双基因缺失与三基因缺失阳性率较低,本实验采取Kan-F和Kan-R与敲除目的基因的鉴定引物交叉组合鉴定及测序鉴定;(5)携带能表达FLP重组酶的PCP20质粒消除卡那霉素抗性基因;(6)鉴定引物筛选敲除目的基因的阳性重组体。
1.2.2 线性打靶片段构建: 以质粒pKD4为模板,用相应打靶片段引物和高保真酶进行PCR扩增。利用PCR产物纯化试剂盒对各PCR产物进行分别纯化回收,回收产物经Dpn1酶37 ℃单酶切6-8 h,酶切产物经胶回收试剂盒回收用于电转化。
1.2.3 CVCC541感受态的制备以及质粒pKD46的电转化: (1) 37 ℃过夜培养需要敲除的靶细菌,次日取该菌液1 mL加入含有100 mL LB液体培养基的锥形瓶中,置摇床37 ℃、200 r/min培养4-6 h,使菌液OD600达到0.6-0.8。(2)将菌液立刻置冰水浴中冷却30 min,然后将100 mL的菌液平分为两管,4 ℃、5500 r/min离心5 min,弃上清,再用预冷的10%甘油洗涤3次后,加入300 μL预冷的10%甘油重悬细菌,将重悬细菌分装于预冷的1.5 mL EP管中,每管50 μL,立即置-80 ℃保存待用。(3)将2 μL pKD46质粒(80-200 ng/μL)加入制备好的CVCC541感受态细胞悬液内,混匀,转移至预冷的0.2 cm电击杯中,用Bio-Rad电击仪进行电击,电击条件为200 Ω,25 μF,电压为2.3 kV,电击时间为2.5 ms,电击后迅速加入1 mL LB液体培养液并混匀,将该菌液置于30 ℃温箱静置培养至少1 h,然后均匀涂布在含50 μg/mL氨苄青霉素的LB平皿上,于30 ℃温箱培养过夜后,挑取单个菌落于含有50 μg/mL氨苄青霉素的LB液体培养基中培养,并用引物pKD46-F/R进行菌液PCR鉴定。将鉴定为阳性的CVCC541/pKD46菌液于60%的甘油中保存备用。
1.2.4 CVCC541/pKD46感受态细菌的制备以及抗性片段的电转化: (1) CVCC541/pKD46菌液按1:100转接到10 mL的LB中,并以1:1000加入50 mg/mL氨苄青霉素,置摇床30 ℃、200 r/min培养过夜。次日,将菌液按1:100转接到100 mL的LB液体培养液中,同时按1:1000加入50 mg/mL氨苄青霉素,30 ℃、200 r/min摇振培养至菌液OD600≈0.2时,按1:100加入3 mol/mL的L-阿拉伯糖诱导至菌液OD600≈0.6-0.8 (诱导过程至少1 h),然后按1.2.3所述步骤(2)制备CVCC541/pKD46感受态细胞。(2)取2 μL构建的线性打靶片段加入至CVCC541/pKD46感受态细胞并混匀,然后置于预冷的电击杯内,在电转仪电转,电击后加入1 mL LB液体培养液重悬。将菌液置于37 ℃温箱静置培养至少1 h后,在含有50 μg/mL卡那霉素抗性的LB平皿上均匀涂板,37 ℃过夜培养,选取长出的单菌落于LB液体培养基后,用交叉鉴定引物(kan-F/目的鉴定引物R,kan-R/目的鉴定引物F)进行菌液PCR扩增鉴定,阳性的PCR产物送往西安擎科泽西生物科技有限责任公司测序,测序结果含有卡那抗性基因片段而不含有目的基因的菌株为具有卡那抗性的基因缺失菌株。
1.2.5 质粒pKD46消除: 将1.2.4获得的基因缺失菌株在42 ℃、200 r/min条件下培养过夜后,涂于含有50 μg/mL氨苄青霉素的LB平皿上37 ℃培养过夜,将挑取的单菌落接种于LB液体培养基中,然后分别涂布含有50 μg/mL卡那霉素和50 μg/mL氨苄青霉素的LB平板,在37 ℃温箱培养,能在卡那霉素平皿上生长而不能在氨苄青霉素平皿上生长的菌株为消除了pKD46质粒且具有卡那抗性的基因缺失菌株。
1.2.6 卡那霉素抗性基因及质粒PCP20的消除: (1) 将消除了pKD46质粒且具有卡那抗性的基因缺失菌株按照1.2.3所述方法(1)和(2)制备成感受态细胞。(2)取1 μL质粒PCP20分别与感受态细胞混匀置于冷的电击杯内,在电转仪电转,电击后加入1 mL LB液体培养液重悬。将菌液置于30 ℃温箱静置培养至少1 h,均匀涂板含有50 μg/mL氨苄青霉素的LB平皿,30 ℃培养16 h以上后,挑取单菌落于LB液体培养基中,在42 ℃、200 r/min过夜培养或37 ℃、200 r/min培养12 h以上,用目的基因鉴定引物进行菌液PCR扩增鉴定。将鉴定为阳性的菌液分别涂于含有50 μg/mL卡那霉素LB平皿、50 μg/mL氨苄青霉素LB平皿或无抗性LB平皿上进行鉴定筛选,同时设置阴性与阳性对照,挑选只能在无抗性LB平皿上生长且在卡那霉素LB平皿和氨苄青霉素LB平皿上均不能生长的菌株进行PCR扩增,并将PCR产物送往西安擎科泽西生物科技有限责任公司进行测序。测序正确后保存。
1.2.7 CVCC541双基因缺失株与三基因缺失株敲除: 利用Red同源重组系统在CVCC541单缺失基础上进行逐个基因缺失得到各个双基因缺失株或三缺失株。
1.3 鼠伤寒沙门氏菌CVCC541亲本株及其基因缺失株感染细胞实验
1.3.1 CVCC541、CVCC541Δvgrg、CVCC541 Δhcp2Δvgrg和CVCC541Δhcp1Δhcp2Δhcp3菌株的生长曲线测定实验: 分别挑取4个菌株的单菌落于10 mL的LB液体培养基,在37 ℃、200 r/min条件下振荡培养培养至OD600≈0.8时,分别取1 mL加入相应的盛有100 mL LB液体培养基的锥形瓶中振荡培养,并每间隔1 h取100 μL液体测定OD600值,每个菌株做3个平行试验,试验重复3次。另外,在OD600≈0.7时,取各菌株菌液100 μL分别加入900 μL的PBS中,按照10倍梯度依次稀释,取稀释度为10-5、10-6、10-7、10-8的菌液涂于LB固体培养板,12 h后进行菌落计数。每个梯度做3个平行实验,实验重复3次。
1.3.2 Hela细胞和小鼠的巨噬细胞RAW 264.7的活力试验: 为了验证细菌感染HeLa细胞和小鼠的巨噬细胞RAW 264.7后细胞的活力不受影响,将HeLa细胞或小鼠的巨噬细胞RAW 264.7培养于96孔细胞板中,培养CVCC541、CVCC541Δvgrg、CVCC541Δhcp2Δvgrg和CVCC541Δhcp1Δhcp2Δhcp3菌株至OD600≈0.7时,分别以感染复数MOI为1、10、100接种长成单层的HeLa细胞或小鼠的巨噬细胞RAW 264.7的96孔细胞板,并于接种90 min、120 min、150 min、180 min和210 min后,用counting kit-8 cck-8细胞增殖试剂盒检测细胞的活性,与不加细菌的对照进行相比,每个组合做3个重复,重复试验3次,以此确定最佳感染时间和最佳感染复数。
1.3.3 CVCC541、CVCC541Δvgrg、CVCC541 Δhcp2Δvgrg和CVCC541Δhcp1Δhcp2Δhcp3菌株对Hela细胞的黏附试验: 将Hela细胞培养于24孔板(细胞计数板计数, 每孔含有大约6×105个细胞),长成单层后,用PBS轻洗3遍,每孔加入1 mL含有细菌(OD600≈0.7和感染复数MOI=10)的DMEM培养基,于37 ℃、5% CO2温箱培养180 min,吸去孔中液体,用PBS轻洗5次,为确定细胞培养孔中游离的细菌是否被清洗干净,取最后一次洗涤液涂于无抗性的LB平皿并进行计数。每孔加入500 μL的胰酶消化5 min,再加入500 μL 1%的Trition X-100溶解混匀,收集100 μL液体倍比稀释一定梯度涂于无抗性LB平皿上。黏附率表示为鼠伤寒沙门氏菌感染HeLa细胞后,每个HeLa细胞表面的平均细菌,即每孔溶解的细菌数/每孔的细胞数。试验时每个处理设3个重复,整个试验重复3次。为了探究500 μL胰酶和500 μL 1%的Trition X-10在消化和破碎细胞过程中是否对细菌有影响,本实验设置500 μL胰酶和500 μL 1%的Trition X-100处理各菌株作为对照组进行菌落计数试验。
1.3.4 CVCC541、CVCC541Δvgrg、CVCC541 Δhcp2Δvgrg和CVCC541Δhcp1Δhcp2Δhcp3菌株对Hela细胞的侵袭试验: 将长成单层的Hela细胞用PBS轻洗3遍,每孔加入1 mL含有细菌(OD600≈0.7和感染复数MOI=10)的DMEM培养基于37 ℃、5% CO2培养180 min,吸去孔中液体,用PBS洗5次,为确保细胞培养孔中的细菌被洗掉,取最后一次洗涤液涂于无抗性的LB平皿并计数;根据庆大霉素保护实验[21]以及前期的探索试验,选择每孔中加入1 mL终浓度为300 μg/mL的庆大霉素DMEM培养基,在5% CO2温箱培养1 h,PBS洗涤5次,为了确保在使用抗生素后能100%杀死细胞外的细菌,取最后一次洗涤液再次涂于无抗性的LB平皿并计数。每孔加入500 μL的胰酶消化5 min,再加入500 μL 1%的Trition X-100溶解混匀,取100 μL倍比稀释的菌液涂于无抗性LB平皿上,计算每孔裂解液中的细菌数量。侵袭率表示为在使用庆大霉素后每个HeLa细胞内的平均细菌数,即每孔裂解的细菌数/每孔接种的细胞数。试验时每个处理组设3个重复,整个试验重复3次。
1.3.5 CVCC541、CVCC541Δvgrg、CVCC541 Δhcp2Δvgrg和CVCC541Δhcp1Δhcp2Δhcp3菌株对小鼠的巨噬细胞RAW 264.7抗吞噬能力影响实验: 实验操作过程与1.3.4基本相同,24孔细胞板中每孔含有大约4.6×105个RAW 264.7细胞(细胞计数板计数)。
1.4 数据的处理 除凝胶电泳图片和碱基序列图片,其他所有图片用GraphPad Prism 5.0制作完成,所有数据用SPSS11.5软件进行统计学分析,结果用平均值±标准差(mean±SD)表示,差异显著性分析用Duncans多重比较分析方法,*表示P < 0.05,差异显著,**表示P < 0.01,差异极显著。
2 结果和分析 2.1 CVCC541单缺失株构建 分别用目的基因hcp1、hcp2、hcp3和vgrg两侧的鉴定引物进行菌液PCR扩增CVCC541菌液,大小分别是845、824、645和2269 bp。用目的基因hcp1、hcp2、hcp3和vgrg两侧的鉴定引物分别进行PCR扩增各自基因缺失株CVCC541Δhcp1、CVCC541Δhcp2、CVCC541Δhcp3和CVCC541Δvgrg菌液,大小分别为465、430、241和365 bp (图 1)。敲除后的测序结果显示在消除卡那抗性基因的过程中在基因位置残留84 bp“疤痕序列”,测序结果也显示该基因被敲除。以hcp1基因敲除后为例(图 2),序列中红色部分表示hcp1基因上下游56 bp同源序列,蓝色划线部分表示hcp1基因敲除后该位置残留84 bp碱基的“疤痕序列”。
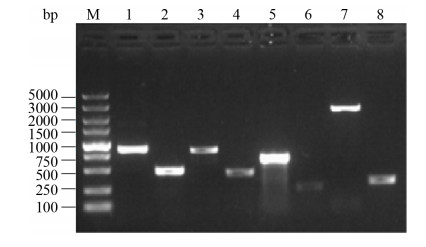 |
| 图 1 CVCC54各单基因缺失前后的PCR扩增结果 Figure 1 PCR amplification result of CVCC541 and CVCC541 sigle deletion strains. M: TaKaRa DL 5000 marker; lane 1, 3, 5, 7: PCR amplification results of genes hcp1, hcp2, hcp3, and vgrg in the bacteria CVCC541; lane 2: PCR amplification result of hcp1 gene in the CVCC541 Δhcp1; lane 4: PCR amplification result of hcp2 gene in the CVCC541 Δhcp2; lane 6: PCR amplification result of hcp3 gene in the CVCC541Δhcp3; lane 8: PCR amplification result of vgrg gene in the CVCC541Δvgrg. |
| 图选项 |
 |
| 图 2 基因敲除后残留的碱基序列 Figure 2 Remaining base sequence after gene knockout. The red represents the 56 bp homologous sequence of the genes upstream and downstream, and the blue underlined portion indicates the remaining scar sequence after gene knockout. |
| 图选项 |
2.2 CVCC541双基因缺失株构建 分别用hcp1、hcp2、hcp3和vgrg基因两侧的鉴定引物对敲除了两个基因的缺失菌株进行扩增的结果显示,扩增得到的片段明显变小,目的基因被敲除(图 3)。敲除后的测序结果显示在消除卡那抗性基因的过程中在每个基因位置同样残留84 bp “疤痕序列”,测序结果也显示该双基因同时被敲除。
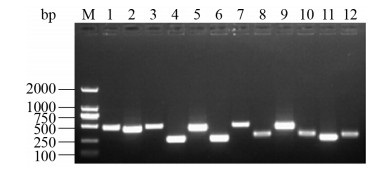 |
| 图 3 CVCC54双基因缺失株的PCR扩增结果 Figure 3 PCR amplification result of CVCC541 double gene deletion strains. M: TaKaRa DL 2000 marker; lane 1-2: PCR amplification results of genes hcp1 and hcp2 in the bacteria CVCC541Δhcp1Δhcp2, respectively; lane 3-4: PCR amplification results of genes hcp1 and hcp3 in the bacteria CVCC541Δhcp1Δhcp3, respectively; lane 5-6: PCR amplification results of genes hcp2 and hcp3 in the bacteria CVCC541Δhcp2Δhcp3, respectively; lane 7-8: PCR amplification results of genes hcp1 and vgrg in the bacteria CVCC541Δhcp1Δvgrg, respectively; lane 9-10: PCR amplification results of genes hcp2 and vgrg in the bacteria CVCC541Δhcp2Δvgrg, respectively; lane 11-12: PCR amplification results of genes hcp3 and vgrg in the bacteria CVCC541Δhcp3Δvgrg, respectively. |
| 图选项 |
2.3 CVCC541三缺失株构建 分别用hcp1、hcp2、hcp3基因两侧的鉴定引物扩增敲除了三基因缺失的CVCC541菌液,结果显示扩增得到的片段明显变小,目的基因被敲除(图 4)。敲除后的测序结果显示在消除卡那抗性基因的过程中在每个基因缺失位置同样残留84 bp “疤痕序列”,测序结果也显示hcp1、hcp2和hcp3三个基因同时被敲除。
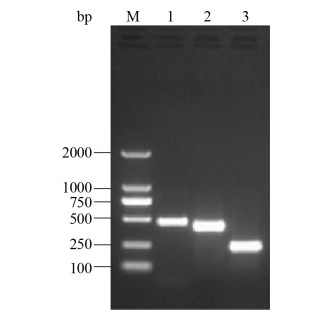 |
| 图 4 CVCC54Δhcp1Δhcp2Δhcp3缺失株的菌液PCR的扩增结果 Figure 4 PCR amplification result of CVCC541Δhcp1Δhcp2Δhcp3. M: TaKaRa DL 5000 marker; lane 1-3: PCR amplification results of genes hcp, hcp2, and hcp3 in the bacteria CVCC541Δhcp1Δhcp2Δhcp3, respectively. |
| 图选项 |
2.4 CVCC541、CVCC541Δvgrg、CVCC541 Δhcp2Δvgrg和CVCC541Δhcp1Δhcp2Δhcp3菌株的生长曲线测定结果 生长曲线结果显示4个菌株的对数生长期均为OD600=0.3-0.9,与对照组CVCC54相比,各菌株的生长速度并无显著差异(图略)。CFU计数实验证明,鼠伤寒沙门氏菌CVCC541在对数生长期且OD600≈0.7时,菌液含有3×108 CFU/mL,并且CVCC541Δvgrg、CVCC541Δhcp2Δvgrg和CVCC541 Δhcp1Δhcp2Δhcp3在对数生长期且OD600≈0.7时,菌落含量与CVCC541均在一个数量级(即108 CFU/mL)。
2.5 CVCC541、CVCC541Δvgrg、CVCC541 Δhcp2Δvgrg和CVCC541Δhcp1Δhcp2Δhcp3菌株对Hela细胞活力影响及感染复数MOI的确定 在4个菌株分别生长到对数生长期时(OD600≈0.7),以不同感染复数接种Hela细胞或小鼠的巨噬细胞RAW264.7后,不同时间段感染后,用counting kit-8 cck-8试剂盒检测细胞的活性,发现HeLa细胞和小鼠巨噬细胞RAW 264.7在4个菌株(MOI=10)感染180 min后,其活性均可以维持在90%以上,为了使细菌粘附侵袭细胞最大化,而且细胞活性维持在一个较高状态,故实验选择180 min、MOI=10为最佳感染时间和感染复数。
2.6 CVCC541、CVCC541Δvgrg、CVCC541 Δhcp2Δvgrg和CVCC541Δhcp1Δhcp2Δhcp3菌株对HeLa黏附结果 与CVCC541粘附Hela细胞(100%)相比,CVCC541Δvgrg、CVCC541Δhcp2Δvgrg和CVCC541Δhcp1Δhcp2Δhcp3的粘附率分别约为17.17%±2.1%、14.73%±2.5%和82%±3.7% (图 5)。实验表明缺失hcp与vgrg的菌株粘附HeLa细胞能力均下降,但缺失vgrg基因的菌株粘附力显著下降。试验中我们发现500 μL胰酶和500 μL 1%的Trition X-100消化和破碎细胞过程中无损伤杀灭细菌作用。
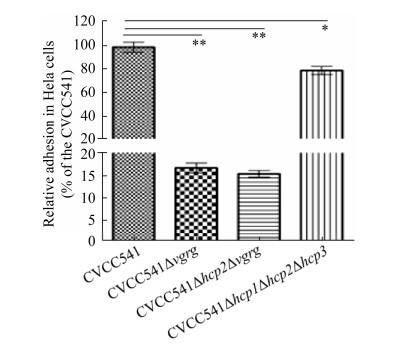 |
| 图 5 CVCC541、CVCC541Δvgrg、CVCC541Δhcp2Δvgrg和CVCC541Δhcp1Δhcp2Δhcp3菌株粘附Hela细胞的CFU比较 Figure 5 Comparison of adhesion rates of CVCC541, CVCC541Δvgrg, CVCC541Δhcp2Δvgrg, and CVCC541Δhcp1Δhcp2Δhcp3 to Hela cells. ** indicates P < 0.01, *P < 0.05. |
| 图选项 |
2.7 CVCC541、CVCC541Δvgrg、CVCC541 Δhcp2Δvgrg和CVCC541Δhcp1Δhcp2Δhcp3菌株对Hela细胞的侵入结果 与CVCC541侵入Hela细胞(100%)相比,CVCC541Δvgrg、CVCC541Δhcp2Δvgrg和CVCC541Δhcp1Δhcp2Δhcp3的侵入率分别约为7.05%±1.05%、6.21%±1.35%和87%±3.25% (图 6)。实验数据表明缺失hcp与vgrg的菌株侵袭力均下降,但缺失VgrG的菌株侵袭力显著下降。说明VgrG在细菌侵入上皮细胞中发挥更加显著作用,也有可能是Hcp与vgrG相互关联发挥影响细菌进入上皮细胞的能力。
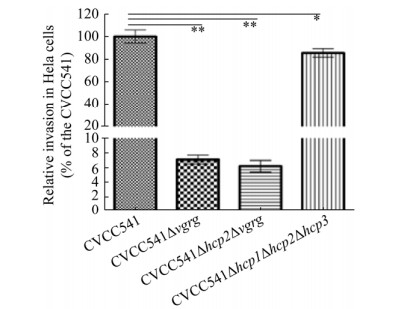 |
| 图 6 CVCC541、CVCC541Δvgrg、CVCC541Δhcp2Δvgrg和CVCC541Δhcp1Δhcp2Δhcp3菌株对Hela细胞的侵袭率的比较 Figure 6 Comparison of invasion rates of CVCC541, CVCC541Δvgrg, CVCC541Δhcp2Δvgrg, and CVCC541Δhcp1Δhcp2Δhcp3 to Hela cells. ** indicates P < 0.01, *P < 0.05. |
| 图选项 |
2.8 CVCC541、CVCC541Δvgrg、CVCC541 Δhcp2Δvgrg和CVCC541Δhcp1Δhcp2Δhcp3菌株对小鼠的巨噬细胞RAW 264.7抗吞噬作用影响的实验结果 与CVCC541在小鼠巨噬细胞RAW 264.7的存活数量相比,CVCC541Δvgrg、CVCC541 Δhcp2Δvgrg和CVCC541Δhcp1Δhcp2Δhcp3的存活率分别为15.67%±2.9%、14.47%±1.87%和56.12%±3.48% (图 7)。实验数据表明,与CVCC541菌株相比,缺失了hcp与vgrg基因的菌株抗小鼠巨噬细胞RAW 264.7吞噬的能力均下降,但缺失了vgrg基因的菌株抗小鼠巨噬细胞RAW 264.7吞噬的能力显著下降,说明其可能在鼠伤寒沙门氏菌CVCC541逃逸巨噬细胞吞噬进而逃逸免疫监视过程中发挥巨大作用,也有可能是Hcp与VgrG相互关联发挥这种逃逸吞噬的能力。
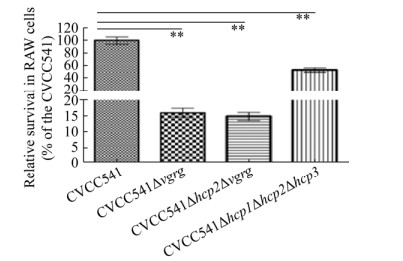 |
| 图 7 CVCC541、CVCC541Δvgrg、CVCC541Δhcp2Δvgrg和CVCC541Δhcp1Δhcp2Δhcp3在小鼠巨噬细胞RAW 264.7存活的CFU的比较 Figure 7 The CFU comparison of CVCC541, CVCC541Δvgrg, CVCC541Δhcp2Δvgrg, and CVCC541Δhcp1Δhcp2Δhcp3 in mouse macrophage RAW 264.7. ** indicates P < 0.01. |
| 图选项 |
3 讨论 沙门氏菌可以采用多种方式逃避宿主的免疫系统监视,从而在宿主体内较长时间存活并造成持续感染。Ⅵ型分泌系统是一种能够直接将自身蛋白分子或分泌物通过该系统递呈到其他细菌和真核细胞中的接触依赖性分泌装置,其结构类似于T4噬菌体。Ⅵ型分泌系统普遍存在于动植物革兰氏阴性细菌中,细菌可以通过该分泌系统吸取有利的营养物质或营造利己的环境。大量实验研究表明,Ⅵ型分泌系统不仅与细菌毒力、生物膜形成、应激反应、耐药基因的水平转移、金属离子的摄入和肠道菌群竞争等生理现象密切相关,而且还参与细菌对宿主细胞的粘附侵袭、巨噬细胞的抗吞噬以及宿主免疫监视的抵抗等作用[22-25]。Ⅵ型分泌系统至少由13种蛋白组成,其中,溶血素共调节蛋白(Hcp)和缬氨酸甘氨酸重复蛋白G (VgrG)是标志性蛋白[4]。与其他革兰氏阴性菌一样,沙门氏菌同样具有Ⅵ型分泌系统。沙门氏菌的SCI包括编码Hcp样蛋白的sci K基因和编码VgrG样蛋白的vgrS基因,如果缺失伤寒沙门氏菌的整个SCI基因岛,其入侵真核细胞的能力将会下降[26],而敲除Hcp2基因后,可以检测到Hcp1基因的表达量上升,推测细菌为了避免过度繁殖造成自身损害,多拷贝的Hcp可
以发挥一种调控同源基因并平衡同源基因的功能[27-28]。沙门氏菌Ⅵ型分泌系统在哺乳动物肠道内细菌间的竞争中也发挥着重要的依赖性抗菌作用,其不仅可以塑造微生物群落组成,而且可以控制微生物群落与入侵病原体之间的相互作用,从而促进病原菌定植。研究发现,沙门氏菌Ⅵ型分泌系统可利用其Hcp1蛋白介导分泌型效应因子Tae4与Hcp1相互作用来杀死产酸克雷伯氏菌,而其Hcp2则不能通过与Tae4相互作用来发挥杀菌功能[30],但猪源肠道致病性大肠杆菌的Hcp2则能在细菌竞争中发挥巨大作用[23]。另一项研究发现,荧光假单胞菌(Pseudomonas fluorescens)的Hcp1与细菌的运动能力有关,Hcp2则介导杀伤其他细菌[31]。另外,研究表明,细菌的Ⅵ型分泌系统与抗吞噬作用也有紧密联系。周宏[32]等发现敲除产志贺毒素大肠埃希菌(Shiga toxin-producing Escherichia coli,STEC)分离株F18ab+的Hcp基因后,该菌的运动能力和黏附上皮细胞及抗巨噬细胞吞噬的能力均下降;嗜水气单胞菌Hcp不仅具有抑制促炎细胞因子产生的作用,同时还有诱导细胞产生免疫抑制因子的作用,从而逃避宿主天然免疫[33]。研究也发现,被变形细胞阿米巴吞噬后,Hcp基因缺陷型鼠伤寒沙门菌在该细胞内的定植能力下降[29]。霍乱弧菌被巨噬细胞吞噬时,其Ⅵ型分泌系统可利用VgrG与巨噬细胞肌动蛋白发生共价交联,进而破坏巨噬细胞骨架,使巨噬细胞失去吞噬作用[34]。在少数沙门菌中还发现了一些C-末端延伸VgrG蛋白,可介导宿主细胞肌动蛋白交联,造成细胞肽聚糖层的退化和蛋白的ADP-核糖基化等,从而发挥致病作用[35]。但鼠伤寒沙门氏菌Ⅵ型分泌系统的VgrG在该菌入侵上皮细胞和抗吞噬方面是否发挥作用尚未见报道。
在本研究中,我们成功构建了多个基因缺失株,并对CVCC541Δvgrg、CVCC541Δhcp2Δvgrg和CVCC541Δhcp1Δhcp2Δhcp31粘附侵袭Hela细胞以及抵抗小鼠巨噬细胞RAW 264.7吞噬的能力进行了实验探索,研究发现,缺失Hcp与VgrG的鼠伤寒沙门氏菌菌株对HeLa细胞的粘附能力、侵袭力以及对小鼠巨噬细胞RAW 264.7的抗吞噬能力都显著下降,但缺失VgrG的菌株的粘附能力、侵袭力及抗吞噬能力下降极显著。在一定程度上说明,鼠伤寒沙门氏菌CVCC541Ⅵ型分泌系统的VgrG可能在入侵与定植上皮细胞、抗巨噬细胞吞噬及逃逸宿主免疫监视中发挥一定作用。也有可能如铜绿假单胞菌利用Hcp-VgrG2b结构进入Hela细胞[24]一样,鼠伤寒沙门氏菌CVCC541Ⅵ型分泌系统也有可能存在Hcp-VgrG结构共同发挥作用机制。由于hcp及vgrg基因的启动子区域及终止子区域并未见报道,而回复株的构建需要非诱导性的启动子,最常用的是基因本身启动子,需要下一步的实验进行具体研究以确定其完整的调控序列。本研究构建的多个缺失株为下一步研究鼠伤寒沙门氏菌利用Ⅵ型分泌系统相关分子入侵上皮细胞、抗吞噬、逃逸免疫监视、介导细菌耐药、维持细菌毒力与生物被膜形成以及参与微生物菌群竞争等研究作了前期铺垫工作。
References
| [1] | Scallan E, Mahon BE. Foodborne diseases active surveillance network (FoodNet) in 2012: a foundation for food safety in the United States. Clinical Infectious Diseases, 2012, 54(S5): S381-S384. |
| [2] | Schadich E, Dzubak P, Hajduch M. Role of Salmonella Typhi Vi antigen and secretory systems on immune response. Current Pharmaceutical Design, 2016, 22(41): 6251-6260. DOI:10.2174/1381612822666160829142308 |
| [3] | Young AM, Palmer AE. Methods to illuminate the role of Salmonella effector proteins during infection: a review. Frontiers in Cellular and Infection Microbiology, 2017, 7: 363. DOI:10.3389/fcimb.2017.00363 |
| [4] | Schwarz S, Hood RD, Mougous JD. What is type VI secretion doing in all those bugs?. Trends in Microbiology, 2010, 18(12): 531-537. DOI:10.1016/j.tim.2010.09.001 |
| [5] | Pukatzki S, Ma AT, Sturtevant D, Krastins B, Sarracino D, Nelson WC, Heidelberg JF, Mekalanos JJ. Identification of a conserved bacterial protein secretion system in Vibrio cholerae using the Dictyostelium host model system. Proceedings of the National Academy of Sciences of the United States of America, 2006, 103(5): 1528-1533. DOI:10.1073/pnas.0510322103 |
| [6] | Basler M, Pilhofer M, Henderson GP, Jensen GJ, Mekalanos JJ. Type VI secretion requires a dynamic contractile phage tail-like structure. Nature, 2012, 483(7388): 182-186. DOI:10.1038/nature10846 |
| [7] | Mougous JD, Cuff ME, Raunser S, Shen A, Zhou M, Gifford CA, Goodman AL, Joachimiak G, Ordo?ez CL, Lory S, Walz T, Joachimiak A, Mekalanos JJ. A virulence locus of Pseudomonas aeruginosa encodes a protein secretion apparatus. Science, 2006, 312(5779): 1526-1530. DOI:10.1126/science.1128393 |
| [8] | Cascales E. The type VI secretion toolkit. EMBO Reports, 2008, 9(8): 735-741. DOI:10.1038/embor.2008.131 |
| [9] | Silverman JM, Brunet YR, Cascales E, Mougous JD. Structure and regulation of the type VI secretion system. Annual Review of Microbiology, 2012, 66: 453-472. DOI:10.1146/annurev-micro-121809-151619 |
| [10] | Brunet YR, Hénin J, Celia H, Cascales E. Type VI secretion and bacteriophage tail tubes share a common assembly pathway. EMBO Reports, 2014, 15(3): 315-321. DOI:10.1002/embr.201337936 |
| [11] | Durand E, Derrez E, Audoly G, Spinelli S, Ortiz-Lombardia M, Raoult D, Cascales E, Cambillau C. Crystal structure of the VgrG1 actin cross-linking domain of the Vibrio cholerae type VI secretion system. Journal of Biological Chemistry, 2012, 287(45): 38190-38199. DOI:10.1074/jbc.M112.390153 |
| [12] | Ho BT, Dong TG, Mekalanos JJ. A view to a kill: the bacterial type VI secretion system. Cell Host & Microbe, 2014, 15(1): 9-21. |
| [13] | Shneider MM, Buth SA, Ho BT, Basler M, Mekalanos JJ, Leiman PG. PAAR-repeat proteins sharpen and diversify the type VI secretion system spike. Nature, 2013, 500(7462): 350-353. DOI:10.1038/nature12453 |
| [14] | Folkesson A, L?fdahl S, Normark S. The Salmonella enterica subspecies I specific centisome 7 genomic island encodes novel protein families present in bacteria living in close contact with eukaryotic cells. Research in Microbiology, 2002, 153(8): 537-545. DOI:10.1016/S0923-2508(02)01348-7 |
| [15] | Boyer F, Fichant G, Berthod J, Vandenbrouck Y, Attree I. Dissecting the bacterial type VI secretion system by a genome wide in silico analysis: what can be learned from available microbial genomic resources?. BMC Genomics, 2009, 10: 104. DOI:10.1186/1471-2164-10-104 |
| [16] | Pukatzki S, McAuley SB, Miyata ST. The type VI secretion system: translocation of effectors and effector-domains. Current Opinion in Microbiology, 2009, 12(1): 11-17. DOI:10.1016/j.mib.2008.11.010 |
| [17] | Blondel CJ, Jiménez JC, Contreras I, Santiviago CA. Comparative genomic analysis uncovers 3 novel loci encoding type six secretion systems differentially distributed in Salmonella serotypes. BMC Genomics, 2009, 10: 354. DOI:10.1186/1471-2164-10-354 |
| [18] | Wang P, Dong JF, Zou QH. Knockout of hcp genes in Salmonella typhimurium by Red recombination system. Microbiology China, 2018, 45(11): 2529-2536. (in Chinese) 王萍, 董俊芳, 邹清华. 利用Red重组系统敲除鼠伤寒沙门氏菌Ⅵ型分泌系统相关基因. 微生物学通报, 2018, 45(11): 2529-2536. |
| [19] | Datsenko KA, Wanner BL. One-step inactivation of chromosomal genes in Escherichia coli K-12 using PCR products. Proceedings of the National Academy of Sciences of the United States of America, 2000, 97(12): 6640-6645. DOI:10.1073/pnas.120163297 |
| [20] | Murphy KC. Use of bacteriophage λ recombination functions to promote gene replacement in Escherichia coli. Journal of Bacteriology, 1998, 180(8): 2036-2071. |
| [21] | Othman S, Parton R, Coote J. Interaction between mammalian cells and Pasteurella multocida B:2. Adherence, invasion and intracellular survival. Microbial Pathogenesis, 2012, 52(6): 353-358. DOI:10.1016/j.micpath.2012.03.005 |
| [22] | Borgeaud S, Metzger LC, Scrignari T, Blokesch M. The type VI secretion system of Vibrio cholerae fosters horizontal gene transfer. Science, 2015, 347(6217): 63-67. DOI:10.1126/science.1260064 |
| [23] | Peng Y, Wang XR, Shou J, Zong BB, Zhang YY, Tan J, Chen J, Hu LL, Zhu YW, Chen HC, Tan C. Roles of Hcp family proteins in the pathogenesis of the porcine extraintestinal pathogenic Escherichia coli type VI secretion system. Scientific Reports, 2016, 6: 26816. DOI:10.1038/srep26816 |
| [24] | Sana TG, Baumann C, Merdes A, Soscia C, Rattei T, Hachani A, Jones C, Bennett KL, Filloux A, Superti-Furga G, Voulhoux R, Bleves S. Internalization of Pseudomonas aeruginosa strain PAO1 into epithelial cells is promoted by interaction of a T6SS effector with the microtubule network. mBio, 2015, 6(3): e00712-15. |
| [25] | Chen WJ, Kuo TY, Hsieh FC, Chen PY, Wang CS, Shih YL, Lai YM, Liu JR, Yang YL, Shih MC. Involvement of type VI secretion system in secretion of iron chelator pyoverdine in Pseudomonas taiwanensis. Scientific Reports, 2016, 6: 32950. DOI:10.1038/srep32950 |
| [26] | Filloux A, Hachani A, Bleves S. The bacterial type VI secretion machine: yet another player for protein transport across membranes. Microbiology, 2008, 154(6): 1570-1583. DOI:10.1099/mic.0.2008/016840-0 |
| [27] | 赵潘.鼠伤寒沙门菌VI型分泌系统中溶血素共调节蛋白的功能探讨.北京大学学位论文, 2015. |
| [28] | Wang P, Zou QH. Advances in hemolysin co-regulated protein of bacterial type VI secretion system. Progress in Microbiology and Immunology, 2018, 46(3): 67-71. (in Chinese) 王萍, 邹清华. 细菌Ⅵ型分泌系统溶血素共调节蛋白研究进展. 微生物学免疫学进展, 2018, 46(3): 67-71. |
| [29] | Riquelme S, Varas M, Valenzuela C, Velozo P, Chahin N, Aguilera P, Sabag A, Labra B, álvarez SA, Chávez FP, Santiviago CA. Relevant genes linked to virulence are required for Salmonella typhimurium to survive intracellularly in the social amoeba Dictyostelium discoideum. Frontiers in Microbiology, 2016, 7: 1305. |
| [30] | Sana TG, Flaugnatti N, Lugo KA, Lam LH, Jacobson A, Baylot V, Durand E, Journet L, Cascales E, Monack DM. Salmonella Typhimurium utilizes a T6SS-mediated antibacterial weapon to establish in the host gut. Proceedings of the National Academy of Sciences of the United States of America, 2016, 113(34): E5044-E5051. DOI:10.1073/pnas.1608858113 |
| [31] | Gallique M, Decoin V, Barbey C, Rosay T, Feuilloley MGJ, Orange N, Merieau A. Contribution of the Pseudomonas fluorescens MFE01 type VI secretion system to biofilm formation. PLoS One, 2017, 12(1): e0170770. DOI:10.1371/journal.pone.0170770 |
| [32] | 周虹. F18ab+大肠杆菌hcp基因缺失株的构建及其对重要毒力因子分泌功能的影响.扬州大学硕士学位论文, 2012. |
| [33] | Suarez G, Sierra JC, Kirtley ML, Chopra AK. Role of Hcp, a type 6 secretion system effector, of Aeromonas hydrophila in modulating activation of host immune cells. Microbiology, 2010, 156(12): 3678-3688. DOI:10.1099/mic.0.041277-0 |
| [34] | Pukatzki S, Ma AT, Revel AT, Sturtevant D, Mekalanos JJ. Type VI secretion system translocates a phage tail spike-like protein into target cells where it cross-links actin. Proceedings of the National Academy of Sciences of the United States of America, 2007, 104(39): 15508-15513. DOI:10.1073/pnas.0706532104 |
| [35] | Blondel CJ, Jiménez JC, Contreras I, Santiviago CA. Comparative genomic analysis uncovers 3 novel loci encoding type six secretion systems differentially distributed in Salmonella serotypes. BMC Genomics, 2009, 10: 354. DOI:10.1186/1471-2164-10-354 |
